-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv neoadjuvantní terapie na pooperační komplikace po pneumonektomii
Impact of Neoadjuvant Chemotherapy on Postoperative Complications Following Pneumonectomy
Background:
The risks of complications in patients undergoing pneumonectomy after preoperative chemotherapy for nonsmall cell lung cancer remain controversial. We reviewed a consecutive series of patients having undergone pneumonectomy in a single centre.Material and Methods:
This retrospective study included 292 patients operated from January 1, 1998 through December 31, 2008. Group 1 included patients those who received preoperative chemotherapy and pneumonectmy (57 patients, 19%), and group 2 included patients who underwent pneumonectomy alone (235 patients, 81%). The main objectives were 30-day and 90-day mortality rates, and major postoperative complications.Results:
There was no statistically significant difference in patients’ age, gender, cardiovascular co morbidity, histology and side of pneumonectomy between these two groups. Overall 30-days and 90-days mortality rates were 5.5 % and 8.6%, respectively. Postoperative mortality at 30 days was 5.2% in group 1 and 5.6 % in group 2 (p = 0.16), and 10.5% for group 1 and 8.1% in group 2 at 90 days (p = 0.8). Incidence of empyema was 5.2 % in group 1 and 3.0 % in group 2 (p = 0.12); incidence of bronchopleural fistula was 3.5 % in group 1 and 3.0% in group 2 (p = 0.10); incidence of postoperative respiratory failure was 3.4% in group 1 and 3.0% in group 2 (p = 0.75).Conclusion:
Preoperative chemotherapy does not significantly increase postoperative morbidity and early mortality after pneumonectomy in our experience.Key words:
neoadjuvant chemotherapy – pneumonectomy – morbidity
Autoři: A. J. Stolz; J. Schützner; T. Haruštiak; R. Lischke
; J. Šimonek; P. Pafko
Působiště autorů: III. chirurgická klinika 1. LF UK a FN Praha-Motol, přednosta: prof. MUDr. P. Pafko, DrSc.
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 5, s. 225-228.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Názory na vliv neoadjuvantní chemoterapie (NT) na pooperační mortalitu a morbiditu nejsou jednoznačné, hlavně ve vztahu k pneumonektomii (PE). Cílem studie bylo zhodnotit morbiditu a mortalitu po pneumonektomii u pacienty po neoadjuvantní chemoterapii.Soubor a metody:
Naše retrospektivní studie obsahovala 292 pacienty s pneumonektomiemi pro nemalobuněčný bronchogenní karcinom, které byly na naší klinice provedeny v období leden 1998 až prosinec 2008. Soubor pacientů byl rozdělen do dvou skupin. Skupina 1 obsahovala pacienty s neoadjuvantní terapií a pneumonektomií (skupina NT+PE, 57 pacientů, 19 %), skupina 2 pacienty s pneumonektomií bez neoadjuvantní terapie (skupina PE, 235 pacientů, 81 %).Výsledky:
Celková 30denní a 90denní mortalita po pneumonektomii byla 5,5 % resp. 8,6 %. V skupině s neoadjuvantní terapií byla 30denní mortalita 5,2 % a ve skupině bez NT byla 5,6 %. Ve skupině NT a PE byla 90denní mortalita 10,5 % a ve skupině bez NT byla 8,1 %. Incidence empyému byla 5,2 % ve skupině 1 a 3,0 % ve skupině 2 (p = 0,12); incidence bronchopleurální píštěle byla 3,5 % ve skupině 1 a 3,0 % ve skupině 2 (p = 0,10); incidence respiračního selhání byla 3,4 % ve skupině 1 a 3,0 % ve skupině 2 (p = 0,75).Závěr:
Naše studie ukazuje, že provedení pneumonektomie po neoadjuvantní chemoterapii může být provedeno s akceptovatelnou morbiditou a mortalitou. Domníváme se, že základem je adekvátní předoperační evaluace pacientů a tento typ výkonů by měl být prováděn na specializovaných pracovištích s dostatečnými operačními zkušenostmi po neoadjuvantní terapii.Klíčová slova:
neoadjuvantní terapie – pneumonektomie – morbiditaÚVOD
Léčba lokálně pokročilého nemalobuněčného bronchogenního karcinomu (NSCLC) je multimodální, pozůstávající z onkologické a chirurgické terapie. Cílem kombinované terapie je zlepšit resekabilitu a zlepšit přežití pacientů léčbou mikrometastatického postižení. I když je tento postup všeobecně akceptovaný, kontroverze zůstávají ohledně pooperačního rizika u pacientů po neoadjuvantní terapii (NT). Některé studie publikovaly zvýšené riziko pooperačních komplikací po neoadjuvantní chemoterapii, na druhé straně jiné toto riziko neprokázaly [1–6]. Většina studií obsahovala pacienty s různým rozsahem plicní resekce. Proto cílem naší studie bylo zjistit incidenci pooperační mortality a morbidity pacientů s pneumonektomií po neoadjuvantní chemoterapii a porovnat ji s pacienty, kteří neměli neoadjuvantní chemoterapii.
MATERIÁL A METODA
Na naší klinice byly v období leden 1998 až prosinec 2008 provedeny 292 pneumonektomie pro nemalobuněčný bronchogenní karcinom. Tato retrospektivní analýza naší prospektivní databáze obsahovala pacienty s elektivní plicní resekcí. Mezi sledované předoperační faktory patřil: věk, pohlaví, body mass index (BMI), kardiovaskulární komorbidity (supraventrikulární arytmie, ICHS, hypertenze, anamnéza infarktu myokardu), FEV 1 (usilovný vteřinový výdech, procento náležitých hodnot), FVC (usilovná vitální kapacita, procento náležitých hodnot), FEV1/ FVC. Chronická obstrukční plicní nemoc (CHOPN) byla definována hodnotami FEV1 < 70 % náležitých hodnot a FEV1/ FVC < 70 % náležitých hodnot. Mezi sledované pooperační komplikace patřily: pneumonie, pooperační respirační selhání, plicní embolizace, postpneumonektomický plicní edém (PPE), kardiovaskulární komplikace, bronchopleurální píštěl (BPF), postpneumonektomický empyém. Celkem 57 pacientů mělo neoadjuvantní chemoterapii před pneumonektomií. Neoadjuvantní terapie byla indikovaná z následujících důvodů: cN2 onemocnění (cIIIA, n = 39, 68 %), inoperabilita nádoru (cT4, n = 18, 32 %). Ze skupiny pacientů s cN2 postižením mělo 16 pacientů (41 %) provedenou mediastinoskopii a verifikované postižení N2 uzlin. U ostatních pacientů cN2 a cT4 bylo hodnoceno na základě vyšetření počítačovou tomografií (CT). Více než polovina pacientů absolvovala neoadjuvantní chemoterapii mimo FN Motol. Pacienti dostali neoadjuvantní chemoterapii založenou na platině kombinované s vinorelbinem (n = 30) nebo gemcitabinem (n = 15), mitomycinem (n = 4) nebo jiných kombinacích podle referujících pneumologických pracovišť. Pacienti absolvovali průměrně 2,5 cyklu (2–5 cyklů). Průměrná doba od ukončení chemoterapie po pneumonektomii byla 42 dní (21–71 dní). Restaging pacientů byl proveden na základě CT vyšetření, v poslední době za pomocí PET-CT. Parciální nebo kompletní odpověď na NT byla u 26 (45 %), resp. u 8 (12 %) pacientů.
Histologicky se jednalo o epidermoidní karcinom u 186 pacientů (64 %), adenokarcinom v 70 případech (24 %), jiný typ karcinomu byl přítomný u 36 pacientů (12%).
Pacienti byli indikováni k plicní resekci podle standardů pro rozsah plicních resekcí podle předoperačních vyšetření [7]. Všechny plicní resekce byly provedeny v selektivní plicní ventilaci s laterální torakotomií. Pahýl bronchu po pneumonektomii byl zašitý jednotlivými stehy ve dvou vrstvách (PDS II 4-0, Ethicon), plicní tepna a plicní žíly byly podvázané (Silon, Chirana) a přešité pokračujícím cévním stehem (Prolen 4/0, Ethicon). Pahýl pravostranného bronchu byl překrytý u 60 (42 %) pacientů lalokem pleury. Pahýl bronchu byl zkontrolován přetlakem 30 cm H2O pod vodou. Negativní pahýl hlavního bronchu byl zkontrolován peroperačním histologickým vyšetřením. Pleurální dutina byla drénovaná jedním hrudním drénem 28Fr se spádovou drenáží, který se podle odpadů odstraňoval většinou první pooperační den. Pacientům byl podán Vulmizolin l g předoperačně a dvě další dávky pooperačně. Hned po operaci bylo šest pacientů (2 %) přeloženo na anesteziologicko-resuscitační oddělení, ostatní na jednotku intenzivní péče naší kliniky. Pooperační analgezie byla udržována pomocí zavedeného epidurálního katétru, do kterého byl aplikován kontinuálně bupivakain a fentanyl podle intenzity bolesti pacienta.
Statistická data byla zpracována pomocí verze SPSS 10.0. Kategorické proměnné byly porovnány pomocí χ2testu. Studentův t-test byl použit k analýze pokračujících proměnných. Jako faktor se statistickou významností byl definován jako p < 0,05 a vysoce signifikantní jako p < 0,01.
VÝSLEDKY
Soubor pacientů po pneumonektomii jsme rozdělili na dvě skupiny. První skupina obsahovala pacienty s neoadjuvantní terapií (skupina NT+PE, 57 pacientů), druhá skupina pacienty bez neoadjuvantní terapie (skupina PE, 235 pacientů). Nenalezli jsme signifikantní rozdíl mezi oběma skupinami pacientů ve věku, pohlaví, BMI, komorbidit, histologického typu a strany pneumonektomie (Tab. 1). Celková morbidita byla 28 %. Nejčastěji se vyskytovaly kardiovaskulární komplikace (19 %), z nich fibrilace síní. Neprokázali jsme signifikantní rozdíly v pooperačních komplikacích, které jsou znázorněny v tabulce 2.
Tab. 1. Charakteristika pacientů Tab. 1. Patients‘ characteristics 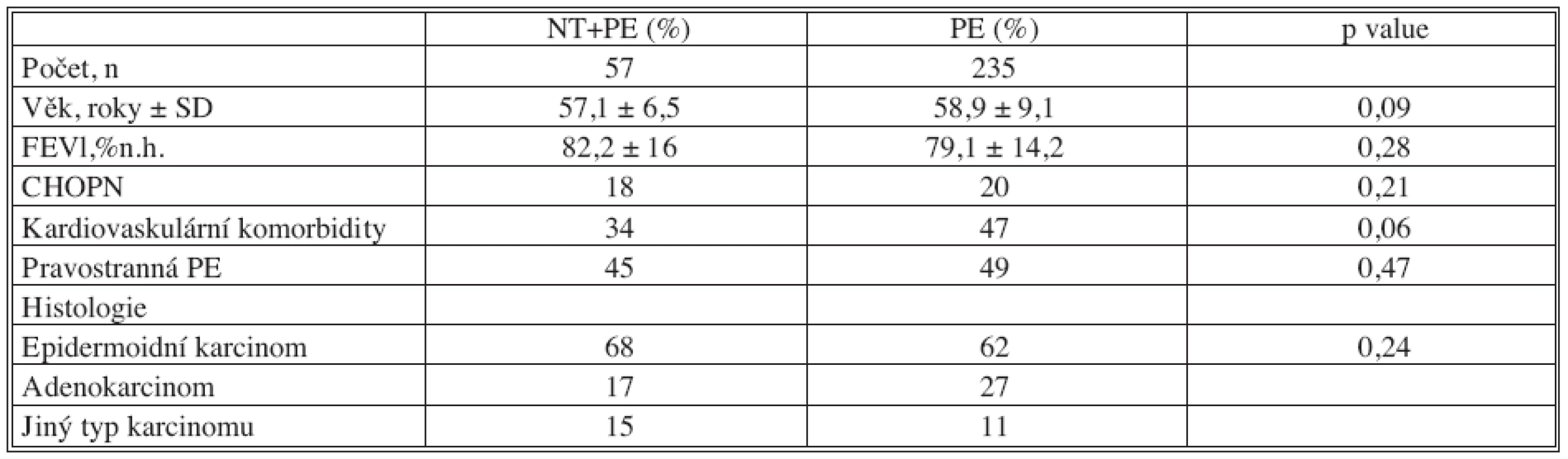
(FEV1 – usilovný výdech za l s, SD – směrodatná odchylka, CHOPN – chronická obstrukční bronchopulmonální nemoc, NT – neoadjuvantní chemoterapie, PE – pneumonektomie) Tab. 2. Pooperační komplikace Tab. 2. Postoperative complications 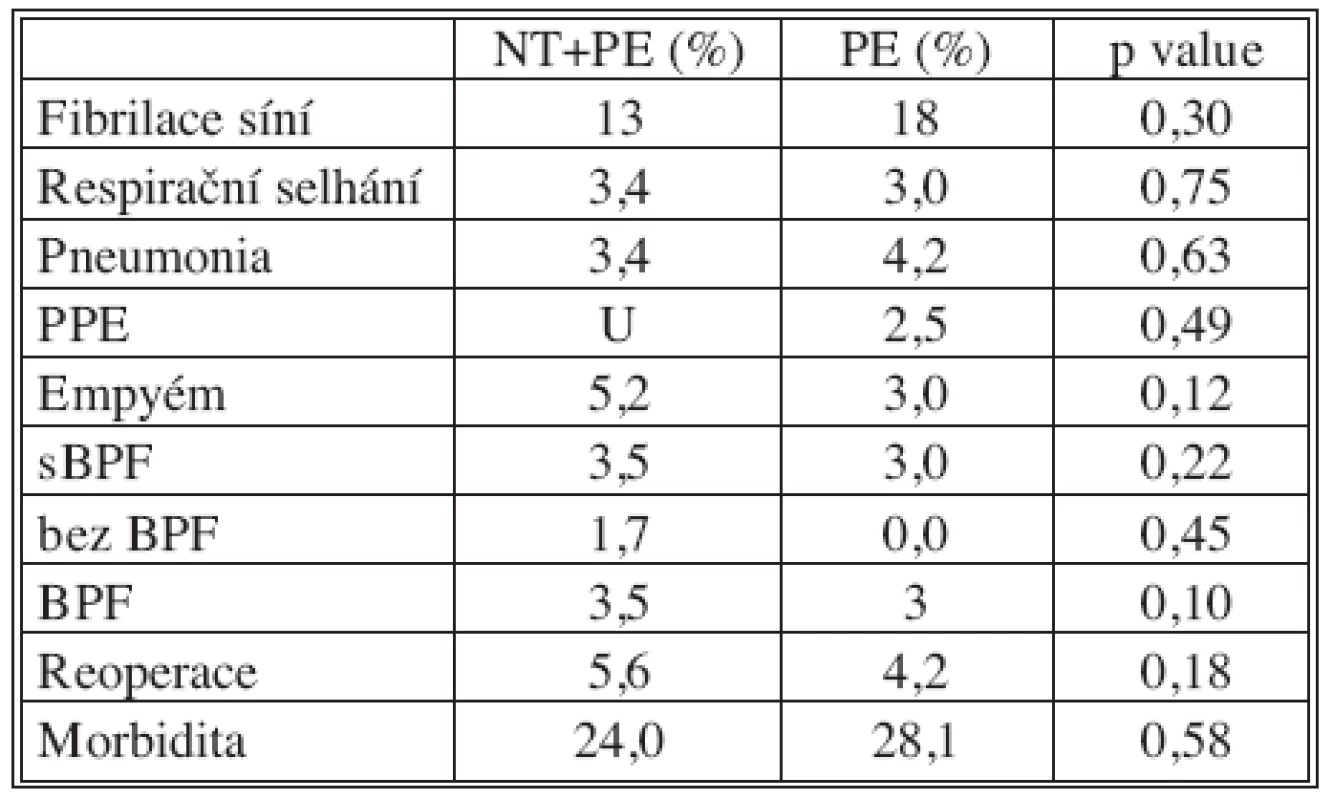
(NT – neoadjuvantní chemoterapie, PE – pneumonektomie, PPE – postpneumonektomický plicní edém, BPF – bronchopleurální fistula) Celková 30denní úmrtnost byla 5,5 %. Tři pacienti zemřeli ve skupině 1 (5,2 %) a 13 pacientů ve skupině 2 (5,5 %). Příčiny úmrtí byly: PPE (n = 4), BPF (n = 4), pneumonia (n = 3), plicní embolizace (n = 3), hemoragický šok (n = l) a akutní infarkt myokardu (n = l). Celková 90denní mortalita byla 8,6 %, ve skupině NT+PE 10,5 % a 8,1 % ve skupině PE.
DISKUSE
Naše studie neprokázala signifikantní zvýšení pooperační morbidity a mortality u pacientů po neoadjuvantní terapii a pneumonektomii s 30denní mortalitou 5,2 % a 90denní mortalitou 10,5 %.
Názory na vliv NT na pooperační mortalitu a morbiditu nejsou jednoznačné, hlavně ve vztahu k pneumonektomii. De Perrot na skupině 55 pacientů s pneumonektomii při mortalitě 1,8 % a morbiditě 31 % neprokázal negativní efekt NT na pooperační průběh [5]. Podobné výsledky publikoval Mansour [6]. V jeho studii byla 30denní mortalita 6,7 % a 90denní 11,7 % bez signifikantního rozdílu naproti pacientům bez neoadjuvantní terapie. Poukazuje však na fakt, že posuzování 30denní mortality nemusí být průkazné a dostačující, jelikož při porovnání s 90denní mortalitou může dojít až k dvojnásobnému nárůstu úmrtnosti. Podobný nárůst také prokázali Martin a Doddoli (6,2 % vs. 11,3 %; resp. 12 % vs. 21 %) [1,2]. Leo neprokázal zvýšenou mortalitu po NT a pneumonektomii (3 %), ale zjistil zvýšenou incidenci respiračních komplikací (19,2%), přičemž pacienti po NT měli signifikantně nižší hodnoty DLCO [8]. Allen publikoval 30denní úmrtnost 6 % a 90denní úmrtnost 10 % po pneumonektomii s neoadjuvantní chemoradioterapií u pacientů v III. stadiu [9]. Její provedení nepovažuje za kontraindikované v centrech, kde má tento výkon akceptovatelnou mortalitu a morbiditu. Ve studii EORT 08941 byli pacienti s prokázaným postižením N2 uzlin před neoadjuvantní terapií randomizovaně rozděleni po ní do skupiny s plicní resekcí a do skupiny s radioterapií. Operační mortalita u pacientů s lobektomií byla 0 % a u pacientů po pneumonektomii 6,9 % [10].
Martin v roce 2001 publikoval práci, kdy celková morbidita po pneumonektomii následující po NT byla 38 % a mortalita 11,3 % [1]. Poukazuje na mortalitu po pravostranné pneumonektomii, která byla 23,9 %. S ohledem na tento fakt doporučuje provedení pravostranné pneumonektomie pouze u selektované skupiny pacientů. Je zajímavé, že po levostranné pneumonektomii byla nulová mortalita. Doddoli identifikoval pneumonektomii jako rizikový faktor pro zvýšenou pooperační mortalitu po NT (30denní 12 %, 90denní 21 %) [2]. V práci Robertse měli pacienti s plicní resekcí po NT zvýšené riziko vážných komplikací, reintubací a nutnosti provedení tracheostomie [4]. Celková 90denní mortalita po NT byla signifikantně vyšší než bez NT (6 % vs. 0 %) a její hlavní příčinou byla pneumonie a plicní embolizace. Pacienti po pneumonektomii a NT měli signifikantně vyšší riziko život ohrožujících komplikací (reintubace, srdeční selhání, reoperace) než pacienti bez NT. Bernard publikoval retrospektivní studii 639 pacientů po pneumonektomii, kdy 63 z nich absolvovalo NT [11]. Pravostranná pneumonektomie a neoadjuvantní chemoterapie byly identifikovány jako jedny z faktorů, které zvyšují pooperační mortalitu.
Neoadjuvantní terapie (NT) může zlepšit resekabilitu nádorů a prognózu pacientů s bronchogenním karcinomem. Po NT dochází k zlepšení FEV 1 a FVC, ale také k poklesu DLCO. Zlepšení spirometrických hodnot je pravděpodobně na základě ukončení kouření pacientem a možném odstranění obstrukce v dýchacích cestách u respondentů na NT. Naopak při NT dochází k poškození alveolokapilární membrány s následným poklesem DLCO (10–25 %) [8]. Tento pokles je markantnější u respondentů na NT než u non-respondentů. DLCO se jeví jako lepší indikátor poškození plic a rizika pooperačních plicních komplikací po NT než FEV 1 a FVC a měl by být součástí každého předoperačního vyšetření po NT.
ZÁVĚR
Naše studie ukazuje, že provedení pneumonektomie po neoadjuvantní chemoterapii může být provedeno s akceptovatelnou morbiditou a mortalitou. Domníváme se, že základem je adekvátní předoperační evaluace pacientů a tento typ výkonů by měl být prováděn na specializovaných pracovištích s dostatečnými operačními zkušenostmi po neoadjuvantní terapii.
MUDr. Alan J. Stolz, Ph.D., MBA
Kroková 11
128 00 Praha 28
e-mail: stolz@seznam.cz
Zdroje
1. Martin, J., Ginsberg, R. J., Abolhoda, A., et al. Morbidity and mortality after neoadjuvant therapy for lung cancer: the risks of right pneumonectomy. Ann. Thorac. Surg., 2001; 72: l149–1154.
2. Doddoli, C., Barlesi, F., Trousse, D., et al. One hundred consecutive pneumonectomies after induction therapy for non-small cell lung cancer: an uncertain balance between risks and benefits. J. Thorac. Cardiovasc. Surg., 2005; 130 : 416–425.
3. Bernard, A., Deschamps, C., Allen, M. S., et al. Pneumonectomy for malignant disease: factors affecting early morbidity and mortality. J. Thorac. Cardiovasc. Surg., 2001; 121 : 1076–1082.
4. Roberts, J. R., Eustis, C., Devore, R., et al. Induction chemotherapy increases perioperative complications in patients undergoing resection for non-small cell lung cancer. Ann. Thorac. Surg., 2001 ;72 : 885–888.
5. Perrot, E., Guibert, B., Mulsant, P., et al. Preoperative chemotherapy does not increase complications after nonsmall cell lung cancer resection. Ann. Thorac. Surg., 2005; 80 : 423–427.
6. Mansour, Z., Kochetkova, E. A., Ducrocq, X., et al. Induction chemotherapy does not increase the operative risk of pneumonectomy! Eur. J. Cardiothorac. Surg., 2007; 31 : 181–185.
7. Wyser, C., Stulz, P., Solér, M., et al. Prospective evaluation of an algorithm for the functional assessment of lung resection candidates. Am. J. Respir. Crit. Care Med., 1999; 159 : 1450–1456.
8. Leo, F., Solli, P., Veronesi, G., et al. Does chemotherapy increase the risk of respiratory complications after pneumonectomy? J. Thorac. Cardiovasc. Surg., 2006; 132 : 519–523.
9. Allen, A. M., Mentzer, S. J., Yeap, B. Y., et al. Pneumonectomy after chemoradiation: the Dana-Farber Cancer Institute/Brigham and Women‘s Hospital experience. Cancer, 2008; 112 : 1106–1113.
10. van Schil, P., van Meerbeeck, J., Kramer, G., et al. Morbidity and mortality in the surgery arm of EORTC 08941 trial. Eur. Respir. J., 2005; 26 : 192–197.
11. Bernard, A., Deschamps, C., Allen, M. S., et al. Pneumonectomy for malignant disease: factors affecting early morbidity and mortality. J. Thorac. Cardiovasc. Surg., 2001; 121 : 1076–1082.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Česká hrudní chirurgie
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Česká hrudní chirurgie
- Mezinárodní setkání východoevropských hrudních chirurgů – milníky na cestě vědy a přátelství
- Maligní teratom mediastina – kazuistika
- Vliv neoadjuvantní terapie na pooperační komplikace po pneumonektomii
- Otevřené pleurální okénko v léčbě pokročilého empyému hrudníku: zkušenosti s léčbou dvaceti rizikových pacientů
- Nevýhody jednostranné videotorakoskopické tymektomie
- Plicní segmentektomie pro nádor
- Využití KLS Martin Nd: YAG laseru MY 40 1.3 v plicní chirurgii
- Akutní mediastinitis – optimální diagnostická a léčebná opatření
- Mediastinální lymfadenektomie v chirurgii plicních metastáz
- Pozdně diagnostikovaná ruptura bránice – kazuistika
- Postavení peroperační neuromonitorace, neuroprotekce a preventivní karotické endarterektomie u nemocných se zvýšeným rizikem mozkové ischemie indikovaných ke kardiochirurgické operaci
- GIST ako náhla brušná príhoda
- Další možnost modifikovaného přístupu při laparoskopické cholecystektomii
- Endovenózní laserová terapie varixů dolních končetin
- Hemotorax při tupém poranění hrudníku
- Zánětlivá onemocnění hrudníku v chirurgii
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hemotorax při tupém poranění hrudníku
- Akutní mediastinitis – optimální diagnostická a léčebná opatření
- Zánětlivá onemocnění hrudníku v chirurgii
- Maligní teratom mediastina – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



