-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Postavení peroperační neuromonitorace, neuroprotekce a preventivní karotické endarterektomie u nemocných se zvýšeným rizikem mozkové ischemie indikovaných ke kardiochirurgické operaci
Intraoperative Neuromonitoring, Neuroprotection and Preventive Carotid Endarterectomy in Patients with Increased Risk for Development of Cerebral Ischemia Indicated for Cardiosurgery
Aim of study:
To demonstrate the benefit of peroperative electrophysiological monitoring and neuroprotection in cardiac surgery that makes use a cardiopulmonary bypass in patients with a high risk of stroke and to analyze the importance of prophylactic carotid endarterectomy.Background:
Cerebral ischemia is the most dreaded complication of cardiovascular operations that make use of a cardiopulmonary bypass. It is necessary to select an approach that minimalizes neurological complications. In our treatment strategy we use preoperative electrophysiological monitoring and neuroprotection. Prophylactic carotid endarterectomy performed as part of a combined operation we performed in patients with a high risk of hemodynamic stroke.Method:
We retrospectively evaluated 86 patients (2004–2008) after cardiac surgery that made use of a cardiopulmonary bypass and synchronous electrophysiological neuromonitoring. After any decrease in neuronal function neuroprotection was used. Combined carotid and cardiac operations were performed under one general anestesia in ten patients with a high risk of hemodynamic stroke.Results:
A peroperative decline in electrophysiological responses was noted in 76.5%, of these 54.5% were insignificant alterations, 42.4% significant and in two cases there was a total deletion. After administration of neuroprotection electrophysiological responses partially normalized in 14%, totally normalized in 60% and did not change in 26%. Only one permanent stroke and four temporary encephalopathy were identified after surgery. No morbidity/mortality were detected after combined operations.Conclusion:
Peroperative electrophysiological neuromonitoring combined with neuroprotection eliminate cerebral ischemic complications in cardiac surgery that makes use of a cardiopulmonary bypass. Selected patients with high risk of hemodynamic stroke profit from carotid endarterectomy.Key words:
carotid artery stenosis – cardiac surgery – cardiopulmonary bypass – stroke – neuromonitoring – neuroprotection – carotid endarterectomy
Autoři: J. Mraček; I. Holečková; J. Mork; J. Frdlík *; J. Škorpil *
Působiště autorů: Neurochirurgické oddělení LF UK a FN Plzeň, primář: MUDr. M. Choc, CSc. ; Kardiochirurgické oddělení LF UK a FN Plzeň, primář: MUDr. T. Hájek *
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 5, s. 264-268.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Cíl:
Cílem sdělení je prokázat přínos peroperační elektrofyziologické monitorace a neuroprotekce při kardiochirurgických operacích v mimotělním oběhu u nemocných se zvýšeným rizikem vzniku mozkové ischemie a analyzovat význam preventivní karotické endarterektomie.Úvod:
Ischemické poškození mozku patří k nejzávažnějším komplikacím kardiovaskulárních operací v mimotělním oběhu. Žádoucí je proto zvolit léčebný postup, který riziko neurologických komplikací minimalizuje. Prezentovaná léčebná strategie spočívá ve využití peroperační elektrofyziologické monitorace a neuroprotekce. Preventivní karotickou endarterektomii indikujeme v rámci kombinovaného zákroku u nemocných s vysokým rizikem hemodynamického mozkového infarktu.Materiál a metodika:
Retrospektivně hodnotíme soubor 86 nemocných za období 2004–2008 u kterých byla provedena kardiochirurgická operace v mimotělním oběhu s elektrofyziologickou monitorací mozkových funkcí. Při alteraci elektrofyziologických odpovědí byly využity neuroprotektivní postupy. U podskupiny deseti nemocných byla provedena preventivní endarterektomie v jedné celkové anestezii jako kombinovaný zákrok.Výsledky:
Pokles elektrofyziologických odpovědí byl zjištěn v 76,5 %, z toho nevýznamné změny byly zaznamenány v 54,5 %, významné ve 42,4 % a dvakrát došlo k úplnému vymizení odpovědí. Po aplikaci neuroprotektivních léčebných postupů se ve 14 % elektrofyziologické odpovědi normalizovaly, v 60 % upravily částečně a v 26 % neupravily. Po operaci byl v jednom případě zjištěn mozkový infarkt a čtyřikrát přechodná encefalopatie. Kombinované zákroky měly nulovou morbiditu a mortalitu.Závěr:
Peroperační elektrofyziologický monitoring v kombinaci s neuroprotektivními postupy eliminuje frekvenci ischemických cerebrálních komplikací srdečních operací v mimotělním oběhu. Z preventivní karotické endarterektomie profituje selektovaný soubor nemocných s prokázaným rizikem hemodynamického mozkového infarktu.Klíčová slova:
stenóza krkavice – kardiovaskulární operace – mimotělní oběh – mozkový infarkt – neuromonitorace – neuroprotekce – karotická endarterektomieÚVOD
Ischemické poškození mozku patří k nejvíce devastujícím komplikacím kardiochirurgických (KCH) operací v mimotělním oběhu [1]. Frekvence neurologických komplikací se zvyšuje, neboť operováni jsou stále starší nemocní, u kterých je riziko vzniku ischemické cévní mozkové příhody (iCMP) vysoké [1]. Neurologické komplikace kardiochirurgických operací prodlužují pobyt v nemocnici, dvojnásobně zvyšují náklady na péči a jsou zodpovědné za 23% mortalitu [2]. Incidence iCMP je udávána u 1–9 % operovaných. Mnohem častěji, až v 76 %, se vyskytuje difuzní multifokální encefalopatie projevující se širokým spektrem příznaků od kognitivních poruch až k deliriu a vegetativním stavům [3–5]. Cílem by mělo být zvolit léčebné postupy, které riziko rozvoje mozkového postižení minimalizují.
Z důvodů prevence iCMP je tradičně prováděna preventivní karotická endarterektomie před vlastním KCH výkonem [1]. Byl potvrzen ochranný efekt některých neuroprotektiv při srdečních operacích [6]. Prokázaný protektivní účinek má i využití různých technik per-operační neuromonitorace (transkraniální dopplerometrie /TCD/, near-infrared spektroskopie /NIRS/, cerebrální oxymetrie a elektrofyziologické metody – elektroencefalografie /EEG/ a somatosenzorické evokované potenciály /SEP/) [7]. Zatímco v neurochirurgii se využití elektrofyziologické monitorace stalo standardem [8, 9], v kardiovaskulární chirurgii k jejímu vše-obecnému rozšíření zatím nedošlo a literární sdělení jsou sporadická [10, 11]. Je třeba zdůraznit, že elektrofyziologické odpovědi s mozkovou perfuzí nekorelují přímo, lineárně. Hodnota fyziologické mozkové perfuze (CBF) je 50 ml/100 g/min. Somatosenzorické evokované potenciály nejsou však ovlivněny poklesem CBF až na 22 ml/100 g/min. K vymizení SEP dochází v intervalu 12–15 ml/100 g/min (období tzv. penumbry – přechod funkčního a strukturálního prahu poškození neuronu) [9].
Vznik mozkového infarktu je spojován s peroperační hypoperfuzí na podkladě stenózy vnitřní krkavice (ACI). Provedení preventivní karotické endarterektomie (CEA) je ospravedlňováno snahou této hypoperfuzi zabránit [12]. Zatímco indikace samotné CEA a revaskularizace myokardu (CABG) jsou založeny na obecně přijatých pravidlech (guidelines), názory na léčebný postup při kombinaci obou postižení zůstávají nejednotné [13, 14].
Cílem naší práce je prokázat přínos peroperační elektrofyziologické monitorace a neuroprotekce u nemocných indikovaných ke kardiochirurgické operaci v mimotělním oběhu, u kterých je zvýšené riziko vzniku mozkové ischemie na podkladě aterosklerotických změn magistrálních krčních nebo mozkových tepen. Ve sdělení je analyzován význam preventivní CEA z pohledu prevence vzniku peroperační iCMP.
MATERIÁL A METODA
V období 2004–2008 byly peroperačně elektrofyziologicky monitorovány mozkové funkce u 86 nemocných (67 mužů, 19 žen) ve věku 47–85 let (průměrný věk – 66) (Tab. 1.). Ve všech případech byla provedena kardiochirurgická operace v mimotělním oběhu. U podskupiny 10 nemocných byla indikována karotická endarterektomie v rámci kombinovaného výkonu v jedné celkové narkóze (Tab. 2).
Tab. 1. Soubor nemocných (2004–2008) Tab. 1. Subjects (2004–2008) 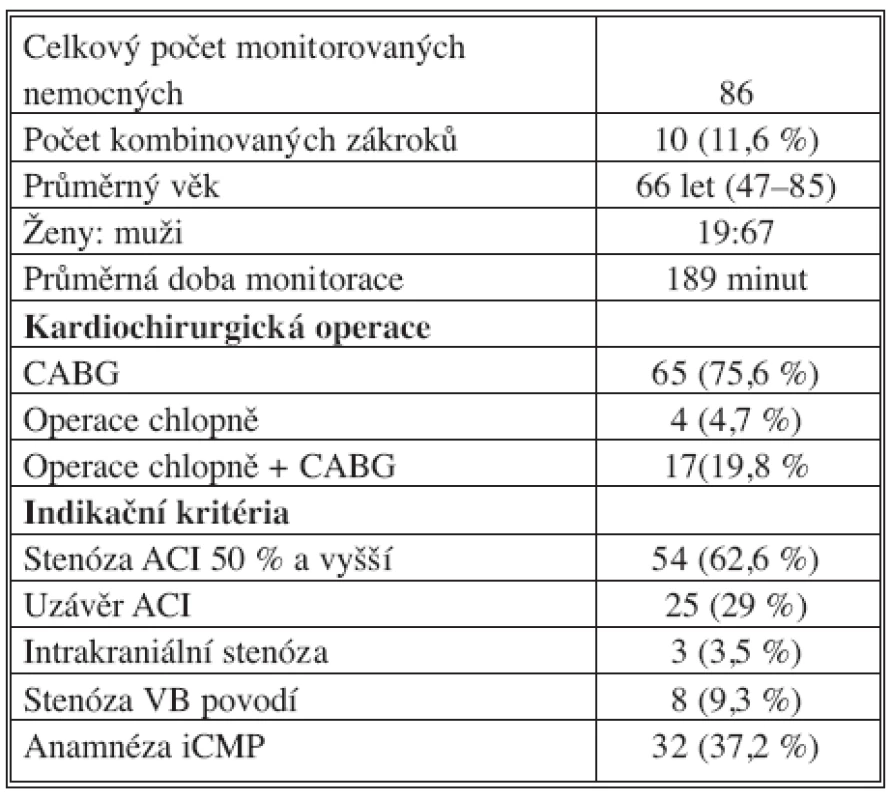
Tab. 2. Kombinované zákroky Tab. 2. Combined procedures 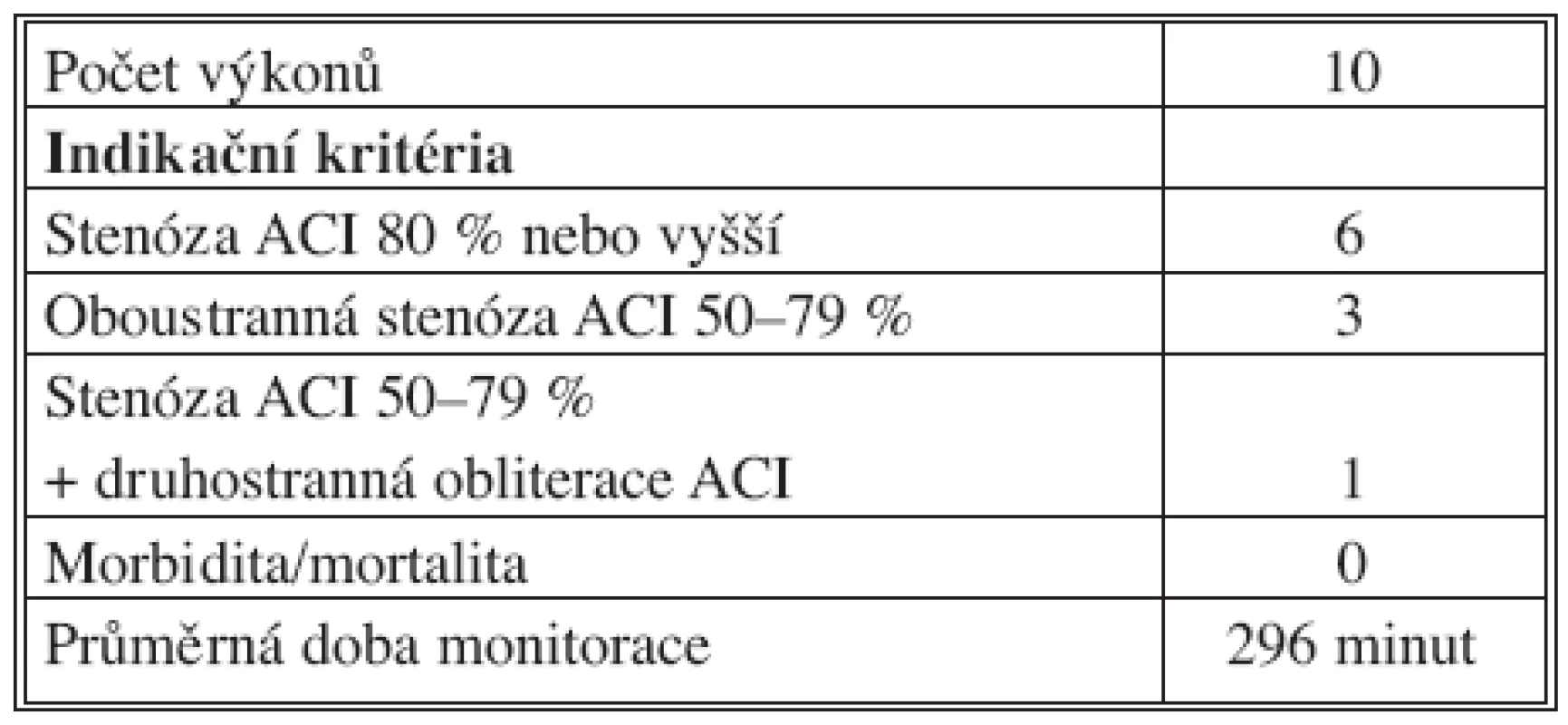
Do studie byli zařazeni nemocní se zvýšeným rizikem vzniku peroperačních ischemických neurologických komplikací. Vstupními kritérii pro použití monitorace byly: uzávěr ACI, uzávěr nebo sklerotické změny intrakraniálního cévního řečiště, hemodynamicky hraničně významná stenóza ACI (50–79 %), inoperabilní stenóza ACI, stenóza vertebrobazilárního (VB) řečiště a anamnéza iCMP. Vstupními kritérii pro provedení preventivní CEA byla jednostranná stenóza ACI 80 % nebo vyšší, oboustranná stenóza ACI 50–79 %, nebo jednostranná stenóza ACI 50–79 % při druhostranném uzávěru ACI.
K peroperačnímu sledování mozkových funkcí jsme použili elektrofyziologicky monitoring – oboustranné somatosenzorické evokované potenciály nervus medianus. Nervus medianus stimulujeme kontinuálně na zápěstí střídavě vlevo a vpravo (pravoúhlý klik délky 0,2 ms, frekvence stimulace 4,7 Hz, intenzita stimulace 9–15 mA). Kontinuálně registrujeme po celou dobu operace (on line) skalpovou odpověď (N20-P25) selektivně z obou hemisfér (umístění elektrod na skalpu: C3’-Fz a C4’ - Fz, 500 zprůměrněných přeběhů, filtrová propusť 30–300 Hz) a hodnotíme její amplitudu (mV). Výchozí hodnota je stanovena zprůměrněním tří po sobě následujících registrovaných odpovědí po stabilizaci anestezie. Změny skalpové odpovědi v průběhu operace jsme rozdělili do čtyř stupňů: 1. beze změn (pokles amplitudy N20-P25 o méně jak 25 % výchozích hodnot), 2. nevýznamné změny (pokles o 25–50 %), 3. významné změny (pokles o více než 50 %), 4. úplné vymizení odpovědí. Nemocní byli monitorováni od úvodu do anestezie (úplná intravenózní anestezie (TIVA) Propofol + Sufentanyl) po celou dobu trvání operačních výkonů, které byly prováděny v normotermii. Za úpravu elektrofyziologických odpovědí bylo považováno jejich zlepšení minimálně do oblasti nevýznamných změn.
Při poklesu neuronálních funkcí byly využity fyzikální neuroprotektivní léčebné postupy eliminující riziko vzniku cerebrálních komplikací: elevace krevního tlaku, zvýšení parciálního tlaku kyslíku, elevace průtoku krve mimotělním oběhem, zvýšení srdečního indexu a medikamentózní neuroprotekce (Sendai cocktail – Manitol, Phenhydan, vitamin E). Po probuzení z narkózy bylo provedeno podrobné neurologické vyšetření k posouzení event. přítomnosti ložiskové neurologické symptomatiky nebo difuzní encefalopatie.
VÝSLEDKY
Předoperační angiografické vyšetření prokázalo u šesti nemocných stenózu krčního úseku ACI 80 % nebo vyšší, ve 48 případech hemodynamicky hraniční stenózu ACI (3x oboustranná) 25x uzávěr krčního úseku ACI, 3x významnou stenózu v intrakraniálním povodí ACI a 8x stenózu ve VB povodí. 32 nemocných mělo v anamnéze iCMP. Ve 42 případech se jednalo o asymptomatickou stenózu ACI, 12x byla stenóza ACI symptomatická.
V průběhu KCH operace (65x CABG, 17x CABG + operace chlopně, 4x operace chlopně) nebyly ve 23,5 % případů elektrofyziologické odpovědi alterovány. V 76,5 % došlo k jejich poklesu, z toho nevýznamné změny byly zaznamenány v 54,5 %, významné ve 42,4 % a dvakrát bylo zjištěno úplné vymizení odpovědí (Tab. 3). Pokles amplitud SEP se vyskytl v různých fázích operace: ve 14 případech po napojení na mimotělní oběh, 16x po naložení nebo sejmutí příčné svorky, 16x po naložení nebo sejmutí nástěnné svorky a u 20 nemocných při poklesu středního arteriálního tlaku. U kombinovaných zákroků došlo v jednom případě v průběhu CEA k vymizení SEP. Po zavedení shuntu se neuronální odpovědi zcela normalizovaly. Průměrná doba monitorace celého souboru byla 189 minut (maximum 394 minuty, minimum 75 minut), u kombinovaných výkonů 296 minut.
Tab. 3. Výsledky Tab. 3. Results 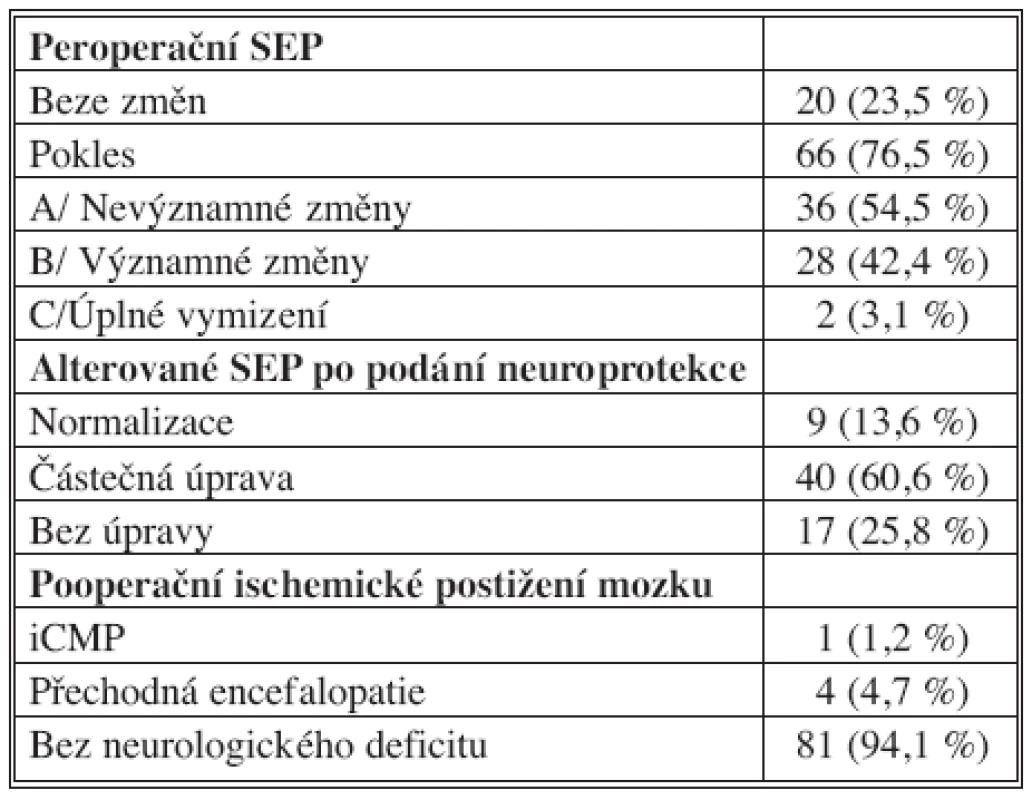
Při poklesu elektrofyziologických odpovědí došlo po aplikaci neuroprotektivních postupů ve 14 % k jejich normalizaci, v 60 % se odpovědi upravily částečně a v 26 % nebyl pokles podáním neuroprotekce ovlivněn.
Mozkový infarkt byl po operaci zjištěn u jednoho nemocného (1,2 %), u čtyř pacientů došlo k rozvoji přechodné difuzní multifokální encefalopatie (4,5 %). Morbidita a mortalita (MM) kombinovaných zákroků byla nulová.
DISKUSE
Prezentovaný soubor je specifickou populací nemocných se zvýšeným rizikem vzniku mozkové ischemie u kterých byla provedena kardiovaskulární operace v mimotělním oběhu s užitím peroperační elektrofyziologické monitorace. U kombinovaných zákroků, prováděných vždy v jedné celkové narkóze, bylo v monitoraci pokračováno i po endarterektomii až do skončení následné srdeční operace, v průběhu které je nemocný ohrožen iCMP na podkladě trombózy operované krkavice (vysazená antiagregancia, opakované kolísání koagulačních parametrů, nonpulzatilní hypotenze). Pokles elektrofyziologických odpovědí byl zaznamenán u většiny monitorovaných nemocných. Neuroprotektivní opatření byla efektivní u třech čtvrtin případů, u kterých došlo k úplné nebo částečné úpravě neuronálních odpovědí. Úplné peroperační vymizení neuronální funkce bylo zjištěno ve dvou případech, klinický korelát ve formě iCMP byl však prokázán pouze jedenkrát. V druhém případě se jednalo o nemocného, který měl již předoperačně přítomnou hemiparézu na podkladě proběhlé encefalitidy, což negativně ovlivnilo specificitu elektrofyziologického vyšetření. Příznaky difuzní encefalopatie u čtyř nemocných odezněly po několika dnech. Nezjistili jsme závislost vzniku encefalopatie na peroperační alteraci SEP. Senzitivita elektrofyziologického monitoringu v našem souboru nemocných byla 100%, specificita se pohybovala v závislosti na míře poklesu amplitud SEP od 77 % při padesátiprocentní alteraci až po 99 % při úplném vymizení.
Domníváme se, že minimální výskyt neurologických komplikací v našem souboru, ve srovnání s literárně udávanou incidencí, potvrzuje pozitivní efekt kombinace neuromonitorace a neuroprotektivních opatření [5, 6, 15]. Fyzikální neuroprotektivní postupy, aplikované při poklesu neuronálních odpovědí, jsou podobně jako zavedení shuntu při CEA kauzální při hypoperfuzi. Medikamentózní neuroprotekce eliminuje hloubku ischemického postižení bez ohledu na jeho etiologii. Jako medikamentózní neuroprotekce v průběhu KCH výkonů byl podáván Sendai cocktail, který je standardně používán při cévních neurochirurgických zákrocích (intrakraniální aneuryzmata, karotická endarterektomie) a jehož účinnost byla potvrzena [16].
Zjištěním alterace elektrofyziologických odpovědí v různých fázích KCH operací potvrzujeme v současnosti panující představu o multifaktoriální etiologii peroperační mozkové ischemie [12]. Za hlavní mechanismus je považována embolizace ze srdce a aorty, hypoperfuze je příčinou pouze u jedné třetiny operovaných [1, 12, 17, 18]. Kombinace embolizace a hypoperfuze, spolu s chabým kolaterálním oběhem, vede k neschopnosti vymýt mikroemboly zejména z oblastí na rozhraní povodí, což se projevuje typickou lokalizací iCMP (watershed infarkt) [19]. Uvádí se, že mimotělní oběh může sám o sobě pravděpodobně vést k mozkovému poškození (nonpulzatilní hypoperfúze, tvorba mikroembolů, vyšší agregace destiček, aktivace komplementu) [5].
Význam stenózy krkavice v etiologii peroperační iCMP bývá přeceňován. Stenóza ACI již není považována za vlastní příčinu mozkového infarktu, ale je řazena pouze mezi rizikové faktory (věk, aortální ateroskleróza, trvání mimotělního oběhu, fibrilace síní, DM, arteriální hypertenze, anamnéza iCMP) [20]. Zatímco pouze 8 % nemocných indikovaných k CABG má zjištěnu významnou stenózu krkavice, výskyt ischemických neurologických komplikací dosahuje až 76 % [21]. Preventivní CEA eliminuje pouze jeden rizikový faktor – sníží riziko hemodynamické iCMP, jejíž výskyt je však podmíněn vyčerpanou cerebrovaskulární rezervou (CVRC) [22]. Vyšetřením CVRC lze vyselektovat nemocné, kteří mohou z preventivní CEA profitovat. Příkladem je nemocný, který měl oboustrannou obliteraci krkavice a jedné vertebrální tepny (supratentoriální mozková perfuze byla při agenezi zadních komunikujících arterií umožněna v minulosti provedeným konvenčním EC-IC bypassem). Při vyšetření jsme nezjistili porušenou CVRC, další cerebrální revaskularizace před KCH operací proto nebyla indikována (zvažován druhostranný EC-IC bypass) a nemocný podstoupil CABG aniž by došlo k peroperačnímu poklesu elektrofyziologických odpovědí a výskytu neurologických komplikací. Naše výsledky spolu s převažujícím embolizačním mechanismem iCMP ukazují, že paušální provádění CEApřed KCHvýkonem nemá opodstatnění.
Názory na léčebné zásady u nemocných s kombinací aterosklerotického postižení krkavic a koronárních tepen nejsou jednotné [23–26]. V načasování operačních výkonů jsou tři možnosti: 1. kombinovaný výkon, kdy jsou obě operace provedeny v jedné době, 2. sekvenční výkon, kdy je nejprve provedena CEA a odložené CABG a 3. reverzní sekvenční výkon, kdy je posloupnost operací obrácená. Kombinovaný i sekvenční postup jsou považovány za bezpečné a efektivní a v klinické praxi jsou poměrně rozšířené [23–25]. V literatuře však nalezneme jen minimum prací týkajících se reverzního sekvenčního výkonu. Hertzer et al. jej navrhují pouze u nemocných s nestabilním koronárním syndromem (nutnost urgentní operace) a incidentální asymptomatickou stenózou ACI [26]. Směrnice American College of Cardiology (ACC) a American Heart Association (AHA) pro CABG z roku 1999 reverzní sekvenční výkon dokonce vůbec nedoporučovaly [27]. Novější ACC/AHA guideline z roku 2004 jsou velmi stručná, doporučují provést CEA před CABG kombinovaně nebo sekvenčně při stenóze ACI 80 % nebo vyšší (klasifikace IIA, hladina významnosti C) [14]. Nylor et al. metaanalýzou provedených studií prokázali, že výsledky jednotlivých postupů nejsou jednoznačné [28]. Zjistili, že kombinovaný výkon má nejvyšší mortalitu bez ohledu na vznik perioperační iCMP a je spojen s delší hospitalizací. Sekvenční výkon má nejvyšší riziko vzniku perioperačního infarktu myokardu (IM), ale nejnižší riziko iCMP. Naopak nejvyšší riziko perioperační iCMP, ale nejnižší riziko IM bylo zjištěno u reverzního sekvenčního výkonu. Rozdíly v outcome nemocných po kombinovaných a sekvenčních výkonech však nebyly signifikantní. Prokazatelně vyšší MM kombinovaných zákroků je udávána při porovnání se samotným CABG [29]. Naši kardiochirurgové uvádějí komplikované hojení sternotomií po kombinovaných výkonech.
Důvody k indikaci kombinovaného zákroku jsou v zásadě dva: na jedné straně snaha eliminovat riziko per - operační iCMP, na druhé straně stojí přesvědčení o nižší MM a výhodnějším poměru cost/benefit ve srovnání se sekvenčními výkony [24]. V podstatě však jde o spojené nádoby. Naše zkušenosti a závěry ukazují, že z kombinovaného zákroku profituje pouze selektovaná podskupina nemocných s vysokým rizikem peroperační iCMP, které by měla preventivní CEA zabránit. U paušálně prováděných kombinovaných zákroků je CEA pravděpodobně ve většině případů zbytečná, neefektivní a naopak pouze zvyšuje MM prováděného CABG. Zdali kombinované výkony přináší ve srovnání se sekvenčním postupem nemocným užitek je třeba testovat v dalších studiích.
ZÁVĚR
- Peroperační elektrofyziologický monitoring v kombinaci s neuroprotekcí eliminuje frekvenci neurologických komplikací srdečních operací v mimotělním oběhu.
- Paušální provádění CEA v rámci kombinovaného nebo sekvenčního výkonu není z důvodů prevence vzniku peroperační iCMP opodstatněné.
- Z preventivní CEA profituje selektovaný soubor nemocných s prokázaným rizikem hemodynamické iCMP.
- Zdali kombinovaný postup, ve srovnání se sekvenčními zákroky, přináší nemocným benefit, je třeba testovat v dalších studiích.
Seznam zkratek:
KCH – kardiochirurgický
iCMP – ischemická cévní mozková příhoda
TCD – transkraniální dopplerometrie
NIRS – near-infrared spektroskopie
EEG – elektroencefalografie
SEP – somatosenzorické evokované potenciály
CBF – cerebral blood flow (mozková perfuze)
ACI – arteria carotis interna
CEA – karotická endarterektomie
CABG – coronary artery bypass graft
VB – vertebrobazilární
TIVA – úplná intravenózní anestezie
MM – morbidita/mortalita
DM – diabetes mellitus
CVRC – cerebrovaskulární rezervní kapacita
EC-IC bypass – extrakraniální-intrakraniální bypass
ACC – American College of Cardiology
AHA – American Heart Association
IM – infarkt myokardu
MUDr. J. Mraček
Alej Svobody 27
323 00 Plzeň
e-mail: mracek@fnplzen.cz
Zdroje
1. Akins, C. W., Cambria R. P. Myocardial revascularization with carotid artery disease. In: John, L.H. Cardiac surgery in the adult. New York: McGraw-Hill, 2008 : 655–668.
2. Tuman, K. J., McCarthy, R. J., Najafi, H., et al. Differential effects of advanced age on neurologie and cardiac risk on coronary artery operations. J. Thorac. Cardiovasc. Surg., 1992; 104 : 1510–1517.
3. Puskas, J. D., Winston, A. D., Wright, C. E., et al. Stroke after coronary artery operation: Incidence, correlates, outcomes, and cost. Ann.Thorac. Surg., 2000; 69 : 1053–1056.
4. McKhann, G. M., Grega, M. A., Borowicz, L. M. jr., et al. Encephalopathy and stroke after coronary artery bypass grafting: incidence, consequences, and prediction. Arch. Neurol., 2002; 59 : 1422–1428.
5. Arrowsmith, J. E., Grocott, H. P., Reves, J. G., et al. Central nervous system complication of cardiac surgery. Br. J. Anaesth., 2000; 84 : 378–393.
6. Arrowsmith, J. E., Harrison, M. J. G., Newman, S. P., et al. Neuroprotection of the brain during cardiopulmonary bypass. Stroke, 1998; 29 : 2357–2362.
7. Edmonds, H. L. jr. Multi-modality neurophysiologic monitoring for cardiac surgery. Heart Surg. Forum, 2002; 5 : 225–228.
8. Holeckova, I., Fischer, C, Giard, M. H., et al. Brain response to a subjecťs own name uttered by a familiar voice. Brain. Res., 2006; 1082 : 142–152.
9. Haupt, W. F, Horsch, S. Evoked potential monitoring in carotid surgery: a review of 994 cases. Neurology, 1992; 42(4): 835–838.
10. Ueno, T., Ikeda, K., Matsuyama, S. Characteristic changes in cerebral perfusion during on-pump and off-pump coronary artery surgery. Jpn. J. Thorac. Cardiovasc. Surg., 2005; 53 : 138–142.
11. Oki, A., Ohtake, H., Okada, Y., et al. Simultaneous monitoring of somatosensory evoked potentials and regional cerebral oxygen saturation combined with serial measurement of plasma levels of cerebral specific proteins for the early diagnosis of postoperative brain damage in cardiovascular surgery. J. Artif. Organs., 2004; 7 : 13–18.
12. Goldemund, D., Mikulík, R. Neurologické komplikace operací v mimotělním oběhu. Neurol. pro praxi, 2003; 5 : 253–256.
13. The European Stroke Organisation (ESO) Executive Comittee and the ESO Writing Committee. Guidelines for management of ischemic stroke and transient ischaemic attack 2008. Cerebrovasc. Dis., 2008; 25 : 457–507.
14. Eagle, K. A., Guyton, R. A., Davidoff, R. D., et al. ACC/AHA 2004 Guideline Update for coronary artery bypass graft surgery: Summary article. J. Am. Coll. Cardiol., 2004; 44 : 1146–1154.
15. Suzuki, J., Fujimoto, S., Mizoi, K. et al. The protective effect of combined administration of antioxidants and perfluorochemicals on cerebral ischemia. Stroke, 1984; 15 : 672–679.
16. Suzuki, J., Imaizumi, S., Kayama, T., et al. Chemiluminiscence in hypoxic brain, the second report: Cerebral protective effect of Mannitol, Vitamin E and glucocorticoid. Stroke, 1985; 16 : 695–700.
17. Blossom, G. B., Fietsam, R. Jr., Bassett, J. S., et al. Characteristics of cerebrovascular accidents after coronary artery bypass grafting. Am. Surg., 1992; 58 : 584–589.
18. Wijdicks, E. F., Jack, C. R. Coronary artery bypass grafting-associated ischemic stroke. A clinical and neuroradiological study. J. Neuroimaging, 1996; 6 : 20–22.
19. Wareing, T. H., Davila-Roman, V. G., Barzilai, B., et al. Management of the severely atherosclerotic ascending aorta during cardiac operations. J. Thorac. Cardiovasc. Surg., 1992; 103 : 453–462.
20. Ricotta, J. J., Car, D. J., Cuadra, S. A., et al. Modeling stroke risk after coronary artery bypass and combined coronary artery bypass and carotid endarterectomy. Stroke, 2003; 34 : 1212–1217.
21. Ivey, T. D., Strandness, E., Williams, D. B., et al. Management of patients with carotid bruit undergoing cardiopulmonary bypass. J. Thorac. Cardiovasc. Surg., 1984; 87 : 183–189.
22. Schmiedek, P., Piepgras, A., Leinsinger, G., et al. Improvement of cerebrovascular reservě capacity by EC-IC arterial bypass surgery in patiens with ICA occlusion and hemodynamic cerebral ischemia. J. Neurosurg., 1994; 81 : 236–244.
23. Akins, C. W., Moncure, A. C, Daggett, W. M., et al. Safety and efficacy of concomitant carotid and coronary artery operations. Ann. Thorac. Surg., 1995; 60 : 311–317.
24. Zacharias, A., Schwan, T. A., Riordan, CH. J., et al. Operative and 5-year outcome of combined carotid and coronary revascularization: Review of a large contemporary experience. Ann. Thorac. Surg., 2002;73 : 491–498.
25. Antunes, P. E., Anacleto, G., Ferrao de Oliveira, J. M., et al. Staged carotid and coronary surgery for concomitant carotid and coronary artery disease., 2002; 21 : 181–186.
26. Hertzer, N. R., Loop, F. D., Beven, E. G., et al. Surgical staging for simultaneous coronary and carotid disease: A study including prospective randomization. J. Vasc. Surg., 1989; 9 : 455–463.
27. Eagle, K. A., Guyton, R. A., Davidoff, R. D., et al. ACC/AHA Guideline for coronary artery bypass graft surgery: Executive summary and recommendations. Circulation, 1999; 100 : 1464–1480.
28. Naylor, A. R., Cuffe, R. L., Bell, P. R. A systematic review of outcomes following staged and synchronous carotid endarterectomy and coronary artery bypass. Eur. J. Vasc. Endovasc. Surg., 2003; 25 : 380–389.
29. Cywinski, J. B., Koch, C. G., Krajewski, L. P., et al. Increased risk associated with combined carotid endarterectomy and coronary artery bypass graft surgery: a propensity-matched comparison with isolated coronary artery bypass grafit surgery. J. Cardiothorac. Vasc. Anesth., 2006; 20 : 796–802.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek Česká hrudní chirurgie
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Česká hrudní chirurgie
- Mezinárodní setkání východoevropských hrudních chirurgů – milníky na cestě vědy a přátelství
- Maligní teratom mediastina – kazuistika
- Vliv neoadjuvantní terapie na pooperační komplikace po pneumonektomii
- Otevřené pleurální okénko v léčbě pokročilého empyému hrudníku: zkušenosti s léčbou dvaceti rizikových pacientů
- Nevýhody jednostranné videotorakoskopické tymektomie
- Plicní segmentektomie pro nádor
- Využití KLS Martin Nd: YAG laseru MY 40 1.3 v plicní chirurgii
- Akutní mediastinitis – optimální diagnostická a léčebná opatření
- Mediastinální lymfadenektomie v chirurgii plicních metastáz
- Pozdně diagnostikovaná ruptura bránice – kazuistika
- Postavení peroperační neuromonitorace, neuroprotekce a preventivní karotické endarterektomie u nemocných se zvýšeným rizikem mozkové ischemie indikovaných ke kardiochirurgické operaci
- GIST ako náhla brušná príhoda
- Další možnost modifikovaného přístupu při laparoskopické cholecystektomii
- Endovenózní laserová terapie varixů dolních končetin
- Hemotorax při tupém poranění hrudníku
- Zánětlivá onemocnění hrudníku v chirurgii
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hemotorax při tupém poranění hrudníku
- Akutní mediastinitis – optimální diagnostická a léčebná opatření
- Zánětlivá onemocnění hrudníku v chirurgii
- Maligní teratom mediastina – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



