-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
Case Report: Fat Embolism Syndrome – Grave Handicap after Traumatic Long-bones Fractures
Embolism of fat and bone marrow tissue is quite often due to bone fractures but it is seldom with signs of systemic involvement as a fat embolism syndrome. The main forming factor is late stabilization of fractures and hypovolemia too. Clinical image of fat embolism syndrome results from lung and systemic microembolism which leads to activation of inflammatory and thrombogenic cascades. We present a case report of a 24-year-old male after bike accident in low speed suffering from isolated thighbone fracture – osteosynthesis was applied in 6 hours after injury. The very first day the organ failure and coma with negative CT occurred, then ARDS, petechiae into the skin of chest and conjunctiva, also embolic closure of a. centralis retinae. Treatment interventions included anticoagulation, steroids, artificial ventilation for 17 days. After 3 weeks from injury he was still unconscious (with GCS 10) so that we tried a hyperbaric oxygen therapy. The patient regained consciousness after 3 months after injury. One year later he is able to walk alone, he has no visual failure, but he is still quadruspastic although able to manipulate with a mobile phone. We discuss diagnostic criteria and treatment. We also point out need of volumetherapy in prevention of fat embolism syndrome – this was underrated here because of primary missed out diagnose of co-existing tibia fracture at the same time (this was stabilised 18 hours after injury).
Key words:
fat embolism syndrome – trauma
Autoři: M. Blažek; E. Havel; J. Cerman; E. Bělobrádková; T. Dědek; I. Počepcov
Působiště autorů: Chirurgická klinika, Univerzita Karlova v Praze, Lékařská fakulta v Hradci Králové a Fakultní nemocnice Hradec Králové, přednosta: prof. MUDr. Alexander Ferko, CSc.
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 11, s. 649-655.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Embolie tukových a dřeňových částic při zlomeninách kostí jsou časté, ale jen v málo případech jsou vyjádřeny klinické známky systémového embolizačního postižení – tzv. syndrom tukové embolie. Jako hlavní faktory vzniku syndromu se uvádějí pozdní fixace zlomenin a hypovolemie. Klinické projevy syndromu jsou dány plicními a systémovými mikroembolizacemi s aktivací zánětlivé a trombogenní kaskády. Předkládáme kazuistiku 24letého muže po motocyklové nehodě v malé rychlosti s izolovanou příčnou frakturou stehenní kosti. Osteosyntéza stehenní kosti dlahou byla provedena za 6 hodin po úrazu. První den po úrazu byla diagnostikována porucha vědomí s negativním CT nálezem mozku. V dalších dnech vývoj ARDS, výsev petechií na kůži hrudníku a na spojivkách, na očním pozadí známky embolie a. centralis retinae. V léčebné intervenci podávána antikoagulační léčba a kortikoidy, arteficiální ventilace probíhala 17 dnů. Po 3 týdnech od úrazu přetrvává porucha vědomí (GCS 10) bez možnosti navázání kontaktu, následovala léčba v hyperbarické komoře. K plnému obnovení vědomí dochází do 3 měsíců od úrazu. Za rok po úrazu je nemocný chodící a s úpravou zraku, ještě přetrvávají známky kvadruspasticity, v jemné motorice dobře zvládá obsluhu mobilního telefonu. V diskusi je proveden rozbor diagnostických kritérií a možnosti léčby. Zdůrazňujeme časnou volumovou terapii jako prevenci rozvoje syndromu tukové embolie, která zde byla podceněna i z důvodu primárně přehlédnuté současné zlomeniny bérce (ta byla stabilizována za 18 hodin od úrazu).
Klíčová slova:
syndrom tukové embolie – traumaDEFINICE A EPIDEMIOLOGIE
Patofyziologický fenomén embolizace tukových hmot může být při systémovém postižení součástí syndromu, který je definován přítomností komplexu klinických známek [1]. Syndrom tukové embolie je nejčastěji popisován u polytraumatizovaných nemocných, resp. až v 90 % u fraktur dlouhých kostí [1–3]. Přitom klinické projevy pozorujeme jen asi u 10–30 % nemocných se zlomeninami, s nejvyšší incidencí v období prvních 48 hodin po traumatu [1, 4]. Systémový rozsev tukových hmot může však provázet i těžké pankreatitidy, popáleniny, maligní procesy, těžkou osteomyelitidu, kardiopulmonální resuscitaci, sternotomii, liposukci apod. [5, 6, 7, 8]. Také hemoglobinopatie nebo diagnostická či léčebná aplikace přípravků obsahující lipidové emulze i.v. je zatížena tímto rizikem [3, 7]. Vyplavení tukových či ateromových hmot bylo popsáno i v souvislosti s katetrizačními zákroky nebo s operačními výkony na velkých sklerotických tepnách [8, 9].
PATOFYZIOLOGIE
Vznik syndromu tukové embolie [1–3] spočívá v uvolnění tukových partikulí do systémového řečiště, které dál jednak mechanicky uzavírají drobné kapiláry a zaklíněním v periferním oběhu tak působí lokální ischemii [10], současně na různé úrovni vedou k aktivaci zánětlivé a trombogenní kaskády [11].
DIAGNÓZA
Diagnostika syndromu tukové embolie se opírá především o pečlivou analýzu anamnézy (zde polytrauma) a vývoje klinického stavu s výsledky vyšetření a laboratorních testů [1, 3].
Klinický nález
Gurd formuloval v roce 1970 tzv. velká a malá diagnostická kritéria, jsou stále aktuální [12, 13] – diagnóza je pravděpodobná, je-li přítomno alespoň jedno velké kritérium a současně čtyři malá kritéria společně s tukovou makroglobulinemií (Tab. 1). Někteří autoři klasifikaci Gurda různě upravili, jiní ji doplnili [14, 15] – např. Schonfeld navrhl skóre tukové embolie, které však není optimální pro pacienty s poraněním hlavy, hrudníku a břicha (Tab. 2).
Tab. 1. Diagnostická kritéria syndromu tukové embolie podle Gurda 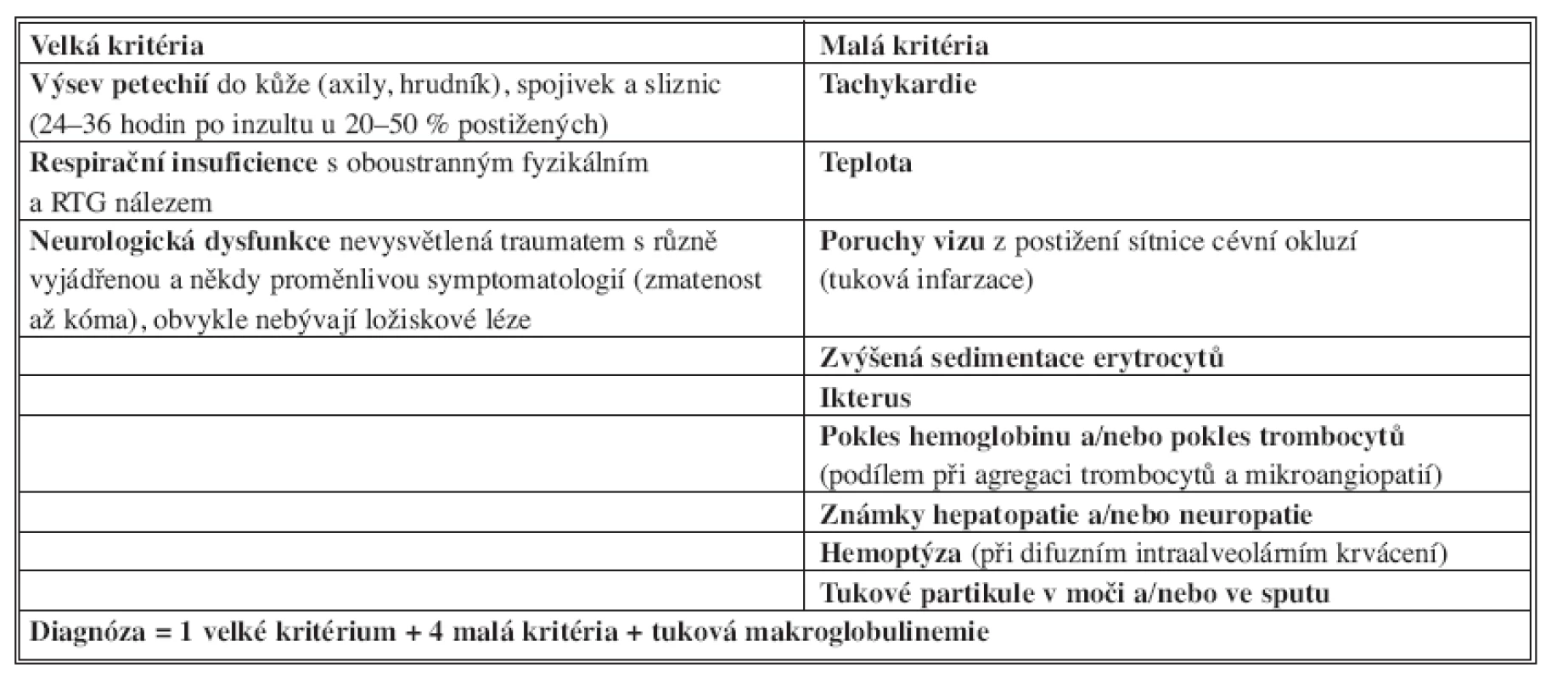
Tab. 2. Skóre tukové embolie podle Schonfelda 
Respirační dysfunkce je přítomna asi u 75 % nemocných, u kterých až v 10 % může vyústit do respiračního selhání [13]. Centrální nervové projevy bývají v 80–90 % případů, mohou být proměnlivé a přítomný otok mozku může vést až k bezvědomí [3]. Postižení kůže se projevuje výsevem petechií u 20–50 % nemocných v průběhu 24–36 hodin – typicky na hrudi a krku, v axilách a na spojivce [16]. Ostatní uvedené známky jsou méně specifické.
Diagnózu obvykle stanovíme na základě klinického nálezu za současného vyloučení jiné příčiny. V rámci diferenciální diagnózy [3] je nutné pomýšlet na hypoxii při tromboembolismu, kontuzi plic a pneumonii, na cerebrální dysfunkci při hypoxii a při meningitidě (meningokokovou septikemii provází rychlý generalizovaný kožní výsev s dalšími systémovými projevy).
Laboratorní vyšetření
Z laboratorních vyšetřovacích metod může k diagnóze přispět analýza arteriálních krevních plynů (hypoxie s paO2 < 60 mm Hg s normo/hypokapnií); krevní obraz a vyšetření hemostázy (anemie a trombocytopenie, hypofibrinogenemie a prodloužené koagulační testy při konsumpční koagulopatii); sedimentace erytrocytů (může být nespecificky vysoká) [2, 3]. Cytologickým vyšetřením moče, krve a sputa je možné opticky stanovit přítomnost tukových partikulí, a to volně nebo v makrofázích – negativní nález však nevylučuje tukovou embolii a např. pozitivní močový nález u traumat často bývá; přínosné zde může být vyšetření provedené z centrální žilní krve [17].
Zobrazovací a invazivní vyšetřovací metody
Ze základních vyšetření rentgen srdce a plic (RTG) může zachytit difuzní oboustranné plicní infiltráty (obraz „sněhové bouře“), zvýšenou plicní kresbu a dilataci pravostranných srdečních oddílů v průběhu 24–48 hodin od začátku příznaků [3]. Později může RTG nález odpovídat již typickému obrazu ALI/ARDS.
Počítačová tomografie mozku (CT) bývá s normálním a nespecifickým nálezem nebo odpovídá difuznímu petechiálnímu krvácení [3, 17].
Magnetická rezonance (MR) zobrazí tukovou embolizaci v mozku s podstatně vyšší citlivostí než CT [18, 19].
Jícnové ultrazvukové vyšetření srdce může zobrazit cirkulující tukové substance v pravostranných srdečních oddílech společně se zvýšením pravostranných srdečních tlaků a plicní hypertenzí u klinicky těžkých stavů [3, 20].
Kontroverzní je užití bronchoskopie s bronchoalveolární laváží (BAL), kde barvení na tuk prokazuje volné lipidové substance i depozita v makrofázích [3, 21].
LÉČEBNÁ A PREVENTIVNÍ OPATŘENÍ
Léčba
Terapie syndromu tukové embolie je v zásadě podpůrná s důrazem na časné zajištění orgánové perfuze a vitálních funkcí [1–3]. Primárně tedy podáváme oxygenoterapii [3, 4] brýlemi či maskou a dále podle tíže respirační tísně má své místo časně zahájená neinvazivní plicní ventilace až případně intubace s řízenou umělou plicní ventilací při rozvoji ALI/ARDS.
Současně je k perfuzi tkání nutné zajistit dostatečný tekutinový volum [3, 4] a důsledně kontrolovat vnitřní prostředí, tím předcházet orgánovým komplikacím z hypoperfuze a rozvoji šoku se všemi důsledky [3, 4, 22, 23]. Další farmakologické intervence zahrnující např. podání heparinu, alkoholu či dextranu nebyly zcela efektivní a názory na jejich podání jsou kontroverzní [3, 4, 23–27]. Heparin podáváme podle běžných zásad v prevenci tromboembolismu a spolu s antiagregační léčbou v komplexním zajištění a ke zlepšení kapilární perfuze při rozvoji intravaskulárních okluzí až DIC [3, 5]. Na kortikoidy (methylprednisolon) v léčbě jsou různé názory, mnohé práce však podporují jejich místo v medikaci [4, 23–27] pro stabilizaci buněčných membrán, nesporný antiedematózní efekt na CNS a příznivý vliv na tkáňovou perfuzi.
Opodstatněné se zdá být i využití hyperbarické terapie v časné fázi, resp. pokud to stav pacienta a technická dostupnost metody dovolí. Nejen experimentální, ale i klinické práce prokazují příznivý vliv na CNS [28–34] – mechanismy účinku nejsou ještě zcela objasněny, ale hyperbarický kyslík mj. redukuje ischemií navozenou buněčnou adhezi a migraci neutrofilů a zmírňuje edém tkáně, zlepšuje reparaci neuronů [28–34]. Indikace odvisí spíše od neurologického nálezu a zdá se, že efekt aplikované baroterapie nastupuje časně a přetrvává desítky hodin [31].
Samozřejmostí je aktivní přístup k zajištění komplexní podpůrné péče do doby plného obnovení vědomí vč. rehabilitace, bazální stimulace, nutriční podpory apod.
Prevence
Prevence syndromu tukové embolie spočívá v pečlivé kontrole tkáňové perfuze a oxygenace spolu s časnou a šetrnou stabilizací zlomenin [1–4, 35–37].
Pro zachování optimálního prokrvení tkání a v prevenci šoku je významné také časné a razantní zajištění intravaskulárního volumu infuzní terapií [1–4, 35]. Je vhodná kontinuální monitorace periferním pulzním oxymetrem [38].
Různé názory jsou na preventivní podání kortikoidů – jednorázové podání rizikovým nemocným se podle některých autorů zdá být užitečné [4, 14].
PROGNÓZA
Vysoká četnost poranění dlouhých kostí v klinické praxi a vysoká incidence vyplavení tukových hmot do systémové cirkulace u těchto nemocných odráží klinickou situaci a prognózu [1–3].
Je mnohdy těžké odhadnout průběh – může být klinicky němý, ale také s rychlým rozvojem orgánového selhání s možností vážných až trvalých komplikací [3, 39–43]. Fulminantní formy s akutním cor pulmonale a respiračním selháním vedou ke smrti během několika málo hodin od úrazu [3].
Starší a interně nemocní traumatizovaní jedinci mají menší fyziologické rezervy a tím i horší prognózu [44]. Mortalita v přímé souvislosti s embolizací tukových hmot je udávána asi 5–15 % [3].
KAZUISTIKA – POPIS PŘÍPADU A PŘEHLED LÉČEBNÝCH OPATŘENÍ
Dosud zdravý muž, 24 let, s negativní anamnézou (hmotnost 80 kg, výška 184 cm). Po nehodě na motocyklu v malé rychlosti byl na místě od počátku při vědomí (GCS 15), kardiopulmonálně stabilní (TK 120/70 mm Hg, pulz pravidelný 90/min).
PŘI PŘIJETÍ vyšetřen, kde na hlavě a páteři bez traumatických změn, neprokázána dutinová poranění, zjištěna byla pouze zlomenina diafýzy femuru vpravo – ta byla primárně ošetřena extenzí a dále byla provedena definitivní osteosyntéza dlahou (MIPO LCP 4,5/5,0) asi ZA 6 HODIN od přijetí (Obr. 1). Poranění bylo tč. vedeno jako monotrauma (zjištěná zlomenina femuru) přímým úrazovým mechanizmem v malé rychlosti.
Obr. 1. Zlomenina diafýzy femuru vpravo, osteosyntéza dlahou 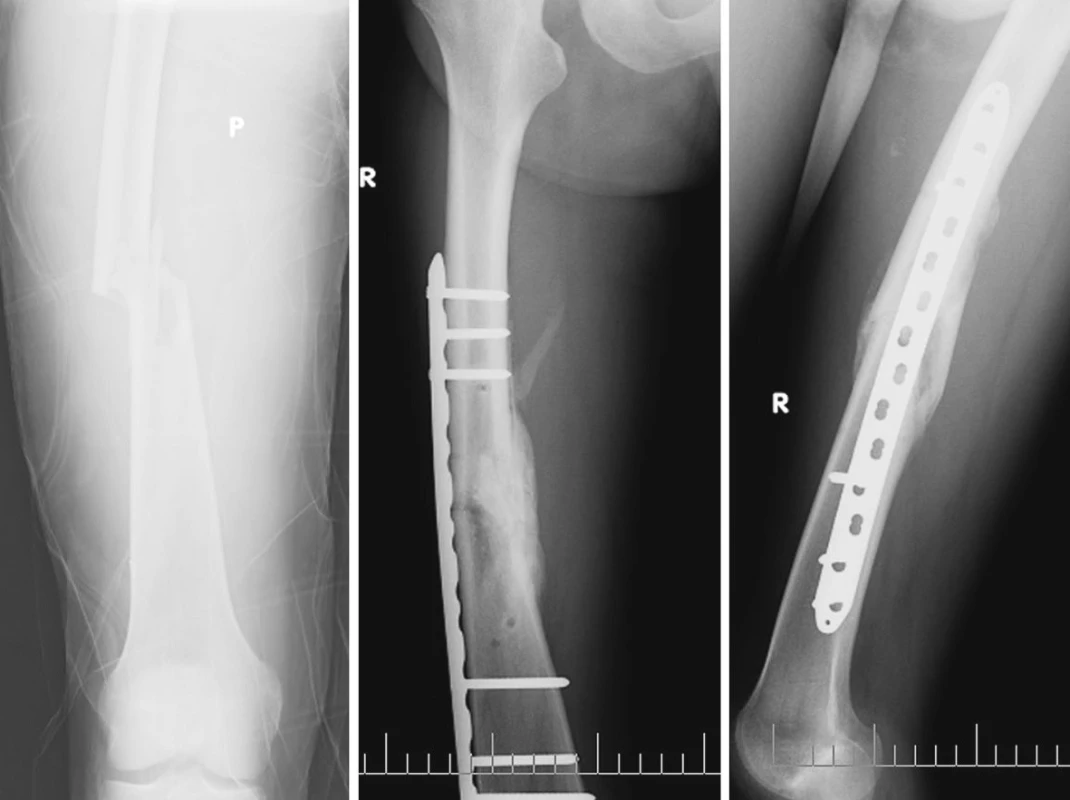
V pooperačním nočním monitorování pulzním oxymetrem SpO2 asi 90%, proto byl ponechán na JIP a monitorován – do rána podáno infuzí cca 2 500 ml krystaloidů, oběhově stabilní se zachovanou diurézou. Pacient od přijetí do ústavní péče při plném vědomí a bez neurologického deficitu. Zajištěn byl již v úvodu standardně také antibiotiky a nízkomolekulárním heparinem v preventivní dávce (enoxaparin 1x 0,4 ml).
Ráno, cca ZA 14 HODIN od přijetí, zjištěna porucha vědomí od somnolence až postupně nemožnost navázat slovní kontakt s bezvědomím; proměnlivý neurologický nález (přechodně zaznamenána anizokorie – tč. zornice vlevo širší, oboustranně bez fotoreakce). Na provedeném CT mozku a páteře negativní nález (magnetická rezonance nemohla být provedena pro přítomnost kovového materiálu v těle, stav po osteosyntéze). Na monitoru a na EKG byla srdeční akce bez poruchy rytmu, sinusová tachykardie 130/min. Nemocný tč. bez poklesu systémového krevního tlaku a se zachovanou spontánní dechovou aktivitou (pulzním oxymetrem SpO2 92%). Tělesná teplota měřená v axile 37,6 °C. Laboratorně s ohledem na povahu úrazu a v časném pooperačním období tč. bez významných pozoruhodností v krevním obrazu (hemoglobin 104 g/l, trombocyty 152 x109/l) a bez pozoruhodností v biochemii (bilirubin 10 mmol/l, urea 4,3 mmol/l, kreatinin 70 mmol/l, kreatinkináza 27,3 μkat/l, CRP 53 mg/l, glykemie 6 mmol/l, bez minerálové dysbalance); aktuálně laktát 2,4 mmol/l, bez významné alterace hemostázy (D-dimery 5,61 mg/l, antitrombin 67 %, fibrinogen 4,45 g/l, tromboplastinový test v INR 1,76, aPTT 1,31 index). Aktuálně v centrálních žilních krevních plynech hodnoty pH 7,44, pCO2 4,88 kPa, pO2 6 kPa, O2 saturovaný 82%.
V dalším průběhu rozvoj globální respirační insuficience, proto byl 18 HODIN PO ÚRAZU intubován a napojen na umělou plicní ventilaci (již po definitivní stabilizaci stehenní kosti dlahou). Bezprostředně po intubaci a napojení na řízenou ventilaci nemocný s hypotenzí vyžadující tekutinovou resuscitaci a současně krátkodobou mírnou podporu oběhu katecholaminy. Na jícnovém UZ srdce byl popsán věku přiměřený nález bez tekutiny v perikardu a bez jiných pozoruhodností, normální velikost srdečních oddílů; přechodně na monitoru a na EKG zachycen iRBB. Na kontrolním CT mozku difuzně jen mírný otok. Neurologicky trvá obraz komatu, známky dekortikace.
Postupně V PRŮBĚHU 18–24 HODIN OD PŘIJETÍ rozvoj ARDS s náročnými ventilačními parametry, obraz systémové odpovědi a známky sekundární konsumpční koagulopatie (pokles trombocytů a fibrinogenu, prodloužení koagulačních testů). Nově symetrický generalizovaný výsev petechií – slizničních na spojivkách (Obr. 2) a současně také na kůži s maximem v axilách, na hrudníku a na krku (Obr. 3).
Obr. 2. Syndrom tukové embolie – výsev petechií (oční víčko a spojivka) 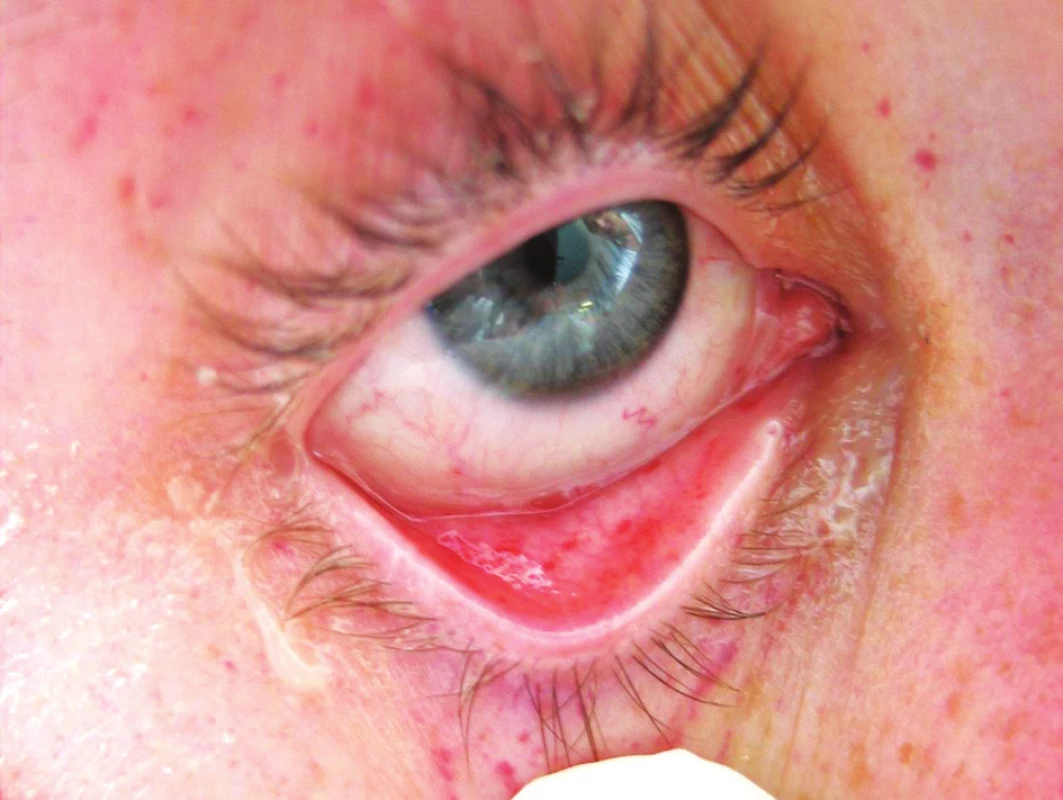
Obr. 3. Syndrom tukové embolie – výsev kožních petechií (kůže hrudníku) 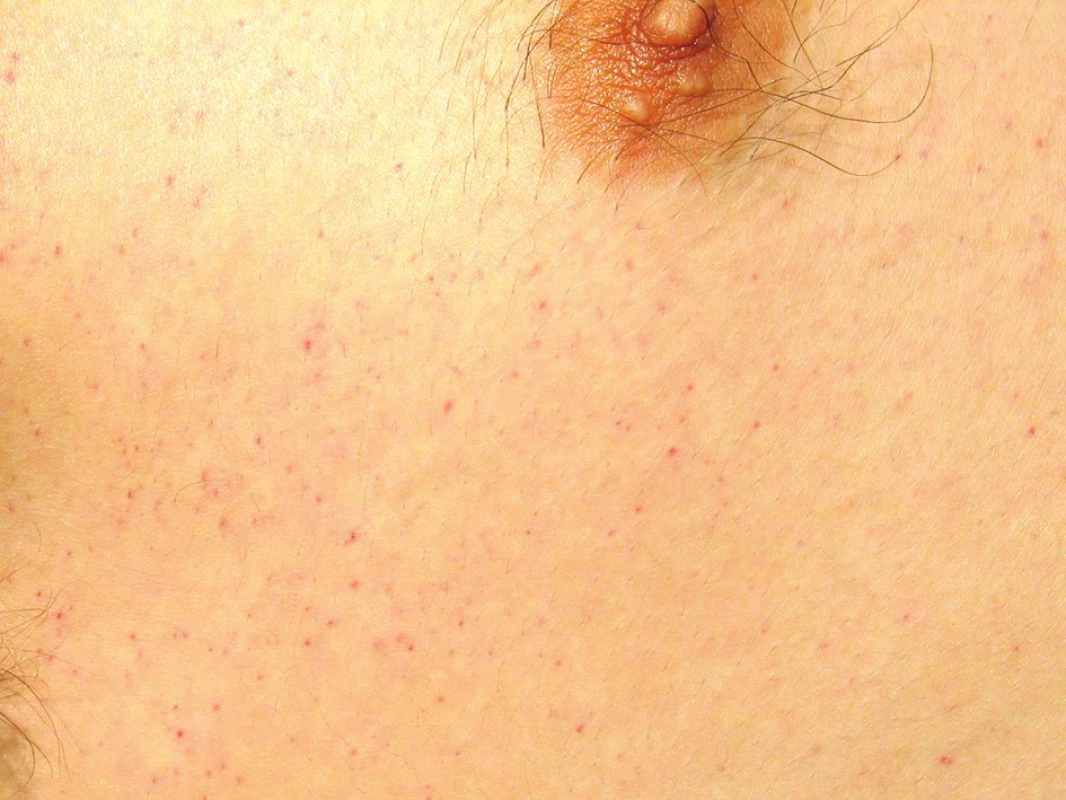
Vysloveno bylo podezření, že celkový obraz a porucha vědomí nastaly v souvislosti s difuzní systémovou embolizací tukových hmot při zlomeninách těla dlouhých kostí pravé dolní končetiny – při celkovém přešetření byla ZA 18 HODIN od přijetí dodatečně zjištěna ještě zlomenina tibie vpravo s dislokací a s ohledem na celkový stav byla aktuálně nasazena zevní fixace (Pin less bérce vpravo).
V rámci syndromu z tukové embolie byl zjištěn také patologický nález na očním pozadí, kde bez známek městnání vpravo popsána Valsalvova retinopatie vzniklá primárně při traumatickém stlačení hrudníku, vlevo však obraz embolizace art. centralis retinae.
Léčebně vedle umělé ventilace také intenzivní tekutinová resuscitace a přechodně podpora oběhu katecholaminy (noradrenalin). S ohledem na hrozící rozvoj konsumpční koagulopatie byla provedena substituce hemostázy čerstvou dárcovskou plazmou a nízkomolekulární heparin byl v dávce navýšen (enoxaparine 2x 0,4 ml), současně antiagregační medikace (kyselina acetylsalicylová 100 mg/den). Dále byla aplikována antiedematózní léčba s ohledem na popsaný difuzní edém mozku na CT (NaCl 3%, diuretika) a k podpoře orgánové perfuze byla současně podávána rheologika (pentoxifyllin) a nootropika (piracetam).
Vzhledem k patologickému nálezu na očním pozadí byly v léčbě také podány kortikoidy ve vysokých dávkách a s dobrým efektem (methylprednisolon 125 mg/den).
Pacient byl komplexně standardně zajištěn vč. nutriční podpory a důsledné korekce vnitřního prostředí. Umělá plicní ventilace 6. DEN přes tracheostomii. Postupně byl při stávající terapii 10. DEN z řízené ventilace převáděn na režim s tlakovou podporou, klinicky však ještě trvá porucha vědomí. Ve stabilizovaném stavu byla 10. DEN od přijetí provedena odložená konverze zevní fixace zlomeniny pravého berce na nitrodřeňovou osteosyntézu (UTN vpravo) (Obr. 4).
Obr. 4. Zlomenina tibie vpravo, nitrodřeňová osteosyntéza 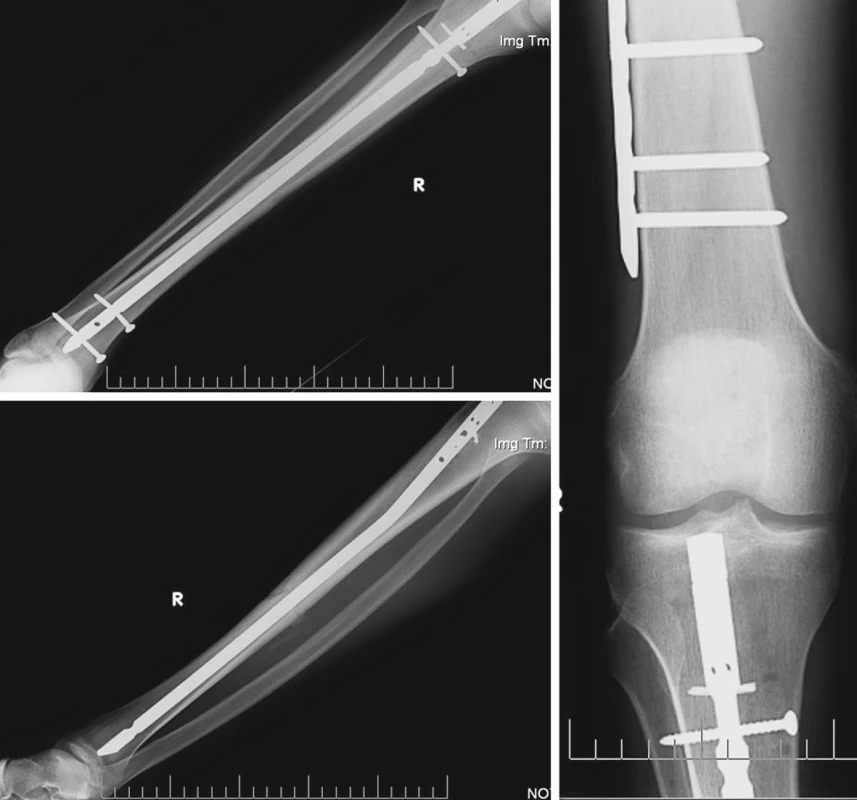
OD 12. DNE na oslovení otevře oči, neurologicky v dalším průběhu však již bez významných známek zlepšení – klinicky trvá GCS 10 se známkami kvadruspasticity. Postupně byly snižovány dávky kortikoidů až k plnému vysazení. Oběhově byl stabilní a 17. DEN byl odpojen od ventilátoru.
Dále 18. DEN byl ve stabilizovaném stavu přeložen na specializované lůžkové pracoviště Městské nemocnice Ostrava za účelem léčby v hyperbarické komoře, a to k ovlivnění funkcí CNS – úhrnem tak bylo bez komplikací aplikováno 19 léčebných kúr za současné intenzivní bazální stimulace a rehabilitace s dobrým klinickým efektem. Poté byl přeložen zpět na naše pracoviště, kde pokračováno střídavě v ambulantní a ústavní rehabilitační péči společně s bazální stimulací.
V červenci 2009, tzn. 12 MĚSÍCŮ PO ÚRAZU, je pacient soběstačný v základních úkonech, je bez poruchy zraku vč. úpravy anizokorie, řeč je formálně i obsahově správná a nemá potíže v kontaktu s okolím, z jemné motoriky ovládá bez obtíží mobilní telefon. Je schopen chůze bez opory se semiflexí obou horních končetin, napadá na pravou dolní končetinu. Stav je neurologem aktuálně hodnocen jako axonální postižení s tč. trvající kvadruspasticitou.
Pacient nyní pokračuje v ambulantním rehabilitačním programu s dalším příznivým vývojem klinického stavu.
DISKUSE
Proč předkládáme tuto kazuistiku?
- Velmi pravděpodobně se nezřídka setkáváme s různě klinicky vyjádřenými variacemi této nozologické jednotky, a to nejen u traumatizovaných nemocných, měli bychom na ni proto myslet [1–9]. Zvláště internista bývá volán ke stavům dechové tísně nebo poruchy vědomí, k nejasné tachykardii apod. Proto i zdánlivě nevýznamné skutečnosti je nutné vidět v souvislostech neboť jen časné rozpoznání závažnosti stavu vede ke správnému a rychlému zajištění nemocného.
- Občas jde o zpochybňovanou diagnózu, která však bezpochyby má své místo v naší praxi. To nakonec dokládá i tento ilustračně bohatý a jednoznačný případ se závažným postižením.
- Zdůrazňujeme možnost úpravy vážného postižení i s delším časovým odstupem při trpělivé intenzivní a komplexní péči.
- Ponaučení z tohoto případu spočívá také v uvědomění si skutečnosti, že je nutné důsledně aplikovat časná preventivní opatření u rizikových nemocných vč. rozpoznání a stabilizace všech poranění a razantního zajištění dostatečného přísunu tekutin. Riziko rozvoje syndromu tukové embolie přitom určuje samotná skutečnost traumatu – toto nebezpečí je reálné a úměrné míře poranění, kdy ani zprvu stabilní vstupní klinický nález nevylučuje další klinicky manifestní až fulminantní průběh s těžkým postižením.
Pravděpodobně jsme zde při stávajících poraněních nemohli zcela zabránit systémové tukové embolizaci, ale vážný klinický průběh v tomto případu mohl být umocněn zprvu nepoznaným poraněním dalších dlouhých kostí (zlomenina bérce s opožděnou stabilizací) a zprvu také váhavým přístupem k infuzní terapii v situaci tč. mylně považované za „monotrauma“ stehenní kosti.
ZÁVĚR
Vzhledem k bohatosti klinické symptomatologie a závažnému postižení s dobrou klinickou úpravou považujeme tuto dokumentovanou kazuistiku za poučnou pro širokou odbornou veřejnost. Syndrom tukové embolie jako diagnózu uznáváme a zdůrazňujeme reverzibilitu i závažného postižení při komplexní terapii.
Práce byla podpořena výzkumným záměrem MZO 00179906.
MUDr. Martin Blažek, Ph.D.
Chirurgická klinika – JIP
FNHradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: blazek@fnhk.cz
Zdroje
1. Talbot, M., Schemitsch, E. H. Fat embolism syndrome: history, definition, epidemiology. Injury, 2006, Oct; 37 Suppl 4: S3–7.
2. Müller, C., Rahn, B. A., Pfister, U., Meinig, R. P. The incidence, pathogenesis, diagnosis, and treatment of fat embolism. Orthop. Rev., 1994 Feb; 23(2): 107–117.
3. Shaikh, N. Emergency management of fat embolism syndrome. J. Emerg. Trauma Shock., 2009 Jan; 2(1): 29–33.
4. Lindeque, B. G., Schoeman, H. S., Dommisse, G. F., Boeyens, M. C., Vlok, A. L. Fat embolism and the fat embolism syndrome. A double-blind therapeutic study. J. Bone Joint Surg. Br., 1987 Jan; 69(1): 128–131.
5. Hulman, G. Pathogenesis of non-traumatic fat embolism. Lancet, 1988 Jun 18; 1(8599): 1366–1367. Review.
6. Guardia, S. N., Bilbao, J. M., Murray, D., Warren, R. E., Sweet, J. Fat embolism in acute pancreatitis. Arch. Pathol. Lab. Med., 1989 May; 113(5): 503–506.
7. Shapiro, M. P., Hayes, J. A. Fat embolism in sickle cell disease: Report of a case with brief review of literature. Arch. Intern. Med., 1984; 14 : 181–182.
8. Orvar, K., Johlin, F. C. Atheromatous embolization resulting in acute pancreatitis after cardiac catheterization and angiographic studies. Arch. Intern. Med., 1994 Aug 8; 154(15): 1755–1761.
9. Fernández Suárez, F. E., García Arango, M. B., Quintela Baizán, A. F., Hernández Bujedo, M., Fernández Miranda, A., Ordiz Gómez, T. Multiple cholesterol athero-embolisms after resection of an abdominal aortic aneurysm. Rev. Esp. Anestesiol. Reanim., 2000 Dec; 47(10): 485–488.
10. Glossing, H. R., Pellegrini, V. D. Jr. Fat embolism syndrome: A review of pathology and physiological basis of treatment. Clin. Orthop. Relat. Res., 1982; 165 : 68–82.
11. Baker, P. L., Paxel, J. A., Pettier, L. F. Free fatty acids, catecholamine and arterial hypoxia in patients with fat embolism. J. Trauma, 1971; 11 : 1026–1030.
12. Gurd, A. R. Fat embolism: an aid to diagnosis. J. Bone Joint Surg. Br., 1970, 52-B: 732–737.
13. Gurd, A. R., Wilson, R. I. The fat embolism syndrome. J. Bone Joint Surg Br., 1974; 56 : 408–416.
14. Schonfeld, S. A., Ploysongsang, Y., DiLisio, R., Crissman, J. D., Miller, E., Hammerschmidt, D. E., et al. Fat embolism prophylaxis with corticosteroid: A prospective study in high-risk patients. Ann. Int. Med., 1983; 99 : 438–443.
15. Lindeque, B. G., Schoeman, H. S., Dommissen, G. F., Boeyens, M. C., Vlok, A. L. Fat embolism syndrome: A double blind therapeutic study. J. Bone Joint Surg. Br., 1987; 69 : 128–131.
16. Alho, A. Fat embolism syndrome, Etiology pathogenesis and treatment. Acta Chir. Scand., 1980; 499 : 75–85.
17. van den Brande, F. G., Hellemans, S., De Schepper, A., De Paep, R., Op De Beeck, B., De Raeve, H. R., et al. Post-traumatic severe fat embolism syndrome,with uncommon CT fi ndings. Anaesth. Intensive Care, 2006; 34 : 102–106.
18. Stoeger, A., Daniaux, M., Feiber, S., Stockhammer, G., Aichner, F., zur Nedden, D. MRI finding in cerebral fat embolism. Eur. Radiol., 1998; 8 : 1590–1593.
19. Suzuki, S., Hayashi, T., Ri, K., Hashimoto, T., Matsui, S., Kitanosono, T., Munechika, H., Hishida, T., Ohbuchi, M., Takizawa, K., Kuniyasu, Y., Osakabe, Y. Brain CT and MRI findings in fat embolism syndrome. Nippon Igaku Hoshasen Gakkai Zasshi, 1996 May; 56(6): 390–398.
20. Wenda, K., Runkel, M., Degrief, J., Ritter, G. Pathogenesis and clinical relevance in medullary nailing demonstrated by intra-operative echocardiography. Injury, 1993; 24: S73–81.
21. Vedrinne, J. M., Guillaume, C., Gagnieu, M. C., Gratadour, P., Fleuret, C., Motin, J. Bronchoalveolar lavage in trauma patients for diagnosis of fat embolism syndrome. Chest, 1992; 102 : 1323–1327.
22. Jawed, M., Naseem, M. An update on fat embolism syndrome. Pak. J. Med. Sci., 2005; 21 : 2–6.
23. Enneking, F. K. Cardiac arrest during total knee replacement. J. Clin. Anaesth., 1995; 7 : 253–263.
24. Shier, M. R., Wilson, R. F., James, R. E., Riddle, J., Mammen, E. F., Pedersen, H. E. Fat embolism prophylaxis: a study of four treatment modalities. J. Trauma, 1977; 17 : 621–629.
25. Stoltenberg, J. J., Gustilo, R. B. The use of methylprednisolone and hypertonic glucose in the prophylaxis of fat embolism syndrome. Clin. Orthop., 1979; 143 : 211–22l.
26. Swartz, S. L., Dluhy, R. G. Corticosteroids: clinical pharmacology and therapeutic use. Drugs, 1978; 16; 238–255.
27. Szabó, G., Serinyi, P., Kocsir, L. Fat embolism: fat absorption from the site of injury. Surgery, 1963; 54 : 756–760.
28. Hu, S. L., Hu, R., Li, F., Liu, Z., Xia, Y. Z., Cui, G. Y., Feng, H. Hyperbaric oxygen preconditioning protects against traumatic brain injury at high altitude. Acta Neurochir. Suppl., 2008; 105 : 191–196.
29. Qin, Z., Hua, Y., Liu, W., Silbergleit, R., He, Y., Keep, R. F., Hoff, J. T., Xi, G. Hyperbaric oxygen preconditioning activates ribosomal protein S6 kinases and reduces brain swelling after intracerebral hemorrhage. Acta Neurochir. Suppl., 2008; 102 : 317–320.
30. Khiabani, K. T., Bellister, S. A., Skaggs, S. S., Stephenson, L. L., Nataraj, C., Wang, W. Z., Zamboni, W. A. Reperfusion-induced neutrophil CD18 polarization: effect of hyperbaric oxygen. J. Surg. Res., 2008 Nov; 150(1): 11–16.
31. Voigt, C., Förschler, A., Jaeger, M., Meixensberger, J., Küppers-Tiedt, L., Schuhmann, M. U. Protective effect of hyperbaric oxygen therapy on experimental brain contusions. Acta Neurochir. Suppl., 2008; 102 : 441–445.
32. Henninger, N., Küppers-Tiedt, L., Sicard, K. M., Günther, A., Schneider, D., Schwab, S. Neuroprotective effect of hyperbaric oxygen therapy monitored by MR-imaging after embolic stroke in rats. Exp Neurol., 2006 Oct; 201(2): 316–323.
33. Higgins, A. C., Pearlstein, R. D., Mullen, J. B., Nashold, B. S. Jr. Effects of hyperbaric oxygen therapy on long-tract neuronal conduction in the acute phase of spinal cord injury. J. Neurosurg., 1981 Oct; 55(4): 501–510.
34. Asamoto, S., Sugiyama, H., Doi, H., Iida, M., Nagao, T., Matsumoto, K. Hyperbaric oxygen (HBO) therapy for acute traumatic cervical spinal cord injury. Spinal Cord, 2000 Sep; 38(9): 538–540.
35. White, T., Petrisor, B. A., Bhandari, M. Prevention of fat embolism syndrome. Injury, 2006 Oct; 37 Suppl 4: S59–67.
36. Behrman, S. W., Fabian, T. C., Kudsk, K. A., Taylor, J. C. Improved outcome with femur fracture: Early VS delayed fixation. J. Trauma, 1990; 30 : 792–797.
37. Wheelwright, E. F., Byrick, R. J., Wigglesworth, D. F., Kay, J. C., Wong, P. Y., Mullen, J. B., et al. Hypotension during cemented arthoplasty, relationship with cardiac output and fat embolism. J. Bone Joint Surg. Br., 1993; 75 : 715–723.
38. Wong, M. V., Taji, H. F., Young, S. H., Chan, K. M., Cheng, J. C. Continuous pulse oximeter, for in apparent hypoxemia after long bone fractures. J. Trauma, 2004; 56 : 356–362.
39. Wenda, K., Runkel, M. Systemic complications in intramedullary nailing. Orthopade, 1996 Jun; 25(3): 292–299.
40. Kallina IV, C., Probe, R. Paradoxical fat embolism after intramedullary rodding: a case report. J. Orthop. Trauma, 2001 Aug; 15(6): 442–445.
41. Riska, E. B., Myllynen, P. Fat embolism in patients with multiple injuries. J. Trauma, 1982 Nov; 22(11): 891–894.
42. Kim, K. C., Hwang, D. S., Shin, H. D. Post-traumatic cerebral fat embolism prior to operative repair of femoral and tibial fractures. Orthopedics, 2008 Feb; 31(2): 170.
43. Bouaggad, A., Harti, A., Barrou, H., Zryouil, B., Benaguida, M. Tetraplegia in fat embolism Ann. Fr. Anesth. Reanim., 1994; 13(5): 730–733.
44. Nikolič, S., Micič, J., Savič, S., Gajič, M. Factors which could affect the severity of post-traumatic pulmonary fat embolism: A prospective histological study. Srp. Arch. Celok Lek., 2003; 131 : 244–248.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 11- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Endovaskulární léčba spontánního hemotoraxu u neurofibromatózy I. typu
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
- Endoskopický odběr v. saphena magna – výskyt ranných komplikací
- Recenze
- Gastrointestinální stromální tumor – analýza vlastní sestavy pacientů, přehled literatury
- Artroplastika krční ploténky (Prodisc-C): analýza výsledků po 3–4 letech sledování
- Prodloužená profylaxe tromboembolické nemoci u pacientů po chirurgické resekci kolorekta pro malignitu
- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Peritonitidy způsobené perforací trávicí trubice – analýza gerontologické skupiny pacientů
- Transplantace tenkého střeva v experimentu
- Hybridní NOTES cholecystektomie transgastrickým a transrektálním přístupem v experimentu
- Laparoskopická chirurgie karcinomu rekta – dlouhodobé výsledky
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Karcinom prsu u nemocné po transplantaci ledviny – kazuistika
- Životní jubileum prim. MUDr. Jana Kubačáka
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Syndrom tukové embolie – přehled problematiky a kazuistika: závažný průběh po traumatu dlouhých kostí
- Traumatická poranění mozku – vliv alkoholu a kofeinu na intrakraniální tlak a průtok krve mozkem
- Životní jubileum prim. MUDr. Jana Kubačáka
- Pacient s entrapment syndrómom a. poplitea a infekčnou endokarditídou (kazuistika)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



