-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Invazivní zygomykóza tlustého střeva u pacienta s diabetem
Invasive Zygomycosis of the Large Intestine in a Diabetes Patient
Invasive mucormycosis is a rare, serious or even fatal condition. The authors diagnosed and successfully treated the disorder in a 62-year-old diabetes patient. The course of the disease, including justification of the surgical procedure are described in the case review. All treatment options were implemented and, after 121 days of hospitalization, the patient was released for homecare.
Key words:
zygomycosis – mucormycosis – diabetes – colektomy – amphotericin B – complications
Autoři: J. Bureš 1; D. Codl 2; D. Kodetová 3; Z. Jech 4; P. Hubáček 5
Působiště autorů: Klinika anesteziologie a resuscitace UK 2. LF a FN Motol MUDr. M. Pelichovská / Prof. MUDr. K. Cvachovec, CSc. 1; Ústav lékařské mikrobiologie UK 2. LF a FN Motol, MUDr. O. Nyč 2; Ústav patologie a molekulární medicíny UK 2. LF a FN Motol, prof. MUDr. R. Kodet, CSc. 3; Chirurgická klinika UK 2. LF a FN Motol, prof. MUDr. J. Hoch, CSc. 4; Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, prof. MUDr. J. Starý, DrSc. 5
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 8, s. 405-408.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Invazivní mukormykóza je vzácné, závažné až smrtelné onemocnění. Diagnostikovali jsme ho a vyléčili u 62letého diabetika. Podrobnosti průběhu onemocnění včetně důvodů operace jsou předmětem kazuistiky. Díky využití všech léčebných možností pacient s prokázanou infekcí přežil a byl propuštěn do domácího ošetřování po 121 dnech hospitalizace.
Klíčová slova:
zygomykóza – mukormykóza – diabetes – kolektomie – amphotericin B – komplikaceÚVOD
Invazivní mykotická onemocnění závažně ohrožují imunosuprimované pacienty. Mezi nejohroženější patří pacienti po transplantacích, zejména hematopoetických kmenových buněk (Hematopoetic Stem Cell Transplant, HSCT), a pacienti s maligním onemocněním.
Hlavními původci onemocnění jsou kvasinky rodu Candida spp., vláknité houby Aspergillus spp. [1–3], rod Fusarium [3, 4] a třída Zygomycetes [5].
Mykotické spory jsou běžnou součástí životního prostředí a jejich vdechnutí či spolknutí může u vnímavého jedince vést k rozvoji infekce s projevy poškození jednotlivých orgánů (neurologické, plicní, kožní), s možným rozvojem sepse a MODS [6–8].
S mukormykotickou infekcí jsme se setkali a dokázali jí s využitím více léčebných metod včetně operace zvládnout. Protože se jedná o vzácnou infekci, upozorňujeme na ní následující kazuistikou.
KAZUISTIKA
Pacient (62 let) byl přijat pro 5 dní progredující dušnost. Byla vyloučena primárně kardiální či metabolická příčina a pomocí angio-CT i plicní embolizace. Pro respirační insuficienci byl pacient hospitalizován na lůžkovém oddělení anesteziologicko-resuscitační kliniky. V té době vykazoval známky těžké sepse (pulz 110/min, TK 110/75, TT 38 °C, leukocyty: 19,8 x 109/l, CRP 342 mmol/1, laktát: 4,7 mmol/1, glykemie: 27 mmol/1). Při CT vyšetření plic byl prokázán mnohočetný drobnoložiskový proces, zejména v dorzálních lalocích (Obr. 1), kultivačně byl prokázán H. influenzae a St. aureus. Klinický stav se po cílené ATB terapii nelepšil, progredovalo plicní postižení obrazu ARDS, proto byla ATB terapie změněna a znovu bylo pátráno po zdroji sepse. Nálezy (hemokultury, US, transezofageální echo, CT) však byly negativní, došlo k regresi ložiskového postižení a kondenzaci bazálních partií plic (Obr. 2). Klinický stav se nadále horšil, zvyšovaly se hodnoty ukazatelů systémového zánětu a byla nutná vysoká podpora krevního oběhu (Graf 1), přetrvávalo ARDS a rozvíjel se subileózní stav. Mikrobiologický nález ze sputa i z hemokultur byl opakovaně negativní, proto byl zvažován extrapulmonální zdroj sepse.
Obr. 1. CT scan bazální oblasti plic s drobnoložiskovým procesem, 1. den Fig. 1. CT scan of the pulmonary base with multiple small opacities detected, Day 1 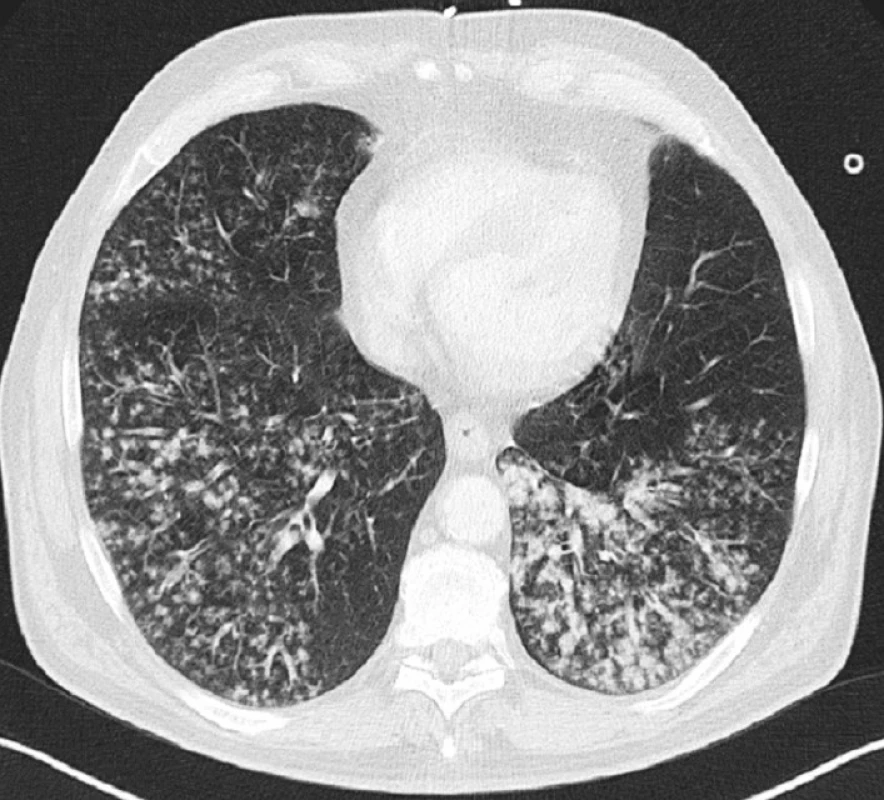
Obr. 2. CT scan, patrná postupná konsolidace bazálních oblastí plic a ústup drobnoložiskového nálezu, 8. den Fig. 2. CT scan, gradual consolidation of the basal pulmonary regions and recovery of the small opacities findings – Day 8 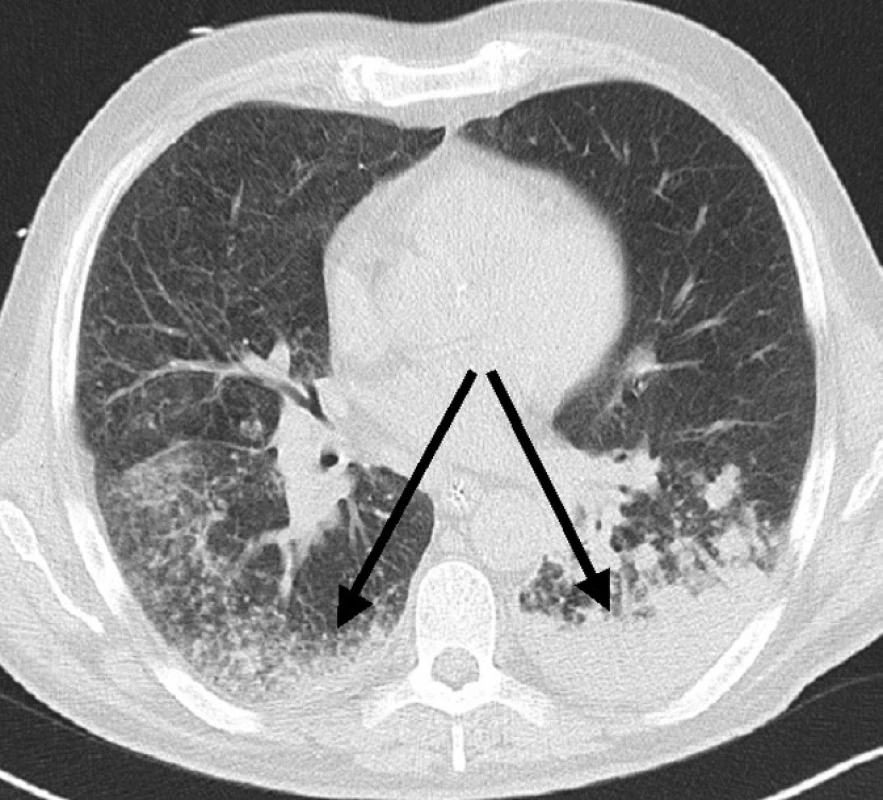
Graf 1. Vývoj zánětlivých parametrů (CRP. leukocyty) v průběhu onemocnění Graph 1. Development of inflammatory parameters (CRP. leukocyty) during the course of the disease 
CT vyšetřením hrudníku a břicha provedeném 11. den byla nalezena pokračující konsolidace plicního parenchymu v bazálních oblastech a prosáknutí stěny tlustého střeva (Obr. 3).
Obr. 3. CT scan břicha, patrno prosáknutí tkání v okolí tračníku Fig. 3. CT scan of the abdomen, infiltration of the colon-surrounding tissues is detectable 
Koloskopicky byly v sestupném tračníku odhaleny cirkulární infiltráty, z nichž byla odebrána biopsie.
Histologický nález byl jednoznačný, ukázal široké septované hyfy plísní odpovídající zygomykóze (mukormykóze) (Obr. 5). Byla nasazena cílená léčba amphotericinem B (preparát Abelcet) v dávce 5 mg/kg/den a vzorky krve, sputa a stolice byly cíleně vyšetřovány na přítomnost možného původce mukormykózy.
Obr. 4. Histologický nález biopsie, šipky označují myotické hyfy Fig. 4. Biopsy histological findings, the arrow marks the myotic hyphae 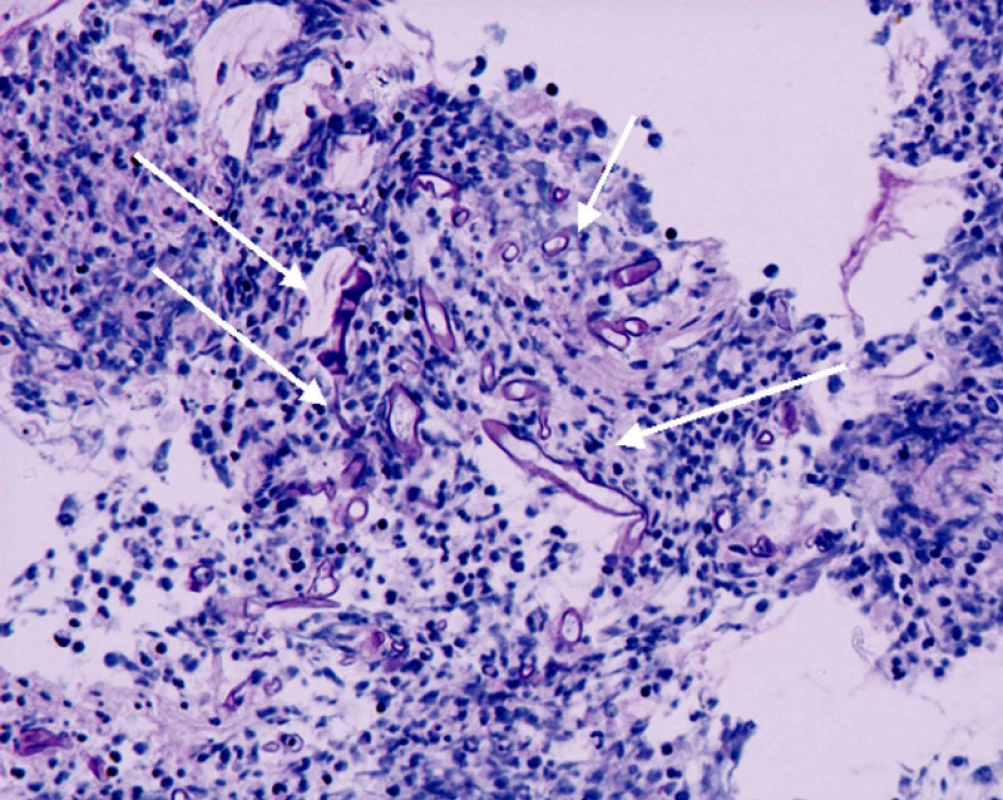
15. den byla pomocí PCR detekována DNA zygomycet rodu Rhizopus v krvi. Tento nález svědčil o diseminaci onemocnění a systémové zygomykóze.
Od 17. dne se postupně obnovila peristaltika, nadále však trval septický stav, rozvinulo se akutní selhání ledvin.
Důvodem k operaci bylo masivní krvácení do střeva. S předpokladem, že zdrojem krvácení je mykotické ložisko, byla z vitální indikace provedena subtotální kolektomie a založena terminální stomie (resekát s ložiskem na obrázku 5). V dalších dnech došlo k regresi septického stavu, zlepšení plicních funkcí a obnově funkce trávicího ústrojí. Bylo zahájeno odvykání pacienta od ventilátoru, které bylo komplikováno opakovanými bronchopneumoniemi při mikroaspiracích kolem tracheostomické kanyly. Terapie amphotericinem B pokračovala kvůli imunokompromitaci pacienta opakovanými infekty zároveň s ATB terapií až do 70. dne hospitalizace.
Obr. 5. Myotické ložisko v resekátu střeva Fig. 5. Myotic focus in the colon resecate 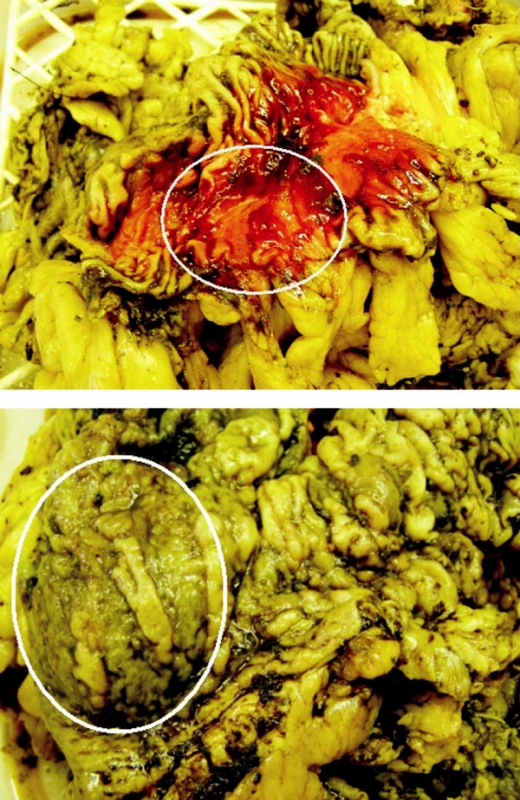
Po téměř 3 měsících na ARK byl pacient v dobrém zdravotním stavu přeložen k další péči na chirurgickou kliniku, odkud byl 121. den hospitalizace propuštěn do domácího ošetřování.
DISKUSE
Mezi obzvláště nebezpečné, invazivní a destruující mykózy patří infekce vláknitými houbami třídy Zygomycetes, zejména rody Rhizopus, Mucor a Rhizomucor. Jde o vzácná onemocnění s incidencí přibližně 1,7/1 milion obyvatel. V poslední dekádě stoupá výskyt zygomykózy u i u pacientů s diabetem 2. typu a u pacientů v malnutrici [5, 14, 32]. Důvodem je deficit funkčních neutrofilů a dysfunkce fagocytů při poruše vnitřního prostředí (hyperglykemie, acidóza) [5, 14, 15].
Klinicky se zygomykózy dělí na formy rinocerebrální, plicní, kožní, gastrointestinální, diseminované a další podle lokalizace [22–26]. Vysoká angioinvazivita zygomycet [14, 15] je příčinou zvýšeného krvácení a rychlé diseminace zygomykózy, proto podezření na toto onemocnění opravňuje užít i invazivní diagnostické metody.
Diagnostika se provádí kultivací s určením druhu a stanovením citlivosti na jednotlivá antimykotika a detekcí antigenu či mykotické DNA (ELISA, PCR). Vyšetření je nutné provádět opakovaně a diagnóza se stanovuje na základě souhlasu klinického obrazu a laboratorních vyšetření.
V terapii a prevenci invazivních mykóz se používají azolová (např. flukonazol, itrakonazol, vorikonazol …), polyenová a další antimykotika (amphotericin B, echinokandiny, 5-flucytosin) [14–21]. V případě zygomykózy spočívá terapie v bezodkladné farmakologické a chirurgické léčbě včetně léčby primárního onemocnění. Lékem volby jsou lipidové formule amphotericinu B [14, 15]. Vorikonazol ani echonokandiny nejsou při léčbě zygomykózy účinné. Novou možností je použití preparátu posakonazol [14].
U našeho nemocného byl jediným známým rizikovým faktorem diabetes 2. typu, jehož dekompenzace při bakteriální infekci, tkáňová hypoxie, acidóza a sepse se zřejmě podílely na rozvoji a diseminaci zygomykotické infekce. Plicní postižení zygomykózou by bylo možné verifikovat jen transtracheální biopsií, ta však nebyla vzhledem k tíži plicního postižení provedena.
Zdrženlivost v časování radikálního chirurgického výkonu vyplynula z velmi špatného stavu pacienta, který nebyl schopen operaci podstoupit. Když se rozvinulo masivní krvácení do střeva, stala se subtotální kolektomie život zachraňujícím výkonem. Až odstranění mykotického ložiska vedlo k ústupu sepse a stabilizaci stavu pacienta, což potvrzují závěry jiných prací [5, 14, 15], že samostatná antimykotická terapie není dostatečná a je nezbytný radikální chirurgický přístup k sanaci ložiska. Také u našeho nemocného kombinovaný přístup k onemocnění vedl ke stabilizaci stavu a vyléčení.
ZÁVĚR
Prezentovaný případ ukazuje nutnost myslet na vzácné mykotické infekce u imunokompromitovaných pacientů, kteří nereagují na standardní terapii. V případě agresivních patogenů jako jsou zygomycety, může mít opomenutí této možnosti fatální následky.
Pro úspěšnou diagnostiku a léčbu zygomykotických onemocnění je rozhodující včasná diagnóza včetně invazivních vyšetření a kombinace farmakologické a chirurgické terapie, která musí být dostatečně radikální. Nezbytná je úzká spolupráce mikrobiologů, chirurgů, patologů a intenzivistů.
MUDr. J. Bureš
U Nové dálnice 691/2
149 00 Praha
e-mail: buresjan@email.cz
Zdroje
1. Wisplinghoff, H., Bischoff, T., Tallent, S. M., Seifert, H., Wenzel, R. P., Edmond, M. B. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin. Infect. Dis., 2004, Aug, l; 39(3): 309–317.
2. Alangadeh, G. J., Wahiduzzaman, M., Chandrasekar, P. H. Aspergillosis: The most common community-acquired pneumonia with gram-negative Bacilli as copathogens in stem cell transplant recipients with graft-versus-host disease. Clin. Infect Dis., 2002, Sep, 15; 35(6): 659–664.
3. Marr, K. A., Carter, R. A., Crippa, F., Wald, A., Corey, L. Epidemiology and outcome of mould infections in hematopoietic stem cell transplant recipients. Clin. Infect Dis., 2002, Apr, 1; 34(7): 909–917.
4. Selleslag D. A case of fusariosis in an immunocompromised patient successfully treated with liposomal amphotericin B. Acta Biomed. 2006;77 Suppl. 2 : 32–35.
5. Chayakulkeeree, M., Ghannoum, M. A., Perfect, J. R. Zygomycosis: the re-emerging fungal infection. Eur. J. Clin. Microbiol. Infect Dis., 2006, Apr; 25(4): 215–229.
6. Chandrasekar, P. H., Ito, J. I. Amphotericin B lipid complex in the management of invasive aspergillosis in immunocompromised patients. Clin. Infect Dis., 2005, May, 1; 40 Suppl 6: S392–400.
7. Pagano, L., Girmenia, C., Mele, L., Ricci, P., Tosti, M. E., Nosari, A., et al. Infections caused by filamentous fungi in patients with hematologie malignancies. A report of 391 cases by GIMEMA Infection Program. Haematologica, 2001, Aug; 86(8): 862–870.
8. Pagano, L., Ricci, P., Tonso, A., Nosari, A., Cudillo, L., Montillo, M., et al. Mucormycosis in patients with haematological malignancies: a retrospective clinical study of 37 cases. GIMEMA Infection Program (Gruppo Italiano Malattie Ematologiche Maligne dell-ulto). Br. J. Haematol., 1997, Nov; 99(2): 331–336.
9. Khan, Z. U., Ahmad, S., Theyyathel, A. M. Detection of Aspergillus fumigatus-specific DNA, (1-3)-beta-d-glucan and galactomannan in serum and bronchoalveolar lavage specimens of experimentally infected rats. Mycoses, 2008, Mar; 51(2): 129–135.
10. Khan, Z. U., Ahmad, S., Theyyathel, A. M. Diagnostic value of DNA and (1-3)-beta-D-glucan detection in serum and bronchoalveolar lavage of mice experimentally infected with Fusarium oxysporum. J. Med. Microbiol., 2000, 8, Jan; 57 (Pt 1): 36–42.
11. Persat, F., Ranque, S., Derouin, F., Michel-Nguyen, A., Picot, S., Sulahian, A. Contribution of the (l-3)-beta-D-Glucan Assay for the Diagnosis of Invasive Fungal Infections. J. Clin. Microbiol., 2007, Dec 26.
12. Ahmad, S., Khan, Z., Mustafa, A. S., Khan, Z. U. Seminested PCR for diagnosis of candidemia: comparison with culture, antigen detection, and biochemical methods for species identification. J. Clin. Microbiol., 2002, Jul; 40(7): 2483–2489.
13. Mirhendi, H., Diba, K., Kordbacheh, P., Jalalizand, N., Makimura, K. Identification of pathogenic Aspergillus species by a PCR-restriction enzyme method. J. Med. Microbiol., 2007, Nov; 56(Pt 11): 1568–1570.
14. Rogers, T. R. Treatment of zygomycosis: current and new options. J. Antimicrob. Chemother., 2008, Jan; 61 Suppl. 1 : 135–140.
15. Spellberg, B., Edwards, J. Jr., Ibrahim, A. Novel perspectives on mucormycosis: pathophysiology, presentation, and management. Clin. Microbiol. Rev., 2005, Jul; 18(3): 556–569.
16. Walsh, T. J., Hiemenz, J. W., Seibel, N. L., Perfect, J. R., Horwith, G., Lee, L., et al. Amphotericin B lipid complex for invasive fungal infections: analysis of safety and efficacy in 556 cases. Clin. Infect Dis., 1998, Jun; 26(6): 1383–1396.
17. Groll, A. H., Walsh, T. J. Posaconazole: clinical pharmacology and potential for management of fungal infections. Expert Rev. Anti Infect Ther., 2005, Aug; 3(4): 467–487.
18. Groll, A. H., Stergiopoulou, T., Roilides, E., Walsh, T. J. Micafungin: pharmacology, experimental therapeutics and clinical applications. Expert Opin. Investig. Druha, 2005, Apr; 14(4): 489–509.
19. Groll, A. H., Walsh, T. J. Antifungal chemotherapy: advances and perspectives. Swiss Med. Wkly., 2002, Jun, 15; 132(23–24): 303–311.
20. Walsh, T. J., Viviani, M. A., Arathoon, E., Chiou, C., Ghannoum, M., Groll, A. H., et al. New targets and delivery systems for antifungal therapy. Med. Mycol., 2000; 38, Suppl 1 : 335–347.
21. Groll, A. H., Muller, F. M., Piscitelli, S. C., Walsh, T. J. Lipid formulations of amphotericin B: clinical perspectives for the management of invasive fungal infections in children with cancer. Klin. Padiatr., 1998, Jul-Aug; 210(4): 264–273.
22. Nakazato, T., Nagasaki, A., Nakayama, T., Shinhama, A., Taira, N,. Takasu, N. Sinonasal zygomycosis in a patient with myelodysplastic syndrome following non-myeloablative allogeneic peripheral blood stem cell transplantation. Intern. Med., 2007; 46(22): 1881–1882.
23. Ferguson A. D. Rhinocerebral mucormycosis acquired after a short course of prednisone therapy. J. Am. Osteopath. Assoc., 2007, Nov; 107(11): 491–493.
24. Mikesch, J. H., Rudat, A., Zuhlsdorf, M., Berdel, W. E., Mesters, R., Conrad, B., et al. Subcutaneous zygomycosis in neutropenia. J. Clin. Oncol., 2007, Oct; 20; 25(30): 4844–4845.
25. Trifilio, S., Singhal, S., Williams, S., Frankfurt, O., Gordon, L., Evens, A., et al. Breakthrough fungal infections after allogeneic hematopoietic stem cell transplantation in patients on prophylactic voriconazole. Bone Marrow Transplant., 2007, Sep; 40(5): 451–456.
26. Jung, J. H., Choi, H. J., Yoo, J., Kang, S. J., Lee, K. Y. Emphysematous gastritis associated with invasive gastric mucormycosis: a case report. J. Korean Med. Sci., 2007, Oct; 22(5): 923–927.
27. Nosari, A., Oreste, P., Montillo, M., Carrafiello, G., Draisci, M., Muti, G., et al. Mucormycosis in hematologie malignancies: an emerging fungal infection. Haematologica, 2000, Oct; 85(10): 1068–1071.
28. Uckay, I., Chalandon, Y., Sartoretti, P., Rohner, P., Berney, T., Hadaya, K., et al. Invasive zygomycosis in transplant recipients. Clin. Transplant., 2007, Jul-Aug; 21(4): 577–582.
29. Ho, P. L, Yuen, K. Y. Aspergillosis in bone marrow transplant recipients. Crit. Rev. Oncol. Hematol., 2000, Apr; 34(l): 55–69.
30. Underhill, D., Braun, J. Current understanding of fungal microflora in inflammatory bowel disease pathogenesis. Inflamm. Bowel Dis., 2008, Feb 19.
31. Ibrahim A. S., Edwards, J. E. Jr., Fu, Y., Spellberg, B. Deferiprone iron chelation as a novel therapy for experimental mucormycosis. J. Antimicrobial chemotherapy, 2006, Aug, 58 : 1070–1073.
32. Roden, M. M., Zaoutis, T. E., Buchanan, W. L., et al. Epidemiology and outcome of zygomycosis:a review of 929 reported cases. Clin. Infect Dis., 2005, Sep, l; 41(5): 634–653.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Koloproktologie
- Infekce v koloproktologii – slovo úvodem
- Infekce v koloproktologii pohledem mikrobiologa
- Endoluminal Vacuum Therapy for the Treatment of Anastomotic Leakage after Anterior Rectal Resection
- Fournièr’s Gangrene
- Invazivní zygomykóza tlustého střeva u pacienta s diabetem
- Kolitidy vyvolané Clostridium difficile
- Závažné komplikace po prosté apendektomii
- Laparoskopická resekcia karcinómu rekta: zhodnotenie perioperačných výsledkov primárnej resekcie a resekcie po neoadjuvantnej chemorádioterapii
- Rekonstrukce análních svěračů pro fekální inkontinenci a hodnocení funkčních výsledků
- Laparoskopická proktokolektómia s ileo-pouch-análnou anastomózou
- Prof. MUDr. František Řehák, DrSc.
- Ohlédnutí za sympoziem „Endosonografie a virtuální endoskopie“
- Jozef Korček: Diagnostika a terapia análnej inkontinencie
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rekonstrukce análních svěračů pro fekální inkontinenci a hodnocení funkčních výsledků
- Závažné komplikace po prosté apendektomii
- Laparoskopická proktokolektómia s ileo-pouch-análnou anastomózou
- Kolitidy vyvolané Clostridium difficile
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



