-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Výskyt a řešení prolongovaného úniku vzduchu po plicní lobektomii
Incidence and Management of Prolonged Air Leak Following Pulmonary Lobectomy
Introduction:
Prolonged air leak (prolonged air leak – PAL, an air leak for over 7 postoperative days) is a common complication following lung resections. It extends the period of thoracic drainage, duration of hospitalization, increases postoperative morbidity rates and the cost of the treatment.Methodology:
The retrospective study included a group of 256 subjects with lung lobectomies, performed during 2002–2007, where active thoracic drainage was introduced postoperatively. The following parametres were assessed: gender, age, preoperative FEV1/FVC values, intraoperative detection of pleural adhesions, missing interlobar fissures (due to stapler resections), presence of distinct bullae, number of removed mediastinal lymph nodes, lobectomy types (upper vs. lower), use of staplers and insufficient lung inflation of 2cm, detectable on x-ray on the day of the procedure.Results:
PAL was recorded in 26 (10.1%) of the subjects and their thoracic drain was left in place for 8–34 days (the mean of 15.9 days). In 7 subjects, the active thoracic drainage was replaced by a passive one (on the 14.4th postoperative day, on average, the range: postoperative Day 11 to postoperative Day 22). In seven subjects, the drain’s position was changed , and in a single subject, reoperation for PAL was required. In particular, the following subjects are more likely to develop PAL: patients with FEV1/FVC of 80% (p-value = 0.0066; odds ratio = 3.494), where stapler resections of interlobar fissures are required (p-value = 0.0118; odds ratio = 3.070) and males (p-value = 0.0471; odds ratio = 3.200).Conclusion:
In patients, predisposed to develop PAL, saving techniques to optimalize surgical procedures, as well as approaches to optimalize their postoperative care, including early replacement of the active thoracic drainage for the passive method, should be employed.Key words:
prolonged air leak – lung lobectomy
Autoři: J. Šafránek
; J. Vodička; V. Špidlen; J. Klečka; V. Šimánek; K. Houdek
Působiště autorů: Chirurgická klinika FN Plzeň, přednosta: prof. MUDr. V. Třeška, DrSc.
Vyšlo v časopise: Rozhl. Chir., 2008, roč. 87, č. 4, s. 176-179.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Prolongovaný únik vzduchu (prolonged air leak – PAL 7 dní po operaci) je častá komplikace po plicní resekci. Prodlužuje dobu hrudní drenáže, hospitalizace, zvyšuje pooperační morbiditu a ekonomické náklady.Metodika:
Retrospektivně jsme hodnotili soubor 256 provedených plicních lobektomií v období 2002–2007, kdy pooperačně zakládáme aktivní hrudní drenáž. Sledovali jsme pohlaví, věk, předoperační hodnotu FEV1/FVC, operačně přítomnost pleurálních adhezí, zaniklých interlobárních rýh (použití staplerů k resekci) a zřetelných bul, počet odebraných mediastinálních uzlin, typ lobektomie (horní vs. dolní), užití stapleru a nedorozvinutí plíce 2 cm na RTG v den operace.Výsledky:
PAL byl zaznamenán u 26 (10,1 %) pacientů a jim byl hrudní dren ponechán v rozpětí 8–34 dní (průměr 15,9 dne). V 7 případech jsme provedli změnu aktivní hrudní drenáže na pasivní (v průměru 14,4 den po operaci; min. 11, max. 22 den). Sedmkrát jsme měnili pozici hrudní drenáže a jen jednou jsme byli nuceni pro PAL reoperovat. Dispozici k PAL vykazují především pacienti s FEV1/FVC < 80 % (p-value = 0,0066; odds ratio = 3,494), s nutností staplerové resekce interlobární rýhy (p-value = 0,0118; odds ratio = 3,070) a muži (p-value = 0,0471; odds ratio = 3,200).Závěr:
Zejména u pacientů s predispozicí vzniku PAL se snažíme optimalizovat operační postup šetrnou technikou i pooperační léčbu, včetně časného převodu aktivní hrudní drenáže na pasivní.Klíčová slova:
prolongovaný únik vzduchu – plicní lobektomieÚVOD
Vedle respirační insuficience, masivní atelektázy, lobární torze či gangrény, plicního infarktu, pneumonie a bronchopleurální píštěle patří prolongovaný únik vzduchu (PAL) mezi „plicní“ typ komplikací po lobektomiích [1]. Je definován, jako únik vzduchu patrný hrudním drénem déle jak 7 dní po operaci [1, 2]. PAL prodlužuje dobu hrudní drenáže, hospitalizace, zvyšuje pooperační morbiditu a ekonomické náklady léčby. Literárně se udává jeho výskyt po lobektomiích v rozmezí asi 5–15 %, častější je po volumreduktivních plicních resekcích (LVRS) pro emfyzém – zde je výskyt 30–50 % [1, 2, 3, 4, 5, 6]. Dosavadní zkušenosti potvrzují PAL častěji pokud nejsou kompletně vyvinuty interlobární rýhy, u pacientů s emfyzémem (pokles FEV1), léčených steroidy, mužského pohlaví, při horní lobektomii atd. [1, 2, 4, 7].
MATERIÁL A METODA
Retrospektivně jsme hodnotili soubor 256 provedených plicních lobektomií za uplynulých 5 let (2002–2007) na chirurgické klinice v Plzni. Operace byly provedeny třemi operačními skupinami, celkem pěti chirurgy. Standardem na našem pracovišti je použití stapleru k oddělení parenchymu pokud není vyvinuta mezilaloková rýha. Stapler využíváme rovněž pro uzavření bronchiálního pahýlu, kde linii svorek přešíváme pokračujícím stehem. Zvykle zakládáme po plicní resekci dolní hrudní drén laterálně, v případech horní lobektomie navíc horní drén ventrálně. Oba hrudní drény napojíme samostatně na aktivní sání s podtlakem 20 cm vodního sloupce. Aktivní drenáž užíváme standardní, systém dvou lahví, kdy ve sběrné lahvi je vodní hladina, kde lze sledovat únik vzduchu (air leak). Aktivní hrudní sání ponecháváme i v dalších dnech. Drény odstraňujeme pokud množství výpotku klesne pod 100–200 ml/24 hod. a není patrný air leak. Byla provedena univariační statistická analýza s užitím software CRAN 2.4.0. Porovnávali jsme skupinu PAL a bez PAL. Na porovnání distribucí spojitých parametrů (věk), byl použit Wilcoxonův test. Pro zjištění závislostí zkoumaných znaků, vzhledem k negaussovskému rozdělení těchto proměnných pak Spearmanův koeficient korelace. Hodnotili jsme pohlaví, věk, předoperační hodnotu FEV1/FVC, operačně přítomnost pleurálních adhezí, zaniklých interlobárních rýh (použití staplerů k resekci) a zřetelných bul, počet odebraných mediastinálních uzlin, typ lobektomie (horní vs. dolní), užití stapleru a nedorozvinutí plíce >2 cm na RTG v den operace.
VÝSLEDKY
Z celkem 256 lobektomií, resp. bilobektomií se jednalo o 217 pacientů (84,8 %) s NSCLC a jinými malignitami včetně karcinoidů, 34 (12,9 %) benigních onemocnění a 6 úrazů (2,3 %). PAL jsme v našem souboru zaznamenali v 26 (10,1 %) případech, mužů 23 a žen 3. Průměrný věk pacientů s PAL byl 61,6 roků (min. 49 a max. 74). Celková doba ponechaného hrudního drénu ve skupině PAL byla v rozpětí 8–34 dní, průměr 15,9 dne. V sedmi případech jsme provedli změnu aktivní hrudní drenáže na pasivní, v průměru 14,4 den po operaci (min. 11, max. 22 den). Rovněž v sedmi případech jsme provedli změnu polohy či opětovné zavedení drenáže. Jednou jsme byli nuceni reoperovat pro významný PAL, který neustoupil konzervativně, a provedli pleuroabrazi resp. pleurektomii. Ve čtyřech případech (1,5 %) jsme bronchoskopicky prokázali insuficienci bronchiálního pahýlu. Tyto nemocné jsme operovali 12., 21., 26. a 35. den od původní operace a vždy dokončili pneumonektomii. Dva z těchto nemocných následně zemřeli, jeden následující den po pneumonektomii pro respirační insuficienci a sepsi a druhý 61. den po dokončené pneumonektomii pro druhostrannou pneumonii a respirační insuficienci. Přehledně ukazuje výsledky podle jednotlivých hodnocených parametrů souboru tabulka 1.
Tab. 1. Srovnání parametrů ve skupině PAL a bez PAL se stanovením p-value Tab. 1. Comparison of the parametres in the PAL and non- PAL groups, with the p- value established 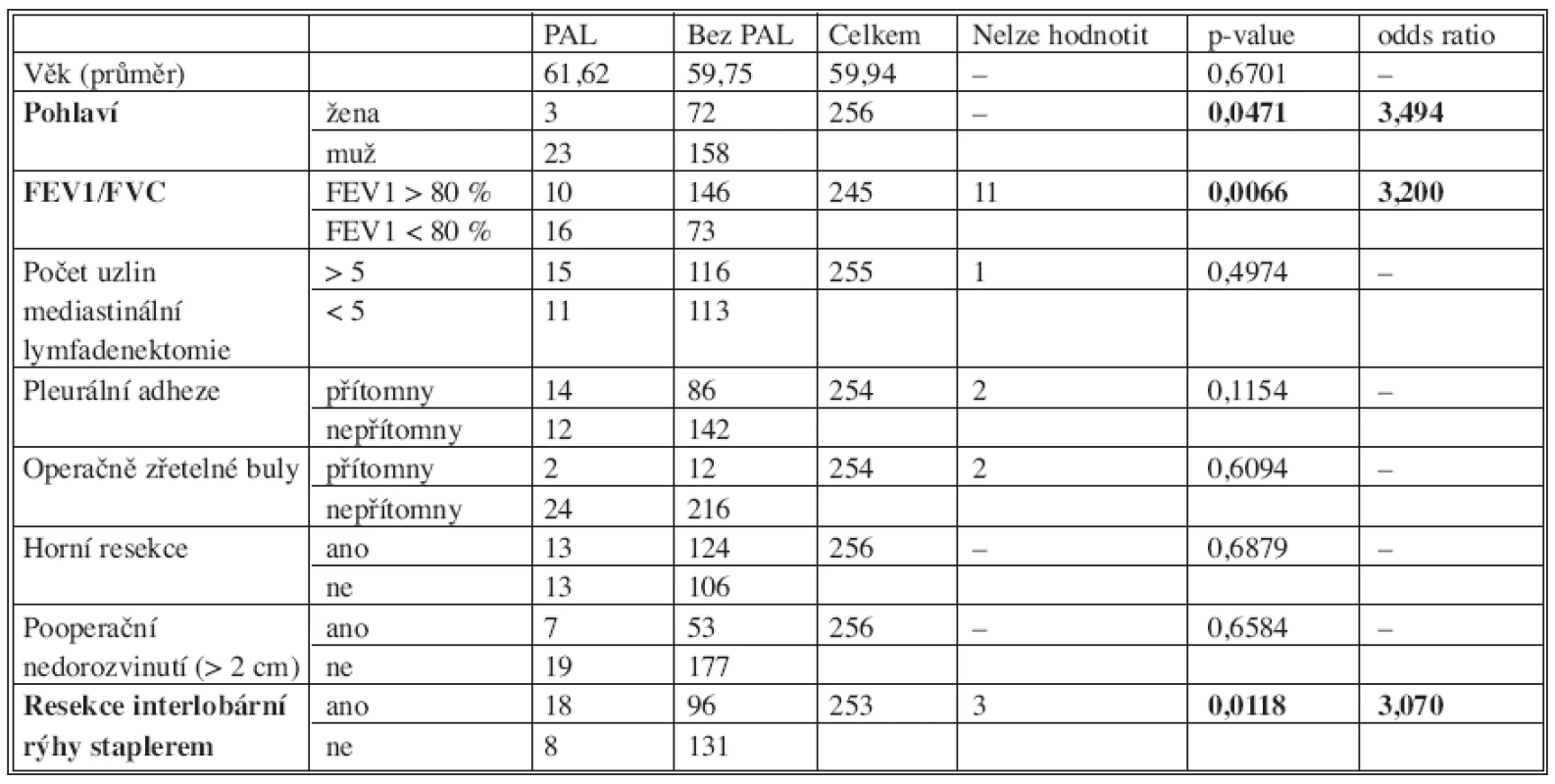
Tučně zvýrazněny významné hodnoty (p < 0,05), u nich pak stanoveno i odds ratio (odhad násobku výskytu daného jevu) Significant values (p < 0.05) are highlighted in bold, their odds ratio is established (estimate of the ratio of the odds of an event occurring in one group to the odds of it occurring in another group) DISKUSE
Prodloužení doby hospitalizace a zvýšení nákladů na léčbu nejsou jediným negativným dopadem PAL. Mezi možné komplikace patří vyšší pooperační morbidita. Až 10násobně vyšší riziko hrudního empyému (11,9 % vs. 1,0 %), febrilie trvající více jak 3 dny bez identifikovaného zdroje (6,5 % vs. 2,0 %) a pneumonie (11,9 % vs. 5,6 %) [2]. Podstatou PAL je nepřilnutí viscerální pleury k parietální po plicní resekci a tím obliterace defektů plicního parenchymu. Vzniká proto častěji po lobektomii, než např. po klínovité resekci nebo segmentektomii. Za významný prediktor PAL v našem souboru vychází FEV1/FVC < 80 %, tedy lehká forma obstrukční choroby bronchopulmonální (COPD). Tento faktor zvyšuje možnost výskytu PAL v našem případě až 3,5násobně (p-value = 0,0066; odds ratio = 3,494). Dalším významným faktorem je v našem hodnocení mužské pohlaví (p-value = 0,0471; odds ratio = 3,200) a staplerová resekce interlobární rýhy (p-value = 0,0118; odds ratio = 3,070), tedy 3x častěji průkaz PAL při použití stapleru než při jejich nepoužití. Takový výsledek si vysvětlujeme rutinním používáním staplerů na našem pracovišti. Tam kde je rýha téměř úplně vyvinuta, není riziko PAL a pokud vyvinuta není používáme stapler. Při vodní zkoušce těsnosti sutury obvykle pozorujeme mírný únik vzduchu jen z části parenchymu neresekovaném staplerem. Důvodně se domníváme, že pokud bychom stapler neužívali byla by frekvence PAL ještě vyšší, jak to potvrzují jiní autoři [7, 8, 9]. Další často citovaný faktor predikující PAL jsou horní lobektomie.Ty vedou častěji k nedorozvinutí plíce a jsou tak více disponovány k PAL (nepřilnutí pleury). Při horní lobektomii vždy přerušujeme lig. pulmonale, což může být důvodem proč jsme neprokázali rozdíl mezi horní a dolní lobektomií. Někteří autoři při horní lobektomii prováděli výběrově či dokonce pravidelně pleurální „tenting“ [10, 11]. Rozsáhlá disekce plicních laloků zvyšuje riziko bronchioloalveolárního úniku vzduchu dělenou linií parenchymu. V našem souboru jsme provedli změnu hrudní drenáže z aktivní na pasivní v sedmi případech. Častěji ne z důvodu současného většího pleurálního výpotku. Ostatní námi sledované faktory nebyly statisticky významné. Vyšší počet odebraných lymfatických uzlin znamená především disekci v mediastinu a nepoškozuje plicní parenchym. Zřetelné buly chráníme, nebo raději resekujeme a drobný mikrobulózní emfyzém spíše odráží nižší hodnota FEV1/FVC (statisticky významně). Pleurální adheze ligujeme resp. přerušujeme elektrokoagulací. Pooperační plicní nedorozvinutí zřejmě spíše znamená hůře funkční hrudní drenáž nebo špatné rozvinutí plíce ventilátorem závěrem operace, ale nepredikuje následný PAL. Prevencí PAL je jemná operační technika zejména při preparaci interlobárního parenchymu. K tomu užíváme stapleru, pouze v případech kdy jde o krátký a periferní úsek vystačíme s disekcí parenchymu peany a ligaturami přerušovaných úseků tkáně. Eliminace potenciálního air leaku spočívá závěrem operace v kontrole ventilace vodní zkouškou. Atraumatickým stehem pak přešíváme pouze místa, kde je únik vzduchu výrazný, tyto stehy totiž mnohdy sami způsobují další poranění plíce. Rozhodnutí zda přidat další stehy tak závisí na zkušenostech chirurga a kvalitě plicní tkáně. Ve snaze předejít PAL lze využít různá opatření. Resekční plochu krýt zesilujícími materiály. Využití bovinního perikardu (Bio-Vascular Dry Peri-Strips, Mineapolis, MN) [8] v této souvislosti bylo poprvé popsáno r. 1994 Cooperem při volumreduktivních operacích. [12] Tato technika i materiál však nejsou ve všech zemích přijímány liberálně a není ani levnou záležitostí, v porovnání s např. pleurálním tentingem [10]. Dále lze využít fibrinová lepidla, Focal Seal (Genzyme, Biosurgery, Cambridge, MA) [13], ePTFE (expanded polytetrafluoethylene) cévní protézu. Různým způsobem zesílená staplerová linie vykazuje v experimentu vyšší pevnost, signifikatní rozdíly mezi materiály navzájem však prokázány nebyly [5]. Budoucí výzkum teprve prokáže, zda jsou tato opatření ekonomicky a léčebně přínosná a bezpečná. Například dosavadní práce o využití bovinního perikardiu nezaznamenávají totiž zkrácení délky hospitalizace ani dobu hrudní drenáže, prokazující pouze dřívější vymizení pooperačního air leaku. [8]. Mimo stapleru v resekci plicního parenchymu lze užít i elektrokauter, stejně efektivně jako např. laser a s menšími finančními náklady [7]. Základem léčby již prokázaného PAL pochopitelně musí být nejprve vyloučení insuficience sutury bronchiálního pahýlu, tedy průkaz, že se jedná pouze o periferní či alveolární air leak. Pak je možné předpokládát, že se zhojí spontánně [1]. Podstatou zůstává řádná fyzioterapie, bronchodilatans, v případě reziduálních pneumotoraxů přidání či změna hrudní drenáže (7x v našem souboru). Pokud PAL trvá déle jak 10 dní od operace, zvažujeme individuálně převod aktivního sání na pasivní – vodní ventil, kde lze velikost PAL sledovat a při jeho ústupu převod na sáček opatřený jednocestným ventilem (Heimlich valve). Ten se jeví jako bezpečný a efektivní, umožňující propuštění pacienta z chirurgického pracoviště. Užití je však možné jen v případech omezeného PAL, resp. pokud je PAL menší než výdechový objem, tak aby nedocházelo k progresi pneumotoraxu nebo podkožního emfyzému. Pokud je PAL větší než objem výdechu je nutné pokračovat v léčbě spádovým drénem, vodním ventilem nebo aktivním sáním a Heimlichův ventil užít až později. Obecně je při prodlouženém užití hrudního drénu doporučeno podávání antibiotik [4]. Důvodem aktivního sání po plicní resekci tak zůstává odsávání pooperačního krvácení a následného pleurálního výpotku. Dodnes se většina chirurgů kloní k zakládání aktivní hrudní drenáže podtlakem -20 cm H2O po plicních resekcích, případně s konverzí na vodní ventil v situacích pokud je patrný jen únik vzduchu. Předpokládá se prodlužování air leaku aktivní drenáží. Doporučenou mezní hranici ponechání drenáže Kirschner (1992) a později Cerfolio (2002) uvádí dobu 2–3 týdnů trvajícího PAL [1, 4, 14]. Především v problematice LVRS, kde jsou PAL ještě častější se v poslední době rozšířilo doporučení časného převodu hrudního drénu na vodní ventil [15]. Randomizovaná studie (Brunelli) neprokázala statisticky signifikantní rozdíly mezi užitím aktivní hrudní drenáže a pasivním vodním ventilem. Konstatuje dobrou toleranci vodního ventilu, nikoli však zkrácení hospitalizace či nižší incidenci PAL. Prokazuje pouze méně pooperačních komplikací u pacientů s vodním ventilem (31,9 % vs. 17,8 %, p = 0,056 ) [11]. Jiné práce přínos využití vodního ventilu potvrzují (Cerfolio) [4, 16, 17]. Marshall úspěšně převáděl pacienty po operaci na vodní ventil dokonce již po 5–30 min. aktivního sání. Vysvětlení autora k tomuto postupu je, že únik vzduchu, který je vodním ventilem patrný pouze v usilovném exspiriu je v případě aktivního sání fixován na téměř kontinuální [15]. Některá pracoviště aktivní drenáž užívají pouze v den operace. První pooperační den je hrudní drén převeden na pasivní drenáž vodním ventilem. Drenáž je odstraňována pokud množství pleurálního výpotku klesne pod 200 ml a po vymizení air leaku. Po týdnu trvání air leaku je hrudní drén převáděn na Heimlichovu chlopeň, se kterou je pacient případně i propuštěn do domácího ošetřování. Následují ambulantní kontroly vodním ventilem a pokud při hlubokém kašli je patrný únik, Heimlichova chlopeň se ponechá dál. Pokud air leak trvá i 3 týdny, je pacient opět přijat do nemocnice, drén uzavřen na 12 hodin a pak provedeno RTG. Když pak není na RTG patrný pneumotorax ani podkožní emfyzém, hrudní drén je extrahován [2]. Ač je tento postup diskutabilní, je prokázáno, že je tak možno činit, díky vyplnění pleurálního prostoru adhezemi [4, 14]. Ty působí jako prevence kolapsu i tenzního pneumotoraxu [4]. Potvrzují to klinické zkušenosti, dokonce bez rozdílu velikosti air leaku a rozsahu pneumotoraxu. Pokud periferní alveolární air leak přetrvává ve velké míře a odstranění drenáže z nejrůznějších důvodů není možné, může být řešením subsegmentální bronchiální coiling či aplikace fibrinového lepidla bronchoskopicky či pod CT. Posledním krokem je pak reoperace, torakotomie a přešití místa léze v případě jeho identifikace, dále pleuroabraze (jednou provedeno i v našem souboru), aplikace talku resp. jiných sklerozujících agens.
ZÁVĚR
Za predisponující faktory vzniku PAL po plicních lobektomiích rozborem našeho souboru lze považovat: FEV1/FVC < 80%, zaniklé interlobární rýhy, kdy je nutné použití staplerů pro disekci a mužské pohlaví. Na základě našich i literárních poznatků se u takových pacientů snažíme optimalizovat operační postup i pooperační léčbu. Podstatou té je především prevence. Prodloužení doby hrudní drenáže a časný převod aktivní drenáže na pasivní zůstává hlavní formou léčby prokázaného PAL.
Tato práce byla podpořena grantem IGA NR/9343-3, VZ MSM 0021620819.
MUDr. J. Šafránek
Alej Svobody 80
304 60 Plzeň
e-mail: safranek@fnplzen.cz
Zdroje
1. Ponn, R. P. Complication of Pulmonary Resection. In: Shields, T. W., LoCicero, J., Ponn, R. P., Rusch, V. W. General Thoracic Surgery. Sixth edition, Lippincott Williams, Wilkins, 2005, 567–568, volume 1.
2. Brunelli, A., Monteverde, M., Borri, A., Salati, M., Marasco, R. D., Fianchini, A. Predictors of prolonged air leak after pulmonary lobectomy. Ann. Thorac. Surg., 2004, Apr; 77(4): 1205–1210.
3. Isowa, N., Hasegawa, S., Bando, T., Wada, H. Preoperative risk factors for prolonged air leak following lobectomy or segmentectomy for primary lung cancer. Eur. J. Cardiothorac. Surg., 2002, May; 21(5): 951.
4. Cerfolio, R. J., Bass, C. S., Pask, A. H., Katholi, C. R. Predictors and treatment of persistent air leaks. Ann. Thorac. Surg., 2002, Jun; 73(6): 1727–1730.
5. Abolhoda, A., Liu, D., Brooks, A., Burt, M. Prolonged air leak following radical upper lobectomy: an analysis of incidence and possible risk factors. Chest, 1998, Jun; 113(6): 1507–1510.
6. Stolz, A. J., Schützner, J., Lischke, R., Simonek, J., Pafko, P. Predictors of prolonged air leak following pulmonary lobectomy. Eur. J. Cardiothorac. Surg., 2005, Feb; 27(2): 334–346.
7. Venuta, F., Rendina, E. A, De Giacomo, T., Flaishman, I., Guarino, E., Ciccone, A. M., Ricci, C. Technique to reduce air leaks after pulmonary lobectomy. Eur. J. Cardiothorac. Surg., 1998, Apr; 13(4): 361–364.
8. Miller, J. I. Jr., Landreneau, R. J., Wright, C. E., Santucci, T. S., Sammons, B. H. A comparative study of buttressed versus nonbuttressed staple line in pulmonary resections. Ann. Thorac. Surg., 2001, Jan;71(1): 319–322.
9. Roberson, L. D., Netherland, D. E., Dhillon, R., Heath, B. J. Air leaks after surgical stapling in lung resection: a comparison between stapling alone and stapling with staple-line reinforcement materials in a canine model. J. Thorac. Cardiovasc. Surg., 1998, Aug; 116(2): 353–354.
10. Brunelli, A., Monteverde, M., Borri, A., Salati, M., Marasco, R. D., Al Refai, M., Fianchini, A. Comparison of water seal and suction after pulmonary lobectomy: a prospective, randomized trial. Ann. Thorac. Surg., 2004, Jun; 77(6): 1932–1937.
11. Brunelli, A., Al Refai, M., Muti, M., Sabbatini, A., Fianchini, A. Pleural tent after upper lobectomy: a prospective randomized study. Ann. Thorac. Surg., 2000, Jun; 69(6): 1722–1724.
12. Cooper, J. D. Technique to reduce air leaks after resection of emphysematous lung. Ann. Thorac. Surg., 1994; 57 : 1038–1039.
13. Wain, J. C., Kaiser, L. R., Johnstone, D. W., Yang, S. C., Wright, C. D., Friedberg, J. S., Feins, R. H., Heitmiller, R. F., Mathisen, D. J., Selsyn, M. R. Trial of a novel synthetic sealant in preventing air leaks after lung resection. Ann. Thorac. Surg., 2001, May; 71(5): 1623–1628.
14. Kirschner, P. A. Provocative clamping and removal of chest tubes despite persistent air leak. Ann. Thorac. Surg., 1992, Apr; 53(4): 740–741.
15. Marshall, M. B., Deeb, M. E., Bleier, J. I., Kucharczuk, J. C., Friedberg, J. S., Kaiser, L. R., Shrager, J. B. Suction vs water seal after pulmonary resection: a randomized prospective study. Chest, 2002, Mar; 121(3): 831–835.
16. Cerfolio, R. J., Bass, C., Katholi, C. R. Prospective randomized trial compares suction versus water seal for air leaks. Ann. Thorac. Surg., 2001, May; 71(5): 1613–1617.
17. Cerfolio, R. J., Tummala, R. P., Holman, W. L., Zorn, G. L., Kirklin, J. K., McGiffin, D. C., Naftel, D. C., Pacifico, A. D. A prospective algorithm for the management of air leaks after pulmonary resection. Ann. Thorac. Surg., 1998, Nov; 66(5): 1726–1731.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2008 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Akutní endovaskulární řešení disekce hrudní aorty a následné ischemie dolních končetin
- Výskyt a řešení prolongovaného úniku vzduchu po plicní lobektomii
- Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi
- Hluboká žíla dolní končetiny jako tepenná náhrada při řešení infekce cévní protézy
- Skúsenosti s plastikou ventrálnych hernií podľa Chevrela s „on lay“ prolénovou sieťkou
- Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza
- Chronická pankreatitída, indikácie k resekčným výkonom a pooperačné komplikácie
- Kvalita života pacientov po resekčných výkonoch pre chronickú pankreatitídu
- Epidemiologie a ekonomie zlomenin proximálního femuru, proximálního humeru, distálního radia a luxačních zlomenin hlezna
- Prof. MUDr. Václav Vojtěch Tošovský, DrSc., zemřel ve věku 95 let
- Životní jubileum prof. MUDr. Vl. Krále, CSc. (29. 3. – 70 let)
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kvalita života pacientov po resekčných výkonoch pre chronickú pankreatitídu
- Skúsenosti s plastikou ventrálnych hernií podľa Chevrela s „on lay“ prolénovou sieťkou
- Chronická pankreatitída, indikácie k resekčným výkonom a pooperačné komplikácie
- Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



