-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam parametrů krevního obrazu pro diagnostiku a odhad prognózy u pacientů s myelodysplastickým syndromem
Importance of blood count for diagnosis and prognosis in patients with myelodysplastic syndrome
Myelodysplastic syndrome (MDS) is a clonal haematopoietic disorder characterised by dysplastic bone marrow. It manifests as mono-, bi - or pancytopenia in peripheral blood and eventually can progress to leukaemia. The first important laboratory assessment on suspicion of MDS, to enable the differential diagnosis of this syndrome is full blood count (CBC), based on which, other specialised tests are indicated to confirm diagnosis of MDS. The careful evaluation of all parameters of blood count can contribute to rapid estimation of MDS prognosis.
The aim of the retrospective analysis of 100 MDS patients examined within the period from 2000–2008 at the Haemato-oncology Department of the University Hospital, Olomouc was to evaluate the initial parameters of blood count for the risk of leukaemia development and overall survival (OS). Statistically significant unfavourable prognostic factors for OS showed thrombopenia, neutropenia, presence of blast cells in peripheral blood, peripheral blast cells ≥ 5 % and low platelet mass. The favourable factors were macrocytosis and lymphocytopenia. The level of haemoglobin (Hb), MPV and RDW were not shown as statistically significant for the prognosis. The risk factors of leukaemia development were thrombopenia, low or normal platelet mass, normal or low MCV, presence of blasts cells in peripheral blood, neutropenia, and lymphocytosis. Another parameters of CBC (Hb, RDW, MPV) were not statistically significant for leukaemia development in our group. This analysis confirms the importance of CBC not only as a basic diagnostic laboratory test but also as a prognostic indicator for MDS patients.Key words:
myelodysplastic syndrome, blood count (CBC), prognostic factors, risk of leukaemia development.
Autoři: J. Vondráková 1; J. Zapletalová 2; J. Indráková 1; K. Indrák 1
Působiště autorů: Hemato-onkologická klinika Fakultní nemocnice a Lékařská fakulta Univerzity Palackého, Olomouc Přednosta: prof. MUDr. Karel Indrák, DrSc. 1; Ústav lékařské biofyziky, Lékařská fakulta Univerzity Palackého, Olomouc Přednostka: doc. RNDr. Hana Kolářová, CSc. 2
Vyšlo v časopise: Prakt. Lék. 2009; 89(6): 324-327
Kategorie: Diagnostika
Souhrn
Myelodysplastický syndrom (MDS) je způsoben klonální poruchou krvetvorby s dysplastickou kostní dření. Projevuje se mono-, bi - nebo pancytopenií v periferní krvi a posléze může akcelerovat v akutní leukémii (AL). Důležitým prvotním vyšetřením, které umožňuje vyslovit podezření na MDS a přispívá k diferenciální diagnostice tohoto syndromu, je krevní obraz (KO), na jehož základě jsou indikována další speciální vyšetření k potvrzení diagnózy MDS. Pečlivé zhodnocení všech parametrů KO však může přispět i k rychlému odhadu prognózy nemocného s MDS.
Cílem retrospektivní analýzy souboru 100 MDS nemocných léčených na HOK FN Olomouc v letech 2000–2008 bylo posouzení přínosu vstupních parametrů KO k odhadu rizika přechodu MDS v AL a jejich vlivu na celkové přežití (OS). Statisticky významným nepříznivým ukazatelem pro OS byla trombopenie, neutropenie, vyplavování blastů, počet blastů v periferii ≥ 5 % a nižší celkový objem trombocytární masy. Příznivým prognostickým faktorem naopak byla makrocytóza a lymfopenie. Nebyla prokázána statistická významnost hodnot hemoglobinu (Hb), středního objemu trombocytů (MPV) a distribuční šíře erytrocytů (RDW). Jako riziko pro vývoj AL se jevila trombopenie, nízký nebo normální objem trombocytární masy, normální střední objem erytrocytů (MCV) či mikrocytóza, vyplavování blastů, neutropenie, lymfocytóza. Ostatní parametry KO (Hb, RDW, MPV) neměly v hodnocené sestavě statisticky signifikantní vliv na riziko vzniku AL. Naše analýza tak potvrzuje význam KO nejen jako základního diagnostického laboratorního vyšetření, ale i jako prognostického ukazatele u nemocných s MDS.Klíčová slova:
myelodysplastický syndrom, krevní obraz, prognóza, riziko akutní leukémie.Úvod
Myelodysplastický syndrom (MDS) je chronické onemocnění krvetvorby, definované jako klonální hematopoetická porucha vznikající na podkladě poruchy proliferace, diferenciace a apoptózy pluripotentní kmenové buňky. MDS zahrnuje heterogenní skupinu onemocnění, jejímž charakteristickým rysem je dysplastická kostní dřeň (KD) a současně periferní cytopenie při inefektivní hematopoéze, která může asi u 20 až 30 % nemocných posléze vyústit do obrazu akutní leukémie (AL) (1, 5, 6, 7, 8, 11).
Symptomy nemoci vyplývají z tíže insuficience KD a periferní mono-, bi - či pancytopenie. Nejčastějším příznakem MDS je anémie (80 % pacientů má hodnotu Hb < 100 g/l) projevující se únavovým syndromem, dále infekce při leukopenii (25–30 % pacientů) a krvácivé projevy při trombocytopenii (10 % pacientů) (1).
Základním laboratorním testem, který vede k podezření na MDS je proto krevní obraz (KO), který by měl být vždy doplněn i o počet retikulocytů a diferenciální rozpočet leukocytů opticky zhodnocený laboratorním pracovníkem. Další diagnostika se pak opírá o morfologické zhodnocení nálezu v KD, kterou případně doplňují další speciální laboratorní metody – barvení KD na železo (Fe), cytochemická barvení, cytogenetické vyšetření, molekulárně-genetické metody, trepanobiopsie, apod. Na podkladě těchto vyšetření je stanoven podtyp MDS podle klasifikačních schémat FAB a nově WHO a zároveň je odhadováno riziko transformace v AL.
Prognostická stratifikace nemocných pak umožňuje individuálně zvolit optimální léčebnou strategii (2, 4, 5, 6, 7, 8, 10, 11, 13).
Klíčovou úlohu v diferenciálně-diagnostickém algoritmu cytopenie však hraje KO jako elementární vyšetření prvního kontaktu. Jeho správné zhodnocení a interpretace vede praktického lékaře či internistu k podezření na MDS a následnému vyšetření, které může tuto diagnózu potvrdit.
I pro hematologa jsou vstupní parametry KO přínosné nejen pro diagnostiku MDS, ale mohou sloužit i k odhadu prognózy v první fázi vyšetřování, kdy nejsou k dispozici všechny výsledky časově náročných sofistikovaných laboratorních metod.
Ve světle literárních dat jsme se proto pokusili zhodnotit parametry KO našich nemocných s MDS, jak z hlediska diagnostického, tak prognostického (3, 9, 12).
Soubor pacientů a metodika
Cílem retrospektivní analýzy MDS nemocných diagnostikovaných a léčených v letech 2000–2008 na HOK FN Olomouc bylo zhodnocení vstupních parametrů KO na celkové přežití (OS) a riziko vývoje AL. Do analýzy bylo zařazeno 100 nemocných s potvrzenou diagnózou MDS. Vyloučeni byli nemocní s chronickou myelomonocytární leukémií a překryvnými syndromy (MDS a aplastické anémie či MDS a myeloproliferativního syndromu) pro odlišný klinický průběh nemoci. Nemocní byli klasifikováni na základě opakovaného stanovení KO (minimálně 2x) v průběhu 2 měsíců a na podkladě vyšetření aspirátu KD.
Krevní obrazy byly vyšetřovány na analyzátorech Coulter LH-750 nebo Sysmex XE 2100 optickou nebo impedanční metodou, byly určeny všechny parametry KO – hodnoty Hb, leukocytů, erytrocytů, trombocytů, hematokritu, MCV, MPV, MCHC, RDW a pětipopulační diferenciální rozpočet leukocytů, který byl dále hodnocen mikroskopicky laborantkou v nátěru periferní krve obarveném panoptickou Pappenheimovou metodou.
Aspiráty KD pro morfologické vyšetření byly obarvené panoptickou metodou, laborantkou byl určen myelogram (procentuální zastoupení jednotlivých elementů z 200 jaderných buněk), lékař vyhodnotil nález s popisem, definitivní kontrolu a komplexní posouzení 2. čtením provedl atestovaný hematolog. Dále bylo cytochemicky určeno zásobní Fe a procento prstenčitých sideroblastů (barvením KD na Fe berlínskou modří).
Veškerá vyšetření byla prováděna v rutinních a specializovaných laboratořích HOK FN Olomouc s využitím standardních operačních postupů a na základě správné laboratorní praxe.
Podrobný popis metodiky přesahuje účel tohoto článku, součástí diagnostiky a prognostické stratifikace byly též metody cytogenetiky a molekulární genetiky.
Při statistické analýze bylo použito standardních statistických metod, tj. analýzy přežití dle Kaplan-Meiera, log-rank testu, metody regresní analýzy pomocí modelu dle Coxe.
Obr. 1. Morfologie KD u pokročilého MDS 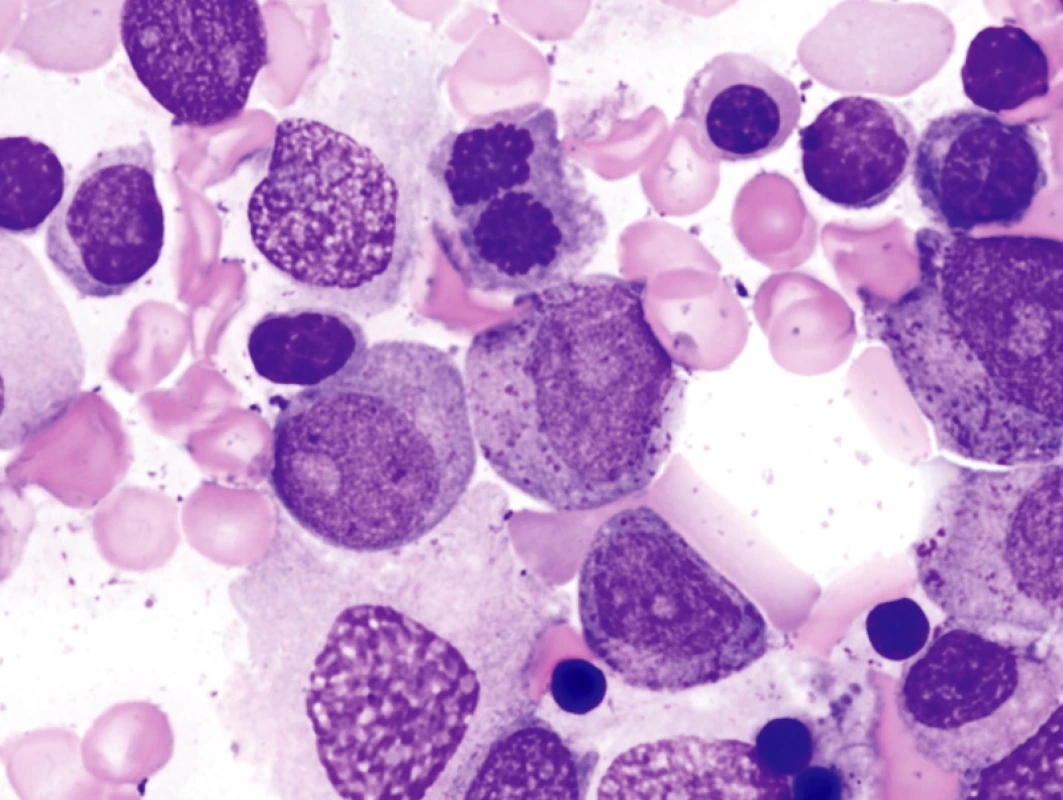
Výsledky
Celkem bylo hodnoceno 100 nemocných, 51 mužů a 49 žen (1 : 1), ve věku 28–90 let s mediánem (Me) 65 let. Věk mužů se pohyboval v intervalu 33–90 let (Me 65 let) a věk žen od 28 do 85 let (Me 65 let).
Podle FAB klasifikace se jednalo 41x o refrakterní anémii (RA), 16x refrakterní anémii s prstenčitými sideroblasty (RARS) a 43x refrakterní anémii s excesem blastů (RAEB). OS bylo (průměr a Me) pro RA 68,7 měsíců (Me nedosaženo), pro RARS 39,2 a 52,7 měsíců a pro RAEB 22,9 a 13,6 měsíců (p=0,0003), doba do vzniku AML byla průměrně pro RA 77,6 a RARS 50,5 měsíců (Me nedosaženo) a pro RAEB 17,4 (respektive Me 10,3) měsíců (p<0,0001).
Podobným způsobem jsme hodnotili nemocné i podle nové WHO klasifikace, která MDS přesněji prognosticky rozčleňuje. Rozlišuje se „čistá“ RA s dysplastickými změnami jen červené krevní řady oproti prognosticky nepříznivější refrakterní cytopenii s multilineární dysplázií (RCMD) s dysplastickými změnami ve více buněčných řadách. RAEB je podle počtu blastů v KD rozdělena na podskupinu méně a více pokročilou, tj. RAEB-I a RAEB-II.
WHO klasifikace nově definuje AML přítomností 20 % blastů v KD a ruší tak jednotku refrakterní anémie s excesem blastů v transformaci (13). V souladu s touto klasifikací měli naši nemocní statisticky významně (p<0,0001) horší prognózu, kratší přežití a vyšší riziko transformace v AML v pokročilejších fázích MDS.
OS tak např. pro RCMD bylo průměrně 54,3 měsíců, pro RAEB-I 26,6 měsíců a pro RAEB-II 12,4 měsíců. Průměrná doba do vzniku AML byla pro RCMD 74,6 měsíců, pro RAEB-I 22,6 měsíců a pro RAEB-II jen 8,9 měsíců.
Celkově došlo u 41 % nemocných k vývoji AML.
Vstupní hodnoty KO byly:
- Hb 44–149 g/l (Me 93),
- leukocyty 1–30.109/l (Me 3,5),
- neutrofily 0,1–17.109/l (Me 1,7),
- lymfocyty 0–5.109/l (Me 1,3),
- monocyty 0–6.109/l (Me 0,3),
- MCV 77–125 fl (Me 96),
- trombocyty 3–702.109/l (Me 113),
- plt mass (součin MPV a počtu trombocytů) 0–6,8 ml/l (Me 1,6),
- blasty 0–12 % (Me 0),
- RDW 13–29 % (Me 17),
- retikulocyty 0–0,035 (Me 0,015).
Při statistické analýze jsme sledovali vliv na OS a riziko AML hodnoty Hb ≥ 70 g/l, ≥ 100 g/l, počty trombocytů nižší nebo vyšší než norma (150–400.109/l) či trombocyty ≥100 a ≥50 a ≥30.109/l, počet lymfocytů (norma 1,4–3,4.109/l), neutrofilů (norma 1,4–6,5.109/l), MCV (norma 82–96 fl), plt mass (norma 0,6–1,3 ml/l), vyplavování blastů do periferie (blasty přítomny x nenalezeny), počet blastů ≥ 5 %, hodnoty RDW (norma 11,5–14,5 %) a MPV (norma 7,8–11 fl).
Statisticky významným nepříznivým ukazatelem pro OS byla ve studovaném souboru
- trombopenie,
- těžká i velmi těžká trombopenie (vše p<0,001),
- neutropenie (p=0,0004),
- vyplavování blastů (ano x ne p<0,0001),
- počet blastů v periferii ≥ 5 % (p=0,003),
- nižší celkový objem trombocytární masy (p=0,002).
Příznivá naopak byla makrocytóza (p=0,013). Hodnoty Hb, lymfocytů, MPV, RDW nebyly statisticky významné.
Rizikem pro vývoj AL byla
- trombopenie (p=0,001),
- trombocyty <100.109/l (p=0,001),
- trombocyty < 30.109/l (p=0,029),
- nízký nebo normální objem trombocytární masy (p=0,017),
- vyplavování blastů (p=0,0001),
- blasty ≥5 % (p=0,0002),
- neutropenie (p=0,001).
Překvapivě lymfopenie < 1,4.109/l statisticky signifikantně (p=0,0005) snižovala riziko přechodu v AL.
Ostatní parametry (Hb, RDW, MPV, MCV) neměly statisticky významný vliv na riziko vzniku AL. Ačkoliv hodnoty Hb (≥100 g/l či ≥70 g/l) nedosáhly hladiny statistické významnosti, odlišný průběh křivek naznačoval trend vyššího rizika AL při těžší anémii. Alarmujícím poznatkem bylo zjištění, že vyplavení byť jediné blastické buňky do periferní krve představuje riziko přechodu do AL v Me 8,2 měsíců.
Graf 1. Riziko vzniku AML dle počtu trombocytů (p=0,001) 
Graf 2. Riziko vzniku AML dle počtu lymfocytů (p=0,0005) 
Graf 3. Riziko vzniku AML dle počtu neutrofilů (p=0,001) 
Graf 4. Riziko vzniku AML při vyplavování blastů (p<0,0001) 
Graf 5. Vliv objemu tromobcytární masy na OS (p=0,002) 
Graf 6. Vliv středního objemu erytrocytů na OS (p=0,013) 
Diskuse
Výsledky analýzy studovaného souboru nemocných potvrzují v souladu s literárními daty přínosnost FAB a zejména pak nové WHO klasifikace pro stanovení pokročilosti MDS a určení prognózy nemoci, především pak rizika progrese v AL. Vzhledem k určité primární selekci nemocných odesílaných do centra specializované hematologické péče, kdy důvodem ke konzultaci a dovyšetření je mnohdy až výraznější cytopenie, převažují v souboru pokročilejší stádia MDS, čemuž by zřejmě odpovídal i častější přechod choroby v AL. Podobně jako jiní autoři jsme se pokusili zhodnotit, byť z hlediska statistického zpracování relativně malého souboru nemocných, přínos KO, nejen jako důležitého základního laboratorního vyšetření, ale i jako možného prognostického ukazatele pro MDS.
Závěr
KO jako elementární vyšetření při prvotním kontaktu s nemocným přináší celou řadu cenných informací směřující ke stanovení správné diagnózy. Využití všech parametrů KO, jejich komplexní a správná interpretace pak přispívá k rychlé diferenciální diagnostice řady onemocnění. Nezbytnou součástí KO by mělo vždy být i optické hodnocení diferenciálního rozpočtu leukocytů zkušeným laboratorním pracovníkem, které může včas odhalit i závažná hematologická onemocnění jako MDS a AL. Opomenutí tohoto vyšetření zejména u cytopenických nemocných by bylo závažným pochybením.
Přínosné je též stanovení počtu retikulocytů k vyloučení dřeňového útlumu, aplastické anémie či hemolýzy. Pro hematologa KO skýtá i možnost odhadu rizikovosti MDS v době, kdy nejsou k dispozici výsledky dalších speciálních vyšetření.
MUDr. Jana Vondráková
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
E-mail: vondrakj@fnol.cz
Zdroje
1. Adam, Z., Penka, M., Doubek, M. Myelodysplastický syndrom a myelodysplastické/ myeloproliferativní choroby. In Adam, Z. a kol.: Diagnostické a léčebné postupy u maligních chorob. Praha: Grada Publishing, 2002, s. 341-350.
2. Bennett, M. J., Catovsky, D., Daniel, T. M. et al. Proposals for the classification of the myelodysplastic syndromes. Br. J. Haematol., 1982, 51, p. 189-199.
3. Bowles, M. K., Warner, A. B., Baglin, P. T. Platelet mass has prognostic value in patients with myelodysplastic syndromes. Br. J. Haematol., 2006, 135, p. 198-200.
4. Čermák, J., Vítek A., Michalová, K. a kol. Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a jak léčit nemocné? Vnitř. Lék., 2005, 51, 1, s. 20-30.
5. Čermák, J. Myelodysplastický syndrom. Doporučené postupy pro praktické lékaře. ČLS JEP, projekt MZ ČR, reg. č. o/017/301, dostupný z WWW: <http://www.cls.cz/dp>
6. Hochová, I., Neuwirtová, R., Vodičková, E. a kol. Myelodysplastický syndrom. Diagnostický atlas. Praha: Jessenius, Maxdorf, 2006, 323 s. ISBN 80-7345-088-7.
7. Indrák, K. a kol. Hematologie. Postgraduální klinický projekt. Vnitřní lékařství VII. Praha: Triton, 2006, 278 s. ISBN 80-7254-868-9.
8. Kačírková, P., Campr, V. Hematoonkologický atlas krve a kostní dřeně. Praha: Grada Publishing 2007, 285 s. ISBN 978-80-247-1853-8.
9. Matsuda, A., Misumi, M., Yoshida, K. et al. Is macrocytosis a favourable prognostic factor in myelodysplastic syndrome patients without increased blasts? Br. J. Haematol., 2003, 121, p. 815-816.
10. Neuwirtová, R. Myelodysplastický syndrom: onkohematologické onemocnění vyššího věku. Čes. Ger. Rev., 2005, 3, 2, s. 21-28.
11. Neuwirtová, R., Mociková, K., Jelínek, J. a kol. Smíšené myelodysplastické a myeloproliferativní syndromy. Čas. Lék. čes., 1997, 136, s. 724-729.
12. Palmer, R. S., Tefferi, A., Hanson, A. C., Steensma, P. D. Platelet count is an IPSS-independent risk factor predicting survival in refracotry anaemia with ringed sideroblasts. Br. J. Haematol., 2008, 140, p. 722-724.
13. Vardiman, W. J., Harris, L. N., Brunning, D. R. The World Health Organization (WHO) classification of the myeloid neoplasms. Blood, 2002, 100, 7, p. 2292-2302.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2009 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Syndrom kombinované fibrózy a emfyzému – CPFE syndrom
- Hodnocení zdravotních dopadů profesionální expozice karcinogenům v jednotlivých hospodářských odvětvích
- Zdravotní komplikace zneužívání návykových látek a možnosti prevence v primární péči
- Chyby při léčbě deliria tremens
- Rané faktory ovlivňující vznik obezity na začátku života
- Oboustranná rekonstrukce prsů dvěma DIEP laloky Jak ji hodnotí pacientky?
- Epidemiologie a socioekonomické dopady hyperaktivity močového měchýře
- Bolestivá noha
- Srdeční AL-amyloidóza s relativně benigním průběhem
- Význam parametrů krevního obrazu pro diagnostiku a odhad prognózy u pacientů s myelodysplastickým syndromem
- Dermatovenerologie v ČR O dermatologii s nadhledem i vážně s prof. MUDr. Petrem Arenbergerem, DrSc., MBA, předsedou České dermatovenerologické společnosti ČLS JEP
- Poučení a souhlas pacienta, který je pod vlivem alkoholu
- Bohumil Eiselt, profesor vnitřního lékařství a zakladatel Spolku českých lékařů
- Miniportréty slavných českých lékařů Profesor MUDr. Zdeněk Mysliveček, představitel české psychiatrie v první polovině 20. století
- Nekamenujte proroky
- Prof. MUDr. Květoslav Šipr, CSc., se dožívá 75 let
- O neurologovi, který sbírá úsměvné historky
- NÁZOR
- Odpověď autorů článku „Konec elektromagnetické hypersenzitivity“
- Jubilea
- Komunikace ve zdravotnické péči
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Zdravotní komplikace zneužívání návykových látek a možnosti prevence v primární péči
- Chyby při léčbě deliria tremens
- Syndrom kombinované fibrózy a emfyzému – CPFE syndrom
- Bolestivá noha
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



