-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Časná kancerogeneze u spinocelulárního karcinomu hlavy a krku
Early cancerogenesis in head and neck squamous cell carcinoma
Squamous cell carcinoma is the most frequent malignant tumour of the head and neck. It affects more than one thousand patients in the Czech Republic each year. Despite advances in surgical techniques (endoscopic surgery, functional neck dissection etc.), instruments (laser, harmonic ultrascission knife, radiofrequency a.o.) and oncology guidelines, the overall 5-year survival rate remains under 50 %. The article reviews current data on early cancerogenesis of head and neck squamous cell carcinoma and outlines possible research trends.
Key words:
head and neck squamous cell carcinoma, tailored medicine, molecular biology, field cancerization, biochip, RT-PCR.
Autoři: J. Kastner 1; J. Bouček 1,2; J. Betka 1,2; J. Plzák 1,3,4; M. Jáchymová 5; J. Betka 1
Působiště autorů: Klinika otorhinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN v Motole, Katedra otorhinolaryngologie IPVZ, Praha Přednosta: Prof. MUDr. Jan Betka, DrSc. 1; Mikrobiologický ústav AV ČR, Sektor Imunologie a gnotobiologie, Praha Vedoucí: Prof. RNDr. Blanka Říhová, DrSc. 2; Anatomický ústav 1. LF UK, Praha Přednosta: Prof. MUDr. Miloš Grim, DrSc. 3; Centrum buněčné terapie a tkáňových náhrad 2. LF UK, Praha Vedoucí: Prof. MUDr. Eva Syková, DrSc. 4; Ústav klinické biochemie a laboratorní diagnostiky 1. LF UK a VFN, Praha Přednosta: Prof. MUDr. Tomáš Zima, DrSc., MBA. 5
Vyšlo v časopise: Prakt. Lék. 2008; 88(9): 501-505
Kategorie: Přehledy
Souhrn
Spinocelulární karcinom hlavy a krku je zdaleka nejčastěším zhoubným nádorem ORL oblasti a v ČR postihuje ročně přes tisíc pacientů. I přes pokroky v zavádění nových operačních postupů (endoskopické výkony, funkční bloková dissekce aj.), přístrojů (laser, harmonický skalpel) či onkologických schémat zůstává u lokálně pokročilého nádoru pětileté přežití pod 50 %. Souhrnný článek popisuje dosavadní poznatky o časné kancerogenezi u spinocelulárního karcinomu hlavy a krku a uvádí molekulárně biologické trendy, které mohou přispět k dalšímu poznání časné fáze kanzerogeneze u tohoto typu karcinomu, a tím i zlepšit detekci, výhledově pak i léčbu tohoto zhoubného onemocnění.
Klíčová slova:
spinocelulární karcinom hlavy a krku, individualizovaná léčba, molekulární biologie, plošná kancerizace, biochip, RT-PCR.Úvod
Současná úroveň vědeckých poznatků v oblasti molekulární biologie vede k poznání, že naše až doposud používané diagnosticko-terapeutické postupy u nádorových onemocnění doznají v budoucnosti poměrně významných změn či modifikací. Nádorová biologie dosáhla v posledních 25 letech významných úspěchů, a to zejména při detekci změn na subcelulární, respektive molekulární, úrovni, a bylo dosaženo značného pokroku v poznání zákonitostí vzájemného ovlivnění imunitního systému jedince a nádorového procesu. Je prokázáno, že námi až doposud používaná histopatologická diagnostika chorobných procesů tkání je na subcelulární úrovni nepoměrně složitější a komplexnější, než v současnosti stále platný zlatý standard histopatologického vyšetření.
Molekulární biologie buňky se stává důležitým parametrem normální i patologické tkáně a je velice pravděpodobné, že v blízké budoucnosti doplní či nahradí klasickou patologii, na níž spoléhaly operační obory posledních více jak 100 let. Pre-symptomatický screening, diagnostika i staging chorobného procesu na molekulární úrovni se stanou zřejmě již v blízké budoucnosti součástí diagnostického postupu. Tento molekulárně genetický otisk chorobného procesu se s dalším rozvojem molekulární biologie stane i základem úspěchu metod terapeutických u doposud obtížně terapeuticky ovlivnitelných chorobných stavů, například u onkologických onemocnění. S tím souvisí i v poslední době často skloňovaný pojem „tailored medicine“, což v tomto případě znamená individuálně modifikovanou (z angl. doslova „ušitou“) léčebnou strategii na základě genetického otisku určitého typu nádoru u jednotlivého pacienta (1). To se týká i nejčastějšího představitele maligního nádoru v ORL oblasti – spinocelulárního karcinomu hlavy a krku (angl. HNSCC – head and neck squamous cell carcinoma).
Proces kancerogeneze, onkogeny a tumor-supresor geny
Klasická histopatologická Slaughterova teorie plošné kancerizace („field cancerization“) popsala před více než 50 lety vznik vícečetných ložisek dysplazie ikarcinomu utéhož jedince při dlouhodobé expozici kancerogenu v jednom orgánovém systému a při klonální expanzi alterovaného epitelu (9). Tato je s rozvojem molekulárně genetických postupů posunuta na další, subcelulární, tj. molekulární úroveň. Teorie geneticky alterovaného pole vhistologicky normální tkáni je potvrzena mnoha studiemi z poslední doby, abyly publikovány neúplné modely molekulární kancerogeneze uHNSCC. Dochází k„molekulárně genetické dysplázii“ v tkáni histologicky zdravé (8, 10, 11). Při operaci zhoubného nádoru je radikalita chirurgické léčby potvrzena histopatologickým vyšetřením excidovaného tumoru snegativním okrajovým lemem nenádorové tkáně. Přesto i při kompletním odstranění nádorové tkáně dochází v horizontu 5-tileté dispenzarizace ve více než 50 % případů k selhání léčby (obr. 1), incidence druhého primárního tumoru (SPT = second primary tumor, duplicita) v ORL oblasti se udává v rozmezí 3–20 % (4). Ačkoliv v posledních 25 letech dosáhla lékařská věda značných pokroků, vedoucích k lepší lokální kontrole, diagnostice i terapii, zůstávají rekurence či duplicita hlavní příčinou selhání terapie u HNSCC (5-7). Důvodem selhání léčby může být různá úroveň molekulárně genetických změn v histologicky normální tkáni přilehlé k nádoru u histopatologicky jednotně postižených jedinců a také různá úroveň nastavení imunitního systému jednotlivého pacienta (8).
Obr. 1. Paratracheostomická rekurence (šipka) u pacienta 9 měsíců po chirurgické léčbě a adjuvantní chemoradioterapii pro laryngofaryngeální spinocelulární karcinom. 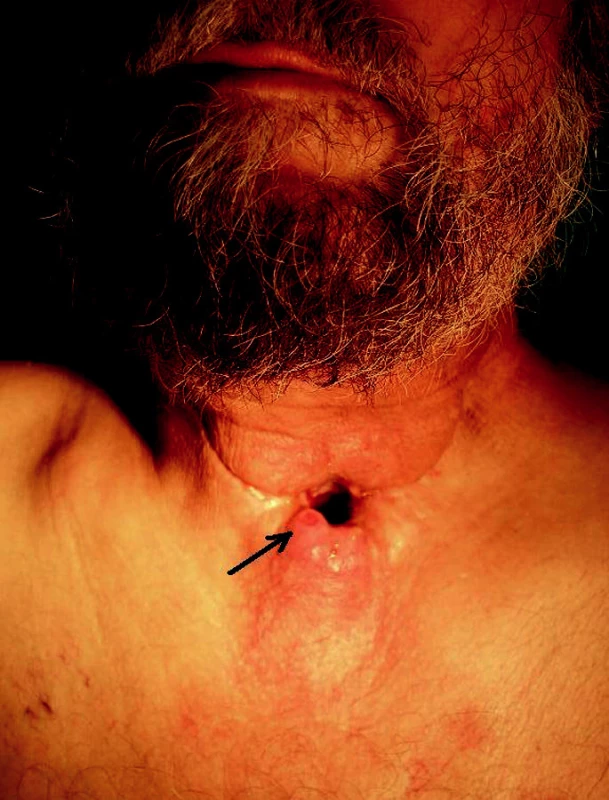
Je známo mnoho genů, jejichž exprese je unádorových stavů změněna oproti tkáni zdravé, jde zejména o geny kódující proteiny, které ovlivňují buněčnou proliferaci, diferenciaci a plánovanou buněčnou smrt, apoptózu. Zjednodušeně lze rozdělit geny podílející se na řízení těchto dějů na na onkogeny a tumor supresorové geny (TSG). Základním kritériem je míra jejich exprese (up/down regulace) ve vyšetřované tkáni, ve zdravé tkáni převažují TSG nad onkogeny, u nádorových buněk je tomu naopak. Ale i onkogeny kódují proteiny, které jsou nutné pro vývoj zdravé buňky. Mezi nejznámější onkogeny, či tzv. onkogenové rodiny, patří onkogeny kódující transkripční regulační faktory (myc, fos, jun), onkogeny kódující proteinkinázy a receptory růstových faktorů (src, ebr), kódující růstové faktory, signální transduktory (ras), blokující apoptózu (bcl) ajiné.
Nádorové supresory se uplatňují při regulaci buněčného dělení a blokují buněčný cyklus v případě abnormální proliferace nebo poškození genetické informace. Jejich inaktivace má za následek ztrátu kontrolních mechanismů buňky s následnou převahou faktorů podporujících růst a invazivitu, a tím i vývoj nádoru. Často jsou to igeny kódující proteiny extracelulární matrix, strukturální proteiny, adhesiny a inhibitory proteáz. Představiteli TSG jsou geny p53, Rb, cyklin D a mnohé jiné (12, 13). U některých lokalit HNSCC (dutina ústní a orofarynx) je studována role lidského papilloma viru (HPV) jako etiologického činitele (mutagenní akancerogenní efekt) v procesu časné kancerogeneze (14).
Vznik zhoubného nádoru, tzv. vícestupňový proces kancerogeneze, je tedy komplexní děj počínající akumulací molekulárně genetických změn na pozadí nádorového mikroprostředí, ovlivněný do značné míry imunitním systémem. Nastane-li v určité oblasti orgánového systému akumulace genetických změn (posléze vedoucí ke vzniku nádoru), dochází v této tkáni ke změně exprese genů oproti tkáni molekulárně zdravé. Počet genetických změn se zvyšuje od zdravé přes preneoplastickou až po nádorovou tkáň, zdaleka ne vždy ale histologický obraz odpovídá stupni molekulárně genetických změn ve vyšetřované tkáni. Tyto postuláty se opírají o studie, které popisují rozsah klonální expanze molekulárních změn v preneoplastické, histologicky zdravé tkáni v blízkém okolí nádoru souvisejících s procesem časné kancerogeneze a růstem nádoru (15–18).
Od klasické onkologie a onkochirurgie k terapii „šité na míru“
Obor onkologie prodělal v posledních třiceti letech obrovský vývoj, a to zejména s rozvojem chemoterapeutických schémat, vliv na celkové přežití pacientů u některých (zejména solidních) nádorových procesů však zůstal minimální. Spinocelulární karcinom hlavy a krku postihuje v České republice přibližně tisíc pacientů ročně (2), celosvětově tvoří kolem 5 % všech nově diagnostikovaných karcinomů.
Nejčastěji se setkáváme v oblasti hlavy a krku s nádory hrtanu, střední a dolní části hltanu (orofarynx a hypofarynx) a dutiny ústní. Vzácnější jsou procesy nosohltanu, nosních a paranazálních dutin, které se od výše uvedených do určité míry odlišují (rizikové a etiologické faktory, léčebná modalita aj.).
Jedinými specifickými prognostickými faktory rutinně užívanými při plánování terapeutického postupu, jsou v dnešní době, spolu s histopatologickou povahou nádoru (grading), pouze lokalizace a rozsah primárního nádoru, přítomnost regionálních lymfatických a vzdálených metastáz (TNM staging), zavedené do klinické praxe před více než 50-ti lety) (3).
Rozmanitost biologického chování spinocelulárních nádorů a stav či různě nastavená rovnováha imunitního systému jsou ale důvody, proč pacienti diagnostikovaní ve stejném stádiu onemocnění odpovídají odlišně na shodnou léčbu. Existují tedy další prognostické a prediktivní markery, jejichž odhalení pomůže výhledově stratifikovat a individualizovat léčbu u postižených pacientů a ovlivnit zhoubný proces metodami molekulární biologie u jednotlivého pacienta. To je podstatou léčby pojmenované jako „medicína šitá na míru“ (tailored medicine).
Zlatým standardem v terapii HNSCC zůstává i dnes primární chirurgická léčba tumoru, při přítomnosti regionálních metastáz pak doplněná o blokovou krční dissekci, při rozsáhlejších tumorech (T3-4) či přítomnosti regionálních metastáz je v případě operability chirurgická léčba následována adjuvantní onkologickou terapií (radioterapie nebo chemoradioterapie).
V chirurgii ORL oblasti platí, že je nutné zachovat dostatečnou radikalitu resekce při snaze o co největší omezení zbytečně agresivních postupů, které zhoršují funkční výsledky. Kosmetický či funkční hendikep v ORL oblasti je pro pacienta zdravotně i sociálně značně zatěžující (porucha funkce hlavových nervů, ztráta hlasu, problémy s polykáním, asymetrie obličeje a krku aj.), a proto je v některých vyspělých zemích patrný trend preferovat primárně nechirurgická léčebná schémata, založená na kombinaci chemoterapie a radioterapie i při lokálně pokročilé nemoci ve stadiu III-IV (obr. 2).
Obr. 2. Lokálně pokročilý spinocelulární karcinom orofaryngu a dutiny ústní, vycházející z patrové tonzily vpravo. 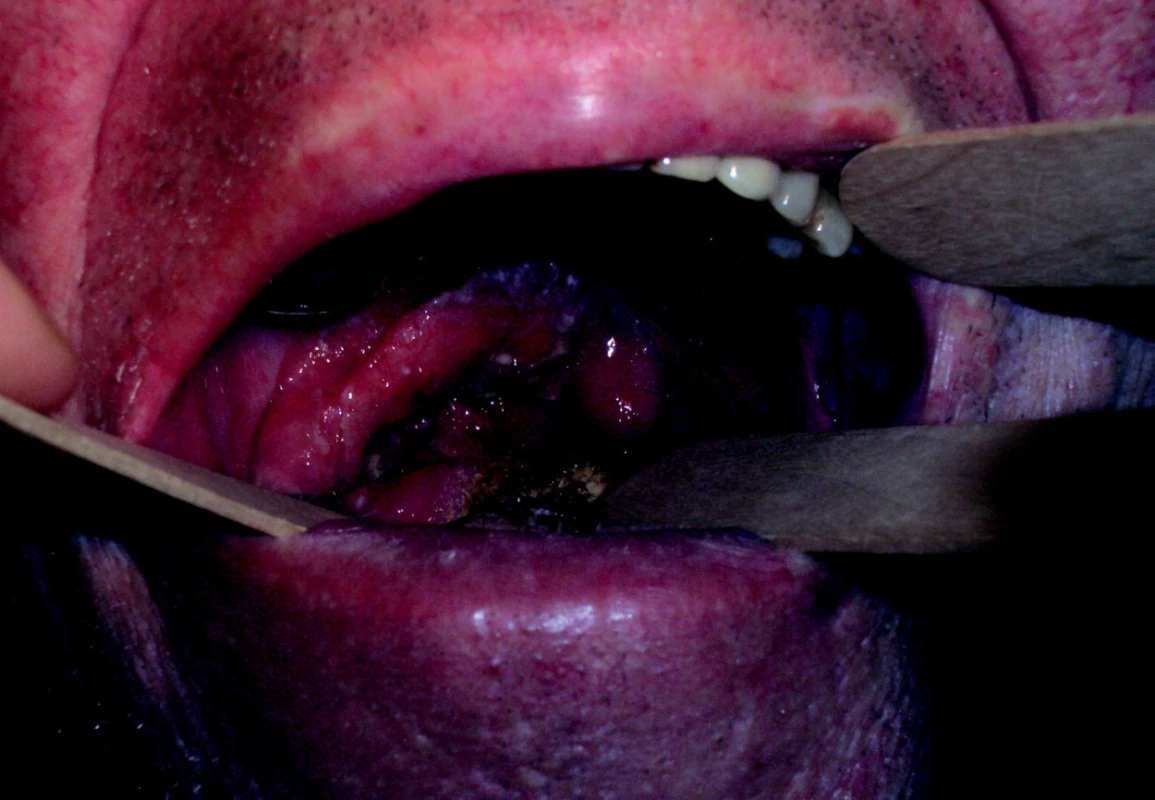
Nakolik je tento trend vyhrazen ekonomicky silným zdravotním systémům je předmětem diskusí na odborných fórech i otázkou pohledu (chirurg, onkolog, ekonom aj.). Zřejmé je ale, že i tato schémata mají svá omezení a nežádoucí efekty, a to zejména vysokou toxicitu a neselektivitu. I proto je velká naděje upřena k molekulárně biologickým terapeutickým postupům, které představují cílený specifický zásah do procesu kancerogeneze a nejsou pro organismus tolik toxické.
Cílem této biologické či molekulárně biologické léčby je zasažení nádorové buňky na úrovni regulačních a signálních proteinů. Již dnes je v klinické praxi několik látek, které můžeme hrubě rozdělit jak podle mechanismu účinku, tak podle charakteru vlastní účinné látky. Jednotlivé molekuly mohou mít různé mechanismy účinku, a jedna látka může být současně řazena do několika podskupin.
Jednou z nich jsou tzv. monoklonální protilátky. Ty představují zatím v praxi nejvíce využívanou skupinu a současně velkou množinu molekul, které mohou zasahovat na nejrůznějších úrovních řízení procesu kancerogeneze v postižené buňce. Monoklonální protilátka je taková, která je tvořena pouze jedním klonem B-lymfocytů a která je zaměřena na jeden konkrétní antigen (při obranné reakci organismu vznikají v těle protilátky polyklonální, které jsou vytvořeny mnoha klony B-lymfocytů a směřovány proti různým antigenům). Monoklonální protilátky mohou být kompetitivními inhibitory receptorů pro růstové faktory (např. EGFR, receptor pro epidermální růstový faktor), mohou být zaměřeny proti tzv. CD antigenům (cluster of differentiation, tzv. diferenciační antigeny, označují se tak membránové antigeny, které mají na povrchu stejnou antigenní determinantu – tzv. epitop), z nichž některé jsou zvýšeně exprimovány na povrchu nádorových buněk (např. CD20 u non-hodgkinského lymfomu, CD52 u chronické lymfatické leukémie, aj.).
Monoklonální protilátka může být využita jako léčivo, které blokuje například receptor pro růstový faktor, signální dráhu pro apoptózu či angiogenezi a/nebo může být využita jako směrující struktura pro jiný typ terapeutika. Je možné konjugovat monoklonální protilátku s toxiny, s radioaktivním izotopem, či přes polymerní nosič s konvenčním cytostatikem. (19, 20). V ORL oblasti je do klinické praxe již zaveden cetuximab (Erbitux), který v kombinaci s radioterapií u lokálně pokročilého karcinomu hlavy a krku zlepšuje přežití o 20 měsíců (prodloužení přežití z 29 měsíců na 49 měsíců, tj. o 68 %) ve srovnání se samotnou radioterapií bez navýšení toxicity, a přibližně o třetinu také snižuje riziko lokoregionálního relapsu (21). Je schválen pro léčbu lokálního a lokálně pokročilého karcinomu hlavy a krku v kombinaci s radioterapií u pacientů s neresekovatelným nádorem a jako monoterapii u pacientů s metastatickým karcinomem po selhání standardní platinové chemoterapie.
Další potencionální monoklonální protilátkou je bevacizumab (Avastin), který selektivně blokuje VEGF (vaskulární endoteliální růstový faktor), vyřazuje jej z vazby na receptor a tak brání angioneogenezi. Klinické použití Avastinu je možné u kolorektálního karcinomu, pro klinické použití v ORL oblasti není registrován (22).
Mezi další skupinu látek využitelných pro cílenou léčbu patří inhibitory tyrosinkináz. Tyrosinkinázy představují širokou skupinu membránových i buněčných enzymů, katalyzujících fosforylaci tyrosinových zbytků. Tak dochází k aktivaci proteinů jednotlivých signálních drah, které se podílejí na přenosu signálu do nitra buňky. Ty jsou za normálních okolností odpovědné za regulaci buněčné proliferace, diferenciace a apoptózy. V procesu kancerogeneze mohou jejich inhibitory ovlivňovat tyto signální dráhy a tak blokovat patologickou proliferaci, angioneogenezi či poruchu dějů nutných k apoptóze buňky.
Existují tři hlavní mechanismy inhibice tyrozinkináz:
- blokádou vazebného místa pro ATP (kompetitivní vazba na vazebné místo pro ATP na intracelulární doméně receptoru a zabránění jeho fosforylaci a přenosu signálu do buňky);
- vazbou na extracelulární doménu receptoru prostřednictvím monoklonálních protilátek (viz výše);
- inhibicí stimulačních ligandů těchto drah.
Z inhibitorů tyrosinkináz se jako nejlepší z těchto cílů u HNSCC jeví inhibitor tyrosinkinázové aktivity signalizační dráhy receptoru pro epidermální růstový faktor (EGFR) gefitinib (Iressa). Pro snadnější orientaci lze říci, že monoklonální protilátky využívané v léčbě nádorových onemocnění mají koncovku –ab (např. cetuximab/Erbitux), zatímco názvy inhibitorů enzymatických reakcí mají koncovku –ib (např. gefitinib/Iressa).
Potenciální způsoby cílené léčby nádorů představují inhibitory matrixmetaloproteinázy, které mohou zablokovat destrukci bazální membrány, a tím zabránit invazívnímu růstu tumoru. Mechanismem jejich účinku je vytvoření komplexu se zinkem, který se podílí na aktivaci matrixmetaloproteináz.
Další skupinu tvoří cykliny, které s cyklin-dependentními kinázami vytvářejí aktivní komplexy a hrají důležitou roli v regulaci buněčného cyklu. Inhibitory cyklin-dependentních kináz mohou zastavit buněčný cyklus a indukovat apoptózu. Ve fázi klinických zkoušek se slibnými výsledky je také inhibitor proteinkinázy-C (enzastaurin), který současně blokuje angiogenezi, buněčnou proliferaci a indukuje apoptózu (19).
Pozornost se zaměřuje i na jiné možnosti ovlivnění kancerogeneze. Velká pozornost se věnuje imunitním mechanismům, protože i když se nějaký preparát jeví jako přínosný, nelze dopředu říci, jak konkrétní pacient na léčbu zareaguje. To je dáno nejenom genetickou výbavou daného jedince, charakteristikami určitého typu nádoru a vlastnostmi léků, důležitou roli hraje nastavení imunitního systému daného jedince v danou chvíli. Proto je taková pozornost věnována procesu vzniku a růstu dlaždicobuněčného karcinomu v oblasti hlavy a krku a jeho ovlivnění imunitním systémem. Je zřejmé, že zastoupení jednotlivých subpopulací buněk imunitního systému přímo souvisí s rozvojem a prognózou onemocnění. Bylo prokázáno, že subpopulace T lymfocytů, tzv. regulační T lymfocyty (CD4+CD25+), přímo korelují s časnou recidivou HNSCC. Analýza zastoupení lymfocytárních subpopulací by mohla být jedním z údajů ovlivňujících naše rozhodování při volbě terapie či plánování dispenzarizace pacienta (20).
V dnešní medicíně je často skloňována individualizace léčby. Je ale zřejmé, že v současnosti nelze vyrábět jeden lék pro jednoho pacienta, ani nelze každého pacienta léčit veškerými dostupnými přípravky, neboť se jedná o velice nákladnou léčbu. Určitá pravidla v rozhodování komu lék podat a komu ne přináší výzkum potenciálních markerů. Obecně vzato, nejstarším markerem mohla být ve starověké medicíně glukóza, respektive její obsah v moči u jedince trpícího diabetem. V dnešní době to jsou nejčastěji proteiny/enzymy (nejsnadněji prokazatelné biochemicky), ale i jejich prekurzory prokazatelné metodami molekulární genetiky (DNA, RNA a další), nebo složitĕjší molekuly, např. proteoglykany (23-25). Markery v užším slova smyslu mohou být exprimovány pouze určitou částí nádorových buněk, u jednotlivých pacientů různě významně zastoupených. Ale ani tehdy není úplně jisté, že když některý pacient, respektive jeho nádorové buňky ve zvýšené míře exprimují onen marker, bude léčba úspěšná.
HNSCC a genová exprese, využití biočipu a real-time PCR
Při studiu exprese genů je zásadní porovnání exprese genů ve zdravé a v patologické tkáni. Zajímavé je ale také sledovat genovou expresi ve tkáni přilehlé k nádoru, která je, jak bylo uvedeno výše, histologicky normální, ale molekulárně již prokazatelně patologická. Pro zjednodušení lze říci, že při studiu exprese genů je třeba nejprve izolovat RNA, poté ji převést reverzní transkripcí na stabilnější cDNA (komplementární DNA je tedy jakýmsi otiskem exprimovaného genu) a tuto detekovat kvalitativně (např. biočip) či semikvantitavně (např. real-time PCR). Porovnáním výsledků mezi tkání zdravou a patologickou se určí, nakolik je daný gen v jednotlivé tkáni exprimován.
Biočip si můžeme představit jako mikrodestičku (umělohmotná destička, sklíčko aj.), kde na ploše řádově několika mm² je možné identifikovat hybridizačním procesem mezi na destičce navázanými sondami a zkoumanou a zároveň např. fluorescenčně značenou komplementární DNA až několik desítek tisíc genů. Jsou k dispozici komerčně vyráběné „screeningové“ biočipy pro celý genom (tzv. profil genové exprese v genomickém měřítku) i pro některé podoblasti výzkumného zájmu, například „onkologické“ biočipy, biočipy pro studium polymorfismu vybraných genů (cytochrom P450 aj.) pro účely farmakogenetiky a jiné.
Dalším způsobem je tzv. real-time PCR (někdy zkracováno RT-PCR, ale pozor, tak se označuje i reverzní transkripce, tedy zpětný přepis RNA na komplementární DNA, která je nicméně také nutná k provedení samotné real-time PCR), tedy polymerázová řetězová reakce v reálném čase. Tato metoda umožňuje semikvantitavní analýzu exprese genů na základě sledování zvyšující se fluorescence označené zkoumané cDNA při polymerázové řetězové reakci srovnáním se standardně exprimovaným genem (tzv. housekeeping gen, který je ve zdravé i patologické buňce exprimován ve stejné míře) a standardním genetickým materiálem (např. buněčná linie). Existují i složitější a náročnější analýzy výsledku genové exprese na podkladě tzv. proteomiky, která se zabývá identifikací jednotlivých proteinů kódovaných genomem, jejich vzájemnými interakcemi a stanovením jejich trojrozměrné struktury.
Na podkladě analýzy pomocí biočipu a real-time PCR získaných výsledků je možné určit tzv. target geny, tedy ty, které jsou ve zvýšené míře exprimovány v nádorové či přednádorové tkáni. Za předpokladu, že v histologicky normální tkáni přilehlé k nádoru jsou přítomny molekulárně genetické změny, vede další akumulace genetických změn k transformaci zdravé buňky v maligní, nádorovou tkáň. Akceptujeme-li teorii klonální expanze, tedy že je molekulárně alterována i histologicky zdravá tkáň v těsném okolí nádoru, pak srovnání míry exprese genu mezi molekulárně postiženou tkání (v těsném okolí nádoru) a molekulárně zdravou tkání (odebranou v dostatečné vzdálenosti od nádoru) může určit potenciální target geny, které jsou zapojeny do časných fází kancerogeneze.
Rozpoznání těchto genů časné kancerogeneze by napomohlo například časnějšímu záchytu druhého primárního tumoru, který se v ORL oblasti vyskytuje relativně často. V budoucnu přispějí tyto poznatky k optimálnímu cílení biologické léčby v časných stadiích kancerogeneze u dosud obtížně terapeuticky ovlivnitelných nádorových stavů ale i při časné detekci rekurencí. Kombinace biochipové technologie s real-time PCR se jeví jako vhodná kombinace studia procesu kancerogeneze, zejména pak jeho časných fází, a to u spinocelulárního karcinomu hlavy a krku, který představuje ideální model solidního nádoru pro studium časné kancerogeneze.
Závěr
Při studiu mechanismů vzniku a progrese nádorového bujení je nezbytná dobrá spolupráce mezi klinickým a výzkumným pracovištěm. V některých západních zemích je běžné, že student medicíny zakončí své pregraduální vzdělání dizertací podloženou publikací v renomovaném časopise. Takto nastavená spolupráce na jedné straně pomáhá pozdějším klinickým pracovníkům k detailnějšímu seznámení s vědou a výzkumem a na straně druhé nutí ke kombinaci jiných způsobů řešení problémů, různých metodických přístupů a v neposlední řadě i k nastolení úzké spolupráce v rámci řešitelského kolektivu. Tak například v sousedním Německu může sice lékař bez dizertace vykonávat lékařské povolání, ale nepřísluší mu respektovaný titul Dr. med. (obdoba titulu MUDr., který v Česku získáváme automaticky s poslední státní zkouškou, německý lékař bez dizertace používá označení Arzt/lékař, bez titulu).
Tento fungující systém (sám bych ale, býti ještě studentem, našel mnoho důvodů proti …) sice v České republice ještě nemáme, ale v posledních letech vzrůstá trend, kdy dochází k většímu zapojení klinických pracovišť do vědeckého výzkumu. Tato spolupráce je do určité míry vynucena systémem hodnocení klinik v rámci fakult, ale je to dáno též nárůstem počtu postgraduálních studentů, kteří přispívají ke zvýšení povědomí o vědeckém výzkumu na svých mateřských pracovištích. Věda a klinická práce by samozřejmě neměly koexistovat nezávisle na sobě, ale spíše se vzájemně obohacovat a přispívat k aplikaci nových vědeckých do klinické praxe, což se naštěstí v posledních letech v některých univerzitních centrech i v České republice daří.
Věříme, že tyto poznatky umožní v blízké budoucnosti časně diagnostikovat i účinně terapeuticky zasáhnout spinocelulární karcinom hlavy a krku u pacientů, kteří jsou z dosud neznámých příčin neodpovídají na dnes standardně zavedená terapeutická schémata. Možná se tak, jako chirurgové, nevědomky do budoucna připravujeme o velkou část našich výkonů (obr. 3), ale poznat mechanismy časné kancerogeneze a moci účinně zasáhnout biologickou léčbou za to jistě stojí.
Obr. 3. Pohled zvnějšku do nitra hltanu (šipka) při klasické operaci pro karcinom kořene jazyka s krčním metastazováním (tzv. laterální faryngotomie s blokovou krční dissekcí). 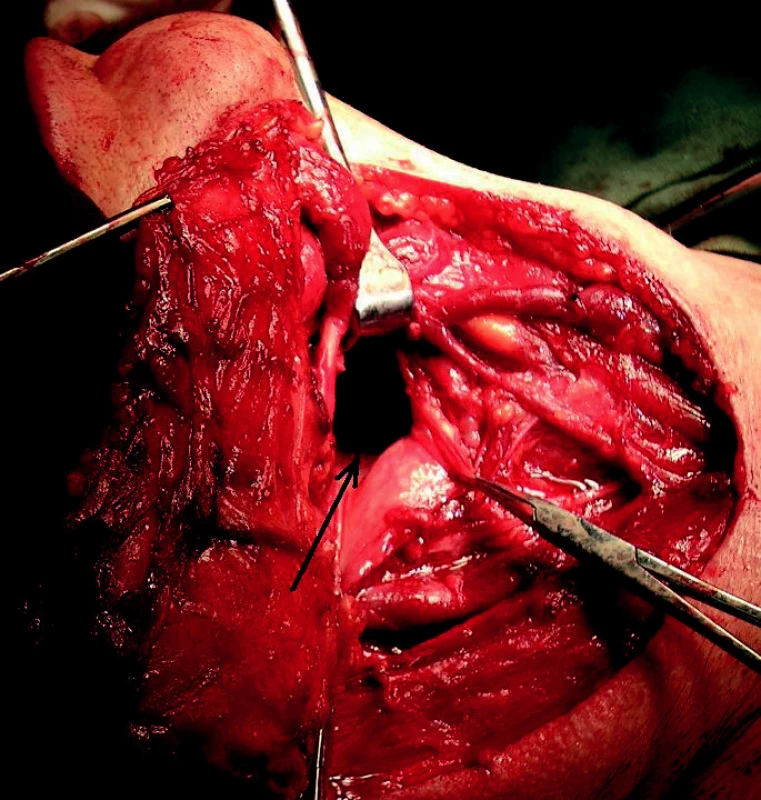
Článek byl podpořen grantem GAUK 203435 - 36/06, IGA MZ ČR č. 8883–3 a Národním programem výzkumu II 2B06106.
MUDr.Jan Kastner
Klinika otorhinolaryngologie a chirurgie hlavy a krku 1. LF UK, FN v Motole
V Úvalu 84, 150 06 Praha 5 – Motol
E-mail: jkastner@email.cz ,
jkastner@uni-mainz.de
Zdroje
1. Smart, A., Martin, P., Parker, M. Tailored medicine: whom will it fit? The ethics of patient and disease stratification. Bioethics 2004, 18(4), p. 322-342.
2. Statistická ročenka ČR 2002. Zemřelí podle příčin smrti.
3. Chiesa, F., Tradati, N., Mauri, S. et al. Prognostic factors in head and neck oncology: a critical appraisal for use in clinical practice. Anticancer Res. 1998, 18(6B), p. 4769-4776.
4. Esser, D., Anke, S., Roessner, A., Freigang, B. Second carcinomas in cancers of the mouth cavity, pharynx and larynx. Clinical, histopathologic and cell kinetic findings. Laryngorhinootologie 2000, 79(8), p. 478-482.
5. Muir, C., Weiland, L. Upper aerodigestive tract cancers. Cancer 1995, 75 (1 Suppl), p. 147-153.
6. Chamberlain, R.M., Williams, B., Pajak, T.F. et al. The impact of smoking status, disease stage, and index tumor site on second primary tumor incidence and tumor recurrence in the head and neck retinoid chemoprevention trial. Cancer Epidemiol. Biomarkers Prev. 2001, 10(8), p. 823-829.
7. Greenlee, R.T., Hill-Harmon, M.B., Murray, T., Thun, M. Cancer statistics, 2001 CA Cancer J. Clin. 2001, 51(1), p. 15-36.
8. Tabor, M.P., Brakenhoff, R.H., Ruijter-Schippers, H.J. et al. Multiple head and neck tumors frequently originate from a single preneoplastic lesion. Am. J. Pathol. 2002, 161(3), p. 1051-1060.
9. Slaughter, D.P., Southwick, H.W., Smejkal, W. Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin. Cancer 1953, 6(5), p. 963-968.
10. Braakhuis, B.J., Tabor, M.P., Kummer, J.A. et al. A genetic explanation of Slaughter´s concept of field cancerization: evidence and clinical implications. Cancer Res. 2003, 63(8), p. 1727-1730.
11. Braakhuis, B.J., Tabor, M.P., Leemans, C.R. et al. Second primary tumors and field cancerization in oral and oropharyngeal cancer: molecular techniques provide new insights and definitions. Head Neck 2002, 24(2), p. 198-206.
12. Brdička, R. Lidský genom na přelomu tisíciletí. Praha: GRADA, 2001.
13. Kolář Z. a kol. Molekulární patologie nádorů. Olomouc: EPAVA, 2003.
14. Tachezy, R., Klozar, J., Saláková, M. et al. HPV and other risk factors of oral cavity/oropharyngeal cancer in the Czech Republic. Oral Dis. 2005, 11(3), p. 181-185.
15. Brieger, J., Jacob, R., Riazimand, H.S. et al. Chromosomal aberrations in premalignant and malignant squamous epithelium. Cancer Genet. Cytogenet. 2003, 144(2), p. 148-155.
16. Brieger, J., Kastner, J., Gosepath, J., Mann, W.J. Evaluation of microsatellite amplifications at chromosomal locus 3q26 as surrogate marker for premalignant changes in mucosa surrounding head and neck squamous cell carcinoma. Cancer Genet. Cytogenet. 2006,167(1), p. 26-31.
17. Califano, J., van der Riet, P., Westra, W. et al. Genetic progression model for head and neck cancer: implications for field cancerisation. Cancer Res. 1996, 56(11), p. 2488-2492.
18. Nagpal, J.K., Das, B.R. Oral cancer: reviewing the present understanding of its molecular mechanism and exploring the future directions for its effective management. Oral Oncol. 2003, 39(3), p. 213-221.
19. Halámková, J., Šmardová, J., Pour, L. a kol. Nové léky v onkologii. Postgraduální medicína (Praha), 2008, 10(3), s. 336-344.
20. Boucek, J., Chovanec, M., Kuchar, M. et al. Head and neck squamous cell carcinoma and regulatory T cells. 12th World Congress on Advances in Oncology and 10th International Symposium on Molecular Medicine, October 11-13, 2007.
21. Bonner, J.A., Harari, P.M., Giralt, J. et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck. N. Enol. J. Med. 2006, 354(6), p. 567-578.
22. Mechl, Z., Neuwirthová, J., Burkoň, P. a kol. Současné možnosti léčby karcinomů hlavy a krku. Farmakoterapie (Praha) 2008, 4(2), s. 213-220.
23. Betka, J., Plzák, J., Smetana, K. Jr., Gabius, H.J. Galectin-3, an endogenous lectin, as a tool for monitoring cell differentiation in head and neck carcinomas with implications for lectin-glycan functionality. Acta Otolaryngol. 2003, 123(2), p. 261-263.
24. Plzák, J., Smetana, K. Jr., Chovanec, M., Betka, J. Glycobiology of head and neck squamous epithelia and carcinomas. ORL J. Otorhinolaryngol. Relat. Spec. 2005, 67(2), p. 61-69.
25. Cada, Z., Boucek, J., Dvoranková, B. et al. Nucleostemin expression in squamous cell carcinoma of the head and neck. Anticancer Res. 2007, 27(5A), p. 3279-3284.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Urticaria solarisČlánek Hospicová péče v OlomouciČlánek Spolek lékařů v PlzniČlánek JUBILEAČlánek Beautiful pro zdravé srdceČlánek Aktuality
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2008 Číslo 9- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Časná kancerogeneze u spinocelulárního karcinomu hlavy a krku
- Neinvazivní ventilace v intenzivní péči
- Neinvazivní ventilace – snížení rizika ventilátorové pneumonie Komentář k článku Herold I. Neinvazivní ventilace v inten
- Kompresivní neuropatie jako profesionální onemocnění
- Spirituální péče ve zdravotnictví
- Double flap plastika vysoké rektoanální píštěle
- Urticaria solaris
- Hospicová péče v Olomouci
- Výroky nemocných, které mohou stresovat zdravé
- Neodkladné operace štítné žlázy – dvě kazuistiky
- Aneurysma v místě akutního uzávěru pravé koronární tepny prezentující se akutním infarktem myokardu spodní stěny levé komory
- Idiopatická trombóza jugulární žíly
- Miniportréty slavných českých lékařů Docent MUDr. Karel Šilink – vůdčí představitel české endokrinologie
- Cena Josefa Hlávky za rok 2007 udělena
- Spolek lékařů v Plzni
- Inteligentní formuláře 602XML – nástroj odbourávání byrokratických činností ve zdravotnictví
- První evropská implantace zařízení Promote RF na úpravu srdečního rytmu
- MEDIN představí inovace v artroskopii
- JUBILEA
- Nový přístroj BTL pro aplikaci rázové vlny
- Beautiful pro zdravé srdce
- Oceněná vrtačka Acculan 3Ti mini míří do českých nemocnic
- Aktuality
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Idiopatická trombóza jugulární žíly
- Kompresivní neuropatie jako profesionální onemocnění
- Neinvazivní ventilace v intenzivní péči
- Double flap plastika vysoké rektoanální píštěle
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



