Molekulární cytogenetika v diagnostice genetických abnormalit u karcinomu děložního hrdla
Molecular cytogenetics in diagnostics of genetic abnormalities in cervical carcinoma
The oncogynecological guideline of cervical cancer treatment is mainly based on conventional histopathological prognostic factors. According to available studies, it seems that genetic defects and specific chromosomal aberrations can cause gene expression deregulation and so play an important role in the origin and the development of cervical intraepithelial neoplasia and influence the progression to cervical cancer. Especially the amplification of the human telomerase gene hTERC (3q26) and protooncogene MYCC (8q24) are associated with the progression. This study reviews the recent knowledge of the chromosomal aberration role in cervical carcinoma development and describes the multicolor HPV-FISH technique as molecular cytogenetic technique that allows common identification of HPV infected cells and amplification of the hTERC a MYCC genes in premalignant cervical dysplasia and cervical cancer cytology specimens. The test results enable to determine which samples carry high risk HPV infection and chromosomal aberrations with potential to progression in invasive cervical carcinoma. Detection of these new genetic markers can contribute to individualized targeted treatment and clarify follow-up.
Key words:
diagnostics of genetic abnormalities – cervical carcinoma/cancer – cervical intraepithelial neoplasia –molecular cytogenetics – human telomerase gene hTERC (3q26) – protooncogene MYCC (8q24)
Autoři:
Petr Kuglík 1,2; Anna Laštůvková 1,2; Vladimíra Vallová 1,2; Kateřina Kašíková 1,2; Lucie Mouková 3
Působiště autorů:
Ústav experimentální biologie, Přírodovědecká fakulta, Masarykova Univerzita, Brno, vedoucí pracoviště prof. RNDr. Jan Šmarda, CSc.
1; Oddělení lékařské genetiky, Fakultní nemocnice, Brno, primářka prim. MUDr. Renata Gaillyová, Ph. D.
2; Oddělení gynekologické onkologie, Masarykův onkologický ústav, Brno, primář MUDr. Josef Chovanec, Ph. D.
3
Vyšlo v časopise:
Prakt Gyn 2013; 17(1): 53-57
Kategorie:
Onkogynekologie: Původní článek
Souhrn
Standardy léčby karcinomu děložního hrdla vycházejí zejména z klasických prognostických histopatologických faktorů. Dle dostupných studií se zdá, že genetické defekty a specifické chromozomové abnormality mohou způsobovat deregulaci genové exprese a hrát důležitou roli při vzniku a vývoji intraepiteliálních cervikálních neoplazií a ovlivnit progresi do karcinomu děložního hrdla. S progresí jsou asociovány zejména amplifikace protoonkogenu MYCC (8q24) a amplifikace genu pro lidskou telomerázu hTERC (3q26). Práce shrnuje současné poznatky o úloze chromozomových abnormalit při vzniku karcinomu děložního hrdla a popisuje techniku vícebarevné HPV-FISH jako molekulárně cytogenetickou metodu, která umožňuje simultánně identifikovat buňky infikované HPV a amplifikace genů hTERC a MYCC u vzorků prekancerózních cervikálních intraepiteliálních lézí a karcinomu děložního hrdla. Výsledky vyšetření umožňují stanovit, které vzorky obsahují vysoce rizikovou infekci HPV a chromozomové aberace spojené s potenciálem progrese a nádorového bujení. Detekce těchto nových genetických markerů by mohla přispět k individualizovanému zacílení léčby a upřesnit follow-up.
Klíčová slova:
diagnostika genetických abnormalit – karcinom děložního hrdla – intraepiteliální cervikální neoplazie – molekulární cytogenetika – protoonkogen MYCC (8q24) – gen pro lidskou telomerázu hTERC (3q26)
Úvod
Problematice karcinomu děložního hrdla je věnována stále větší pozornost. V České republice je každoročně nově diagnostikováno cca 1 200 nových případů a umírá cca 400 žen za rok. Incidence se pohybuje kolem 19/100 000 žen a mortalita 7/100 000 žen (ÚZIS ČR 2007). Vzniku karcinomu děložního hrdla předcházejí různé stupně histopatologických přednádorových abnormalit – cervikálních intraepiteliálních neoplazií (CIN). Za hlavní etiologický faktor těchto změn je v současné době považována infekce lidským papilomavirem (Human Papillomavirus – HPV) v oblasti transformační zóny děložního hrdla. U člověka se vyskytuje cca 120 typů HPV, z toho 40 v genitoanální oblasti [1]. Dle onkogenního potenciálu rozdělujeme lidské papilomaviry na high risk HPV (typ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) a low risk HPV (typ 6, 11, 34, 40, 42, 43, 44, 54, 70, 72, 74, 81). Na vzniku karcinomu děložního hrdla se podílí zejména HPV typ 16 a typ 18 (cca 70 %) a HPV typy 31, 33, 45, 52 a 58 (cca 20 %). Úspěšnost rozvoje infekce HPV závisí na vnímavosti hostitele, délce kontaktu a dávce HPV. K rizikovým faktorům patří větší počet sexuálních partnerů, časné zahájení sexuálního života před 16. rokem, multiparita (zejména 3 a více porodů), nízký věk prvního porodu, kouření cigaret, koincidence sexuálně přenosných chorob (např. chlamydie, herpesviry), malou měrou i věk ženy, rodinná zátěž (při postižení matky i dcery je RR 2–3), diety s nedostatkem vitaminu C, beta-karotenu, folátů a další. Při oslabeném imunitním systému (stres, imunoterapie) se zejména high-risk HPV zabudují do genomu buněk hostitele, kde odstartují proces přednádorové až nádorové transformace [1,2,3].
Standardizované terapeutické onkogynekologické postupy karcinomu děložního hrdla vycházejí z klasických prognostických faktorů, jako je velikost nádoru, hloubka stromální invaze, histopatologický typ nádoru, metastatické postižení lymfatických uzlin, velikost resekční linie a dalších. Nalezením nových prognostických genetických markerů by bylo možno blíže specifikovat chování zhoubných nádorů a přednádorových lézí. U cervikálních karcinomů se obdobně jako u jiných typů solidních nádorů setkáváme se specifickými chromozomovými abnormalitami, které mohou způsobovat deregulaci genové exprese, a tak iniciovat vznik a vývoj nádorů. Chromozomové změny související s progresí mírných dysplazií (CIN I) do vyšších stadií prekanceróz (CIN II a CIN III) a cervikálního karcinomu jsou asociovány zejména s amplifikací protoonkogenu MYCC (8q24) [4] a genu pro lidskou telomerázu hTERC (3q26), obr. 1 [5].
Úloha amplifikace genů hTERC a MYCC a dalších chromozomových změn při vzniku a vývoji intraepiteliálních cervikálních neoplazií (CIN) a karcinomu děložního hrdla
Gen hTERC kódující RNA podjednotku lidské telomerázy se nachází na 3. chromozomu v oblasti 3q26. Enzym telomeráza je zodpovědný za udržování stabilní délky telomer a v aktivním stavu propůjčuje buňkám nesmrtelnost. V průběhu uplynulých let bylo opakovaně prokázáno, že amplifikace genu hTERC je klíčovým faktorem v deregulaci tohoto genu vedoucí k progresi z nižších stadií prekanceróz (CIN I) na vyšší (CIN II, CIN III) a dále na invazivní karcinom [5]. Již v roce 1997 prokázali Heselmeyer et al u pokročilých stadií karcinomu specifické rekurentní chromozomové aberace, zejména zisky dlouhého raménka chromozomu 3 (3q) [6]. S dalšími provedenými studiemi bylo opakovaně zjištěno, že míra amplifikace genu hTERC vykazuje rostoucí trend s progresí lehčích dysplazií v karcinom. Tak například Jin et al prokázali amplifikaci genu hTERC u 18,2 % vzorků ve stadiu CIN I, u 66,7 % pacientek ve stadiu CIN II, u 84,6 % ve stadiu CIN III a u všech žen s prokázaným dlaždicobuněčným karcinomem (squamous cell carcinoma – SCC) [7]. Podobně Chen et al v roce 2012 detekovali pomocí metody fluorescenční in situ hybridizace (fluorescence in situ hybridization – FISH) amplifikaci genu hTERC u 9,2 % žen ve stadiu CIN I, u 17,2 % ve stadiu CIN II, u 76,2 % ve stadiu CIN III a ve 100 % případů u SCC [8]. Nejen z výše uvedených studií, ale i mnoha dalších prací je zřejmé, že stanovení amplifikace genu hTERC může být užitečným genetickým markerem k predikci progrese cervikálních lézí v invazivní karcinom.
Amplifikace a zvýšená exprese buněčných protoonkogenů ze skupiny MYC genů je jednou z nejčastěji pozorovaných genetických změn u většiny solidních nádorů [9]. Zvýšená exprese těchto genů vede k neregulované buněčné proliferaci. Například amplifikace genu MYCN (2p24.3) je často pozorovaným jevem u dětského nádoru – neuroblastomu [10]. S vývojem karcinomu děložního hrdla souvisí amplifikace genu MYCC v oblasti 8q24. Protoonkogen MYCC kóduje transkripční faktor, který spolu s dalšími buněčnými proteiny reguluje buněčnou proliferaci a diferenciaci. Jako transkripční faktor se MYCC protein váže mimo jiné na promotor genu hTERT (gen pro reverzní transkriptázu telomerázy), který nese více vazebných míst pro MYCC. Gen MYCC je exprimován jak u vzorků všech stadií CIN, tak v buňkách invazivního karcinomu. Liší se pouze míra exprese podle závažnosti onemocnění [11]. Ve studii Gilijowa et al z roku 2001 bylo prokázáno, že existuje rozdíl v počtu kopií genu MYCC mezi stadii CIN I, CIN II, CIN III, CIS, a tedy že amplifikace genu MYCC není významná jen v procesu progrese samotného tumoru, ale už v buněčné transformaci u prekanceróz [4]. Podobně Chen et al zaznamenali amplifikaci genu MYCC u 31 % vzorků ve stadiu CIN I, v 71,4 % ve stadiu CIN II, v 81,8 % ve stadiu CIN III a u SCC ve 100 % [7]. Prognostický význam genu MYCC byl ověřován např. i u karcinomu prsu a plic, u nichž bývá nalezena amplifikace MYCC asi u 20 % případů a je spojena se špatnou prognózou (viz např. http://lem.ocol.cz/cs/info/gen-c-myc).
Amplifikace genu hTERC a MYCC však nejsou jediné chromozomové změny související se vznikem a vývojem karcinomu děložního hrdla. Se zavedením celogenomových analýz nádorových genomů pomocí techniky komparativní genomové hybridizace (comparative genomic hybridization – CGH) a zvláště s využitím DNA-čipů (array-CGH) se významným způsobem posunula citlivost určování genetických změn u jednotlivých typů solidních nádorů včetně karcinomu děložního hrdla. Vedle amplifikace genu hTERC, která je již zmiňovanou nejčastější genetickou změnou u tohoto typu nádoru, byly ve studiích nalezeny ztráty genetického materiálu (delece) na chromozomech 3p, 11q, 6q a 10q [12]. Další genetické změny pozorované u pacientek v pozdních stadiích spinocelulárního karcinomu jsou zisky na chromozomech 1q, 5p, 6p a 20. Ke ztrátám genetického materiálu dochází v pokročilých stadiích SCC nejčastěji v oblastech 2q, 3p, 4, 8p a 13q [13]. Ve studii Oh et al byly popsány rozdíly ve změnách v počtu kopií DNA-sekvencí v oblastech 5q35.3 a 2q14.3 mezi skupinou mírné až střední dysplazie CIN I a CIN II a mezi středními až těžkými dysplaziemi CIN II a CIN III. Značné rozdíly v počtu kopií DNA-sekvencí mezi nálezem CIN III a spinocelulárním karcinomem byly pozorovány též v oblastech 1q24.3, 3p14.2, 5q13.2, 7p15.3, 7q22.1 a 13q23.3 [13]. Změny, které jsou detekovány s progresí CIN v karcinomu, mohou být způsobeny pozitivní klonální selekcí maligních aberantních buněk. Lee et al (2012) porovnávali celogenomové profily array-CGH mezi cytologickým nálezem HSIL (high grade cervical squamous intraepithelial lesion) a SCC. Identifikovali zisky genetického materiálu na chromozomech 11q12.3 a 2q24.1 u obou skupin žen. Zvýšené množství počtu kopií DNA sekvencí v oblastech 16p12p13 a 20q11q13 byly detekovány pouze u HSIL. Naopak jen u SCC byly zaznamenány zisky počtu kopií DNA-sekvencí v oblastech 1q25.3 a 3q23q29 [14].
Technika fluorescenční hybridizace in situ (FISH) v diagnostice genetických abnormalit u karcinomu děložního hrdla
Nezbytným předpokladem pro cytogenetické vyšetření solidních nádorů je v současnosti analýza chromozomových odchylek metodami molekulární cytogenetiky. Široké využití má zejména modifikace techniky FISH, která umožňuje sledovat strukturní i početní změny chromozomů v interfázních buňkách solidních nádorů bez nutnosti kultivace (I-FISH).
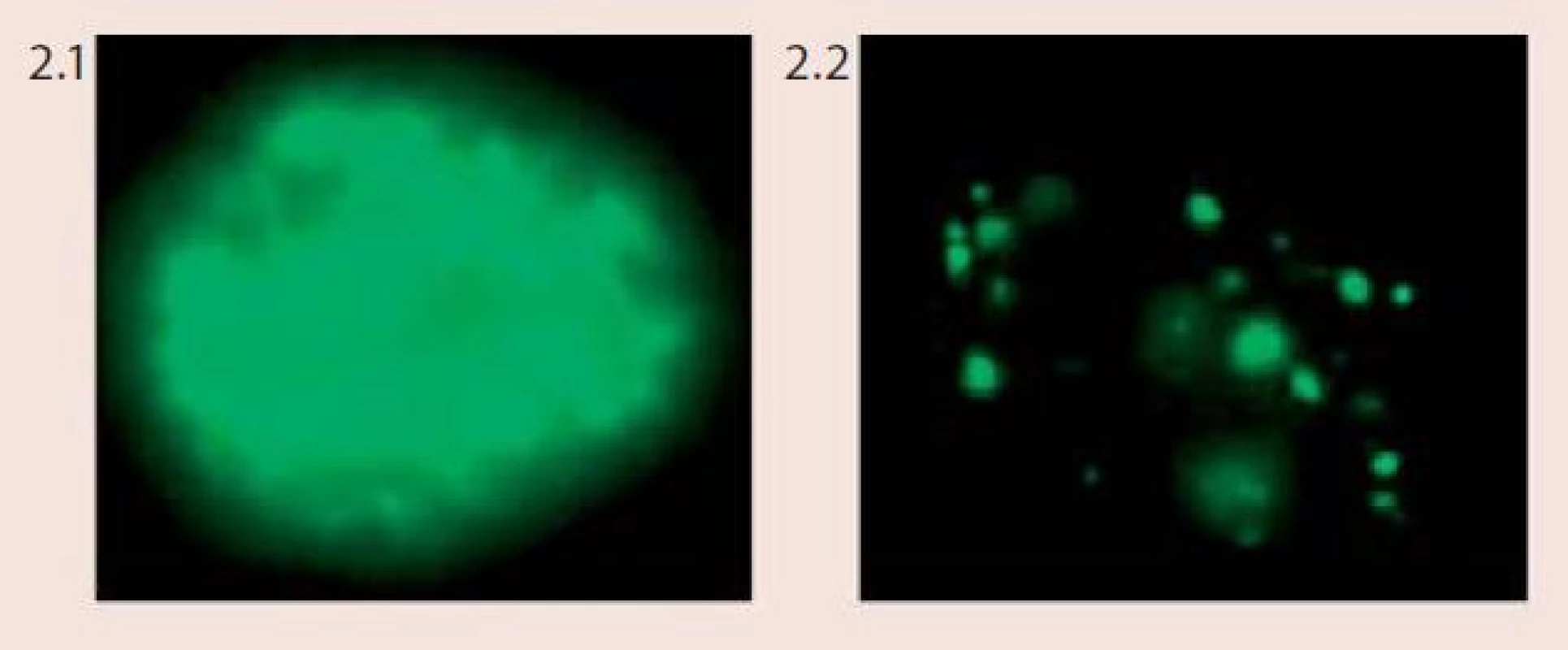
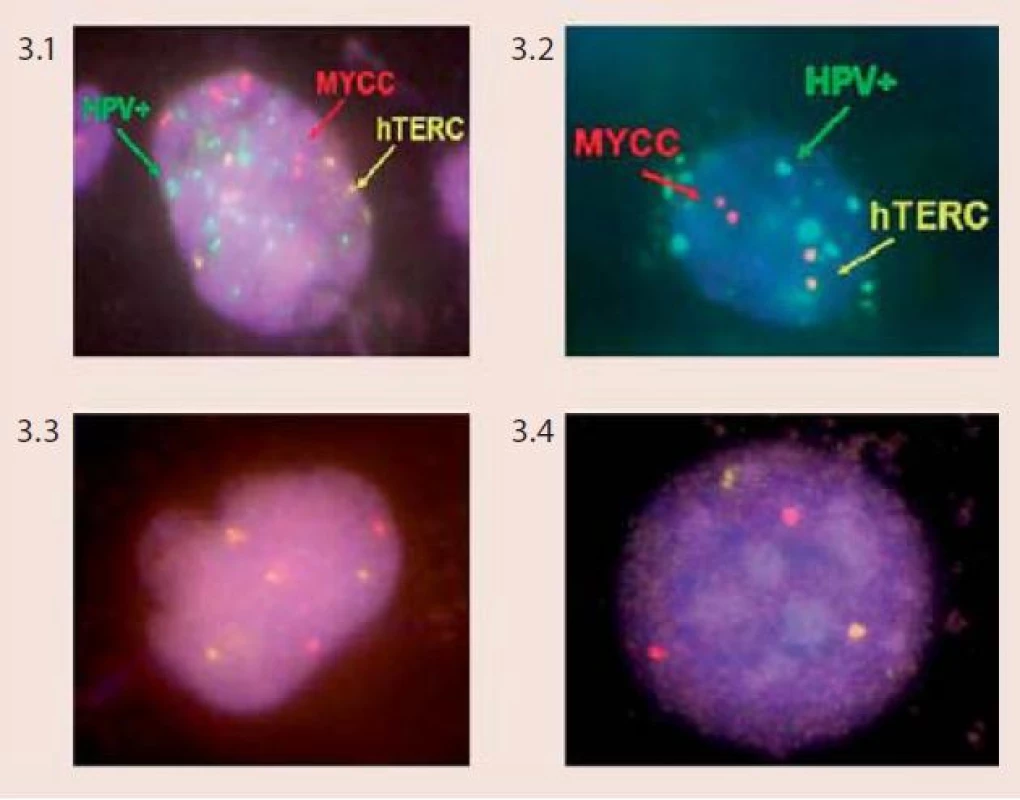
Technika FISH je založena na hybridizaci fluorescenčně značené DNA sondy s cílovými místy na chromozomech na základě jejich komplementarity. Pomocí vhodných centromerických a genově specifických DNA sond můžeme vyšetřovat specifické početní i strukturní chromozomové aberace v jednotlivých buňkách či v klonech nádorových buněk, a to dokonce v úzké korelaci s morfologickou či imunologickou charakteristikou nádoru nebo zpětně z archivovaného patologického materiálu. Pro vyšetření chromozomových abnormalit u dysplazií a karcinomu děložního hrdla byl vyvinut specifický mix DNA-sond firmou Abbott/Vysis – Vysis Cervical FISH Probe Kit. Tento kit umožňuje simultánní detekci změn počtu kopií genů MYCC a hTERC a zároveň také identifikaci buněk infikovaných virem HPV u cytologických vzorků děložního hrdla (tzv. vícebarevná HPV-FISH) pomocí fluorescenčního mikroskopu. Sondy pro detekci HPV jsou značeny biotinem a při jejich použití při in situ hybridizaci reagují s buňkami, které jsou infikovány vysoce rizikovými typy HPV. Sondy spolehlivě detekují následující typy HPV – HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68. Na základě charakteru výsledného zbarvení jsme schopni u infikovaných buněk odlišit, zda je virus v epizomálním stavu či je již integrovaný v genomu buněk (obr. 2). Lokusově specifická sonda hTERC o velikosti 495 kb hybridizuje s oblastí 3q26 a je značena žlutě. Lokusově specifická sonda pro gen MYCC je značena červeně a hybridizuje s oblastí na chromozomu 8q26 o velikosti 821 kb. V buňkách se hodnotí přítomnost a množství kopií signálů pro geny hTERC a MYCC a pozitivita či negativita buněk se zaměřením na průkaz HPV-infekce. Za negativní nález považujeme buňky bez amplifikace jednoho či druhého genu, bez přítomnosti lidského papilomaviru. Mikroskopicky pozorujeme v buněčném jádře 2 červené a 2 žluté signály. Kritéria pro hodnocení pozitivních nálezů a klasifikace pacientek do jednotlivých rizikových skupin podle přítomnosti chromozomových aberací jsou komplexnější, založeny na kombinaci jednotlivých faktorů (obr. 3).
Závěr
Karcinom děložního hrdla představuje v České republice stále závažný problém. Přes dostupný cervikální screening se incidence i mortalita onemocnění příliš nemění a jejich hodnotami se řadíme k hodnotám rozvojových zemí. Z těchto důvodů je naší snahou analyzovat nové genetické markery vzniku a progrese tohoto onemocnění. Na základě současných znalostí o genetických změnách u cervikálních intraepiteliálních neoplazií a karcinomu děložního hrdla lze shrnout, že vyšetření amplifikace genů hTERC, MYCC a dalších chromozomových abnormalit poskytuje u jednotlivých pacientek klinicky důležité informace o potenciálu transformace z mírných přednádorových změn do těžkých cervikálních neoplazií a zároveň prohlubuje znalosti o úloze genetických abnormalit v patogenezi vzniku a progresi karcinomu děložního hrdla. Od roku 2009 probíhá ve spolupráci s MOÚ v Brně pilotní projekt zaměřený na uplatnění cytogenetického vyšetření u pacientek s tímto typem onemocnění. V rámci našeho projektu byly doposud odebrány a vyšetřeny cytologické vzorky u 120 pacientek s cervikálními intraepiteliálními neoplaziemi a karcinomem děložního hrdla. Naše předběžné výsledky naznačují, že amplifikace genu hTERC může predikovat horší prognózu u pacientek se závažnou prekancerózou a karcinomem děložního hrdla. Dle našeho názoru by potenciální zařazení detekce amplifikace genu hTERC mezi nové prognostické faktory karcinomu děložního hrdla mohlo v budoucnu ovlivnit proces rozhodování v managementu léčby. U vysoce rizikových pacientek by mohl být zvolen primárně agresivnější léčebný postup a intenzivnější follow-up. U pacientek v nízkém riziku by mohla být snížena radikalita léčby, čímž bychom docílili snížení pooperační morbidity a zachování kvality života. Další výzkum v této genetické oblasti může blíže specifikovat biologické chování zhoubných nádorů děložního hrdla.
Práce byla podpořena projektem vědecko-výzkumného záměru Ministerstva zdravotnictví České republiky FUNDIN MZ0 MOÚ 2005 a grantovým projektem IGA MZ NT 11089–4/2010
Doručeno do redakce dne 18. března 2013
Přijato po recenzi dne 5. dubna 2013
MUDr. Lucie Mouková, Ph.D.
moukova@mou.cz
Oddělení gynekologické onkologie, Masarykův onkologický ústav, Brno
www.mou.cz
doc. RNDr. Petr Kuglík, CSc.
Bc. Anna Laštůvková
RNDr. Vladimíra Vallová, Ph.D.
Mgr. Kateřina Kašíková
Oddělení lékařské genetiky FN Brno
www.fnbrno.cz
Ústav experimentální biologie PřF MU, Brno
www.sci.muni.cz
Zdroje
1. Barr E, Sings HL. Prophylactic HPV vaccines: New interventions for cancer kontrol. Vaccine 2008; 26(49): 6244–6257.
2. Freitag P. Rizikové a prognostické faktory gynekologických zhoubných nádorů. Moderní gynekologie a porodnictví 2007; 16(3 Onkogynekologie): 448–449.
3. Cibula D, Petruželka L et al. Nádory děložního hrdla. In: Cibula D, Petruželka L (eds) et al. Onkogynekologie. Grada Publishing, Praha 2009: 393–456.
4. Golijow CD, Abba MC, Mourón SA et al. c-myc gene amplification detected in preinvasive inraepithelial cervical lesions. Int J Gynecol Cancer 2001; 11(6): 462–465.
5. Heselmeyer K, Schrock E, du Manoir S et al. Gain of chromosome 3q defines the transition from severe dysplasia to invasive carcinoma of the uterine cervix. Proc Natl Acad Sci USA 1996; 93(1): 479–484.
6. Heselmeyer K, Macville M, Schrock E et al. Advanced-stage cervical carcinomas are defined by a recurrent pattern of chromosomal aberrations revealing high genetic instability and a consistent gain of chromosome arm 3q. Genes Chromosomes Cancer 1997; 19(4): 233–240.
7. Jin Y, Li JP, He D et al. Clinical significance of human telomerase RNA gene (hTERC) amplification in cervical squamous cell lesions detected by fluorescence in situ hybridization. Asian Pac J Cancer Prev 2011; 12(5): 1167–1171.
8. Chen S, Yang Z, Zhang Y et al. Genomic amplification patterns of human telomerase RNA gene and C-MYC in liquid-based cytological specimens used for the detection of high-grade cervical intraepithelial neoplasia. Diagn Pathol 2012; 7: Art. no 40. Dostupný z WWW: <http://www.diagnosticpathology.org/content/7/1/40>.
9. Adhikary S, Eilers M. Transcriptional regulation and transformation by Myc proteins. Nat Rev Mol Cell Biol 2005; 6(8): 635–645.
10. Schwab M, Alitalo K, Klempnauer KH et al. Amplified DNA with limited homology to myc cellular oncogene is shared by human neuroblastoma cell lines and a neuroblastoma tumor. Nature 1983; 305(5931): 245–248.
11. Busmanis I. Biomarkers in Carcinoma of the Cervix: Emphasis on Tissue-related Factors and Their Potential Prognostic Factors. Ann Acad Med Singapore 1998; 27(5): 671–675.
12. Allen DG, White DJ, Hutchins AM et al. Progressive genetic aberrations detected by comparative genomic hybridization in squamous cell cervical cancer. Br J Cancer 2000; 83(12): 1659–1663.
13. Oh EK, Kim YW, Kim IW et al. Differential DNA copy number aberrations in the progression of cervical lesions to invasive cervical carcinoma. Int J Oncol 2012; 41(6): 2038–2046.
14. Lee BH, Roh S, Kim YI. et al. Difference of Genome-Wide Copy Number Alterations between High-Grade Squamous Intraepithelial Lesions and Squamous Cell Carcinomas of the Uterine Cervix. Korean J Pathol 2012; 46(2): 123–130.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicínaČlánek vyšel v časopise
Praktická gynekologie

2013 Číslo 1
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Dlouhodobé užívání dienogestu v terapii endometriózy
- Postupné vysazování inhibitorů protonové pumpy
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
Nejčtenější v tomto čísle
- Vliv některých anestetik a sedativ na sexuální halucinace pacienta: podceňované forenzní riziko pro lékaře
- Problematika rozsáhlého porodního poranění a komplikace s ním spojené
- Raritní komplikace děložní myomatózy: kazuistiky
- Indikace mamografie, ultrasonografie a vyšetření prsu magnetickou rezonancí u mladých žen
