-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dabrafenib v monoterapii u BRAF+ nemalobuněčného karcinomu plic – naše zkušenosti
Dabrafenib monotherapy in BRAF+ non-small cell lung cancer – our experience
Background: Activating BRAF mutations result in constitutive activation of the MAP kinase signaling cascade, stimulating cell proliferation. BRAF mutations are typical for malignant melanoma, but occur less frequently in other tumors, including in 1–2% cases of non-small cell lung cancer (NSCLC) [1,2]. Case: We present two case reports of BRAF+ NSCLC patients, treated with 3rd line dabrafenib monotherapy on our department, and also brief review of available information about dabrafenib and its use in monotherapy of BRAF+ NSCLC. Conclusion: Monotherapy with BRAF inhibitors presents a viable alternative for BRAF+ NSCLC patients, incapable of combined therapy with trametinib. The lack of proper indication and reimbursement for NSCLC cases remains a problem, and individual treatment approval is required.
Keywords:
dabrafenib – BRAF – lung cancer – non-small cell – NSCLC – monotherapy
Autoři: Ondřej Fischer 1; Vítězslav Kolek 1; Denisa Rozsívalová 1; Tomáš Tichý 2; Jozef Škarda 2; Jiří Drábek 3
Působiště autorů: Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc 1; Ústav patologie, LF UP v Olomouci 2; Ústav molekulární a translační medicíny, UP v Olomouci 3
Vyšlo v časopise: Klin Onkol 2020; 33(6): 458-462
Kategorie: Kazuistika
Souhrn
Východiska: Aktivační mutace BRAF vedou ke konstitutivní aktivaci MAP kinázové signální kaskády, která stimuluje buněčnou proliferaci. Jsou známy především u maligního melanomu, vyskytují se však méně často i u dalších tumorů, vč. nemalobuněčného karcinomu plic (NSCLC), kde jsou přítomny v 1–2 % [1,2]. Případ: Prezentujeme případ dvou pacientek s BRAF+ NSCLC léčených v letech 2018–2019 na naší klinice dabrafenibem v 3. linii terapie a stručný přehled informací o dabrafenibu a jeho použití v monoterapii BRAF+ NSCLC. Závěr: Monoterapie inhibitory BRAF představuje viabilní alternativu pro nemocné s BRAF+ NSCLC nevhodné ke kombinační terapii s trametinibem. Problémem zůstává absence řádné indikace a úhrady pro případy NSCLC vyžadující individuální schvalování léčby.
Klíčová slova:
dabrafenib – BRAF – karcinom plic – nemalobuněčný – NSCLC – monoterapie
Úvod
Karcinom plic patří mezi nejčastější novotvary v ČR jak co do incidence, tak mortality. Jeho nemalobuněčná forma vykazuje přítomnost cílitelných aktivačních (tzv. driver) mutací v zhruba 25 % [3], při použití metod sekvenování nové generace (next generation sequencing – NGS) až 65 % [4]. V reálné praxi je záchyt mírně nižší, např. s ohledem na omezené možnosti biopsie dle lokace tumoru, stav nemocného aj. [5]. Mutace BRAF je v současnosti testována na žádost klinika a u nemalobuněčného karcinomu plic (non-small cell lung cancer – NSCLC) bývá detekována v 1–3 % případů [1,6]. BRAF je serin/threoninová kináza nacházející se v signální kaskádě RAS-RAF-MEK-ERK, účastnící se buněčné proliferace [7]. Nejčastější je mutace V600E (či též V600G (kyselina glutamová = symbol E) – vyskytuje se v 50–80 % [8,9]. Tato mutace vede k výraznému zvýšení aktivity tyrozinkinázy proti nemutované formě (12×) a působí jako onkogenní stimulus. Mutace mimo pozici 600 jsou méně časté a jejich onkogenní aktivita není zatím přesně objasněna [10]. BRAF mutace u NSCLC se vyskytují bez vazby na věk, kouření či pohlaví [11,12], vykazují vyšší četnost adenokarcinomů (testování skvamózních karcinomů se zpravidla neprovádí). Představuje však vhodný cíl pro cílenou terapii tyrozinkinázovými inhibitory [13].
Popis případu
Naše první kazuistika prezentuje ženu, nekuřačku, v době diagnózy (2016) 79 let, hypertoničku, s lehkou renální insuficiencí (glomerulární filtrace 50 ml/min), hyperlipidemií a diabetem II. typu na dietě, 149 cm / 55 kg. Klinické potíže začaly v březnu 2016 v podobě dušnosti podmíněné objemným fluidothoraxem vpravo, se kterým byla odeslána na naše pracoviště. V pleurální punkci cytolog popsal buňky adenokarcinomu. Další došetření zahrnovalo bronchoskopii, při které byl zjištěn jen útlak pravostranného hemisystému zvenčí výpotkem; forceps biopsií z periferie S6 vpravo však byly zachyceny struktury adenokarcinomu plicního origa (CK7+, TTF1+). Vyšetření prediktivních markerů kitem IntellMed (ČR) prokázalo negativitu receptoru epidermálního růstového faktoru (epidermal growth factor receptor – EGFR), anaplastické lymfomkinázy (ALK) a genu ROS1 a pozitivní BRAF mutaci V600E, staging dle PET 4/216 T4N3M1a, st. IV dle TNM-7. Pacientka byla v 1. linii léčena 4 cykly karboplatiny, paklitaxelu a bevacizumabu, s výraznou parciální regresí plicních lézí i lymfadenopatie, kompletní resorbcí výpotků, následně udržovací léčba bevacizumabem – stabilizace nemoci až do září 2018, kdy dochází k drobnoložiskové diseminaci do obou plic a recidivuje fluidothorax, tentokrát vlevo. Do 2. linie zvolen pemetrexed, po 4. cyklu však zjevná progrese, další chemoterapii již pacientka ani rodina nebyly nakloněny s ohledem na věk a celkovou slabost. S ohledem na přítomnost BRAF mutace a non-VZP zdravotní pojišťovnu bylo zažádáno do 3. linie o dabrafenib dle paragrafu 16 zákona 48/1997 Sb., zvažovaný trametinib nebyl připojen z obavy o celkovou toleranci zesláblou pacientkou a z potenciální toxicity. Po vyžádání doplňkového vyjádření byl dabrafenib pojišťovnou schválen a v prosinci 2018 nasazen v dávce 75 mg 2-0-2. V době nasazení pacientka váží 46 kg, PS (performance status) 1–2, je dušná při malé námaze, kašel jen částečně tlumen antitusiky. Během 14 dní dochází k výraznému ústupu kašle i dušnosti, pacientka vysazuje antitusika, lépe jí, přibírá 2 kg, pro bolesti končetin a myalgie však rodina sama snížila dávku na 1-0-1, kterou pacientka tolerovala již bez problémů. Jiná toxicita se nevyskytovala. Léčebná odpověď byla potvrzena již po 5 týdnech léčby neplánovanou výpočetní tomografií (CT) (provedeno akutně na pohotovosti pro bolesti zad, vyloučena generalizace, dle neurologa dekompenzace chronického vertebrogenního algického syndromu, zaléčeno úspěšně nesteroidními antiflogistiky), kontrolními CT a skiagramy (obr. 1–4). Výrazná parciální regrese trvá i ke květnu 2020 (tj. 17 měsíců), pacientka nadále užívá dabrafenib 75 mg 2 × 1, bez významné toxicity, PS 1.
Obr. 1. Kazuistika 1, CT hrudníku 9/2018 (před zahájení léčby). ©FNOL 2018.
CT – výpočetní tomografie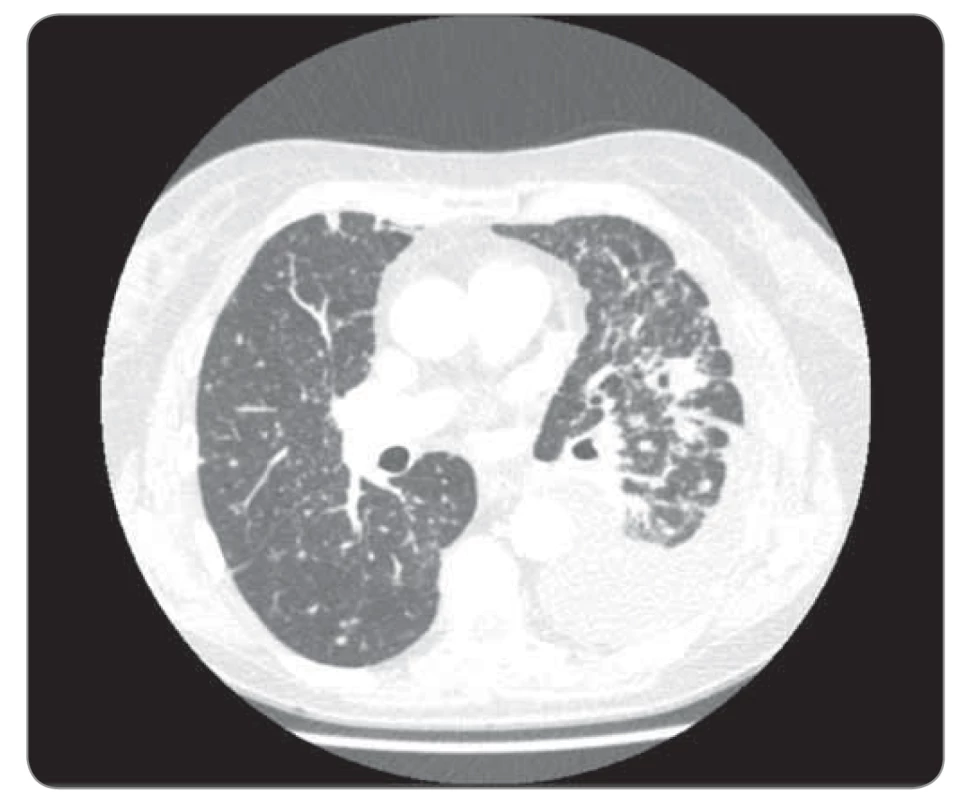
Obr. 2. Kazuistika 1, CT hrudníku 7/2019. ©FNOL 2019.
CT – výpočetní tomografie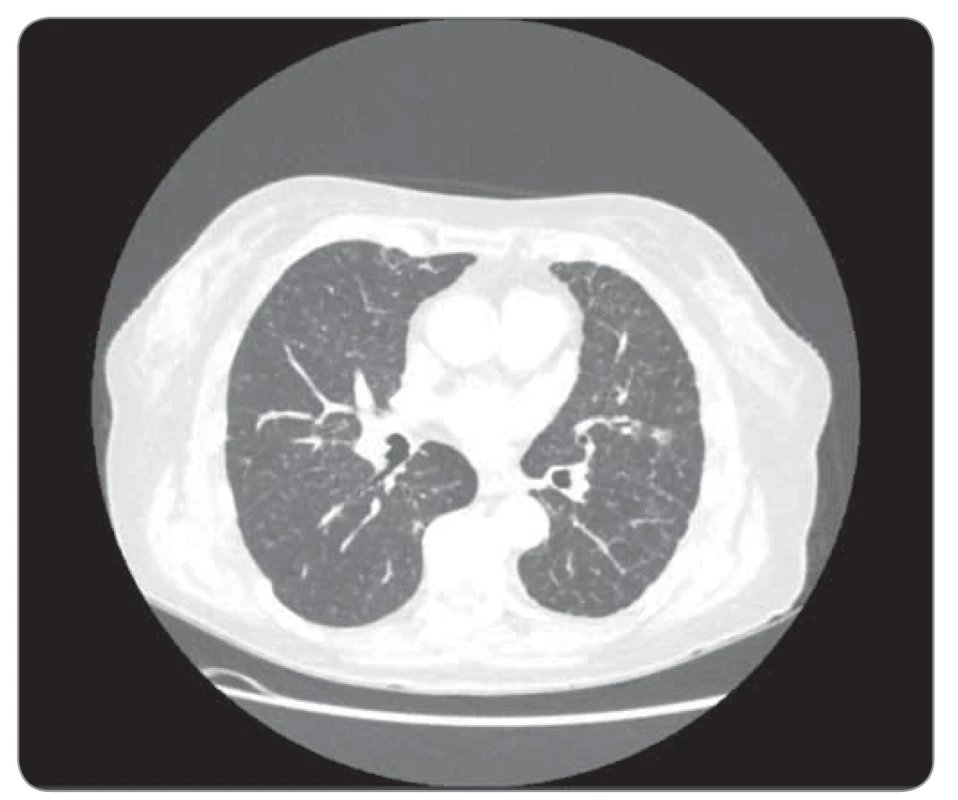
Obr. 3. Kazuistika 1, skiagram hrudníku 11/2018 (den zahájení léčby). ©FNOL 2018. 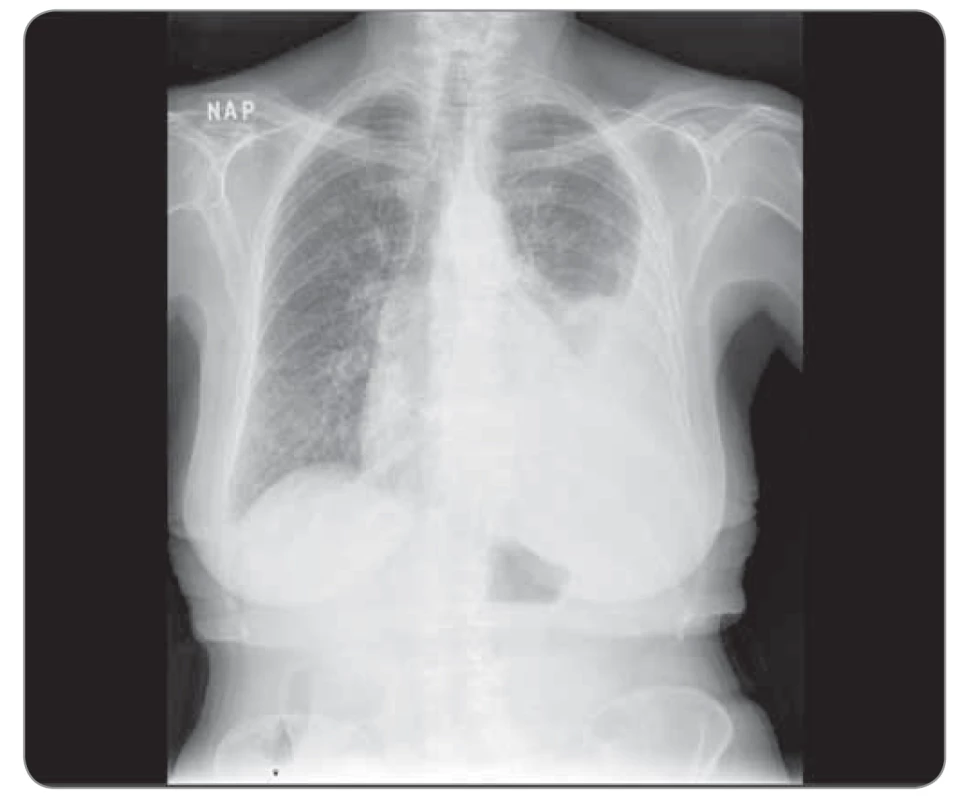
Obr. 4. Kazuistika 1, skiagram hrudníku 05/2020. ©FNOL 2020. 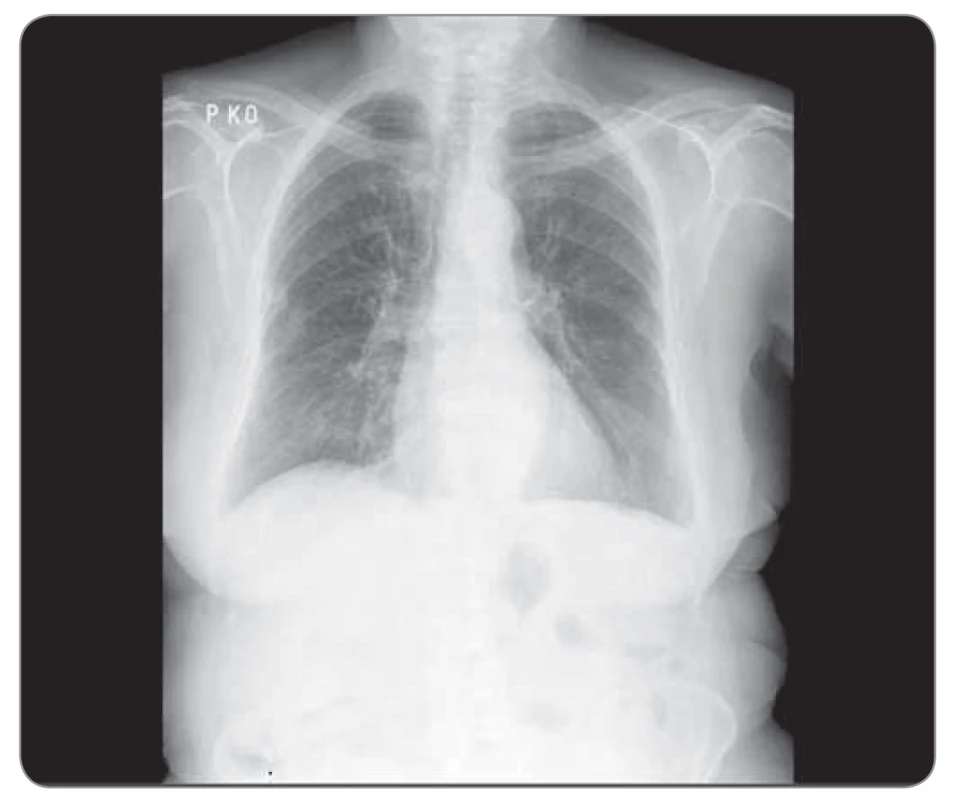
Druhá kazuistika představuje ženu, nekuřačku, silně obézní (BMI 37), špatně kompenzovanou, dietně non-compliantní diabetičku II. typu na inzulinu, s anamnézou alergického astma bronchiale. Potíže se objevily na začátku roku 2018 v podobě paraneoplastické trombózy v. subclavia vpravo, následně došetřována a léčena ve spádovém zařízení od března 2018. Tumor byl verifikován endoskopicky, primární ložisko v horním laloku vpravo, histologicky adenokarcinom, EGFR a ALK negativní, pozitivní BRAF mutace V600G kitem IntellMed, dle CT T2bN3M1a, stadium IV/TNM-7, maligní fluidothorax vpravo, cytologicky ověřený. V 1. linii podáno 6 cyklů chemoterapie CBDCA + vinorelbin od dubna do září 2019, kdy se objevuje progrese v podobě generalizace do CNS (3 drobné léze dle MRI, ošetřeny gama nožem – Nemocnice Na Homolce, Praha) v lednu 2019, následně odeslána na naše pracoviště. V 2. linii léčena pemetrexedem, celkem 6 cyklů, v červnu 2019 dochází ke generalizaci do plic oboustranně. Pacientka PS 1, tedy zažádáno o úhradu dabrafenibu na paragraf 16 zákona 48/1997 Sb., po schválení od července 2019 zahájena léčba v dávce 2× 150 mg denně, dvojkombinace nebyla zvolena z obavy z možných nežádoucích účinků a kvůli preexistujícím průjmům (podmíněných zejména nedodržováním racionálních dietních opatření). Bylo dosaženo mírné parciální remise potvrzené kontrolními CT za 3, 6 a 9 měsíců (obr. 5, 6). Ke květnu 2020 (tj. 10 měsíců) léčba trvá bez významné toxicity, PS 1, mozkové metastázy v kompletní remisi. Při léčbě došlo k rozvoji Dupuytrenovy kontraktury dlaně, která ale byla přisouzena špatně kompenzovanému diabetu.
Obr. 5. Kazuistika 2, CT hrudníku 6/2019 (před zahájením léčby). ©FNOL 2019.
CT – výpočetní tomografie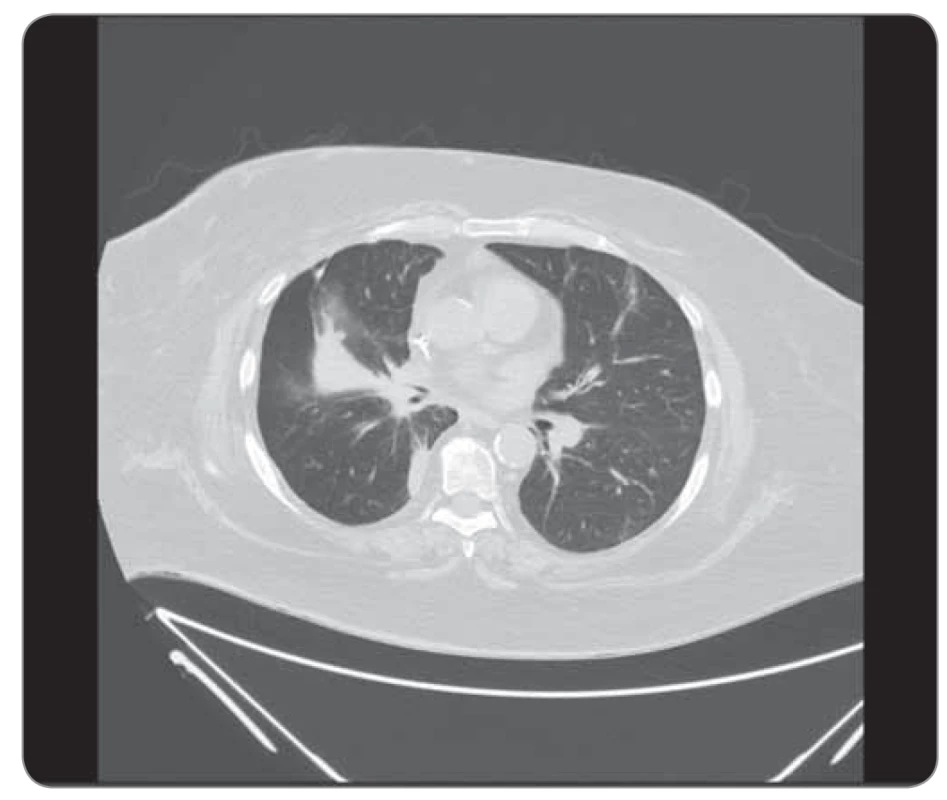
Obr. 6. Kazuistika 2, CT hrudníku 6/2019 (před zahájením léčby). ©FNOL 2019.
CT – výpočetní tomografie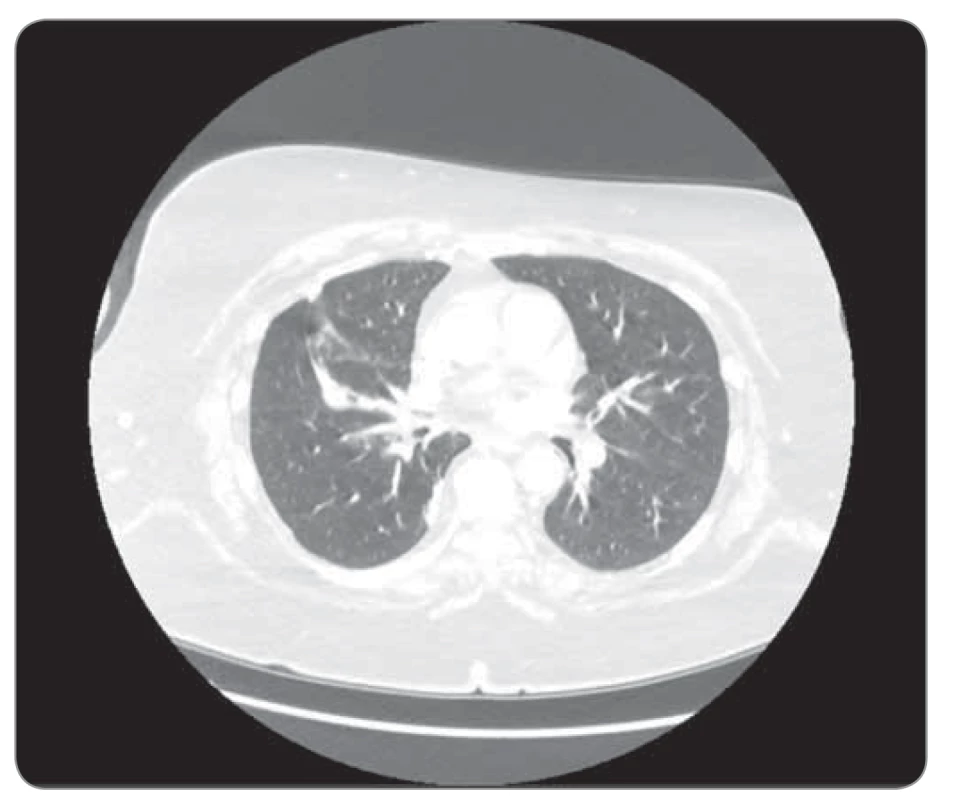
Diskuze
Výskyt mutací BRAF je popsán zejména u maligního melanomu, ale též např. u papilokarcinomu štítné žlázy, karcinomu ovaria či kolorektálního karcinomu [6]. Jde o mutaci exkluzivní, např. Litvak et al nezaznamenali v souboru 63 pacientů konkomitantní mutace EGFR/ALK či RAS [12]. Přítomnost mutace BRAF podle dostupných studií [6,8] s řádově desítkami BRAF+ pacientů neovlivňuje přežití pacientů ani odpověď na chemoterapii s platinovými deriváty ve srovnání s BRAF wild-type neskvamózního NSCLC [14]. Typická mutace V600E je dobře cílitelná tyrozinkinázovými inhibitory, z nichž jsou na českém trhu k dispozici dabrafenib či vemurafenib, doporučené současně s inhibitory MEK vzhledem k možnosti obcházení blokády genu BRAF alternativní cestou CRAF [13,15,16].
K 1. 3. 2020 však nebyla v ČR pro dabrafenib v kombinaci s trametinibem v žádné linii léčby BRAF+ NSCLC stanovena úhrada. Léčba zatím vyžaduje individuální schválení, přičemž podmínky tzv. paragrafu 16 (vyčerpání jiných možností léčby) reálné nasazení v 1. linii léčby vylučují.
Ve vyšších liniích léčby pak může být problémem horší celkový stav pacienta, který může toleranci kombinační léčby limitovat. Snížené předpoklady tolerance kombinace s trametinibem mají rovněž pacienti polymorbidní či ve vysokém věku, i přes dobrý PS. Právě pro tyto pacienty může být monoterapie inhibitorem BRAF benefitem, byť s vědomím možné kratší doby do progrese než při použití dvojkombinace. Jak však ukazují oba naše případy, není toto pravidlem.
Dle světové literatury monoterapie (dabrafenibem či vemurafenibem) vykazuje podstatně vyšší míru léčebných odpovědí než konvenční chemoterapie v 1. i vyšších liniích terapie [16,17] a v mezinárodních guidelines (NCCN 1.2020) je doporučována. Studie na toto téma jsou limitovány malým počtem BRAF+ případů. Multicentrická studie fáze II NCT01336634 (n = 84 BRAF+ NSCLC IIIB–IVB, z toho 78 nemocných předléčených chemoterapií) deklarovala celkovou míru odpovědi (overall response ratio – ORR) 33 %, míru kontroly nemoci (disease control ratio – DCR) 58 %, přežití bez nemoci (progression-free survival – PFS) 5,5 měsíce a celkové přežití (overall survival – OS) 12,7 měsíce. Nežádoucí účinky ≥ 3. stupně představovaly spinocelulární karcinom kůže (12 %), astenie (5 %) a bazocelulární karcinom kůže (5 %) [9].
Obdobná data při užití dabrafenibu v 2. linii v monoterapii popisují Auliac et al: ORR 35 %, PFS 4,1 měsíce (2–10,9) a 2leté přežití 58,5 % [14]; Paik et al: PFS v 2. linii 5 měsíců, medián OS 10,8 měsíce (stadium IV), ORR 53 %, DCR 85 % [18] nebo Brustung et al [8]. OS u BRAF+ pacientů s NSCLC dosahuje 22–23 měsíců při použití inhibitorů BRAF a cytostatik [6,8,12]. Mechanizmy sekundární rezistence zahrnují sekundární mutace jiných členů MAPK kaskády, zejména RAS/RAF, vedoucí k obnovení aktivity této signální dráhy, či aktivaci jiných onkogenních driverů [15,16]. Vyšší předpoklady k rychlému vzniku rezistence jsou očekávány u tumorů s vyšší mutační náloží, detailnější práce k tomuto tématu ovšem zatím nebyly provedeny.
Monoterapie inhibitory BRAF je zpravidla dobře tolerována, nejčastější nežádoucí účinky zahrnují hyperkeratózy kůže, bolesti hlavy, končetin, svalů a kloubů, artralgie, nevolnost, únavu, exantém, méně často se vyskytuje snížení chuti k jídlu, kašel, průjem, poruchy termoregulace, suchost kůže, syndrom palmoplantární erytrodysestezie a další kožní změny [19], vč. výskytu kožních malignit (12% výskyt spinocelulárního karcinomu kůže [9]). Vzácně bývá popisována panikulitida, uveitida, pankreatitida, akutní renální selhání, nefritida, gastrointestinální perforace, kolitida a prodloužení QT intervalu. Při terapii dabrafenibem i vemurafenibem je třeba respektovat, že jde o substrát cytochromů CYP 2C8 a CYP 3A4, a vyhnout se silným inhibitorům a induktorům, z přírodních sloučenin zejména třezalce. S biologickou dostupností dabrafenibu mohou interferovat léky snižující kyselost žaludeční šťávy, u vemurafenibu toto není popsáno [20,21].
Závěr
Cílená terapie inhibitory BRAF by měla být lékem volby u pacientů s prokázaným BRAF+ NSCLC. Světová literatura ukazuje benefit zejména z duální terapie inhibitory BRAF a MEK. U pacientů, kteří nemají předpoklady zvládat duální terapii z důvodu celkového stavu, věku či komorbidit, představuje monoterapie inhibitorem BRAF vhodnou terapeutickou alternativu s možností zlepšit kvalitu života i délku přežití pacienta, jak dokazují naše kazuistiky. Léčba inhibitory BRAF by měla být zahájena ideálně v 1. linii terapie, v našich podmínkách však nelze reálně očekávat její schválení plátci péče před vyčerpáním možností konvenční terapie. Bez nadsázky lze říct, že největším problémem v terapii inhibitory BRAF je úhrada plátcem zdravotní péče, kdy v současnosti je jediná možnost, a to žádat o výjimku na paragraf 16.
Podpořeno z programového projektu MZ ČR,
reg. č. 16–32318A.
Supported by a program project of the Ministry
of Health of the Czech Republic, reg. No. 16–
32318A.
Autoři deklarují, že v souvislosti s předmětem
studie nemají žádné komerční zájmy.
The authors declare they have no potential
confl icts of interest concerning drugs, products,
or services used in the study.
Redakční rada potvrzuje, že rukopis práce
splnil ICMJE kritéria pro publikace zasílané do
bi omedicínských časopisů.
The Editorial Board declares that the manuscript
met the ICMJE recommendation for biomedical
papers.
MUDr. Ondřej Fischer
Klinika plicních nemocí
a tuberkulózy FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: ondrej.fi scher@fnol.cz
Obdrženo/Submitted: 18. 3. 2020
Přijato/Accepted: 13. 6. 2020
Zdroje
1. Davies H, Gignell GR, Cox C et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417 (6892): 949–954. doi: 10.1038/nature00766.
2. Skřičková J, David P. Cílená biologická léčba nemalobuněčného karcinomu plic. Onkologická revue 2019; 5 : 25–35.
3. Bílek O, Bohovicová L, Demlová R et al. Nemalobuněčný karcinom plic – od imunobiologie k imunoterapii. Klin Onkol 2016; 29 (Suppl 4): 78–87.
4. Li SD, Ma M, Li H et al. Cancer gene profiling in non-small cell lung cancers reveals activating mutations in JAK2 and JAK3 with therapeutic implications. Genome Med 2017; 9 (1): 89. doi: 10.1186/s13073-017-0478-1.
5. Fiala O, Pešek M, Fínek J et al. Mutace genu EGFR u pacientů s pokročilým NSCLC. Klin Onkol 2012; 25 (4): 267–273.
6. Tissot C, Couraud S, Tanguy R et al. Clinical characteristics and outcome of patients with lung cancer harboring BRAF mutations. Lung Cancer 2016; 91 : 23–28. doi: 10.1016/j.lungcan.2015.11.006.
7. Garnett MJ, Marais R. Guilty as charged: B-RAF is a human oncogene. Cancer Cell 2004; 6 (4): 313–319. doi: 10.1016/j.ccr.2004.09.022.
8. Brustugun OT, Khattak AM, Trømbork AK et al. BRAF--mutations in non-small cell lung cancer. Lung Cancer 2014; 84 (1): 36–38.
9. Planchard D, Kim TM, Mazieres J et al. Dabrafenib in patients with BRAFV600E-positive advanced non-small--cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol 2016; 17 (5): 642–650. doi: 10.1016/S1470-2045 (16) 00077-2.
10. Ngyuen-Ngoc T, Bouchaab H, Adjei AA et al. BRAF alterations as therapeutic targets in non–small-cell lung cancer. J Thorac Oncol 2015; 10 (10): 1396–1403. doi: 10.1097/JTO.0000000000000644.
11. Marchetti A, Felicioni L, Malatesta S et al. Clinical features and outcome of patients with non-small-cell lung cancer harboring BRAF mutations. J Clin Oncol 2011; 29 (26): 3574–3579. doi: 10.1200/JCO.2011.35.9638.
12. Litvak AM, Paik PK, Woo KM et al. Clinical characteristics and course of 63 patients with BRAF mutant lung cancers. J Thorac Oncol 2014; 9 (11): 1669–1674. doi: 10.1097/JTO.0000000000000344.
13. Beeram M, Patniak A, Rowinsky EK. RAF: a strategic target for therapeutic development against cancer. J Clin Oncol 2005; 23 (27): 6771–6790. doi: 10.1200/JCO.2005.08.036.
14. Auliac JB, Bayle S, Vergnenegre A et al. Non small cell lung cancer (NSCLC) patients harboring BRAF mutation: Clinical characteristics and management in real world setting. Cohort BRAF EXPLORE GFPC 02-14. [online]. Available from: https: //www.researchgate.net/publication/313325410_Non_small_cell_lung_cancer_NSCLC_patients_harboring_BRAF_mutation_Clinical_characteristics_and_management_in_real_world_setting_Cohort_BRAF_EXPLORE_GFPC_02-14.
15. Heidorn SJ, Milagre C, Whittaker S et al. Kinase-dead BRAF and oncogenic RAS cooperate to drive tumor progression through CRAF. Cell 2010; 140 (2); 209–221. doi: 10.1016/j.cell.2009.12.040.
16. Rudin CM, Hong K, Streit M. Molecular characterization of acquired resistance to the BRAF inhibitor dabrafenib in a patient with BRAF-mutant non–small-cell lung cancer. J Thorac Oncol 2013; 8 (5): e41–42. doi: 10.1097/JTO.0b013e31828bb1b3.
17. Myall NJ, Neal JW, Cho-Phan CD et al. Long-term survival of a patient with non–small-cell lung cancer harboring a V600E mutation in the BRAF oncogene. Clin Lung Cancer 2016; 17 (2): e17–21. doi: 10.1016/j.cllc.2015.12.001.
18. Paik PK, Arcila ME, Fara M et al. Clinical characteristics of patients with lung adenocarcinomas harboring BRAF mutations. J Clin Oncol 2011; 29 (15): 2046. doi: 10.1200/JCO.2010.33.1280.
19. Kocák, I. Kožní toxicita u cílené léčby dabrafenibem. Klin Onkol 2017; 30 (3): 233.
20. Tafinlar – FDA prescribing information, side effects and uses. [online]. Available from: http: //www.drugs.com/pro/dabrafenib.html.
21. Zelboraf – FDA prescribing information, side effects and uses. [online]. Available from: http: //www.drugs.com/pro/vemurafenib.html.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Chemie jménem CRISPRČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Chemie jménem CRISPR
- Praktický návod pro testování a cílenou léčbu dospělých pacientů se solidními nádory s genovou fúzí NTRK v běžné klinické praxi
- Možnosti rehabilitácie pri sarkopénii a kachexii onkologických pacientov
- Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
- Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
- První klinické zkušenosti v České republice s aplikací perirektálního hydrogelu před radioterapií pro karcinom prostaty
- SNHG7 a FAIM2 jsou ve tkáni kolorektálního karcinomu up-regulovány a koexprimovány
- Ukrajinská multicentrická prospektivní studie hodnoty prognostické role PET/ CT u primárních pacientů s Hodgkinovým lymfomem v kohortě z reálného života
- Dabrafenib v monoterapii u BRAF+ nemalobuněčného karcinomu plic – naše zkušenosti
- Multirezistentná oportúnna talaromykóza u pa cientky s karcinómom ovária
- Atezolizumab a bevacizumab v léčbě hepatocelulárního karcinomu
- Aktuality z odborného tisku
- Hodnocení expozice nízkým dávkám u hypofrakcionované radioterapii prsu s modulovanou intenzitou – zohlednění účinku velikosti frakce při lineárně-kvadratickém modelu
- Profesor Pavel Šlampa slaví 60 let
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
- První klinické zkušenosti v České republice s aplikací perirektálního hydrogelu před radioterapií pro karcinom prostaty
- Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
- Možnosti rehabilitácie pri sarkopénii a kachexii onkologických pacientov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



