-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
Immunostimulatory and anticancer effect of Reishi and Coriol extracts at the level of clinical studies and their implementation in practice
Background: Mushrooms Reishi and Coriolus have been used for centuries in Asian countries to treat various diseases, mainly respiratory tract infections or pulmonary diseases, and more recently also cancers. Polysaccharides and triterpenes, which are found in these mushrooms, are their main bioactive components. Preclinical and clinical studies in humans presented their beneficial effects as immunomodulators; besides this, they possess a direct anticancer effect. In Asia, they are used after cancer treatment as single agents or in combination with chemotherapy or radiotherapy. Extracts from Coriolus have been approved for more than 30 years as an effective adjuvant addition to standard cancer treatment in Japan and China without obvious toxicity. Purpose: In this review, clinical studies with Reishi and Coriolus in cancer patients and their meta-analyses are briefly summarized. Conclusion: Both extracts from Reishi and Coriolus, if used in combination with standard therapy or as an adjuvant single agent, have shown benefits at immune function measures, tumor-related symptoms and performance status of cancer patients. Moreover, they have prolonged their disease-free interval and overall survival. They are well tolerated even in advanced cancer diseases and could be safely used continuously for long periods of time. Because of clinically approved efficacy and safety, they are applied mainly in some countries as a complementary therapy for various types of cancers.
Keywords:
Reishi – Ganoderma lucidum – polysaccharides – Coriolus – polysaccharide K – PSK – polysaccharide peptide – PSP – immunostimulation
Autoři: Jana Neuwirthová; Pavla Urbánková; Pavel Smilek
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku LF UK a FN sv. Anny v Brně
Vyšlo v časopise: Klin Onkol 2020; 33(6): 426-434
Kategorie: Přehled
Souhrn
Východiska: Houby Reishi a Coriolus se dlouhodobě užívají v Asii k léčbě různých onemocnění, především respiračních infekcí, plicních onemocnění a v posledních letech navíc i k léčbě nádorů. Za jejich hlavní bioaktivní komponenty se považují polysacharidy a triterpeny. Preklinické i klinické studie na lidech u nich prokázaly jak imunomodulační, tak přímý protinádorový účinek. Extrakty z těchto hub jsou proto v Asii užívány v období po onkologické léčbě anebo i během ní v kombinaci s chemoterapií a radioterapií. Extrakty z Coriolu jsou již přes 30 let oficiálně schváleny v Japonsku a Číně jako účinný a současně netoxický imunostimulační doplněk léčby, podávaný zejména adjuvantně po operaci nádorových onemocnění. Cíl: Tento souhrnný článek má za cíl rozbor doposud proběhlých klinických studií s Reishi a Coriolem u onkologických pacientů a jejich metaanalýz. Závěr: Jak extrakty z Reishi, tak extrakty z Coriolu, ať již užívané v kombinaci se standardní onkologickou léčbou, anebo samostatně v období po ní, prokázaly přínos ve zlepšení imunitních funkcí, s nádory spojených příznaků a celkového stavu pacientů. Ve studiích také prodloužily přežití bez příznaků návratu onkologického onemocnění i celkové přežití. Jsou dobře tolerované dokonce u pokročilých onemocnění a lze je užívat dlouhodobě. Na základě klinicky prokázané účinnosti a bezpečnosti jsou indikovány v některých zemích jako doplňková léčba pro mnoho druhů nádorů.
Klíčová slova:
Reishi – Ganoderma lucidum – polysacharidy – Coriolus – polysacharid K – PSK – polysacharidový peptid – PSP – imunostimulace
Úvod
Extrakty z Reishi vzbuzují pozornost nejen u lidí s častými respiračními infekcemi, ale i u oslabených onkologických pacientů, kteří hledají možnosti, jak zabránit návratu nádorového onemocnění a zlepšit kvalitu svého života. Vedle Reishi je při podobných indikacích vyhledávána také houba Coriolus. Studie s extrakty z Reishi a Coriolu již postoupily od laboratorních experimentů až po randomizované prospektivní dvojitě zaslepené klinické studie na lidech a proběhly i jejich metaanalýzy, které potvrdily přínos pro imunitně oslabené onkologické pacienty [1]. Tento souhrnný článek se proto po krátkém popsání experimentálních podkladů zaměří především na výsledky klinických studií, které mají pro praxi největší význam.
Důvodem zvolení tohoto tématu je jeho aktuálnost a skutečnost, že v Asii jsou některé z těchto extraktů již oficiálně schváleny a běžně používány jako účinná a současně netoxická součást standardní léčby onkologických pacientů. Vedle prokázaného imunostimulačního vlivu se projevuje dobrá tolerabilita v pokročilých stadiích onemocnění, zlepšení kvality života, zmírnění únavy [2] a hepatoprotektivní účinek [3]. Za výhodu se považuje také účinnost a možnost použití u skupiny dětských pacientů s nezralou nebo nádory oslabenou imunitou, a to v prevenci jak samotných nádorů, tak i častých virových infekcí dýchacích cest [4,5].
Původ Reishi a experimentální studie jejího imunostimulačního a protinádorového účinku
Reishi vychází z japonského pojmenování houby, která je latinsky nazývána Ganoderma lucidum, čínsky pak Ling Zhi. Co se týče jejích zdravotních účinků a vlivu na imunitu, je mezi asijskými houbami rozhodně nejzajímavějším zástupcem. Patří mezi nejvíce v praxi užívané a v současné době je u nás registrovaná jako doplněk stravy. S oblibou se používá u dospělých i u dětí. Navíc má schválené zdravotní tvrzení o podpoře přirozené imunity, což se zatím v našich podmínkách u ostatních druhů houbových extraktů nepodařilo prosadit. Zdravotní tvrzení jsou informace, které již mají dostatečný podklad ve vědeckých studiích a současně musejí být schváleny Evropskou komisí. Pokročila tedy v rámci studií a zkušeností ze všech asijských hub nejdále.
V Asii je Reishi známa pro použití v různých indikacích již přes 4 000 let a historicky je dokonce považována za klíčový medikament tradiční čínské medicíny. V překladu je nazývána „zázračnou houbou“, „houbou nesmrtelnosti“ anebo „houbou dlouhověkosti“. Je o ní známo, že podporuje fungování imunitního systému, a dle některých studií dokáže bojovat i proti mnoha druhům virů, mezi které patří respirační viry [6,7], viry Ebstein-Barrové [8,9], herpetické viry [10,11], papilomaviry [12] a další. Především z důvodu jejího pozitivního vlivu na imunitu se v Evropě stala centrem pozornosti u lidí se sklonem k častým infekcím dýchacích cest, astmatem anebo chronickou bronchitidou, ale také u onkologických pacientů po léčbě, kteří hledají přirozené metody podpory imunity a odstranění únavy [13].
V přírodě se Reishi vyskytuje u kořenů listnatých stromů, pro medicínské účely se však již mnoho let pěstuje uměle za dodržení speciálních podmínek. Za účinné se z Reishi považují pouze kvalitně provedené a čisté extrakty, které mají dobrou biologickou dostupnost a jsou zbavené nestravitelného chitinu; nelze tedy použít pouhý prášek z usušené houby. Reishi obsahuje řadu účinných bioaktivních složek, které se dají získat různými metodami extrakce. Studie tvrdí, že za jejím vlivem na imunitu a protinádorovým potenciálem stojí především v ní obsažené polysacharidy a triterpeny [13–15], ale na imunomodulačním účinku se může podílet i organické germanium a některé jiné složky [16]. Reishi obsahuje přes 100 různých typů polysacharidů, z nichž jsou jako biologicky aktivní sledovány zejména beta-D-glukany [16]. Výrobci doplňků stravy by proto měli garantovat nejen kvalitu a čistotu extrakce, ale udávat také procento obsahu polysacharidů, které ukazuje na intenzitu účinnosti produktu. V praxi se procento polysacharidů v dostupných extraktech z Reishi pohybuje v širokém rozmezí 10–50 % a za ideální jsou považovány a ve studiích používány produkty s obsahem ≥ 25 %. Navíc se na trhu objevují extrakty, které kromě polysacharidů udávají také procento obsažených triterpenů, a jejich obsah se pohybuje v rozmezí 4–20 %. Pro Reishi specifické triterpeny, zejména lanostanového typu, prokázaly v řadě studií protizánětlivý i protinádorový účinek [16–19], a proto jsou produkty s jejich zvýšeným obsahem doporučovány u chronických zánětlivých nebo nádorových onemocnění.
Imunostimulační a protinádorový účinek Reishi byl potvrzen v řadě experimentálních a preklinických studií [20]. Byl popsán imunomodulační efekt skrze aktivaci T i B lymfocytů. Vlivem extraktu z Reishi dochází ke zvýšení počtu T lymfocytů a NK buněk (natural killer cells, tzv. přirození zabíječi) zodpovědných za buněčnou imunitu i k jejich aktivizaci ve smyslu zvýšené sekrece cytokinů [21]. Reishi dle studií zvyšuje cytotoxicitu NK buněk a schopnost fagocytózy makrofágů. Tyto složky imunity hrají klíčovou roli v obranyschopnosti nejen proti infekcím, ale i proti nádorovým buňkám [22,23]. Glykoproteiny z Reishi vedle T lymfocytů stimulují i proliferaci a diferenciaci B lymfocytů zodpovědných za protilátkovou imunitní odpověď. Byla popsána několikanásobně vyšší produkce B lymfocytů ze sleziny, jejich větší objem i schopnost vyšší produkce protilátek [24]. Polysacharidy z Reishi však mohou mít vedle imunostimulačního efektu také přímé protinádorové působení. V tomto smyslu proběhla řada experimentálních studií, ve kterých došlo k útlumu růstu různých druhů nádorových buněk, a to až o 60 % [13,25,26]. V experimentech byl kromě inhibice proliferace nádorových buněk popsán antimetastatický a antiangiogenní účinek [13]. Stejně jako polysacharidy také celá řada pro Reishi specifických triterpenů prokázala schopnost aktivace jednotlivých složek imunity i přímých protinádorových mechanizmů způsobující zástavu buněčného cyklu a apoptózu, tedy smrt nádorových buněk [17,18]. Experimentální studie prokázaly protinádorový účinek na příkladu řady druhů nádorů a delší přežívání nemocného při nádorovém onemocnění [14].
Klinické studie s Reishi u onkologických pacientů
Na základě předchozích studií bylo zjištěno, že v určitém stadiu nádorových onemocnění dochází k imunosupresi s oslabením imunitních funkcí [27,28] a stav je ještě dále potenciován vlivem chemoterapie [29], což zhoršuje prognózu a přežití pacientů. Dokonce i po vyléčení z nádoru může po chemoterapii přetrvávat dlouhodobý stav oslabení imunity, který pak skrytě napomáhá návratům onemocnění, ale i vzniku sekundárních malignit anebo sklonu k opakovaným a chronickým infekcím [29]. Extrakty z Reishi pro tyto pacienty představují díky svojí prokázané účinnosti na imunitní systém a dobré tolerabilitě i při dlouhodobém podávání netoxickou možnost podpory přirozené obranyschopnosti.
Většina klinických studií s extrakty z Reishi proběhla v zemích jako Čína anebo Japonsko, kde je tato houba považována za standardní součást imunomodulační léčby vč. onkologických indikací. Např. v roce 2003 byla zveřejněna studie s 34 pacienty s pokročilými nádory různých lokalit, kterým byl podáván extrakt z Reishi v dávce přes 5 g denně (1 800 mg 3× denně) nalačno před jídlem po dobu 12 týdnů. V použitém extraktu byla standardizovaná dávka polysacharidů 25 %. Buněčná imunita se u 80 % z nich zvýšila ve smyslu aktivace NK buněk, zvýšení počtu CD56+, IFN - g a interleukinu 2. Naopak došlo k poklesu hladin prozánětlivého TNF-a [30].
Stejný autor pak vedle toho prezentoval výsledky multicentrické dvojitě zaslepené klinické studie, která zhodnotila efekt totožného standardizovaného extraktu z Reishi u pacientů s pokročilým karcinomem plic. Zahrnuto bylo 68 pacientů, kteří byli randomizováni do skupiny s extraktem z Reishi a do kontrolní skupiny s placebem bez onkologické léčby. Sledování probíhalo 12 týdnů a stabilizace se zastavením růstu nádoru bylo dosaženo u 35 % pacientů léčených Reishi oproti 22 % pacientů v kontrolní neléčené skupině. Laboratorně byly vlivem extraktu z Reishi prokázány známky imunostimulace, konkrétně zvýšení celkového počtu T lymfocytů, NK buněk, CD56+ a IFN - g. Navíc Reishi v této studii na základě zhodnocení Karnofského skóre zlepšila kvalitu života ve srovnání s placebem a vedla k ústupu vedlejších příznaků, jako byl kašel, nespavost anebo únava [2].
Později jiný autor popsal v randomizované dvojitě zaslepené studii po 6 měsících perorálního podávání extraktu z Reishi zvýšené množství lymfocytů u dětských imunokompromitovaných pacientů ve srovnání s kapslemi placeba. Jednalo se celkem o 29 onkologických pacientů ve věku 2–18 let s různými druhy malignit (leukémie a solidní nádory) po léčbě chemoterapií. Celková denní dávka byla volena v závislosti na věku dětských pacientů v rozmezí 1 200–1 800 mg standardizovaného extraktu Reishi a doba podávání byla kontinuálně půl roku [4].
Přínos Reishi pro imunitu dětí potvrdila na jiném modelu také další dvojitě zaslepená studie, tentokrát z Kolumbie, která se zaměřila na zdravé děti ve věku 2–5 let a prokázala po 12 týdnech podávání beta-glukanů z Reishi zvýšení celkového počtu lymfocytů (CD3+, CD4+, CD8+) oproti placebu. Závěrem autorů bylo, že Reishi má aktivizující vliv na imunitní buňky i u dětí, a může proto u této k častým respiračním infekcím náchylné skupiny pomoci tvořit imunitní ochranu [5].
Metaanalýza provedená v roce 2012 z proběhlých randomizovaných klinických studií došla k závěru, že přidání extraktu z Reishi ke standardní onkologické léčbě zvyšuje léčebnou odpověď 1,27×, tedy o téměř jednu třetinu. Reishi dle autorů zlepšuje imunitní funkce, prodlužuje přežití pacientů s pokročilými nádory a má pro praxi přínos vzhledem ke svojí prokázané účinnosti, nízké toxicitě a možnosti dlouhodobého adjuvantního podávání [31].
Později v roce 2014 bylo v klinické studii vlivem Reishi potvrzeno snížení stupně imunosuprese, která doprovází růst nádoru. Karcinomy vylučují imunitu tlumící působky, které potlačují protinádorovou reaktivitu organizmu, čímž se vyhýbají přirozené kontrole nad onemocněním. Jak již bylo zmíněno výše, tento pokles imunitních funkcí je pak u onkologických pacientů známkou špatné prognózy. Celkem byla ve studii odebrána krev 12 pacientům s karcinomem plic a laboratorně sledována reakce imunitních buněk na extrakt z Reishi. Reishi dokázala antagonizovat imunosupresivní stav, který se u onkologických pacientů projevoval sníženou aktivitou lymfocytů. Závěrem této studie bylo, že polysacharidy z Reishi se jeví jako atraktivní imunitní podpora v adjuvantní léčbě oslabených onkologických pacientů [32].
Za přednádorový rizikový stav před vznikem kolorektálního karcinomu je považována přítomnost adenomů. V Japonsku byl proto u kolonoskopií diagnostikovaných kolorektálních adenomů 123 pacientům podáván spórový extrakt z Reishi a tito byli srovnáni se 102 pacienty bez léčby. Léčba extraktem v dávce 1 500 mg denně trvala po dobu 12 měsíců a na konci tohoto období byla u léčené i neléčené skupiny provedena kontrolní kolonoskopie ke zhodnocení efektu. Rozdíl byl signifikantní. Velikost adenomů se vlivem Reishi zmenšila průměrně o 1,4 mm, zatímco u skupiny bez léčby došlo naopak k nárůstu v průměru o 1,7 mm. Závěrem této studie proto bylo, že extrakt z Reishi může mimo jiné tlumit vývoj kolorektálních adenomů představujících přednádorový stav ve střevech [33].
U 15 pacientů s gynekologickým karcinomem byla zaznamenána vlivem léčby Reishi stabilizace onemocnění. Jednalo se o celkem 21 pacientek, které se nacházely v pokročilém stadiu gynekologického karcinomu s progresí onemocnění i přes minimálně 2 série chemoterapie. Randomizace u nich proběhla do skupiny s vodným extraktem z Reishi, do skupiny se spóry z Reishi a do skupiny s placebem bez jakékoliv další léčby. Obě formy extraktu z Reishi prokázaly klinický efekt ve srovnání s placebem. Z celkového počtu 15 léčených došlo u 5, tj. u 33 % pacientek k zastavení růstu nádoru, tedy ke stabilizaci onemocnění, a to bez významnějších nežádoucích účinků. Neléčená kontrolní skupina vykazovala ve všech případech naopak zhoršení stavu s progresí nádoru. V této studii byly použity vysoké dávky 3 000 mg extraktu 2× denně po dobu 12 týdnů [34].
U onkologických pacientů je kromě oslabené imunity častým problémem i únava, kterou dle předchozích zkušeností může Reishi také zmírnit. Studie z roku 2012 popsala ústup únavy a zlepšení kvality života při probíhající onkologické léčbě. Jednalo se celkem o 48 pacientek s karcinomem prsu, které byly v rámci zaslepené studie randomizovány do skupiny s extraktem z Reishi v dávce 1 000 mg 3× denně po dobu 4 týdnů a do kontrolní skupiny s placebem. Skupina s Reishi brzy po užívání zaznamenala více fyzické a psychické výkonnosti, aktivity, zlepšení spánku a pokles úzkostí a depresí. Tolerance Reishi byla velmi dobrá a dle krevních odběrů se nezhoršily ani jaterní a ledvinné funkce ve srovnání s kontrolní skupinou. V souhlase s ostatními studiemi byl vlivem Reishi zaznamenán pokles prozánětlivého cytokinu TNF-a v krevním séru. Závěrem autorů bylo podpoření hypotézy, že Reishi pomáhá odstranit únavu i depresivní stavy onkologických pacientů [35].
Vedle toho Reishi prokazuje na základě experimentálních a klinických studií také antioxidační a hepatoprotektivní účinek. Léčba jaterních poškození je proto jednou z dalších indikací Reishi v Asii. Randomizovaná klinická studie 42 zdravých jedinců prokázala vlivem extraktu z Reishi snížení jaterních enzymů a zvýšení antioxidační kapacity v krevní plazmě ve srovnání se skupinou, která dostala pouze placebo [3].
V jiné randomizované kontrolované klinické studii byl popsán účinek na ústup fibromyalgie [36], což by mohlo představovat další příznivý efekt pro onkologické pacienty.
Reishi se historicky používá v Asii také pro léčbu virových respiračních a herpetických infekcí. Odhalen byl však i ústup papilomavirových infekcí, které jak známo zasahují do procesu kancerogeneze. V klinické studii byl popsán efekt kombinace Reishi a Coriolu na vymizení HPV infekce dutiny ústní o 88 % oproti pouhým 5 % v kontrolní skupině. Za pomoci PCR ze stěru byly u 61 z celkem 472 pacientů s chronickými zánětlivými změnami v dutině ústní identifikovány papilomaviry rizikových typů 16 a 18, které jsou původci karcinomů. U pozitivních případů byla následně provedena randomizace do 2 skupin tak, aby se od sebe vzájemně nelišily podílem jednotlivých rizikových typů HPV ani jinými faktory, které by mohly zkreslit výsledky. U 36 pacientů (36/41), tedy u 88 % případů, které byly léčeny pomocí kombinace extraktu z Reishi a Coriolu po dobu 2 měsíců, došlo k vymizení infekce. V kontrolní skupině zůstali naopak téměř všichni pozitivní kromě 1 pacienta (1/20), tedy kromě 5 % [12].
Obecně již s extrakty z Reishi proběhla řada klinických randomizovaných dvojitě zaslepených studií, které potvrdily přínos pro onkologické pacienty. Jejich výhodou je dobrá tolerabilita a možnost dlouhodobého podávání během léčby i po ní (tab. 1).
Tab. 1. Příklady klinických randomizovaných studií s extrakty z Reishi u nádorových onemocnění – stručný souhrn výsledků. 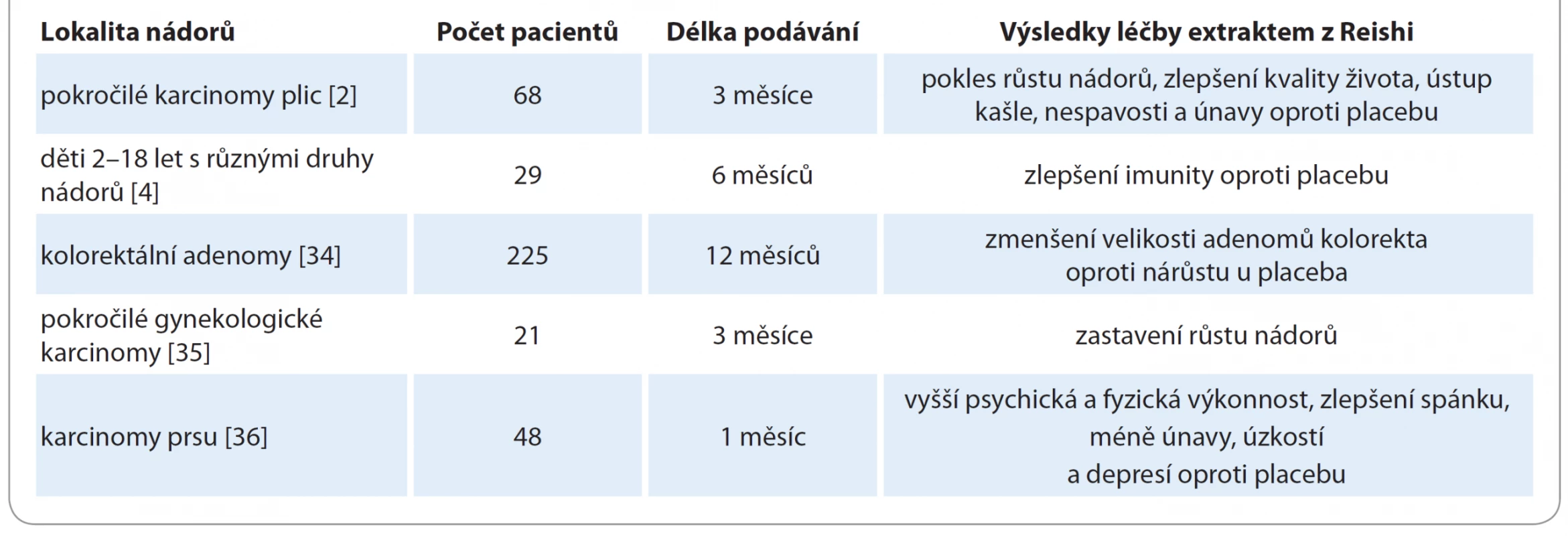
Vedlejší účinky a možné interakce Reishi
Reishi není mutagenní a považuje se za bezpečný doplněk stravy [37]. Řada klinických studií na zdravých i onkologických pacientech a jejich metaanalýz prokazuje, že extrakty z Reishi jsou nejen bezpečné, ale i velmi dobře tolerované [20]. Nepopisuje se u nich vyvolání autoimunitních onemocnění, jak tomu býváme svědky u jednostranně působících imunostimulačních léků. Reishi je pacienty s některými atoimunitními chorobami dokonce i vyhledávána jako doplněk stravy. Podobně jako u ostatních doplňků stravy anebo léků se ale na světě vyskytují jedinci popisující alergickou kožní reakci, jako je vyrážka a svědění, i když u Reishi jsou to pouze vzácné případy.
Ve vyšších dávkách však může mít, podobně jako ostatní extrakty z asijských druhů hub, určité antiagregační působení. Toto může být na straně jedné žádoucím efektem v rámci prevence kardiovaskulárních chorob a ischemických příhod, ale na straně druhé může interagovat se současnou antiagregační léčbou, jejíž účinky tak zvyšuje. Ze stejného důvodu se doporučuje extrakty z asijských hub vysazovat alespoň týden před plánovaným chirurgickým zákrokem.
Reishi má kromě toho i určité antidiabetické a antihypertenzivní působení. Snížení krevního cukru a krevního tlaku pak může být na straně jedné pro mnoho jedinců výhodou, na straně druhé pro jiné představovat nežádoucí efekt. Je proto třeba i toto brát v potaz při jejím doporučení konkrétnímu pacientovi [13].
Klinické studie s Coriolem u onkologických pacientů
Vedle Reishi je v onkologických studiích dokonce ještě více sledována podobná asijská dřevokazná houba, u nás známá jako Coriolus, latinsky Coriolus versicolor anebo Trametes versicolor. Označována je také názvem Yun Zhi v Číně anebo Kawaratake v Japonsku. V českém překladu je známa jako outkovka pestrá. Přestože v posledních letech přibylo mnoho studií vč. klinických podporujících přínos extraktů z Coriolu pro onkologické pacienty, a v asijských zemích jsou dokonce lékaři oficiálně schváleny a používány, u nás zatím nejsou zaregistrovány ani jako doplněk stravy. Z toho důvodu zůstává prodej Coriolu v ČR stále ještě legislativně složitější.
V Číně je Coriolus využíván jako imunoterapeutikum zejména v onkologických indikacích, ale i při léčbě hepatopatie, hyperlipidemie, chronické bronchitidy a některých jiných onemocnění [38]. Extrakty z mycelia této houby jsou asijskými studiemi prezentované jako netoxická a účinná léčba s pouze minimem nežádoucích účinků. Od 70. let, tedy více než 30 let, jsou proto v Číně i Japonsku standardně používány lékaři v kombinaci s chemoterapií a radioterapií anebo v následné léčbě onkologických pacientů [39].
V Japonsku proběhlo v roce 1976 na základě předchozích klinických studií a zkušeností oficiální schválení polysacharidu z Coriolu jako součásti léčby karcinomů trávicí soustavy, plic a prsu. Jeho klinické používání je následně datováno od roku 1977 a po dalším zhodnocení v roce 1989 byly indikace navíc rozšířeny o adjuvantní léčbu pacientů po resekci karcinomů žaludku anebo kolorekta, u kterých kombinace extraktu z Coriolu s pooperační chemoterapií prokazatelně prodlužuje přežití [40].
Coriolus obsahuje mnoho složek vč. beta-glukanů, podobně jako Reishi. Polysacharid K (PSK) neboli krestin extrahovaný z Coriolu se v Japonsku považuje za účinný a bezpečný produkt běžně užívaný během léčby nádorů. Nežádoucí účinky jsou u něj zaznamenávány jen zřídka. Polysacharidový peptid (PSP) je dalším specifickým extraktem z Coriolu, produkovaným zase v Číně. PSK a PSP jsou sobě podobné bioaktivní látky [41].
V klinických studiích prokázal PSK schopnost imunostimulace skrze zvýšení aktivity T lymfocytů, NK buněk, sekrece interleukinu 2 a IFN - g. U 20 pacientů po kurativním odstranění karcinomu žaludku ve III. stadiu onemocnění byla provedena pooperační randomizace do skupiny se samotnou chemoterapií a do skupiny s chemoterapií spolu s přidáním PSK. Po 5 týdnech pooperační léčby byla v krevním séru pacientů s PSK signifikantně nižší chemoterapií indukovaná apoptóza T lymfocytů. Naopak pokud byli pacienti pouze na chemoterapii, došlo k vyššímu stupni imunosuprese. Závěrem této studie z roku 2008 proto bylo, že PSK z Coriolu dokáže snížit nežádoucí účinek reaktivního oslabení imunity vyvolaného chemoterapií [42].
V roce 2010 pak jiní autoři v podobně koncipované randomizované klinické studii přidali PSK k adjuvantní chemoterapii 21 pacientům po resekci karcinomu žaludku stadií II–III a srovnali ji s chemoterapií samotnou. Začátek podávání byl načasován 2 týdny po operaci. Při prodlouženém podávání 3 000 mg PSK denně po dobu alespoň 1 roku byly zaznamenány významné rozdíly v přežití. U pacientů s přidáním PSK jako následné léčby přežívalo po 3 letech 62 %, kdežto v kontrolní skupině při chemoterapii bez další následné léčby pouze 12 %. V subanalýze N2 uzlinových metastáz bylo 3leté přežití ve skupině s PSK 75 % oproti 0 % v kontrolní skupině. Navíc bylo v souladu i s jinými studiemi v krevním séru pacientů vlivem PSK prokázáno snížení stupně imunosuprese, která provází onkologická onemocnění [43].
Japonská studie publikovaná v časopise Lancet v roce 1994 zahrnovala větší skupinu 262 pacientů po chirurgickém odstranění karcinomu žaludku, kterým byla v rámci adjuvantní léčby po operaci podávána buďto chemoterapie samotná, anebo tatáž chemoterapie s přidáním PSK v denní dávce 3 000 mg. Pacienti byli monitorováni 5–7 let. Výsledky byly podobné, pacienti po přidání PSK přežívali déle a navíc bylo prokázáno méně návratů onemocnění. Statisticky signifikantně se vlivem PSK prodloužilo 5leté období bez příznaků recidivy onemocnění na 71 % oproti 59 % kontrolní skupiny a 5leté celkové přežití na 73 % oproti 60 %. Léčba tímto extraktem měla u pacientů kromě zlepšení výsledků onkologické léčby i dobrou snášenlivost, a závěrem autorů proto bylo doporučení jejího přidání k chemoterapii u pacientů po kurativní gastrektomii [44].
Jiná multicentrická japonská studie byla zveřejněna v roce 2000 a srovnala chemoterapii samotnou s chemoterapií s přidáním 3 000 mg PSK denně. Celkem zahrnovala 751 pacientů po kurativní resekci karcinomu žaludku, kteří byli v pooperačním období randomizováni. V subanalýze po stratifikaci dle poměru granulocytů k lymfocytům (G/L) bylo delší 5leté přežití u pacientů s přidáním PSK 69 % oproti 55 % při chemoterapii samotné. Poměr G/L nad 2 v krevním séru pacientů může být dle autorů marker dobré odpovědi na léčbu PSK. Zvýšení přežívání po přidání PSK k chemoterapii autoři přikládají imunostimulačnímu působení a vlivu na zvýšení počtu granulocytů a lymfocytů v krvi pacientů [45].
Souhrnný článek publikovaný v roce 2007 zhodnotil 8 randomizovaných kontrolovaných studií na celkem 8 009 pacientech po odstranění karcinomu žaludku a potvrdil hypotézu, že přidání PSK z Coriolu k adjuvantní chemoterapii je účinnou cestou k prodloužení přežití. Celkem bylo srovnáno 4 037 případů, kterým byl k chemoterapii přidán extrakt z Coriolu, s kontrolní skupinou 3 972 pacientů s chemoterapií samotnou. V rámci obou srovnávaných skupin nebyla nalezena významná heterogenita ve studiích, která by mohla zkreslit výsledky. Rozdíl v přežití byl statisticky významný ve prospěch přidání extraktu z Coriolu. Závěrem autorů bylo, že PSK představuje účinnou možnost adjuvantní imunoterapie v onkologii [46].
Stejný efekt byl však vysledován i u dalších druhů nádorů, řada studií proběhla např. u karcinomů tlustého střeva a rekta. Jedna z těchto studií z roku 2009 zahrnovala celkem 63 pacientů ve věku nad 70 let po operaci kolorektálního karcinomu a retrospektivně srovnala efekt adjuvantního přidání PSK k chemoterapii s chemoterapií samotnou. Období 3 let bez příznaků návratu onemocnění bylo zaznamenáno v 76 % po přidání PSK oproti pouhým 48 % u adjuvantní chemoterapie samotné. Rozdíl byl také v celkovém 3letém přežití: 81 % oproti 53 %. Nebyly zaznamenány významné nežádoucí účinky, tolerabilita PSK byla i u těchto pacientů velmi dobrá [47].
Jiná studie ze stejného období byla koncipována již prospektivně a zhodnotila 101 pacientů v Japonsku, kteří byli v rámci randomizace podobným způsobem léčeni adjuvantní chemoterapií s přidáním PSK, a to v intervalu denního podávání nepřetržitě 2 roky po odstranění kolorektálního karcinomu. Po 10letém sledování bylo potvrzeno vlivem přidání PSK významně delší přežívání 82 % oproti 51 % v kontrolní skupině s pouhou adjuvantní chemoterapií. U pacientů s vyšším stadiem uzlinových metastáz anebo přítomností cévní invaze ve stadiu C dle Dukesovy klasifikace byl rozdíl v 10letém přežívání ještě výraznější: 81 % oproti 26 %. Na základě svých výsledků autoři podpořili zavedení PSK do onkologické léčby, zejména u pokročilých onemocnění [48].
Metaanalýza randomizovaných prospektivních klinických studií publikovaných mezi lety 1980 a 2004 zahrnula tři velké studie s celkem 1 094 pacienty. Nebyla nalezena heterogenita, která by znemožňovala zhodnocení těchto studií, a statisticky významně bylo potvrzeno delší období bez návratu onemocnění i delší celkové přežití vlivem přidání PSK k adjuvantní chemoterapii po operacích kolorektálního karcinomu. Po 5 letech byla recidiva zaznamenána u 28 % při přidání PSK k chemoterapii oproti 34 % při pouhé chemoterapii. Celkové 5leté přežití bylo prodlouženo na 79 % oproti 72 % [49].
Později bylo v roce 2010 také na příkladu kolorektálního karcinomu v randomizované studii zhodnoceno 30 pacientů ve stadiích onemocnění II–III, kteří byli léčeni zevní radioterapií a chemoterapií bez přidání nebo s přidáním PSK. Vlivem PSK bylo zaznamenáno zvýšení počtu NK buněk v krevním séru pacientů, které jak známo představují důležitou složku protinádorové imunity, a naopak nižší hladiny tzv. inhibitorů apoptotických proteinů (IAP), které jsou jedním z markerů rychlejšího růstu nádoru a špatné prognózy onemocnění. Vedle toho bylo zachyceno více cytotoxických T lymfocytů ve zdravé sliznici kolem nádorů. Autoři proto shrnuli, že PSK může podpořit nejen celkovou imunitní obranyschopnost v krevním séru, ale i lokální slizniční imunitu v ozařovaném poli [50].
Další studie se zaměřily také na jiné druhy nádorů, a to s podobnými výsledky. Imunostimulační efekt extraktu z Coriolu byl popsán v roce 2012 v závislosti na použité dávce v klinické randomizované studii zahrnující 23 pacientek po léčbě karcinomu prsu. Jednalo se o perorální přidání PSK z Coriolu v odstupňovaných dávkách 3 000 mg, 6 000 mg a 9 000 mg denně po dobu 6 týdnů. Po zhodnocení 9 léčených případů byl při vyšších dávkách 6 000 mg a 9 000 mg PSK zaznamenán oproti kontrolní skupině vzestup celkového počtu lymfocytů i specificky NK buněk, tedy aktivizace složek imunologického dohledu nad nádory. Autoři na základě svých výsledků považují extrakt z Coriolu ve zvýšených dávkách až 9 000 mg denně za přínosný a současně bezpečný pro imunokompromitované onkologické pacienty [51].
Jiná studie se zaměřila na 38 karcinomů nosohltanu léčených radioterapií anebo chemoradioterapií. Extrakt z Coriolu byl po léčbě přidán 21 z nich a ostatní představovali kontrolní skupinu. Ve skupině s přidáním Coriolu došlo ke snížení výskytu vzdálených metastáz a prodloužení 5letého přežití [52]. K prodloužení přežití přidáním PSK po operaci došlo také u karcinomu jícnu [53], močového měchýře [54] anebo již zmiňovaného prsu [55].
Studie na příkladu karcinomu močového měchýře po jeho chirurgickém odstranění provedla pooperační randomizaci 187 pacientů do 4 skupin: A – bez další léčby, B – s chemoterapií, C – s PSK, D – s chemoterapií a PSK. Denní dávka PSK byla v této studii 3 000 mg. Po 3 letech bylo procento bez recidivy následující: A – 39 %, B – 38 %, C – 59 %, D – 50 %. Stejným způsobem bylo vedle toho randomizováno 71 pacientů po operaci recidiv onemocnění a výsledky 3 let bez návratu onemocnění byly: A – 15 %, B – 28 %, C – 49 %, D – 31 %. Po zahrnutí obou skupin do analýzy, tedy celkem 258 pacientů jak s primárním, tak i s recidivujícím onemocněním, byly výsledky následující: A – 33 %, B – 36 %, C – 56 %, D – 43 %. Extrakt z Coriolu tedy snížil riziko návratu onemocnění jak v monoterapii při srovnání se skupinou bez jakékoliv pooperpační léčby (C vs. A), tak i při kombinaci s chemoterapií oproti pacientům s chemoterapií samotnou (D vs. B). To, že v celkové analýze vyšla skupina se samotným PSK paradoxně lépe než skupina s kombinací PSK a chemoterapie (C vs. D), vysvětlují autoři možností oslabení imunity dlouhodobě podávanou chemoterapií [54].
U karcinomu prsu s přítomnou vaskulární invazí byla ve studii s 227 pacientkami v pooperačním období srovnána chemoterapie samotná a chemoterapie v kombinaci s PSK. Po 10 letech bylo zaznamenáno bez návratu onemocnění 74 % a celkově přežívalo 81 % pacientek při chemoterapii s PSK oproti pouhým 65 % v kontrolní skupině s chemoterapií samotnou. Tolerance PSK byla i v této studii dobrá [55].
U karcinomu plic proběhla řada jak retrospektivních, tak prospektivních randomizovaných studií. Jejich souhrnná analýza v roce 2015 potvrdila zlepšení imunitních funkcí, kvality života i délky přežití vlivem přidání PSK anebo jiného extraktu z Coriolu ke standardní chemoterapii. V randomizovaných studiích byly používány převážně denní dávky 3 000 mg PSK nebo PSP dohromady s chemoterapií. Vlivem uvedených extraktů došlo ke snížení délky trvání dřeňového útlumu po chemoterapii. V krevním séru pacientů byly prokázány vyšší hladiny hemoglobinu, krevních destiček, leukocytů, neutrofilů, IgG a IgM protilátek, IL-1, IL-2, aktivity NK buněk, počtu CD4+ a poměru CD4+/CD8+. Po přidání extraktů z Coriolu k chemoterapii však nedošlo pouze ke zlepšení krevního obrazu a imunitních funkcí, ale i ke stabilnější tělesné hmotnosti pacientů. Dále studie zaznamenaly méně s nádory spojených příznaků, jako je únava, nechutenství, nevolnost, noční pocení, palpitace, dušnost, nespavost, úzkosti apod. Extrakty z Coriolu neovlivnily krevní srážlivost a ve studiích je pacienti užívali bez vedlejších účinků až 5 let. Vzhledem k imunostimulačnímu působení by však jejich užívání mělo být u jedinců s autoimunitními chorobami a u pacientů na imunosupresivní léčbě nebo po transplantaci kostní dřeně kontraindikováno. Autoři ve svém závěru podpořili hypotézu protinádorového účinku extraktů z Coriolu cestou imunomodulace a aktivace imunitního dohledu nad nádory. Coriolus dle nich dokáže zmírnit imunosupresi, která doprovází chemoterapii, a to bez rizika postižení ledvinných anebo jaterních funkcí. Zlepšuje tak tolerabilitu onkologické léčby [56].
Také další studie prokazují zlepšení kvality života onkologických pacientů vlivem přidání extraktu z Coriolu. Na souboru pacientů s karcinomy hlavy a krku byla např. prokázána menší potřeba analgetik [57].
Obecně klinické randomizované studie prokázaly význam Coriolu především ve schopnosti imunostimulace oslabených onkologických pacientů a zlepšení jejich přežití a kvality života. Ve studiích se však volily vysoké denní dávky – minimálně 3 000 mg i více. Výhodou je podobně jako u extraktů z Reishi možnost dlouhodobého podávání jak během léčby, tak i po ní (tab. 2).
Tab. 2. Příklady klinických randomizovaných studií s extrakty z Coriolu (PSK nebo PSP) u nádorových onemocnění – stručný souhrn výsledků. 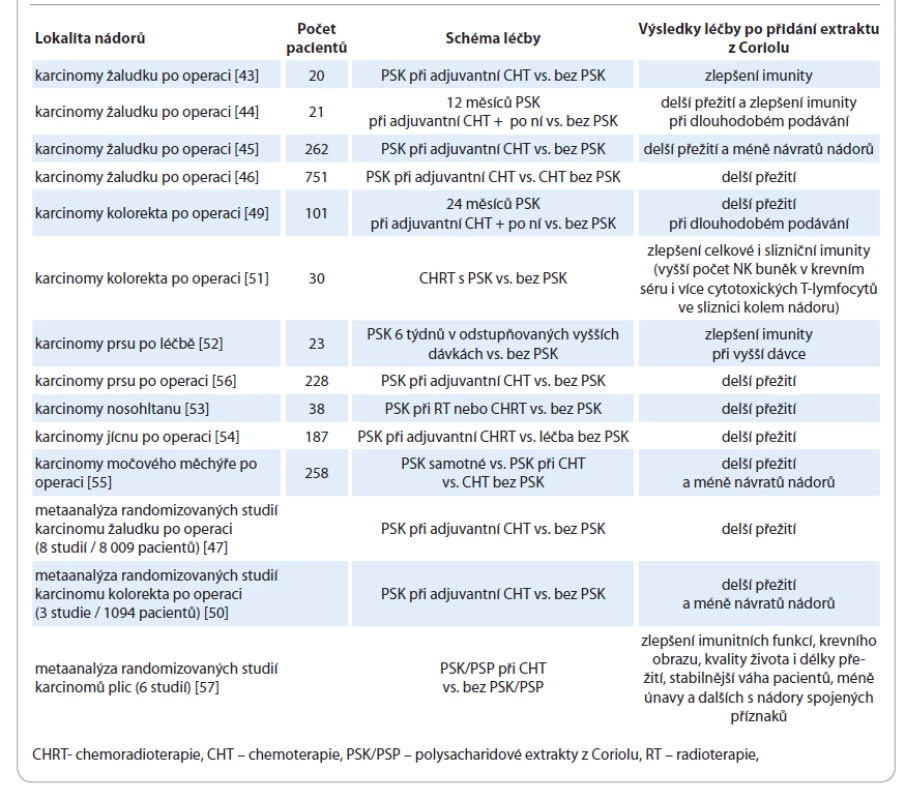
Závěr
Imunosuprese, která je vyvolána již samotnou přítomností zhoubného nádoru v těle, vede ke ztrátě imunitní kontroly nad onemocněním, urychlení šíření nádoru a zhoršení prognózy a přežití pacientů [27,28]. Tento stav oslabení imunity je pak ještě více vystupňován vlivem onkologické léčby, jako je operace a adjuvantní chemoterapie, a může dokonce přetrvávat i dlouhodobě po vyléčení. To vede nejen k častějším návratům onemocnění, ale skrytě také k výskytu druhotných nádorů a k oslabení imunity vůči řadě infekcí [29]. Chemoterapie je ve stavu imunosuprese onkologických pacientů tedy dvousečná zbraň, která sice v pooperačním období bojuje proti zbytkovým nádorovým buňkám, ale současně ještě více tlumí již tak oslabený imunitní systém. Z toho důvodu jsou v praxi, zejména pak v pooperačním období, s úspěchem zkoušeny možnosti kombinace standardních cytotoxických chemoterapeutik s imunostimulancii [54]. Extrakty z hub Reishi a Coriolu jsou přírodní produkty, které nejsou pro organizmus zatěžující a již v minulosti opakovaně prokázaly stimulující vliv na imunitní obranyschopnost jak proti infekcím, tak i proti nádorům. Do současné doby s nimi proběhla řada klinických studií, které zahrnovaly mimo jiné onkologické pacienty. Určitým limitem pro jejich zhodnocení může být variabilita používaných produktů, ale i přesto metaanalýzy těchto studií potvrdily nesporný účinek na zlepšení imunitních funkcí, snížení rizika recidiv, prodloužení přežití, zlepšení kvality života a současnou bezpečnost pro jedince oslabené nádorovým onemocněním a onkologickou léčbou. V asijských zemích, kde mají největší tradici, jsou mezi lékaři již oficiálně schválené jako účinné a bezpečné imunostimulační produkty pro onkologické pacienty, a staly se u nich dokonce běžným doplňkem standardní léčby. V ČR i dalších evropských zemích, kde nemají takovou historii, jsou sice také dostupné, ale zatím jen jako doplňky stravy. Klíčovým problémem u nás zůstává variabilita na trhu nabízených produktů. Vždy je proto potřeba volit pouze renomované firmy zaručující kvalitu extrakce, čistotu produktu a dostatečné procento v něm obsažených polysacharadidů. U extraktů z Reishi je pro onkologické pacienty vedle obsahu polysacharidů důležité také procento triterpenů. K dosažení klinického efektu jsou dle dostupných studií u standardizovaných extraktů potřeba denní dávky minimálně 3 000 mg a více pro dospělé, u dětí pak poloviční dle věku a váhy. Jedná se tedy o mnohem vyšší dávky, než jsou používané pro prevenci. Stran možných interakcí a omezení by se Reishi měli vyhnout jedinci s antiagregační léčbou anebo vyšším rizikem krvácení. Extrakty z Coriolu pro svůj silnější imunostimulační účinek zase nejsou vhodné pro pacienty s autoimunitními chorobami, po transplantaci kostní dřeně anebo při probíhající imunosupresivní léčbě.
Autoři deklarují, že v souvislosti s předmětem
studie nemají žádné komerční zájmy.
The authors declare they have no potential
confl icts of interest concerning drugs, products,
or services used in the study.
Redakční rada potvrzuje, že rukopis práce
splnil ICMJE kritéria pro publikace zasílané do
bi omedicínských časopisů.
The Editorial Board declares that the manuscript
met the ICMJE recommendation for biomedical
papers.
doc. MUDr. Břetislav Gál, Ph.D.
Klinika otorinolaryngologie
a chirurgie hlavy a krku
LF UK a FN sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: b.gal@fnusa.cz
Obdrženo/Submitted: 21. 3. 2020
Přijato/Accepted: 26. 4. 2020
Zdroje
1. Zhong L, Yan P, Lam WC et al. Coriolus versicolor and Ganoderma lucidum related natural products as an adjunct therapy for cancers: a systematic review and meta--analysis of randomized controlled trials. Front Pharmacol 2019; 13 (10): 703. doi: 10.3389/fphar.2019.00703.
2. Gao YH, Sai XH, Chen GL et al. A randomized, placebo--controlled, multi-center study of Ganoderma lucidum (W. Curt.: Fr.) Lloyd (Aphyllophoromycetideae) polysaccharides (Ganopoly) in patients with advanced lung cancer. Int J Med Mushrooms 2003; 5 : 368–581. doi: 10.1615/InterJMedicMush.v5.i4.40.
3. Chiu HF, Fu HY, Lu YY et al. Triterpenoids and polysaccharide peptides-enriched Ganoderma lucidum: a randomized, double-blind placebo-controlled crossover study of its antioxidation and hepatoprotective efficacy in healthy volunteers. Pharm Biol 2017; 55 (1): 1041–1046. doi: 10.1080/13880209.2017.1288750.
4. Shing MK, Leung TF, Chu YL et al. Randomized, double--blind and placebo-controlled study of the immunomodulatory effects of Lingzhi in children with cancers. [online]. Available from: https: //ascopubs.org/doi/abs/10.1200/jco.2008.26.15_suppl.14021.
5. Henao SLD, Urrego SA, Cano AM et al. Randomized clinical trial for the evaluation of immune modulation by yogurt enriched with b-glucans from Lingzhi or Reishi medicinal mushroom, Ganoderma lucidum (Agaricomycetes), in children from Medellin, Colombia. Int J Med Mushrooms 2018; 20 (8): 705–716. doi: 10.1615/IntJMedMushrooms.2018026986.
6. Avtonomova AV, Krasnopolskaya LM. Antiviral properties of basidiomycetes metabolites. Antibiot Khimioter 2014; 59 (7–8): 41–48.
7. Zhu Q, Bang TH, Ohnuki K et al. Inhibition of neuraminidase by Ganoderma triterpenoids and implications for neuraminidase inhibitor design. Sci Rep 2015; 5 : 13194. doi: 10.1038/srep13194.
8. Zheng DS, Chen LS. Triterpenoids from Ganoderma lucidum inhibit the activation of EBV antigens as telomerase inhibitors. Exp Ther Med 2017; 14 (4): 3273–3278. doi: 10.3892/etm.2017.4883.
9. Huh S, Lee S, Choi SJ et al. Quercetin synergistically inhibit EBV-associated gastric carcinoma with Ganoderma lucidum extracts. Molecules 2019; 24 (21): 3834. doi: 10.3390/molecules24213834.
10. Niedermeyer TH, Lindequist U, Mentel R et al. Antiviral terpenoid constituents of Ganoderma pfeifferi. J Nat Prod. 2005; 68 (12): 1728–1731. doi: 10.1021/np0501886.
11. Hijikata Y, Yamada S, Yasuhara A. Herbal mixtures containing the mushroom Ganoderma lucidum improve recovery time in patients with herpes genitalis and labialis. J Altern Complement Med 2007; 13 (9): 985–987. doi: 10.1089/acm.2006.6297.
12. Donatini B. Control of oral human papillomavirus (HPV) by medicinal mushrooms, Trametes versicolor and Ganoderma lucidum: a preliminary clinical trial. Int J Med Mushrooms 2014; 16 (5): 497–498. doi: 10.1615/intjmedmushrooms.v16.i5.80.
13. Sohretoglu D, Huang S. Ganoderma lucidum Polysaccharides as An Anti-cancer Agent. Anticancer Agents Med Chem 2018; 18 (5): 667–674. doi: 10.2174/1871520617666171113121246.
14. Wachtel-Galor S, Yuen J, Buswell JA et al. Ganoderma lucidum (Lingzhi or Reishi): A medicinal mushroom. In: Benzie IFF, Wachtel-Galor S (eds.). Herbal Medicine: Biomolecular and Clinical Aspects. 2nd edition. Boca Raton (FL): CRC Press/Taylor & Francis 2011; Chapter 9.
15. Wu GS, Guo JJ, Bao JL. Anticancer properties of triterpenoids isolated from Ganoderma lucidum – a review. Expert Opin Investig Drugs 2013; 22 (8): 981–992. doi: 10.1517/13543784.2013.805202.
16. Neil JR, Smith JE, Sullivan R. Immunomodulatory activities of mushroom glucans and polysaccharide-protein complexes in animals and humans (a review). Int J Med Mushrooms 2003; 5 : 95–110. doi: 10.1615/InterJMedicMush.v5.i2.10.
17. Liang C, Tian D, Liu Y et al. Review of the molecular mechanisms of Ganoderma lucidum triterpenoids: Ganoderic acids A, C2, D, F, DM, X and Y. Eur J Med Chem 2019; 174 : 130–141. doi: 10.1016/j.ejmech.2019.04.039.
18. Gao JJ, Min BS, Ahn EM et al. New triterpene aldehydes, lucialdehydes A-C, from Ganoderma lucidum and their cytotoxicity against murine and human tumor cells. Chem Pharm Bull 2002; 50 (6): 837–840. doi: 10.1248/cpb.50.837.
19. Sun Y, Sun L. Cellular and molecular mechanism of Ganoderma (Lingzhi) against tumor. Adv Exp Med Biol 2019; 1182 : 79–118. doi: 10.1007/978-981-32-9421-9_3.
20. Sohretoglu D, Huang S. Ganoderma lucidum polysaccharides as an anti-cancer agent. Anticancer Agents Med Chem 2018; 18 (5): 667–674. doi: 10.2174/1871520617666171113121246.
21. Wang YY, Khoo KH, Chen ST et al. Studies on the immuno-modulating and antitumor activities of Ganoderma lucidum (reishi) polysaccharides: functional and proteomic analyses of fucose-containing glycoprotein fraction responsible for the activities. Bioorg Med Chem 2002; 10 (4): 1057–1062. doi: 10.1016/s0968-0896 (01) 00377-7.
22. Chang YH, Yang JS, Yang JL et al. Gandoderma lucidum extract promotes immune responses in normal BALB/c mice in vivo. In Vivo 2009; 23 (5): 755–759.
23. Wang PY, Zhu XL, Lin ZB. Antitumor and immunomodulatory effects of polysaccharides from broken-spore of Ganoderma lucidum. Front Pharmacol 2012; 3 : 135. doi: 10.3389/fphar.2012.00135.
24. Zhang J, Tang Q, Zimmerman-Kordmann M et al. Activation of B lymphocytes by GLIS, a bioactive proteoglycan from Ganoderma lucidum. Life Sci 2002; 71 (6): 623–638. doi: 10.1016/s0024-3205 (02) 01690-9.
25. Kladar NV, Gavarić NS, Božin BN. Ganoderma: insights into anticancer effects. Eur J Cancer Prev 2016; 25 (5): 462–471. doi: 10.1097/CEJ.0000000000000204.
26. Joseph S, Sabulal B, George V et al. Antitumor and anti-inflammatory activities of polysaccharides isolated from Ganoderma lucidum. Acta Pharm 2011; 61 (3): 335–342. doi: 10.2478/v10007-011-0030-6.
27. Šťastný M, Říhová B. Únikové strategie nádorů pozornosti imunitního systému. Klin Onkol 2015; 28 (Suppl 4): 28–37. doi: 10.14735/amko20154s28.
28. Hatina J. Imunologie nádorů – současný stav a poznatky z 1. mezinárodní konference základní a klinické imunogenomiky. Část I – Interakce nádoru a imunitního systému. Klin Onkol 2005; 18 (4): 119–125.
29. Eckschlager T, Radvanská J, Hladíková M et al. Poruchy imunity jako pozdní následky protinádorové léčby u dětí. In: 2007 XXXI. Brněnské onkologické dny a XXI. Konference pro sestry a laboranty, Dětská onkologie. Sborník abstrakt: 82.
30. Gao YH, Zhou SF, Jiang W et al. Effects of Ganopoly (a Ganoderma lucidum polysaccharide extract) on immune functions in advanced-stage cancer patients. Immunol Invest 2003; 32 (3): 201–215. doi: 10.1081/imm-120022979.
31. Jin X; Ruiz Beguerie J; Sze DM et al. Ganoderma lucidum (Reishi mushroom) for cancer treatment. Cochrane Database Syst Rev 2016; 4 (4): CD007731. doi: 10.1002/14651858.CD007731.pub3.
32. Sun LX, Li WD, Lin ZB et al. Protection against lung cancer patient plasma-induced lymphocyte suppression by Ganoderma lucidum polysaccharides. Cell Physiol Biochem 2014; 33 (2): 289–299. doi: 10.1159/000356669.
33. Oka S, Tanaka S, Yoshida S et al. A water-soluble extract from culture medium of Ganoderma lucidum mycelia suppresses the development of colorectal adenomas. Hiroshima J Med Sci 2010; 59 (1): 1–6.
34. Suprasert P, Apichartpiyakul C, Sakonwasun C et al. Clinical characteristics of gynecologic cancer patients who respond to salvage treatment with Lingzhi. Asian Pac J Cancer Prev 2014; 15 (10): 4193–4196. doi: 10.7314/apjcp.2014.15.10.4193.
35. Zhao H, Zhang Q, Zhao L et al. Spore powder of Ganoderma lucidum improves cancer-related fatigue in breast cancer patients undergoing endocrine therapy: a pilot clinical trial. Evid Based Complement Alternat Med 2012; 2012 : 809614. doi: 10.1155/2012/809614.
36. Collado Mateo D, Pazzi F, Domínguez Muñoz FJ et al. Ganoderma lucidum improves physical fitness in woman with fibromyalgia. Nutr Hosp 2015; 32 (5): 2126–2135. doi: 10.3305/nh.2015.32.5.9601.
37. Zhang J, Gao X, Pan Y et al. Toxicology and immunology of Ganoderma lucidum polysaccharides in Kunming mice and Wistar rats. Int J Biol Macromol 2016; 85 : 302–310. doi: 10.1016/j.ijbiomac.2015.
38. Dou H, Chang Y, Zhang L. Coriolus versicolor polysaccharopeptide as an immunotherapeutic in China. Prog Mol Biol Transl Sci 2019; 163 : 361–381. doi: 10.1016/bs.pmbts.2019.03.001.
39. PDQ Integrative, Alternative, and Complementary Therapies Editorial Board. Medicinal Mushrooms (PDQ®): Health Professional Version. 2019 Oct 25. In: PDQ Cancer Information Summaries. [online]. Available from: https: //pubmed.ncbi.nlm.nih.gov/27929633/.
40. Maehara Y, Tsujitani S, Saeki H et al. Biological mechanism and clinical effect of protein-bound polysaccharide K (KRESTIN (®)): review of development and future perspectives. Surg Today 2012; 42 (1): 8–28. doi: 10.1007/s00595-011-0075-7.
41. Ng TB. A review of research on the protein-bound polysaccharide (polysaccharopeptide, PSP) from the mushroom Coriolus versicolor (Basidiomycetes: Polyporaceae). Gen Pharmacol 1998; 30 (1): 1–4. doi: 10.1016/s0306-3623 (97) 00076-1.
42. Kono K, Kawaguchi Y, Mizukami Y et al. Protein-bound polysaccharide K partially prevents apoptosis of circulating T cells induced by anti-cancer drug S-1 in patients with gastric cancer. Oncology 2008; 74 (3–4): 143–149. doi: 10.1159/000151361.
43. Akagi J, Baba H. PSK may suppress CD57+ T cells to improve survival of advanced gastric cancer patients. Int J Clin Oncol 2010; 15 (2): 145–152. PSK may suppress CD57+ T cells to improve survival of advanced gastric cancer patients.
44. Nakazato H, Koike A, Saji S et al. Efficacy of immunochemotherapy as adjuvant treatment after curative resection of gastric cancer. Study Group of Immunochemotherapy with PSK for Gastric Cancer. Lancet 1994; 343 (8906): 1122–1126. doi: 10.1016/s0140-6736 (94) 90233-x.
45. Toge T, Yamaguchi Y. Protein-bound polysaccharide increases survival in resected gastric cancer cases stratified with a preoperative granulocyte and lymphocyte count. Oncol Rep 2000; 7 (5): 1157–1161. doi: 10.3892/or.7.5.1157.
46. Oba K, Teramukai S, Kobayashi M et al. Efficacy of adjuvant immunochemotherapy with polysaccharide K for patients with curative resections of gastric cancer. Cancer Immunol Immunother 2007; 56 (6): 905–911. doi: 10.1007/s00262-006-0248-1.
47. Yoshitani S, Takashima S. Efficacy of postoperative UFT (Tegafur/Uracil) plus PSK therapies in elderly patients with resected colorectal cancer. Cancer Biother Radiopharm 2009; 24 (1): 35–40. doi: 10.1089/cbr.2008.0547.
48. Sakai T, Yamashita Y, Maekawa T et al. Immunochemotherapy with PSK and fluoropyrimidines improves long--term prognosis for curatively resected colorectal cancer. Cancer Biother Radiopharm 2008; 23 (4): 461–467. doi: 10.1089/cbr.2008.0484.
49. Sakamoto J, Morita S, Oba K et al. Meta-analysis group of the Japanese society for cancer of the colon rectum. Efficacy of adjuvant immunochemotherapy with polysaccharide K for patients with curatively resected colorectal cancer: a meta-analysis of centrally randomized controlled clinical trials. Cancer Immunol Immunother 2006; 55 (4): 404–411. doi: 10.1007/s00262-005-0054-1.
50. Sadahiro S, Suzuki T, Maeda Y et al. Effects of preoperative immunochemoradiotherapy and chemoradiotherapy on immune responses in patients with rectal adenocarcinoma. Anticancer Res 2010; 30 (3): 993–999.
51. Torkelson CJ, Sweet E, Martzen MR et al. Phase 1 clinical trial of Trametes versicolor in women with breast cancer. ISRN Oncol 2012; 2012 : 251632. doi: 10.5402/2012/251632.
52. Go P, Chung CH. Adjuvant PSK immunotherapy in patients with carcinoma of the nasopharynx. J Int Med Res 1989; 17 : 141–149. doi: 10.1177/030006058901700205.
53. Ogoshi K, Satou H, Isono K et al. Immunotherapy for esophageal cancer. A randomized trial in combination with radiotherapy and radiochemotherapy. Am J Clin Oncol 1995; 18 (3): 216–222.
54. Matsumoto K, Nakagami Y, Kishimoto T. The prevention of recurrence of superficical bladder tumours with immunochemotherapy. In: deKernion JB (ed.). International society of urology reports. Immunotherapy of urological tumours. Edinburgh: Churchill Livingstone 1990 : 149–155.
55. Iino Y, Yokoe T, Maemura M et al. Immunochemotherapies versus chemotherapy as adjuvant treatment after curative resection of operable breast cancer. Anticancer Res 1995; 15 (6B): 2907–2911.
56. Fritz H, Kennedy DA, Ishii M et al. Polysaccharide K and Coriolus versicolor extracts for lung cancer: a systematic review. Integr Cancer Ther 2015; 14 (3): 201–211. doi: 10.1177/1534735415572883.
57. Motai H. PSK effectiveness for cancer pain relief: clinical study covering the last 11 years. Biotherapy 1992; 6 : 950–956.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Chemie jménem CRISPRČlánek Aktuality z odborného tisku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Chemie jménem CRISPR
- Praktický návod pro testování a cílenou léčbu dospělých pacientů se solidními nádory s genovou fúzí NTRK v běžné klinické praxi
- Možnosti rehabilitácie pri sarkopénii a kachexii onkologických pacientov
- Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
- Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
- První klinické zkušenosti v České republice s aplikací perirektálního hydrogelu před radioterapií pro karcinom prostaty
- SNHG7 a FAIM2 jsou ve tkáni kolorektálního karcinomu up-regulovány a koexprimovány
- Ukrajinská multicentrická prospektivní studie hodnoty prognostické role PET/ CT u primárních pacientů s Hodgkinovým lymfomem v kohortě z reálného života
- Dabrafenib v monoterapii u BRAF+ nemalobuněčného karcinomu plic – naše zkušenosti
- Multirezistentná oportúnna talaromykóza u pa cientky s karcinómom ovária
- Atezolizumab a bevacizumab v léčbě hepatocelulárního karcinomu
- Aktuality z odborného tisku
- Hodnocení expozice nízkým dávkám u hypofrakcionované radioterapii prsu s modulovanou intenzitou – zohlednění účinku velikosti frakce při lineárně-kvadratickém modelu
- Profesor Pavel Šlampa slaví 60 let
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Imunostimulační a protinádorový účinek extraktů z Reishi a Coriolu na úrovni klinických studií a stav jejich zavedení do praxe
- První klinické zkušenosti v České republice s aplikací perirektálního hydrogelu před radioterapií pro karcinom prostaty
- Stomatitidy při terapii s inhibitory mTOR a další cílené onkologické terapii, možnosti ovlivnění a význam lokální kortikoterapie
- Možnosti rehabilitácie pri sarkopénii a kachexii onkologických pacientov
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



