-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Syntetická letalita – její současné využití a potenciál v onkologické léčbě
Synthetic Lethality – Its Current Application and Potential in Oncological Treatment
Background: Synthetic lethality is a gene interaction where a defect in one of the interacting genes is compatible with cell viability, whereas the disruption of both genes leads to cell death. The discovery of the lethal effect of poly(ADP-ribose) polymerase (PARP) inhibitors in BRCA1/2 mutant cells has opened an important direction in the development of targeted therapy in oncology. The PARP inhibitor olaparib has become the first registered drug for recurrent high-grade serous ovarian cancer treatment based on synthetic lethality that has reached the clinic. Current research focuses on the combination of PARP inhibitors and inhibitors of kinases, which control the cell cycle, to prevent or overcome resistance to PARP inhibitors. There are also ongoing clinical trials which examine PARP inhibitor treatment in other types of cancers including tumours presenting the so-called BRCAness phenotype. Screenings for new synthetic lethalities which could serve as potential targets for new drug development have improved with the CRISPR/Cas9 technology, but another key problem persists in the screening efforts, namely the incomplete penetrance of synthetic lethality throughout a tumour cell population.
Purpose: This paper summarises the current application of synthetic lethality principles in oncology and discusses the challenges in research focused on potential new drugs based on synthetic lethality.
Keywords:
synthetic lethality – PARP inhibitors – olaparib – BRCAness – DNA repair
Autoři: L. Bortlíková 1; P. Müller 1; B. Vojtěšek 1; V. Rak 2; M. Svoboda 3
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; Klinika radiační onkologie, Masarykův onkologický ústav, Brno 2; Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Klin Onkol 2019; 32(Supplementum 3): 19-24
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20193SSouhrn
Východiska: Syntetická letalita je typ genové interakce, při níž je mutace v jednom z interagujících genů slučitelná s životaschopností buňky, ale vyřazení obou genů z funkce vede k buněčné smrti. Odhalením letálního účinku inhibitorů poly(ADP-ribóza) polymerázy (PARP) na BRCA1/ 2 mutantní buňky byl otevřen jeden z důležitých směrů vývoje cílené terapie v onkologii. Olaparib patřící do skupiny inhibitorů PARP se díky tomu mohl stát prvním registrovaným léčivem fungujícím na principu syntetické letality a je nyní používán v klinické praxi hlavně v léčbě rekurentních high-grade serózních ovariálních karcinomů. Současný výzkum se zaměřuje na kombinovaný přístup, kdy by se podáním inhibitorů PARP spolu s inhibitory kináz zapojených do kontroly buněčného cyklu mohlo předcházet rezistenci k léčbě inhibitory PARP či již vzniklou rezistenci překonat. Zároveň probíhají klinické studie, které by mohly pomoci rozšířit využití inhibitorů PARP pro další typy malignit vykazující obdobný fenotyp jako mutace v genech BRCA (BRCAness fenotyp). Hledání dalších cílů pro vývoj nových léčiv na principu syntetické letality bylo usnadněno díky metodě CRISPR/ Cas9, stále však přetrvává klíčový faktor neúspěchů screeningových experimentů, kterým je neúplná penetrance syntetické letality napříč populací buněk tumoru.
Cíl: Záměrem této práce je poskytnout přehled současného využití principu syntetické letality v onkologické léčbě a nastínit, s jakými výzvami se nyní potýká výzkum potenciálních cílů pro vývoj nových léčiv založených na syntetické letalitě.
Klíčová slova:
syntetická letalita – inhibitory PARP – olaparib – BRCAness – opravy DNA
Úvod
Syntetická letalita byla popsána jako typ genové interakce, při níž je v případě defektu v jednom z interagujících genů životaschopnost buňky zachována, zatímco poškození obou genů vede k buněčné smrti [1] (schéma 1A). Poprvé byl tento koncept zaveden u modelového organizmu Drosophila melanogaster, což vedlo k intenzivnímu zájmu o toto téma z pohledu vývojové biologie i genetiky, ale až díky několika významným pracím [2–4] vznikla myšlenka využít princip syntetické letality při vývoji nových terapeutických postupů v onkologii [5].
Schéma 1. Syntetická letalita. 
A. Klasické schéma syntetické letality mezi geny A a B – mutace v jednom z těchto dvou genů je slučitelná s přežitím buňky, mutace v obou genech způsobí buněčnou smrt.
B. Schéma syntetické letality v případě indukované esenciality – mutace v antionkogenu způsobí u buňky závislost na funkčním genu C, pokud je gen C následně také mutován či jinak inhibován, buňka není schopná přežít [1].Z pohledu nádorové biologie se nejčastěji setkáváme se syntetickou letalitou ve formě indukované esenciality, mutace v genu nádorového supresoru může způsobit, že se díky ní stane jiný gen pro buňku esenciální [1] (schéma 1B). Tím se pak tento gen nebo jím kódovaný protein stává vhodným kandidátem pro cílenou farmakologickou inhibici. Na základě vztahu syntetické letality mezi oběma geny je tato inhibice fatální pouze pro nádorové buňky nesoucí mutaci v antionkogenu a u nenádorových buněk buněčná smrt nenastane [5].
Biologie nádorových buněk je však velmi komplexní a genové interakce mohou mít mnoho podob. I u syntetické letality je na základě charakteru interakce dvou genů možno rozlišovat mezi silnou a slabou syntetickou letalitou, přičemž silnou syntetickou letalitu není téměř vůbec možné ovlivnit změnou v dalších genech. Naopak při slabé syntetické letalitě se buňka nesoucí jinak letální mutace může vyhnout buněčné smrti vznikem nové mutace v dalším genu. Co se týče výběru genových interakcí, na které by mohla být uplatněna farmakologická inhibice za účelem protinádorové terapie, je žádoucí volit za cíl geny, které jsou ve vzájemném vztahu silné syntetické letality [1].
Inhibitory PARP
Významným spojníkem principu syntetické letality a vývoje nových terapeutických přístupů založených na inhibitorech poly(ADP-ribóza) polymerázy (PARP) byly dvě práce publikované v roce 2005 [6,7]. Obě poukázaly na vztah syntetické letality mezi PARP a geny BRCA1 a BRCA2 [5]. Buňky deficientní v genu BRCA1 či BRCA2 se ukázaly být velmi významně citlivé k inhibici PARP, která u nich vede k nestabilitě chromozomů, zastavení buněčného cyklu a postupné apoptóze [6,7].
BRCA1 a BRCA2 jsou tumor supresorové geny, jejichž funkce je důležitá pro opravu dvouvláknových zlomů DNA pomocí homologní rekombinace (HR). Pokud jsou v zárodečné linii heterozygotně mutované, zvyšuje se pravděpodobnost vzniku různých typů karcinomů [8]. Inhibitory PARP cílí na další z typů oprav poškozené DNA, v tomto případě jednovláknových zlomů. Funkční enzymy PARP1 a PARP2 jsou zásadní pro správnou aktivaci kaskády vedoucí k opravě DNA pomocí nehomologního spojování konců (non-homologous end joining – NHEJ), a především pomocí excizní reparace bází (base excision repair – BER) tím, že se vážou do jednovláknových zlomů a postranslačně modifikují substrát syntézou poly(ADP-ribózových) řetězců, tzv. PARylací [5,8]. Inhibice PARP vede k replikačnímu stresu a zapříčiňuje tak vznik dvouvláknových zlomů, které u BRCA mutantních buněk nemohou být opraveny pomocí HR, což vede k zastavení buněčného cyklu a k buněčné smrti [6,9].
Nadějné výsledky, které vzešly z preklinické fáze testování inhibitorů PARP, byly dále zkoumány v klinických studiích zahrnujících pacientky s ovariálním karcinomem nesoucím mutaci v genech BRCA1/ 2 [10,11]. Na základě dobré odpovědi v klinických zkouškách dostal v roce 2014 první inhibitor PARP s názvem olaparib (obr. 1) zrychlené schválení od amerického Úřadu pro kontrolu potravin a léčiv (U.S. Food and Drug Administration – FDA). O něco později byl také schválen Evropskou lékovou agenturou (European Medicines Agency – EMA) [9,12]. V současné době je olaparib podle EMA registrován k udržovací léčbě po chemoterapii na bázi platiny pro dospělé pacienty s BRCA1/ 2 mutantním nebo k platině citlivým (bez ohledu na BRCA status) rekurentním epiteliálním high-grade karcinomem ovaria, vejcovodu či peritonea. Navíc obdržel schválení od FDA také k léčbě HER2 negativního metastazujícího karcinomu prsu po prodělané chemoterapii u pacientů se zárodečnou mutací v BRCA1/ 2 [9]. Dalšími registrovanými inhibitory PARP pro léčbu ovariálních karcinomů jsou také rucaparib a niraparib [5,9] (obr. 1). Objevuje se také stále více experimentálních dat zaměřených na použití inhibitorů PARP i u jiných malignit nesoucích mutaci BRCA, např. u karcinomu pankreatu nebo prostaty [13].
Obr. 1. Chemické struktury olaparibu, niraparibu a rucaparibu. 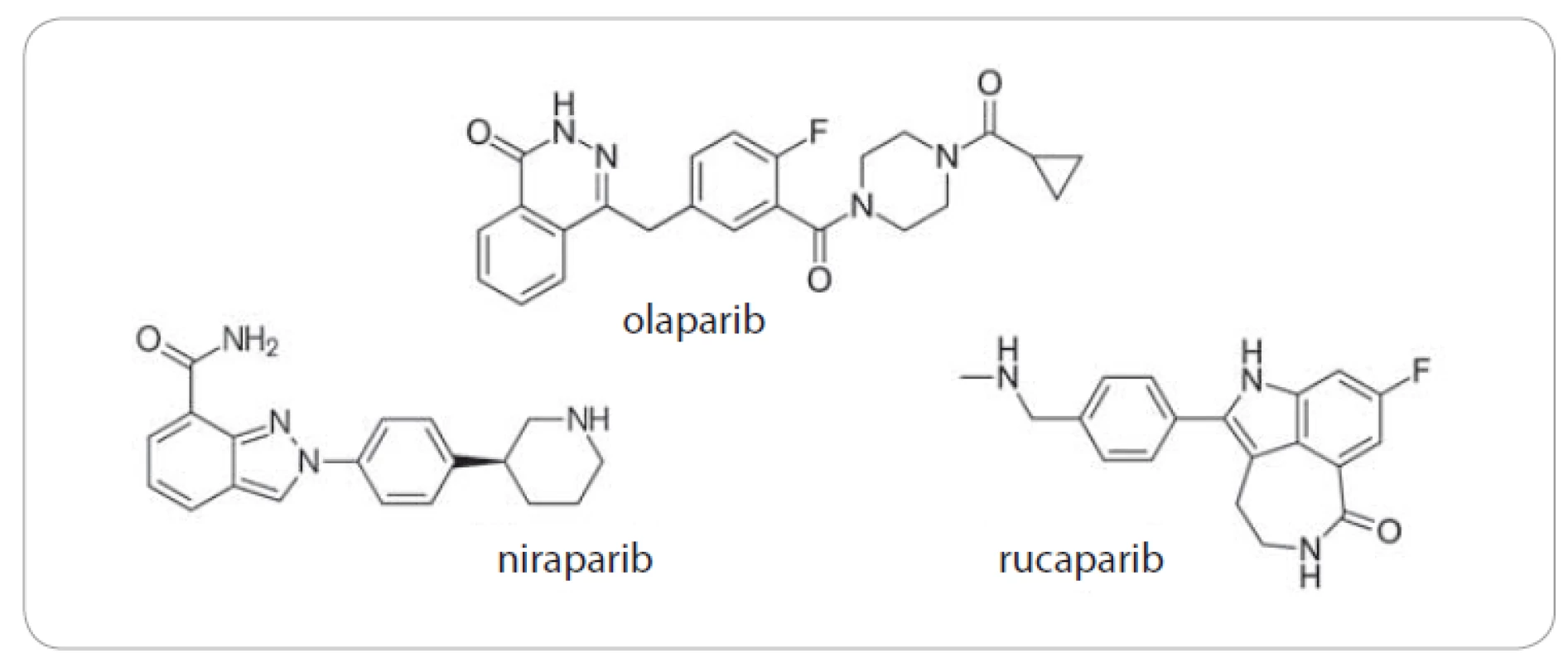
Rezistence vůči léčbě inhibitory PARP
I přes obecně dobrou odpověď na léčbu inhibitory PARP se u značné části pacientů s ovariálním karcinomem i karcinomem prsu vyskytují případy rezistence [5]. Mechanizmů jejího vzniku bylo navrženo několik, přičemž velká část z nich je založena na obnovení HR u nádorových buněk [13]. V jejich nestabilním genomu mohou po inhibici oprav DNA normálně zprostředkovaných PARP vznikat reverzní mutace, které přímo obnovují funkci genu BRCA2 [14] a na základě přirozené selekce začnou být dominantní a proliferovat hlavně ty klony nádorových buněk, které nesou reverzní mutaci [5]. Některé práce také ukazují, že HR může být obnovena ztrátou či sníženou expresí proteinu 53BP1 (p53 binding protein 1) [15] nebo mutací REV7 (znám také jako MAD2L2) (mitotic arrest deficient 2 like 2) [16]. REV7 je součástí nedávno popsaného proteinového komplexu Shieldin, jehož další tři podjednotky jsou SHLD1, SHLD2 a SHLD3. Tento komplex se shlukuje kolem dvouvláknových zlomů DNA a jako opravný mechanizmus podporuje NHEJ [17,18]. Ztráta Shieldinu tedy narušuje NHEJ a podporuje rezistenci k inhibitorům PARP skrze obnovenou HR u BRCA mutantních buněk [18,19].
U buněčných linií odvozených od nádoru tlustého střeva bylo prokázáno, že inhibitory PARP snižují expresi proteinu PARP1, čímž se zvyšuje rezistence buněk vůči těmto inhibitorům [20]. Podobně snížení endogenní hladiny proteinu PARP1 působením miRNA-210 vede k rezistenci vůči inhibitorům PARP [21,22]. Na druhou stranu je podle další studie také overexprese PARP1 u buněčné linie odvozené od karcinomu prsu spojena s rezistencí vůči olaparibu [23].
Dalším z prokázaných mechanizmů rezistence vůči inhibitorům PARP u myších modelů bylo snížení intracelulární koncentrace rucaparibu, zapříčiněné jeho efluxem z buněk skrze up-regulaci BCRP/ ABCG2 (breast cancer resistance protein), a P-glykoproteinu ABCB1, které jsou oba členy proteinové super-rodiny ABC (ATP-binding cassette) transportérů [22,24,25].
Pro vývoj terapeutických strategií, které by vedly k překonání rezistence vůči inhibitorům PARP, však bude nutné provést další studie, jež by význam výše zmíněných mechanizmů navržených na základě experimentů na myších modelech a buněčných liniích zhodnotily také u onkologických pacientů [22].
Inhibitory PARP a kontrola buněčného cyklu
Podle aktuálních poznatků ovlivňují inhibitory PARP buněčný cyklus tak, že se zvyšující se koncentrací inhibitoru dochází k akumulaci buněk ve střední až pozdní S fázi a inhibici buněčné proliferace [26]. Pro buňky BRCA deficientních nádorů je zablokovaní PARylace olaparibem fatální pravděpodobně kvůli narušené schopnosti protekce replikační vidlice během S fáze a jejího následného kolapsu [6,7,27]. Původní model, ve kterém bylo navrženo, že inhibitory PARP způsobují tento kolaps v důsledku ustrnutí replikační vidlice [7], byl nedávno vyvrácen pomocí měření rychlosti progrese replikační vidlice. PARylace totiž za normálních okolností funguje společně s proteinem p21WAF jako senzor replikačního stresu a v koordinaci s celou regulační sítí ovládanou hlavně PARP1 a proteinem p53 rychlost replikační vidličky snižuje. Ovlivnění buněk 10µm olaparibem po dobu 24 hod zrychlilo šíření vidlice až o 60 %, přičemž již 40% zvýšení rychlosti oproti běžnému stavu vede k poškození DNA, které je u buněk s poruchou v HR nevratné [26].
V současné době je kladen důraz na optimalizaci kombinovaných přístupů tak, aby bylo možné vyhnout se vzniku rezistence vůči léčbě inhibitory PARP, popř. již vzniklou rezistenci překonat. Jedním z těchto přístupů je kombinace inhibitorů PARP spolu s inhibitory kináz – ATR (ataxia telangiectasia and Rad3-related protein), CHEK1 (checkpoint kinase 1) nebo WEE1 (WEE1 G2 checkpoint kinase), které jsou zapojeny do kontroly buněčného cyklu [28]. ATR funguje jako centrální kontrolní bod, který v případě poškození DNA aktivuje kinázu CHEK1 a vede k celkové zástavě replikace DNA. CHEK1 dále aktivuje WEE1, která přímou fosforylací udržuje inaktivní cyklin dependentní kinázy CDK1/ 2 (cyclin-dependent kinase 1/2), a tím udržuje buňku v G1 fázi buněčného cyklu [29–31]. Použití inhibitoru jednoho z komponent této dráhy společně s inhibitorem PARP by mělo limitovat čas určený pro opravu DNA (v případě vzniku rezistence např. pomocí obnovené HR), a tím posílit replikaci poškozené DNA. Nekontrolovatelná replikace následně vede k rozsáhlému poškození DNA, které se stává pro nádorovou buňku letální. Klinické studie, které kombinují olaparib a některý z inhibitorů buněčného cyklu, jsou nyní ve fázi I či II a poskytnou důležitá data o vlivu ATR, CHEK1 a WEE1 inhibitorů na rezistenci vůči léčbě inhibitory PARP [28].
Interakce mezi ATR, CHEK1 a WEE1
Z preklinických studií navíc vyplývá, že některé z výše uvedených kináz mají mezi sebou vztah syntetické letality [32–34], což může sloužit jako logický základ pro další klinické studie, které budou testovat také kombinace jejich inhibitorů v protinádorové terapii [28]. Například buněčná linie MCF-7 odvozená od karcinomu prsu vykazovala syntetickou letalitu po společném ovlivnění látkami VE821 (inhibitor ATR) a AZD7762 (inhibitor CHEK1) [28,32]. Inhibice CHEK1 totiž vede k zesílení replikačního stresu prostřednictvím CDK2 a k většímu počtu míst s jednovláknovou DNA, což normálně vede k aktivaci ATR, která chrání replikační vidlici před kolapsem pomocí replikačního proteinu A (replication protein A – RPA) [32,35]. Použití inhibitorů ATR a CHEK1 současně vedlo u MCF-7 buněk k velkému počtu zastavených replikačních vidlic kolabujících do dvouvláknových zlomů a následně k buněčné smrti [32]. V preklinických modelech se také současná inhibice CHEK1 a WEE1 ukázala být synteticky letální [33,34].
ATR, CHEK1 i WEE1 jsou si podobné v tom, jakou zastávají funkci v signální dráze kontroly přechodu buňky z G1 fáze, avšak podle dalších prací vykazují rozdílnou funkci v ochraně replikační vidlice [36–39]. Ta může být důležitá při volbě jedné z těchto tří kináz jako vhodného cíle k inhibici v kombinované terapii zaměřené na překonání rezistence vůči inhibitorům PARP. Pokud by totiž ochrana replikační vidlice byla u buněk s rezistencí k inhibitorům PARP jedním z kompenzačních mechanizmů, pak by bylo důležité zvolit inhibitor buněčného cyklu, který cílí nejen na opravu DNA pomocí HR, ale i na ochranu replikační vidlice. Tím by podle posledních prací mohly být inhibitory ATR a WEE1, nikoli však CHEK1 [28].
Využití inhibitorů PARP u nádorů s BRCAness fenotypem
K dalšímu rozšíření skupiny pacientů, která by benefitovala z léčby inhibitory PARP, by mohlo vést také studium nádorů s BRCAness fenotypem. Tento pojem se užívá k definování skupiny nádorů, které nenesou germinální mutaci v BRCA1/ 2, ale s BRCA mutantními nádory mají totožný fenotyp, což je způsobeno defektní HR [40]. Patří mezi ně především tumory se somatickou mutací v BRCA1/ 2, s hypermetylací v BRCA1 promotoru nebo nádory s mutací v dalších genech zapojených do opravy dvouvláknových zlomů DNA, jako je např. ATR, RAD51 (RAD51 recombinase), PALB2 (partner and localizer of BRCA2) či BRIP1 (BRCA1 interacting protein C-terminal helicase 1). Díky defektu v HR tyto nádory mohou také vykazovat syntetickou letalitu po aplikaci inhibitorů PARP [13,40]. S rozšířením sekvenování lidských nádorů se ukázalo, že mutace genů, které mohou vykazovat BRCAness fenotyp, nese značná část high-grade serózních ovariálních karcinomů, pokročilých kastračně rezistentních karcinomů prostaty, nádorů pankreatu a dalších typů tumorů [5,40–42]. Pro možnost využít inhibitory PARP u nádorů s tímto fenotypem je důležité stanovit biomarker, na jehož základě by bylo možné predikovat odpověď na léčbu inhibitory PARP [13]. Klinická studie I-SPY 2 testovala klasifikátor obsahující 77 genů navržený ke zhodnocení BRCA1ness fenotypu a předpovědi reakce na inhibici PARP společně s karboplatinou. Přestože autoři dokázali prokázat spojitost mezi klasifikací BRCA1ness a odpovědí pacientů na léčbu, tato studie zahrnovala jen omezený počet pacientů, takže spolehlivý biomarker, který by byl vhodný pro klinickou praxi, v současné době ještě dostupný není [13,40,43].
Vývoj léčiv založených na syntetické letalitě
Ačkoli je koncept syntetické letality znám již dlouho a její potenciál pro protinádorovou terapii byl odhalen už před více než 10 lety, inhibitory PARP jsou stále jedinými schválenými léčivy, které fungují na principu syntetické letality [5]. I když se nyní obrací pozornost k překonání mechanizmů rezistence vůči inhibitorům PARP a k rozšíření skupiny pacientů, pro které mohou být inhibitory PARP přínosné, stále je jen malá část onkologických pacientů léčena pomocí cílené terapie. Je tedy důležité hledat také nové geny, na které by se cílená léčba na principu syntetické letality mohla zaměřit [44].
V průběhu let bylo provedeno velké množství screeningů, jež měly odhalit významné syntetické letality mezi geny, které se často účastní vzniku nádorových onemocnění [5]. Že z těchto screeningů nevzešla nová úspěšná léčiva, bylo často připisováno hlavně technickým problémům jako např. RNA interferenci (RNAi), která byla používána k umlčování transkripce genů. Ačkoli novější způsob editace genů pomocí CRISPR/ Cas9 metodu RNAi předčil a vyvolal novou vlnu zájmu o screeningy, pořád přetrvává další klíčový faktor, který limituje hledání syntetických letalit významných pro klinickou praxi, a tím je neúplná penetrance syntetických letalit. Termín penetrance syntetické letality označuje, jaká část klonů nádorových buněk nesoucích specifikovanou genovou mutaci (tj. většinou „driver“ mutaci) podlehne buněčné smrti po inhibici cílového partnera, který je s tímto genem ve vztahu syntetické letality. V ideálním případě by léčba založená na syntetické letalitě měla mít úplnou penetranci. To znamená, že inhibice synteticky letálního partnera by u všech buněk nádoru nesoucích „driver“ mutaci vedla k buněčné smrti, a to bez ohledu na molekulární pozadí (tzn. bez ohledu na výskyt dalších mutací) [44].
Pro vývoj nových léčiv založených na synteticky letální interakci genů jsou tedy nevhodnější syntetické letality vykazující vysokou penetranci. Velká část screeningů však byla v minulosti uskutečněna pouze na jednom definovaném genetickém pozadí (např. na jedné buněčné linii), a chybí tedy informace o tom, jakou relevanci mají tyto synteticky letální vztahy napříč jinými genetickými pozadími [44]. Tomu nasvědčují i výsledky screeningu hledajícího synteticky letální partnery proto-onkogenu KRAS, který využil metodu CRISPR/ Cas9 u dvou buněčných linií kolorektálního karcinomu, kdy většina syntetických letalit byla identifikována pouze u jedné ze dvou buněčných linií [45]. Podobně v jiné studii, která zahrnovala tři buněčné linie a cílila na 73 genů zapojených do vzniku rakoviny, autoři identifikovali asi jen 10 % syntetických letalit u více než jedné buněčné linie [46].
Důvodem neúplné penetrance je na jedné straně tkáňová specificita genové regulace a signálních drah, kdy např. u panelu buněčných linií odvozených od akutní myeloidní leukemie byla potvrzena syntetická letalita mezi geny PREX1 a RAS, ale u linií odvozených od jiných buněčných typů po mutaci či inhibici obou genů k buněčné smrti nedojde [44,47]. Dalším důvodem je také heterogenita populace buněk v rámci jednoho nádoru, kdy nemusí všechny buňky napříč tumorem nést stejnou mutaci, podobně jako v případě výše zmíněného vzniku rezistence vůči inhibitoru PARP pomocí reverzní mutace obnovující u části buněk funkci genu BRCA2 [14,44].
Limitací screeningů zaměřených na syntetickou letalitu, které jsou prováděny in vitro na buněčných liniích rostoucích v jedné vrstvě na povrchu kultivační nádoby, je také omezená interakce mezi buňkami. Objevený vztah syntetické letality v tomto prostředí pak nemusí být platný v rámci nádoru, kde buněčná komunikace probíhá v 3D struktuře. Tento problém by mohlo řešit použití 3D buněčných kultur, případně využití myších či xenograftových modelů, které sice v současnosti nelze z technických důvodů využít k velkým screeningům, ale tyto bariéry mohou být s vývojem technologií poměrně brzy překonány. K větší efektivitě při hodnocení dat ze screeningových experimentů by mohlo přispět také filtrování relevantnosti výsledků podle již známých syntetických letalit z jiný modelových organizmů [44].
Závěr
Objevení vztahu syntetické letality mezi geny PARP1 a BRCA1/ 2 otevřelo cestu léčbě cílené na tento způsob genové interakce. Inhibitor PARP s názvem olaparib je v současné době užíván v klinické praxi s dobrými výsledky, avšak i vůči tomuto typu léčby může vznikat rezistence. Jedině pochopení jejího vzniku může vést k úspěšnému překonání rezistence. To by mohl přinést např. testovaný kombinovaný přístup, kdy jsou společně s inhibitorem PARP podávány také inhibitory ATR nebo WEE1. K rozšíření skupiny pacientů léčených inhibitory PARP může v budoucnu také přispět navržení vhodného klasifikátoru zhodnocujícího BRCAness fenotyp u různých typů nádorů, jenž by umožnil predikci odpovědi na tuto léčbu, která cílí na nádorové buňky s defektní HR. Od registrace inhibitorů PARP se do klinické praxe jiná léčiva fungující na principu syntetické letality ještě nedostala, to by mohl pomoci změnit způsob, jakým jsou navrhovány experimenty hledající nové synteticky letální genové interakce. Návrh budoucích experimentů by měl mimo jiné také zohledňovat význam studia penetrance konkrétní syntetické letality napříč různým genetickým pozadím, což může napovědět, jaká by mohla být úspěšnost léčby cílené na geny v synteticky letálním vztahu. Využití nových modelů jako např. 3D buněčných linií či xenograftů může také pomoci lépe reprezentovat mezibuněčnou komunikaci uvnitř tumoru a látka cílící na geny, jejichž synteticky letální vztah by byl potvrzen i v tomto experimentálním nastavení, bude mít větší šanci dostat se do klinických studií.
Práce byla podpořena projektem MŠMT – NPU I –LO1413. Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 15-33999A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Mgr. Lucie Bortlíková
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: lucie.bortlikova@mou.cz
Obdrženo/Submitted: 31. 5. 2019
Přijato/Accepted: 19. 8. 2019
Zdroje
1. Ashworth A, Lord CJ, Reis-Filho J. Genetic interactions in cancer progression and treatment. Cell 2011; 145(1): 30–38. doi: 10.1016/ j.cell.2011.03.020.
2. Hartwell LH, Szankasi P, Roberts CJ et al. Integrating genetic approaches into the discovery of anticancer drugs. Science 1997; 278(5340): 1064–1068. doi: 10.1126/ science.278.5340.1064.
3. Kaelin WG Jr. The concept of synthetic lethality in the context of anticancer therapy. Nat Rev Cancer 2005; 5(9): 689–698. doi: 10.1038/ nrc1691.
4. Brummelkamp TR, Bernards R. New tools for functional mammalian cancer genetics. Nat Rev Cancer 2003; 3(10): 781–789. doi: 10.1038/ nrc1191.
5. Ashworth A, Lord CJ. Synthetic lethal therapies for cancer: what’s next after PARP inhibitors? Nat Rev Clin Oncol 2018; 15(9): 564–576. doi: 10.1038/ s41571-018-0055-6.
6. Farmer H, McCabe N, Lord CJ et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature 2005; 434(7035): 917–921. doi: 10.1038/ nature03445.
7. Bryant HE, Schultz N, Thomas HD et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature 2005; 434(7035): 913–917. doi: 10.1038/ nature03443.
8. Lord CJ, Ashworth A. PARP inhibitors: Synthetic lethality in the clinic. Science 2017; 355(6330): 1152–1158. doi: 10.1126/ science.aam7344.
9. Minchom A, Aversa C, Lopez J. Dancing with the DNA damage response: next-generation anti-cancer therapeutic strategies. Ther Adv Med Oncol 2018; 10 : 1–18. doi: 10.1177/ 1758835918786658.
10. Audeh MW, Carmichael J, Penson RT et al. Oral poly(ADP-ribose) polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer: a proof-of-concept trial. Lancet 2010; 376(9737): 245–251. doi: 10.1016/ S0140-6736(10)60893-8.
11. Gelmon KA, Tischkowitz M, Mackay H et al. Olaparib in patients with recurrent high-grade serous or poorly differentiated ovarian carcinoma or triple-negative breast cancer: a phase 2, multicentre, open-label, non-randomised study. Lancet Oncol 2011; 12(9): 852–861. doi: 10.1016/ S1470-2045(11)70214-5.
12. Evans T, Matulonis U. PARP inhibitors in ovarian cancer: evidence, experience and clinical potential. Ther Adv Med Oncol 2017; 9(4): 253–267. doi: 10.1177/ 1758834016687254.
13. Turk AA, Wisinski KB. PARP inhibitors in breast cancer: Bringing synthetic lethality to the bedside. Cancer 2018; 124(12): 2498–2506. doi: 10.1002/ cncr.31307.
14. Sakai W, Swisher EM, Karlan BY et al. Secondary mutations as a mechanism of cisplatin resistance in BRCA2-mutated cancers. Nature 2008; 451(7182): 1116–1120. doi: 10.1038/ nature06633.
15. Jaspers JE, Kersbergen A, Boon U et al. Loss of 53BP1 causes PARP inhibitor resistance in BRCA1-mutated mouse mammary tumors. Cancer Discov 2013; 3(1): 68–81. doi: 10.1158/ 2159-8290.CD-12-0049.
16. Xu G, Chapman JR, Brandsma I et al. REV7 counteracts DNA double-strand break resection and affects PARP inhibition. Nature 2015; 521(7553): 541–544. doi: 10.1038/ nature14328.
17. Ghezraoui H, Oliveira C, Becker JR et al. 53BP1 cooperation with the REV7-shieldin complex underpins DNA structure-specific NHEJ. Nature 2018; 560(7716):122–127. doi: 10.1038/ s41586-018-0362-1.
18. Noordermeer SM, Adam S, Setiaputra D et al. The shieldin complex mediates 53BP1-dependent DNA repair. Nature 2018; 560(7716): 117–121. doi: 10.1038/ s41586-018-0340-7.
19. Dev H, Chiang TW, Lescale C et al. Shieldin complex promotes DNA end-joining and counters homologous recombination in BRCA1-null cells. Nat Cell Biol 2018; 20(8): 954–965. doi: 10.1038/ s41556-018-0140-1.
20. Liu X, Han EK, Anderson M et al. Acquired resistance to combination treatment with temozolomide and ABT-888 is mediated by both base excision repair and homologous recombination DNA repair pathways. Mol Cancer Res 2009; 7(10): 1686–1692. doi: 10.1158/ 1541-7786.MCR-09-0299.
21. Volinia S, Galasso M, Sana ME et al. Breast cancer signatures for invasiveness and prognosis defined by deep sequencing of microRNA. Proc Natl Acad Sci USA 2012; 109(8): 3024–3029. doi: 10.1073/ pnas.1200010109.
22. Du Y, Yamaguchi H, Hsu JL et al. PARP inhibitors as precision medicine for cancer treatment. Natl Sci Rev 2017; 4(4): 576–592. doi: 10.1093/ nsr/ nwx027.
23. Gilabert M, Launay S, Ginestier C et al. Poly(ADP-ribose) polymerase 1 (PARP1) overexpression in human breast cancer stem cells and resistance to olaparib. PLoS One 2014; 9(8): e104302. doi: 10.1371/ journal.pone.0104302.
24. Durmus S, Sparidans RW, van Esch A et al. Breast cancer resistance protein (BCRP/ ABCG2) and P-glycoprotein (P-GP/ ABCB1) restrict oral availability and brain accumulation of the PARP inhibitor rucaparib (AG-014699). Pharm Res 2015; 32(1): 37–46. doi: 10.1007/ s11095-014-1442-z.
25. Vaidyanathan A, Sawers L, Gannon AL et al. ABCB1 (MDR1) induction defines a common resistance mechanism in paclitaxel - and olaparib-resistant ovarian cancer cells. Br J Cancer 2016; 115(4): 431–441. doi: 10.1038/ bjc.2016.203.
26. Maya-Mendoza A, Moudry P, Merchut-Maya JM et al. High speed of fork progression induces DNA replication stress and genomic instability. Nature 2018; 559(7713): 279–284. doi: 10.1038/ s41586-018-0261-5.
27. Schlacher K, Wu H, Jasin, M. A distinct replication fork protection pathway connects Fanconi anemia tumor suppressors to RAD51-BRCA1/ 2. Cancer Cell 2012; 22(1): 106–116. doi: 10.1016/ j.ccr.2012.05.015.
28. Haynes B, Murai J, Lee JM. Restored replication fork stabilization, a mechanism of PARP inhibitor resistance, can be overcome by cell cycle checkpoint inhibition. Cancer Treat Rev 2018; 71 : 1–7. doi: 10.1016/ j.ctrv.2018.09.003.
29. Yekezare M, Gómez-González B, Diffley JF. Controlling DNA replication origins in response to DNA damage - inhibit globally, activate locally. J Cell Sci 2013; 126(6): 1297–1306. doi: 10.1242/ jcs.096701.
30. Mechali M. Eukaryotic DNA replication origins: many choices for appropriate answers. Nat Rev Mol Cell Biol 2010; 11(10): 728–738. doi: 10.1038/ nrm2976.
31. Carrassa L, Damia G. DNA damage response inhibitors: mechanisms and potential applications in cancer therapy. Cancer Treat Rev 2017; 60 : 139–151. doi: 10.1016/ j.ctrv.2017.08.013.
32. Sanjiv K, Hagenkort A, Calderon-Montano JM et al. Cancer-specific synthetic lethality between ATR and CHK1 kinase activities. Cell Reports 2016; 17(12): 3407–3416. doi: 10.1016/ j.celrep.2016.12.031.
33. Magnussen GI, Emilsen E, Giller Fleten K et al. Combined inhibition of the cell cycle related proteins Wee1 and Chk1/ 2 induces synergistic anti-cancer effect in melanoma. BMC Cancer 2015; 15 : 462. doi: 10.1186/ s12885-015-1474-8.
34. Guertin AD, Martin MM, Roberts B et al. Unique functions of CHK1 and WEE1 underlie synergistic anti-tumor activity upon pharmacologic inhibition. Cancer Cell Int 2012; 12(1): 45. doi: 10.1186/ 1475-2867-12-45.
35. Toledo LI, Altmeyer M, Rask MB et al. ATR prohibits replication catastrophe by preventing global exhaustion of RPA. Cell 2013; 155(5): 1088–1103. doi: 10.1016/ j.cell.2013.10.043.
36. Elvers I, Hagenkort A, Johansson F et al. CHK1 activity is required for continuous replication fork elongation but not stabilization of post-replicative gaps after UV irradiation. Nucleic Acids Res 2012; 40(17): 8440–8448. doi: 10.1093/ nar/ gks646.
37. Couch FB, Bansbach CE, Driscoll R et al. ATR phosphorylates SMARCAL1 to prevent replication fork collapse. Genes Dev 2013; 27(14): 1610–1623. doi: 10.1101/ gad.214080.113.
38. Kim H, George E, Ragland R et al. Targeting the ATR/ CHK1 Axis with PARP inhibition results in tumor regression in BRCA-mutant ovarian cancer models. Clin Cancer Res 2017; 23(12): 3097–3108. doi: 10.1158/ 1078-0432.CCR-16-2273.
39. Dominguez-Kelly R, Martin Y, Koundrioukoff S et al. Wee1 controls genomic stability during replication by regulating the Mus81-Eme1 endonuclease. J Cell Biol 2011; 194(4): 567–579. doi: 10.1083/ jcb.201101047.
40. Lord CJ, Ashworth A. BRCAness revisited. Nat Rev Cancer 2016; 16(2): 110–120. doi: 10.1038/ nrc.2015.21.
41. Waddell N, Pajic M, Patch AM et al. Whole genomes redefine the mutational landscape of pancreatic cancer. Nature 2015; 518(7540): 495–501. doi: 10.1038/ nature14169.
42. Robinson D, Van Allen EM, Wu YM et al. Integrative clinical genomics of advanced prostate cancer. Cell 2015; 161(5): 1215–1228. doi: 10.1016/ j.cell.2015.05.001.
43. Severson TM, Wolf DM, Yau C et al. The BRCA1ness signature is associated significantly with response to PARP inhibitor treatment versus control in the I-SPY 2 randomized neoadjuvant setting. Breast Cancer Res 2017; 19(1): 99. doi: 10.1186/ s13058-017-0861-2.
44. Ryan CJ, Bajrami I, Lord CJ. Synthetic lethality and cancer – penetrance as the major barrier. Trends Cancer 2018; 4(10): 671–683. doi: 10.1016/ j.trecan.2018.08.003.
45. Martin TD, Cook DR, Choi MY et al. A role for mitochondrial translation in promotion of viability in K-Ras mutant cells. Cell Rep 2017; 20(2): 427–438. doi: 10.1016/ j.celrep.2017.06.061.
46. Shen JP, Zhao D, Sasik R et al. Combinatorial CRISPR–Cas9 screens for de novo mapping of genetic interactions. Nat Methods 2017; 14(6): 573–576. doi: 10.1038/ nmeth.4225.
47. Wang T, Yu H, Hughes NW et al. Gene essentiality profiling reveals gene networks and synthetic lethal interactions with oncogenic Ras. Cell 2017; 168(5): 890–903. doi: 10.1016/ j.cell.2017.01.013.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial 2019
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Syntetická letalita – její současné využití a potenciál v onkologické léčbě
- Pokroky ve využití organokovových sloučenin při vývoji protinádorových léčiv
- Editorial 2019
- Souhrn aktuálních poznatků o úloze estrogenového receptoru α v nádorové buněčné signalizaci
- Glykoproteiny v sérech onkologických pacientů
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Výskum ubikvitinácie proteínov v onkológii
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
- Dlouhé nekódující RNA – současné možnosti detekce a využití v klinické praxi
- Interakce onkogenních virových proteinů s proteiny rodiny p53
- Kooperace genomických, transkriptomických a proteomických metod v detekci mutovaných proteinů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výskum ubikvitinácie proteínov v onkológii
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



