-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pokroky ve využití organokovových sloučenin při vývoji protinádorových léčiv
Progress in the Utilisation of Organometallic Compounds in the Development of Cancer Drugs
Background: Organometallic compounds are chemical substances containing a carbon-metal bond. From a biological point of view, these compounds are generally considered to be toxic for living organisms. They may exert therapeutic potential, especially as anticancer or antimicrobial drugs. Their structural variability and usually uncharged and mostly lipophilic character are particularly advantageous properties. Platinum derivatives (predominately cisplatin) are the most proven advantageous agents in the medical field. The success of cisplatin has led the scientific community to focus on the synthesis of other organometallic compounds with improved anti-tumour effects and lower cytotoxicity towards healthy tissues. Close attention is focused on compounds bearing atoms of iron, titanium or ruthenium.
Purpose: Here, we focus on summarising a description of the most important compounds containing iron, titanium or ruthenium atoms in their structure, showing potential application in cancer treatment including the mechanism of action for some of the most commonly studied compounds. The reported structures were used successfully in preclinical studies including animal models and progressed to various stages of human clinical trials. Despite the failure of some of these compounds, there are still several candidates which are expected to progress to the late stages of the clinical trials either alone or as part of combined chemotherapy. Ruthenium-containing substances in particular show high potential for utilisation in cancer treatment due to low cytotoxicity associated with the ability to block neoangiogenesis and metastasis development.
Keywords:
cancer – chemotherapy – Drugs – organometallic compounds – Titanium – ruthenium
Autoři: H. Skoupilová; R. Hrstka
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2019; 32(Supplementum 3): 25-33
Kategorie: Přehled
doi: https://doi.org/10.14735/amko20193SSouhrn
Východiska: Organokovové sloučeniny jsou látky, které obsahují vazbu uhlík - kov. Z biologického hlediska jsou tyto sloučeniny všeobecně považovány za látky toxické pro živé organizmy. Díky tomu však současně vykazují terapeutický potenciál, především jako protinádorová nebo antimikrobiální léčiva. Jsou variabilní co do struktury, obvykle bez náboje a většinou mají lipofilní charakter. V oblasti medicíny se doposud nejvíce osvědčily deriváty platiny, především cisplatina, která je jednou z nejdéle používaných chemoterapeutických látek. Na její úspěchy se vědecká komunita snaží navázat syntézou dalších organokovových sloučenin vykazujících výraznější protinádorové účinky a současně nižší cytotoxicitu vůči zdravým tkáním. Velká pozornost je upínána zejména ke sloučeninám nesoucím atomy železa, titanu nebo ruthenia.
Cíl: V této práci jsme se zaměřili na popis nejdůležitějších sloučenin obsahujících ve své struktuře atomy železa, titanu nebo ruthenia, které by potenciálně mohly být využity při léčbě onkologických onemocnění, a zahrnuli jsme také mechanizmus účinku u některých podrobněji zkoumaných sloučenin. Uvedené sloučeniny byly úspěšně testovány v preklinických studiích vč. zvířecích modelů a některé byly testovány i v rámci klinických studií. Navzdory skutečnosti, že řada doposud testovaných organometalických látek v klinických hodnoceních neuspěla, stále je k dispozici několik kandidátů, u kterých se očekává postoupení do dalších fází klinických studií ať už samostatně, nebo jako součást kombinované chemoterapeutické léčby. Jedná se zejména o sloučeniny obsahující ruthenium, které mají vysoký potenciál použití díky své nízké cytotoxicitě, ale současně vysoké schopnosti inhibovat neoangiogenezi a tvorbu metastáz.
Klíčová slova:
rakovina – chemoterapie – léčiva – organometalické sloučeniny – titan – ruthenium
Úvod
Organokovové sloučeniny jsou obecně definovány jako látky nesoucí ve své molekule vazbu uhlík-kov. Tyto sloučeniny nacházejí široké uplatnění v chemické syntéze, neboť jsou značně reaktivní. Klasickým příkladem jsou tzv. Grignardovy (organohořečnaté) sloučeniny, které se připravují reakcí alkylhalogenidu s hořčíkem v bezvodém éteru a využívají se pro vnášení alkylového zbytku do molekuly například reakcí s karbonylovými sloučeninami. Organokovové sloučeniny jsou látky, které se vyskytují i přirozeně v přírodě, o čemž svědčí např. struktura vitamínu B12 obsahující centrální atom kobaltu se čtyřmi atomy dusíku pyrrolových jader vázaných spolu do porfyrinového skeletu. Za správné určení struktury vitamínu B12 byla v roce 1964 udělena Nobelova cena za chemii [1]. Přestože jsou syntetické organokovové sloučeniny obecně považovány za toxické, resp. nekompatibilní s biologickými systémy, jejich možný terapeutický potenciál, především jako protinádorových nebo antimikrobiálních léčiv, dlouhodobě přitahuje zájem organometalických chemiků. Tím spíš, že organokovové sloučeniny vykazují značnou strukturní variabilitu, obvykle jsou bez náboje a poměrně lipofilní. To vše je pak umocněno reálnou potřebou vývoje nových alternativních léčiv, která by v porovnání se stávajícími léky vykazovala vyšší účinnost a minimální nežádoucí účinky. Vybrané strukturní typy organokovových sloučenin, které prokázaly potenciál pro uplatnění v lékařské chemii, jsou znázorněny na obr. 1. V této práci jsme se zaměřili na bližší charakterizaci sloučenin obsahujících ve své struktuře železo (Fe), titan (Ti) a ruthenium (Ru).
Obr. 1. Strukturní typy organokovových sloučenin s protinádorovým účinkem. 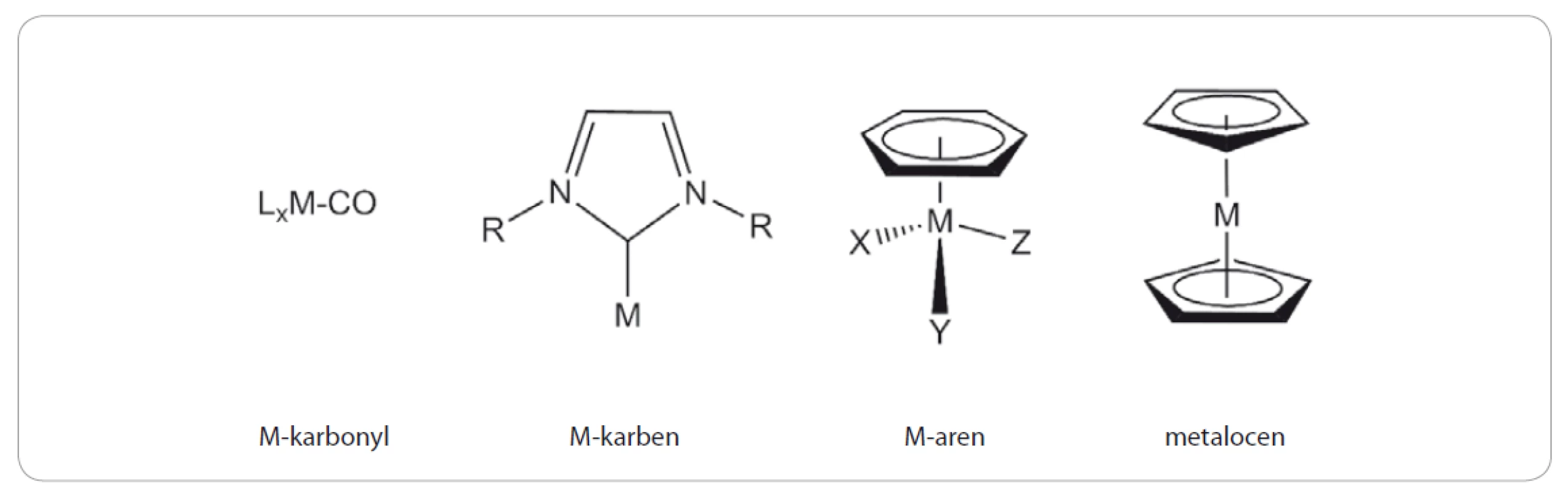
Ferroceny
Ferroceny patří mezi tzv. metaloceny, tedy sloučeniny s obecným vzorcem (C5R5)2M, které jsou tvořeny dvěma cyklopentadienylovými kruhy vázanými k atomu kovu, v tomto případě železnatému kationtu Fe2+. Bývají poměrně často používány při designu nových léčiv, obvykle jako náhrada za fenylové nebo alkylové skupiny, a to především z důvodu vyšší lipofility v porovnání s benzenem a lepší membránové permeability dané molekuly. Ferroceny navíc patří mezi tzv. „bezpečné molekuly“, jak dokazují testy akutní a chronické cytotoxicity u řady savčích organizmů [2]. Mechanizmus účinku ferrocenů zřejmě spočívá v uvolnění iontů železa, které přispívají k tvorbě kyslíkových radikálů pomocí tzv. Fentonovy reakce [3]. První a v podstatě doposud jediný derivát ferrocenu schválený v humánní medicíně je ferroceron, který byl podáván při léčbě chudokrevnosti v bývalém Sovětském svazu [4]. Při designu ferrocenů, resp. ferrocen obsahujících sloučenin, se jako nejslibnější zdá být strategie založená na systematickém začleňování ferrocenylové skupiny do struktur kandidátních nebo již známých léčiv, což se pak může významně odrazit na jejich molekulárních vlastnostech. Tento přístup vedl mj. i k objevení ferrocifenu, který se nachází ve fázi preklinického testování jako potenciální protinádorové léčivo, nebo antimalarika ferroquinu, který je ve II. fázi klinického testování [5].
Ferrocifeny
Ferrocifeny představují skupinu sloučenin odvozených od struktury tamoxifenu, u kterého byl nahrazen jeden fenylový kruh ferrocenem (obr. 2). Tamoxifen je důležitým medikamentem především při léčbě karcinomu prsu (99,5% tvoří ženy), ale i dalších malignit, které jsou pozitivní na estrogenové receptory (ER) α. Mechanizmus účinku tamoxifenu spočívá v inhibici ER, přičemž se jedná o tzv. selektivní modulátor estrogenového receptoru, což znamená, že se v různých tkáních může chovat rozdílně. Tamoxifen se po podání v lidském těle oxiduje na hydroxytamoxifen, který se váže na ER a soutěží tak o vazebné místo s přirozenými ligandy, jako je např. 17β-estradiol. Na rozdíl od přirozených ligandů, které vazbou na ER iniciují translokaci receptoru do jádra, kde působí jako pro-onkogenní transkripční faktor, tamoxifen tuto aktivaci ER inhibuje (pro více informací viz článek Voňka et al [6]).
Obr. 2. Strukturní vzorce tamoxifenu a ferrocifenu. 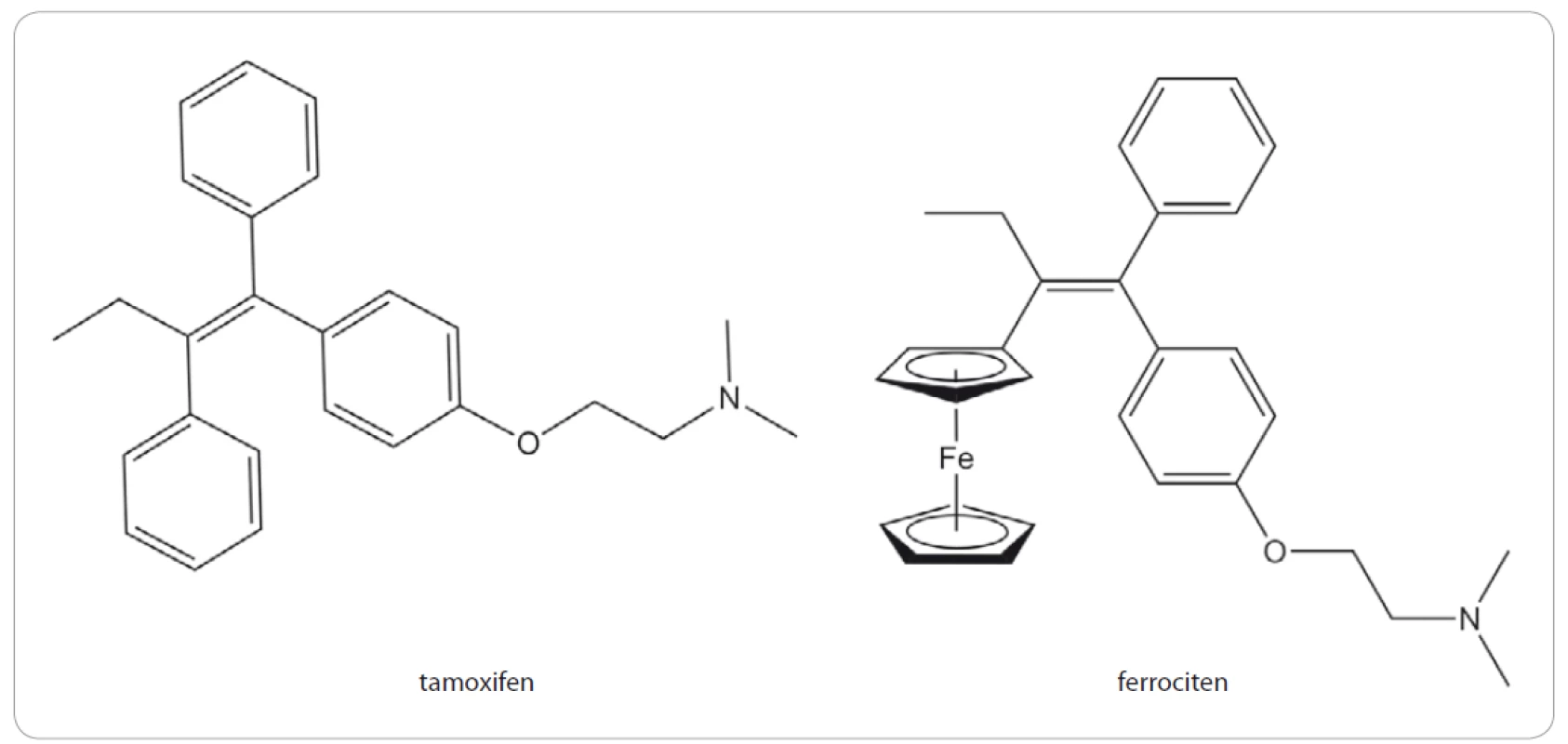
Ferrocifeny byly připravovány jako organokovové analogy tamoxifenu s cílem uchovat jeho schopnost vázat se na ER a tím jej inhibovat, ale současně zesílit protinádorové účinky díky přítomnosti cytotoxického ferrocenylového zbytku. Tento záměr se skutečně podařil, protože v porovnání s hydoxytamoxifenem mohou ferrocifeny indukovat tvorbu reaktivních kyslíkových radikálů, což zřejmě představuje hlavní mechanizmus cytotoxického účinku [7]. Díky tomu pak ferrocifeny mohou účinně inhibovat i proliferaci buněk, které nemají funkční ER [8]. Ferrocifeny jsou navíc značně selektivní, neboť vykazují 100 – 200krát vyšší antiproliferativní aktivitu vůči nádorovým buňkám v porovnání s buňkami nenádorovými [9].
Sloučeniny titanu jako protinádorová léčiva
Oproti sloučeninám obsahujícím železo, které jako protinádorová léčiva prozatím nepřekonaly preklinické testy, jsou sloučeniny s centrálním atomem titanu úspěšnější, neboť postoupily až do klinických studií fáze I a fáze II.
Titanocen dichlorid
Prvním z aktivních titanocenů byl titanocen dichlorid (Cp2TiCl2) (obr. 3) syntetizovaný Wilkinsonem a Birminghamem již v roce 1954 [10]. Jednalo se o první neplatinovou sloučeninu vykazující vysokou cytotoxicitu in vivo proti implantovaným Ehrlichovým nádorům u myší, přičemž léčebná účinnost přesáhla 80 %, aniž by byla pozorována vysoká toxicita, jako tomu bylo při podání cisplatiny [11]. Právě tyto slibné preklinické výsledky vedly v roce 1993 k zahájení klinických studií fáze I. Závěry prokázaly léčebný efekt u pacientů s adenokarcinomy, nemalobuněčným karcinomem plic i nádory močového měchýře. Po podání však byly pozorovány také nežádoucí vedlejší účinky, zejména gastrointestinální a neurologické problémy a poškození jater a ledvin [12,13]. Několik klinických studií fáze II bylo následně provedeno na pacientech s metastatickým karcinomem ledvin, resp. prsu [14,15]. Částečná regrese byla pozorována pouze u dvou případů s metastatickým karcinomem prsu. U pacientů s nádory ledvin nebyl pozorován žádný ústup onemocnění [14]. Tyto studie tudíž nebyly považovány za úspěšné a další klinické studie Cp2TiCl2 byly ukončeny z důvodu primární nefrotoxicity, nízké účinnosti a také kvůli špatné rozpustnosti sloučeniny a její hydrolytické nestabilitě za fyziologických podmínek. Později byl titanocen dichlorid podroben další řadě laboratorních studií, které prokázaly slibnou protinádorovou účinnost in vitro v buněčných liniích [16 – 19] i in vivo na zvířecích modelech [20]. Studie však byly prováděny zejména z důvodů identifikace molekulárního mechanizmu účinku titanocen dichloridu uvnitř buněk. Ve srovnání s cis-platinou byl potvrzen jako silnější růstový inhibitor [17], který způsobuje zástavu buněčného cyklu v pozdní S fázi až časné G2 fázi spolu s navozením buněčné smrti nezávislé na buněčném cyklu. Christodoulou et al zjistili, že po ošetření buněk titanocen dichloridem dochází v buněčné linii A2780 pocházející z karcinomu vaječníku k akumulaci proteinu p53 [18]. Naopak Kolberg et al v xenograftovém modelu lidského vaječníku žádné výrazné změny v expresi p53 nezaznamenali [20]. Cp2TiCl2 byl dále potvrzen jako inhibitor angiogeneze [19]. Nakonec však ani tato nově zjištěná fakta nevedla k posunu titanocen dichloridu do dalších fází klinického hodnocení, a to především z důvodu nesplnění podmínek pro správnou formu léčiva.
I přes neúspěchy v klinických studiích byla struktura titanocen dichloridu použita jako základní strukturní prvek při syntéze substituovaných titanocenů lépe rozpustných za fyziologických podmínek, přičemž inkorporací elektronegativních substituentů odebírajících elektrony byl posílen charakter titanocenů coby Lewisových kyselin [21]. Další modifikace zahrnovaly například funkcionalizaci cyklopentadienylového kruhu aromatickým zbytkem [22], alkylaminy a cyklickými aminy [23,24] nebo chirálními acyklickými aminy [25].
Titanocen Y
Titanocen Y (TiY) (obr. 3) je jednou ze sloučenin odvozených od titanocen dichloridu [26]. Tato sloučenina ve své struktuře nenese žádná stereocentra, což může být považováno za přínos zejména při potenciální výrobě léčiva, neboť není nutné separovat jednotlivé stereoizomery. Relativní úspěch cytotoxických testů na prasečích buněčných liniích LLC-PK posunul testování titanocenu Y až do fáze testování na zvířatech [26]. U myších Caki-1 xenograftů byla pozorována signifikantní redukce velikosti nádorů v závislosti na zvyšující se dávce TiY, přičemž nejvyšší tolerovaná dávka 40 mg/ kg vykázala celkově lepší výsledky než porovnávaná dávka 2 mg/ kg u cisplatiny [27]. V několika dalších nezávislých studiích na myších xenograftových modelech epidermoidních nádorů nebo nádorů prsu byly tyto slibné výsledky potvrzeny, přičemž nebyly pozorovány žádné, nebo jen velmi malé nežádoucí účinky léčby [28,29].
Titanocen Y zasahuje do vnější signální dráhy navozující buněčnou smrt prostřednictvím exprese proteinu p53 [30], který ovlivňuje vazbu Fas ligandů na receptory CD95, jež eliminují buňky postižené rakovinou nebo napadené virem. Tato vzájemná interakce vede k aktivaci signalizačního komplexu indukujícího smrt a prekurzoru kaspázy 8, čímž iniciuje kaskádu reakcí vedoucích až k indukci apoptózy [31]. Weber et al prokázali, že ošetření buněk TiY (IC50 = 4,9 μm) vykazuje asi 4krát vyšší míru inhibice angiogeneze ve srovnání s titanocen dichloridem (IC50 = 19 μm) [19].
Oxali-titanocen Y
V důsledku úspěchu titanocenu Y byla v roce 2008 na základě jeho struktury připravena sloučenina oxali-titanocen Y, u níž byly atomy chloru nahrazeny oxalátovým aniontem [32]. Tento komplex vykazoval na LLC-PK buňkách 13krát vyšší cytotoxicitu než původní titanocen Y a 2krát vyšší účinnost než cisplatina [26,32]. Oxali-titanocen Y 16 byl testován in vitro na lidských endoteliálních buňkách pocházejících z pupečníkové žíly (human umbilical vein endothelial cells – HUVEC) s hodnotami IC50 = 14 μm pro ověření antiangiogenních účinků. Testy pokračovaly na Caki-1 myších xenograftech ošetřených dávkou 30 mg/ kg/ den 5krát týdně po dobu 3 týdnů. Myši ošetřené pomocí oxali-titanocenu Y vykazovaly statisticky významnou redukci růstu nádoru o 38 % ve srovnání s kontrolní skupinou. Oxali-titanocen Y také inhiboval proliferaci a růst buněk. Exprese proliferačního markeru Ki-67 byla redukována o 30 % [33].
Titanocen T
Další z úspěšnějších sloučenin odvozených od titanocen dichloridu je titanocen T syntetizovaný začleněním 1-methyl-3-diethylaminomethyl-indol-4-ylového zbytku jako substituentu methyl-cyklopentadienylového ligandu [34]. Výsledky testování této sloučeniny na lidské renální rakovinné linii Caki-1 prokázaly slibnou cytotoxicitu s IC50 kolem 13±2 μm spolu s dobrou rozpustností ve vodných roztocích, která zvyšuje potenciální použití této látky jako léčiva [34]. Testy v myších Caki-1 xenograftových modelech ošetřovaných titanocenem T ukázaly redukci velikosti nádorů o 32 – 51 % ve srovnání s kontrolní skupinou. Nebyly pozorovány žádné vedlejší účinky na myších mimo 5% snížení jejich hmotnosti při podání vyšších dávek [35].
Ansa-titanocen X
Ansa-titanocen X (obr. 3) je dalším z relativně úspěšných titanocenů, které se dostaly do fáze testování na zvířatech. V jeho struktuře jsou cyklopentadienylové kruhy spojeny vazbou, která zabraňuje rotaci ligandu a často modifikuje strukturu a reaktivitu kovového centra [22,36]. Testy in vivo v BALB/ c myších xenograftech s Ehrlichovým ascitickým tumorem ukázaly prodloužení doby přežití myší ošetřených dávkami od 2,5 do 50 mg/ kg. Nejvyšší dávka prodlužovala u myší dobu přežití o 50 % [37].
Obr. 3. Struktura vybraných titanocenů. 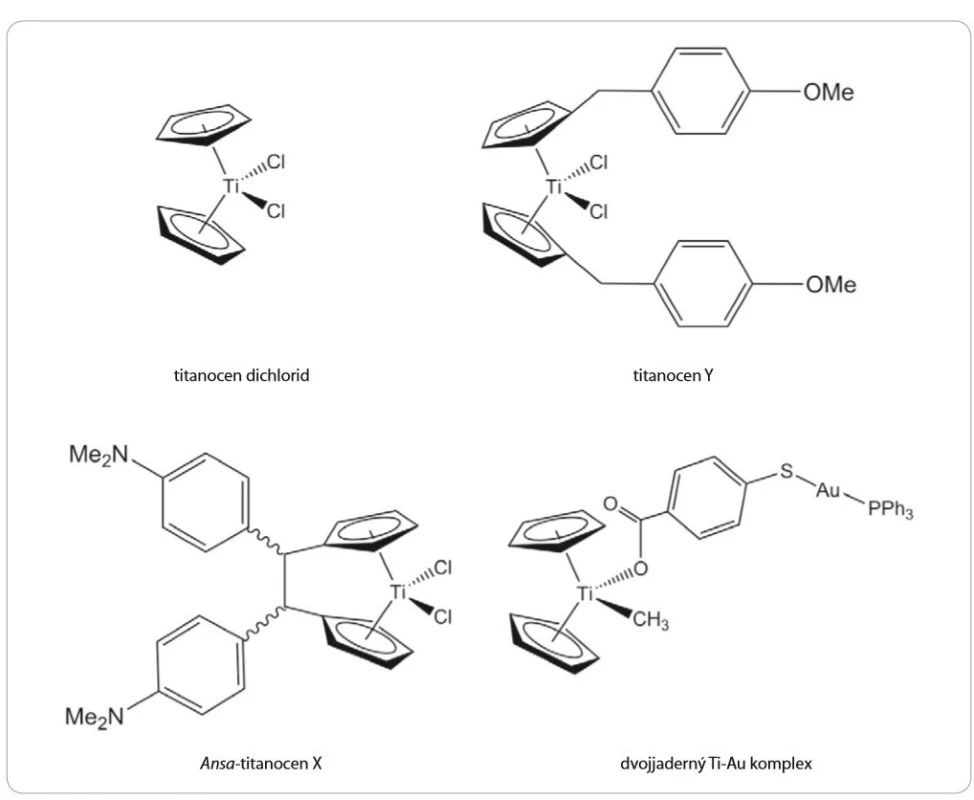
Heterometalické Ti-Au komplexy
Pro zesílení účinku titanocenových sloučenin bylo použito i navázaní na komplexy jiných kovů. Takto byla vytvořena bimetalická sloučenina Ti-Au komplexu složená ze stabilního titanocenu, u něhož byl jeden z chloridových ligandů nahrazen methylovou skupinou a druhý karboxylátovým ligandem 4-merkaptobenzoové kyseliny komplexující přes atom síry trifenylfosfanový fragment s jednomocným zlatem (obr. 3) [38]. Tento komplex dokázal blokovat buněčný růst renálních Caki-1 buněk a vykazoval vyšší toxicitu ve srovnání s cisplatinou i titanocenem Y. V in vivo testech na Caki-1 xenograftovém myším modelu vykazovala sloučenina redukci velikosti nádoru přibližně o 67 %. Tato slibná data ukázala, že kombinace různých kovů vykazuje značný chemoterapeutický potenciál [38,39]. Některé další z podobných Ti-Au komplexů byly schopny inhibovat protein kinázy rodiny AKT a MAPKAPK [39] nebo p90-RSK [38]. Aktivní sloučeniny byly také zapojeny do inhibice thioredoxin-reduktázy [38,40].
Budotitan
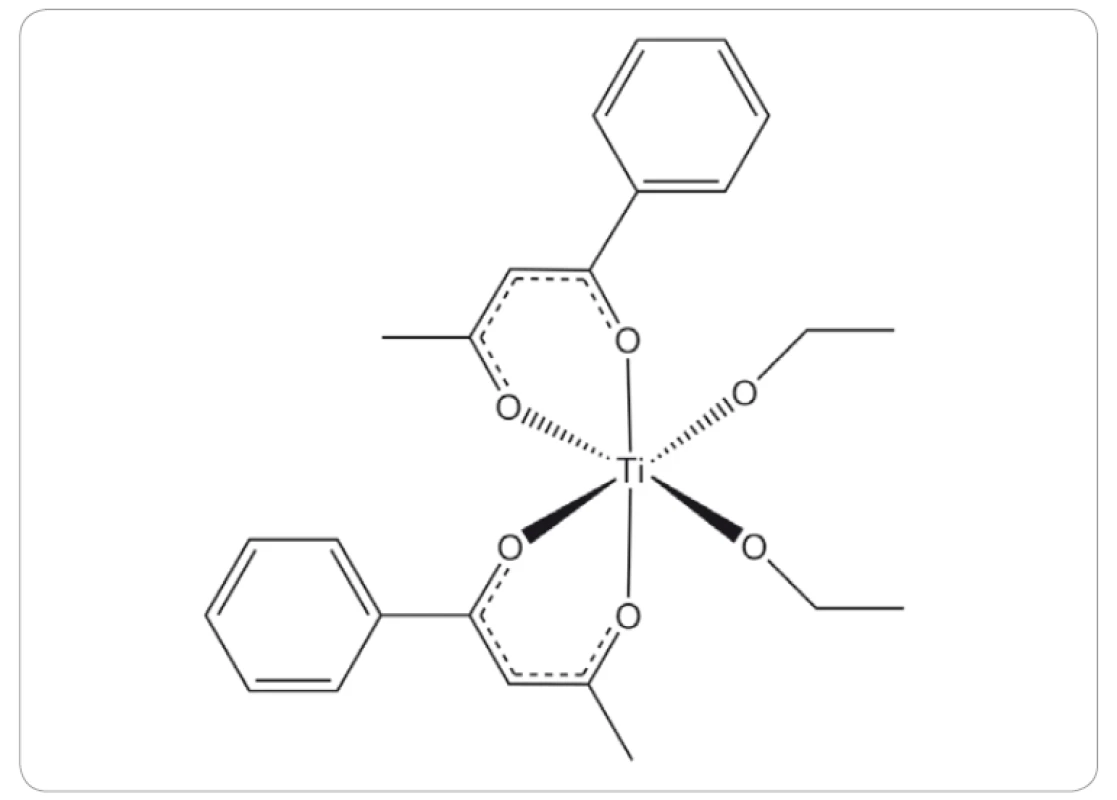
Odlišným komplexem titanu, který pokročil až ke klinickým studiím, je budotitan (obr. 4). Preklinické studie budotitanu na potkanech s myšími nebo potkaními transplantabilními nádory tlustého střeva, osteosarkomu, sarkomu nebo leukemie vykazovaly prodloužený čas přežití, redukci velikosti nádorů a pouze mírné vedlejší účinky jako plicní a jaterní toxicita, bez významné kardiální toxicity pozorované u cisplatiny [41,42]. První výsledky klinických studií fáze I ukázaly mírnou hepatotoxicitu, nefrotoxicitu a reverzibilní nechutenství počínající dávkou 9 mg/ kg [41]. Výsledky druhé klinické studie fáze I ukázaly minimální akutní toxicitu. Jediným limitujícím faktorem byl vznik srdeční arytmie, která se vyskytla u dvou pacientů při podání dávky 230 mg/ m2 [43].
Interakce titanových sloučenin s biomolekulami v buňkách může usnadnit transport, příjem a dodávání titanu do buňky [16,44]. Bylo prokázáno, že titanocen dichlorid může být vázán na transferin v krevní plazmě, odkud je přenášen pomocí krve do celého těla a za spotřeby ATP až do cytoplazmy buněk [16,45]. Podobně může být lidský sérový albumin dalším z proteinů zodpovědných za přenos titanu do buněk [46 – 48]. Nicméně i přes nepopiratelné úspěchy uvedených sloučenin v preklinických studiích se mimo titanocen dichlorid a budotitan žádná další sloučenina titanu až do klinického testování nedostala.
Rutheniové komplexy
Přestože jsou komplexy obsahující ruthenium považovány za méně toxické, zachovávají si silnou protinádorovou aktivitu [49]. Myšlenka použití organokovových sloučenin obsahujících ruthenium jako protinádorových látek byla poprvé vyslovena v 90. letech minulého století [50,51]. Od té doby bylo syntetizováno mnoho sloučenin obsahujících ruthenium, které byly testovány jako potenciální protinádorová léčiva [52 – 58].
NAMI-A
Prvním komplexem ruthenia [Ru (III)] schváleným pro testování v klinických studiích byl NAMI-A, [ImH][trans-RuCl4(DMSO)(Im)] (imidazol – Im, dimethylsulfoxid – DMSO). Tato sloučenina sice vykazovala nízkou účinnost z hlediska přímé cytotoxicity vůči nádorovým buňkám in vitro, ale významně inhibovala růst nádorových metastáz v myších modelech in vivo [57,59 – 63]. V dalších studiích byly potvrzeny i antiangiogenní vlastnosti NAMI-A pomocí testů na endoteliálních buňkách kuřecích chorioallantoických membrán i u modelu rohovky králičího oka [64,65].
Mechanizmus účinku NAMI-A zatím není zcela prozkoumán. Za fyziologických podmínek je NAMI-A relativně labilní a podléhá postupné hydrolýze jednoho až dvou chloridů [62]. Existují data, která naznačují schopnosti NAMI-A vázat se na DNA a RNA. Za fyziologických podmínek se může vázat také na zbytky histidinu u sérového albuminu [66,67]. Účinky na buněčné linie in vitro se projevily zvýšením buněčných adhezních vlastností a zastavením buněčného cyklu v G2/ M fázi, in vivo byla v myších modelech potvrzena i antimetastatická aktivita [59].
V klinické studii fáze I byla u pacientů stanovena maximální tolerovaná dávka na 300 mg/ m2 na den po dobu 5 dnů každý 3. týden [68]. Studie fáze I/ II však ukázala nízkou terapeutickou účinnost a pouze částečnou odpověď na kombinovanou léčbu NAMI-A s nukleosidovým analogem gemcitabinem u pacientů s nemalobuněčným karcinomem plic [69], což v podstatě vedlo k ukončení dalšího klinického testování NAMI-A.
KP1019
Další z rutheniových komplexů, které prošly až do fáze klinického testování, je sloučenina KP1019 (indazolium [trans-tetrachloro-bis-(1H-indazol)ruthenitan]) navržená Seeligem et al [70]. V preklinických testech in vivo prokázala významnou antineoplastickou aktivitu vůči chemicky indukovanému kolorektálním karcinomu u potkanů [70]. Další studie odhalila, že se v buňkách nevyvíjí nádorová rezistence vůči KP1019 v porovnání s jinými léčivy na bázi kovů a látka zůstává dlouhodobě účinná i v buněčných liniích odvozených od epidermálních nádorů, malobuněčného i nemalobuněčného plicního karcinomu, adenokarcinomu prsu a leukemie [71]. KP1019 vykazuje silnou cytotoxicitu proti primárním nádorům necitlivým k cisplatině, zejména pak proti kolorektálnímu karcinomu [72]. Jeho působením dochází v buňkách k razantním změnám potenciálu mitochondriální membrány a spolu se zvýšenou mírou oxidativního stresu pak k indukci apoptózy [71]. To bylo potvrzeno i v kvasinkovém modelu Saccharomyces cerevisiae, kde KP1019 vyvolala poškození DNA, pozastavení buněčného cyklu a následnou buněčnou smrt [73].
Klinické studie fáze I přinesly informaci o neexistujících nebo jen nepatrných vedlejších účincích KP1019 [74,75], avšak z důvodu nízké solubility byly klinické studie pozastaveny a další testování se zaměřilo na její ve vodě více rozpustný analog KP1339.
KP1339 (IT-139)
Sloučenina KP1399 ([trans-tetrachloro-bis-(1H-indazol)ruthenitan] sodný) (obr. 5) byla původně připravena jako prekurzor pro syntézu KP1019, a to již v roce 1999 [76]. Stejně jako KP1019 vykazuje silnou afinitu k albuminu a transferinu v krevním řečišti [77]. Studie KP1339 in vitro a in vivo ukázaly, že zesiluje aktivitu sorafenibu, používaného v 1. linii léčby hepatomu, a dokonce působí i na buněčné modely rezistentní k sorafenibu [78]. V porovnání se sorafenibem tato látka prokázala v xenograftových myších modelech pro nádory jater vyšší účinnost in vivo a kombinovaná terapie dokonce 4násobně zvýšila průměrné přežití. Synergická aktivita byla také pozorována u myšího xenograftu VM-1 melanomu nesoucího aktivační mutaci BRAF [78].
Obr. 5. Struktury vybraných rutheniových sloučenin. 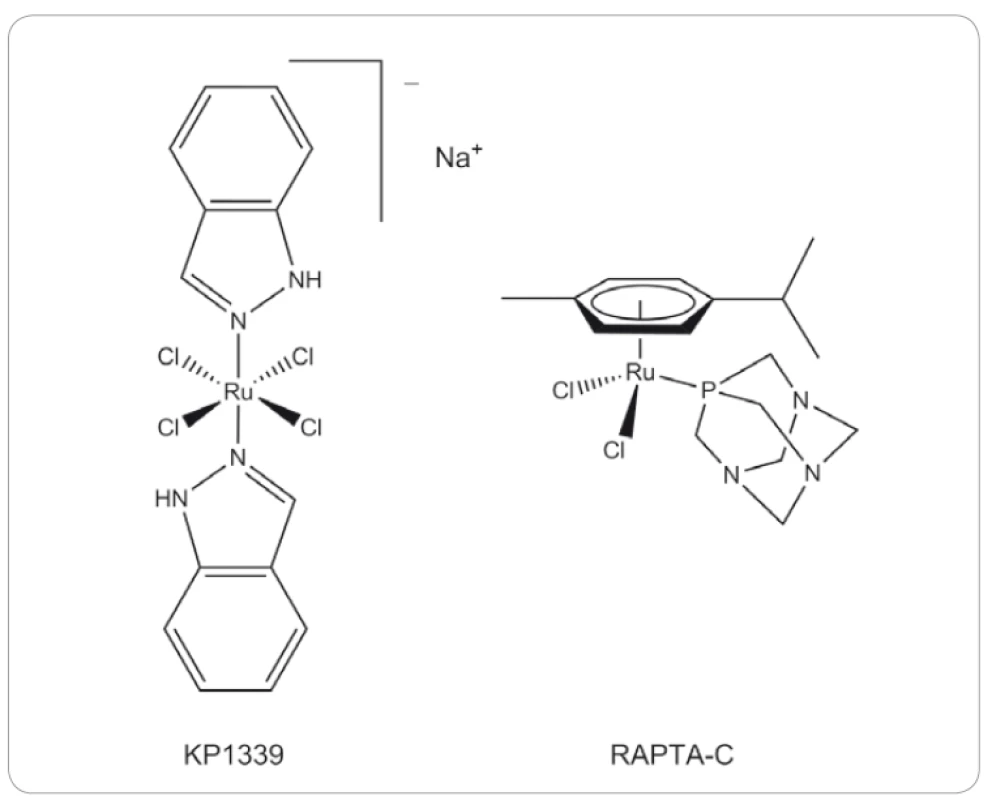
Klinická studie fáze I byla provedena na pacientech s různými druhy solidních nádorů, přičemž výsledky ukázaly vysokou účinnost KP1399 zejména proti neuroendokrinním nádorům [79]. Další studie byla provedena v roce 2016 s velice podobným výsledkem na pacientech s karcinoidními neuroendokrinními tumory bez signifikantní neurotoxické a hematologické cytotoxicity [80]. Autoři také na základě nezávislých in vitro studií [81,82] uvádějí, že mechanizmus účinku KP1339 spočívá ve snížení hladiny chaperonového proteinu GRP78, jehož hladina bývá v reakci na stres silně zvýšena u řady nádorů [80]. Funkční studie vedla k závěru, že mechanizmus účinku KP1339 je soustředěn na interakce s cytosolovými proteiny vedoucími k nadprodukci reaktivních kyslíkových radikálů, oxidačnímu stresu a stresu endo-plazmatického retikula, které nakonec prostřednictvím mitochondriální signalizace spouštějí apoptózu [80,83]. Ačkoliv protinádorová aktivita KP1339 není vysoká, její budoucí využití v klinické praxi je reálné především v kombinaci s jinými léčivy pro zvýšení účinnosti a překonání rezistence indukované zvýšenou hladinou GRP78 [80].
RAPTA – funkční organometalické Ru (II) komplexy
Po rozsáhlém studiu sloučenin nesoucích Ru (III) (NAMI-A, KP1019, KP1339) byly testovány i sloučeniny Ru (II), které též prokázaly protinádorovou aktivitu in vitro. Slibnými kandidáty této skupiny jsou látky třídy RAPTA [Ru(η6-arene)Cl2(PTA)] (PTA = 1,3,5-triaza-7-fosfatricyklo-adamantan), u nichž je η6-aren vázán na centrální atom Ru (II). Vzhledem ke svému prostorovému uspořádání jsou tyto sloučeniny označovány jako struktury „pianových stoliček“. Ligandy PTA zvyšují rozpustnost látek ve vodě a η6-areny mohou být v molekule substituovány podle potřeby. Dva chloridové ligandy jsou labilní a citlivé na hydrolýzu uvnitř buňky [54].
Jedna z těchto sloučenin, [Ru(η6-p-cymene)Cl2(PTA)] neboli RAPTA-C (obr. 5), prokázala redukci tvorby plicních metastáz u myšího modelu karcinom prsu s minimálním efektem na velikost primárního nádoru [84,85]. Bylo také zjištěno, že RAPTA-C inhibuje buněčnou proliferaci in vitro zastavením dělení buněk v G2/ M fázi buněčného cyklu, které bylo spojeno se zvýšením hladiny p21 a snížením množství cyklinu E. Současně byla indukována mitochondriální apoptotická dráha v neoplastických buňkách díky indukci hladiny proteinu p53 [86].
Analog RAPTA-T [Ru(η6-toluen)Cl2(PTA)] také prokázal účinnost proti invazivním rakovinným buňkám in vitro a selektivně inhiboval růst metastáz karcinomu plic in vivo represí migrace, invaze a re-adheze metastatických buněk z primárního nádoru [84]. RAPTA-C spolu s RAPTA-T prokázaly slibnou antimetastatickou aktivitu i prostřednictvím inhibice angiogeneze, a proto jsou stále aktivně studovanými látkami a kandidáty pro vývoj protinádorové terapie založené na kombinaci cytostatických a angiostatických léčiv [56].
Kombinace rutheniových komplexů s nanomateriály
Také výzkum zaměřený na kombinaci Ru (II) s novými nanomateriály vykazuje poměrně slibné výsledky pro budoucí použití v lékařství. Degradovatelné, polymerické, fruktózou potažené micely obsahující RAPTA-C výrazně zvyšují příjem a internalizaci ruthenia uvnitř buněk ve srovnání s volnou RAPTA-C a inhibují invazivitu ovariálních buněk OVCAR4 in vitro [87,88]. Chen et al vyvinuli nanokapsulový 3P-Ru/ PbPS systém, který zvyšuje příjem aktivního 3P-Ru z 35 % v roztoku, který měl pH 7,4, na 65 % příjmu aktivního 3P-Ru z roztoku s pH 6,5. To indikuje selektivní a rychlé uvolňování v kyselém prostředí, a tedy zvýšení koncentrace látky v oblasti nádorů a zabránění jejich růstu. Tento systém byl schopen dodávat 3P-Ru do U251 gliomových buněk s vysokou účinností, současně docházelo k inhibici proliferace a navození buněčné smrti apoptózou. V myších modelech nesoucích U251 buňky aplikované pod kůží se po působení 3P-Ru/ PbPS během 8 dní významně snížil růst nádorů asi o 5násobek (průměrná velikost nádoru 5 mm3) ve srovnání s myšmi ošetřenými PBS (25 mm3), PbPS nanočásticemi (26 mm3) a pH necitlivými kapsulemi PEG-Ru (20 mm3) [89].
Poslední novinkou v oblasti potenciální léčby nádorů pomocí sloučenin ruthenia je kombinace s nanomateriály a bimodální fototermální (photothermal – PTT) a dvoufotonovou fotodynamickou léčbou (two-photon photodynamic therapy – TPPDT). V jednom z výzkumů jsou Ru (II) komplexně funkcionalizované jednovrstvé uhlíkové nanotrubice (Ru@SWCNTs) vyvinuté jako nano-templáty pro PTT-TPPDT. V testech byly použity uhlíkové nanotrubičky schopné pojmout velké množství ruthenia Ru (II) (Ru@SWCNTs). To je v buňkách uvolňováno fototermálním účinkem ozáření pomocí 808nm diodového laseru (0,25 W/ cm2). Uvolněné Ru (II) komplexy uvnitř ozářených nádorových buněk produkují kyslíkové radikály a mohou být použity jako dvoufotonové fotodynamické terapeutické činidlo. U myších xenograftů s injekovanými HeLa buňkami ošetřených tímto postupem došlo po aplikaci Ru@SWCNTs s PTT-TPPDT terapií k vymizení nádorů [90]. Dalším vylepšením této PTT léčby je přidání transferinu na syntetizovaný nanomateriál s rutheniem (Tf-RuNPs) pro další zvýšení kumulace látky uvnitř nádorových buněk pomocí endocytózy právě díky obsahu transferinu. U testů in vivo na myších xenograftech došlo ke 100% eliminaci nádorů bez pozorování významných toxických vedlejších účinků. To dokázalo, že Tf-RuNPs mohou sloužit jako výborná fototermální činidla pro léčbu nádorů [91].
Původně se předpokládalo, že vazba sloučenin ruthenia na DNA je základem jejich protinádorového účinku [74,92,93]. Nedávné studie však odhalily, že DNA není primárním cílem a sloučeniny ruthenia jsou ve skutečnosti mnohem silněji vázány na proteiny než na struktury DNA [77,94]. Komplexy ruthenia se mohou silně vázat na transferin a jejich příjem v nádorových buňkách pravděpodobně interferuje s příjmem železa. Nádorové buňky mají zvýšené nároky na příjem železa. Následkem toho je zvýšení koncentrace transferinu. Proto tedy komplexy ruthenia vykazují vyšší účinnost v nádorových buňkách oproti buňkám zdravých tkání [77].
Závěr
Rakovina je jednou z nejčastějších a nejvíce heterogenních nemocí. Z toho důvodu je důležité její léčbu volit tak, aby byla co nejúčinnější pro daný typ nádoru. Osvědčeným přístupem při léčbě nádorových onemocnění je kombinované použití více různých typů chemoterapeutických léčiv. Současné možnosti chemoterapie však mají určitá omezení spočívající především v negativních vedlejších účincích a ve vzniku rezistence. Organokovové sloučeniny mohou být možnou alternativou, tudíž jejich vývoji bylo během posledních několika desetiletí věnováno značné úsilí. Zejména sloučeniny ruthenia díky své potenciální cytotoxicitě a především schopnosti potlačovat neoangiogenezi a blokovat metastazování mají v počátečních klinických studiích vysokou úspěšnost a slibují i možné využití v praxi. Bližší poznatky o jejich mechanizmu účinku mohou vést až k integraci multimodálních léčebných strategií založených na využití synergických účinků organokovových sloučenin v kombinaci s dalšími typy protinádorové terapie s cílem zvýšit, resp. optimalizovat efektivitu léčby rakoviny.
Práce byla podpořena projekty GAČR 17-05838S, MŠMT – NPU I – LO1413 a MZ ČR-RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Mgr. Hana Skoupilová
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: hana.skoupilova@mou.cz
Obdrženo/Submitted: 10. 7. 2019
Přijato/Accepted: 5. 8. 2019
Zdroje
1. Glusker JP. Dorothy Crowfoot Hodgkin (1910 – 1994). Protein Sci 1994; 3(12): 2465 – 2469. doi: 10.1002/ pro. 5560031233.
2. Leung HW, Hallesy DW, Shott LD et al. Toxicological evaluation of substituted dicyclopentadienyliron (ferrocene) compounds. Toxicol Lett 1987; 38(1 – 2): 103 – 108.
3. Latunde-Dada GO. Ferroptosis: role of lipid peroxidation, iron and ferritinophagy. Biochim Biophys Acta Gen Subj 2017; 1861(8): 1893 – 1900. doi: 10.1016/ j.bbagen.2017.05.019.
4. Beliakova TA, Leshchev LS. Use of ferroceron for the treatment of iron deficiency anemia. Ter Arkh 1975; 47(6): 115 – 119.
5. Patra M, Gasser G. The medicinal chemistry of ferrocene and its derivatives. Nat Rev Chem 2017; 1 : 66. doi: 10.1038/ s41570-017-0066.
6. Voňka P, Hrstka R. Souhrn aktuálních poznatků o úloze estrogenového receptoru α v nádorové buněčné signalizaci. Klin Onkol 2019; 32 (Suppl 3): 3S34–3S38. doi: 10.14735/amko20193S34.
7. Acevedo-Morantes CY, Meléndez E, Singh SP et al. Cytotoxicity and reactive oxygen species generated by ferrocenium and ferrocene on MCF7 and MCF10A cell lines. J Cancer Sci Ther 2012; 4 : 4271 – 275. doi:10.4172/ 1948-5956.1000154.
8. Vessieres A, Corbet C, Heldt JM et al. A ferrocenyl derivative of hydroxytamoxifen elicits an estrogen receptor-independent mechanism of action in breast cancer cell lines. J Inorg Biochem 2010; 104(5): 503 – 511. doi: 10.1016/ j.jinorgbio.2009.12.020.
9. Michard Q, Jaouen G, Vessieres A et al. Evaluation of cytotoxic properties of organometallic ferrocifens on melanocytes, primary and metastatic melanoma cell lines. J Inorg Biochem 2008; 102(11): 1980 – 1985. doi: 10.1016/ j.jinorgbio.2008.07.014.
10. Birmingham JM, Seyferth D, Wilkinson G. A new preparation of bis-cyclopentadienyl-metal compounds. J Am Chem Soc 1954; 76(16): 4179. doi: 10.1021/ ja01645a038.
11. Kopf H, Kopf-Maier P. Titanocene dichloride – the first metallocene with cancerostatic activity. Angew Chem Int Ed Engl 1979; 18(6): 477 – 478. doi: 10.1002/ anie.197904771.
12. Christodoulou CV, Ferry DR, Fyfe DW et al. Phase I trial of weekly scheduling and pharmacokinetics of titanocene dichloride in patients with advanced cancer. J Clin Oncol 1998; 16(8): 2761 – 2769. doi: 10.1200/ JCO.1998.16.8.2761.
13. Korfel A, Scheulen ME, Schmoll HJ et al. Phase I clinical and pharmacokinetic study of titanocene dichloride in adults with advanced solid tumors. Clin Cancer Res 1998; 4(11): 2701 – 2708.
14. Kröger N, Kleeberg UR, Mross K et al. Phase II clinical trial of titanocene dichloride in patients with metastatic breast cancer. Oncol Res Treat 2000; 23 : 60 – 62. doi: 10.1159/ 000027075.
15. Lummen G, Sperling H, Luboldt H et al. Phase II trial of titanocene dichloride in advanced renal-cell carcinoma. Cancer Chemother Pharmacol 1998; 42(5): 415 – 417. doi: 10.1007/ s002800050838.
16. Guo M, Sun H, McArdle HJ et al. Ti(IV) uptake and release by human serum transferrin and recognition of Ti(IV)-transferrin by cancer cells: understanding the mechanism of action of the anticancer drug titanocene dichloride. Biochemistry 2000; 39(33): 10023 – 10033. doi: 10.1021/ bi000798z.
17. Harstrick A, Schmoll HJ, Sass G et al. Titanocendichloride activity in cisplatin and doxorubicin-resistant human ovarian carcinoma cell lines. Eur J Cancer 1993; 29A(7): 1000 – 1002. doi: 10.1016/ s0959-8049(05)80210-2.
18. Christodoulou CV, Eliopoulos AG, Young LS et al. Anti-proliferative activity and mechanism of action of titanocene dichloride. Br J Cancer 1998; 77(12): 2088 – 2097. doi: 10.1038/ bjc.1998.352.
19. Weber H, Claffey J, Hogan M et al. Analyses of titanocenes in the spheroid-based cellular angiogenesis assay. Toxicol In Vitro 2008; 22(2): 531 – 534. doi: 10.1016/ j.tiv.2007.09.014.
20. Kolberg HC, Villena-Heinsen C, Deml MM et al. Relationship between chemotherapy with paclitaxel, cisplatin, vinorelbine and titanocene dichloride and expression of proliferation markers and tumour suppressor gene p53 in human ovarian cancer xenografts in nude mice. Eur J Gynaecol Oncol 2005; 26(4): 398 – 402.
21. Boyles JR, Bair MC, Campling BG et al. Enhanced anti-cancer activities of some derivatives of titanocene dichloride. J Inorg Biochem 2001; 84(1 – 2): 159 – 162.
22. Tacke M, Allen LT, Cuffe LP et al. Novel titanocene anti-cancer drugs derived from fulvenes and titanium dichloride. J Organomet Chem 2004; 689(13): 2242 – 2249. doi: 10.1016/ j.jorganchem.2004.04.015.
23. Allen OR, Croll L, Gott AL et al. Functionalized cyclopentadienyl titanium organometallic compounds as new antitumor drugs. Organometallics 2004; 23(2): 288 – 292. doi: 10.1021/ om030403i.
24. McGowan MA, McGowan PC. A one-step synthesis of protected functionalised titanocene dichlorides. Inorg Chem Commun 2000; 3(7): 337 – 340.
25. Potter GD, Baird MC, Cole SPC. A new series of titanocene dichloride derivatives bearing chiral alkylammonium groups: assessment of their cytotoxic properties. Inorg Chim Acta 2010; 364(1): 16 – 22.
26. Sweeney NJ, Mendoza O, Müller-Bunz H et al. Novel benzyl substituted titanocene anti-cancer drugs. J Organomet Chem 2005; 690(21 – 22): 4537 – 4544. doi: 10.1016/ j.jorganchem.2005.06.039.
27. Fichtner I, Pampillon C, Sweeney NJ et al. Anti-tumor activity of titanocene Y in xenografted Caki-1 tumors in mice. Anticancer Drugs 2006; 17(3): 333 – 336.
28. Bannon JH, Fichtner I, O’Neill A et al. Substituted titanocenes induce caspase-dependent apoptosis in human epidermoid carcinoma cells in vitro and exhibit antitumour activity in vivo. Br J Cancer 2007; 97(9): 1234 – 1241. doi: 10.1038/ sj.bjc.6604021.
29. Beckhove P, Oberschmidt O, Hanauske AR et al. Antitumor activity of titanocene Y against freshly explanted human breast tumor cells and in xenografted MCF-7 tumors in mice. Anticancer Drugs 2007; 18(3): 311 – 315. doi: 10.1097/ CAD.0b013e328010a6f7.
30. Kater L, Claffey J, Hogan M et al. The role of the intrinsic FAS pathway in titanocene Y apoptosis: the mechanism of overcoming multiple drug resistance in malignant leukemia cells. Toxicol In Vitro 2012; 26(1): 119 – 124. doi: 10.1016/ j.tiv.2011.09.010.
31. Juo P, Woo MS, Kuo CJ et al. FADD is required for multiple signaling events downstream of the receptor Fas. Cell Growth Differ 1999; 10(12): 797 – 804.
32. Claffey J, Hogan M, Muller-Bunz H et al. Oxali-titanocene Y: a potent anticancer drug. Chem Med Chem 2008; 3(5): 729 – 731. doi: 10.1002/ cmdc.200700302.
33. Fichtner I, Behrens D, Claffey J et al. Antitumor activity of oxali-titanocene Y in xenografted CAKI-1 tumors in mice. Letters in Drug Design & Discovery 2008; 5(8): 489 – 493. doi: 10.2174/ 157018008786898545.
34. Deally A, Hackenberg F, Lally G et al. Synthesis and biological evaluation of achiral indole-substituted titanocene dichloride derivatives. Int J Med Chem 2012; 2012 : 905981. doi: 10.1155/ 2012/ 905981.
35. Walther W, Fichtner I, Deally A et al. The activity of titanocene T against xenografted Caki-1 tumors. Letters in Drug Design & Discovery 2013; 10(5): 375 – 381. doi: 10.2174/ 1570180811310050002.
36. Tacke M, Cuffe LP, Gallagher WM et al. Methoxy-phenyl substituted ansa-titanocenes as potential anti-cancer drugs derived from fulvenes and titanium dichloride. J Inorg Biochem 2004; 98(12): 1987 – 1994. doi: 10.1016/ j.jinorgbio.2004.09.001.
37. Valadares MC, Ramos AL, Rehmann FJ et al. Antitumour activity of [1,2-di(cyclopentadienyl)-1,2-di(p-N,N-dimethylaminophenyl)-ethanediyl] titanium dichloride in xenografted Ehrlich‘s ascites tumour. Eur J Pharmacol 2006; 534(1 – 3): 264 – 270. doi: 10.1016/ j.ejphar.2006.01.056.
38. Fernandez-Gallardo J, Elie BT, Sadhukha T et al. Heterometallic titanium – gold complexes inhibit renal cancer cells in vitro and in vivo. Chem Sci 2015; 6(9): 5269 – 5283. doi: 10.1039/ C5SC01753J.
39. Fernandez-Gallardo J, Elie BT, Sulzmaier FJ et al. Organometallic titanocene-gold compounds as potential chemotherapeutics in renal cancer. Study of their protein kinase inhibitory properties. Organometallics 2014; 33(22): 6669 – 6681. doi: 10.1021/ om500965k.
40. Mui YF, Fernandez-Gallardo J, Elie BT et al. Titanocene-gold complexes containing N-heterocyclic carbene ligands inhibit growth of prostate, renal, and colon cancers in vitro. Organometallics 2016; 35(9): 1218 – 1227. doi: 10.1021/ acs.organomet.6b00051.
41. Keppler BK, Heim ME, Flechtner H et al. Assessment of the preclinical activity of budotitane in three different transplantable tumor systems, its lack of mutagenicity, and first results of clinical phase I studies. Arzneimittelforschung 1989; 39(6): 706 – 709.
42. Keppler BK, Schmahl D. Preclinical evaluation of dichlorobis(1-phenylbutane-1,3-dionato)titanium (IV) and budotitane. Two representatives of the new class of antitumor-active bis-beta-diketonato metal complexes. Arzneimittelforschung 1986; 36(12): 1822 – 1828.
43. Schilling T, Keppler KB, Heim ME et al. Clinical phase I and pharmacokinetic trial of the new titanium complex budotitane. Invest New Drugs 1996; 13(4): 327 – 332.
44. Qian ZM, Li H, Sun H et al. Targeted drug delivery via the transferrin receptor-mediated endocytosis pathway. Pharmacol Rev 2002; 54(4): 561 – 587.
45. Aarabi MH, Mirhashemi SM, Ani M et al. Comparative binding studies of titanium and iron to human serum transferrin. Asian J Biochem 2011; 6(2): 191 – 199. doi: 10.3923/ ajb.2011.191.199.
46. Lally G, Deally A, Hackenberg F et al. Titanocene Y - transport and targeting of an anticancer drug candidate. Letters in Drug Design & Discovery 2013; 10(8): 675 – 682. doi: 10.2174/ 15701808113100890027.
47. Pavlaki M, Debeli K, Triantaphyllidou IE et al. A proposed mechanism for the inhibitory effect of the anticancer agent titanocene dichloride on tumour gelatinases and other proteolytic enzymes. J Biol Inorg Chem 2009; 14(6): 947 – 957. doi: 10.1007/ s00775-009-0507-7.
48. Tinoco AD, Eames EV, Valentine AM. Reconsideration of serum Ti(IV) transport: albumin and transferrin trafficking of Ti(IV) and its complexes. J Am Chem Soc 2008; 130(7): 2262 – 2270. doi: doi: 10.1021/ ja076364+.
49. Gasser G, Ott I, Metzler-Nolte N. Organometallic anticancer compounds. J Med Chem 2011; 54(1): 3 – 25. doi: 10.1021/ jm100020w.
50. Berger MR, Garzon FT, Keppler BK et al. Efficacy of new ruthenium complexes against chemically induced autochthonous colorectal carcinoma in rats. Anticancer Res 1989; 9(3): 761 – 765.
51. Dale LD, Tocher JH, Dyson TM et al. Studies on DNA damage and induction of SOS repair by novel multifunctional bioreducible compounds. II. A metronidazole adduct of a ruthenium-arene compound. Anticancer Drug Des 1992; 7(1): 3 – 14.
52. Canovic P, Simovic AR, Radisavljevic S et al. Impact of aromaticity on anticancer activity of polypyridyl ruthenium(II) complexes: synthesis, structure, DNA/ protein binding, lipophilicity and anticancer activity. J Biol Inorg Chem 2017; 22(7): 1007 – 1028. doi: 10.1007/ s00775-017-1479-7.
53. Castonguay A, Doucet C, Juhas M et al. New ruthenium(II)-letrozole complexes as anticancer therapeutics. J Med Chem 2012; 55(20): 8799 – 8806. doi: 10.1021/ jm301103y.
54. Gossens C, Tavernelli I, Rothlisberger U. Structural and energetic properties of organometallic ruthenium(II) diamine anticancer compounds and their interaction with nucleobases. J Chem Theory Comput 2007; 3(3): 1212 – 1222. doi: 10.1021/ ct6003577.
55. Chelopo MP, Pawar SA, Sokhela MK et al. Anticancer activity of ruthenium(II) arene complexes bearing 1,2,3,4-tetrahydroisoquinoline amino alcohol ligands. Eur J Med Chem 2013; 66407 – 66414. doi: 10.1016/ j.ejmech.2013.05.048.
56. Nowak-Sliwinska P, van Beijnum JR, Casini A et al. Organometallic ruthenium(II) arene compounds with antiangiogenic activity. J Med Chem 2011; 54(11): 3895 – 3902. doi: 10.1021/ jm2002074.
57. Sava G, Clerici K, Capozzi I et al. Reduction of lung metastasis by ImH[trans-RuCl4(DMSO)Im]: mechanism of the selective action investigated on mouse tumors. Anticancer Drugs 1999; 10(1): 129 – 138.
58. Weiss A, Berndsen RH, Dubois M et al. In vivo anti-tumor activity of the organometallic ruthenium(II)-arene complex [Ru(h6-p-cymene)-Cl2(pta)] (RAPTA-C) in human ovarian and colorectal carcinomas. Chem Sci 2014; 12(5): 4742 – 4748.
59. Bergamo A, Zorzet S, Gava B et al. Effects of NAMI-Aand some related ruthenium complexes on cell viability after short exposure of tumor cells. Anticancer Drugs 2000; 11(8): 665 – 672.
60. Debidda M, Sanna B, Cossu A et al. NAMI-A inhibits the PMA-induced ODC gene expression in ECV304 cells: involvement of PKC/ Raf/ Mek/ ERK signalling pathway. Int J Oncol 2003; 23(2): 477 – 482.
61. Sava G, Capozzi I, Clerici K et al. Pharmacological control of lung metastases of solid tumours by a novel ruthenium complex. Clin Exp Metastasis 1998; 16(4): 371 – 379.
62. Sava G, Bergamo A, Zorzet S et al. Influence of chemical stability on the activity of the antimetastasis ruthenium compound NAMI-A. Eur J Cancer 2002; 38(3): 427 – 435. doi: 10.1016/ s0959-8049(01)00389-6.
63. Sava G, Zorzet S, Turrin C et al. Dual action of NAMI-A in inhibition of solid tumor metastasis: selective targeting of metastatic cells and binding to collagen. Clin Cancer Res 2003; 9(5): 1898 – 1905.
64. Vacca A, Bruno M, Boccarelli A et al. Inhibition of endothelial cell functions and of angiogenesis by the metastasis inhibitor NAMI-A. Br J Cancer 2002; 86(6): 993 – 998. doi: 10.1038/ sj.bjc.6600176.
65. Morbidelli L, Donnini S, Filippi S et al. Antiangiogenic properties of selected ruthenium(III) complexes that are nitric oxide scavengers. Br J Cancer 2003; 88(9): 1484 – 1491. doi: 10.1038/ sj.bjc.6600906.
66. Pacor S, Zorzet S, Cocchietto M et al. Intratumoral NAMI-A treatment triggers metastasis reduction, which correlates to CD44 regulation and tumor infiltrating lymphocyte recruitment. J Pharmacol Exp Ther 2004; 310(2): 737 – 744. doi: 10.1124/ jpet.104.066175.
67. Bacac M, Hotze AC, van der Schilden K et al. The hydrolysis of the anti-cancer ruthenium complex NAMI-A affects its DNA binding and antimetastatic activity: an NMR evaluation. J Inorg Biochem 2004; 98(2): 402 – 412.
68. Rademaker-Lakhai JM, van den Bongard D, Pluim D et al. A phase I and pharmacological study with imidazolium-trans-DMSO-imidazole-tetrachlororuthenate, a novel ruthenium anticancer agent. Clin Cancer Res 2004; 10(11): 3717 – 3727. doi: 10.1158/ 1078-0432.CCR-03-0746.
69. Leijen S, Burgers SA, Baas P et al. Phase I/ II study with ruthenium compound NAMI-A and gemcitabine in patients with non-small cell lung cancer after first line therapy. Invest New Drugs 2015; 33(1): 201 – 214. doi: 10.1007/ s10637-014-0179-1.
70. Seelig MH, Berger MR, Keppler BK. Antineoplastic activity of three ruthenium derivatives against chemically induced colorectal carcinoma in rats. J Cancer Res Clin Oncol 1992; 118(3): 195 – 200.
71. Heffeter P, Pongratz M, Steiner E et al. Intrinsic and acquired forms of resistance against the anticancer ruthenium compound KP1019 [indazolium trans-[tetrachlorobis(1H-indazole)ruthenate (III)] (FFC14A). J Pharmacol Exp Ther 2005; 312(1): 281 – 289. doi: 10.1124/ jpet.104.073395.
72. Hartinger CG, Jakupec MA, Zorbas-Seifried S et al. KP1019, a new redox-active anticancer agent – preclinical development and results of a clinical phase I study in tumor patients. Chem Biodivers 2008; 5(10): 2140 – 2155. doi: 10.1002/ cbdv.200890195.
73. Stevens SK, Strehle AP, Miller RL et al. The anticancer ruthenium complex KP1019 induces DNA damage, leading to cell cycle delay and cell death in Saccharomyces cerevisiae. Mol Pharmacol 2013; 83(1): 225 – 234. doi: 10.1124/ mol.112.079657.
74. Hartinger CG, Zorbas-Seifried S, Jakupec MA et al. From bench to bedside – preclinical and early clinical development of the anticancer agent indazolium trans-[tetrachlorobis(1H-indazole)ruthenate(III)] (KP1019 or FFC14A). J Inorg Biochem 2006; 100(5 – 6): 891 – 904. doi: 10.1016/ j.jinorgbio.2006.02.013.
75. Lentz F, Drescher A, Lindauer A et al. Pharmacokinetics of a novel anticancer ruthenium complex (KP1019, FFC14A) in a phase I dose-escalation study. Anticancer Drugs 2009; 20(2): 97 – 103. doi: 10.1097/ CAD.0b013e328322fbc5.
76. Peti W, Pieper T, Sommer M et al. Synthesis of tumor-inhibiting complex salts containing the anion trans-tetrachlorobis(indazole)ruthenate(III) and crystal structure of the tetraphenylphosphonium salt. Eur J Inorg Chem 1999; 1999(9): 1551 – 1555.
77. Kratz F, Hartmann M, Keppler B et al. The binding prop-erties of two antitumor ruthenium(III) complexes to apotransferrin. J Biol Chem 1994; 269(4): 2581 – 2588.
78. Heffeter P, Atil B, Kryeziu K et al. The ruthenium compound KP1339 potentiates the anticancer activity of sorafenib in vitro and in vivo. Eur J Cancer 2013; 49(15): 3366 – 3375. doi: 10.1016/ j.ejca.2013.05.018.
79. Dickson NR, Jones SF, Burris HA et al. A phase I dose-escalation study of NKP-1339 in patients with advanced solid tumors refractory to treatment. J Clin Oncol 2011; 29 (Suppl): abstr. 2607.
80. Burris HA, Bakewell S, Bendell JC et al. Safety and activity of IT-139, a ruthenium-based compound, in patients with advanced solid tumours: a first-in-human, open-label, dose-escalation phase I study with expansion cohort. ESMO Open 2016; 1(6): e000154. doi: 10.1136/ esmoopen-2016-000154.
81. Lizardo MM, Morrow JJ, Miller TE et al. Upregulation of glucose-regulated protein 78 in metastatic cancer cells is necessary for lung metastasis progression. Neoplasia 2016; 18(11): 699 – 710. doi: 10.1016/ j.neo.2016.09.001.
82. Gifford JB, Huang W, Zeleniak AE et al. Expression of GRP78, master regulator of the unfolded protein response, increases chemoresistance in pancreatic ductal adenocarcinoma. Mol Cancer Ther 2016; 15(5): 1043 – 1052. doi: 10.1158/ 1535-7163.MCT-15-0774.
83. Flocke LS, Trondl R, Jakupec MA et al. Molecular mode of action of NKP-1339 - a clinically investigated ruthenium-based drug – involves ER - and ROS-related effects in colon carcinoma cell lines. Invest New Drugs 2016; 34(3): 261 – 268. doi: 10.1007/ s10637-016-0337-8.
84. Bergamo A, Masi A, Dyson PJ et al. Modulation of the metastatic progression of breast cancer with an organometallic ruthenium compound. Int J Oncol 2008; 33(6): 1281 – 1289.
85. Scolaro C, Bergamo A, Brescacin L et al. In vitro and in vivo evaluation of ruthenium(II)-arene PTA complexes. J Med Chem 2005; 48(12): 4161 – 4171. doi: 10.1021/ jm050015d.
86. Chatterjee S, Kundu S, Bhattacharyya A et al. The ruthenium(II)-arene compound RAPTA-C induces apoptosis in EAC cells through mitochondrial and p53-JNK pathways. J Biol Inorg Chem 2008; 13(7): 1149 – 1155. doi: 10.1007/ s00775-008-0400-9.
87. Lu H, Blunden BM, Scarano W et al. Anti-metastatic effects of RAPTA-C conjugated polymeric micelles on two-dimensional (2D) breast tumor cells and three-dimensional (3D) multicellular tumor spheroids. Acta Biomater 2016; 3268 – 3276. doi: 10.1016/ j.actbio.2015.12.020.
88. Lu M, Henry CE, Lai H et al. A new 3D organotypic model of ovarian cancer to help evaluate the antimetastatic activity of RAPTA-C conjugated micelles. Biomater Sci 2019; 7(4): 1652 – 1660. doi: 10.1039/ c8bm01326h.
89. Chen L, Fu C, Deng Y et al. A pH-sensitive nanocarrier for tumor targeting: delivery of ruthenium complex for tumor theranostic by pH-sensitive nanocapsule. Pharm Res 2016; 33(12): 2989 – 2998. doi: 10.1007/ s11095-016-2021-2.
90. Zhang P, Huang H, Huang J et al. Noncovalent ruthenium(II) complexes-single-walled carbon nanotube composites for bimodal photothermal and photodynamic therapy with near-infrared irradiation. ACS Appl Mater Interfaces 2015; 7(41): 23278 – 23290. doi: 10.1021/ acsami.5b07510.
91. Zhao S, Zhu X, Cao C et al. Transferrin modified ruthenium nanoparticles with good biocompatibility for photothermal tumor therapy. J Colloid Interface Sci 2018; 511325 – 511334. doi: 10.1016/ j.jcis.2017.10.023.
92. Wang F, Chen H, Parsons S et al. Kinetics of aquation and anation of ruthenium(II) arene anticancer complexes, acidity and X-ray structures of aqua adducts. Chemistry 2003; 9(23): 5810 – 5820. doi: 10.1002/ chem.200304724.
93. Yan YK, Melchart M, Habtemariam A et al. Organometallic chemistry, biology and medicine: ruthenium arene anticancer complexes. Chem Commun (Camb) 2005(38): 4764 – 4776. doi: 10.1039/ b508531b.
94. Scolaro C, Chaplin AB, Hartinger CG et al. Tuning the hydrophobicity of ruthenium(II)-arene (RAPTA) drugs to modify uptake, biomolecular interactions and efficacy. Dalton Trans 2007(43): 5065 – 5072. doi: 10.1039/ b705449a.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Editorial 2019
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2019 Číslo Supplementum 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Syntetická letalita – její současné využití a potenciál v onkologické léčbě
- Pokroky ve využití organokovových sloučenin při vývoji protinádorových léčiv
- Editorial 2019
- Souhrn aktuálních poznatků o úloze estrogenového receptoru α v nádorové buněčné signalizaci
- Glykoproteiny v sérech onkologických pacientů
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Výskum ubikvitinácie proteínov v onkológii
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
- Dlouhé nekódující RNA – současné možnosti detekce a využití v klinické praxi
- Interakce onkogenních virových proteinů s proteiny rodiny p53
- Kooperace genomických, transkriptomických a proteomických metod v detekci mutovaných proteinů
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Výskum ubikvitinácie proteínov v onkológii
- CRISPR-Cas9 jako nástroj v terapii nádorových onemocnění
- Glykozylácia ako dôležitý regulátor funkcie protilátok
- Méně časté mutace EGFR v kontextu léčby nemalobuněčného karcinomu plic
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání