-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
New Findings in Methotrexate Pharmacology – Diagnostic Possibilities and Impact on Clinical Care
Methotrexate is an anti-cancer drug used to treat several malignancies including pediatric acute lymphoblastic leukemia and choriocarcinoma. Despite recent advances in cancer chemotherapy, it remains a mainstay of therapy since its discovery in the early second half of the previous century. Moreover, low-dose methotrexate is a gold standard antirheumatic drug in the treatment of rheumatoid arthritis, psoriasis, systemic scleroderma and other autoimmune disorders. Side effects of methotrexate treatment are well known and described; however, their occurrence may often be unpredictable due to lack of specific biomarkers of toxicity. Methotrexate plasma levels are routinely monitored by therapeutic drug monitoring, nevertheless, occurrence and concentrations of its metabolites are not measured. During methotrexate treatment 7 - hydroxymethotrexate and 2,4 - diamino - N10 - mehylpteroic acid appear in plasma. The latter can further be hydroxylated and glucuronidated resulting in five possible extracellular methotrexate metabolites. In addition, methotrexate is intracellularly converted to its active polyglutamylated forms. Therapeutic efficacy is dependent on formation of methotrexate polyglutamates as it keeps intracellular pool of the drug and enhances its affinity towards various target enzymes. In this study, we describe pharmacokinetic and pharmacodynamic characteristics of methotrexate metabolites. We also review methotrexate blood brain barrier transport to cerebrospinal fluid regarding its use in the prevention of leukemic central nervous system involvement and management of methotrexate toxicity with the use of carboxypeptidase - G2. Finally, we discuss laboratory methods for monitoring methotrexate metabolites and benefits of simultaneous determination of methotrexate and metabolites as possible biomarkers of therapeutic efficacy and clinical toxicity.
Key words:
methotrexate – 7 - hydroxymethotrexate – toxicity – pharmacokinetics – drug monitoring – polyglutamates
This study was supported by European Regional Development Fund and the State budget of the Czech Republic for Regional Centre of Applied Molecular Oncology (RECAMO, CZ.1.05/2.1.00/03.0101), by the project MEYS – NPS I – LO1413 and by IGA Czech Ministry of Health NT14327.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
27. 3. 2015Accepted:
28. 4. 2015
Autoři: Řiháček M. 1 3; Pilátová K. 1 3; J. Štěrba 1,3; Pilný R. 1 3; Valík D. 1 3
Působiště autorů: Klinika dětské onkologie LF MU a FN Brno 1; Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 2; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Klin Onkol 2015; 28(3): 163-170
Kategorie: Přehledy
doi: https://doi.org/10.14735/amko2015163Souhrn
Methotrexát je protinádorový lék užívaný v léčbě řady onkologických onemocnění. Je základem léčby akutní lymfoblastické leukemie dětského věku a choriokarcinomu již od poloviny minulého století. Zároveň je jedním z nejpoužívanějších antirevmatik, kde je lékem volby u revmatoidní artritidy, psoriázy, systémové sklerodermie a dalších autoimunitních onemocnění. Vedlejší účinky terapie methotrexátem jsou dobře známé, avšak jejich výskyt lze jen těžko předpovědět kvůli absenci specifických markerů toxicity. Plazmatické hladiny methotrexátu jsou v onkologii monitorovány vzhledem k zavedenému terapeutickému monitorování hladin léčiva. Tento monitoring však nezahrnuje měření koncentrací jeho četných metabolitů. Během léčby methotrexátem lze v krevní plazmě detekovat 7 - hydroxymethotrexát a 2,4 - diamino - N10-methylpteroovou kyselinu, která může být dále hydroxylována a glukuronidována, čímž může vzniknout celkem pět různých plazmatických metabolitů. Cíle farmakodynamického účinku methotrexátu se nacházejí v cytoplazmě buněk, kde methotrexát podstupuje extenzivní enzymatickou polyglutamylaci. Tato intracelulární konverze udržuje léčivo v aktivní formě v buňkách a navíc zvyšuje jeho afinitu vůči cílovým enzymům. Přehledový článek popisuje farmakokinetické a farmakodynamické vlastnosti metabolitů methotrexátu, shrnuje problematiku dosažení terapeutických koncentrací methotrexátu v mozkomíšním moku, jako prevence leukemického postižení centrálního nervového systému a diskutuje využití karboxypeptidázy G2 v managementu akutní toxicity léčby. Publikace se také zabývá laboratorní problematikou monitorování methotrexátu a jeho metabolitů, které by v budoucnu mohly být novými biomarkery terapeutického efektu a toxicity léčby.
Klíčová slova:
methotrexát – 7 - hydroxymethotrexát – toxicita – farmakokinetika – monitorování léčiv – polyglutamátyÚvod
Objevení protinádorového účinku folátových antagonistů znamenalo ve 40. letech minulého století značný průlom v klasické chemoterapii [1]. Kromě methotrexátu (MTX) a jeho toxičtějšího předchůdce aminopterinu byly v té době v počátcích experimenty s antiandrogenní terapií karcinomu prostaty a hormonální terapií všeobecně [2]. V době před druhou světovou válkou byla možnost chemoterapeutické léčby omezená a zahrnovala experimenty se sloučeninami arzenu [3], vojenskými plyny (dusíkatý yperit) a dalšími látkami, u nichž však toxicita značně převyšovala terapeutický účinek [4]. Chemoterapie s použitím antifolátových léčiv dokázala jako první přivést do remise dětské onkologické pacienty s hematoonkologickými malignitami s relativně přijatelnou toxicitou vůči zdravé tkáni [1]. Od 40. let 20. století prodělala protinádorová terapie MTX mnoho optimalizací. Zavedení terapeutického monitorování hladin (therapeutic drug monitoring – TDM) MTX, které je dnes standardem při jeho vysokodávkovém podávání, pomohlo zefektivnit nejen terapii hematoonkologických malignit v pediatrické onkologii, ale i léčbu solidních nádorů, jako je osteosarkom a choriokarcinom. Methotrexát je také alternativou v léčbě malobuněčného karcinomu plic a lze jej využít i v paliativní chemoterapii pokročilého karcinomu žlučových cest. Kromě využití v onkologických indikacích je MTX jedním z hlavních imunosupresiv používaných v léčbě autoimunitních chorob dětského a dospělého věku [5]. Hlavním mechanizmem účinku MTX je kompetitivní inhibice dihydrofolát reduktázy (DHFR, E.C. 1.5.1.3), zkoumají se i další možné mechanizmy účinku, jako je nepřímý vliv na indukci apoptózy pomocí různých tumor supresorů [6,7], snížení signalizace onkogenu B cell lymphoma 2 (BCL - 2) downregulací jeho exprese [7] a snížení prozánětlivé aktivity buněk vlivem na metabolizmus adenosinu a syntézu polyaminů [8 – 10]. Kromě DHFR a non-DHFR vázaných mechanizmů účinku se zkoumá vazba MTX na epigenetiku [11,12]. Farmakodynamické účinky vykazují kromě parentální sloučeniny léčiva také metabolity MTX, které vznikají biotransformací v játrech (7 - hydroxymethotrexát – 7 - OH MTX) a cílových buňkách (MTX - polyglutamáty – MTX - Glux) [13]. Zatímco MTX a hlavní metabolit 7 - OH MTX jsou metabolity cirkulující především v plazmě, MTX - Glux zůstávají intracelulárně v cílových buňkách, kde působí cytostaticky [14]. Farmakokinetika MTX v širším smyslu slova má zásadní význam v pochopení a managementu jeho toxicity [15]. Přestože je díky dlouhodobým klinickým zkušenostem a rutinnímu TDM chemoterapie MTX považována za jednu z nejbezpečnějších v dnešní době, má MTX řadu nežádoucích účinků. U nízkých dávek (do 100 mg p.o./ týdně), které jsou indikovány v terapii autoimunit a v udržovací protinádorové chemoterapii, převažuje toxicita v gastrointestinálním traktu (střevní a hepatální) a myelosuprese, zatímco u chemoterapie vysokodávkovaným (high-dose) MTX (HD MTX) dominuje nefrotoxicita, která může v některých případech přejít až do akutního renálního selhání (extenzivněji popsáno jinde) [16]. Dalším závažným nežádoucím účinkem HD MTX je toxicita v centrálním nervovém systému (CNS) [17,18]. MTX má některé významné lékové interakce. Vzhledem k imunomodulačnímu účinku je kontraindikováno podávání vakcín. Při léčbě nesteroidními antirevmatiky (non-steroidal antiinflammatory drugs – NSAIDs) může dojít ke snížení renální clearance MTX a zvýšení toxicity, a to zejména u HD MTX režimů. Antibakteriální chemoterapeutika zasahující do metabolizmu kyseliny listové (trimethoprim/ sulfomethoxazol) mohou potenciálně zvýšit toxicitu MTX [5,19].
Vznik a vlastnosti 7- hydroxymethotrexátu – metabolit může mít vliv na účinnost terapie
Hlavní metabolit 7- OH MTX vzniká z MTX hydroxylací (biotransformace fáze I) na pozici C7 původní sloučeniny [13]. Reakce je katalyzována enzymem aldehyd oxidázou (E.C. 1.2.3.1), která pro správnou funkci vyžaduje účast kofaktorů FAD, molybdenu a dvou FeS clusterů [20]. Aldehyd oxidáza (AO) je enzym se širokou substrátovou specifitou metabolizující aldehydy, některé heterocykly a především se podílí na metabolizmu mnoha léčiv (zaleplon, kofein, acyclovir a jiné), včetně cytostatik (MTX, 6-merkaptopurin). Enzym je exprimován především v játrech, přesto však byla jeho aktivita pozorována v dalších tkáních, jako jsou plíce (epitel trachey a bronchů), gastrointestinální trakt (tenké a tlusté střevo), ledviny (tubulární systém), mozková a endokrinní tkáň [20]. Konverze MTX na 7 - OH MTX v cílových buňkách byla pozorována in vitro ve studii Newtona et al v roce 1984, přesto neexistuje dostatek novějších studií potvrzujících jejich výsledky [21]. Hladiny 7 - OH MTX lze detekovat v plazmě 15 min od zahájení infuze HD MTX. Mezi 12. – 24. hod obvykle převýší plazmatickou koncentraci MTX [15,22].
Suplementace kyseliny listové u revmatologických pacientů snižuje konverzi MTX na 7 - OH MTX formou kompetitivní inhibice AO. Tuto vlastnost však nemá podávaní kyseliny folinové (leucovorinu), který se používá jako antidotum MTX při intravenózní high-dose terapii [23]. Kromě AO se na hydroxylaci MTX pravděpodobně podílí také xanthin oxidáza (E.C. 1.17.3.2), která hraje významnou roli v metabolizmu kyseliny močové. Podání allopurinolu v in vitro studii Chládka et al snížilo produkci 7 - OH MTX v jaterních buňkách člověka o 31,5 % [24].
Metabolit 7 - OH MTX má mnohonásobně nižší inhibiční aktivitu vůči DHFR než MTX a jeho vyšší koncentrace mohou způsobit nedostatečnou účinnost terapie [25]. Jedno z možných vysvětlení tohoto jevu je snížení polyglutamylace MTX v buňkách, které zajišťuje dostatečnou intracelulární koncentraci a aktivitu léčiva [25]. Enzym katalyzující přeměnu MTX na MTX - Glux – folylpolyglutamát syntetáza (E.C. 6.3.2.17) – je schopen metabolizovat také 7 - OH MTX, což naznačuje možnou interferenci mezi polyglutamylací léčiva a metabolitu [23,26,27]. Zabránění polyglutamylace MTX může mít za následek jeho nižší intracelulární koncentraci v cílových buňkách, protože volný MTX je eliminován rychleji než jeho polyglutamylované formy [23]. Interference mezi MTX a 7 - OH MTX byla navíc pozorována na úrovni folátových transportérů u nádorových buněk, kterými do nich léčivo i metabolit vstupují [28].
U revmatologických pacientů léčených MTX se sníženou tvorbou 7 - OH MTX způsobenou inhibicí AO podáním kyseliny listové byla pozorována lepší klinická odpověď ve srovnání s pacienty léčenými kombinací nízkodávkového MTX a leucovorinu, který aktivitu AO neovlivňuje [23]. Snížení plazmatických hladin 7 - OH MTX bylo navíc pozorováno u pacientů s revmatoidní artritidou, kterým byl k monoterapii MTX přidán cyklosporin kvůli nedostatečné odpovědi. Možným vysvětlením poměrně dobré účinnosti této kombinační terapie ve srovnání s monoterapií cyklosporinem nebo MTX je právě snížení tvorby toxičtějšího a podstatně méně aktivního metabolitu [29]. Zavedení rutinního monitorování 7 - OH MTX současně s TDM MTX by mohlo poskytnout cenná klinická data při sledování terapeutického účinku a klinické toxicity léčby MTX v revmatologii i onkologii.
Klinickou toxicitu terapie methotrexátem může ovlivnit tvorba 7 - hydroxymethotrexátu
Názory na vliv 7- OH MTX na toxicitu léčby se v literatuře do určité míry rozcházejí. Ve studii Erttmanna et al byly monitorovány hladiny 7 - OH MTX u sedmi dětských pacientů s osteosarkomem. U jednoho z pacientů byla pozorována výrazně snížená produkce 7 - OH MTX v korelaci se závažnou klinickou toxicitou. U dalších pacientů se klinická toxicita zhoršovala v závislosti na počtu cyklů prodělané chemoterapie, což korelovalo s postupným snižováním produkce endogenního metabolitu s každým dalším cyklem. Studie navrhovala roli 7 - OH MTX jako „endogenního rescue“ působku vzhledem k jeho mnohem nižší inhibiční aktivitě vůči DHFR [30]. Tento model je však v rozporu s novějšími studiemi, které potvrzují roli 7 - OH MTX v manifestaci toxicity chemoterapie MTX [31,32]. Eliminace MTX i 7 - OH MTX probíhá z více než 95 % ledvinami (asi 5 % je odbouráváno žlučí) [13]. Na zvířecích modelech byla prokázána značná nefrotoxicita a hepatotoxicita 7 - OH MTX formou elevace laboratorních markerů (kreatinin, AST, ALT) a intraluminálními morfologickými změnami v ledvinných tubulech. Navíc byl prokázán značný rozdíl v LD50 mezi MTX a 7 - OH MTX, kde hodnota 7 - OH MTX byla 30 – 50krát vyšší [33,34].
Farmakokinetická studie Holmboe et al ukázala, že hladiny 7 - OH MTX jsou přímo úměrné hladinám markerů hepatotoxicity. Studie zahrnovala dospělé i pediatrické pacienty s osteosarkomem léčené podle protokolů skandinávské a italské skupiny pro léčbu sarkomů zahrnujících kombinaci HD MTX s platinovými deriváty, doxorubicinem, ifosfamidem a u některých pacientů s etoposidem [32]. Podíl 7 - OH MTX na nefrotoxicitě vyskytující se u pacientů léčených HD MTX protokoly se předpokládá vzhledem k jeho nižší renální clearance a rozpustnosti v moči a výsledkům pozorovaným na zvířecích modelech. Přestože se MTX uplatňuje v terapii maligních onemocnění již přes půl století, mohou se při vysokodávkových režimech objevit neočekávané nežádoucí účinky [18,35]. I proto je nutné pokračovat v hledání účinných markerů terapeutického efektu a toxicity léčby MTX [14,36]. Zvýšená tvorba nebo snížené odbourávání 7 - OH MTX může potenciálně zvýšit toxicitu léčby MTX. Rutinní stanovení eliminačního profilu 7 - OH MTX by mohlo poskytnout cennou informaci při diagnostice toxicity chemoterapie u onkologického pacienta a mohlo by pomoci předejít komplikacím z akumulace toxického metabolitu v organizmu. Pro potvrzení tohoto předpokladu jsou však nutné další studie.
Nové možnosti v managementu toxicity terapie methotrexátem v souvislosti s akutní renální insuficiencí
Opatření proti poškození ledvinných tubulů precipitací léčiva a pro udržení clearance, tedy kontrola diurézy s alkalinizací moči, platí jak pro MTX, tak pro 7 - OH MTX, protože u obou roste rozpustnost ve vodném prostředí přímo úměrně k pH [15]. V případě akutní renální insuficience, která by mohla mít za následek akumulaci léčiva v těle pacienta, lze přistoupit k hemodialýze nebo k podání karboxypeptidázy G2 (Voraxaze®), což je rekombinantní bakteriální enzym, který štěpí folát a jeho analoga včetně antifolátů MTX a 7 - OH MTX na inaktivní metabolity (obr. 1). Štěpení struktury MTX a 7 - OH MTX probíhá v místě vazby glutamátu na zbytek struktury (pteroová kyselina) a vznikají metabolity 2,4 - diamino - N10 - methylpteroová kyselina (DAMPA), resp. 7-hydroxy - 2,4-diamino - N10 - methylpteroová kyselina (7 - OH DAMPA) [13]. Karboxypeptidáza G2 (CPDG2, E.C. 3.4.17.11) se podává v jednorázové i.v. 5 min bolusové dávce 50 U. kg– 1 a je schopna do 15 min eliminovat více než 98 % MTX, což představuje podstatně rychlejší, šetrnější, efektivnější způsob eliminace než hemodialýza [37]. Mechanizmus účinku lze připodobnit k rasburikáze (v ČR registrována jako Fasturtec®), rekombinantnímu enzymu štěpícímu kyselinu močovou, na v moči dobře rozpustný allantoin, čehož lze využít např. v léčbě závažného akutního tumor lysis syndromu. Přípravek Voraxaze® není v ČR v současné době registrován. V nemocniční lékárně FN v Motole je však dostupná pohotovostní zásoba Voraxaze® jako antidota akutního předávkování MTX. Na lékařský předpis (žádanku) lze přípravek získat, ovšem limitující může být jeho vysoká cena [38]. Karboxypeptidáza G2 je pacienty na základě literárních údajů poměrně dobře tolerována, ovšem vzhledem k typu látky je nutno při opakovaných podáních očekávat nežádoucí účinky charakteru alergické reakce [39].
Obr. 1. Methotrexát a jeho metabolity. 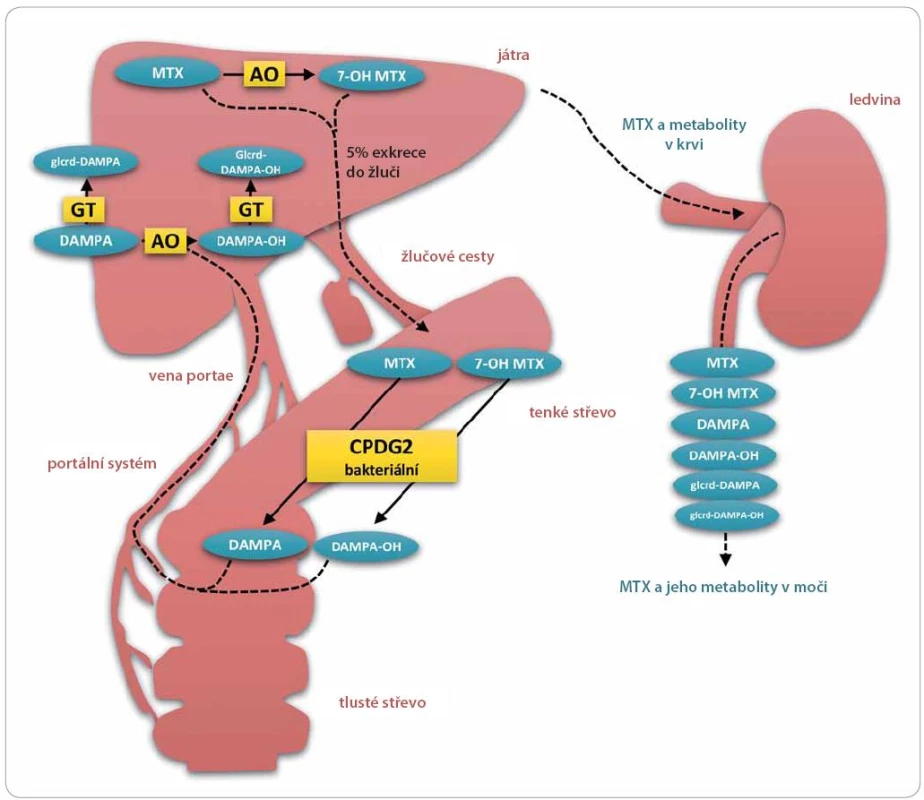
Methotrexát (MTX) se v játrech přeměňuje na jeho hlavní metabolit 7-hydroxymethotrexát (7-OH MTX) pomocí enzymu aldehyd oxidázy (AO). Přestože jsou hlavní cestou eliminace MTX a 7-OH MTX močové cesty, malá část MTX (a pravděpodobně i 7-OH MTX) odchází žluči do střev. Střevní mikroflóra je schopná štěpit MTX a 7-OH MTX na 2,4-diamino-N10-methylpteroovou kyselinu (DAMPA), resp. 7-OH-DAMPA a kyselinu glutamovou. Metabolity DAMPA a 7-OH-DAMPA mohou být zpětně resorbovány a vstoupit do enterohepatální cirkulace. V játrech podléhají biotransformaci II. stupně za vzniku příslušných glukuronidů glcrd-DAMPA a glcrd-DAMPA-OH. Zpětně resorbovaná DAMPA je navíc substrátem AO a může tedy být v játrech konvertována na 7-OH-DAMPA. Netoxické metabolity methotrexátu vznikají i endogenně a mohou ovlivnit imunoanalytické metody používané pro rutinní TDM
Metabolity DAMPA a 7- OH DAMPA byly vyhodnoceny jako téměř netoxické ve srovnání s MTX a 7 - OH MTX. Jejich eliminace probíhá z části renální cestou a částečně dalším jaterním metabolizmem, viz dále [13]. V nízkých koncentracích jsou DAMPA a 7 - OH DAMPA v organizmu detekovatelné po podání MTX i bez aplikace rekombinantní CPDG2. Za tvorbu DAMPA jsou pravděpodobně zodpovědné střevní bakterie, které pomocí vlastní CPDG2 metabolizují tu část MTX, která je vylučována žlučí. Vzniklý metabolit je zpětně resorbován [13,40]. V játrech je potom DAMPA, stejně jako MTX metabolizována AO na 7 - OH derivát. U DAMPA a 7 - OH DAMPA existuje také biotransformační fáze II, kdy jsou pomocí glukuronyl transferázy (E.C. 2.4.1.17) oba metabolity glukuronidovány [13].
Klinicky jsou netoxické metabolity MTX méně významné vzhledem k nízké plazmatické koncentraci a nízké toxicitě. Laboratorní testy však ukazují, že ve vyšších koncentracích mohou signifikantně ovlivnit stanovení MTX pomocí imunoanalytických metod, které převažují v rutinním a statimovém TDM MTX. Al - Turkmani et al publikovali kazuistiku 18letého pacienta s osteosarkomem léčeného HD MTX (cykly pravidelných dávek 20 g MTX v 4 hod infuzích), u něhož se při šestém cyklu chemoterapie projevila akutní nefrotoxicita se závažným snížením ledvinné funkce (elevace kreatininu z hodnoty 90,5 na 7 692 µmol. l–1) a vysokou plazmatickou koncentrací MTX v 72. hod po podání (350 µmol. l–1). Po podání CPDG2 došlo k potížím s monitorováním MTX kvůli suspektní interferenci v analytické metodě. Po pěti dnech již bylo možné znovu monitorovat hladiny MTX a detoxifikace byla dokončena hydratací s forsírovanou diurézou. Analyzované vzorky pacienta byly následně přeměřeny metodou kapalinové chromatografie s detekcí, pomocí tandemové hmotnostní spektrometrie pro potvrzení interference MTX a DAMPA [41]. Podobná interference mezi MTX a metabolity byla pozorována u nízkých koncentrací Klapkovou et al a shoduje se i s našimi předběžnými výsledky (dosud nepublikováno) srovnání metod rutinní imunoanalýzy a kapalinové chromatografie [42].
Tyto výsledky naznačují nepřímý klinický význam netoxických metabolitů MTX. Nedostatečná analytická specificita v měření hladin MTX může mít negativní dopad na účinnost, efektivitu a toxicitu terapie. Nové metody umožňující simultánní analýzu MTX a jeho metabolitů bez vzájemné interference by mohly pomoci dále objasnit tuto problematiku.
Methotrexát v profylaxi leukemického CNS postižení – lumbální punkce nebo vysoké dávky a přestup přes hematolikvorovou bariéru?
Na základě fyzikálních vlastností lze MTX klasifikovat mezi spíše polární molekuly, pro které je charakteristická nízká penetrance přes hematoencefalickou bariéru (HEB). Systém HEB slouží k ochraně mozku před influxem různých plazmatických látek a xenobiotik s potenciální neurotoxicitou a zajišťuje tím stabilní složení likvoru. Hematoencefalickou bariéru tvoří endotelové buňky s těsnými spoji (tight junctions) hustých sítí mozkových kapilár, které exprimují četné efluxní transportéry, které byly asociovány s rezistencí buněk vůči léčivům (P - glykoprotein, ABC - transportéry atd.) [43]. Navzdory spíše polárním vlastnostem prochází MTX částečně přes HEB do subarachnoidálního prostoru u pacientů podstupujících HD MTX chemoterapii [44,45].
CNS je jedním z hlavních míst potenciální infiltrace leukemických buněk u akutní lymfoblastické leukemie (ALL) a non-hodgkinských lymfomů (NHL). Potřeba preventivního opatření proti CNS relapsu, který ve většině případů ALL předcházel relapsu dřeňovému, vedla v 60. letech 20. století k experimentálnímu ozařování krania a páteře u pacientů s ALL. Později byla zavedena kombinace intratekálního (IT) podání chemoterapeutik se sníženými dávkami záření, které způsobovaly pozdní následky zejména u dětských pacientů. Od 70. let 20. století byly dále snižovány dávky záření a častěji se přistupovalo k profylaktickému podávání cytostatik do mozkomíšního moku. Od minulé dekády se dětští pacienti ve většině případů neozařují. V profylaxi se IT podává MTX v kombinaci s dalšími cytostatiky pro jeho výrazně nižší toxicitu vůči zdravé mozkové tkáni [46].
Některé studie zacházejí v optimalizaci prevence leukemického postižení CNS ještě dále. Niemann et al monitorovali hladiny MTX v mozkomíšním moku odebraném před administrací IT MTX u 70 pediatrických pacientů s ALL a NHL (8 – 24 hod po započetí i.v. HD MTX infuze v dávkách 5 g. m–2 u ALL a 1 g. m–2 u NHL) [44]. Bylo zkoumáno překročení antileukemické koncentrace 1 µmol. l–1, která byla dříve stanovena jako dostačující pro potlačení rizika CNS relapsu (graficky zpracováno v obr. 2) [45]. Hladina MTX ≥ 1 µmol. l–1 byla pozorována u 81,2 % pacientů [44]. Zajímavé je, že v souladu s dalšími publikovanými výsledky byl signifikantní věk pacientů. Pacienti nad sedm let akumulovali MTX v mozkomíšním moku více než mladší pacienti. Diskutován je vliv snižování clearance MTX s věkem pacientů [44,45]. K likvorovým koncentracím MTX u dospělých pacientů s ALL a NHL nejsou v dostupné literatuře relevantní citace.
Obr. 2. Methotrexát v mozkomíšním moku. 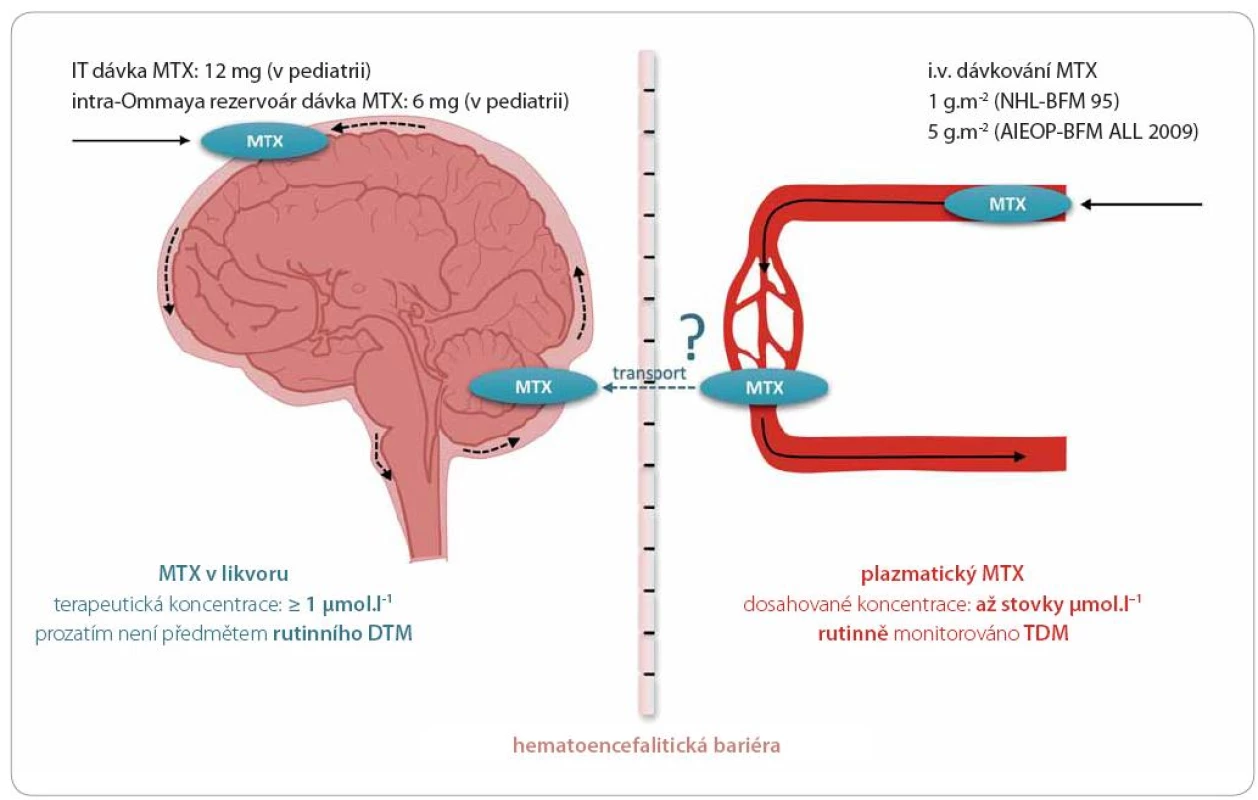
Terapeutické koncentrace methotrexátu (MTX) v likvoru lze dosáhnout intratekálním (IT) podáním cytostatika při lumbální punkci nebo v nižší dávce intraventrikulární aplikací do Ommaya rezervoáru pro chronické IT aplikace. Při prevenci leukemického postižení CNS v pediatrické onkologii byla stanovena cílová koncentrace MTX vyšší než 1 μmol.l–1. Pomocí kapalinové chromatografie s detekcí hmotnostní spektrometrií byly ve studii Niemanna et al měřeny likvorové koncentrace MTX před jeho IT aplikací u pediatrických pacientů s ALL a více než 80 % pacientů dosahovalo cílových hodnot. Lze tedy předpokládat dostatečný přestup MTX z krve do subarachnoidálního prostoru přes hematoencefalickou bariéru u těchto pacientů [45]. Terapeutických hladin v likvoru lze tedy dosáhnout dvěma způsoby. IT aplikace MTX do mozkomíšního moku se může jevit jako jistější alternativa aplikace HD MTX i.v. dávky s předpokladem dostatečného průchodu MTX hematolikvorovou bariérou. U pediatrických pacientů zahrnuje provedení lumbální punkce lokální, v některých případech i celkovou anestezii a může být pro dítě značně zatěžujícím a traumatizujícím zákrokem s řadou potenciálních komplikací. Snížení frekvence IT aplikací MTX s předpokladem dostatečné IT koncentrace po HD MTX infuzi naproti tomu vyžaduje obsáhlá klinická a farmakologická data zahrnující dlouhodobé monitorování hladin MTX v mozkomíšním moku, která by byla pilířem pro stanovení nového terapeutického postupu.
Polyglutamylace methotrexátu je klíčová pro udržení terapeutických koncentrací a zvyšuje jeho antirevmatické účinky
Kromě extenzivní jaterní biotransformace a střevní konverze MTX je významnou kapitolou také jeho intracelulární metabolizmus. Extracelulární MTX vstupuje do buňky přes přenašeč redukovaného folátu (reduced folate carrier – RFC) a folátový receptor (folate binding protein – FBP), membránové přenašeče, jejichž přirozeným substrátem je folát, resp. jeho redukované plazmatické formy [47,48]. Oba přenašeče zajišťují obousměrný přenos folátů a příbuzných sloučenin včetně MTX přes cytoplazmatickou membránu buněk. Defekt funkce folátových přenašečů může vyústit v poruchu buněčné funkce a je zároveň potenciálním místem vzniku rezistence na léčbu MTX [49,50]. Aby se zabránilo úniku folátu a MTX z intracelulární tekutiny, dochází k jejich enzymatické polyglutamylaci, při které se na karboxylový konec glutamátu parentální sloučeniny připojuje další glutamát. Takto vznikají sloučeniny se 2 – 7 glutamátovými zbytky (folát - Glu2– 7 a MTX - Glu2– 7). Tento proces je plně reverzibilní. Hydrolýzu peptidových vazeb mezi glutamáty katalyzuje enzym gamma - glutamyl hydroláza (GGH, E.C. 3.14.19.9) [51].
V revmatologické literatuře je molekula MTX již delší dobu označována jako proléčivo, které je až po vstupu do buňky a intracelulární konverzi aktivováno [52,53]. Toto označení je právě v revmatologii výstižné, protože koncentrace aktivních MTX polyglutamátů převyšují koncentrace volného léčiva v cytoplazmě buněk [54]. Polyglutamylované formy MTX navíc mnohem výrazněji než volný MTX blokují odbourávání 5 - aminoimidazol - 4 - carboxamid ribonucleotidu (AICAR) inhibicí enzymu AICAR transferázy. Zvýšení koncentrací AICAR následně vede ke sníženému odbourávání adenosinu, který se váže na adenosinové receptory (především A2A) imunitních buněk a působí protizánětlivě [8,55]. Podobně výraznější inhibiční aktivitu mají polyglutamáty MTX vůči thymidylát syntáze (E.C. 2.1.1.45), enzymu, který přeměňuje pyrimidinové deoxyribonukleotidy a podílí se tak na syntéze DNA [56]. V lidských nádorových buňkách karcinomu prsu se navíc prodlužovala intracelulární retence a poločas disociace komplexu MTX a DHFR přímo úměrně délce řetězce glutamátových reziduí jednotlivých polyglutamátů [57].
Dosavadními imunoanalytickými metodami, které jsou určené pro rutinní monitorování plazmatických hladin MTX, nelze žádný z jeho metabolitů včetně MTX - Glux monitorovat. Celkovou koncentraci intracelulárních polyglutamátů je možné stanovit imunoanalyticky až po jejich in vitro konverzi rekombinantní GGH na volný MTX. Stanovení koncentrací jednotlivých polyglutamátů vyžaduje pokročilou instrumentaci (nejčastěji chromatografické metody s detekcí pomocí hmotnostní spektrometrie) [58,59]. Koncentrace jednotlivých MTX polyglutamátů jsou závislé na dávce a způsobu podání MTX a mohou být interindividuálně variabilní, což je jednou z možných příčin různé terapeutické odpovědi revmatologických pacientů na léčbu [53,60]. Jak již bylo zmíněno, polyglutamylace zásadně mění farmakodynamické vlastnosti MTX, a proto by doplnění rutinního TDM MTX o stanovení hladin intracelulárních polyglutamátů mohlo být přínosem v monitorování závislosti dávky, koncentrace, terapeutického účinku a toxicity léčiva.
Závěr
Methotrexát zůstává i po 70 letech v klinické praxi lékem se širokým spektrem využití zejména v léčbě autoimunitních onemocnění a malignit. V onkologii jej lze považovat za relativně bezpečné chemoterapeutikum vzhledem k dlouhodobé optimalizaci terapeutických protokolů a rutinnímu TDM. Farmakokinetické vlastnosti základního MTX jsou lékařům dnes poměrně dobře známé, méně však jeho komplikovaná biotransformace a množství aktivních metabolitů. Dnes jsme již schopni pomocí pokročilých laboratorních technik stanovovat i nízké koncentrace intracelulárních polyglutamátů, jejichž koncentrace může mít vliv na účinnost léčby, přesto však zůstává zlatým standardem při TDM stanovení volného MTX. Proti zavedení takových metod do laboratorní diagnostiky hovoří jejich vysoká cena a požadavky na odbornou obsluhu. Přesto však díky nim získáváme nové cenné informace o farmakologických vlastnostech MTX. Jejich zavedení do praxe může pomoci dále optimalizovat efektivitu léčby a upevnit tak postavení MTX v onkologii a především revmatologii, ve které je stále díky pozitivnímu poměru terapeutického účinku a toxicity i nízké ceně zlatým standardem.
Tato práce byla podpořena Evropským fondem pro regionálni rozvoj a státní rozpočet České republiky cestou Operačního programu Výzkum a vývoj pro inovace (OP VAVpI) projektu čislo CZ.1.05/2.1.00/03.0101, projektem MŠMT – NPU I – LO1413 a grantem IGA MZČR NT14327.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Obdrženo: 27. 3. 2015
Přijato: 28. 4. 2015
Mgr. Michal Řiháček
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: michal.rihacek@mou.cz
Zdroje
1. Farber S, Diamond K, Mercer R et al. Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4 - aminopteroyl - glutamic acid (aminopterin). N Engl J Med 1948; 238(23): 787 – 793.
2. Huggins C, Stevens RE, Hodges CV. Studies on prostatic cancer. I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Arch Surg 1941; 43(2): 209 – 223.
3. Forkner CE, McNair S. Arsenic as a therapeutic agent in chronic myelogenous leukemia. Preliminary report. JAMA 1931; 95(1): 3 – 5.
4. DeVita VT Jr., Chu E. A history of cancer chemotherapy. Cancer Res 2008; 68(21): 8643 – 8653. doi: 10.1158/ 0008 - 5472.CAN - 07 - 6611.
5. Drugs.com [homepage on the Internet]. The American Society of Health - System Pharmacists, USA; c2004 – 2014 [updated 2012 October 31; cited 2015 March 21]. Available from: www.drugs.com.
6. Spurlock CF 3rd, Aune ZT, Tossberg JT et al. Increased sensitivity to apoptosis induced by methotrexate is mediated by JNK. Arthritis Rheum 2011; 63(9): 2606 – 2616. doi: 10.1002/ art.30457.
7. Floros KV, Talieri M, Scorilas A. Topotecan and methotrexate alter expression of the apoptosis-related genes BCL2, FAS and BCL2L12 in leukemic HL-60 cells. Biol Chem 2006; 387(12): 1629 – 1633.
8. Haskó G, Linden J, Cronstein B et al. Adenosine receptors: therapeutic aspects for inflammatory and immune diseases. Nat Rev Drug Discov 2008; 7(9): 759 – 770. doi: 10.1038/ nrd2638.
9. Nesher G, Osborn TG, Moore TL. In vitro effects of methotrexate on polyamine levels in lymphocytes from rheumatoid arthritis patients. Clin Exp Rheumatol 1996; 14(4): 395 – 399.
10. Nesher G, Osborn TG, Moore TL. Effect of treatment with methotrexate, hydroxychloroquine, and prednisone on lymphocyte polyamine levels in rheumatoid arthritis: correlation with the clinical response and rheumatoid factor synthesis. Clin Exp Rheumatol 1997; 15(4): 343 – 347.
11. Neradil J, Pavlasova G, Veselska R. New mechanisms for an old drug; DHFR - and non-DHFR - mediated effects of methotrexate in cancer cells. Klin Onkol 2012; 25 (Suppl 2):2S87 – 2S92. doi: 10.14735/ amko20122S87.
12. Plant D, Wilson AG, Barton A. Genetic and epigenetic predictors of responsiveness to treatment in RA. Nat Rev Rheumatol 2014; 10(6): 329 – 337. doi: 10.1038/ nrrheum.2014.16.
13. Widemann BC, Sung E, Anderson L et al. Pharmacokinetics and metabolism of the methotrexate metabolite 2, 4 - diamino - N(10) - methylpteroic acid. J Pharmacol Exp Ther 2000; 294(3): 894 – 901.
14. Valik D, Radina M, Sterba J et al. Homocysteine: exploring its potential as a pharmacodynamic biomarker of antifolate chemotherapy. Pharmacogenomics 2004; 5(8): 1151 – 1162.
15. Widemann BC, Adamson PC. Understanding and managing methotrexate nephrotoxicity. Oncologist 2006; 11(6): 694 – 703.
16. Řiháček M, Řiháček I, Zdražilová - Dubská L et al. Methotrexate update 2014 : 70 years in autoimmunity and cancer treatment. Česk Pediatr 2014; 69(3): 161 – 167.
17. Slaný J. Vysokodávkový methotrexát – nežádoucí účinky léčby. Klin Onkol 1993; 6(6): 163 – 167.
18. Valík D, Zapletal O, Demlová R. Significant and unexpected toxicity in a child treated with high-dose therapy with methotrexate – past questions remaining unanswered. Klin Onkol 2002; 15(6): 230 – 233.
19. Bourre-Tessier J, Haraoui B. Methotrexate drug interactions in the treatment of rheumatoid arthritis: a systematic review. J Rheumatol 2010; 37(7): 1416 – 1421. doi: 10.3899/ jrheum.090153.
20. Pryde DC, Dalvie D, Hu Q et al. Aldehyde oxidase: an enzyme of emerging importance in drug discovery. J Med Chem 2010; 53(24): 8441 – 8460. doi: 10.1021/ jm100888d.
21. Newton PA, Blakley RL. 7 - Hydroxymethotrexate formation in a human lymphoblastic cell line. Biochem Biophys Res Commun 1984; 122(3): 1212 – 1217.
22. Collier CP, MacLeod SM, Soldin SJ. Analysis of methotrexate and 7-hydroxymethotrexate by high-performance liquid chromatography and preliminary clinical studies. Ther Drug Monit 1982; 4(4): 371 – 380.
23. Baggott JE, Morgan SL. Methotrexate catabolism to 7 - hydroxymethotrexate in rheumatoid arthritis alters drug efficacy and retention and is reduced by folic acid supplementation. Arthritis Rheum 2009; 60(8): 2257 – 2261. doi: 10.1002/ art.24685.
24. Chládek J, Martínková J, Sispera L. An in vitro study on methotrexate hydroxylation in rat and human liver. Physiol Res 1997; 46(5): 371 – 379.
25. Fotoohi K, Jansen G, Assaraf YG et al. Disparate mechanisms of antifolate resistance provoked by methotrexate and its metabolite 7 - hydroxymethotrexate in leukemia cells: implications for efficacy of methotrexate therapy. Blood 2004; 104(13): 4194 – 4201.
26. Rhee MS, Galivan J. Conversion of methotrexate to 7 - hydroxymethotrexate and 7 - hydroxymethotrexate polyglutamates in cultured rat hepatic cells. Cancer Res 1986; 46(8): 3793 – 3797.
27. McGuire JJ, Hsieh P, Bertino JR. Enzymatic synthesis of polyglutamate derivatives of 7 - hydroxymethotrexate. Biochem Pharmacol 1984; 33(8): 1355 – 1361.
28. Lankelma J, van der Klein E, Ramaekers F. The role of 7 - hydroxymethotrexate during methotrexate anti-cancer therapy. Cancer Lett 1980; 9(2): 133 – 142.
29. Fox RI, Morgan SL, Smith HT et al. Combined oral cyclosporin and methotrexate therapy in patients with rheumatoid arthritis elevates methotrexate levels and reduces 7 - hydroxymethotrexate levels when compared with methotrexate alone. Rheumatology (Oxford) 2003; 42(8): 989 – 994.
30. Erttmann R, Bielack S, Landbeck G. 7 - Hydroxy - methotrexate and clinical toxicity following high-dose methotrexate therapy. J Cancer Res Clin Oncol 1985; 109(1): 86 – 88.
31. Smeland E, Fuskevag OM, Nymann K et al. High-dose 7 - hydromethotrexate: acute toxicity and lethality in a rat model. Cancer Chemother Pharmacol 1996; 37(5): 415 – 422.
32. Holmboe L, Andersen AM, Morkrid L et al. High dose methotrexate chemotherapy: pharmacokinetics, folate and toxicity in osteosarcoma patients. Br J Clin Pharmacol 2012; 73(1): 106 – 114. doi: 10.1111/ j.1365 - 2125.2011.04054.x.
33. Smeland E, Bremnes RM, Andersen A et al. Renal and hepatic toxicity after high-dose 7 - hydroxymethotrexate in the rat. Cancer Chemother Pharmacol 1994; 34(2): 119 – 124.
34. Fuskevag OM, Kristiansen C, Lindal S et al. Maximum tolerated doses of methotrexate and 7 - hydroxy - methotrexate in a model of acute toxicity in rats. Cancer Chemother Pharmacol 2000; 46(1): 69 – 73.
35. Valik D, Sterba J, Bajciova V et al. Severe encephalopathy induced by the first but not the second course of high-dose methotrexate mirrored by plasma homocysteine elevations and preceded by extreme differences in pretreatment plasma folate. Oncology 2005; 69(3): 269 – 272.
36. Demlova R, Radina M, Sterba J et al. Foláty: fyziologie, metabolismus a mechanismus rezistence na jejich antagonisty. Klin Onkol 2004; 17(6): 185 – 189.
37. Widemann BC, Balis FM, Kempf - Bielack B et al. High-dose methotrexate-induced nephrotoxicity in patients with osteosarcoma. Cancer 2004; 100(10): 2222 – 2232.
38. Nemlek.cz [internetová stránka]. Sekce nemocničních lékárníků, Česká Republika; c2015 [aktualizováno 8. srpna 2010; citováno 22. března 2015]. Dostupné z: www.nemlek.cz.
39. Buchen S, Ngampolo D, Melton RG et al. Carboxypeptidase G2 rescue in patients with methotrexate intoxication and renal failure. Br J Cancer 2005; 92(3): 480 – 487.
40. Donehower RC, Hande KR, Drake JC et al. Presence of 2,4-diamino - N10 - methylpteroic acid after high-dose methotrexate. Clin Pharmacol Ther 1979; 26(1): 63 – 72.
41. Al - Turkmani MR, Law T, Narla A et al. Difficulty measuring methotrexate in a patient with high-dose methotrexate-induced nephrotoxicity. Clin Chem 2010; 56(12): 1792 – 1794. doi: 10.1373/ clinchem.2010.144824.
42. Klapkova E, Kukacka J, Kotaska K et al. The influence of 7 - OH methotrexate metabolite on clinical relevance of methotrexate determination. Clin Lab 2011; 57(7 – 8): 599 – 606.
43. Miller DS, Nobmann SN, Gutmann H et al. Xenobiotic transport across isolated brain microvessels studied by confocal microscopy. Mol Pharmacol 2000; 58(6): 1357 – 1367.
44. Niemann A, Mühlisch J, Frühwald M C et al. Therapeutic drug monitoring of methotrexate in cerebrospinal fluid after systemic high-dose infusion in children: can the burden of intrathecal methotrexate be reduced? Therapeutic Drug Monitoring 2010; 32(4): 467 – 475. doi: 10.1097/ FTD.0b013e3181e5c6b3.
45. Jonsson P, Hoglund P, Wiebe T et al. Methotrexate concentrations in cerebrospinal fluid and serum, and the risk of central nervous system relapse in children with acute lymphoblastic leukaemia. Anticancer Drugs 2007; 18(8): 941 – 948.
46. Hudson MM, Link MP, Simone JV. Milestones in the curability of pediatric cancers. J Clin Oncol 2014; 32(23): 2391 – 2397. doi: 10.1200/ JCO.2014.55.6571.
47. Bosson G. Reduced folate carrier: biochemistry and molecular biology of the normal and methotrexate-resistant cell. Br J Biomed Sci 2003; 60(2): 117 – 129.
48. Deutsch JC, Elwood PC, Portillo RM et al. Role of the membrane-associated folate binding protein (folate receptor) in methotrexate transport by human KB cells. Arch Biochem Biophys 1989; 274(2): 327 – 337.
49. Steinfeld R, Grapp M, Kraetzner R et al. Folate receptor alpha defect causes cerebral folate transport deficiency: a treatable neurodegenerative disorder associated with disturbed myelin metabolism. Am J Hum Genet 2009; 85(3): 354 – 363. doi: 10.1016/ j.ajhg.2009.08.005.
50. Zhao R, Assaraf YG,Goldman ID. A reduced folate carrier mutation produces substrate - dependent alterations in carrier mobility in murine leukemia cells and methotrexate resistance with conservation of growth in 5-formyltetrahydrofolate. J Biol Chem 1998; 273(14): 7873 – 7879.
51. Panetta JC, Wall A, Pui CH et al. Methotrexate intracellular disposition in acute lymphoblastic leukemia: a mathematical model of gamma - glutamyl hydrolase activity. Clin Cancer Res 2002; 8(7): 2423 – 2429.
52. Chabner BA, Allegra CJ, Curt GA et al. Polyglutamation of methotrexate. Is methotrexate a prodrug? J Clin Invest 1985; 76(3): 907 – 912.
53. Dervieux T, Furst D, Lein DO et al. Polyglutamation of methotrexate with common polymorphisms in reduced folate carrier, aminoimidazole carboxamide ribonucleotide transformylase, and thymidylate synthase are associated with methotrexate effects in rheumatoid arthritis. Arthritis Rheum 2004; 50(9): 2766 – 2774.
54. Meesters RJ, den Boer E, de Jonge R et al. Assessment of intracellular methotrexate and methotrexate - polyglutamate metabolite concentrations in erythrocytes by ultrafast matrix - assisted laser desorption/ ionization triple quadrupole tandem mass spectrometry. Rapid Commun Mass Spectrom 2011; 25(20): 3063 – 3070. doi: 10.1002/ rcm.5202.
55. Allegra CJ, Drake JC, Jolivet J et al. Inhibition of phosphoribosylaminoimidazolecarboxamide transformylase by methotrexate and dihydrofolic acid polyglutamates. Proc Natl Acad Sci USA 1985; 82(15): 4881 – 4885.
56. Allegra CJ, Chabner BA, Drake JC et al. Enhanced inhibition of thymidylate synthase by methotrexate polyglutamates. J Biol Chem 1985; 260(17): 9720 – 9726.
57. Jolivet J, Chabner BA. Intracellular pharmacokinetics of methotrexate polyglutamates in human breast cancer cells. Selective retention and less dissociable binding of 4 - NH2 - 10 - CH3 - pteroylglutamate4 and 4 - NH2 - 10 - CH3 - pteroylglutamate5 to dihydrofolate reductase. J Clin Invest 1983; 72(3): 773 – 778.
58. Hroch M, Tukova J, Dolezalova P et al. An im-proved high-performance liquid chromatography method for quantification of methotrexate polyglutamates in red blood cells of children with juvenile idiopathic arthritis. Biopharm Drug Dispos 2009; 30(3): 138 – 148.
59. van Haandel L, Becker ML, Williams TD et al. Measurement of methotrexate polyglutamates in human erythrocytes by ion - pair UPLC - MS/ MS. Bioanalysis 2011; 3(24): 2783 – 2796.
60. Becker ML, van Haandel L, Gaedigk R et al. Analysis of intracellular methotrexate polyglutamates in patients with juvenile idiopathic arthritis: effect of route of administration on variability in intracellular methotrexate polyglutamate concentrations. Arthritis Rheum 2010; 62(6): 1803 – 1812. doi: 10.1002/art.27434.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tiskuČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCI
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Role výzkumných infrastruktur v onkologii
- Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
- Časná integrace paliativní péče do standardní onkologické péče – benefit, limitace, bariéry a druhy paliativní péče
- Anxio-depresívny syndróm v onkológii – biopsychosociálny model suportívnej terapie
- Nádorová hypoxia – molekulárne mechanizmy a klinický význam
- Vplyv frakcionovaného ožiarenia na hipokampus v experimentálnom modeli
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Dlouhodobé sledování nutričního, klinického stavu a kvality života u nemocných s rakovinou hlavy a krku
- Extrémně vzácný případ trichocellulární leukemie u pacientky se sarkoidózou
- Informace z České onkologické společnosti
- Podávání kontinuálních infuzí cytostatik pomocí elastomerických infuzorů
-
Domácí parenterální výživa v onkologii
Díl 3 – Mobilní režim domácí parenterální výživy - Aktuality z odborného tisku
- Kongenitální naevus – někdy neprávem opomíjené riziko
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Podávání kontinuálních infuzí cytostatik pomocí elastomerických infuzorů
- Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
- Nádorová hypoxia – molekulárne mechanizmy a klinický význam
- Anxio-depresívny syndróm v onkológii – biopsychosociálny model suportívnej terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



