-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dlouhodobé sledování nutričního, klinického stavu a kvality života u nemocných s rakovinou hlavy a krku
Long Term Monitoring of Nutritional, Clinical Status and Quality of Life in Head and Neck Cancer Patients
Background:
Malnutrition in head and neck cancer (HNC) patients decreases survival, quality of life (QOL) and oncological outcomes. The aim of the prospective three-year study was to compare QOL, clinical symptoms and variables (complications, survival and mortality rates in HNC patients).Patients and Methods:
A total of 726 patients aged 55 to 72 years with treatable HNC were included from January 2004 to December 2009; these patients were randomized to either group with PEG and enteral nutrition and nonPEG group with nutritional counselling according to nutritional care. We used EORTC questionnaires QOL C-30 and Head and neck module (HN-35) for measuring of QOL. The following variables due to expectable influence on QOL (demographic data, oncological data, nutritional screening, Clinical symptom score, Karnofsky performance status score, Charlson comorbidity index) were included. Monitoring was done five times in three years.Results:
In the first six months, we found decrease of weight and body mass index (BMI). After this critical time point and finish of oncological treatment, a marked difference in the development of patients treated with PEG. Negative factors influencing patients survival, QOL, clinical status were males aged > 63 years, hypopharyngeal cancer (stage III – IV), smoking, weight loss > 10%, BMI < 21 and disallowance of PEG.Conclusions:
QOL is an essential factor for cancer patients. Our study showed that nutritional intervention with early enteral nutrition may improve QOL and survival in HNC patients. The PEG group better tolerated oncological treatment, had lower incidence of complications, shorter time to re-entry of permanent increase in weight, lower rate of rehospitalization and its shorter length. We found QOL questionnaires to be very important for better understanding and communication and a key instrument for improving solution of patient’s difficulties during their therapy in multidisciplinary approach.Key words:
head and neck cancer – quality of life – EORTC – C-30 – HN-35 – PEG – malnutrition
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
16. 4. 2015Accepted:
4. 5. 2015
Autoři: E. Malá 1; E. Vejražková 2; J. Bielmeierová 3; M. Jindra 3; M. Vošmik 4
; J. Novosad 1; L. Sobotka 5
Působiště autorů: Ústav klinické imunologie a alergologie, LF UK a FN Hradec Králové 1; IV. interní klinika LF UK a FN Hradec Králové 2; Rehabilitační klinika LF UK a FN Hradec Králové 3; Klinika onkologie a radioterapie LF UK a FN Hradec Králové 4; III. interní gerontometabolická klinika LF UK a FN Hradec Králové 5
Vyšlo v časopise: Klin Onkol 2015; 28(3): 200-214
Kategorie: Původní práce
doi: https://doi.org/10.14735/amko2015200Souhrn
Východiska:
Malnutrice u nemocných s rakovinou hlavy a krku snižuje přežití, kvalitu života (quality of life – QOL) i ostatní onkologické výstupy. Cílem tříleté prospektivní studie bylo srovnání QOL, klinického stavu a symptomů s řadou proměnných (komplikace, přežití, mortalita nemocných s rakovinou hlavy a krku).Soubor pacientů a metody:
Do sledování jsme přijali celkem 726 pacientů ve věku 55 – 72 let s léčitelnou rakovinou hlavy a krku v období od ledna 2004 do prosince 2009. Pacienti byli randomizováni do dvou skupin – s PEG a enterální výživou a do skupiny bez PEG, s doporučením nutričních přípravků podle lokální praxe. Pro sledování QOL jsme použili dotazníky QOL EORTC C-30 a modul HN-35 (pro měření QOL s rakovinou). Dále jsme zařadili demografická data, onkologická data, nutriční vyšetření, sledování klinických symptomů, Karnofského skórování, Charlsonův index komorbidit a laboratorní ukazatele. Sledování bylo realizováno v pěti kontrolách během následujících tří let.Výsledky:
V prvních šesti měsících jsme nalezli v obou sledovaných skupinách pokles hmotnosti i snížení body mass indexu (BMI). Po překlenutí kritického období a ukončení onkologické léčby došlo k významnému odlišení vývoje většiny sledovaných parametrů ve prospěch nemocných s PEG. Negativní faktory ovlivňující přežití, QOL i klinický stav jsou mužské pohlaví, věk > 63 let, hypofaryngeální karcinom ve stadiu III – IV, kouření, ztráta hmotnosti > 10 %, BMI < 21 a neakceptování PEG.Závěr:
QOL je zásadním faktorem pro nemocné s nádorovým onemocněním. Naše sledování ukázalo, že časná nutriční intervence formou enterální výživy může zlepšit QOL, má příznivý vliv na další vývoj malnutrice i přežití nemocných s rakovinou hlavy a krku. Skupina nemocných s PEG lépe tolerovala onkologickou léčbu nižším výskytem komplikací a kratším časem k návratu ke stabilnímu zvyšování hmotnosti. Zjistili jsme, že sledování QOL jsou nesmírně cenné pro vzájemné lepší porozumění, komunikaci a je klíčovým nástrojem pro zlepšení řešení obtíží pacienta během léčby v rámci multidisciplinárního přístupu.Klíčová slova:
rakovina hlavy a krku – kvalita života – EORTC – C-30 – HN-35 – PEG – malnutriceÚvod
Onkologická onemocnění představují celosvětový závažný zdravotní problém. Nádorová onemocnění jsou druhou nejčastější příčinou úmrtí člověka. Vzestupný trend výskytu onkologických nemocí je výsledkem mnoha faktorů, zahrnujících změny enviromentálního prostředí, chemické a fyzikální vlivy v interakci s člověkem, jeho adaptabilitou, potenciálem protinádorové obrany, životním stylem, potravními zvyklostmi, rizikovým chováním, obezitou i komorbiditami [1]. K růstu populační zátěže nádorovým onemocněním významně přispívá demografické stárnutí populace, zvyšující se incidence vícečetného výskytu primárních nádorů u téhož nemocného i komplikace sekundárních nádorových onemocnění. Podle odhadů Světové zdravotnické organizace (WHO) se předpokládá, že do roku 2020 každoročně zemře na rakovinu více než 10 mil. pacientů. ČR patří mezi země s nejvyšším zatížením onkologickými chorobami v Evropě i v celosvětovém měřítku. Celková incidence všech nádorových onemocnění setrvale roste, růstový index dosáhl v letech 1997 – 2007 hodnoty +26,4 % [2,3]. Hrubá incidence zhoubných nádorů přesáhla v roce 2007 736 nádorů na 100 000 mužů a 648 na 100 000 žen. Roční hrubá mortalita překročila 263 úmrtí na 100 000 obyvatel. Mezi nejčastější malignity v ČR patří nádory kolorekta, prsu, plic a prostaty [2,3]. Nádory hlavy a krku (head and neck cancer – HNC) patří celosvětově mezi nejrizikovější onkologická onemocnění. Ve světě je HNC na 6. místě onkologických onemocnění. V zemích Evropské unie představují HNC 4. nejčastější nádor u mužů. Jeho incidence u mužů se zvyšuje od severských zemí (Švédsko 9 – 10 na 100 000 obyvatel) jižně ke Středozemnímu moři (Francie a Portugalsko 50 na 100 000 obyvatel). U žen je výskyt HNC nejen významně nižší (3 na 100 000 obyvatel), nemá ani geografické postižení. Nejvyšší výskyt HNC je ve Finsku, Itálii, Španělsku, v pobaltských zemích, naopak nejnižší je v Dánsku, Francii, Švýcarsku a Skotsku [4]. V ČR se incidence pohybuje kolem 2,6 % u mužů a 0,7 % u žen a společně s Chorvatskem, Polskem a Ruskem vykazuje nejvyšší mortalitu v Evropě [3]. Celosvětově se udává výskyt nádorů v oblasti hlavy a krku kolem 370 000 nemocných. Mortalita v letech 2000 – 2004 byla v ČR, Polsku nebo Chorvatsku 6 – 10 na 100 000 pro muže všech věkových kategorií a 12 – 18 na 100 000 pro muže věkové skupiny 35 – 64 let [3]. V této skupině je situace obdobně závažná i na Slovensku, kde je mortalita 16,8 na 100 000 [4]. Na kongresu ASCO v roce 2010 Brenner et al poprvé prezentovali údaje o prodlouženém přežití pacientů s HNC. V letech 1992 – 1996 bylo pětileté relativní přežití nemocných s těmito nádory 54,7 %, v letech 2002 – 2006 již dosahuje 65,7 %. Zlepšení bylo pozorováno zvláště u nádorů dutiny ústní, jazyka, tonzil a nosohltanu. Zlepšení souvisí zejména s časnější diagnostikou, zavedením povinných nutričních screeningů s důslednou nutriční intervencí a významnými pokroky v komplexní onkologické léčbě [5 – 8]. Lokalizace primárního nádoru ovlivňuje relativně časný vznik příznaků, a tím i možnost včasné diagnózy. Problémem je podceňování projevů nemoci pacientem i lékaři. Komplikovanost diferenciálně diagnostické rozvahy způsobuje podobnost s běžnými zánětlivými nemocemi horních dýchacích cest, kde je téměř „zvykem“ ignorovat banální symptomy, jako je snížená průchodnost nosní, nosní sekrece či pocit cizího tělesa v krku nebo chrapot. Včasnost diagnózy a zahájení onkologické léčby ovlivňuje prognózu, plně léčebný záměr či možnost radikálního chirurgického řešení. U HNC se prognóza onemocnění zhoršuje v anatomickém sledu od rtů přes dutinu ústní do hltanu. Nejvýznamnější pro prognózu je však rozsah primárního nádoru v době stanovení diagnózy. Malý nádor v oblasti hlasivek a rtů má pětileté přežití až u 80 % nemocných [4]. Pokročilé nádory (stadium III a IV) mají prognózu velmi špatnou. Pětileté přežití u nich nedosahuje 25 % [4]. Druhotné nádory HNC jsou popisovány u 40 % nemocných, nejvyšší podíl v této skupině představují nemocní, kteří nepřestali kouřit. Většina recidiv se objevuje do dvou let od začátku léčby. Vzdálené metastázy nejsou časté a vznikají většinou pozdě. Je nutné konstatovat i další fakt, že prognóza je zhoršována četnými přidruženými chorobami, jejichž výskyt je v naší populaci také velmi vysoký, a dále významně narůstá s každou dekádou věku nad 60 let.
Nádorové onemocnění doprovází řada patologických změn. Mezi nejzávažnější patří malnutrice onkologicky nemocného člověka. Její přítomnost přímo ovlivňuje prognózu, toleranci onkologické léčby, zvyšuje riziko přerušení nebo ukončení léčby i komplikace bez vazby na nádorové onemocnění. Nemocní s HNC i vzhledem ke své anamnéze kuřáctví a vyššího výskytu abúzu alkoholu patří mezi častěji malnutriční nemocné v době stanovení diagnózy oproti ostatním onkologickým pacientům. Stávající neuspokojivý nutriční stav výrazně a rychle zhoršuje nádorová kachexie [9,10]. Pojem kachexie pochází z řeckých slov kakos a hexis, což znamená „špatný stav“. Nádorová kachexie je chronický, progresivní, komplexní metabolický stav vedoucí k devastaci svalové hmoty (většinou bez ztráty adekvátního množství tukové hmoty), který se vyvíjí jako sekundární porucha u nemocných s nádorovým onemocněním. Vede ke zhoršování funkční výkonnosti a fyzické zdatnosti [11 – 13]. Výstupem těchto změn je potlačení obranyschopnosti a enormní nárůst infekčních komplikací zejména v oblasti dýchacích cest. Podstatou nádorové kachexie je složitá a mnohastupňová interakce hostitel vs. nádor, snížení perorálního příjmu, zvýšení energetických nároků a abnormální metabolizmus [9]. Jde o syndrom charakterizovaný anorexií, pocity plnosti či neschopností jíst až hladověním, nechtěným váhovým úbytkem, metabolickými, zánětlivými i dalšími změnami. V literatuře je tento stav označován jako syndrom nádorové kachexie-anorexie (cancer anorexia-cachexia syndrome – CACS) [11 – 13]. Nemůže být sice rychle a plně zastaven nutriční intervencí, ale lze ho velmi účinně modulovat v čase a v kontextu s dalšími výsledky onkologické léčby, pak i celkově zmírnit jeho následky ve smyslu povšechného poškození organizmu ve většině aspektů běžného života [14]. Pokud zajistíme dostatečnou výživu, významně dokážeme ovlivnit průběh a toleranci onkologické léčby, infekční komplikace, restaurovat vyčerpanou obranyschopnost organizmu. Model nádorové kachexie ze 70. let 20. století byl označován jako „autokanibalizmus“. Zde je postižen nádor, který přežívá na úkor hostitele [12,15 – 17]. Dnešní pohled na patofyziologii nádorového bujení a s ním souběžný metabolický rozvrat je složitější. Metabolické změny při nádorové kachexii jsou výsledkem složitého procesu [18], kde spolu interferují globální systémová reaktivita organizmu [19], zprostředkovaná imunologickou [20], neurogenní [21] a hormonálně senzorickou odezvou, s působky, které jsou produkovány nádorovou tkání [12,15 – 17,22,23]. Tyto změny jsou evolučně podobné většině život ohrožujících procesů a jsou srovnatelné se změnami, ke kterým dochází např. při těžkém traumatu nebo sepsi [24 – 27].
Anorexie s neschopností přijmout dostatečné množství energie a živin je výsledkem dlouhotrvajícího hladovění, kdy organizmus bojuje s nádorem a jeho působky, rostou energetické nároky i systémový prozánětlivý stav [28,29] i sympatikotonie, mění se preferenční vliv participujících signálních drah [22,30], s inzulinorezistencí narůstají problémy se vzestupem glykemie [31], inzulinovou rezistencí i s dalšími endokrinně [32], imuchochemicky, cytokinově ovlivňovanými interakcemi hostitelské i nádorové tkáně (anorexigenní vlivy) [33]. Bludný kruh se uzavírá v pokračujícím katabolizmu již devastované kosterní svaloviny. Klinicky jsou významné změny chemosenzorických vjemů, které při nádorovém onemocnění i během onkologické léčby participují na dalším snížení schopnosti adekvátního příjmu potravy (pokles apetitu, změny v chuti a vnímání vůní, změny tvorby slin, vazkost slin). Tyto mechanizmy komplikují a prodlužují trvání potravinové averze [19,34,35]. HNC způsobují dysfagii nebo odynofagii z důvodu anatomické obstrukce horní části zažívacího traktu a omezují perorální příjem. Následující onkologická léčba s rozvojem mukozitidy po chemoterapii nebo radioterapii stav dále zhoršuje. Nechutenství nebo snížení chuti k jídlu má vysokou prevalenci. Je dokladováno u více než 50 % onkologických pacientů. Podvýživa je považována za důležitý prognostický faktor u všech nemocných s nádorovým onemocněním [36 – 38]. U nemocných s HNC se výskyt podvýživy v době stanovení diagnózy odhaduje na 35 – 87 %. Nechtěný úbytek hmotnosti je považován za další významný prediktor sníženého přežití onkologicky nemocných [27 – 29]. Pokles hmotnosti o více než 5 % je považován za klinicky významný v mnoha studiích. Většina studií prezentovaných v posledních letech (2006 – 2012) považuje za klinicky signifikantní ztrátu hmotnosti více než 10 %. Tento váhový úbytek je vnímán jako nezávislý rizikový faktor pro malnutrici [27 – 29]. Nepoměr poklesu hmotnosti a míry odbourávání svalové hmoty může komplikovat včasné odhalení malnutrice u obézních nemocných [5,39 – 42]. Prevalence obezity v ČR je vysoká, a proto je třeba cíleně pomýšlet na malnutriční stav i u nemocného s BMI ≥ 25 [43].
Pro definici malnutrice u nádorových onemocnění jsou užívány následující parametry:
1. Neočekávaná ztráta hmotnosti více než 5 % za poslední tři měsíce nebo 2. neočekávaná ztráta hmotnosti o více než 10 % v posledních šesti měsících; 3. úbytek hmotnosti ≥ 5 % u pacientů s BMI < 20 [44] nebo 4. pokles hmotnosti ≥ 2 % při BMI < 18,5. Jak bylo zmíněno, po malnutrici je nezbytné cíleně pátrat i u obézních pacientů s BMI ≥ 25 [43]. K vyhledávání nemocných s malnutricí nebo s rizikem rozvoje malnutrice a k řešení problémů s výživou u všech onkologicky (i jinak) nemocných je určena metodologie a doporučení ESPEN (Evropská společnost pro parenterální a enterální výživu), která od roku 2006 na kongresu v Istanbulu deklarovala guidelines pro nutriční screening i nutriční péči napříč medicínskými obory [5 – 8,45,46]. Nástroje nutriční péče představují cílené a důsledné nutriční vyšetření, zhodnocení stavu a rizika a návrh individuálních řešení a výživových doporučení ke zlepšení příjmu potravy, včetně zvážení potřeby prostředků klinické výživy (doplňky stravy, zavedení sondové výživy v různých režimech) lékařem-nutricionistou a konzultace nutričním terapeutem [5,6,42,45 – 52]. V klinické praxi jednoznačně upřednostňujeme individualizovaný včasný a razantní přístup námi zprostředkované nutriční péče v kontextu multidisciplinární spolupráce, která zajistí využití všech dostupných léčebných možností, které povedou ke zlepšení kvality života (quality of life – QOL), perspektivy léčby a vyléčení onkologicky nemocného pacienta a která současně respektuje zachování lidské důstojnosti, sociálního soužití, psychické stability, ošetření bolesti, předchází strádání i stabilizuje úpadek či ztrátu fyzické zdatnosti [53 – 55].
Materiál a metody
Do tříletého sledování jsme zahrnuli pacienty s HNC, kteří byli odesláni do nutriční ambulance III. interní kliniky gerontometabolické z onkologické kliniky a dalších onkologických oddělení a nemocnic ze spádu FN Hradec Králové. Celkem 726 nemocných bylo sledováno ve dvou skupinách. První skupina nemocných měla zavedený PEG (perkutánní endoskopická gastrostomie) a akceptovala nutriční intervenci formou sondové výživy, druhá skupina nemocných byla bez PEG (pacienti zavedení PEG neakceptovali) [5,6,42,45 – 52]. Péče a sledování nemocných s HNC bylo zahájeno v lednu 2004 a ukončeno v prosinci 2012. Vstup posledního nemocného byl realizován v roce 2009 a pozorování bylo vedeno po dobu tří let. Vstupním kritériem byla diagnóza HNC (rakovina v oblasti hlavy a krku) a onkologická léčba v léčebném režimu. Jako vylučovací kritéria jsme stanovili recidivu onemocnění, paliativní péči a chybějící data ze sledování. Všichni účastníci podepsali informovaný souhlas se svou účastí ve sledování.
Nemocní ve skupině s PEG prošli kompletní edukací (konzultace lékaře-nutricionisty a nutričního terapeuta), byl zvolen individuálně vyhovující režim s doporučením, které zohledňovalo osobní zvyklosti a životní styl nemocného člověka, preference i komorbidity [9,10]. Podle výpočtu kalorického příjmu z doneseného jídelníčku z posledních alespoň sedmi dnů byla provedena konzultace individuálního jídelníčku se zdůrazněním možností ke zlepšení perorálního příjmu bílkovin a nutriční poradenství pro pravidla při onkologické léčbě. Všichni pacienti byli zajištěni časnou nutriční podporou formou sondové enterální výživy podávané cestou PEG. Enterální výživa byla stanovena s denní kalorickou dávkou 12,6 MJ (3 000 kcal) [5 – 8,45,46]. Skupina nemocných bez PEG byla rovněž poučena formou kompletní nutriční konzultace [5,6,42,45 – 52]. Podle osobních stravovacích návyků a aktuálních možností perorálního příjmu dle stavu nemocných byla sestavena individualizovaná doporučení. Nutriční péče byla vedena formou sippingu. Cílem byla snaha o dosažení obdobného energetického zajištění jako ve skupině s PEG.
Sledování jsme provedli v následujícím schématu:
- vstup pacienta (T0),
- kontrola za 6 měsíců (T6),
- kontrola po 12 měsících od vstupu nemocného (T12),
- kontrola za 24 měsíců (T24),
- kontrola za 36 měsíců od vstupu nemocného do sledování (T36).
Sledované parametry
- Demografické údaje (pohlaví, věk, vzdělání, anamnéza kouření a pravidelného požívání alkoholu, vstupní terapie pomocí antidepresivní léčby).
- Onkologická data (nádor dle TNM klasifikace – primární nádor, stadium a rozsah nádoru, modalita onkologické léčby, preventivní ústní a stomatologická péče před zahájením onkologické léčby).
- Subjektivní klinické symptomy (Clinical symptom score – CSS, 1 – 16 bodů) jsme sledovali pomocí sestavené škály spektra nejčastěji udávaných obtíží nemocných (informace jsme získali z onkologických učebnic a z našeho pilotního sledování před zahájením projektu): dysfagie, ztráta chuti k jídlu, pocity plnosti, nevolnost, zvracení, obtíže se žvýkáním, obtíže při polykání, změna chuti, změna čichu, sucho v ústech, vazké/ husté sliny, bolesti v ústech, úbytek energie, úzkosti, bolest, nespavost.
- Komorbidity nemocného byly postiženy pomocí dotazníku CCI (Charlson comorbidity index) [56,57]. Klinický aktuální stav a míra funkčního poškození nemocného byly zachyceny pomocí KPS (Karnofsky performance status score) [58].
- Nutriční hodnocení. Hmotnost byla měřena na váze (Lindeltronic 8000, Digital Medical Scale, Copenhagen, Denmark) při všech měřeních. BMI byl vypočten jako hmotnost v kg/ výška v metrech čtverečných [2,44]. BMI byl klasifikován podle WHO. Úbytek hmotnosti (v %) vyjadřuje neočekávaný pokles hmotnosti z obvyklé tělesné hmotnosti udaný za posledních šest měsíců. MUST (Malnutrition universal screening tool) byl realizován s použitím příslušného dotazníku [7,8], NRS screening rovněž s užitím dotazníku NRS 2002 [7,8,59]. Metodologie nutričního screeningu byla provedena podle doporučení ESPEN [5 – 8,45,46]. Kombinaci nutričního screeningu MUST a NRS 2002 [7,8,59] jsme užili z důvodu vyšší účinnosti při vyhledávání malnutričních nemocných a pro důslednější vedení nutriční intervence [7,8,37,45,46,60 – 62]. Zlatým standardem, který jsme použili, jsou doporučení ESPEN pro ambulantní nutriční péči [5 – 8,45,46].
- Kvalita života (QOL) [63 – 66]. Měřeníjsme prováděli pomocí dotazníků EORTC QOL C-30 (Evropská organizace pro výzkum a léčbu rakoviny) [54,65,67 – 70] a byly použity moduly C-30 [67,70] a HN-35 (EORTC QOL HN-35) [71 – 73]. Dotazník QOL C-30 slouží ke zjišťování obecného zdravotního, psychického, emocionálního a sociálního stavu nemocného. Obsahuje 30 otázek rozdělených do pěti funkčních škál: každodenní výkonnost a aktivity, emocionální a kognitivní kondice a sociální stav. Dále následuje hodnocení únavy, nevolnosti a bolesti. V dalších šesti otázkách pacient hodnotí intenzitu následujících příznaků: dušnost, nespavost, nechutenství, zácpa, průjem a finanční problémy. Poslední dvě otázky se týkají obecného pocitu zdraví. Odpověď nemocný vybírá ze čtyř možností odpovědí (nikdy – 1, někdy – 2, často – 3, velmi často – 4). Dotazník QOL HN-35 obsahuje 35 otázek rozdělených do sedmi skupin: bolest, polykání, smysly, mluvení, jedení ve společnosti druhých, sociální kontakt, sexualita. Následuje 11 otázek pro hodnocení konkrétních příznaků nemocných s HNC: problémy se zuby, obtíže s otevřením úst, suchost dutiny ústní, husté sliny, kašel, vlastní povědomí nemoci, bolest, užívání potravinových doplňků a změny hmotnosti (úbytek nebo vzestup hmotnosti). Všechny otázky mají také možnost čtyř stejných odpovědí. Výpočet výsledků obou dotazníků QOL byl proveden podle EORTC manuálu [54,65,67 – 70]. Skóre je udáváno v rozmezí 0–100.
- Laboratorní markery [29,74– 76] – leukocyty, CRP (C-reaktivní protein), FW (sedimentace erytrocytů), albumin (S_alb.), glykemie (S_gly.), sérový cholesterol (S_chol.).
- Přežití, mortalita závislá a nezávislá na nádorovém onemocnění.
Statistika
V kontrolovaném sledování se smíšeným designem jsme provedli analýzu vlivů (PEG vs. skupina nemocných bez PEG, pohlaví a kuřáctví) na časově závislé proměnné (např. QOL). Pro naše sledování jsme zvolili jako definici malnutrice neočekávanou ztrátu hmotnosti větší než 10 % v posledních šesti měsících. Opakovaná měření u jednotlivých subjektů byla realizována s cílem zhodnotit chování jednotlivých závisle proměnných v čase (např. hladina albuminu) s ohledem na nezávislé faktory (např. zavedení PEG) a dále popsat míru vlivu těchto faktorů na riziko zhoršení QOL, morbidity a mortality pacientů. Hlavními výstupy jsou statistické modely, které s větší či menší mírou věrohodnosti popisují chování jednotlivých proměnných za daných okolností a mohou tak v rámci definované pravděpodobnosti umožnit extrapolaci výstupů na celou populaci pacientů. Navržené modely jsou následně navzájem porovnávány s ohledem na množství parametrů (stupně volnosti) a skutečně dosaženou věrohodnost pomocí hodnot – 2LL ( – 2 log likelihood) a AIC (Akaike infromation criterion).
Statistické analytické metody byly:
- smíšená faktoriální ANOVA konceptualizovaná spolu s mnohočetnou regresí do obecného lineárního modelu pro opakovaná měření (general linear model for repeated measures – GLM) s odhadem parametrů metodou nejmenších čtverců;
- multivariátní analýza rozptylu (MANOVA);
- smíšený model (mixed model) s odhadem parametrů metodou maximální věrohodnosti (maximum likelihood);
- analýza přežití Kaplan - Meierovým algoritmem;
- Coxova regrese.
Deskriptivní statistika byla použita k popisu charakteristik proměnných, kontinuální proměnné jsou prezentovány jako průměr/ směrodatná odchylka nebo medián/ interkvartilové rozpětí. Kategoriální proměnné jsou prezentovány jako četnosti. Pro získání validních výsledků je nezbytné, aby analyzovaná data splňovala řadu podmínek zvlášť hodnocených příslušnými testy. Mezi nejdůležitější patří podmínka normálního rozdělení (hodnocení šikmosti, strmosti, Kolmogorovův-Smirnovův test) s přihlédnutím na tzv. teorém centrálního limitu (při vysokém počtu měření není ani signifikantní odchylka od normality zdrojem závažného ovlivnění výsledků parametrických statistických testů – Kolmogorov-Smirnov test normality dat, Levenův test pro testování stejnorozptylovosti, Mauchlyho test pro datovou sféricitu). Pro srovnání mezi dvěma skupinami kontinuální proměnné byl použit Studentův t-test. Konfigurace kategoriálních dat byly analyzovány pomocí chí-kvadrátu (χ2 test). Analýza přežití byla provedena pomocí Kaplan-Meierova algoritmu a Coxovou regresí definující poměr rizika hazard risk (HR) odlišných faktorů, doplněného o 95% CI. Opakovaná opatření byla ošetřena pomocí smíšené faktoriální ANOVY (general linear model – GLM) s příslušnými korekcemi dle Greenhouse a Geissera. U nezávislých měření byly aplikovány post hoc testy dle Bonferroniho a Games-Howella. V případě problému s autokorelací chyb pak byla použita autoregresní kovariační matice ve smíšeném modelu. Všechny výsledky testů považujeme za statisticky významné při p ≤ 0,05 a byly doplněny standardizovanou sílou efektu (partial eta squared, η2), který je možné interpretovat (po vynásobení 100) jako procento unikátní variability závisle proměnné, které je vysvětleno nezávisle proměnnou. Statistické analýzy byly provedeny s použitím produktu IBM SPSS Statistics software (verze 22).
Výsledky
Náplní naší práce byl nutriční screening a zavedení adekvátní nutriční péče se sledováním nutričních i dalších laboratorních parametrů nemocných v čase. Vzhledem k charakteru nemoci a závažnému postižení života a psychické stigmatizaci nemocí jsme sledování rozšířili o sledování QOL, její vývoj a další aspekty v závislosti na vývoji onkologického onemocnění. Podle výsledků sledování QOL i ostatních parametrů „well-being“ jsme mohli péči zlepšit poskytnutím cílené intervence většiny problémů v mezioborové spolupráci v rámci Fakultní nemocnice (psychologická, psychiatrická péče, rehabilitace a rekondiční režimy, interní a kardiologická léčba, plicní či imunologické vyšetření, stomatologická péče, sociální péče, event. koordinace terénní zdravotnické nebo pečovatelské pomoci). Pro popsání jednotlivých nemocných jsme zvolili řadu nástrojů a zavedli skórovací škály obtíží, hodnocení klinického stavu, komplikací, komorbidit i QOL. Tím jsme získali dostatečné množství informací, které jsme využili ve prospěch nemocného během celého sledování a léčby, pro monitorování další morbidity a mortality nemocných. Ze získaných výsledků jsme mohli posoudit vztahy a přínos nutriční intervence na sledované proměnné včetně vývoje QOL a přežití, komplikací stavu a rehospitalizací. Dalším významným přínosem byla velká spolupráce s nemocnými i s rodinami, lepší porozumění a větší oboustranná vzájemná důvěra i komunikace, protože poskytované informace přinášely nejen řešení v rámci námi zajišťované nutriční péče, ale pomoc i v ostatních oborech s řešením obtíží, které nebyly v klíčovém hledáčku onkologa.
Do sledování bylo zařazeno celkem 726 ambulantních pacientů s HNC, v průběhu sledování zemřelo celkem 535 pacientů (73 %) a 7 pacientů jsme vyloučili z hodnocení z důvodu chybějících dat. Spolupráce nemocných byla po dobu sledování vynikající – i přes fakt, že jde o skupinu, která je rizikovější než řada ostatních. Charakteristiky pacientů s HNC jsou uvedeny v tab. 1. Průměrný věk nemocných byl 62 let, poměr mužů a žen byl 2,27 (odpovídá zastoupení onemocnění v naší populaci).
Tab. 1. Demografická data pacientů a vstupní proměnné. 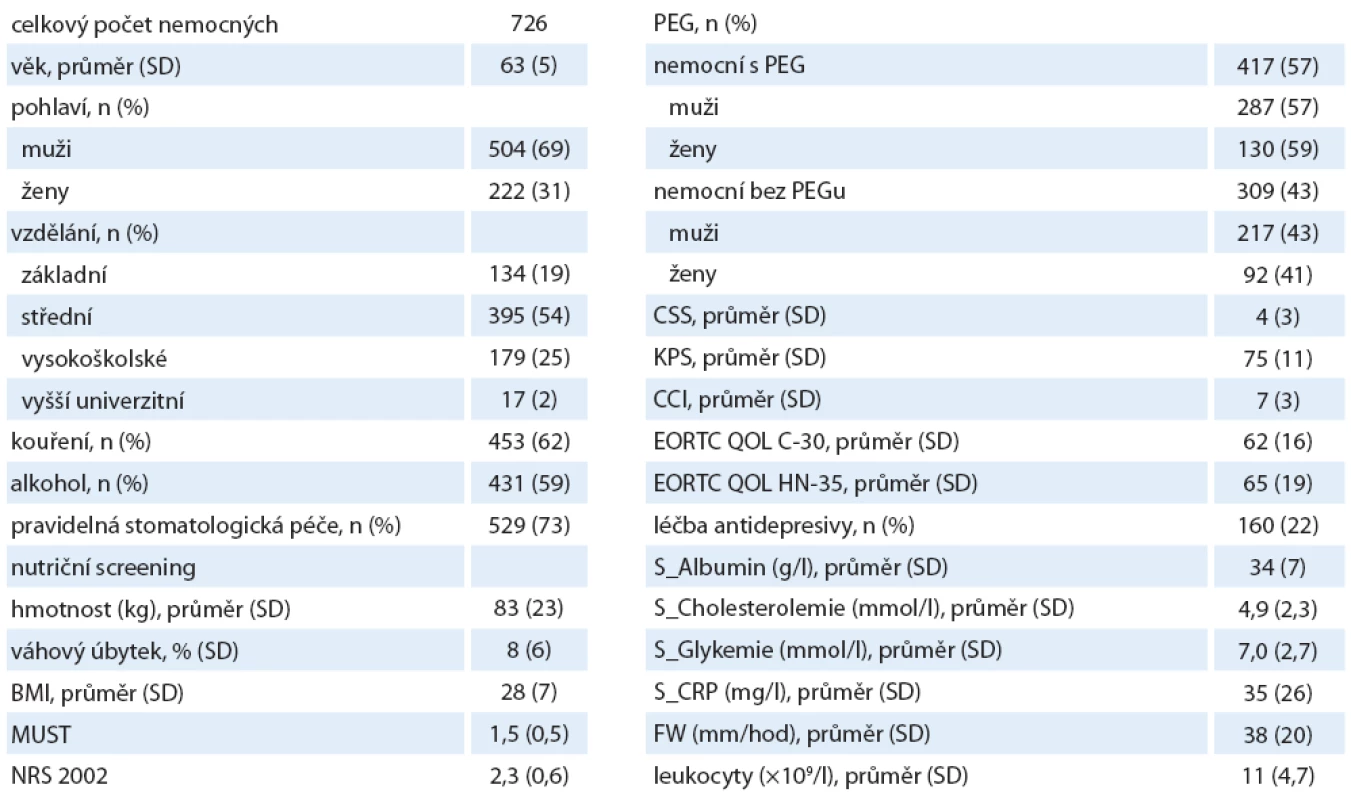
KPS – Karnofsky performance status score, CCI – Charlson comorbidity index, CSS – Clinical symptom score Pohlaví a věk
Zachytili jsme signifikantní věkový rozdíl mezi pohlavími. Muži měli průměrný věk 62 let, zatímco ženy 64 let (p < 0,02). I přes mladší věk mužů byla mortalita nezávislá na rakovině (cancer-independent mortality) signifikantně vyšší právě u mužů (kardiovaskulární mortalita) a koreluje s vyšším výskytem nemocí kardiovaskulárního systému, diabetem a hypercholesterolemií. To znamená, že muži zařazení do sledování byli více nemocní dle CCI. Muži byli častějšími kuřáky.
Kouření a pravidelná konzumace alkoholu
Kouřením rozumíme každodenní kouření více než pěti cigaret, pravidelnou konzumací alkoholu rozumíme každodenní požití více než 0,4 dl vína nebo každodenní požívání piva v počtu nad 3 ks nebo pravidelné požívání libovolných destilátů. Pravidelný abúzus jsme vstupně zaznamenali spolu s kouřením u 529 pacientů (73 %). V dalším sledování ale dochází k významnému poklesu požívání alkoholu, zejména mezi T0 a T6 ze 73 na 28 %. Nebyl žádný rozdíl mezi pohlavími. Celkový počet kuřáků byl 453 (62 %), z toho 307 mužů, a 146 žen v čase T0. V následném sledování dochází také k poklesu počtu kuřáků – na 33 % nemocných. Podle našich sledování lze říci, že ukončení kouření v čase kontroly T6 nebo T12 (u nemocných, kteří byli kuřáky v čase T0) má ochranný vliv na progresi onkologického onemocnění, pokles mortality na rakovině závislé i rakovině nezávislé v době T24 – T36 (p < 0,02). Ve skupině se základním ukončeným vzděláním je nejvíce nemocných, kteří nadále kouřili až do konce sledování v T36, a také nejvíce pacientů, u kterých byla diagnostikována recidiva nádoru nebo duplicita ještě v době sledování.
Rakovina hlavy a krku (HNC)
Nejčastější rakovinou v našem souboru byl hypofaryngeální karcinom (26 %) a karcinom nosohltanu (21 %). Nejvyšší věk 66 let jsme zaznamenali u rakoviny mandlí, nejnižší věk byl 55 let u karcinomu jazyka. Při hodnocení pokročilosti nádorového onemocnění bylo nejvíce zastoupeno stadium II (344 pacientů, 48 %), 190 nemocných (26 %) mělo pokročilé stadium III a IV. Preventivní stomatologickou péči před zahájením onkologické léčby mělo evidovanou 529 pacientů (73 %). Pro sledování klinických symptomů jsme užívali CCS škálu (klinické symptom skóre). Nejčastěji zaznamenanými obtížemi byla z našich vybraných obtíží dysfagie, ztráta chuti k jídlu, změny chuti a vůní, pocit plnosti a bolest. Průměrný počet symptomů CSS byly nejméně čtyři příznaky. CSS odpovídá lokalizaci primárního nádoru. S narůstajícím stadiem nemoci roste i počet udávaných klinických symptomů CSS. Obecně platí, že malnutriční nemocní s úbytkem hmotnosti ≥ 10 % anebo s BMI ≤ 22 a pacienti-kuřáci, kteří již vstupně dosáhli CCS ≥ 6, se vyznačují kratším přežitím, signifikantně sníženou QOL (viz dále) a nejvyšší mortalitou závislou na rakovině (cancer-dependent mortality). HR pro CSS bylo 1,13 a riziko pro malnutrici se zvyšuje o 14 % s každými dalšími třemi symptomy skóre CSS. Zjistili jsme statisticky významný rozdíl CSS mezi pohlavími. Ženy měly průměrné hodnoty CSS nižší než muži (3 vs. 5; p < 0,02) při obdobném stadiu nemoci. Znamená to tedy, že ženy obecně lépe snášely svou nemoc a její projevy. Ale nelze pominout fakt, že ženy dříve a lépe akceptovaly antidepresivní léčbu (viz dále) a byly v pravidelné péči psychologa nebo psychiatra. Spotřeba analgetika u žen nebyla vyšší. Stav s nálezem CSS ≥ 6 jsme sledováním stanovili jako klinicky závažný, vedoucí k významnému zhoršování celkového klinického stavu, se zvýšením rizika podvýživy s dehydratací, vyžadující častější a opakované rehospitalizace z důvodu odvodnění, neschopnosti adekvátního příjmu – u nemocných ve skupině bez PEG. Avšak u obou skupin je CSS ≥ 6 spojeno s významně častějším přerušením onkologické léčby. CSS ≥ 8 významně koreluje s vyšším úbytkem hmotnosti (p < 0,02), nižším BMI v čase vstupu do sledování (T0), úplným přerušením onkologické léčby, časnější úmrtností, nižší hladinou albuminu (p < 0,03), vyšším počtem rehospitalizací a delším pobytem v nemocnici nad 21 dnů, kde byly důvodem přijetí infekční komplikace (p < 0,02).
Komorbidity
Komorbidity byly klasifikovány podle CCI.
Průměrná hodnota CCI v čase vstupu (T0) byla 6,7. Nejčastější komorbiditou pacientů s HCN byly nemoci kardiovaskulárního systému, diabetes mellitus a hypercholesterolemie. U mužů-kuřáků, kteří v T0 měli vyšší sérové hladiny glykemie a cholesterolu, odpovídající CCI a BMI vyšší než 25, jsme nalezli významně vyšší kardiovaskulární úmrtnost mezi T12 a T36. Nenašli jsme stejný rozdíl u žen. CCI se zdá být silným nezávislým rizikovým faktorem pro mortalitu na rakovině nezávislé (cancer-independent mortality). U nemocných, kteří přežili, byla vstupní hodnota nižší – CCI 4 (SD 2), zatímco vstupní index komorbidit u zemřelých nemocných byl 7 (SD 3). HR byl 1,19 a riziko kardiovaskulární úmrtnosti vzrůstá o 16 % s každými 3 body CCI. Nemocní s CCI ≥ 7 v T0 mají významně vyšší hmotnost a BMI (BMI ≥ 26) na začátku léčby, nižší QOL, nižší KPS, vyšší hladinu cholesterolu a glykemie, nižší hladiny albuminu a signifikantně vyšší mortalitu v období T12 – T36. Dále mají častější rehospitalizace s delšími pobyty v nemocnici (nad 21 dnů). Nenašli jsme signifikantní rozdíl mezi skupinou s PEG a bez PEG.
Nutriční sledování
Klasifikace nemocných podle úbytku hmotnosti je uvedena v tab. 2. Většina nemocných (53 %) v našem souboru měla nadváhu s BMI ≥ 25. BMI ≥ 25 u mužů-kuřáků považujeme za nezávislý prediktor vyšší kardiovaskulární mortality (viz výše). Průměrná hmotnost na začátku studie byla 83 kg. Zaznamenali jsme významný rozdíl mezi pohlavími. Muži měli průměrnou hmotnosti 84 kg a ženy 69 kg (p < 0,01), obdobně významný rozdíl BMI u mužů 30 vs. 23 u žen (p < 0,01). Nejčastěji udávaný úbytek hmotnosti v čase T0 byl 10 % (75 % nemocných). Úbytek hmotnosti nad 25 % jsme zaznamenali jen u 11 nemocných. Úbytek hmotnosti ≥ 12 kg v čase vstupu do sledování (T0) byl spojen s horší prognózou přežití. Celková ztráta hmotnosti ≥ 20 % významně odpovídá vyššímu riziku přerušení léčby mezi T0 a T6, vyššímu výskytu infekčních komplikací s časnější úmrtností již během sledování (mezi T12 a T36), vyšším počtem rehospitalizací i prodloužením délky pobytu v nemocnici nad 21 dnů. BMI ≤ 22 s váhovým úbytkem nad 10 % jsou silnými prediktory malnutrice a spolu s CSS a S_alb. < 30 jsou spojeny s vyšší mortalitou závislou na rakovině mezi T0 a T36. Je zřejmé, že nemocní při poklesu hmotnosti o 10 – 15 % v čase T0 jsou již malnutriční a potřebují časnou nutriční podporu. Prokázali jsme přítomnost významného rozdílu ve vývoji BMI v čase mezi skupinami s PEG a bez PEG a mezi pohlavími (graf 1).
Tab. 2. Klasifikace nemocných podle úbytku hmotnosti v čase vstupu do sledování. 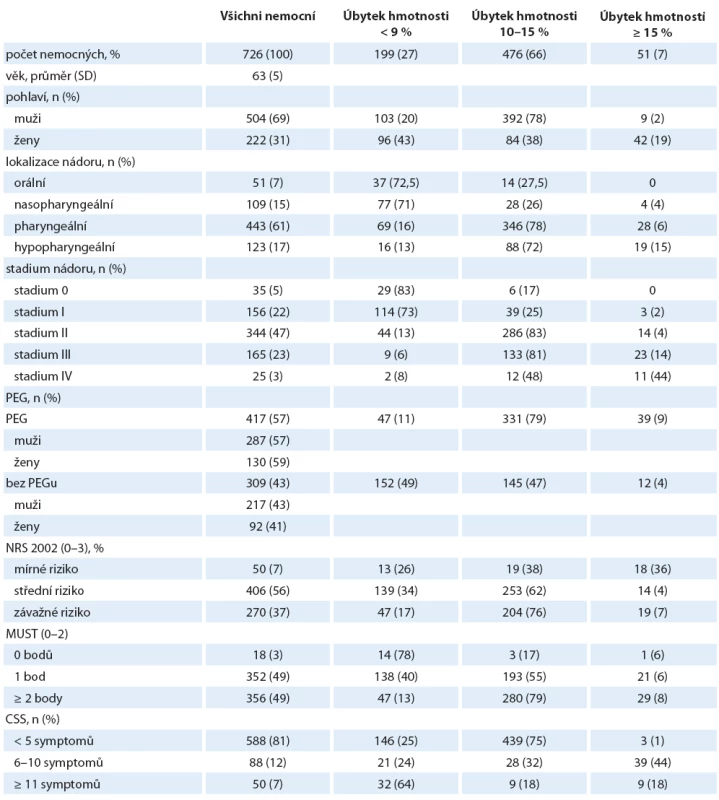
CSS – Clinical symptom score Graf 1. Znázornění vývoje BMI nemocných mezi T0 a T36 u žen a u mužů a bez pohlavní diferenciace. 
PEG vs. skupina bez PEG
Enterální výživa podávaná cestou PEG byla zavedena u 57 % nemocných, zbývající nemocní zavedení PEG neakceptovali (309 nemocných, 43 %). Vstupně jsme nezaznamenali žádný statisticky významný rozdíl v podílu pacientů s poklesem o 10 – 15 % a kachektických nemocných s BMI ≤ 22 mezi oběma skupinami. Podle našeho sledování dochází k významně odlišnému vývoji ve většině sledovaných parametrů od kontroly T6. Skupina nemocných bez PEG vykazuje pokračující pokles hmotnosti až do T12 u 61 % nemocných – o více než 5 kg [77]. Pokles hmotnosti mezi 1,6 a 4,9 kg mělo 33 % nemocných. Od T6 měli nemocní v této skupině vždy nižší hmotnost i BMI a S_alb. – až do T24 než nemocní s PEG. Tito nemocní vykázali častější infekční komplikace a více rehospitalizací T6 – T36. Nikdo ze 79 pacientů bez PEG (10,9 %), kteří měli vstupně BMI < 20 v T0, nedosáhli do konce sledování (T36) ani své vstupní hmotnosti v čase T0. Tento snížený efekt nutriční intervence ve skupině nemocných bez PEG odpovídal vyššímu zastoupení nemocných, kteří nepřestali kouřit a dále pravidelně konzumovali (každodenně) alkohol. V této skupině je nejvyšší podíl nemocných s ukončeným základním vzděláním. Vzestupný trend hmotnosti s trvalým přírůstkem hmotnosti jsme nalezli pouze ve skupině s PEG. Od kontroly T6 se vyskytla u 34 % nemocných, zvýšení hmotnosti bylo nejméně o 1,4 kg, od T12 jsme zaznamenali konstantní vzestup tělesné hmotnosti nejméně o 1,7 kg u 64 % pacientů. Tyto výsledky odpovídají příznivému vývoji i dalším sledovaným parametrům (CSS, KPS). Střední hodnota KPS byla 73 vs. 78 ve skupině bez PEG (p < 0,01). Nemocní se zavedeným PEG měli nižší výskyt infekčních komplikací, nižší počet rehospitalizací (p < 0,01), nižší počet přerušení nebo ukončení onkologické léčby z důvodu zhoršení celkového zdravotního stavu, menší pokles fyzické schopnosti a udrželi si spontánní mobilitu. Dále vykázali časnější začátek trvalého vzestupu S_alb. (viz dále).
Kvalita života (QOL)
QOL považujeme za klíčový faktor života nemocných s nádorovým onemocněním, protože jsou denně konfrontováni se závažnou a život ohrožující chorobou. Význam informací získávaných ze sledování považujeme za nenahraditelný. Momentální stav obtíží i sledování vývoje údajů zvyšovalo pozornost s nepodceňováním stavu a umožňovalo včasnou intervenci v rámci naší odbornosti i v multioborovém přístupu. Komplexnost veškeré vynaložené péče o nemocné zajistila prevenci zbytečných komplikací v průběhu nesmírně náročné onkologické léčby. Sledování QOL v čase považujeme za nástroj pro vybudování a udržení vzájemné důvěry a pro udržení dlouhodobé vynikající spolupráce. Nemocní i jejich rodiny byli trvale ujišťováni, že jimi sdělované informace nezůstávají bez adekvátního povšimnutí, naopak jsou nesmírně důležité oboustranně, protože jsou reflektovány a řešeny. V našem sledování tyto atributy byly uchopeny velmi dobře, o čemž svědčí nezvykle vysoká spolupráce nemocných a fakt, že ze 726 nemocných nespolupracovalo během tříletého sledování pouhých osm nemocných. Dotazníky QOL popisují změny zdraví, symptomů i funkční výkonnosti ve vztahu k vlastnímu onemocnění i v průběhu onkologické léčby, která je směřována k plnému léčebnému účinku, byť přináší řadu nepříjemných a subjektivně obtížně tolerovaných obtíží, společně s dalšími životně důležitými parametry. I proto má subjektivní pohled a sebehodnocení nemocného člověka tak vysokou výpovědní hodnotu nejen aktuálně, ale i pro sledování v čase. Mohli jsme dobře sledovat a studovat vývoj i stagnování jednotlivých skupin projevů nebo potíží. Pro klinickou péči pak tímto vytěžit lepší přístup k nemocnému, lépe a cíleněji směřovat intervenci podle tříbení klinických potíží, také snadněji odhalit psychické změny a propady nemocných, stejně jako zhoršování mobility a sociálních dopadů nemoci. Větší pozornost výsledkům QOL umožňuje všem zainteresovaným zdravotníkům lépe pochopit nemocného a porozumět mu, sledovat vývoj subjektivního vnímání obtíží pacientů napříč všemi spektry nemocí – nejen u onkologických onemocnění, ale tím spíš právě u nich, protože každé onkologické onemocnění není jen onkologickou chorobou, ale změnou celého života.
Vzhledem k primárnímu významu nutriční ambulance jsme QOL sledovali cíleně ve dvou skupinách – z pohledu nemocného s PEG a bez PEG. Toto rozdělení poskytlo další možnosti srovnání z pohledu malnutrice, vývoje nutričního stavu a dalších klinických aspektů [77]. Z tohoto úhlu pohledu lze konstatovat, že přítomná malnutrice významně ovlivňuje QOL nemocných. Ztráta hmotnosti více než 10 % významně ovlivňuje jak QOL C-30, tak i QOL HN-35 a současně plně odpovídá CSS. Tato vazba se nám stala současně také slepou kontrolou ke sdělovaným (subjektivním) informacím nemocných. Jako klinicky závažnou jsme stanovili změnu větší, než je 10 bodů měřítka QOL C-30 a 5 bodů u HN-35. HR byl 1,18 a zhoršení podvýživy o 12 % je vázáno s každým zvýšením o 10 bodů QOL C-30 a o 5 bodů QOL HN-35, pokud jde o nemocné s BMI ≥ 22. U pacientů s BMI < 20 je HR 1,22 a zhoršení podvýživy je vázáno o 16 % s každým zvýšením o 5 bodů QOL C-30 a o 3 body QOL HN-35. Tito nemocní byli nejrizikovější z pohledu psychické deprivace, mezi T0 a T6 je v této skupině pacientů nevyšší vzestup v antidepresivní léčbě, současně mají nejnižší hladinu cholesterolu a signifikantně vyšší zastoupení hyperglykemií ≥ 8 mmol/ l, nejnižší hladiny albuminu a častější rehospitalizace s delšími pobyty v nemocnici z důvodu infekčních komplikací. Preferenčně se jedná o nemocné bez PEG v čase T0, kteří přehodnotili svůj názor na zavedení PEG a rozhodli se akceptovat jeho zavedení. Tito nemocní vykazovali vysoké poškození fyzické kondice, pokles výkonnosti ve většině cílených otázek včetně sociální sounáležitosti a stávali se nejčastěji závislými na péči druhé osoby.
Pacienti s PEG, BMI ≥ 22, nekuřáci vykazovali od T6 nejlepší QOL, nejnižší CSS a lepší KPS. Signifikantní rozdíly v QOL mezi pacienty s PEG a bez PEG (p < 0,02) nastávají od T6. Průměrné hodnoty QOL C-30 byly 58 (SD 17), QOL HN-35 byly 66 (SD 19); p < 0,01. Pokud dále analyzujeme zastoupení nemocných, kteří byli již v T0 léčeni antidepresivy, nenacházíme statisticky významný rozdíl mezi skupinou nemocných s PEG a bez PEG, mimo zmíněný rozdíl vyššího zastoupení žen s antidepresivy v obou skupinách. V čase T0 bylo léčeno antidepresivy 160 nemocných (22 %). Takto léčení nemocní mají nižší výskyt úzkosti v CSS (p < 0,02), nespavosti a lepší výsledky QOL (QOL C-30 a QOL HN-35), p < 0,02. Můžeme tedy konstatovat lepší obecnou QOL, lepší výkonnost a odolnost nemocných k psychickým propadům. U pacientů s PEG nacházíme od T6 lepší profil psychického ladění, méně úzkosti a i přes pomyslný handicap zavedené sondové výživy lepší sociální kontakty a mnohem nižší vnímání sociální izolace. Naopak u nemocných bez PEG konstatujeme nález významně vyššího výskytu úzkosti a nespavosti i při postupně stále vyšším podílu terapie antidepresivy a péči psychiatra. Ženy vykazují setrvale lepší QOL (C-30 i HN-35) od T6 a odpovídající nižší CSS i vyšší (tzn. lepší) KPS. Znamená to, že ženy tolerovaly lépe onkologickou léčbu (patrně i z důvodu včasné antidepresivní intervence?) i přes vyšší pokles hmotnosti a nižší BMI při zachování srovnatelného podílu pokročilých nádorů (stadium II – IV). Ženy s PEG měly významně nižší frekvenci rehospitalizací a kratší dobu pobytu v nemocnici (do 10 dnů) než muži. Ženy v obou skupinách (s PEG i bez PEG) vykazují stagnaci spotřeby antidepresivní i analgetické medikace mezi T6 a T12. Zavedení léčby tedy odpovídá významnému zlepšení QOL C-30, v obecné QOL i QOL postihující nádorové onemocnění. Celkově klesá výskyt nespavosti, anxiety a zlepšuje se schopnost života v sociálním prostředí, včetně schopnosti stolovat s rodinou a přáteli. QOL sledovaná ve vztahu k nádorovému onemocnění (QOL HN-35) také koreluje zlepšování stavu, i když míra zlepšování je mezi kontrolami pomalejší než u QOL C-30 (obecné zdraví). Tuto skutečnost lze vysvětlit jistě perzistujícími obtížemi vlastního nádorového onemocnění a léčeného nádoru s následky onkologické léčby (mukozitida). Od T12 nejčastěji přetrvává pocit sucha v ústech, potíže s polykáním, změny čichu a chuti, vazkost slin. Nalezli jsme klinicky významný rozdíl u nemocných s PEG, kteří měli po celou dobu onkologické léčby adekvátní a důslednou stomatologickou péči, protože i ve skupině nemocných s progresí onkologického onemocnění nedochází k tak významnému zvýšení potíží jako u skupiny bez této péče. Obdobný trend nacházíme u nemocných, kteří přestali kouřit, protože i jim se daří v čase lépe. Skupina nemocných bez PEG má obecně častější a významnější klinické obtíže, které zhoršují QOL, mají menší efekt antidepresivní léčby, vyšší výskyt anxiety a nespavosti, udávají vyšší spotřebu analgetické léčby. Je nutné konstatovat nezbytný fakt, že nemocní, kteří změnili své rozhodnutí a v průběhu onkologické léčby akceptovali zavedení PEG mezi T0 a T6, využívají častěji profity, které provázejí nemocné ve skupině se zavedeným PEG od počátku. QOL v obou parametrech (C-30 i HN-35) je odlišná i z pohledu sledování u všech nemocných (tab. 3) a pouze přeživších nemocných (graf 2 a tab. 4).
Tab. 3. Kvalita života u všech nemocných v čase s porovnáním s KPS. 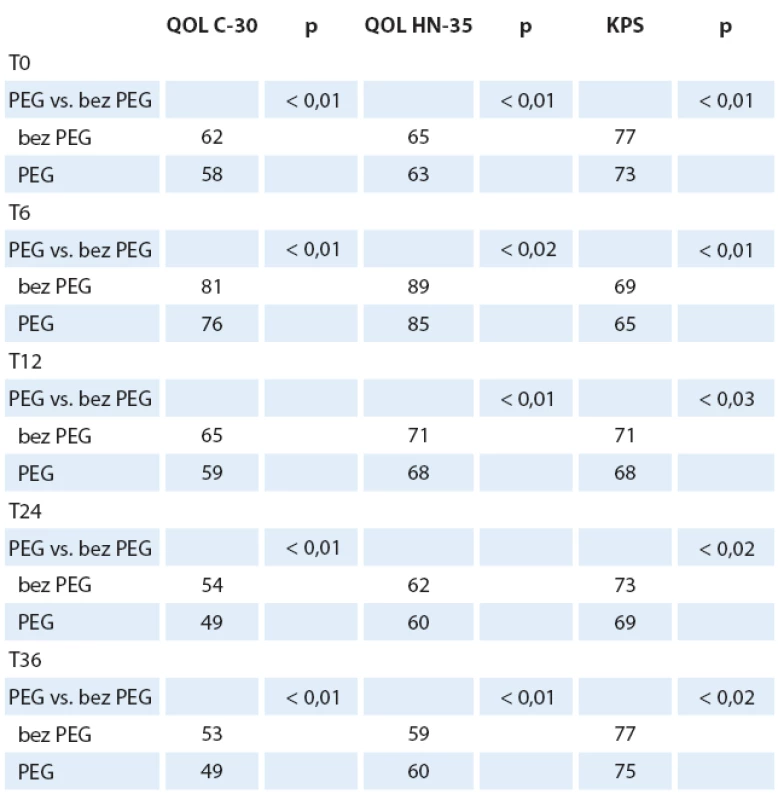
QOL – kvalita života, KPS – Karnofsky performance status score Graf 2. Vývoj kvality života přeživších nemocných dle EORTC QOL C-30 a HN-35 v čase T0–T36 se srovnáním nemocných s PEG a bez PEG. 
Tab. 4. Kvalita života u přeživších pacientů v porovnání s KPS. 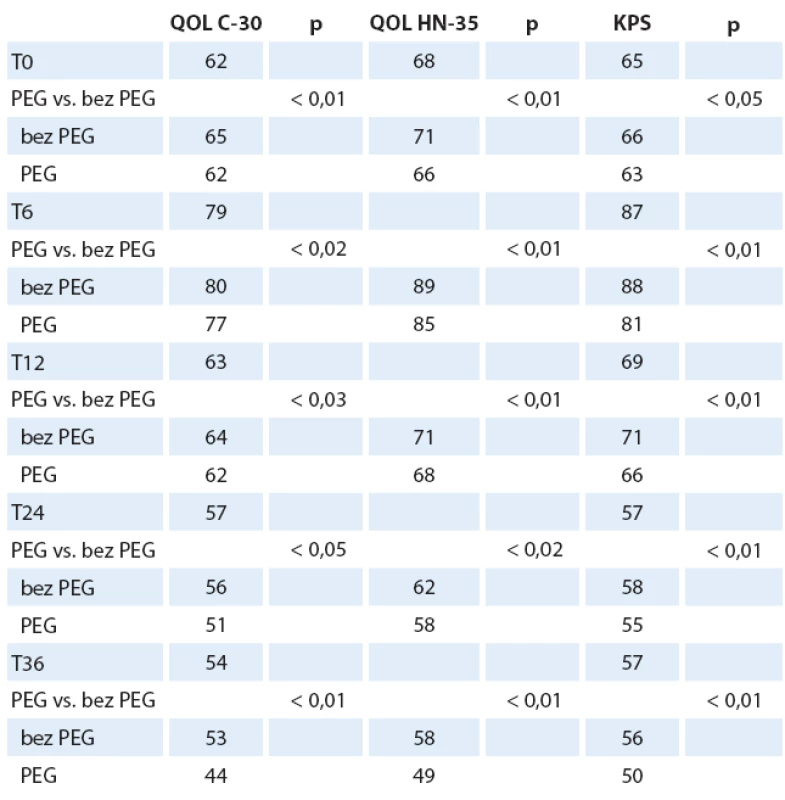
QOL – kvalita života, KPS – Karnofsky performance status score Laboratoř
Podle očekávání jsme nalezli řadu významných rozdílů v hodnotách markerů systémového zánětu (C-reaktivní protein, sedimentace erytrocytů, leukocytóza), biochemických ukazatelů – albumin (g/ l), cholesterol (mmol/ l) a glykemie (g/ l). Průměrná leukocytóza byla 11 × 109/ l, zaznamenali jsme statisticky významné rozdíly: ženy měly vyšší markery zánětu než muži. Průměrná FW (sedimentace erytrocytů) byla 38 za 1 hod. Nejčastější FW byla 36 u 25 % pacientů. Průměrná hodnota CRP byla 35 u 33 % nemocných. Signifikantně vyšší CRP mají ženy v T6 – T12 (p < 0,01) a odpovídá vyšším hodnotám FW i leukocytózy. Ženy s vyššími ukazateli zánětu vykazovaly nižší QOL v obou dotaznících než ženy s nižšími hodnotami zánětu. Přesto ale ženy v systémovém zánětu nevykazují vyšší výskyt zánětlivých komplikací, ani nutnost přerušení onkologické léčby nebo zvýšení počtu rehospitalizací. Maximální hodnoty CRP u mužů dosahují pouze 50 % maximálních hodnot CRP u žen ve všech sledovaných kontrolách (T0 – T36). Rychlý a kontinuální pokles CRP u mužů nastává od T12 (p < 0,002), zatímco u žen nastupuje trvalý a pozvolnější pokles CRP až od T24. Získané výsledky naznačují, že přítomná zánětlivá reakce byla významněji zastoupena u žen, které měly současně nižší hmotnost, BMI, větší váhový úbytek a byly kuřačky. V pozorování jsme nalezli vztah, kde HR byl 1,12 a zhoršení podvýživy je o 10 % s každým zvýšením CRP o 10, pokud jde o nemocné s BMI < 22. Hodnota CRP ≥ 34 koreluje s nižšími hladinami albuminemie (S_alb. < 30) a je spojena s dvakrát vyšším výskytem infekčních komplikací v T6 – T36 u obou pohlaví, u mužů je tato závislost významnější. Muži, jejichž stav je komplikován infekcí, častěji umírají na sepsi než všichni ostatní nemocní. Nalezli jsme i rozdíl mezi muži kuřáky a nekuřáky, protože muži, kteří kouří, umírají častěji. Muži, kteří měli v T0 leukocytózu nad 12 × 109/ l, měli nejčastěji hematologickou duplicitu. Průměrná hladina S_alb. byla 34 g/ l. Hodnota S_ alb. ≤ 32 g/ l významně koreluje s vyšším úbytkem hmotnosti nad 15 % v T0 a delší stagnací hmotnosti do nástupu stabilizovaného vzestupu hmotnosti – do T24 při celkově nižším BMI ≤ 24 a častějším výskytem infekčních komplikací v T12 – T24. Tato hypalbuminemie je nejčastějším nálezem ve skupině bez PEG a u mužů kuřáků. Je spojena s častějšími infekčními komplikacemi a delší rehospitalizací (nad 21 dnů/rok). Nádorová kachexie snižuje toleranci nemocných k onkologické léčbě. Nemocní s malnutricí a vstupní hypalbuminemií (S_alb. ≤ 30) vykazovali nejvyšší počet komplikací, nejčastější nutnost přerušení onkologické léčby a nejvyšší vzestup v CSS. Jejich QOL byla signifikantně nižší než v ostatních skupinách (C-30 i HN-35) a korelovala se sníženým KPS. Od T12 je v této skupině nemocných progrese nádorového onemocnění u 63 %. U nemocných bez takto významné hypalbuminemie jsme takto významný trend k progresi onkologického onemocnění nenašli.
Diskuze
Dlouhodobé sledování nutričního stavu nemocných cestou nutriční ambulance přineslo řadu podnětů ke zlepšení pozornosti v přístupu k nemocným s HNC. Měli jsme příležitost sledovat vývoj mnoha parametrů a s analýzou složitých datových matic hledat klinicky významné vztahy a vazby. Za klíčové rozhodnutí považujeme doplnění metabolické léčby dlouhodobou dispenzární péčí s monitorováním QOL nemocných. Informace se staly podkladem pro cílenější a lepší intervenci obtíží nemocných, i když daný problém nebyl vždy v centru nosného zájmu příslušné specializované ambulance. Díky užitým nástrojům, které byly časově nesmírně náročné, jsme získali nejen velmi důležité aktuální subjektivní informace, ale zejména současně i možnost sledovat jejich vývoj v čase. Zlepšila se komunikace mezi nemocným a odborníkem, zlepšila se vzájemná důvěra a spolupráce, zlepšilo se porozumění na obou stranách, které není vždy úplně dobře schůdné, zlepšila se i komunikace s rodinami. Nemocní profitovali z komplexnější a cíleně směřované péče, která zajistila nebo kompenzovala jejich aktuální potřeby či handicapy (rehabilitační a rekondiční péče, stomatologická péče a ošetření, logopedie a ORL, dermatologická péče, interní sledování) v koordinaci s terénní sociální a pečovatelskou službou, která včasně zajišťovala podporu nemocných podle vývoje stavu. Celkově se zlepšilo vnímání významu QOL v jednotlivých aspektech denního života nemocného s možností adekvátní psychologické nebo psychiatrické intervence či farmakologické podpory. Významně jsme ovlivnili aspekty bolesti, protože i tyto informace byly rovněž zahrnuty užívanými nástroji a naše informace se i v tomto duchu lépe objektivizovaly. S poklesem vjemů bolesti významně koreluje nejen spotřeba analgetik, ale i efekt zavedené antidepresivní medikace, kterou jsme pečlivě monitorovali. Cílem našeho sledování nebylo tedy jen vedení nutriční intervence, ale snaha o kompletní péči v rámci multioborové spolupráce a to se nám zdařilo. Jistě jsme si vědomi, že neovlivníme progresi nádorového onemocnění nebo individuální toleranci onkologické léčby či komorbidity nemocného, ale s ohledem na výstupní informace jsme potvrdili, že i stávající péči lze zlepšovat dílčími kroky, které jsou schopné zlepšit celkový stav nemocného člověka. A pokud nebude schopen onkolog dosáhnout plného vyléčení nemocného, tak můžeme co nejdříve intervenovat zlepšitelné aspekty života, který byť by končil, může být alespoň kvalitně ošetřen, může být bez bolesti a bez nedostatečně řešených psychotraumat duše i těla nemocného člověka.
Z našeho souboru přežilo tříleté sledování celkem 185 nemocných (26 %) a zemřelo 88 % nemocných. Porovnáním sledovaných parametrů navzájem a s proměnnými faktory v čase jsme prokázali významné závislosti většiny sledovaných parametrů, které mají kauzální vztah v čase (hmotnost, váhový úbytek, BMI, CSS, KPS, CCI, QOL C-30, QOL HN-35, CRP a S_alb.). Zaznamenali jsme zhoršení funkční i psychické výkonnosti po užití všech modalit onkologické léčby, stejně jako sledování Silanderové et al [64]. Nicméně výsledky ukazují na přínos nutriční péče, včetně výhodnosti zavedení PEG. Nepopiratelný fakt, že onkologicky nemocný člověk zůstává nemocným i po úspěšně ukončené onkologické léčbě, vysvětlují metabolicky, imunologicky i jinak podmíněná náročná a obtížná rekonvalescence. I z tohoto důvodu musíme souhlasit s výsledky práce So et al [65], kteří doporučují častější kontroly nemocných v delší perspektivě, než jsou dva roky – nejen onkologem, ale i dalšími specialisty. V duchu našich výsledků se shodujeme na vhodnosti trvání nutriční dispenzarizace společně se sledováním QOL po dobu nejméně tří let. Obdobné doporučení zvažovali ve své práci i Bozzetti et al [68], byť nestudovali přímo problematiku HNC, ale nádorová onemocnění obecněji. V rámci sledování QOL jsme dosáhli velice podobných výsledků jako práce Bjordala et al [73] a Silanderové et al [64], ale naším přínosem je sledování více parametrů a delší péče. Dále jsme nevztahovali QOL pouze k modalitě onkologické léčby, ale k více ukazatelům. Práce Nelke et al [66] byla zaměřena na hodnocení QOL ve vazbě na radioterapii. V naší práci jsme plně akceptovali léčbu dle ordinace onkologického specialisty a pro sledování QOL jsme přidali sledování dalších parametrů. U Silanderové et al [64] nacházíme také podobné výstupy, včetně skórování klinických symptomů (s několika výjimkami), kde je ale rovněž kontrola QOL korelována k modalitě terapie. Prokázali jsme, že negativní vliv na průběh léčby onkologického nemocného mají následující znaky: věk > 63 let, mužské pohlaví, hypofaryngeální karcinom ve stadiu III nebo IV, základní vzdělání, trvalé kouření, úbytek hmotnosti > 10 % z obvyklé hmotnosti, BMI < 21 a albumin ≤ 30 v čase T0 a neakceptování PEG. Naše sledování prokázalo, že adekvátní nutriční intervence u nemocných, kteří akceptovali PEG, zlepšuje QOL, onkologická léčba je lépe snášena a při volbě hodnocení QOL nejméně dvou aspektů – obecné zdraví (C-30) s modulem QOL pro onkologické onemocní (HN-35) – jsou výstupy přesnější a přínosnější, jak prokazuje i práce Carmacka et al [63]. V analýze zemřelých pacientů jsou další cenné odpovědi k závislosti jednotlivých mortalit na hmotnosti a BMI (graf 3). Za nezávislý rizikový faktor mortality nezávislé na rakovině (cancer-independent mortality) považujeme CCI, který přímo koreluje se zvýšením mužské úmrtnosti na kardiovaskulární komplikace současně s hyperglykemií, hypercholesterolemií a BMI > 25. Za nezávislý rizikový faktor mortality závislé na rakovině (cancer-dependent mortality) považujeme úbytek hmotnosti více než 15 %, BMI < 21 a albumin ≤ 30 v čase T0 či přetrvávající stav bez zlepšení do T6.
Graf 3. Přehled příčin smrti u nemocných podle vývoje hmotnosti a BMI. 
Závěr
QOL nemocného člověka by měla být stejně důležitá jako vlastní onkologická léčba, nutriční péče i další odborné intervence v rámci komplexního přístupu k nemocnému. Takto uchopená péče je klíčovým faktorem ovlivňujícím většinu léčebných mechanizmů, včetně informovanosti nemocného, jeho zainteresování na nemoc i léčbu, protože dochází ke zlepšení kooperace všech úrovní, lepšímu porozumění, motivaci a stimulaci nemocného i jeho rodiny a vede ke snížení stigmatizace nesmírně náročným a dlouhým léčebným režimem u život ohrožujícího onemocnění. Různé způsoby léčby nádorových onemocnění ovlivňují život nemocného ve všech aspektech života a QOL musí být jedním z klíčových výstupů veškeré poskytnuté péče.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 16. 4. 2015
Přijato: 4. 5. 2015
MUDr. Eva Malá
Ústav klinické imunologie a alergologie
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: eva.taita@seznam.cz
Zdroje
1. Zvolsky M, Nechanska B, Kralikova E. The use of diagnoses related to tobacco use in the Czech Republic. Cas Lek Cesk 2012; 151(12): 573 – 578.
2. Dusek L, Muzik J, Gelnarova E et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2010; 23(5): 311 – 324.
3. Dusek L, Muzik J, Maluskova D et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2014; 27(6): 406 – 423. doi: 10.14735/ amko2014406.
4. Chroust K, Finek J, Zemanek P et al. Experience in data management of the clinical retrospective project in Czech and Slovak oncology centres (IKARUS Project). Klin Onkol 2009; 22(4): 163 – 167.
5. Elia M, Stratton R. On the ESPEN guidelines for nutritional screening 2002. Clin Nutr 2004; 23(1): 131 – 132.
6. Fearon KC. The 2011 ESPEN Arvid Wretlind lecture: cancer cachexia: the potential impact of translational research on patient-focused outcomes. Clin Nutr 2012; 31 : 577 – 582. doi: 10.1016/ j.clnu.2012.06.012.
7. Kondrup J, Allison SP, Elia M et al. ESPEN guidelines for nutrition screening 2002. Clin Nutr 2003; 22(4): 415 – 421.
8. Lochs H, Allison SP, Meier R et al. Introductory to the ESPEN Guidelines on Enteral Nutrition: terminology, definitions and general topics. Clin Nutr 2006; 25(2): 180 – 186.
9. Meier R. Enteral feeding in tumor patients. Schweiz Med Wochenschr 1995; 125(5): 159 – 162.
10. Sobotka L, Schneider SM, Berner YN et al. ESPEN Guidelines on Parenteral Nutrition: geriatrics. Clin Nutr 2009; 28(4): 461 – 466. doi: 10.1016/ j.clnu.2009.04.004.
11. Fearon K, Strasser F, Anker SD et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol 2011; 12(5): 489 – 495. doi: 10.1016/ S1470-2045(10)70218-7.
12. Fearon K, Arends J, Baracos V. Understanding the mechanisms and treatment options in cancer cachexia. Nat Rev Clin Oncol 2013; 10(2): 90 – 99. doi: 10.1038/ nrclinonc.2012.209.
13. Fearon KC, Borland W, Preston T et al. Cancer cachexia: influence of systemic ketosis on substrate levels and nitrogen metabolism. Am J Clin Nutr 1988; 47(1): 42 – 48.
14. Jager-Wittenaar H, Dijkstra PU, Vissink A et al. Changes in nutritional status and dietary intake during and after head and neck cancer treatment. Head Neck 2011; 33(6): 863 – 870. doi: 10.1002/ hed.21546.
15. Dahlman I, Mejhert N, Linder K et al. Adipose tissue pathways involved in weight loss of cancer cachexia. Br J Cancer 2010; 102(10): 1541 – 1548. doi: 10.1038/ sj.bjc.6605665.
16. Dhanapal R, Saraswathi T, Govind RN. Cancer cachexia. J Oral Maxillofac Pathol 2011; 15(3): 257 – 260. doi: 10.4103/ 0973-029X.86670.
17. Groarke JD, Cheng S, Jones LW et al. Cancer cachexia: getting to the heart of the matter. Eur Heart J 2013; 32(4): 121–123.
18. Narsale AA, Carson JA. Role of interleukin-6 in cachexia: therapeutic implications. Curr Opin Support Palliat Care 2014; 8(4): 321 – 327. doi: 10.1097/ SPC.0000000000000091.
19. Wang H, Ye J. Regulation of energy balance by inflammation: common theme in physiology and pathology. Rev Endocr Metab Disord 2015; 16(1): 47 – 54. doi: 10.1007/ s11154-014-9306-8.
20. Malik ST. Tumour necrosis factor: roles in cancer pathophysiology. Semin Cancer Biol 1992; 3(1): 27 – 33.
21. Laviano A, Seelaender M, Rianda S et al. Neuroinflammation: a contributing factor to the pathogenesis of cancer cachexia. Crit Rev Oncog 2012; 17(3): 247 – 251.
22. Thair S, Russell JA. Noncanonical nuclear factor kappa B (NF-kappaB) signaling and potential for therapeutics in sepsis. Curr Infect Dis Rep 2013; 15(5): 364 – 371. doi: 10.1007/ s11908-013-0362-0.
23. Thair SA, Walley KR, Nakada TA et al. A single nucleotide polymorphism in NF-kappaB inducing kinase is associated with mortality in septic shock. J Immunol 2011; 186(4): 2321 – 2328. doi: 10.4049/ jimmunol.1002864.
24. Thair SA, Russell JA. Sepsis in transit: from clinical to molecular classification. Crit Care 2012; 16(6): 173. doi: 10.1186/ cc11813.
25. Tisdale MJ. Pathogenesis of cancer cachexia. J Support Oncol 2003; 1(3): 159 – 168.
26. Tisdale MJ. The cancer cachectic factor‘. Support Care Cancer 2003; 11(2): 73 – 78.
27. Tisdale MJ. Cancer cachexia. Langenbecks Arch Surg 2004; 389(4): 299 – 305.
28. Mantovani G, Maccio A, Madeddu C et al. Serum values of proinflammatory cytokines are inversely correlated with serum leptin levels in patients with advanced stage cancer at different sites. J Mol Med (Berl) 2001; 79(7): 406 – 414.
29. McMillan DC. Systemic inflammation, nutritional status and survival in patients with cancer. Curr Opin Clin Nutr Metab Care 2009; 12(3): 223 – 226. doi: 10.1097/ MCO.0b013e32832a7902.
30. Tisdale MJ. Molecular pathways leading to cancer cachexia. Physiology (Bethesda) 2005; 20 : 340 – 348.
31. Tayek JA. A review of cancer cachexia and abnormal glucose metabolism in humans with cancer. J Am Coll Nutr 1992; 11(4): 445 – 456.
32. Maddocks M, Jones LW, Wilcock A. Immunological and hormonal effects of exercise: implications for cancer cachexia. Curr Opin Support Palliat Care 2013; 7(4): 376 – 382. doi: 10.1097/ SPC.0000000000000010.
33. Briddon S, Beck SA, Tisdale MJ. Changes in activity of lipoprotein lipase, plasma free fatty acids and triglycerides with weight loss in a cachexia model. Cancer Lett 1991; 57(1): 49 – 53.
34. Vaughan VC, Martin P, Lewandowski PA. Cancer cachexia: impact, mechanisms and emerging treatments. J Cachexia Sarcopenia Muscle 2013; 4(2): 95 – 109. doi: 10.1007/ s13539-012-0087-1.
35. Takahashi M, Terashima M, Takagane A et al. Ghrelin and leptin levels in cachectic patients with cancer of the digestive organs. Int J Clin Oncol 2009; 14(4): 315 – 320. doi: 10.1007/ s10147-008-0856-1.
36. Bossola M. Nutritional interventions in head and neck cancer patients undergoing chemoradiotherapy: a narrative review. Nutrients 2015; 7(1): 265 – 276. doi: 10.3390/ nu7010265.
37. Bozzetti F. Nutritional support of the oncology patient. Crit Rev Oncol Hematol 2013; 87(2): 172 – 200. doi: 10.1016/ j.critrevonc.2013.03.006.
38. Cacicedo J, Casquero F, Martinez-Indart L et al. A prospective analysis of factors that influence weight loss in patients undergoing radiotherapy. Chin J Cancer 2014; 33(4): 204 – 210. doi: 10.5732/ cjc.013.10009.
39. Giacosa A, Frascio F, Sukkar SG et al. Food intake and body composition in cancer cachexia. Nutrition 1996; 12 (Suppl 1): S20 – S23.
40. Khatami M. Unresolved inflammation: ‚immune tsunami‘ or erosion of integrity in immune-privileged and immune-responsive tissues and acute and chronic inflammatory diseases or cancer. Expert Opin Biol Ther 2011; 11(11): 1419 – 1432. doi: 10.1517/ 14712598.2011.592826.
41. Martin L, Birdsell L, Macdonald N et al. Cancer cachexia in the age of obesity: skeletal muscle depletion is a powerful prognostic factor, independent of body mass index. J Clin Oncol 2013; 31(12): 1539 – 1547. doi: 10.1200/ JCO.2012.45.2722.
42. Vassilopoulos PP, Filopoulos E, Kelessis N et al. Competent gastrostomy for patients with head and neck cancer. Support Care Cancer 1998; 6(5): 479 – 481.
43. van Bokhorst-De van der Schuer MA, von Blomberg-van der Flier BM, Riezebos RK et al. Differences in immune status between well-nourished and malnourished head and neck cancer patients. Clin Nutr 1998; 17(3): 107 – 111.
44. Takenaka Y, Takemoto N, Nakahara S et al. Prognostic significance of body mass index before treatment for head and neck cancer. Head Neck 2014. doi: 10.1002/ hed.23785.
45. Arends J, Bodoky G, Bozzetti F et al. ESPEN Guidelines on enteral nutrition: non-surgical oncology. Clin Nutr 2006; 25(2): 245 – 259.
46. Loser C, Aschl G, Hebuterne X et al. ESPEN guidelines on artificial enteral nutrition – percutaneous endoscopic gastrostomy (PEG). Clin Nutr 2005; 24(5): 848 – 861.
47. Lee JH, Machtay M, Unger LD et al. Prophylactic gastrostomy tubes in patients undergoing intensive irradiation for cancer of the head and neck. Arch Otolaryngol Head Neck Surg 1998; 124(8): 871 – 875.
48. Nicholl MB, Lyons DA, Wheeler AA et al. Repeat PEG placement is safe for head and neck cancer patients. Am J Otolaryngol 2014; 35(2): 89 – 92. doi: 10.1016/ j.amjoto.2013.12.001.
49. Raykher A, Correa L, Russo L et al. The role of pretreatment percutaneous endoscopic gastrostomy in facilitating therapy of head and neck cancer and optimizing the body mass index of the obese patient. JPEN J Parenter Enteral Nutr 2009; 33(4): 404 – 410. doi: 10.1177/ 0148607108327525.
50. Reilly JJ. Does nutrition management benefit the head and neck cancer patient? Oncology (Williston Park) 1990; 4(6): 105 – 115.
51. Schutz T, Valentini L, Herbst B et al. ESPEN guidelines on enteral nutrition – summary. Z Gastroenterol 2006; 44(8): 683 – 684.
52. Schutz T, Herbst B, Koller M. Methodology for the development of the ESPEN Guidelines on Enteral Nutrition. Clin Nutr 2006; 25(2): 203 – 209.
53. Pai PC, Chuang CC, Tseng CK et al. Impact of pretreatment body mass index on patients with head-and-neck cancer treated with radiation. Int J Radiat Oncol Biol Phys 2012; 83(1): e93 – e100. doi: 10.1016/ j.ijrobp.2011.11.071.
54. Ravasco P, Monteiro-Grillo I, Marques VP et al. Quality of life in gastrointestinal cancer: what is the impact of nutrition? Acta Med Port 2006; 19(3): 189 – 196.
55. van Bokhorst-de van der Schuer, van Leeuwen PA, Kuik DJ et al. The impact of nutritional status on the prognoses of patients with advanced head and neck cancer. Cancer 1999; 86(3): 519 – 527.
56. Charlson M, Szatrowski TP, Peterson J et al. Validation of a combined comorbidity index. J Clin Epidemiol 1994; 47(11): 1245 – 1251.
57. Charlson M, Wells MT, Ullman R et al. The Charlson comorbidity index can be used prospectively to identify patients who will incur high future costs. PLoS One 2014; 9(12): e112479. doi: 10.1371/ journal.pone.0112479.
58. Karnofsky DA, Ellison RR, Golbey RB. Selection of patients for evaluation of chemotherapeutic procedures in advanced cancer. J Chronic Dis 1962; 15 : 243 – 249.
59. Orell-Kotikangas H, Osterlund P, Saarilahti K et al. NRS-2002 for pre-treatment nutritional risk screening and nutritional status assessment in head and neck cancer patients. Support Care Cancer 2015; 23(6): 1495 – 1502. doi: 10.1007/ s00520-014-2500-0.
60. Bozzetti F. Nutritional support in oncologic patients: where we are and where we are going. Clin Nutr 2011; 30(6): 714 – 717. doi: 10.1016/ j.clnu.2011.06.011.
61. Iro H, Fietkau R, Kolb S et al. Nutrition of ENT tumor patients treated with radiotherapy. Comparison of oral and enteral nutrition using percutaneous gastrostomy. HNO 1989; 37(8): 343 – 348.
62. Iwasaki T, Ohyanagi H. Advance and perspective of clinical nutrition. Nihon Geka Gakkai Zasshi 2004; 105(2): 196 – 199.
63. Carmack CL, Basen-Engquist K, Gritz ER. Survivors at higher risk for adverse late outcomes due to psychosocial and behavioral risk factors. Cancer Epidemiol Biomarkers Prev 2011; 20(10): 2068 – 2077. doi: 10.1158/ 1055-9965.EPI-11-0627.
64. Silander E, Nyman J, Bove M et al. Impact of prophylactic percutaneous endoscopic gastrostomy on malnutrition and quality of life in patients with head and neck cancer: a randomized study. Head Neck 2012; 34(1): 1 – 9. doi: 10.1002/ hed.21700.
65. So WK, Chan RJ, Chan DN et al. Quality-of-life among head and neck cancer survivors at one year after treatment – a systematic review. Eur J Cancer 2012; 48(15): 2391 – 2408. doi: 10.1016/ j.ejca.2012.04.005.
66. Nelke KH, Pawlak W, Gerber H et al. Head and neck cancer patients‘ quality of life. Adv Clin Exp Med 2014; 23(6): 1019 – 1027. doi: 10.17219/ acem/ 37361.
67. Aaronson NK, Ahmedzai S, Bergman B et al. The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 1993; 85(5): 365 – 376.
68. Bozzetti F. Quality of life and enteral nutrition. Curr Opin Clin Nutr Metab Care 2008; 11(5): 661 – 665. doi: 10.1097/ MCO.0b013e32830a7099.
69. Petruson KM, Silander EM, Hammerlid EB. Quality of life as predictor of weight loss in patients with head and neck cancer. Head Neck 2005; 27(4): 302 – 310.
70. Sat-Munoz D, Moran MA, Solano-Murillo P et al. EORTC QLQ-C30 questionnaire role as predictor for malnutrition risk in head and neck cancer Mexican patients. Nutr Hosp 2012; 27(2): 477 – 482. doi: 10.1590/ S0212-16112012000200019.
71. Aaronson NK. Methodologic issues in assessing the quality of life of cancer patients. Cancer 1991; 67 (Suppl 3):844 – 850.
72. Aaronson NK, Snyder C. Using patient-reported outcomes in clinical practice: proceedings of an International Society of Quality of Life Research conference. Qual Life Res 2008; 17(10): 1295. doi: 10.1007/ s11136-008-9422-6.
73. Bjordal K, Hammerlid E, Ahlner-Elmqvist M et al. Quality of life in head and neck cancer patients: validation of the European Organization for Research and Treatment of Cancer Quality of Life Questionnaire-H&N35. J Clin Oncol 1999; 17(3): 1008 – 1019.
74. Laviano A, Renvyle T, Yang ZJ. From laboratory to bedside: new strategies in the treatment of malnutrition in cancer patients. Nutrition 1996; 12(2): 112 – 122.
75. Onesti JK, Guttridge DC. Inflammation based regulation of cancer cachexia. Biomed Res Int 2014; 2014 : 168407. doi: 10.1155/ 2014/ 168407.
76. Unal D, Orhan O, Eroglu C et al. Prealbumin is a more sensitive marker than albumin to assess the nutritional status in patients undergoing radiotherapy for head and neck cancer. Contemp Oncol (Pozn) 2013; 17(3): 276 – 280. doi: 10.5114/ wo.2013.35281.
77. Senior K. Why is progress in treatment of cancer cachexia so slow? Lancet Oncol 2007; 8(8): 671 – 672.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tiskuČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCI
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Role výzkumných infrastruktur v onkologii
- Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
- Časná integrace paliativní péče do standardní onkologické péče – benefit, limitace, bariéry a druhy paliativní péče
- Anxio-depresívny syndróm v onkológii – biopsychosociálny model suportívnej terapie
- Nádorová hypoxia – molekulárne mechanizmy a klinický význam
- Vplyv frakcionovaného ožiarenia na hipokampus v experimentálnom modeli
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Dlouhodobé sledování nutričního, klinického stavu a kvality života u nemocných s rakovinou hlavy a krku
- Extrémně vzácný případ trichocellulární leukemie u pacientky se sarkoidózou
- Informace z České onkologické společnosti
- Podávání kontinuálních infuzí cytostatik pomocí elastomerických infuzorů
-
Domácí parenterální výživa v onkologii
Díl 3 – Mobilní režim domácí parenterální výživy - Aktuality z odborného tisku
- Kongenitální naevus – někdy neprávem opomíjené riziko
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Podávání kontinuálních infuzí cytostatik pomocí elastomerických infuzorů
- Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
- Nádorová hypoxia – molekulárne mechanizmy a klinický význam
- Anxio-depresívny syndróm v onkológii – biopsychosociálny model suportívnej terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



