-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaČasná integrace paliativní péče do standardní onkologické péče – benefit, limitace, bariéry a druhy paliativní péče
Early Integration of Palliative Care into Standard Oncology Care – Benefits, Limitations, Barriers and Types of Palliative Care
Patients with advanced cancer experience a significant number of physical symptoms and psychological distress, which worsen their quality of life (QOL). Palliative care is oriented to prevent and relieve suffering and promote QOL of patients with advanced cancer. In oncology, the role of palliative care is traditionally perceived to be the treatment after the antineoplastic therapy is finished. A concept of early integration of palliative care into standard oncology practice has been recently introduced. There is a lot of data supporting this concept of parallel application of both oncology care and palliative care. Early palliative care has been shown to provide benefits in QOL, mood, symptoms, health care utilization and survival. In this review, we summarize published data about benefits and difficulties of early palliative care. We also discuss the model of general and specialized palliative care integrated into oncological practice, their differences and consequences.
Key words:
palliative care – supportive care – oncology – advanced cancer – survival – quality of life
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
3. 9. 2014Accepted:
14. 3. 2015
Autoři: M. Sochor 1; O. Sláma 2; M. Loučka 3
Působiště autorů: Komplexní onkologické centrum, Krajská nemocnice Liberec, a. s. 1; Ambulance podpůrné a paliativní péče, Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 2; Centrum paliativní péče, Praha 3
Vyšlo v časopise: Klin Onkol 2015; 28(3): 171-176
Kategorie: Přehledy
doi: https://doi.org/10.14735/amko2015171Souhrn
Pacienti s pokročilými nádory trpí řadou tělesných symptomů a psychickým distresem, které negativně ovlivňují kvalitu života (quality of life – QOL). Paliativní péče je orientována na prevenci a léčbu utrpení a zlepšení QOL pacientů s pokročilým nevyléčitelným onemocněním. V onkologii je tradičně vnímána jako léčba po ukončení protinádorové terapie. V posledních letech se stále více rozvíjí koncept časné integrace paliativní péče do standardní onkologické praxe. V literatuře existuje množství dat podporujících koncept současné aplikace paliativní a onkologické péče. Časná integrace paliativní péče prokázala benefit v oblasti QOL, nálady, symptomů, čerpání zdravotní péče a celkového přežití. V přehledovém článku shrnujeme publikovaná data o přínosu a úskalích časné integrace paliativní péče. Dále je zmíněn model obecné a specializované paliativní péče integrovaný do onkologické praxe, jejich rozdíly a konsekvence.
Klíčová slova:
paliativní péče – podpůrná péče – onkologie – pokročilé nádory – přežití – kvalita životaÚvod
Paliativní péče (palliative care – PC) je v onkologii tradičně chápána jako přístup, který je indikován v pozdních stadiích nemoci po ukončení protinádorové terapie. V posledním desetiletí však vzrůstá evidence o pozitivním vlivu časného zahájení PC současně se standardní onkologickou léčbou (early integration of palliative care – EPC) [1]. Dochází tak k posunu ve významu a vnímání konceptu PC. PC začíná být chápána jako důsledná prevence a léčba všech symptomů ovlivňujících kvalitu života (quality of life – QOL) a utrpení, a to po celou dobu života s nevyléčitelnou nemocí, v průběhu protinádorové léčby i po jejím ukončení. Bylo publikováno několik studií, které prokázaly, že EPC vede ke zlepšení QOL, lepší kontrole symptomů, racionálnějšímu čerpání zdravotní péče a prodloužení života v lepší kvalitě [2]. EPC má pozitivní vliv i na pacientovy blízké a pečující. Náš přehledový článek shrnuje data o časné integraci PC do onkologie a promýšlí způsoby, jak zlepšit dostupnost PC v onkologické praxi.
Důvody pro integraci PC do onkologie (tab. 1)
Bolest a ostatní tělesné symptomy jsou významnou determinantou QOL. Z dostupných studií vyplývá, že léčba bolesti a ostatních symptomů není, i přes současné možnosti, dostatečná a velká čast onkologických pacientů zbytečně trpí [3,4]. Vedle tělesných symptomů je QOL ovlivněna také psychickými symptomy a chorobami. Do komplexního pojetí dále musíme zahrnout sociální, spirituální a existenciální faktory [5]. Všechny tyto složky poté formují prožívání života s nevyléčitelnou nemocí a vyrovnání se s touto situací (coping). Pro psychické symptomy platí podobné zásady jako pro symptomy tělesné. Adekvátní léčba všech symptomů a složek utrpení vyžaduje správné hodnocení, dostatek času a zkušeností. Zásadně důležitým faktorem pro stanovení plánu PC je pacientovo správné pochopení vlastního zdravotního stavu, tedy diagnózy, předpokládané prognózy a možného přínosu a rizik protinádorové léčby. Řada studií naznačuje, že onkologové v rutinní praxi své pacienty o předpokládané prognóze neinformují nebo odhad délky přežití a přínosu protinádorové léčby výrazně nadhodnocují [6 – 9]. Důvodem může být snaha pacienta pozitivně namotivovat k onkologické léčbě a minimalizovat traumatický dopad nepříznivé prognostické informace na pacienta a jeho rodinu.
Tab. 1. Možné vztahy mezi intervencemi časné PC a klinickými výsledky. 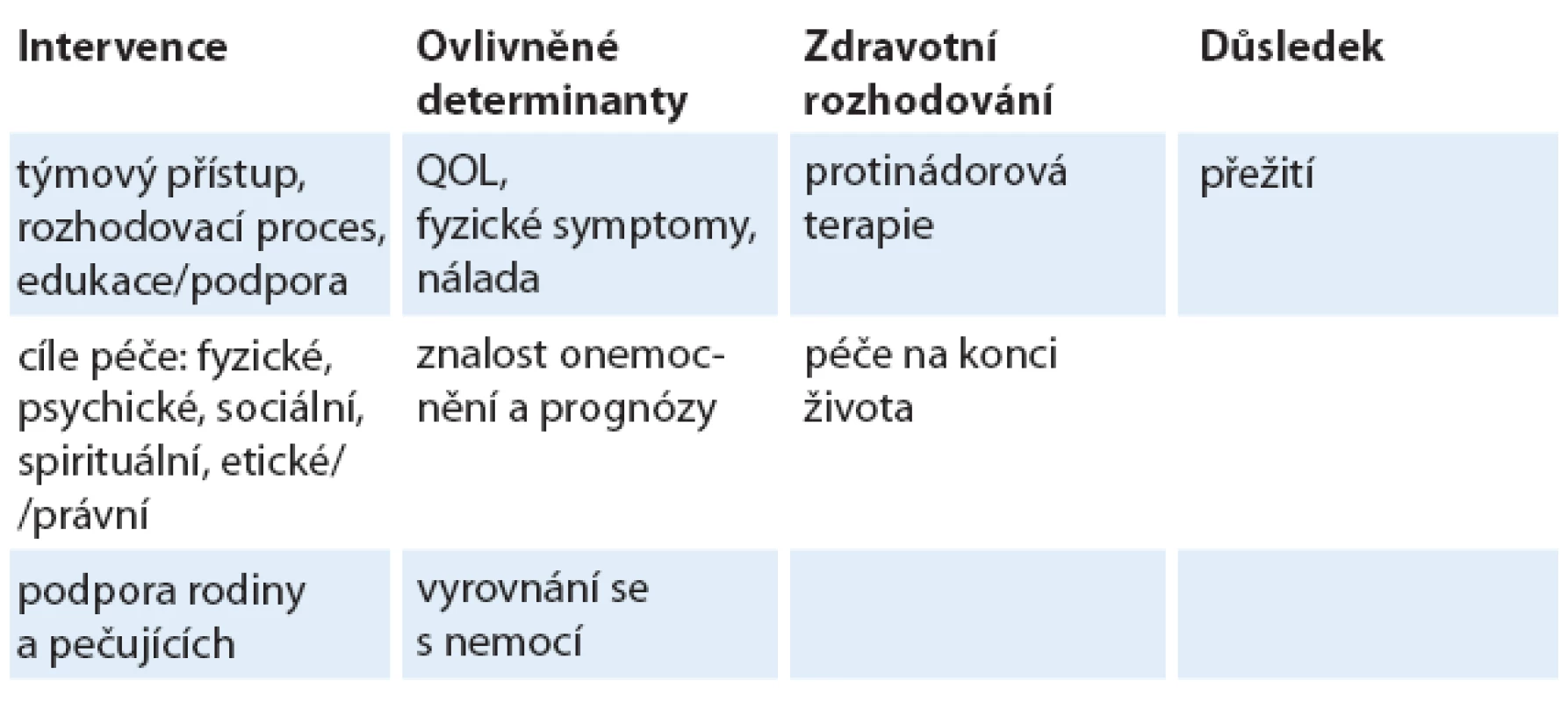
PC – paliativní péče, QOL – kvalita života Z výše uvedného vyplývá, že úroveň komunikace o diagnóze a prognóze, kvalita léčby tělesných symptomů a úroveň psychické a sociální podpory, které jsou pacientům poskytovány v rámci rutinní onkologické péče, často nejsou optimální. Příčinou mohou být nedostatečné znalosti a praktické dovednosti, nedostatek času, nedostupnost ostatních nelékařských profesí (např. psychologa nebo pastoračního pracovníka) a nízká priorita, která je otázkám PC ze strany klinických onkologů věnována. Větší integrace PC do standardní onkologické péče je pokusem, jak tyto překážky překonat.
Publikovaná data o přínosu časného zapojení PC (tab. 2)
V posledních letech bylo publikováno několik prospektivních randomizovaných studií s kvalitní metodologií a statistickou silou k průkazu benefitu EPC. Za nejvýznamnější považujeme studie Temelové, Bakitase a Zimmermannové [10 – 12].
Tab. 2. Publikované studie o časné PC spolu se standardní péčí. 
JIP – jednotka intenzivní péče, PC – paliativní péče, QOL – kvalita života Studie Bakitase et al [11] byla první prospektivní randomizovanou studií provedenou na výlučně onkologické populaci s propracovanou a kvalitní metodologií. Projekt nazvaný ENABLE (Education, Nurture, Advice, Before Life Ends) randomizoval 312 pacientů s metastatickými nádory k běžné péči a běžné péči kombinované s paliativní intervencí vedené sestrami specialistkami. V rámci paliativní intervence vedly sestry telefonické rozhovory zaměřené na edukaci a řešení problémů vztahujících se ke komunikaci, sociální podpoře, symptomům a plánování péče na konci života. Pacienti a pečující byli následně zváni k měsíčním návštěvám u paliativního specialisty. Studie prokázala vyšší QOL (p = 0,02), nižší intenzitu symptomů (p = 0,06) a sníženou depresivitu (p = 0,02) v paliativní oproti kontrolní skupině. V intervenční skupině byl také zaznamenán nesignifikantní trend k prodloužení přežití (14 vs. 8,5 měsíce, p = 0,14).
Temelová et al [10] randomizovali pacienty s metastatickým nemalobuněčným karcinomem plic (non small cell lung cancer – NSCLC) k běžné péči a běžné péči s časnou specializovanou PC. Do studie bylo zařazeno 151 pacientů. Po 12 týdnech měli pacienti s EPC signifikantně lepší QOL (p = 0,03), byli méně depresivní a měli lepší náladu (p = 0,01). Pacienti v EPC skupině lépe porozuměli prognóze a volili méně častěji chemoterapii na konci života (9 vs. 50 %, p = 0,02), faktor, který může být zodpovědný za delší přežití. I přes menší agresivitu péče (p = 0,05) bylo přežití v intervenční skupině delší (11,6 vs. 8,9 měsíce, p = 0,02). Tato studie prokázala významný přínos EPC, kdy i přes nižší agresivitu léčby měli pacienti delší přežití při zachování vyšší QOL a lepší náladě. Předchozí data ukazují na to, že QOL a depresivita jsou nezávislé prediktory přežití u pacientů s NSCLC [13,14].
Studie Zimmermannové et al byla clusterová randomizovaná studie u pacientů s pokročilými malignitami různého původu (plicní, gastrointestinální, prsou, genitourinární a gynekologické) [12]. Jednalo se o pacienty s předpokládanou délkou života mezi 6 a 24 měsíci a randomizováni byli poměrem 1 : 1 do standardní onkologické péče anebo k péči paliativním týmem. Byly hodnoceny: QOL, symptomy, spokojenost s péčí vstupně a poté měsíčně po dobu čtyř měsíců. Primárním výsledkem bylo hodnocení změn QOL měřené tři měsíce od randomizace. Sekundárním výsledkem byla potom změna QOL ve čtyřech měsících od randomizace a ostatních parametrů ve třech a čtyřech měsících. Do studie bylo zařazeno 461 pacientů, celkem 393 z nich vyplnilo alespoň jeden kontrolní dotazník. Ve třech měsících od randomizace byl patrný nesignifikantní trend ke zlepšení QOL (p = 0,07) a signifikantní změna v QOL na jeho konci (p = 0,05) a spokojenosti s léčbou (p = 0,0003) ve prospěch paliativní skupiny. Symptomy nevykazovaly ve třech měsících změnu. Ve čtyřech měsících byl signifikantní rozdíl ve zlepšení všech parametrů ve prospěch paliativní skupiny.
Ke zhodnocení evidence o přínosu EPC bylo v posledních letech publikováno několik metaanalýz, které svými výsledky podpořily koncept EPC. Publikované studie, jejich metaanalýzy a přehledy prokázaly aplikovatelnost PC spolu se standardní onkologickou léčbou. Časné zařazení specializované PC vedlo ke zlepšení parametrů QOL, symptomů, spokojenosti pacientů a rodin, optimalizaci protinádorové terapie a menší agresivitě péče na konci života, celkovému snížení nákladů na léčbu a prodloužení přežití [15 – 17].
Vzrůstající evidence o benefitu EPC vede k její podpoře celou řadou národních a mezinárodních onkologických společností (např. ČOS, ASCO, ESMO, AIOM) [18 – 21]. Současně však vyvstává potřeba specifikace cílové skupiny pacientů a charakteru intervencí, ze kterých mají pacienti skutečný benefit. Na žádost ASCO provedl National Cancer Institute (NCI) zhodnocení studie Temelové et al [11] a dalších studií [22 – 26]. Autoři zdůraznili, že benefit EPC byl prokázán zatím pouze pro konkrétní skupiny pacientů (ve studii Temelové et al se jednalo o pokročilé stadium karcinomu plic) a je potřeba dalšího výzkumu pro ověření přínosu tohoto přístupu pro další skupiny, diagnózy a stadia onkologických onemocnění [27].
Obecná a specializovaná PC a možnosti jejich integrace do onkologické praxe (tab. 3)
Podle komplexnosti intervencí bývá PC dělena na dvě úrovně – obecnou a specializovanou [28,29]. Obecná PC je poskytována ošetřujícím lékařem, onkologem [30 – 32]. Onkolog by měl být schopen hodnotit a léčit nejčastější tělesné symptomy, s pacientem hovořit o prognóze a cílech léčby a v případě potřeby efektivně zprostředkovat psychologickou, sociální a spirituální péči. Obecná PC by měla být součástí vzdělání a praxe klinického a radiačního onkologa. Návyky a zkušenosti jsou při dobře vedeném vzdělávání získatelné a naučitelné [33,34]. Pomáhají k tomu i dobře vedená a propracovaná doporučení a guidelines [35,36].
Tab. 3. Náplň činností obecné a specializované PC. 
Specializovaná PC je poskytována specialistou v oboru paliativní medicína (paliatrem) a multidisciplinárním týmem, jehož členové jsou v oblasti PC speciálně vzděláni. Specializovaná PC by měla být dostupná pacientům, u kterých se nedaří při dobře aplikované obecné PC dosáhnout efektivního zmírnění jejich obtíží. Je určena např. pro pacienty s refrakterními symptomy, složitými a komplexními syndromy deprese, úzkosti a existenciálního distresu. V ideálním případě by měl být paliativní specialista konzultován u všech pacientů s pokročilým onemocněním. Po vstupním vyšetření a zhodnocení by byl stanoven plán komplexní onkologické PC a pacient by byl dále veden ošetřujícím onkologem nebo onkologem ve spolupráci s paliativním specialistou. To ovšem v současné době naráží na nedostatečnou dostupnost paliativních specialistů. Pokud je pacient léčen a sledován zároveň onkologem a paliativním specialistou, klade to velké nároky na dobrou koordinaci spolupráce mezi jednotlivými specialisty.
Bylo navrženo několik modelů spolupráce pro ambulantní a hospitalizační péči (tab. 4.) [37 – 40]. Zjednodušeně lze charakterizovat tři základní formy spolupráce: model plné nezávislosti obou specializací, model častečného personálního a prostorového prolnutí a konečně plná integrace onkologie a PC. Každý model má své výhody a omezení. Modely oddělených specialistů jsou obecně pro pacienta nejnáročnější. Je nutných více návštěv různých specialistů, v různých časech a na různých místech (např. odlišných odděleních). To může být u pacientů v celkově špatném stavu velmi zatěžující a někdy logisticky zcela nereálné. Model částečné integrace představuje přechod mezi plnou integrací a oddělenými specializacemi. Většinou se jedná o částečné prostorové a personální propojení paliativních specialistů a onkologů. Může poskytovat výhody, ale jeho úspěch bude vždy záležet na tom, jak se podaří zkoordinovat péči mezi jednotlivými specialisty. Jako optimální model pro onkologii se jeví model integrovaný, kdy koordinace mezi specializacemi je nejjednodušší a pacient může být zhodnocen současně více specialisty na jednom místě a v jednom čase. Stanoví se komplexní plán péče a ten je upravován podle vývoje pacientova stavu.
Tab. 4. Modely simultánní aplikace onkologické léčby a PC. 
PC – paliativní péče Spolupráce různých specializací je vždy náročná. Je nutná pokora a vnímání pohledu jiných odborníků, jejich možností a schopností. Spolupráce mezi onkologem a paliativním specialistou může být, pokud se dobře nastaví a funguje, velmi efektivní a přínosná pro pacienta i jeho rodinu. Tento způsob spolupráce je však pozitivní i pro lékaře základního oboru. Onkologové se mohou z doporučení a postupů paliativních specialistů poučit a získat tak lepší dovednosti pro obecnou PC.
Bariéry časné integrace PC a možnosti jejich překonání
Bariér, které brání včasnému zařazení PC k protinádorové terapii, je několik [41,42]. Bariéra hlavní a nejpodstatnější je vlastní vnímání PC jako péče nastupující až ke konci života a realizované až po ukončení protinádorové terapie [43]. Druhá důležitá bariéra je vnímání vlastních schopností v podpůrné a PC mezi onkology. Obecně je podle různých dotazníkových přehledů mezi onkology vysoké přesvědčení o vlastních schopnostech řešení různých symptomů. Pokud se ovšem do přehledů a dotazníků zařadily konkrétní otázky na řešení klinických situací, bylo zjištěno, že úroveň znalostí a léčebného rozhodování není optimální. Zajímavé je srovnání dvou přehledových studií, které byly publikovány v rozmezí přibližně 20 let a které neprokázaly výrazné zlepšení symptomové kontroly v onkologické komunitě i přes rozšíření lékového portfolia a jeho dostupnosti [3,4].
Reálnou překážkou je malá dostupnost paliativních specialistů na onkologických pracovištích. Nejenom lékařů, ale i sester, psychologů, sociálních pracovníků a dalších.
Další možná bariéra, která ovlivňuje odeslání pacientů k včasné PC, jsou obavy lékařů z negativních konotací spojených s konceptem PC ze strany pacientů a jejich rodin. Podle celé řady studií je opak pravdou. Pokud pacienti s nevyléčitelnými nádory znají svou prognózu, lze při včasné a dobře vedené psychosociální podpoře vést pacienta po celou dobu nemoci. Dochází k lepší adherenci k terapii, lepšímu rozhodování o další léčbě, zvláště v posledních týdnech a měsících života a pacienti vykazují lepší psychický stav [44].
Hlavním faktorem v překonání výše uvedených bariér se jeví zlepšení vzdělávání v PC. Na úrovni pregraduálního vzdělávání je patrná nízká znalost studentů o možnostech a zaměření PC. Většina zemí s dobře propracovanou PC v současnosti do studijního kurikula všeobecného lékařství zařazuje povinné bloky v paliativní medicíně. V postgraduálním vzdělávání se jedná o větší přísun informací o PC ve všech základních oborech a další rozvoj specializovaného vzdělávání v oboru Paliativní medicína.
Shrnutí a perspektivy budoucího vývoje
Dostupné studie prokázaly benefit EPC pro pacienta i jeho blízké. Studie, které nabízely komplexní týmové přístupy s přímým vlivem na pacienta, prokázaly nejlepší výsledky a benefit. Budoucí studie EPC by měly mít dostatečně velké soubory a kvalitní metodologii, aby odpověděly na otázku, které parametry intervencí přinášejí klinický benefit, jaké diagnózy a stadia choroby skutečně profitují z EPC. Poskytování PC od stanovení diagnózy nevyléčitelného onemocnění současně s protinádorovou léčbou a dále po jejím ukončení představuje v kontextu onkologie významnou inovaci. Tento přístup zcela zapadá do konceptu individulizované onkologické péče, ve které se pozornost přesouvá od zaměření na nemoc k orientaci na pacienta [20].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 3. 9. 2014
Přijato: 14. 3. 2015
MUDr. Marek Sochor
Komplexní onkologické centrum
Krajská nemocnice Liberec, a. s.
Husova 10
460 63 Liberec
e-mail: sochor.marek73@gmail.com
Zdroje
1. Gaertner J, Wolf J, Voltz R. Early palliative care for patients with metastatic cancer. Curr Opin Oncol 2012; 24(4): 357 – 362. doi: 10.1097/ CCO.0b013e328352ea20.
2. Parikh RB, Kirch RA, Smith TJ et al. Early specialty palliative care – translating data in oncology practice. N Engl J Med 2013; 369(24): 2347 – 2351. doi: 10.1056/ NEJMsb1305469.
3. Von Roenn JH, Cleeland CS, Gonin R et al. Physician attitudes and practice in cancer pain management. A survey from the Eastern Cooperative Oncology Group. Ann Intern Med 1993; 119(2): 121 – 126.
4. Breuer B, Fleishman SB, Cruciani SA et al. Medical oncologists’ attitudes and practice in cancer pain management: a national survey. J Clin Oncol 2011; 29(36): 4769 – 4775. doi: 10.1200/ JCO.2011.35.0561.
5. Balboni TA, Paulk ME, Balboni MJ et al. Provision of spiritual care to patients with advanced cancer: associations with medical care and quality of life near death. J Clin Oncol 2010; 28(3): 445 – 452. doi: 10.1200/ JCO.2009.24.8005.
6. Mack JW, Wolfe J, Cook EF et al. Hope and prognostic disclosure. J Clin Oncol 2007; 25(35): 5636 – 5642.
7. Wright AA, Zhang B, Ray A et al. Associations between end-of-life discussions: patient mental health, medical care near death, and caregiver bereavement adjustments. JAMA 2008; 300(14): 1665 – 1673. doi: 10.1001/ jama.300.14.1665.
8. Weeks JC, Catalano PJ, Cronin A et al. Patients’ expectations about effects of chemotherapy for advanced cancer. N Engl J Med 2012; 367(17): 1616 – 1625. doi: 10.1056/ NEJMoa1204410.
9. Mack JW, Weeks JC, Wright AA et al. End-of-life discussions, goal attainment, and distress at the end of life: predictors and outcomes of receipt of care constistent with preferences. J Clin Oncol 2010; 28(7): 1203 – 1208. doi: 10.1200/ JCO.2009.25.4672.
10. Temel JS, Greer JA, Muzikansky A et al. Early palliative care for patients with metastatic non-small-cell lung cancer. N Engl J Med 2010; 363(8): 733 – 742. doi: 10.1056/ NEJMoa1000678.
11. Bakitas M, Lyons KD, Hegel MT et al. Effects of a palliative care intervention on clinical outcomes in patients with advanced cancer: the Project ENABLE a randomized controlled trial. JAMA 2009; 302(7): 741 – 749. doi: 10.1001/ jama.2009.1198.
12. Zimmermann C, Swami N, Krzyzanowska M et al. Early palliative care for patients with advanced cancer: a cluster - randomised controlled trial. Lancet Oncol 2014; 383(9930): 1721 – 1730. doi: 10.1016/ S0140 - 6736(13)62416 - 2.
13. Maione P, Perrone F, Gallo C et al. Pretreatment quality of life and functional status assessment significantly predict survival in elderly patients with advanced non-small-cell lung cancer receiving chemotherapy: a prognostic analysis of the Multicenter Italian Lung Cancer in the Elderly study. J Clin Oncol 2005; 23(28): 6865 – 6872.
14. Bonomi P, Kim K, Fairclough D et al. Comparison of survival and quality of life in advanced non-small-cell lung cancer patients treated with two dose levels of paclitaxel combined with cisplatin versus etoposide with cisplatin: results of Eastern Cooperative Oncology Group trial. J Clin Oncol 2000; 18(3): 623 – 631.
15. Zimmermann C, Riechelmann R, Krzyzanowska M et al. Effectiveness of specialized palliative care: a systematic review. JAMA 2008; 299(14): 1698 – 1709. doi: 10.1001/ jama.299.14.1698.
16. El - Jawahri A, Green JA, Temel JS. Does palliative care improve outcomes for patients with incurable illness? A review of the evidence. J Support Oncol 2011; 9(3): 87 – 94.
17. Higginson IJ, Evans CJ. What is the evidence that palliative care teams improve outcomes for cancer patients and their families? Cancer J 2010; 16(5): 423 – 435. doi: 10.1097/ PPO.0b013e3181f684e5.
18. World Health Organization [homepage on the Internet]. WHO Definition of Palliative Care. Available from: http:/ / www.who.int/ cancer/ palliative/ definition/ en/ .
19. Smith TJ, Temin S, Alesi ER et al. American Society od Clinical Oncology provisional clinical opinion: the integration of palliative care into standard oncology care. J Clin Oncol 2012; 30(8): 880 – 887. doi: 10.1200/ JCO.2011.38.5161.
20. Zagonel V, Cavanna L, Cetto G et al. The medical oncologist’s role in palliative care: AIOM’s position. Tumori 2009; 95(6): 652 – 654.
21. Cherny N, Catane R, Schrijvers D et al. European Society for Medical Oncology (ESMO) Program for the integration of oncology and palliative care: a 5-year review of the Designated Centers’ incentive program. Ann Oncol 2010; 21(2): 362 – 369. doi: 10.1093/ annonc/ mdp318.
22. Rummans TA, Clark MM, Sloan JA et al. Impacting quality of life in patients with advanced cancer with a structured multidisciplinary intervention: a randomized controlled trial. J Clin Oncol 2006; 24(4): 635 – 642.
23. Brumley D, Enguidanos S, Jamison P et al. Increased satisfaction with care and lower costs: results of a randomized trial of in-home palliative care. J Am Geriatr Soc 2007; 55(7): 993 – 1000.
24. Gade G, Venohr T, Conner D et al. Impact of an inpatient palliative care team: a randomized controlled trial. J Palliat Med 2008; 11(2): 180 – 190. doi: 10.1089/ jpm.2007.0055.
25. Pantilat SZ, O’Riordan DL, Dibble SL et al. Hospital-based palliative medicine consultation: A randomized controlled trial. Arch Intern Med 2010; 170(22): 2038 – 2040. doi: 10.1001/ archinternmed.2010.460.
26. Rabow MW, Dibble SL, Pantilat SZ et al. The comprehensive care team: a controlled trial of outpatient palliative medicine consultation. Arch Intern Med 2004; 164(1): 83 – 91.
27. National Cancer Institute at the National Institutes of Health [homepage on the Internet]. PDQ Supportive and Palliative Care Editorial Board. Available from: http:/ / www.cancer.gov/ cancertopics/ pdq/ supportive - care-board.
28. Gaertner J, Wolf J, Hallek M et al. Standardizing integration of palliative care into comprehensive cancer therapy – a disease specific approach. Support Care Cancer 2011; 19(7): 1037 – 1043. doi: 10.1007/ s00520-011 - 1131 - y.
29. Weismann DE. Identifying patients in need of palliative care assessment in a hospital setting: a consenus report from the Center to Advance Palliative Care. J Palliat Med 2011; 14(1): 17 – 23. doi: 10.1089/ jpm.2010.0347.
30. Rangachari D, Smith TJ. Integrating palliative care in oncology. The oncologist as a primary palliative care provider. Cancer J 2013; 19(5): 373 – 378. doi: 10.1097/ PPO.0b013e3182a76b9c.
31. Gaertner J, Weingartner V, Wolf J et al. Early palliative care for patients with advanced cancer: how to make it work? Curr Opin Oncol 2013; 25(4): 342 – 352. doi: 10.1097/ CCO.0b013e3283622c5e.
32. Hoffman MA, Raftopoulos H, Roy R. Oncologists as primary palliative care providers. J Clin Oncol 2012; 30(22): 2801 – 2802. doi: 10.1200/ JCO.2012.42.4655.
33. Von Gunten CF, Twaddle M, Preodor M et al. Evidence of improved knowledge and skills after an elective rotation in a hospice and palliative care program for internal medicine residents. Am J Hosp Palliat Care 2005; 22(3): 195 – 203.
34. Barth J, Lannen P. Efficacy of communication skills training courses in oncology: a systematic review and meta-analysis. Ann Oncol 2011; 22(5): 1030 – 1040. doi: 10.1093/ annonc/ mdq441.
35. NICE. Improving supportive and palliative care for adults with cancer. London: NICE 2004.
36. Caraceni A, Hanks G, Kaasa S et al. Use of opioid analgesics in the treatment of cancer pain: evidence-based recommendations from the EAPC. Lancet Oncol 2012; 13(2): e58 – e68. oi: 10.1016/ S1470 - 2045(12)70040 - 2.
37. Smith TJ, Coyne PJ, Cassel JB. Practical guidelines to developing new palliative care services: resource management. Ann Oncol 2012; 23 (Suppl 3): 70 – 75. doi: 10.1093/ annonc/ mds092.
38. Barbour I, Cohen S, Jackson V et al. Models for palliative care outside the hospital setting: a technical assistance monograph from IPAL - OP project [monograph on the Internet]. New York: Center to Advance Palliative Care 2012. Available from: Ipal.capc.org/ downloads/ overview - of-outpatients - palliative - care-models.pdf.
39. Bruera E, Hui D. Conceptual models for integrating palliative care at cancer centers. J Palliat Med 2012; 15 : 1261 – 1269. doi: 10.1089/ jpm.2012.0147.
40. Kamal AH, Currow DC, Richie CS et al. Community-based palliative care: the natural evolution for palliative care delivery in the US. J Pain Symptom Manage 2013; 46(2): 254 – 264. doi: 10.1016/ j.jpainsymman.2012.07.018.
41. Von Roenn JH, Voltz R, Serrie A. Barriers and approaches to the successful integration of palliative care and oncology practice. J Natl Compr Canc Netw 2013; 11 (Suppl 1): S11 – S16.
42. Quill TE, Abernethy AP. Generalist plus specialist palliative care-creating a more sustainable model. N Engl J Med 2013; 368(13): 1173 – 1175. doi: 10.1056/ NEJMp1215620.
43. Bruera E, Hui D. Integrating supportive and palliative care in the trajectory of cancer: establishing goals and models of care. J Clin Oncol 2010; 28(25): 4013 – 4017. doi: 10.1200/ JCO.2010.29.5618.
44. Johnson CE, Girgis A, Paul CL et al. Cancer specialists’ palliative care referral practices and perceptions: results of a national survey. Palliat Med 2008; 22(1): 51 – 57. doi: 10.1177/ 0269216307085181.
45. Zimmermann C, Swami N, Rodin G et al. Cluster - randomized trial of early palliative care for patients with metastatic cancer. Presented at the 2012 American Society for Clinical Oncology Annual Meeting, Chicago, June 1 – 5, 2012, abstract.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Aktuality z odborného tiskuČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCI
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Role výzkumných infrastruktur v onkologii
- Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
- Časná integrace paliativní péče do standardní onkologické péče – benefit, limitace, bariéry a druhy paliativní péče
- Anxio-depresívny syndróm v onkológii – biopsychosociálny model suportívnej terapie
- Nádorová hypoxia – molekulárne mechanizmy a klinický význam
- Vplyv frakcionovaného ožiarenia na hipokampus v experimentálnom modeli
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Dlouhodobé sledování nutričního, klinického stavu a kvality života u nemocných s rakovinou hlavy a krku
- Extrémně vzácný případ trichocellulární leukemie u pacientky se sarkoidózou
- Informace z České onkologické společnosti
- Podávání kontinuálních infuzí cytostatik pomocí elastomerických infuzorů
-
Domácí parenterální výživa v onkologii
Díl 3 – Mobilní režim domácí parenterální výživy - Aktuality z odborného tisku
- Kongenitální naevus – někdy neprávem opomíjené riziko
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Podávání kontinuálních infuzí cytostatik pomocí elastomerických infuzorů
- Nové poznatky ve farmakologii methotrexátu – diagnostické možnosti a klinický význam
- Nádorová hypoxia – molekulárne mechanizmy a klinický význam
- Anxio-depresívny syndróm v onkológii – biopsychosociálny model suportívnej terapie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



