-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
HDL: funkce, dysfunkce a laboratorní metody stanovení
HDL: function, dysfunction and laboratory methods of determination
Objective:
On the basis of recent studies to make an overview concerning the crucial biological functions of high density lipoproteins (HDL), with emphasis on the role in reverse cholesterol transport and their antiinflammatory traits. The aim was to describe probable mechanisms of dysfunctional proinflammatory HDL formation with introduction some of associated parameters. To present laboratory methods for determination of quantitative, structural and functional qualities of HDL, including advanced mass spectrometry techniques.Study design:
reviewConclusion:
In the case of systemic inflammation and/or oxidative stress, the formation of dysfunctional HDL accumulating oxidants takes place, including apo AI structural modifications. This process can lead to the inhibition of reverse cholesterol transport and proinflammatory HDL generation, among others. Loss of beneficial qualities results from modification of both lipid and protein components of HDL. In some cases, an isolated quantitative measurement of HDL cholesterol may not fully correlate with cardiovascular risk and it is eligible to determine some of structural and/or functional markers of HDL.Key words:
HDL, dysfunctional HDL, reverse cholesterol transport, inflammation, paraoxonase 1.
Autoři: D. Novotný 1; D. Karásek 2; H. Vaverková 2; P. Malina 3
Působiště autorů: Oddělení klinické biochemie, Fakultní nemocnice Olomouc 1; III. Interní klinika lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 2; Oddělení klinické biochemie, Nemocnice Písek 3
Vyšlo v časopise: Klin. Biochem. Metab., 21 (42), 2013, No. 3, p. 122-128
Souhrn
Cíl studie:
Na základě soudobých studií podat přehled o hlavních biologických funkcích lipoproteinů o vysoké hustotě (HDL), zejména ve vztahu k reverznímu transportu cholesterolu a k jejich protizánětlivému působení. Popsat pravděpodobné mechanismy vzniku dysfunkčních prozánětlivých HDL a uvést některé parametry asociované s tímto procesem. Podat přehled o laboratorních metodách stanovení kvantitativních, strukturních a funkčních vlastností HDL, včetně moderních metod založených na hmotové spektrometrii.Typ studie:
přehledový článekZávěr:
V případě systémového zánětu a/nebo oxidačního stresu dochází ke vzniku dysfunkčních HDL akumulujících oxidanty. Probíhá strukturní modifikace apolipoproteinu AI, což vede mimo jiné k inhibici reverzního transportu cholesterolu a tvorbě prozánětlivých HDL. Na ztrátě příznivých vlastností HDL se podílí modifikace proteinové i lipidové složky HDL. Izolované měření HDL cholesterolu nemusí u některých syndromů bezvýhradně korelovat s mírou kardiovaskulárního rizika a v některých situacích je vhodné stanovit markery mapující strukturu a funkci HDL.Klíčová slova:
HDL, dysfunkční HDL, reverzní transport cholesterolu, zánět, paraoxonáza 1.Úvod
Epidemiologické studie i prospektivní randomizované zkoušky konzistentně ukazují na silnou inverzní asociaci mezi hladinou HDL cholesterolu a ischemickou chorobou srdeční (ICHS). Prediktivní hodnota pro konkrétního jedince však není zdaleka tak silná. Již původní Framinghamská studie z roku 1977 zjistila, že 44 % mužů, resp. 43 % žen s prokázanou ischemickou chorobou srdeční má koncentraci HDL cholesterolu vyšší než 1,04 mmol/l, resp. 1,30 mmol/l, tedy „fyziologické“ nebo nijak významně snížené hodnoty [1]. Další práce z poslední doby ukázaly, že např. HDL cholesterol účinkem terapie roste, není ale možné prokázat jeho signifikantní vztah k výskytu vaskulárních příhod (např. Heart Protection Study se simvastatinem, 2002, [2]). Významný počet srdečních příhod se objevuje u pacientů s normálními hladinami LDL a HDL cholesterolu (např. studie JUPITER s rosuvastatinem, 2008, [3]).
V soudobé literatuře jsou podrobně popsány fyziologické funkce lipoproteinů o vysoké hustotě. Největší a zřejmě i nejpodrobněji zmapovaná je jejich role při tzv. reverzním transportu cholesterolu (RTCH), procesu, jehož hlavním cílem je přesun nadbytku cholesterolu z membrán periferních buněk do jater a sterodiogenních orgánů za pomoci HDL částic [4, 5, 6]. To je důležité zejména v případě makrofágů arteriální stěny; odstraňování cholesterolu je zde prevencí vzniku pěnových buněk, progenitorů ateromu. Za fyziologických podmínek působí HDL antitrombogenně, vazoprotektivně, vykazují protizánětlivé, antioxidační a antiapoptotické účinky. Tyto vlastnosti jsou mj. zprostředkovány mnoha enzymy lokalizovanými na HDL částicích. V případě systémového zánětu a/nebo oxidačního stresu dochází ke vzniku dysfunkčních HDL akumulujících oxidanty (dochází tedy ke ztrátě jejich ochranných schopností), které inhibují antioxidační enzymy, zejména paraoxonázu (PON1). Zánět a oxidační stres současně přispívají ke strukturální modifikaci apolipoproteinu AI (apo AI, [7]), což vede mimo jiné k inhibici reverzního transportu cholesterolu a ztrátě protizánětlivých vlastností HDL. Dysfunkční HDL navíc ztrácejí schopnost předcházet oxidaci LDL a potencují vaskulární zánět [8]. Zdá se, že izolované měření HDL cholesterolu ne vždy koreluje s mírou kardiovaskulárního rizika. Roste potřeba identifikovat biomarkery s lepší predikcí, mapující strukturu a funkci HDL.
HDL a reverzní transport cholesterolu
Participace na procesu reverzního transportu cholesterolu je považována za jednu z klíčových antiaterogenních a protizánětlivých vlastností HDL. V soudobé časopisecké literatuře, v monografiích i ve výukových materiálech najdeme bezpočet schémat zachycujících tento proces, více či méně přesných. I z tohoto důvodu nebude ani jedno z nich součástí předkládané přehledové práce. Předpokládá se, že HDL jsou jediné částice schopné přijímat cholesterol z periferních buněk v dostatečném množství. Další částice, jež participují či teoreticky mohou participovat na efluxu cholesterolu z buněk, jako jsou fosfolipidy, syntetické cyklodextriny nebo albumin, se účastní procesů, které jsou nespecifické, pomalé či obousměrné [9]. Reverzní transport cholesterolu probíhá v zásadě několika mechanismy, klíčové kroky jsou uvedené především v bodech 3 a 4:
- Pasivní difúzí volného cholesterolu z makrofágů a jeho esterifikací prostřednictvím enzymu lecithin:cholesterol acyltransferázy (LCAT).
- Transportem cholesterolu na HDL částice a z HDL částic přes scavenger receptor B1 (SRB1), který je lokalizován na povrchu cévní stěny a na jaterních buňkách.
- Interakcí apolipoproteinu AI a ATP - binding casette transportéru A1 (ABCA 1) na arteriálních makrofázích a transportem volného cholesterolu na nezralé extracelulární HDL, diskoidní HDL, popř. na apolipoprotein AI.
- Přenosem lipidů z makrofágů prostřednictvím ATP - binding casette transportéru G1 (ABCG 1) na větší „zralé“ částice HDL částice (HDL2, HDL3).
Polymorfismus na genu pro ABCA1 významně ovlivňuje plazmatické hladiny HDL cholesterolu a je považován za jejich hlavní genovou determinantu [10]. Kapacita efluxu cholesterolu za pomoci HDL částic je úměrná jejich schopnosti odstranit cholesterol z membrán periferních buněk a zejména z makrofágů a pěnových buněk přes interakci s transportéry ABCA1 a ABCG1 a/nebo SRB1 receptory. Na rozdíl od volných apolipoproteinů indukují HDL obsahující lipidovou složku specifickou i nespecifickou dráhu efluxu cholesterolu. Předpokládá se, že např. obsah fosfolipidů v HDL je důležitou determinantou pro zprostředkování RTCH přes SRB1 receptory [11].
Některými autory bylo prokázáno, že tzv. malé husté částice, small dense HDL, jsou účinnějšími akceptory cholesterolu ve srovnání s většími, lipidy obohacenými HDL, tedy že důležitým atributem funkčních HDL je jejich struktura [6].
HDL a zánět
Je zjevné, že HDL představují poměrně heterogenní skupinu lipoproteinů, která se mimo výše uvedených účastní dalších velmi významných pochodů. HDL vykazují protizánětlivé, protioxidační a antiapoptotické efekty. Za fyziologických podmínek působí antitrombogenně, vazoprotektivně a podporují tvorbu oxidu dusnatého a funkci endotelu [12, 13].
HDL a jejich receptory modulují imunitní systém několika způsoby, přičemž se mj. podílejí na regulaci diferenciace a proliferace hematopoietických kmenových buněk a ovlivňují vrozený imunitní systém [14]. Mechanismus buněčného protizánětlivého působení HDL a jejich receptorů je schematicky uveden např. v citované literatuře [14]. Studie na pacientech se syndromy doprovázenými mírným zánětem, jako např. u diabetu, obezity nebo u autoimunitních chorob, ukazují na inverzní vztah mezi hladinami HDL cholesterolu s řadou prozánětlivých markerů, jako jsou tumor nekrotizující faktor alfa (TNF alfa), C-reaktivní protein, interleukiny IL 1, IL 2, IL 6 a řadou dalších [15]. TNF alfa je uvolňován aktivovanými makrofágy a je přítomen v aterosklerotických plátech, jeho přímé působení v procesu aterogeneze je však doposud konfliktní, jak ukazují práce na některých zvířecích modelech: na jedné straně se zdá, že je schopen inhibovat in vitro expresi antiaterogenních receptorů patřící do rodiny ABCA1 transportérů v pěnových buňkách odvozených z makrofágů [16], jiný model však naopak ukázal na indukci exprese ABCA1 v myších peritoneálních makrofázích [17].
HDL vykazují protizánětlivé efekty také na endoteliálních buňkách, a to inhibicí exprese řady buněčných adhezivních molekul, včetně intracelulárních adhezních molekul-1 (ICAM-1) a vaskulárních adhezivních molekul-1 (VCAM-1), a inhibicí produkce monocytárního chemotaktického proteinu 1 (MCP 1) a TNF alfa aktivovanými endoteliálními buňkami [14]. Kromě efluxu cholesterolu má vazba HDL a/nebo apo AI na ABCA1 další příznivý efekt: spouští se tím iniciační kaskáda intracelulárních signálních akcí v makrofázích, jež má za následek aktivaci Janusovy kinázy 2 (JAK2), která následně přes další buněčné mechanismy vede k inhibici buněčného stresu a zánětu [18]. Interakce HDL s buněčnými receptory, včetně těch probíhajících při reverzním transportu cholesterolu, jsou tak významnými protizánětlivými procesy, které se zásadně podílejí na inhibici zánětu a aterogeneze a jejichž inhibice vede k porušení funkce těchto protektivních akcí.
Prozánětlivé, dysfunkční HDL
Soudobé studie ukazují na skutečnost, že HDL jsou mj. modulátory systémového zánětu. Za jeho nepřítomnosti slouží jako komplement k antioxidačním enzymům, které udržují protizánětlivý status. Za přítomnosti systémového zánětu mohou být tyto enzymy inaktivovány a HDL mohou kumulovat oxidované lipidy a proteiny, čímž se stávají prozánětlivými.
Dysfunkční HDL ztrácejí své pozitivní efekty změnou své struktury i funkce. Při systémovém zánětu a/nebo oxidačním stresu navozeným onemocněním srdečních artérií, diabetem, metabolickým syndromem, infekcí, autoimunitním onemocněním, chronickým onemocněním ledvin a dalšími syndromy (tj. při „chronické odpovědi na akutní fázi“) dochází ke vzniku tzv. dysfunkčních HDL. Tyto částice akumulují oxidanty, které inhibují antioxidační enzymy lokalizované na HDL (zejména paraoxonázu 1), strukturně modifikují apolipoprotein AI, a tím znemožňují či minimalizují cestu reverzního transportu cholesterolu přes ABCA1 transportér, a naopak podporují formování oxidovaných LDL a vaskulární zánět [9]. Strukturní modifikaci apo AI vykazují také např. HDL modifikované malondialdehydem, i zde dochází k inhibici interakce s ABCA1 transportérem [14]. HDL částice během zánětu mění významně i svou proteinovou strukturu. Jsou např. obohacovány o sérový amyloid A (SAA), který může indukovat vazbu proteoglykanů na arteriální stěnu.
Je zjevné, že na ztrátě příznivých vlastností HDL se podílí modifikace proteinové i lipidové složky částic. Dysfunkční HDL indukují v různých cílových tkáních expresi prozánětlivých genů. Jde např. o makrofágy a endoteliální buňky. Tabulka 1 uvádí hlavní funkční a strukturní změny na HDL částicích.
Tab. 1. The main types of dysfunctional modification of HDL 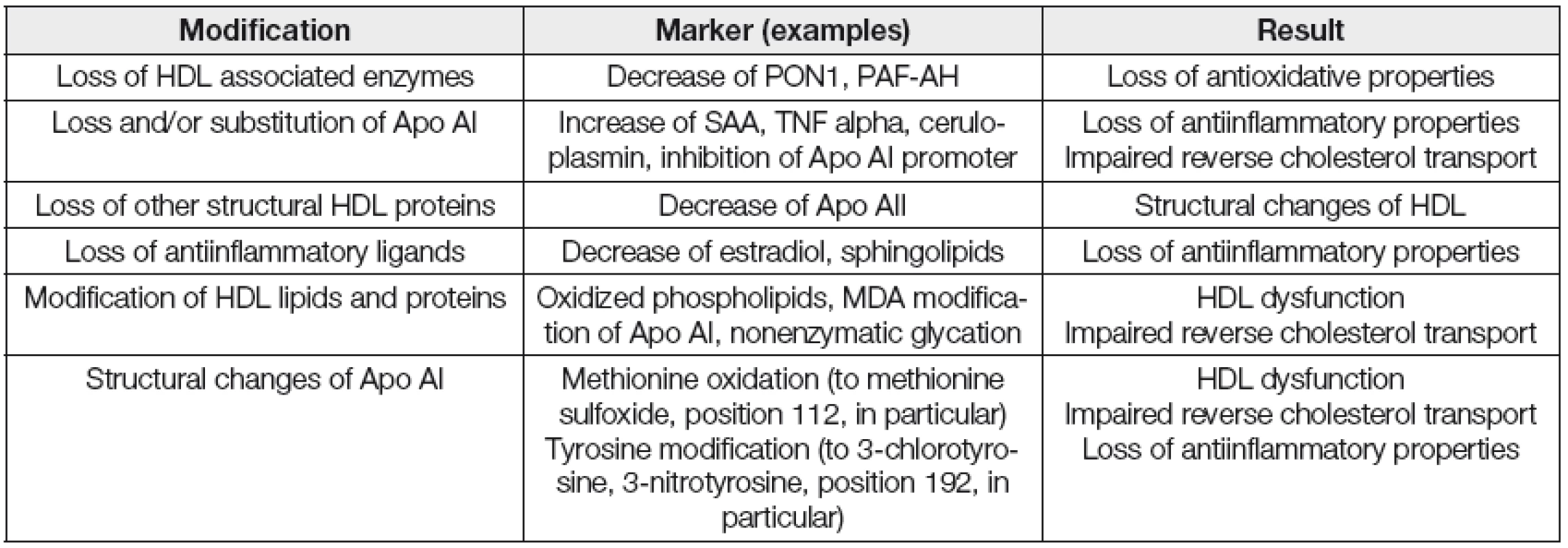
PAF-AH; Platelet activating factor- acetylhydrolase, SAA; serum amyloid A, MDA; malondialdehyde Přesný mechanismus vzniku prozánětlivých HDL není zatím detailně popsán. Jedna z velmi pravděpodobných hypotéz předpokládá působení enzymu myeloperoxidázy (MPO) na apolipoprotein AI, kdy za přítomnosti reaktivních forem kyslíku probíhá jeho oxidace a nitrace za vzniku substituovaných aminokyselin 3-chlorotyrosinu a 3-nitrotyrosinu. Tyto molekuly byly mj. nalezeny i v HDL izolovaných z aterosklerotické tkáně. Dále je porušen RTCH přes ABCA1 transportér, HDL se stávají neefektivním antioxidantem a podporují aktivitu MCP 1 v cévní stěně [19, 20]. Studie na zvířatech a práce na omezeném počtu participantů ukazují, že měření kvalitativních a funkčních parametrů HDL by mohlo poskytnout další prostředek pro identifikaci subjektů se zvýšeným rizikem aterosklerotických jevů, na rozdíl od současného kvantitativního měření hladin HDL cholesterolu. Kvalita a funkce HDL se tak stávají i atraktivními terapeutickými cíli [21, 22].
Dalším předpokládaným mechanismem tvorby modifikovaných HDL je mimo oxidaci a modifikaci jejich konstituentů také působení sekreční fosfolipázy A2. Ishimoto et al prezentovali na zvířecím modelu jev, při němž fosfolipáza A2 , typ V a X, hydrolyzovala HDL způsobem, který významně zredukoval její kapacitu při efluxu cholesterolu. Soudobé studie ukazují, že polynenasycené mastné kyseliny uvolněné působením fosfolipáz snižují expresi ABCA1 z makrofágů, a to jejich zvýšenou degradací. Kyseliny arachidonová a linolenová mohou být navíc působením 12-lipoxygenázy, popř. dalšími mechanismy, oxidovány na více prozánětlivé produkty [35].
Vybrané parametry asociované se vznikem dysfunkčních částic HDL
Paraoxonáza 1
PON1 je v séru téměř exkluzivně lokalizována na částicích HDL. Může se reverzibilně vázat k organofosfátům, které hydrolyzuje, a působí jako ochrana nervového systému proti jejich neurotoxicitě [23, 24].
V poslední době se pozornost soustřeďuje na potenciální antioxidační úlohu PON1. Na základě její přítomnosti v HDL a mechanismu působení je sledována schopnost metabolizovat peroxidy lipidů, a bránit tak jejich akumulaci v LDL. Enzym je převážně syntetizován v játrech a na HDL částice se dostává procesem zprostředkovaným SRB1 receptorem [25]. PON1 má vysokou antioxidační schopnost a je velmi účinná při prevenci peroxidace lipidů na částicích LDL. Vykazuje také - společně s apo AI - významné protizánětlivé vlastnosti [24, 26].
PON1 je lokalizována v subfrakci HDL, která obsahuje apo AI a clusterin (apolipoprotein J). Existují hypotézy, že tato subfrakce má obecně za úkol chránit buněčné membrány před peroxidací lipidů a dalšími toxickými jevy. Nepředpokládá se, že antioxidační funkce PON1 se vyvinula výhradně proto, aby chránila lidi před vznikem ateromu; toto onemocnění se začíná projevovat ve větší míře před méně než sto lety. Její schopnost je pravděpodobně součástí mnohem starší a univerzálnější protektivní role a LDL pouze „využívají“ její ochrany [23].
Aktivita a koncentrace sérové PON1 korelují ve většině studií na zdravých populacích s HDL cholesterolem a koncentrací apo AI, avšak vzájemná závislost není vždy silná. U extrémního případu deficience HDL, Tangierské nemoci, je aktivita PON1 výrazně snížená, u dalších stavů s nedostatečností HDL tomu tak vždy není [27]. Uvedený fakt může vysvětlovat skutečnost, proč některé defekty s deficitem HDL bývají spojovány s předčasnou ischemickou chorobou srdeční a některé nikoli. Aktivita PON1 je zčásti determinována geneticky. Je vesměs redukována u diabetiků a pacientů s familiární hypercholesterolémií, tedy u onemocnění spojených s akcelerovanou aterogenezí. Aktivita PON1 bývá významně potlačena při vzniku dysfunkčních HDL [9].
Gen pro PON1 je lokalizován na dlouhém raménku chromozomu 7 mezi q21.3 a q22.1 spolu s ostatními členy supergenové rodiny (genového clusteru PON1, PON2, PON3) [23]. V sousedství genu pro PON1 leží gen kódující jednu z pyruvátdehydrogenáz, což může vysvětlovat vazbu genotypů PON1 ke glykemické kontrole diabetiků, jak prokazují některé studie [28]. Na genu pro PON1 byla u lidí identifikována nejméně dvě polymorfní místa, a to na pozicích 192 (genotyp Q koresponduje často v literatuře s označením A, genotyp R s označením B) a 55 (genotypy M a L). V soudobé literatuře lze nalézt řadu prací, které zkoumají vztah PON1 polymorfismů k ICHS a dalším onemocněním spojených s aterosklerózou, a které poskytují často rozporuplné výsledky. Byl však jasně prokázán vztah mezi PON1 polymorfismem s PON1 aktivitou a systémovým oxidačním stresem [29]. QQ homozygoti PON1 192 polymorfismu měli vyšší aktivitu enzymu než heterozygoti a RR homozygoti, a také menší počet koronárních příhod. Byla též nalezena signifikantní korelace mezi aktivitou PON1 a plazmatickými hladinami oxidovaných mastných kyselin. V současnosti lze PON1 považovat za důležitý antioxidační enzym působící obecně proti oxidačnímu stresu [30]. Ztráta její aktivity a obsahu je jednou z hlavních příčin ztráty antioxidačních vlastností HDL při jejich konverzi na dysfunkční částice.
Myeloperoxidáza
Jde o enzym ze skupiny peroxidáz, který je produkován fagocytujícími monocyty a neutrofily. Je prozánětlivý a podílí se na destabilizaci aterosklerotického plátu. MPO participuje v proaterogenních biologických pochodech spojených s rozvojem kardiovaskulárních onemocnění včetně iniciace, podpory a akutních komplikací aterosklerózy. Podílí se zejména na vzniku oxidovaných LDL a podpoře jejich internalizace makrofágy, redukci hladin oxidu dusnatého, endoteliální dysfunkci, uvolňování reaktivních forem kyslíku a redukci efluxu cholesterolu přes ABCA1 transportér [31]. Některými autory je navrhována jako prediktor vzniku budoucích kardiovaskulárních příhod. Předpokládá se její aktivní úloha při vzniku modifikovaného apolipoproteinu AI a vzniku prozánětlivých HDL částic [9], a tím se stává i zajímavým terapeutickým cílem.
Adiponektin
Adiponektin je hormon tukové tkáně, který působí jako protektivní faktor při iniciaci a progresi aterosklerózy díky jeho protizánětlivým a protiaterogenním vlastnostem. Jeho sérové hladiny jsou sníženy u obézních jedinců, pacientů a diabetem 2. typu, u pacientů s onemocněním koronárních artérií apod. Hladina adiponektinu pozitivně koreluje s hladinou HDL cholesterolu, naopak negativně s markery zánětu, inzulínové rezistence, triacylglyceroly a markery metabolismu na triacylglyceroly bohatých lipoproteinových částic, a dalšími adipokiny [32]. Protizánětlivý efekt může být hlavní složkou jeho kladného působení při potlačování kardiovaskulárních a metabolických onemocnění včetně aterosklerózy a inzulínové rezistence. Navíc se zdá, že vykazuje přímou biologickou aktivitu, a to mj. indukcí klasické cesty aktivace komplementu [33].
Lidský adiponektin je schopen zvyšovat sekreci apo AI z buněk hepatocelulárního karcinomu HepG2 a zvyšovat buněčnou expresi ABCA1 transportéru. ADP má pravděpodobný potenciál akcelerovat reverzní transport cholesterolu urychlováním tvorby HDL částic v játrech podporou syntézy apo AI a exprese ABCA1.
Laboratorní metody stanovení HDL
Kromě měření koncentrace HDL cholesterolu a apolipoproteinu AI, běžně používaných v rutinní dia-gnostice, se jeví vhodným především v experimentu charakterizovat a kvantifikovat v řadě případů i strukturní a funkční vlastnosti HDL frakce. Vybrané laboratorní postupy pro stanovení kvantitativních, strukturních a funkčních parametrů asociovaných s HDL jsou uvedeny v Tabulkách 2, 3 a 4.
Tab. 2. Routine quantitative methods for HDL and Apo AI 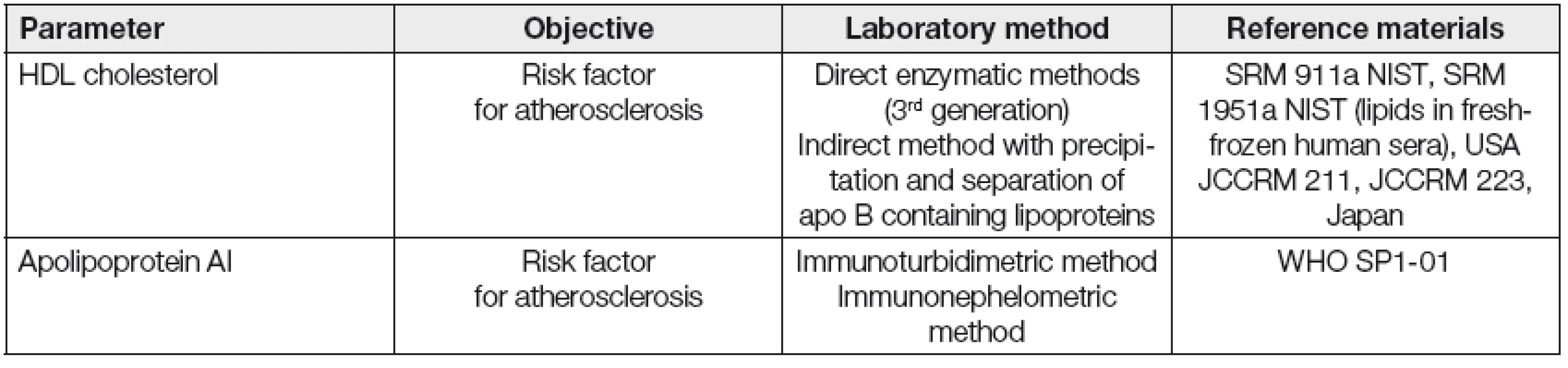
Tab. 3. Selected structural HDL parameters 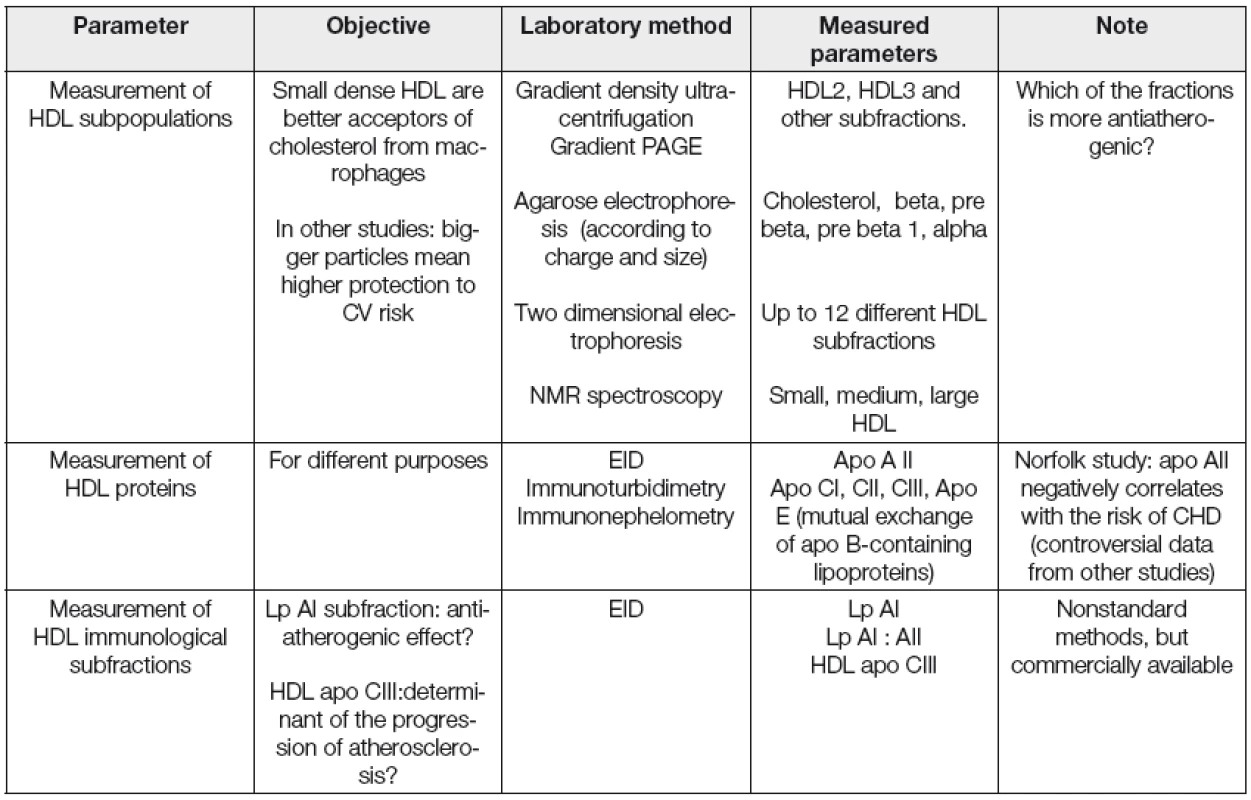
PAGE; polyacrylamide gel electrophoresis, EID; electroimmunodiffusion, CV; cardiovascular, LpAI; HDL associated only with Apo AI, Lp AI : AII; HDL associated both with Apo AI and Apo AII, HDL apo CIII; apo CIII associated with HDL Tab. 4. Selected functional HDL parameters 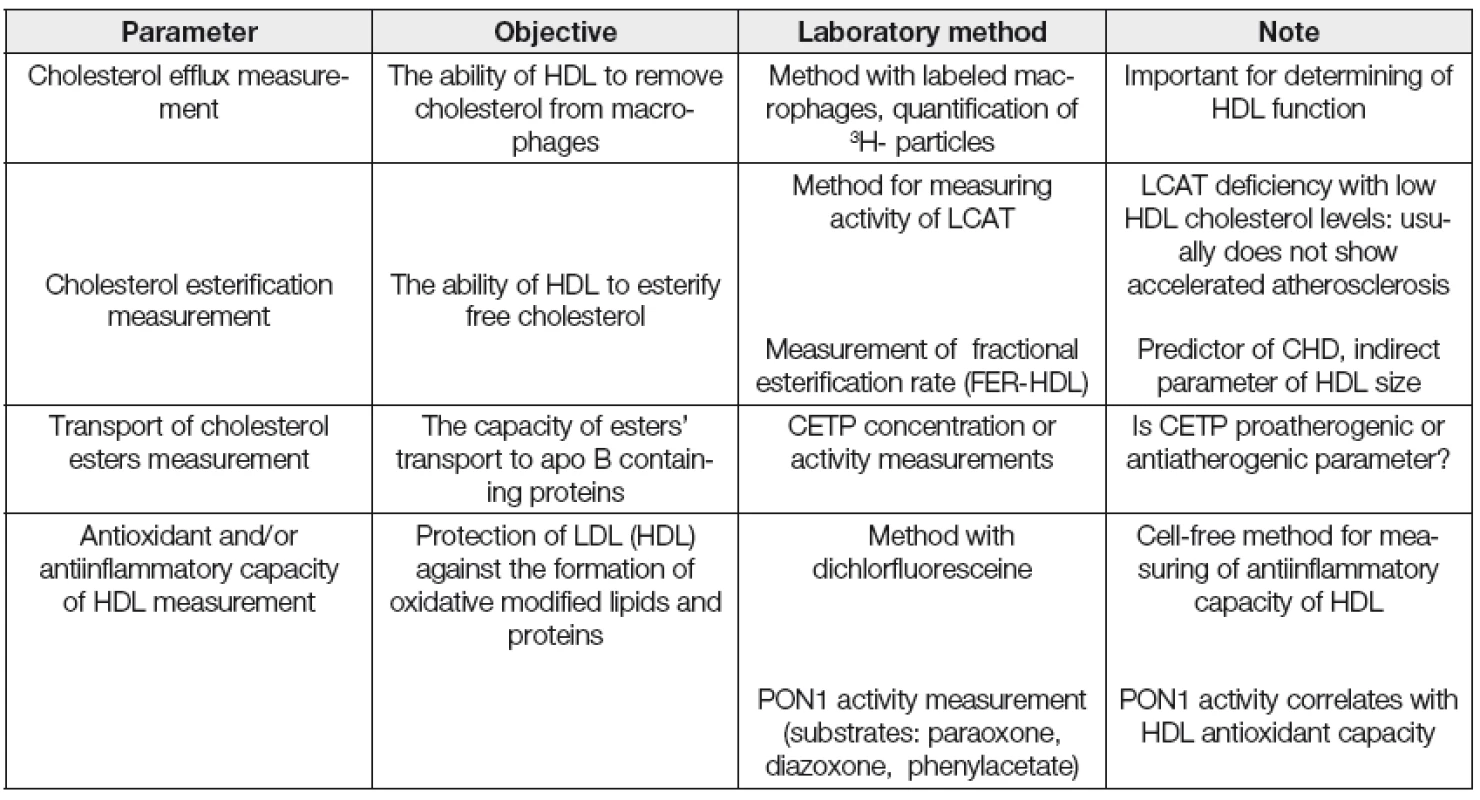
Dřívější metody na určení dysfunkčních HDL byly prováděny na buněčných kulturách endoteliálních buněk, buněk hladkého svalstva a monocytů. Později byla vyvinuta jednodušší, tzv „cell-free“ metoda k detekci dysfunkčních HDL, která je poměrně rychlá a jednoduchá využívající fluorofor dichlorfluorescein. Ta je založena na schopnosti HDL inhibovat oxidaci LDL. Na jejím základě se počítá tzv. „HDL-inflamační index,“ jehož hodnota je u zdravých jedinců < 1, naopak u pacientů s ICHS > 1 [34]. Vyšší hodnota indexu je spojována s HDL, které méně efektivně podporují eflux cholesterolu z makrofágů.
Jiný přístup za použití buněčné kultury, monocytární chemotaktickou metodu (MCA), zvolili Navab et al [36]. Ta kvantifikuje LDL indukovanou inkorporaci monocytů do smíšené kultury endoteliálních buněk aorty a buněk hladkého svalstva. Protizánětlivé HDL redukují monocytární chemotaxi, zatímco prozánětlivé HDL zvyšují monocytární invazi do kultury. „Antiinflamační index“ je počítán jako kvocient MCA v přítomnosti nebo nepřítomnosti testovaných HDL.
Další možností měření funkčních vlastností HDL je potom postup vyhodnocující vliv HDL na expresi ICAM-1 a VCAM-1 z kultivovaných endoteliálních buněk umbilikální žíly [37].
Proteomická analýza HDL
HDL jsou obecně považovány za cirkulující komplex lipidů a proteinů, který byl původně definován na základě hustoty ultracentrifugací. Ve skutečnosti však jde o vysoce polydisperzní soustavu (rodinu) odlišných částic obsahujících apo AI, ale i řadu dalších proteinových složek. Někteří autoři, např. Heinecke et al, došli k závěru, že určení složení a kvantifikace proteinů HDL by mohlo přinést nový pohled na jejich antiaterogenní a protizánětlivé vlastnosti, s následným přímým využitím pro klinické a další studie [38]. Za použití shotgun proteomiky kombinující použití vysokoúčinné kapalinové chromatografie a tandemové hmotnostní spektrometrie byla provedena analýza komplexní směsi proteinů HDL. Ty byly zpracovány za pomoci trypsinu a výsledné peptidy pak separovány chromatograficky, s následnou analýzou prostřednictvím hmotové a tandemové hmotové spektrometrie [39]. Z HDL izolovaných ultracentrifugací od zdravých kontrolních jedinců a/nebo pacientů s ICHS bylo identifikováno 48 proteinů, z 23 doposud známých a charakterizovaných proteinů bylo nalezeno 22. Dále bylo nalezeno 13 proteinů, u kterých nebyla doposud zjištěna asociace s HDL a které pravděpodobně odlišují proteom zdravých jedinců od pacientů. Další práce pak vedly k poznání, že HDL u pacientů s ICHS skutečně vykazují odlišnou proteomickou signaturu od HDL proteomu zdravých lidí. Vaisar et al za pomoci technik hmotové spektrometrie dále potvrdili odlišnost proteinového složení subfrakce HDL2 u pacientů s onemocněním koronárních artérií, kdy u nich zjistili vyšší obsah apolipoproteinu (a) a apolipoproteinu CIII a nižší obsah dvou peptidů odvozených od apo AI oproti zdravým kontrolním jedincům. U pacientů byly také ve větším množství identifikovány posttranslačně modifikované peptidy odvozené od apo AI, zejména oxidované peptidy s methionin sulfoxidem, a větší množství proteinů obsahujících chlorotyrosin a nitrotyrosin [40]. Zdá se tedy, že identifikace změn na proteomu HDL, a zejména cirkulující hladiny prooxidačních a modifikovaných proteinů HDL, může mít dia-gnostický potenciál, za využití vysoce sofistikovaných technik hmotnostní spektrometrie [41].
Závěr
Je pravděpodobné, že měření HDL cholesterolu není exkluzivním měřítkem antiaterogenního působení HDL. Do něj je třeba zahrnout také strukturu a funk-ční vlastnosti HDL subfrakcí. Na bázi experimentu již existují metody pro stanovení strukturních a funkčních charakteristik HDL, jejich širšímu používání brání zatím nízká efektivita v predikci rizika kardiovaskulárních onemocnění, použití vesměs pouze pro výzkumné účely a slabá standardizace. Jako velmi nadějné se jeví využití technik hmotnostní spektrometrie pro identifikaci a kvantifikaci změn na proteomu HDL.
Podpořeno MZ ČR – RVO (Fakultní nemocnice Olomouc - FNOl IČ00098892)
Do redakce došlo 17. 5. 2013
Adresa pro korespondenci:
Ing. Dalibor Novotný, Ph.D.
Oddělení klinické biochemie
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: dalibor.novotny@fnol.cz
Zdroje
1. Gordon, T., Castelli, W. P, Hiortland , M. C., et al. High density lipoprotein as a protective factor against coronary heart disease. The Framingham Study. Am. J. Med., 1977, 62, p. 707-714.
2. Heart Protection Study Collaborative Group: MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20.536 high risk individuals: randomised placebo controlled trial. Lancet, 2002, 360, p. 7-22.
3. Ridker, P. M., Danielson, E., Fonseca , F. A. H., et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N. Engl. J. Med., 2008, 359, p. 2195-2207.
4. Navab, M., Ananthramaiah, G.M., Reddy, S.T., et al. The double jeopardy of HDL. Ann. Med., 2005, 37, s.173-178.
5. Von Eckardstein, A., Nofer, J. R., Assmann, G., et al. HDL and arteriosclerosis. Role of cholesterol efflux and reverse transport. Arterioscler. Thromb. Vasc. Biol., 2001, 21, p. 13-27.
6. Movva, R. , Rader, D. J. Laboratory assesment of HDL heterogeneity and function. Clin. Chem., 2008, 54, p. 788-800.
7. Shao, B. , Oda, M. N., Oram, J. F., et al. Myeloperoxidase - an inflamatory enzyme for generating dysfunctio-nal high density lipoprotein. Curr. Opin. Cardiol., 2006, 21, p. 322-328.
8. Navab, M., Reddy, S. T., Van Lenten B. J., et al. The role of dysfunctional HDL in atherosclerosis. J. Lipid. Res., 2009, 50, S145-S149.
9. Dodani, S., Grice, D. G., Joshi, S. Is HDL function as important as HDL quantity in the coronary artery disease risk assessment? J. Clin. Lipidol., 2009, 3, p. 70-77.
10. Nandi, S., Ma, L., Denis, M., et al. ABCA1-mediated cholesterol efflux generates microparticles in addition to HDL trough process governed by membrane rigidity. J. Lipid. Res., 2009, 50, p. 456-466.
11. Kontush, A., Chapman, M. HDL: structure, metabolism, function and therapeutics. John Willey and Sons, Inc., 2012, NJ.,1st edition.
12. Larkin, L., Khachigian, L. M., Jessup, W. Regulation of apolipoprotein E production in macrophages. Inf. J. Mol. Med., 2000, 6, p. 253-258.
13. Navab, M., Reddy, S. T., Van Lenten, B. J., et al. HDL and cardiovascular disease: atherogenic and atheroprotective mechanisms. Nat. Rev. Cardiol., 2011, 8, p. 222-232.
14. Haas, M. J., Mooradian, A. D. Inflammation, high-density lipoprotein and cardiovascular dysfunction. Curr. Opin. Infect. Dis., 2011, 24, p. 265-272.
15. Kleinbongard, P., Heusch, G., Schultz, R. TNF alpha in atherosclerosis, myocardial ischemia/reperfusion and heart failure. Pharmacol. Ther., 2010, 127, p. 295-314.
16. Wang, Y. F, Yang, X. F., Cheng, B., et al. Protective effect of astragalus polysaccharides on ATP binding cassette transporter A1 in THP-1 derived foam cell exposed to tumor necrosis factor alpha. Phytoter. Res., 2010, 24, p. 393-398.
17. Gergod-Giannone, M. C., Li, Y., Holleboom, A., et al. TNFalpha induces ABCA1 through NK-kappaB in macrophages and in phagocytes ingesting apoptotic cells. Proc. Natl. Acad .Sc. U.S.A., 2006, 103, p. 3112-3117.
18. Tang, C., Liu, Y., Kessler, P. S., et al. The macrophage cholesterol exporter ABCA1 functions as an anti-inflammatory receptor. J. Biol. Chem., 2009, 284, p. 32336-32343.
19. Shao, B., Oda, M. N., Bergt, C., et al. Myeloperoxidase impairs ABCA1-dependent Cholesterol Efflux through Methionine Oxidation and Site-specific Tyrosine Chlorination of Apolipoprotein A-I. J. Biolog. Chem., 2006, 281, p. 9001-9004.
20. Zheng, L., Nukuna, B., Brennan, M. L., et al. Apolipoprotein A-I is a selective target for myeloperoxidase-catalyzed oxidation and functional impairment in subjects with cardiovascular disease. J. Clin. Invest., 2004, 114, p. 529-541.
21. Otocka-Kmiecik, A., Mikhailidis, D. P., Nicholls, J. S., et al. Dysfunctional HDL: A novel important diagnostic and therapeutic target in cardiovascular disease? Progress in Lipid Res., 2012, 51, p. 314-324.
22. Kontush, A., Chapman, J. Funcionally defective high-density lipoprotein: a new therapeutic target at the crossroads of dyslipidemia, inflammation and atherosclerosis. Pharmacol. Rev., 2006, 58, p. 342-374.
23. Durrington, P. N. , Mackness, B., Mackness, M. I. Paraoxonase and atherosclerosis. Art. Thromb. Vasc. Biol., 2001, 21, p. 473-480.
24. Aharoni, S., Aviram, M., Fuhrman, B. Paraoxonase 1 (PON1) reduces macrophage inflammatory response. Atherosclerosis, 2013, 228, p. 353-361.
25. James, R. W., Brulhart-Meynet, M. C., Singh, A. K., et al. The scavenger receptor class B, type I is a primary determinant of paraoxonase 1 association with high-density lipoproteins. Arterioscler. Thromb. Vasc. Biol., 2010, 30, p. 2121-2127.
26. Mackness, B., Mackness, M. Anti-inflammatory properties of paraoxonase 1 in atherosclerosis. Adv. Exp. Med. Biol., 2010, 660, p. 143-151.
27. James, R. W., Blatter Garin, M. C., Calabresi, L., et al. Modulated serum activities and concentrations of paraoxonase in high density lipoprotein deficiency states. Atherosclerosis, 1998, 139, p. 77-82.
28. Mackness, B., Durrington, P. N , Abuashia, B., et al. Low paraoxonase activity in type II diabetes complicated by retinopathy. Clin. Sci., 2000, 98, p. 355-363.
29. Bhattacharyya, T., Nicholls, S. J., Topol, E. J., et al. Relationship of paraoxonase 1 (PON1) gene polymorphisms and functional activity with systemic oxidative stress and cardiovascular risk. JAMA, 2008, 299, p. 1265-1276.
30. Goswami, B. , Tayal, D., Gupta, N., et al. Paraoxo-nase: a multifaceted biomolecule. Clin. Chim. Acta., 2009, 410, p. 1-12.
31. Roman, R. M. , Wendland, A. E., Polanczyk, C. A. Myeloperoxidase and coronary heart disease: from research to clinical practice. Arq. Bras. Cardiol., 2007, 91, p. 11-18.
32. Ouchi, N., Walsh, K. Adiponectin as an anti-inflammatory factor. Clin. Chim. Acta, 2007, 380, p. 24-30.
33. Peake, P. W. , Shen, Y., Walther, A., et al. Adiponectin binds C1q and activates the classical pathway of complement. Biochem. Biophys. Res. Commun., 2008, 367, p. 560-565.
34. Navab, M., Hama, S. Y., Hough, G. P., et al. A cell-free assay for detecting HDL that is dysfunctional in preven-ting the formation of or inactivating oxidized phospholi-pids. J. Lipid. Res., 2001, 42, p. 1308-1317.
35. Ansell, B. J., Fonarow, G. C., Fogelman, A. M. The paradox of dysfunctional high-density lipoprotein. Curr. Opin. Lipidol., 2007, 18, p. 427-434.
36. Navab, M., Hama, S. Y., Hough, G. P., et al. Normal high density lipoprotein inhibits three steps in the formation of midly oxidized low density lipoprotein: steps 2 and 3. J. Lipid. Res., 2000, 41, p. 1495-1508.
37. Nicholls, S. J., Lundman, P., Harmer, J. A., et al. Consumption of saturated fat impairs the anti-inflammatory properties of high-density lipoproteins and endothelial function. J. Am. Coll. Cardiol., 2006, 48, p. 715-720.
38. Heinecke, J. W. The HDL proteome: a marker-and perhaps mediator-of coronary artery disease. J. Lipid. Res., 2009, 50, S167-S171.
39. Vaisar, T., Pennathur, S., Green, P. S., et al. Shotgun proteomics implicates protease inhibition and complement activation in the antiinflammatory properties of HDL. J. Clin. Invest., 2007, 117, p. 746-756.
40. Vaisar, T., Mayer, P., Nilsson, E., et al. HDL in humans with cardiovascular disease exhibits a proteomic signature. Clin. Chim. Acta., 2010, 411, p. 972-979.
41. Shah, A. S., Tan, L., Lu Long, J., et al. The proteomic diversity of high density lipoproteins: Our emerging understanding of its importance in lipid transport and beyond. J. Lipid. Res., 2013, doi: 10.1194/jlr.R035725.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek EditorialČlánek OceněníČlánek ProgramČlánek Seznam posterůČlánek Abstrakta přednášekČlánek Abstrakta posterůČlánek Autorský rejstřík
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2013 Číslo 3- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Editorial
- Struktura, funkce a medicínský význam lipokalinů
- HDL: funkce, dysfunkce a laboratorní metody stanovení
- Molekulárně biologické vyšetření estrogenového a somatostatinových receptorů u klinicky afunkčních adenomů hypofýzy.
- Intoxikace vitaminem D – kazuistika
- Glykovaný hemoglobin HbA1C a diagnóza diabetu mellitu. Názory a perspektiva.
- Ocenění
- Program
- Seznam posterů
- Abstrakta přednášek
- Abstrakta posterů
- Autorský rejstřík
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Intoxikace vitaminem D – kazuistika
- Glykovaný hemoglobin HbA1C a diagnóza diabetu mellitu. Názory a perspektiva.
- Struktura, funkce a medicínský význam lipokalinů
- Abstrakta posterů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



