-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Struktura, funkce a medicínský význam lipokalinů
Structure, function and medical significance of lipocalins
The lipocalin protein family is a large group of small extracellular proteins. The family demonstrates great diversity at the sequence level; however, lipocalin crystal structures are highly conserved and comprise a single eight-stranded antiparallel β-barrel, which encloses an internal ligand-binding site. They have been associated with a variety of different functions, among them transport of retinoids, steroids, bilins, pheromones, enzymic synthesis of prostaglandins, cryptic coloration, olfaction, immune response, cell regulation.
Lipocalin-2 (also known as neutrophil gelatinase-associated lipocalin), which is a useful biomarker for early detection of various renal injuries, shows pleiotropic bioactivities in a variety of different cell types and tissues. It plays important roles in angiogenesis, apoptosis, organogenesis, inflammation, hematopoiesis, wound healing, renal physiology, tumor and reproductive biology.Key words:
lipocalin, β-barrel, lipocalin-2, neutrophil gelatinase-associated lipocalin.
Autoři: M. Fořtová 1,2; R. Průša 1; D. Vajtr 3
Působiště autorů: Ústav lékařské chemie a klinické biochemie 2. LF UK a FN Motol 1; Klinika nefrologie 1. LF UK a VFN 2; Ústav soudního lékařství a toxikologie 1. LF UK a VFN 3
Vyšlo v časopise: Klin. Biochem. Metab., 21 (42), 2013, No. 3, p. 112-121
Souhrn
Lipokaliny tvoří velkou skupinu malých extracelulárních proteinů. Vykazují velkou rozmanitost na úrovni sekvenčního uspořádání, terciární struktura je oproti tomu vysoce konzervovaná a představuje ji β-válec tvořený osmi antiparalelními strukturami β-skládaného listu. Vazebné místo ligandu se nachází uvnitř β-válce. Zastávají rozličné funkce, např. transportují retinoidy, steroidy, biliny, feromony, účastní se syntézy prostaglandinů, tvorby ochranného zbarvení bezobratlých, vytváření čichových vjemů, jsou zapojené do regulace buněčné homeostázy a modulace imunitní odpovědi.
Lipokalin-2 (neutrofilní s gelatinázou asociovaný lipokalin), časný marker různých typů renálního poškození, vykazuje pleio-tropní biologické aktivity v různých typech buněk a tkání. Hraje významnou roli v angiogenezi, apoptóze, organogenezi, zánětu, hematopoeze, v procesu hojení ran, v renální fyziologii, v nádorové a reprodukční biologii.Klíčová slova:
lipokalin, β-válec, lipokalin-2, neutrofilní s gelatinázou asociovaný lipokalin.Úvod
Lipokaliny patří do rodiny calycinů a tvoří velkou skupinu funkčně rozdílných malých extracelulárních proteinů s charakteristickou terciární strukturou, které obvykle váží malé hydrofobní molekuly. Vzhledem k této schopnosti byly v minulosti označovány jako transportní proteiny (retinoidů, bilinů, steroidů, lipidů, feromonů), postupně však byly objevovány jejich další funkce. Lipokaliny jsou např. zapojené do regulace buněčné homeostázy a modulace imunitní odpovědi, do interakce nádorových buněk, účastní se syntézy prostaglandinů a enzymů, vývoje tkání, vytváření čichových vjemů, fungují též jako transportéry savčích feromonů (např. v nosním hlenu hlodavců), lipokalinová podskupina „major urinary protein“ (která se nachází v moči myší) zastává přímo funkci feromonů. U bezobratlých hrají lipokaliny úlohu při tvorbě ochranného zbarvení (např. insecticyanin larvy můry lišaje tabákového, biliverdin-binding protein larvy motýla martináče hedvábného, bilin-binding protein motýla běláska zelného, lazarillo lučních kobylek, Bla g4 protein švábů, crustacyanin humrů, karotenoprotein láčkovců). Do rozvoje zánětlivé reakce je zapojený např. α-1-mikroglobulin, α-1-kyselý glykoprotein, C8γ složka komplementu. Lipokaliny jsou známými respiračními alergeny myší, koček, psů, koní a dalších zvířat, lidské alergické reakce na lipokaliny dosud nejsou přesně zmapované. Lipokaliny se nacházejí u obratlovců i bezobratlých, rostlin a gramnegativních bakterií [1-3].
Struktura a klasifikace lipokalinů
Lipokaliny vykazují velkou rozmanitost na úrovni sekvenčního uspořádání, všechny však sdílejí krátký konzervovaný sekvenční motiv, jehož přítomnost je nutná pro začlenění určitého proteinu do lipokalinové „rodiny“. Skupinu lipokalinů můžeme rozdělit na dvě podskupiny: strukturálně příbuzné „kernel“ (core) lipokaliny a méně početné, různorodější „outlier“ lipokaliny.
„Kernel“ lipokaliny sdílejí tři konzervované sekvenční motivy, které odpovídají třem hlavním strukturálně konzervovaným oblastem. První z nich se vyskytuje u všech lipokalinů a představuje jejich hlavní charakteristický znak. Do této skupiny patří např.: retinol vázající protein (retinol-binding protein, RBP), kyselinu retinovou vázající proteiny, bilin vázající protein, purpuriny, α-1-mikroglobulin, major urinary protein, α-2u-globulin, α-crustacyanin, glykodelin, β-laktoglobulin, C8γ složka komplementu, apolipoprotein D, lazarillo, prostaglandin-D syntáza, neutrofilní s gelatinázou asociovaný lipokalin (NGAL), choroid plexus protein.
Podskupina „outlier“ lipokalinů má společné maximálně dva ze tří konzervovaných motivů. Patří sem např.: α-1-kyselý glykoprotein (orosomukoid), odorant vázající proteiny, afrodisin, probasin a proteiny Ebnerovy žlázy.
Přehled hlavních lidských lipokalinů, jejich funkcí a lokalizace lipokalinových genů jsou uvedeny v Tabulce 1.
Tab. 1. Important human lipocalins 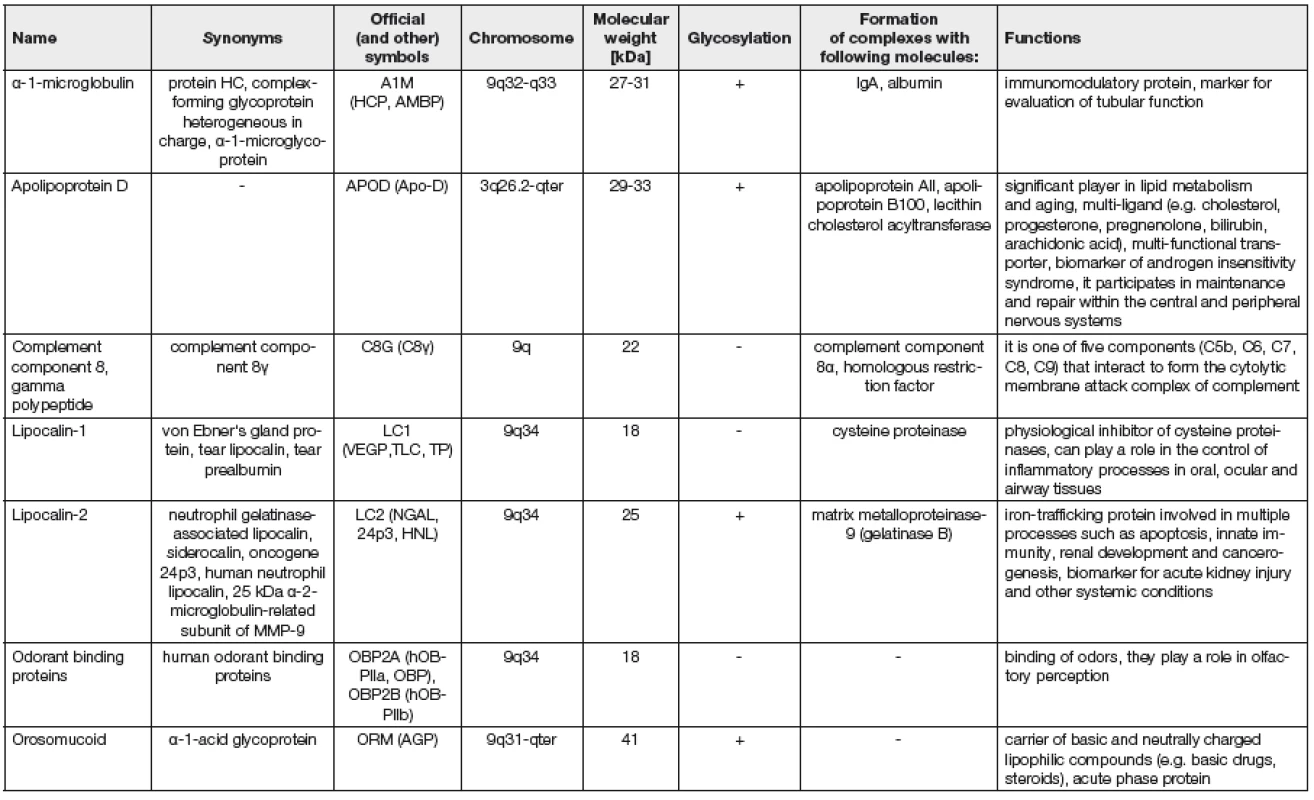
Terciární struktura lipokalinů je (v kontrastu s nízkou sekvenční homologií) vysoce konzervovaná a je sjednocující charakteristikou všech členů této rodiny. Představuje ji β-válec tvořený osmi antiparalelními strukturami β-skládaného listu (jež jsou do výsledné struktury válce zformovány pomocí vodíkových můstků). Vazebné místo ligandu „šálkového tvaru“ se nachází uvnitř β-válce. Osm β-vláken válce označených A-H je spojeno sérií L1-L7 smyček. Smyčky L2-L7 jsou typické krátké β-vlásenky, velká Ω smyčka L1 tvoří jakési „víko“ β-válce a uzavírá vnitřní ligand-vázající místo. Smyčky spojující vlákno A a B (L1), C a D (L3) a E a F (L5) formují vstup do vazebného místa β-válce (obr. 1).
Fig. 1. Schematic representation of lipocalin secondary structure. Letters A-H indicate β-strands participating in β-barrel formation, L1 indicates connecting omega loop, L2-L7 indicate connecting β-hairpin loops, the opened end of the molecule has four loops (L1, L3, L5, L7) and the opening of the internal ligand-binding site is here, the closed end of the molecule has three β-hairpin loops (L2, L4, L6). Adapted from Flower et al., 1996. 
Lipokaliny, společně s dalšími dvěma skupinami ligand-vázajících proteinů (mastné kyseliny vázajícími proteiny (FABPs, fatty acid-binding proteins) a avidiny), jsou součástí větší „superrodiny“ – calycinů. Struktura β-válce uzavírající vnitřní vazebné místo pro ligand je typická pro všechny calyciny. FABP β-válec je 10vláknitý a nesouvislý, β-válec avidinů je 8vláknitý (ale jiného tvaru než β-válec lipokalinů). Calyciny jsou charakterizovány konzervovaným sekvenčním motivem, který koresponduje s neobvyklým strukturálním rysem – krátkým 310 helixem na N-konci molekuly. Lipokaliny syntetizované pro pokusné účely se nazývají antikaliny [1-4].
Vazebné schopnosti lipokalinů
Biologické funkce lipokalinů jsou zprostředkované jednou nebo více z jejich tří charakteristických schopností:
- schopnost vázat malé hydrofobní molekuly,
- schopnost vázat se k specifickým buněčným povrchovým receptorům,
- schopnost formovat makromolekulární komplexy se solubilními molekulami.
Lipokaliny jsou nejvíce známé pro svoji schopnost vázat malé hydrofobní ligandy. Pro vazbu ligandu je rozhodující tvar, velikost a aminokyselinové složení dutiny uvnitř β-válce, v případě větších ligandů (jejichž část molekuly bývá často hydrofilní) hraje významnou roli i složení smyčky L1 („loop scaffold“) ve vstupu do β-válce. Mezi ligandy lipokalinů patří např. retinoidy, arachidonová kyselina a steroidy.
Mnoho lipokalinů může být internalizováno endocytózou prostřednictvím specifických buněčných povrchových receptorů. Tímto mechanismem se např. dostává retinol do hepatocytů. Buněčné povrchové receptory byly identifikované pro α-1-mikroglobulin, major urinary protein, β-laktoglobulin a odorant vázající proteiny. U některých lipokalinů (např. α-1-kyselý glykoprotein) je endocytóza zprostředkována cestou clathrin-potažených jamek.
Nejméně známou schopností lipokalinů je formování komplexů s hydrofilními molekulami [1-3].
V komplexech s apolipoproteinem AII, s apolipoproteinem B100 a s lecitin:cholesterol acyltransferázou (spojených disulfidovými můstky) je vázáno přibližně 80 % plazmatického apolipoproteinu D v lipoproteinech [3, 5].
Lipokalin C8γ je vázán disulfidovou vazbou k C8α podjednotce, která je nekovalentně spojená s podjednotkou C8β. Také neutrofilní s gelatinázou asociovaný lipokalin je kovalentně (cestou disulfidových můstků) připojen k lidské neutrofilní gelatináze a tvoří komplexy.
Polovina plazmatického α-1-mikroglobulinu se vyskytuje ve volné formě, zbytek v kovalentních komplexech s dalšími molekulami: s albuminem a imunoglobulinem A u lidí, s fibronektinem a α1-inhibitorem-3 u potkanů [1-3].
Glykodelin interaguje se svým hlavním sérovým přenašečovým proteinem α-2-makroglobulinem. Přidání α-2-makroglobulinu do vzorku proliferujících T buněk významně potencuje inhibiční schopnost glykodelinu [6].
Na příkladu retinol vázajícího proteinu můžeme demonstrovat všechny zmíněné vazebné schopnosti lipokalinů. Je syntetizován v hepatocytech, kde je jako apoprotein saturován all-trans retinolem, což spouští jeho sekreci do cirkulace. 85-90 % plazmatického RBP přenáší navázaný retinol, 96 % je v komplexu s transthyretinem. Navázání na transthyretin zabraňuje jeho ztrátě filtrací ledvinnými glomeruly. RBP je rozpoznáván specifickým buněčným receptorem, následuje uvolnění retinolu a ztráta jeho afinity pro transthyretin. Resultující apo-RBP je filtrován ledvinami, poté reabsorbován a katabolizován. RBP tedy přenáší pouze jednu molekulu retinolu a poté je degradován.
Retinol-vázajícímu proteinu jsou sekvenčně podobné α-1-mikroglobulin a β-laktoglobulin, které jsou také schopné vázat retinol. β-laktoglobulin pravděpodobně usnadňuje absorpci vitaminu A z mléka, α-1-mikroglobulin zprostředkovává exkreci metabolitů retinolu [1, 3].
Přehled a funkce vybraných lipokalinů
Kernel lipokaliny
Neutrofilní s gelatinázou asociovaný lipokalin (lipokalin-2)
V souvislosti s akutním selháním ledvin je v současné době nejvíce diskutovaným lipokalinem neutrofilní s gelatinázou asociovaný lipokalin (NGAL, synonyma např.: lipokalin-2 (Lcn2), onkogenní protein 24p3, siderocalin). Byl objeven na začátku 90. let minulého století. Jedná se o malý proteáza-rezistentní glykoprotein (25 kDa, 178 aminokyselinových zbytků), který byl původně identifikován v neutrofilních granulích, v nichž je kovalentně vázán na gelatinázu B (matrixovou metaloproteinázu 9, MMP-9). Lipokalin-2 však není vždy asociován s MMP-9. Je syntetizován v časných stádiích granulopoézy (v myelocytech – v průběhu formace sekundárních granulí), zralé neutrofily ho postrádají. Proto byl navrhován i za časný marker diferenciace granulocytů. Expresi lipokalinu-2 v myeloidních buňkách (před začátkem diferenciace v granulocyty) indukují IGF-1 a G-CSF [7 - 9].
Exprese lipokalinu-2 byla zjištěna také v následujících buňkách: v adipocytech, chondrocytech, endometriálních, endoteliálních a epiteliálních buňkách, fibroblastech, hepatocytech, keratinocytech, makrofázích, mesangiálních buňkách, myelocytech, myoblastech, pneumocytech typu 2, splenocytech, thymocytech, buňkách hladké svaloviny cév, buňkách některých karcinomů (např. ovaria či pankreatu). Nachází se tedy v celé řadě tkání a orgánů – např. v plicích, žaludku, střevě, játrech, prostatě, děloze, slinných žlázách. Nejvyšší produkce ze všech výše uvedených buněk byla zjištěna v buňkách distálních tubulů nefronu [10 - 15].
Ve zmíněných buněčných typech je syntéza lipokalinu-2 indukována různými faktory – např.: bakteriálními lipopolysacharidy, dexametazonem, G-CSF, HGF, IGF-1, IL1-β, IL6, leptinem, kyselinou retinovou, TGF-α, TNF-α, IL17. Exprese lipokalinu-2 v hladkých svalových buňkách cév závisí na expresi NF-κB, která je ovlivněna různými cytokiny a růstovými faktory. V některých situacích je exprese lipokalinu-2 regulována autokrinním mechanismem. Lipokalin-2 vykazuje pleiotropní biologické aktivity v rozličných buněčných typech a tkáních. Díky některým z nich bychom mohli lipokalin-2 též klasifikovat jako cytokin nebo růstový faktor [11, 12, 14 - 17].
Vzhledem k malé velikosti molekuly a rezistenci vůči odbourávání je lipokalin-2 snadno renálně vyloučen a detegován v moči – jak jeho volná forma (nejčastěji jako monomer, v malém množství též jako dimer či trimer), tak v komplexu s MMP-9. Je volně filtrovatelný, ale může být též zpětně reabsorbován. Hladiny v moči korelují s hladinami v plazmě nebo séru. Zvláště vysoké koncentrace v moči můžeme očekávat v případě, kdy je lipokalin-2 uvolňován do moči přímo ledvinnými tubuly nebo uroteliálním karcinomem [18].
Syntéza lipokalinu-2 je významně indukována poškozením epitelu (při zánětu, ischemii nebo neoplastických transformacích). Kromě akutního poškození ledvin jsou to např. nádory, záněty střeva, infekce močových cest či systémové infekce, adenokarcinom prsu, pankreatu, uroteliální karcinom. Je produkován též v endotelu (lipokalin-2 byl prokázán v aterosklerotických plátech, v aneurysmatech aorty). Jeho produkce se zvyšuje v orgánech, ve kterých probíhá involuce, jako je poporodní děloha a prsní žláza po laktaci či v klimakteriu; v těchto orgánech zvýšená syntéza lipokalinu-2 indukuje apoptózu [19 - 22].
Miharada et al. ve své práci uvádějí, že lipokalin-2 je hojně vyjádřen v progenitorových buňkách erytrocytů, indukuje jejich apoptózu, inhibuje jejich diferenciaci ve zralé erytrocyty. Během akutní anémie je exprese lipokalinu-2 v erytroidních buňkách redukována autokrinním zpětně vazebným mechanismem [23].
Lipokalin-2 má význam též v imunitní a zánětlivé odpovědi. V pokusech na myších bylo zjištěno, že je jeho exprese indukována aktivací Toll-like receptorů (TLR) na imunitních buňkách. Tyto receptory jsou nástrojem pro včasnou detekci charakteristických mikrobiálních produktů (např. lipopolysacharidů, lipoproteinů, úlomků bakteriálních bičíků, bakteriální DNA, virové RNA) a k zahájení rychlých obranných reakcí. Exprese lipokalinu-2 je významně snížená v případě chybění TLR2 signalizace [24].
Lipokalin-2 pevně váže bakteriální enterobaktin a některé další siderofory (látky produkované a vylučované ve zvýšené míře bakteriemi, které komplexují Fe (III) a transportují ho do bakteriální buňky). Sekvestrací sideroforů s navázaným Fe brání přísunu železa do bakteriální buňky, a tím omezuje bakteriální růst. Bakterie jsou však schopné siderofory modifikovat, a tím zabránit navázání lipokalinu-2 [25].
V roce 2005 studovali Mori et al. model těžkého renálního ischemicko-reperfuzního poškození u myší a popisují, že podání lipokalinu-2 a následná tvorba komplexu „lipokalin-2: siderofor: Fe“ významně chrání ledvinu upregulací exprese protektivního enzymu hemoxygenázy-1, chránící N-cadherin proximalního tubulu a inhibující buněčnou smrt. Dále bylo zjištěno, že komplexy lipokalinu-2 s železo-vázajícími siderofory mohou přeměnit ledvinné progenitorové buňky na epiteliální buňky renálních tubulů. V postischemické ledvině se lipokalin-2 přednostně kumuluje v proximálních tubulech spolu s proliferujícími buňkami, což hypotézu, že lipokalin-2 indukuje reepitalizaci, podpořilo [26].
Gwira et al. ve své práci demonstrují, že hepatocytární růstový faktor (HGF) stimuluje epiteliální buňky k expresi lipokalinu-2. Suprese exprese lipokalinu-2 stimuluje formování cyst tubulárními buňkami. Simultánní působení lipokalinu-2 a HGF však vede k tvorbě komplexu, který částečně inhibuje HGF-zprostředkovanou aktivaci c-Met a následně MAPK a fosfatidylinositol 3-kinázovou signalizační dráhu. Tento inhibiční efekt downreguluje HGF-stimulovanou buněčnou migraci a limituje větvící morfogenezi. Lokální exprese lipokalinu-2 tedy hraje regulační roli v epiteliální morfogenezi podněcováním přeměny buněk v tubulární struktury, ale současně negativně moduluje větvící efekt HGF [27].
Lipokalin-2 poskytuje organismu alternativní cestu v uvolnění železa do cytoplazmy (vedle transferinu), a tak zprostředkovává aktivaci nebo represi železo-vnímavých genů. Tato cesta hraje roli v organogenezi během mesenchymo-epitelialní přeměny [28].
V roce 2005 naklonovali Devireddy et al. myší receptor pro lipokalin-2 (označený jako 24p3 receptor). Jeho exprese uděluje buňkám schopnost přijímat železo a následně regulovat apoptózu. Lipokalin-2 chudý na železo snižuje intracelulární koncentraci železa, což indukuje expresi pro-apoptotického proteinu Bim a způsobí buněčnou smrt. Na železo bohatý lipokalin-2 intracelulární koncentraci železa zvyšuje, apoptóza není podněcována [29].
Ve stejném roce byl identifikován další vysokoafinitní receptor pro lipokalin-2. Jedná se o receptor z low-density lipoprotein receptorové rodiny (low density lipoprotein-related protein 2, LRP2), který je známý také jako gp330, megalin nebo rat Heymann nephritis antigen a je vyjádřený hlavně v epiteliálních buňkách. Váže velké množství specifických ligandů, zahrnující cytokiny, hormony, další proteiny a nízkomolekulární substance. Hraje významnou roli ve vývoji organismu a v ledvinné fyziologii a patofyziologii [30].
Lipokalin-2 je jedním z nejčasnějších proteinů, jejichž syntéza je indukována v ledvinách po ischemickém a nefrotoxickém poškození; jeho zvýšení v séru a moči lze pozorovat během 2 hodin po vzniku poškození ledvin, 24 až 48 hodin před zvýšením sérového kreatininu. V průřezové studii vykazovali dospělí s prokázaným akutním selháním ledvin (definovaným jako zdvojnásobení sérové koncentrace kreatininu v období kratším než pět dnů) více než desetinásobný vzestup sérové koncentrace lipokalinu-2 a více než stonásobný vzestup jeho koncentrace v moči oproti kontrolním osobám [20, 31–33].
Přínos stanovení tohoto markeru pro časnou detekci akutního poškození ledvin byl pozorován u pacientů na jednotkách intenzivní péče, po kardiochirurgickém výkonu, u pacientů s tzv. kontrastní nefropatií a po podávání nefrotoxických léčiv. U nemocných po transplantaci ledviny se lipokalin-2 ukázal jako perspektivní biomarker opožděného nástupu funkce štěpu [33 - 38].
Lipokalin-2 se jeví jako užitečný biomarker také u dalších renálních poškození. Bolignano et al. např. zjistili, že koncentrace lipokalinu-2 v moči pozitivně korelují se závažností renálního poškození u proteinurických pacientů. Stejní autoři uvádějí, že by lipokalin-2 mohl hrát významnou roli v patofyziologii rozvoje diabetické nefropatie a mohl by se tak stát jejím časným biomarkerem. Další studie popisují, že močový lipokalin-2 by mohl sloužit jako časný biomarker tubulointersticiálního poškození u IgA nefropatie, nefroaktivity lupusové nefritidy. U chronického onemocnění ledvin jeho sérové i močové koncentrace významně korelují s glomerulární filtrací [39 - 43].
Tschesche et al. ve své studii uvádějí, že lipokalin-2 je schopný akcelerovat přímou aktivaci proforem matrixové metaloproteinázy MMP-9 a MMP-8. Aktivitu MMP-9 lipokalin-2 moduluje tím, že ji chrání před degradací, čímž lipokalin-2 zasahuje do regulace procesů přestavby tkání, zejména angiogeneze [44].
V buňkách hladké svaloviny cév je exprese lipokalinu-2 indukována jako odpověď na poškození cév. Lipokalin-2 se váže s MMP-9, a tím je modulována proteolytická aktivita MMP-9 v cévních opravných procesech [15].
Právě podpora angiogeneze však může mít na organismus i negativní dopad, např. při progresi nádorových onemocnění. Fernández et al. uvádějí lipokalin-2 do souvislosti s karcinomem prsu. Jeho zvýšená exprese významně koreluje s negativitou steroidních receptorů, overexpresí Neu onkogenu, horším histologickým gradem, přítomností metastáz v lymfatických uzlinách a vysokým Ki-67 proliferačním indexem. Stanovení lipokalinu-2 (nebo MMP-9) v moči nebo krvi tak může sloužit buď jako prediktor horší prognózy nebo nádorový marker u primárního karcinomu prsu. Zvýšená exprese lipokalinu-2 a zvýšená enzymatická aktivita komplexu lipocalin-2 a MMP-9 významně korelující s invazivitou tumoru byla nalezena i v buňkách spinocelulárního karcinomu jícnu (ve srovnání s normální sliznicí) a významně souvisí i se špatnou prognózou karcinomu žaludku [45 - 47].
Venkatesha et al. naopak uvádějí, že podávání lipokalinu-2 by v některých případech mohlo být užitečné pro inhibici nádorové angiogeneze. Lipokalin-2 suprimuje expresi VEGF (vaskulárního endotheliálního růstového faktoru) prostřednictvím down-regulace Ras mitogenem aktivované protein kinázy a Ras fosfatidylinositol-3 kinázové signalizace a upreguluje expresi anti-angiogenního proteinu trombospondinu-1 v buňkách transformovaných Ras onkogenem [48].
Hanai et al. zjistili, že lipokalin-2 je schopný konvertovat Ras onkogenem transformované buňky mezenchymálních tumorů do epiteliálního fenotypu, zvyšuje expresi E-cadherinu a suprimuje buněčnou invazivitu in vitro a růst tumoru a plicní metastazování in vivo. Exprese lipokalinu-2 je např. downregulována v buněčných liniích ovariálního karcinomu podstupující epiteliálně-mezenchymalní přeměnu. Downregulace exprese lipokalinu-2 koreluje s upregulací exprese vimentinu, downregulací exprese E-kadherinu, tj. s některými známkami epiteliálně-mezenchymální tranzice. U karcinomu střeva zvýšená exprese lipokalinu-2 suprimuje invazivitu a metastazování [49 - 51].
V poslední době je diskutováno, že by lipokalin-2 mohl sloužit též jako vhodný neinvazivní biomarker mozkových tumorů. Smith et al. v roce 2008 publikovali, že stanovení močových koncentrací MMP-2, MMP-9, lipokalinu-2 a VEGF může být užitečné k predikci přítomnosti mozkových tumorů a k monitoraci úspěšnosti jejich léčby. Funkce lipokalinu-2 v centrálním nervovém systému a při rozvoji gliomů však není dosud zcela objasněna. Bylo zjištěno, že lipokalin-2 je secernovaný aktivovanými mikrogliemi a astrocyty a že těmto buňkám uděluje autokrinním způsobem citlivost k apoptóze. Lipokalin-2 je tedy pravděpodobně spojený s přežitím/smrtí buněk gliomů a potenciálně i s lékovou rezistencí. Studie Zhenga et al. z roku 2009 uvádí, že down-regulace lipokalinu-2 přispívá k chemorezistenci glioblastomových buněk. Podání rekombinantního proteinu lipokalinu-2 nebo zavedení cDNA lipokalinu-2 významně zvýšilo senzitivitu glioblastomových buněk k chemoterapii. Lipokalin-2 zvýšil chemoterapeutikem (konkrétně 1,3-bis (2-chlorethyl)-1-nitrosoureou) indukovanou Akt defosforylaci, což je molekulární podstatou senzitizace k apoptóze. V současné době probíhá studie vedená Nebrasskou univerzitou (jejíž první vyhodnocení proběhne v září 2014), která sleduje koncentrace MMP-2, MMP-9 a komplexu MMP-9/lipokalin-2 v mozkové tkáni a v moči u pacientů s high grade (grade IV) gliomy a srovnává je s kontrolní skupinou pacientů podstupujících chirurgický zákrok na mozku pro epilepsii [52, 53].
Lipokalin-2 je intenzivně studovaným markerem také u jiných typů mozkového poškození, jeho koncentrace může být ovlivněna právě i u zmíněné kontrolní skupiny pacientů operovaných pro epilepsii. Jeho zvýšená genová exprese byla pozorována při experimentální ischemii mozkové hemisféry po okluzi arteria cerebri media. V některých studiích byla studována genová exprese po experimentálním primárním traumatu mozku. U myší s rozdílným genotypem apolipoproteinu E byla největší exprese lipokalinu-2 u izoformy E3. S využitím real-time PCR byla potvrzena mRNA lipokalinu-2 v astrocytech izolovaných po experimentální intracerebrální hemorhagii do bazálních ganglií. Migrace leukocytů do poraněných regionů mozku je regulována lokální produkcí cytokinů. Role komplexu MMP-9/lipokalin-2 v poškození hematoencefalické bariéry při transmigraci leukocytů do poraněných oblastí mozku není jednoznačně prokázána. V oblasti reaktivní potraumatické astrogliózy může lipokalin-2 interagovat s intracelulárními kaskádami MAP-kináz astrocytů [54].
Zvýšené hladiny lipokalinu-2 byly zjištěny např. i u nemocných s osteoartritidou. Formování komplexu s MMP-9 chrání její aktivitu a může tak přispět ke ztrátě matrixových proteinů chrupavky (uvolnění proteoglykanů chrupavčité matrix) [55].
V roce 2007 Yan et al. označili lipokalin-2 též jako adipokin zvyšující inzulinovou rezistenci. Jeho syntézu stimulují faktory, které zvyšují inzulinorezistenci. Lipokalin-2 je hojně exprimován v tukových tkáních a játrech a je označen za zánětlivý marker asociovaný s obezitou, inzulinovou rezistencí a hyperglykémií [10, 56].
Sørensen et al. popisují funkci lipokalinu-2 v procesu hojení ran. Poranění lidské kůže indukuje epidermální expresi antimikrobiálních polypeptidů zahrnující lipokalin-2, β-defensin-3 a SLPI (secretory leukocyte protease inhibitor), což zvýší aktivaci EGF receptorů. Dále bylo zjištěno, že lipokalin-2 usnadňuje regeneraci sliznice podněcováním migrace epiteliálních buněk [57, 58].
Berger et al. studovali biologické aktivity lipokalinu-2 u knock-outovaných myší postrádajících expresi tohoto proteinu. Tyto myši se jevily zdravé a vykazovaly normální vývoj ledvin, normální skladbu imunitních buněk a normální odpovědi na stimuly indukující apoptózu. Byly však více vnímavé k bakteriálním infekcím a jejich neutrofily byly signifikantně méně bakteriostatické. Samičí knock-outované myši, ale nikoliv samčí, byly významně méně plodné [59].
Apolipoprotein D
Apolipoprotein D je glykoprotein o molekulové hmotnosti 29-33 kDa, který nevykazuje podobnost s ostatními molekulami apolipoproteinů. Jedná se o multifunkční transportér schopný vázat více ligandů – např. cholesterol, progesteron, pregnenolon, bilirubin a arachidonovou kyselinu. Vysoké koncentrace byly nalezeny ve slezině, varlatech, mozku, tekutině vnitřního ucha, ale též v tekutině cyst u žen s cystickým onemocněním prsu. Je akumulován také v místech regenerujících periferních nervů a v mozkomíšním moku u pacientů s neurodegenerativními chorobami, např. Alzheimerovou chorobou. Má význam v patologii a farmakoterapii schizofrenie a bipolární poruchy [3, 5].
C8γ složka komplementu
Lipokalin C8γ je podjednotka C8 složky komplementu. C8 se účastní tvorby membranolytického komplexu, jež vyústí v lýzu buňky. C8γ interaguje s C8 vázajícím proteinem, známým také jako „homologous restriction factor“ a nacházejícím se na buněčném povrchu eukaryotických a dalších buněk. Tato interakce zabrání tvorbě membranolytického komplexu [1-3].
Glykodelin
Glykodelin (placentární protein 14, PP14, progestagen-asociovaný endometriální protein, pregnancy protein 14) je imunosupresivní glykoprotein. Existuje jeho několik isoforem (glykodelin A, F a S) lišících se glyko-sylací. Glykodelin A je hlavní progesteronem regulovaný glykoprotein secernovaný do dutiny děložní sekrečními/decidualizovanými žlázkami. Glykodeliny jsou exprimovány i v jiných tkáních a orgánech, např. ve vejcovodu, vaječníku, prsu, seminálních váčcích, kostní dřeni a ekrinních žlázách. Glykodelin A a glykodelin F inhibují vazbu spermie-vajíčko, zatímco glykodelin S ze seminální plazmy takový efekt nemá. Absence kontraceptivního glykodelinu A v děloze během periovulačního období umožňuje početí [6].
Retinol vázající protein
Retinol vázající protein je transportérem retinolu v lidské plazmě. Vykonává několik fyziologických funkcí:
- usnadňuje transport nerozpustného retinolu ze zásobních míst v játrech do periferních tkání,
- chrání navázaný retinol před oxidací,
- jeho syntéza reguluje uvolnění retinolu z jater a zajišťuje specificitu jeho vychytávání cílovými buňkami [1, 3].
Prostaglandin D syntáza
Prostaglandin D syntáza (PGDS, prostaglandin-H2 D-isomeráza) je glykoprotein specifický pro mozek syntetizovaný hlavně v arachnoidálních buňkách, choroidním plexu a oligodendrocytech a je secernovaný do mozkomíšního moku jako β-trace protein. Ve stopovém množství je β-trace protein i v jiných tělních tekutinách včetně séra, jeho koncentrace v likvoru je však 32krát vyšší než v séru. Je tedy výborným markerem likvorhey. PGDS indukuje a reguluje nonREM spánek prostřednictvím syntézy PGD2. Intenzivní syntéza PGDS byla prokázána v buňkách meningeomu a plaků u pacientů s roztroušenou sklerózou. V poslední době je PGDS diskutována též v souvislosti s kardiovaskulárním rizikem (jako nadějný biomarker akutních koronárních syndromů a akutní dekompenzace srdečního selhání) a je navrhována za alternativní marker cystatinu C při odhadu glomerulární filtrace [60].
Lazarillo
Lipokalin lučního koníka lazarillo se účastní tvorby a vývoje neuronů, neuroblastů, gangliových buněk centrálního nervového systému, senzorických neuronů periferního nervového systému a podskupiny neuronů střevního nervového systému [3].
Major urinary protein, α-2u-globulin
Lipokaliny některých hlodavců jsou spojené s feromonální komunikací mezi samcem a samicí. Major urinary protein nacházející se v moči myší zastává přímo funkci feromonu. α-2µ-globulin potkaních samců zastává feromon transportující roli v holokrinních sebaceózních žlázách, jeho nejvyšší koncentrace byla nalezena v žlázách prepuciálních [3].
Outlier lipokaliny
α-1-kyselý glykoprotein
α-1-kyselý glykoprotein je součástí normálního séra, reaktant akutní fáze. Jeho biologická funkce není dosud zcela objasněna. Zvyšuje se např. při zánětlivých procesech, infekčních onemocněních, různých typech zhoubných nádorů a také po větších chirurgických výkonech, stejně tak ovšem vzrůstá i v těhotenství. Byla prokázána jeho schopnost vázat in vitro různé ligandy, jejichž spektrum je velmi široké – od malých anorganických iontů po steroidní hormony a různé léky (např. fenobarbital). Zdá se tedy, že α-1-kyselý glykoprotein by mohl být primárně transportérem. Dále bylo zjištěno, že má imunomodulační efekt – inhibuje proliferační odpověď lymfocytů, smíšenou lymfocytární odpověď, agregaci neutrofilů a tvorbu superoxidového aniontu [3].
Odorant-vázající proteiny
Odorant-vázající proteiny jsou malé proteiny secernované v nosním hlenu obratlovců (včetně člověka). Lipofilní čichové aktivní láky (odoranty) se dostávají k ciliím receptorů vrstvou hlenu po navázání právě na tyto proteiny, čímž se stávají rozpustnými ve vodě [3].
Lipokalin z lidské Ebnerovy žlázy jazyka
Lipokalin z lidské Ebnerovy žlázy jazyka (lipocalin-1) je fyziologický inhibitor cysteinových proteáz, a proto může hrát roli v kontrole zánětlivých procesů v tkáních dutiny ústní. Stejný lipokalin byl nalezen i v slzách, nosní a tracheální sliznici, prostatě. Recentně bylo zjištěno, že lipokalin-1 (společně s lipokalinem-2) zastává významnou funkci také v patogenezi alergických a infekčních onemocnění dýchacích cest. Pravděpodobně vychytává lipofilní, potenciálně škodlivé látky, a tak by mohl být významným ochranným faktorem epiteliálních buněk. Lipokaliny 1 a 2 jsou proto zvažovány za možné kandidáty pro vývoj nových léků [3, 61, 62].
Afrodisin
Ve vaginálním sekretu samice křečka se nachází lipokalin afrodisin, který je detegován samčím přídavným čichovým systémem. Dosud není známo, zda působí jako feromon, nebo funguje jako přenašeč feromonů [3].
Závěr
Lipokaliny tvoří velkou skupinu malých extracelulárních proteinů. Zastávají rozličné funkce, např. transportují retinoidy, steroidy, feromony, účastní se syntézy prostaglandinů. Některé lipokaliny by mohly mít význam při vývoji nových léků (např. proti zánětlivým nebo nádorovým onemocněním). Lipokalin-2 (neutrofilní s gelatinázou asociovaný lipokalin) má významnou roli v medicíně jako časný marker různých typů renálního poškození, zastává však důležitou roli také v angiogenezi, apoptóze, organogenezi, zánětu, hematopoeze, v procesu hojení ran, v renální fyziologii, v nádorové a reprodukční biologii.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Do redakce došlo 29. 3. 2013
Adresa pro korespondenci:
MUDr. Ing. Magdaléna Fořtová
Ústav lékařské chemie a klinické biochemie UK 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: MagdalenaFortova@seznam.cz
Zdroje
1. Flower, D. R. The lipocalin protein family: structure and function. Biochem. J., 1996, 318, p.1-14.
2. Flower, D. R., North, A. C., Attwood, T. Structure and sequence relationships in the lipocalins and related proteins. Protein. Sci., 1993, 2, p. 753-761.
3. The Lipocalin Protein Family Database. Dostupný na www: <http//www.ibibiobase.com/projects/lipocalin/index.htm>
4. Smathers, R. L., Petersen, D. R. The human fatty acid-binding protein family: Evolutionary divergence and functions. Human Genomics, 2011, 5, p. 170-191.
5. Rassart, E., Bedirian, A., Do Carmo, S. et al. Apolipoprotein D. Biochem. Biophys. Acta, 2000, 1482 (1-2), p. 185-198.
6. Seppälä, M., Tailor, R. N., Koistinen, H. et al. Glycodelin: A major lipocalin protein of reproductive axis with diverse actions in cell recognition and differentiation. Endocr. Rev., 2002, 23 (4), p. 401-430.
7. Kjeldsen, L., Johnsen, A. H., Sengeløv, H. et al. Isolation and primary structure of NGAL, a novel protein associated with human neutrophil gelatinase. Biol. Chem., 1993, 268 (14), p. 10425-10432.
8. Liu, M., Prisco, M., Drakas, R., Searles, D., Baserga, R. 24p3 differentiation of myeloid cells. J. Cell. Physiol., 2005, 205 (2), p. 302-309.
9. Kjeldsen, L., Sengeløv, H., Lollike, K., Nielsen, M. H., Borregaard, N. Isolation and characterization of gelati-nase granules from human neutrophils. Blood, 1994, 83 (6),1640-1649.
10. Yan, Q. W., Yang, Q., Mody, N. et al. The adipokine lipocalin 2 is regulated by obesity and promotes insulin resistence. Diabetes, 2007, 56 (10), p. 2533-2540.
11. Cowland, J. B., Sørensen, O. E., Sehested, M., Borregaard, N. Neutrophil gelatinase-associated lipocalin is up-regulated in human epithelial cells by IL-1 beta, but not by TNF-alpha. J. Immunol., 2003, 171 (12), p. 6630-6639.
12. Jayaraman, A., Roberts, K. A., Yoon, J. et al. Identification of neutrophil gelatinase-associated lipocalin (NGAL) as a discriminatory marker of the hepatocyte-secreted protein response to IL-1beta: a proteomic analysis. Biotechnol. Bioeng., 2005, 91 (4), p. 502-515.
13. Mallbris, L., O‘Brien, K. P., Hulthén, A. et al. Neutrophil gelatinase-associated lipocalin is a marker for dysregulated keratinocyte differentiation in human skin. Exp. Dermatol., 2002, 11 (6), p. 584-591.
14. Sunil, V. R., Patel, K. J., Nilsen-Hamilton, M., Heck, D. E., Laskin, J. D., Laskin, D. L. Acute endotoxemia is associated with upregulation of lipocalin 24p3/Lcn2 in lung and liver. Exp. Mol. Pathol., 2007, 83 (2), 177-187.
15. Bu, D. X., Hemdahl, A. L., Gabrielsen, A. et al. Induction of neutrophil gelatinase-associated lipocalin in vascular injury via activation of nuclear factor-kappa B. Am. J. Pathol., 2006, 169 (6), p. 2245-2253.
16. Sørensen, O. E., Cowland, J. B., Theilgaard-Mönch, K., Liu, L., Ganz, T., Borregaard, N. Wound healing and expression of antimicrobial peptides/polypeptides in human keratinocytes, a consequence of common growth factors. J. Immunol., 2003, 170 (11), p. 5583-5589.
17. Hekerman, P., Zeidler, J., Korfmacher, S. et al. Leptin induces inflammation-related genes in RINm5F insulinoma cells. BMC Mol. Biol., 2007, 8, p. 41.
18. Yan, L., Borregaard, N., Kjeldsen, L. et al. The high molecular weight urinary matrix metalloproteinase (MMP) activity is a complex of gelatinase B/MMP-9 and neutrophil gelatinase-associated lipocalin (NGAL). Modulation of MMP-9 activity by NGAL. J. Biol. Chem., 2001, 276, p. 37258-37265.
19. Bong, J. J., Seol, M. B., Kim, H. H., Han, O., Back, K., Baik, M. The 24p3 gene is induced during involution of the mammary gland and induces apoptosis of mammary epithelial cells. Mol. Cells., 2004, 17 (1), p. 29-34.
20. Nickolas, T. L., Barasch, J., Devarajan, P. Biomarkers in acute and chronic kidney disease. Curr. Opin. Nephrol. Hypertens., 2008, 17 (2), p. 127-132.
21. Hemdahl, A. L., Gabrielsen, A., Zhu, C. et al. Expression of neutrophil gelatinase-associated lipocalin in atherosclerosis and myocardial infarction. Arterioscler. Thromb. Vasc. Biol., 2006, 26, p. 136-142.
22. Friedl, A., Stoesz, S. P., Buckley, P. et al. Neutrophil gelatinase-associated lipocalin in normal and neoplastic human tissues. Cell type-specific pattern of expression. Histochem. J., 1999, 31, p. 433-441.
23. Miharada, K., Hiroyama, T., Sudo, K., Nagasawa, T., Nakamura, Y. Lipocalin 2 functions as a negative regulator of red blood cell production in an autocrine fashion. FASEB J., 2005, 19 (13), p. 1881-1883.
24. Draper, D. W., Bethea, H. N., He, Y. W. Toll-like receptor 2-dependent and -independent activation of macrophages by group B streptococci. Immunol. Lett., 2006, 102 (2), p. 202-214.
25. Goetz, D. H., Holmes, M. A., Borregaard, N., Bluhm, M. E., Raymond, K. N., Strong, R. K. The neutrophil lipocalin NGAL is a bacteriostatic agent that interferes with siderophore-mediated iron acquisition. Mol. Cell., 2002, 10 (5), p. 1033-1043.
26. Mori, K., Lee, H. T., Rapoport, D. et al. Endocytic delivery of lipocalin-siderophore-iron complex rescues the kidney from ischemia-reperfusion injury. J. Clin. Invest., 2005, 115, p. 610-621.
27. Gwira, J. A., Wei, F., Ishibe, S., Ueland, J. M., Barasch, J., Cantley, L. G. Expression of neutrophil gelatinase-associated lipocalin regulates epithelial morphogenesis in vitro. J. Biol. Chem., 2005, 280 (9), p. 7875-7882.
28. Yang, J., Goetz, D., Li, J. Y. et al. An iron delivery pathway mediated by a lipocalin. Mol. Cell., 2002, 10 (5), p. 1045-1056.
29. Devireddy, L. R., Gazin, C., Zhu, X., Green, M. R. A cell-surface receptor for lipocalin 24p3 selectively mediates apoptosis and iron uptake. Cell, 2005, 123 (7), p. 1293-1305.
30. Hvidberg, V., Jacobsen, C., Strong, R. K., Cowland, J. B., Moestrup, S. K., Borregaard, N. The endocytic receptor megalin binds the iron transporting neutrophil-gelatinase-associated lipocalin with high affinity and mediates its cellular uptake. FEBS Lett., 2005, 579 (3), p. 773-777.
31. Mishra, J., Mori, K., Ma, Q., et al. Amelioration of ischemic acute renal injury by neutrophil gelatinase-associated lipocalin. J. Am. Soc. Nephrol., 2004, 15 (12), p. 3073-3082.
32. Fořtová, M., Bláhová, K., Fencl, F., Stará, V., Pechová, M., Průša, R. Vyšetření neutrofilního s gelatinázou asociovaného lipokalinu v moči u dětských pacientů s akutním a chronickým onemocněním ledvin. Klin. Biochem. Metab., 2011, 19 (40), p. 200.
33. Teplan, V., Trbušek, J. Akutní poškození a selhání ledvin: nové biomarkery v časné diagnostice. Postgraduální medicína, 2010, 9, p. 984-989.
34. Zappitelli, M., Washburn, K. K., Arikan, A. A. et al. Urine neutrophil gelatinase-associated lipocalin is an early marker of acute kidney injury in critically ill children: a prospective cohort study. Crit. Care, 2007, 11 (4), R84.
35. Hirsch, R., Dent, C., Pfriem, H. et al. NGAL is an early predictive biomarker of contrast-induced nephropathy in children. Pediatr. Nephrol., 2007, 22 (12), p. 2089-2095.
36. Bennett, M., Dent, C. L., Ma, Q. et al. Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study. Clin. J. Am. Soc. Nephrol., 2008, 3 (3), p. 665-673.
37. Parikh, C. R., Jani, A., Mishra, J. et al. Urine NGAL and IL-18 are predictive biomarkers for delayed graft function following kidney transplantation. Am. J. Transplant., 2006, 6 (7), p. 1639-1645.
38. Wagener, G., Jan, M., Kim, M. et al. Association between increases in urinary neutrophil gelatinase-associated lipocalin and acute renal dysfunction after adult cardiac surgery. Anesthesiology, 2006, 105 (3), p. 485-491.
39. Bolignano, D., Coppolino, G., Campo, S. et al. Urinary neutrophil gelatinase-associated lipocalin (NGAL) is associated with severity of renal disease in proteinuric patients. Nephrol. Dial. Transplant., 2008, 23 (1), p. 414-416.
40. Bolignano, D., Lacquaniti, A., Coppolino, G. et al. Neutrophil gelatinase-associated lipocalin as an early biomarker of nephropathy in diabetic patients. Kidney Blood Press. Res., 2009, 32 (2), p. 91-98.
41. Ding, H., He, Y., Li, K. et al. Urinary neutrophil gelatinase-associated lipocalin (NGAL) is an early biomarker for renal tubulointerstitial injury in IgA nephropathy. Clin. Immunol., 2007, 123 (2), p. 227-234.
42. Pitashny, M., Schwarz, N., Qing, X. et al. Urinary lipocalin-2 is associated with renal disease activity in human lupus nephritis. Arthritis Rheum., 2007, 56 (6), p. 1894-1903.
43. Bolignano, D., Lacquaniti, A., Coppolino, G. et al. Neutrophil gelatinase-associated lipocalin (NGAL) and progression of chronic kidney disease. Clin. J. Am. Soc. Nephrol., 2009, 4 (2), p. 337-344.
44. Tschesche, H., Zölzer, V., Triebel, S., Bartsch, S. The human neutrophil lipocalin supports the allosteric activation of matrix metalloproteinases. Eur. J. Biochem., 2001, 268 (7), p. 1918-1928.
45. Fernández, C. A., Yan, L., Louis, G., Yang, J., Kutok, J. L., Moses, M. A. The matrix metalloproteinase-9/neutrophil gelatinase-associated lipocalin complex plays a role in breast tumor growth and is present in the urine of breast cancer patients. Clin. Cancer Res., 2005, 11 (15), p. 5390-5395.
46. Kubben, F. J., Sier, C. F., Hawinkels, L. J. et al. Clinical evidence for a protective role of lipocalin-2 against MMP-9 autodegradation and the impact for gastric cancer. Eur. J. Cancer., 2007, 43 (12), p. 1869-1876.
47. Zhang, H., Xu, L., Xiao, D. et al. Upregulation of neutrophil gelatinase-associated lipocalin in oesophageal squamous cell carcinoma: significant correlation with cell differentiation and tumour invasion. J. Clin. Pathol., 2007, 60 (5): p. 555-561.
48. Venkatesha, S., Hanai, J., Seth, P., Karumanchi, S. A., Sukhatme, V. P. Lipocalin 2 antagonizes the proangiogenic action of ras in transformed cells. Mol Cancer Res., 2006, 4 (11), p. 821-829.
49. Hanai, J., Mammoto, T., Seth, P. et al. Lipocalin 2 diminishes invasiveness and metastasis of Ras-transformed cells. J. Biol. Chem., 2005, 280 (14), p. 13641-13647.
50. Lim, R., Ahmed, N., Borregaard, N. et al. Neutrophil gelatinase-associated lipocalin (NGAL) an early-screening biomarker for ovarian cancer: NGAL is associated with epidermal growth factor-induced epithelio-mesenchymal transition. Int. J. Cancer., 2007, 120 (11), p. 2426-2434.
51. Lee, H. J., Lee, E. K., Lee, K. J., Hong, S. W., Yoon, Y., Kim, J. S. Ectopic expression of neutrophil gelatinase-associated lipocalin suppresses the invasion and liver metastasis of colon cancer cells. Int. J. Cancer., 2006, 118 (10), p. 2490-2497.
52. Smith, E. R., Zurakowski, D., Saad, A., Scott, R. M., Moses, M. A. Urinary biomarkers predict brain tumor presence and response to therapy. Clin. Cancer. Res., 2008, 14 (8), p. 2378-2386.
53. Zheng, L. T., Lee, S., Yin, G. N., Mori, K., Suk, K. Down-regulation of lipocalin 2 contributes to chemoresistance in glioblastoma cells. J. Neurochem., 2009, 111 (5), p. 1238-1251.
54. Dong, M., Xi, G., Keep, R. F., Hua, Y. Role of iron in brain lipocalin 2 upregulation after intracerebral hemorrhage in rats. Brain Res., 2013, 1505, p. 86-92.
55. Gupta, K., Shukla, M., Cowland, J. B., Malemud, C. J., Haqqi, T. M. Neutrophil gelatinase-associated lipocalin is expressed in osteoarthritis and forms a complex with matrix metalloproteinase 9. Arthritis Rheum., 2007, 56 (10), p. 3326-3335.
56. Wang, Y., Lam, K. S., Kraegen, E. W. et al. Lipocalin-2 is an inflammatory marker closely associated with obesity, insulin resistance, and hyperglycemia in humans. Clin. Chem., 2007, 53 (1), p. 34-41.
57. Sørensen, O. E., Thapa, D. R., Roupé, K. M. et al. Injury-induced innate immune response in human skin mediated by transactivation of the epidermal growth factor receptor. J. Clin. Invest., 2006, 116 (7), p. 1878-1885.
58. Playford, R. J., Belo, A., Poulsom, R. et al. Effects of mouse and human lipocalin homologues 24p3/lcn2 and neutrophil gelatinase-associated lipocalin on gastrointestinal mucosal integrity and repair. Gastroenterology, 2006, 131 (3), p. 809-817.
59. Berger, T., Togawa, A., Duncan, G. S .et al. Lipocalin 2-deficient mice exhibit increased sensitivity to Escherichia coli infection but not to ischemia-reperfusion injury. Proc. Natl. Acad. Sci. U S A, 2006, 103 (6), p. 1834-1839.
60. Orenes-Piñero, E., Manzano-Fernández, S., López-Cuenca, A., Marín, F., Valdés, M., Januzzi, J. L. β-Trace Protein: From GFR Marker to Cardiovascular Risk Predictor. Clin. J. Am. Soc. Nephrol., 2013, 8 (5): 873-881.
61. Redl, B. Human tear lipocalin. Biochem. Biophys. Acta, 2000, 1482 (1-2), p. 241-248.
62. Dittrich, A. M., Meyer, H. A., Hamelmann, E. The role of lipocalins in airway disease. Clin. Exp. Allergy, 2013, 43 (5), p. 503-511.
Štítky
Biochemie Nukleární medicína Nutriční terapeut
Článek EditorialČlánek OceněníČlánek ProgramČlánek Seznam posterůČlánek Abstrakta přednášekČlánek Abstrakta posterůČlánek Autorský rejstřík
Článek vyšel v časopiseKlinická biochemie a metabolismus
Nejčtenější tento týden
2013 Číslo 3- GLP-1RA a PCOS: Je to „jenom“ o hmotnosti?
- Moderní přístupy zvyšující efektivitu antibiotické léčby v nemocniční praxi
- Zpracované masné výrobky a červené maso jako riziko rozvoje kolorektálního karcinomu u žen? Důkazy z prospektivní analýzy
- Farmakologická léčba obezity u pacientek se syndromem polycystických ovarií – systematický přehled a klinická doporučení
- Význam výživy v léčbě nehojících se ran – prakticky a v kostce
-
Všechny články tohoto čísla
- Editorial
- Struktura, funkce a medicínský význam lipokalinů
- HDL: funkce, dysfunkce a laboratorní metody stanovení
- Molekulárně biologické vyšetření estrogenového a somatostatinových receptorů u klinicky afunkčních adenomů hypofýzy.
- Intoxikace vitaminem D – kazuistika
- Glykovaný hemoglobin HbA1C a diagnóza diabetu mellitu. Názory a perspektiva.
- Ocenění
- Program
- Seznam posterů
- Abstrakta přednášek
- Abstrakta posterů
- Autorský rejstřík
- Klinická biochemie a metabolismus
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Intoxikace vitaminem D – kazuistika
- Glykovaný hemoglobin HbA1C a diagnóza diabetu mellitu. Názory a perspektiva.
- Struktura, funkce a medicínský význam lipokalinů
- Abstrakta posterů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




