-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
Candida glabrata – basic characteristics, virulence, treatment, and resistance
Fungal infections are currently a serious health concern. Life-threatening conditions that occur mainly in immunocompromised patients are largely caused by representatives of the genus Candida. The most common causative agent is the yeast Candida albicans, but in recent years there has been a significant shift towards Candida glabrata and other so-called non-albicans Candida yeasts (e.g. Candida tropicalis or Candida parapsilosis). Invasive infections caused by the multidrug-resistant yeast Candida auris are associated with high mortality. There are several differences between C. glabrata and other causative agents of candidiasis in biological characteristics and virulence factors. The innate increased resistance to azoles along with the ability to rapidly acquire resistance to other groups of antifungal agents is a dangerous combination which makes it difficult to manage Candida infections. A better understanding of the virulence factors and mechanisms of resistance to antifungal agents can benefit the management of Candida infections. Equally important is the search for new target sites for antifungal therapy. The present work briefly summarizes the existing knowledge in this area.
Keywords:
biofilm – virulence – Candida glabrata – antifungal resistance – ergosterol
Autoři: D. Eliaš; Y. Gbelská
Působiště autorů: Katedra mikrobiológie a virológie, Prírodovedecká fakulta Univerzity Komenského, Bratislava, Slovenská republika
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 71, 2022, č. 2, s. 118-134
Kategorie: Souhrnné sdělení
Souhrn
Závažný medicínsky problém v súčasnosti predstavujú mykotické infekcie. Život ohrozujúce stavy, ktoré sú asociované najmä s imunokompromitovanými pacientami, spôsobujú vo veľkej miere zástupcovia z rodu Candida. Najčastejším pôvodcom je kvasinka Candida albicans, v posledných rokoch však dochádza k výraznému posunu k druhu Candida glabrata a ďalším tzv. non-albicans Candida kvasinkám (napr. Candida tropicalis, Candida parapsilosis). S vysokou mortalitou sú asociované invazívne infekcie spôsobované multirezistentnou kvasinkou Candida auris. Medzi kvasinkou C. glabrata a ostatnými pôvodcami kandidóz existuje niekoľko rozdielov v biologických vlastnostiach, ako aj vo faktoroch prispievajúcich k virulencii. Vrodene zvýšená rezistencia voči azolom je, spolu so schopnosťou rýchlo nadobúdať rezistenciu aj voči ostatným skupinám antifungálnych látok, nebezpečnou kombináciou pri zvládaní úspešnej liečby kandidových infekcií. Poznanie faktorov podieľajúcich sa na virulencii a mechanizmov vedúcich k rezistencii patogéna voči antifungálnym látkam môže viesť k lepšiemu zvládaniu kandidových infekcií. Nemenej dôležitým je hľadanie nových cieľových miest pre antifungálnu terapiu. Predložená práca stručne sumarizuje existujúce poznatky, ktoré sa venujú uvedenej problematike.
Klíčová slova:
biofilm – Candida glabrata – antifungálna rezistencia – virulencia – ergosterol
ZÁKLADNÁ CHARAKTERISTIKA
Prvá zdokumentovaná identifikácia druhu C. glabrata pochádza z roku 1917. H.W. Anderson, ktorý identifikoval nový druh huby vo vzorkách ľudskej stolice, udelil kvasinke názov Cryptococcus glabratus [1]. Na základe morfologických a biochemických charakteristík došlo neskôr k zmene názvu na Torulopsis glabrata. Dlhé roky bola C. glabrata známa ako málo nebezpečná komenzálna súčasť ľudského gastrointestinálneho traktu a z klinických vzoriek bola izolovaná len sporadicky. Približne od 80. rokov minulého storočia začal narastať počet infekcií spôsobených druhom C. glabrata. Tvorba hýf bola v minulosti klasifikačným kritériom pre druhy patriace do rodu Candida. Avšak schopnosť kvasinky spôsobovať infekcie, ako aj neprítomnosť pohlavného rozmnožovania, nakoniec viedli k zlúčeniu rodov Candida a Torulopsis a súčasnému pomenovaniu [2]. C. glabrata patrí medzi vreckaté huby (Ascomycota). Rozvoj fylogenetických analýz založených na porovnávaní nukleotidových sekvencií odhalil bližšiu príbuznosť kvasinkyC. glabrata s pekárenskou kvasinkou Saccharomyces cerevisiae ako s kvasinkou C. albicans a jej sesterskými druhmi. V súčasnosti je C. glabrata súčasťou tzv. kladu Nakaseomyces, ktorý patrí do pododdelenia Saccharomycotina [3]. Mnohé bežné patogény z rodu Candida (C. albicans, C. parapsilosis, C. tropicalis) patria do tzv. CTG kladu. Kodón CUG v ich prípade kóduje aminokyselinu serín. C. glabrata však využíva štandardný genetický kód a kodón CUG kóduje aminokyselinu leucín [4]. Molekulárne analýzy zaradili kvasinku C. auris do čeľade Metschnikowiaceae, ktorá je blízko príbuzná kladu Clavispora [5]. Fylogenetická skupina Nakaseomyces pozostáva z troch environmentálnych druhov – Candida castellii, Nakaseomyces (Kluyveromyces) delphensis a Nakaseomyces (Kluyveromyces) bacilisporus, ako aj dvoch novo odhalených oportúnnych patogénov Candida nivariensis a Candida bracarensis [6]. Príbuzenské vzťahy medzi jednotlivými kvasinkami ilustruje obr. 1. C. glabrata tvorí súčasť prirodzenej mikroflóry viacerých slizníc. Vyskytuje sa aj v environmentálnych zdrojoch, napr. vo fermentovaných nápojoch a jedlách [7].
Obr. 1. Fylogenetický strom vybraných kvasiniek (Eremothecium gossypii – vláknitá huba blízko príbuzná kvasinkám)
Figure 1. Phylogenetic tree of selected yeasts (Eremothecium gossypii – a filamentous fungus closely related to yeasts)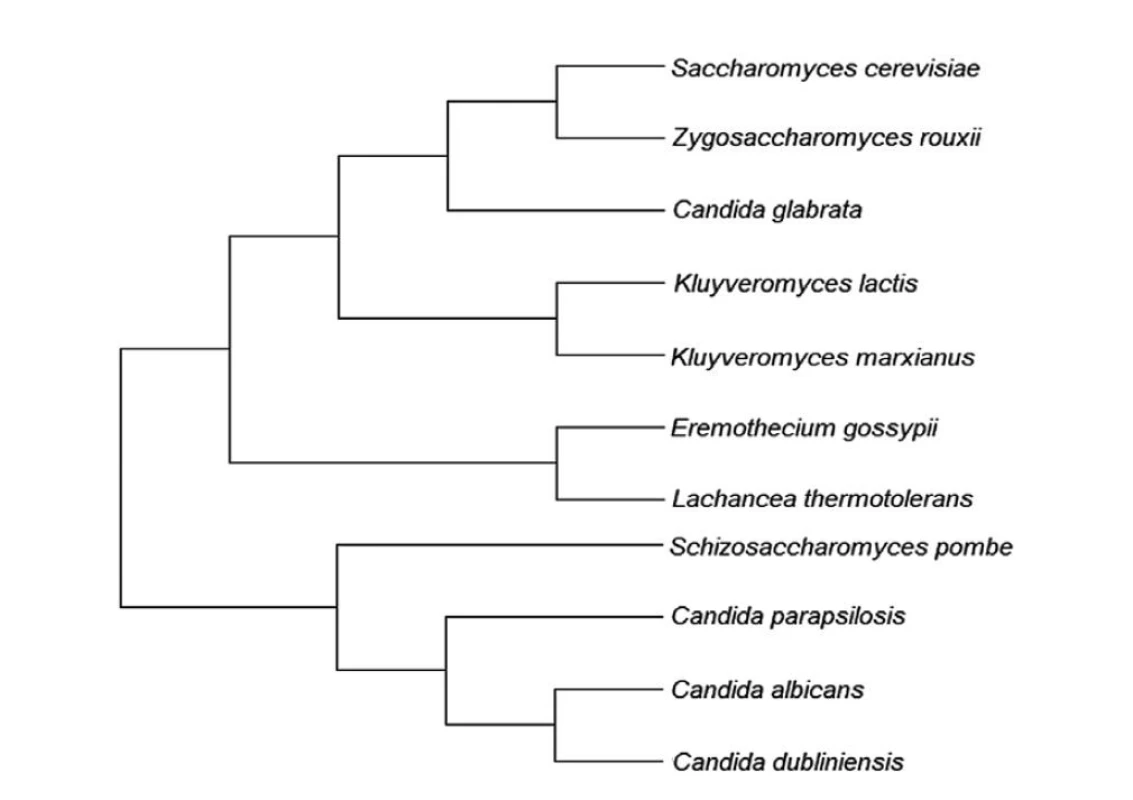
Fylogenetické štúdie odhalili, že C. glabrata patrí do kladu Nakaseomyces, ktorý je evolučne príbuznejší pekárenskej kvasinke S. cerevisiae a len vzdialene príbuzný C. albicans. C. albicans spolu s ďalšími častými pôvodcami kandidóz vytvára oddelený tzv. CTG klad.
Phylogenetic studies have revealed that C. glabrata belongs to the clade Nakaseomyces, which is evolutionarily more closely related to the baker’s yeast S. cerevisiae and only distantly related to C. albicans. C. albicans, along with other common causative agents of candidiasis, form a separate so-called CTG clade.C. glabrata sa vyskytuje takmer výlučne v podobe oválnych alebo sférických blastokonídií. Veľkosť jednotlivých buniek je v rozmedzí od 1 do 4 μm. Pri mikroskopickom zobrazení sú bunky v porovnaní s ostatnými častými pôvodcami kandidóz (C. albicans 4–6 μm, C. tropicalis 4–6 μm,parapsilosis 2,5–4 μm) výrazne menšie [8]. Hyfálna forma rastu sa pri kvasinke druhu C. glabrata nevyskytuje. Pseudohýfy tvorí pri nedostatku dusíka, ako aj pri vystavení buniek oxidu uhličitému [9, 10]. Pravé hýfy sú typické pre druhyC. albicans alebo Candida dubliniensis [8]. C. auris netvorí hýfy, avšak niektoré kmene príležitostne tvoria pseudohýfy [11]. Charakteristické veľké pseudohýfy tvorí aj parapsilosis a pseudohýfy možno pozorovať aj u kvasinky C. tropicalis [8].
Bežným kultivačným médiom je Sabouraudov agar alebo YPD (kvasničný autolyzát, peptón, dextróza). Kolónie kvasiniek C. glabrata sú malé, bielej až krémovej farby s lesklým povrchom. Nie sú výrazne odlíšiteľné od kolónií ostatných zástupcov rodu Candida [12]. Kultivácia kvasiniek C. glabrata na CHROMagarTM Candida médiu je klasickým diagnostickým postupom. Vyrastené kolónie sú ružové až fialové [12].C. albicans tvorí modro - zelené a C. tropicalis tmavomodré kolónie. Kolónie druhu parapsilosis sú biele [8]. Pri kvasinke C. auris pozorujeme ružové alebo béžové kolónie [13].
C. glabrata dokáže reverzibilne vytvárať štyri typy kolónií, ktoré sú farebne odlíšitelné (biele, svetlohnedé, hnedé až tmavohnedé) na YPD médiu s obsahom 1 mM CuSO4. Popísané fenotypy pozorovali aj vo vzorkách izolovaných od pacientiek trpiacich vaginitídou. Tvorba kolónií rôznej farby sa nazýva fenotypová variabilita (phenotypic switching) a je známa aj u iných druhov kvasiniek [14, 15].
C. glabrata je fakultatívne anaeróbna kvasinka, ktorá dokáže asimilovať len glukózu a trehalózu [16]. KvasinkaC. albicans disponuje schopnosťou metabolizovať omnoho širšie spektrum sacharidov s výnimkou sacharózy. C. tropicalis fermentuje a asimiluje sacharózu a maltózu [8]. C. auris asimiluje najmä glukózu, ale dokáže v menšej miere spracovať aj sacharózu a trehalózu [11]. Komerčne dostupné diagnostické súpravy, ako sú napr. API Candida alebo API20C Aux od výrobcu bioMérieux, využívajú existujúce rozdiely v metabolizme kvasiniek na identifikáciu druhov [6]. C. glabrata je prirodzene auxotrofná na niacín, pyridoxín a tiamín. Auxotrofia a obmedzená schopnosť asimilovať sacharidy je dôsledok straty až 29 génov metabolickej dráhy sacharidov, dusíka, síry a fosfátu [17, 18]. Neschopnosť syntézy viacerých metabolitov je však kompenzovaná možnosťou získavať ich z prostredia hostiteľa [12].
Oportúnne patogénna povaha druhu C. glabrata viedla k názoru, že sa rozmnožuje výlučne nepohlavne, tzv. pučaním [19]. V posledných rokoch však niektorí autori naznačujú, že C. glabrata je schopná pohlavného rozmnožovania. Poukazujú pritom na populačné štúdie, ktoré odhalili u kvasinky C. glabrata existenciu oboch párovacích typov. Genetické analýzy preukázali prítomnosť génov potenciálne zapojených do konjugácie ako aj prepínania párovacích typov. Zdôrazňujú tiež, že genómy niektorých kmeňov nesú náznaky rekombinácie medzi rozdielnymi kmeňmi [20, 21].
Genóm kvasinky C. glabrata je haploidný. C. albicans a viaceré patogénne non-albicans druhy majú diploidný genóm [8]. Referenčný kmeň CBS138 má 12.3 Mb genóm a pozostáva z 13 chromozómov označovaných A–M [22]. Celkovo obsahuje 5 293 otvorených čítacích rámcov (ORF) [21] s priemernou veľkosťou 493 kodónov [17]. Priemerný obsah GC párov je 38,8 % [17]. Druh C. glabrata však vykazuje značnú genomickú plasticitu. Častý je výskyt intra - alebo interchromozomálnych duplikácií. Jednotlivé izoláty sa tiež môžu výrazne líšiť v počte a veľkosti chromozómov [22]. C. glabrata spolu so S. cerevisiae a blízko príbuznými kvasinkami podstúpila pred približne 100 miliónmi rokov tzv. celogenómovú duplikáciu. V ďalšom vývoji však došlo k strate množstva génov [6, 22]. Kvasinky C. glabrata tiež obsahujú kruhový mitochondriálny genóm, ktorý patrí k najmenším (20 kb) medzi askomycétnymi kvasinkami. Obsahuje ORF pre gény kódujúce 3 podjednotky cytochróm c oxidázy (COX1, COX2, COX3), apocytochróm b (COB), tri podjednotky ATP syntázy (ATP6, ATP8, ATP9) a jeden gén kódujúci ribozomálny proteín (VAR1). Mitochondriálny genóm tiež obsahuje 23 génov pre molekuly tRNA, 2 gény pre rRNA a jeden gén, ktorý špecifikuje nekódujúcu RNA [23]. Prirodzený výskyt plazmidov u kvasinky druhu C. glabrata nie je známy [24].
Detailnejšie poznanie primárnej štruktúry DNA kvasinky C. glabrata umožnilo postupné zavedenie citlivých identifikačných a typizačných metód. Mnohé pomáhajú identifikovať druhy až na úroveň jednotlivých kmeňov. Správna a rýchla identifikácia je kľúčová pre úspešnú a vhodne zvolenú terapiu predovšetkým v prípade invazívnych kandidóz [25]. Zvlášť citlivé sú metódy založené na polymerázovej reťazovej reakcii (PCR). U kvasinky C. glabrata boli dodnes popísané metódy, ako je real-time PCR [26, 27], multiplex PCR [28, 29], ktorá umožňuje identifikáciu niekoľkých kvasiniek rodu Candida v jednej reakcii a PCR-RFLP (PCR-restriction fragment lenght polymorphism) [29, 30]. Používané primery sú najčastejšie zacielené na ITS (internal transcribed spacer) sekvencie génov ITS1, ITS2 a ITS3 alebo na gény pre ribozomálne RNA [8]. Detailnejšie poznanie genetických rozdielov medzi jednotlivými kmeňmi môžeme získať tzv. genotypizáciou [31]. Multilokusová sekvenčná typizácia (MLST) je založená na sekvenovaní krátkych úsekov (400–600 nt) zvyčajne tzv. housekeeping génov (6–8 lokusov). Podľa primárnej sekvencie lokusu dostáva každá alela určité číslo, ktorých kombináciou vzniká tzv. sekvenčný typ [21]. MLST typizácia sa u kvasinky C. glabrata používa od roku 2003. MLST je najčastejšie zameraná na variácie v sekvenciách 6 lokusov (FKS2, LEU2, NMT1, TRP1, UGP1, URA3) [32]. Získané informácie sa vkladajú do online databázy (dostupná na https://pubmlst.org/organisms/candida-glabrata), čo umožňuje porovnávať získané výsledky jednotlivých laboratórií. MLST typizácia našla uplatnenie pri epidemiologických štúdiách, ako aj štúdiách venujúcich sa antifungálnej rezistencii [21]. Typizácia využívajúca metódu MLP (microsatellite lenght polymorphism) sa u C. glabrata používa od roku 2005. Metóda MLP sleduje rozdiely v tzv. krátkych tandemových repetíciách (mikrosatelity) troch až deviatich lokusov. Mikrosatelity sú niekoľkonásobne opakované sekvencie v genóme s dĺžkou 2 až 6 nukleotidov. Amplifikácia lokusov prebieha pomocou PCR reakcie, pričom jeden z dvojice primerov vždy nesie fluorescenčnú značku. Veľkosť amplikónov určí kapilárna elektroforéza [33]. Použitie rozdielnych fluorescenčných značiek zvyšuje špecificitu reakcie [21]. Obe metódy majú vysokú reprodukovateľnosť a sú užitočným nástrojom pre presnú a spoľahlivú typizáciu izolátov C. glabrata. Metóda MLST je oproti MLP časovo náročnejšia ako aj finančne nákladnejšia [33].
MALDI TOF (matrix-assisted laser desorption/ionization time of flight) je diagnostická metóda s vysokou špecificitou, ktorá dokáže poskytnúť spoľahlivý výsledok v rozsahu niekoľkých minút. Uplatňuje sa pri identifikácii baktérií ako aj húb, vrátane kvasiniek z rodu Candida. V porovnaní s klasickými diagnostickými metódami je výhodou MALDI TOF časová nenáročnosť [34, 35, 36].
MALDI TOF metóda pracuje na princípe merania hmotnosti molekúl vzhľadom k ich náboju. Diagnostika je možná vďaka existencii jedinečných proteínových profilov, ktoré umožňujú identifikáciu až na úrovni jednotlivých druhov. Analogicky k molekulárnym metódam (MLST, MLP) sa získané proteínové profily rôznych mikrobiálnych druhov navzájom odlišujú [34, 35, 37].
Vzorka určená na identifikáciu môže byť kolónia kvasinky narastená na pevnom médiu, v určitých prípadoch sa tiež analyzuje krvná vzorka, moč, mozgovomiechový mok alebo proteínový extrakt. Vzorka sa zmieša s organickou zlúčeninou, tzv. matricou. Ako matrica slúži napr. kyselina α-kyano-4-hydroxyškoricová, kyselina 2,5-dihydrobenzoová alebo kyselina sinapínová. Matrica umožňuje ionizáciu klinického materiálu. Zmes vzorky a matrice sa nanáša na oceľovú platničku, ktorá je po zaschnutí ožarovaná UV žiarením. Ožarovanie prebieha krátku dobu, aby sa predišlo fragmentácii a poškodeniu vzorky. Ožiarenie spôsobí vznik iónov, ktoré následné zaznamenáva detektor prístroja. Vzniknutý signál je analyzovaný pomocou prístrojového softvéra a získaný profil sa porovnáva s dostupnými databázami [34, 35, 37, 38, 39].
CANDIDA GLABRATA AKO OPORTÚNNY PATOGÉN
V posledných desaťročiach došlo k výraznému nárastu fungálnych infekcií. Odhaduje sa, že na komplikácie spojené s fungálnymi infekciami celosvetovo zomrie ročne viac ako jeden milión ľudí [40]. K nepriaznivej situácii výrazným podielom prispievajú invazívne kandidózy, ktoré sú globálne zodpovedné za najmenej 50 000 úmrtí ročne [41]. Rod Candida je spoločné označenie pre 150 druhov rozdielnych kvasiniek. Približne 17 druhov dokáže vyvolať ochorenie u ľudí [42]. Prevládajúcim zástupcom je kvasinka druhu C. albicans. V ostatných rokoch však nastal výrazný posun k tzv. non-albicans druhom (napr. parapsilosis, C. tropicalis, ako ajC. glabrata) [43]. Kandidové infekcie sú treťou najčastejšou príčinou nozokomiálnych infekcií pacientov vyžadujúcich intenzívnu starostlivosť a najčastejšou príčinou fungálnych infekcií spojených s biofilmom [12]. Miera mortality je pri invazívnych kandidózach 45–75% [44].
Oportúnne patogénna kvasinkaC. glabrata je u mnohých imunokompetentných jedincov prirodzenou súčasťou mikroflóry slizníc ústnej dutiny či gastrointestinálneho a urogenitálneho traktu. Narušenie vnútorného prostredia hostiteľa môže byť stimulujúcim faktorom, ktorý vedie k premnoženiu prirodzenej kvasinkovej populácie a rozvoju endoinfekcie. Dôsledkom sú lokálne slizničné infekcie, ale aj život ohrozujúce systémové infekcie. Obzvlášť problematické sú invazívne infekcie pacientov, ktorí trpia rakovinou (predovšetkým hematoonkologickí) alebo AIDS [6, 7, 16]. Zavedenie antiretrovirálnej terapie však spôsobilo zníženie incidencie invazívnych infekcií u HIV pacientov. Vysoko aktívna retrovirálna terapia je asociovaná so zvýšením počtu Th-lymfocytov a znížením vírusovej nálože [45, 46]. Ohrozenú skupinu tvoria aj novorodenci s nízkou pôrodnou hmotnosťou, ľudia vo vysokom veku, pacienti s diabetes mellitus a užívajúci kortikosteroidy alebo transplantovaní jedinci [6, 7, 16]. Spomedzi pacientov s fungálnymi infekciami majú tí s invazívnymi kandidózami vyššiu mieru zastúpenia pridružených zdravotných problémov [46].
Lokálne infekcie sa prejavujú ako orofaryngálna kandidóza (soór) s možnou infekciou priľahlej sliznice pažeráka. Rozvoj orofaryngálnej kandidózy býva prvým prejavom nastupujúcej HIV infekcie [47, 48]. Zavedenie antiretrovirálnej terapie v podobe inhibítorov proteáz malo za následok výrazne zníženie výskytu orofaryngálnej kandidózy medzi HIV pacientami. Aj napriek pokroku v liečbe AIDS ostáva orofaryngálna kandidóza frekventovaným problémom u pacientov so zhoršeným prístupom k antiretrovirálnej terapii. Riziko predstavuje aj objav non-albicans kmeňov, ktoré sú rezistentné voči antifungálnej terapii [48, 49, 50]. Vznik infekcií horného tráviaceho traktu je najčastejší u imunokompromitovaných pacientov, diabetikov a rizikom je aj časté užívanie širokospektrálnych antibiotík. Najčastejším pôvodcom orálnej kandidózy je kvasinkaC. albicans [51]. Lokálnym prejavom infekcie C. glabrata sú tiež infekcie urinárneho traktu a vaginálne infekcie [52]. Najčastejším pôvodcom vulvovaginálnej kandidózy je kvasinka C. albicans. V posledných rokoch dochádza k nárastu vo výskyte infekcií spôsobených druhom C. glabrata. Príčinou môže byť zvýšená expozícia antimykotikám, vrátane voľnopredajných, ktorá viedla k selekcii rezistentných kmeňov. Rizikovými faktormi vulvovaginálnej kandidózy sú tehotenstvo, hormonálne zmeny, diabetes mellitus, imunosupresia, užívanie antibiotík a glukokortikoidov, a tiež genetické predispozície [53].
Podiel kvasinky C. glabrata na infekciách krvného riečiska (kandidémia) predstavuje približne 15 až 29 % [54, 55, 56] spomedzi všetkých zástupcov z rodu Candida. Prevalencia pôvodcov kandidémie vykazuje socio-ekonomickú a verejno-zdravotnú závislosť. V Severnej Amerike a Európe je C. glabrata druhým najčastejším pôvodcom [57, 58] avšak v Ázii alebo Južnej Amerike vystupuje ako tretie, resp. až štvrté najčastejšie sa vyskytujúce etiologické agens [59, 60].
Celosvetový odhad incidencie invazívnych kandidóz je 2–14 prípadov na 100 000 obyvateľov/rok [61]. Najvyšší výskyt invazívnych kandidóz je uvádzaný v Pakistane (21 prípadov na 100 000 obyvateľov/rok) a najnižší v Rakúsku (2 prípady na 100 000 obyvateľov/rok) [62].
V Európe je najčastejšie izolovaná z klinických vzoriek kvasinka C. albicans, po ktorej nasledujú druhy C. glabrata a parapsilosis [63]. V krajinách ako Belgicko alebo Dánsko presahovalo zastúpenie druhuC. glabrata 25 % z vyšetrovaných vzoriek. V Španielsku bola C. glabrata zastúpená len v 13 % prípadov. Častejšie izolované boli druhy C. albicans aparapsilosis [64]. Multicentrická epidemiologická štúdia zameraná na ruských pacientov s invazívnymi kandidózami odhalila, že kvasinka C. albicans bola najčastejšou príčinou (43,2 %). Non-albicans kvasinky boli zastúpené druhmi parapsilosis (20,2 %), C. glabrata (11,5 %) a C. tropicalis (9,6 %). Zvyšné identifikované kvasinky predstavovali minoritne zastúpené druhy [65]. Výsledky získané zo Severnej Ameriky odhalili zmeny v zastúpení pôvodcov invazívnych kandidóz. Medzi rokmi 1992–2011 a 1998–2011 zaznamenali približne 10 % pokles v zastúpení kvasinky C. albicans. Za rovnaké časové obdobie narástol podiel druhu C. glabrata na približne 30 % zo všetkých prípadov invazívnych kandidóz. Tretím najčastejšie izolovaným druhom bola kvasinka parapsilosis [66, 67]. Obdobné trendy v distribúcii jednotlivých pôvodcov kandidových infekcií na území Spojených štátov odhalili niekoľké epidemiologické štúdie [68]. Novší prehľad však odhalil celkový pokles incidencie kandidóz spôsobovaných druhmi C. albicans, C. glabrata a parapsilosis [69]. Epidemiologické prehľady z Južnej Ameriky zistili prevládajúce zastúpenie druhu C. albicans (34–44 %), nasledované druhom parapsilosis (21–27 %) [64]. Prieskum zameraný na ázijsko-pacifickú oblasť ukázal, že kvasinka C. albicans je najčastejším pôvodcom invazívnych kandidóz (41,3 %). Non-albicans kmene boli zastúpené druhmi C. tropicalis (25,4 %), C. glabrata (13,9 %) a parapsilosis (12,1 %) [70]. V Pakistane a Indii má najfrekventovanejšie zastúpenie kvasinka C. tropicalis [64, 70]. Percentuálne zastúpenie pôvodcov invazívnych kandidóz sa v jednotlivých krajinách Blízkeho východu a severnej Afriky odlišuje. Najfrekventovanejšie izolovaným druhom je kvasinka C. albicans. Významné zastúpenie majú aj druhy C. tropicalis parapsilosis, C. glabrata a C. krusei [71].
Z vykonaných epidemiologických štúdií vyplýva, že spomedzi non-albicans druhov má kvasinka C. glabratana jvyššiu prevalenciu v Spojených štátoch, Kanade a severnej Európe. Kvasinka parapsilosis dominuje Latinskej Amerike, južnej Európe a niektorým krajinám Ázie [71, 72].
C. auris bola prvýkrát objavená a popísaná v Japonsku v roku 2009. V priebehu nasledujúceho desaťročia sa rozšírila prakticky celosvetovo. Nálezy kvasinky C. auris pochádzajú z Južnej Kórey, Indie, Pakistanu, Kuvajtu, Izraela, Ománu, Južnej Afriky, Kolumbie, Venezuely, Spojených štátov, Kanady a rôznych štátov Európy [13]. V rámci Európy sa kvasinka C. auris najčastejšie vyskytovala na území Spojeného kráľovstva, ktoré bolo tiež prvou krajinou Európy so zisteným výskytom C. auris [11]. Ďalšie európske krajiny s výskytom kvasinky C. auris sú Španielsko, Nemecko, Švajčiarsko, Belgicko, Rakúsko a Francúzsko [73, 74, 75]. Z mimoeurópskych krajín bol výrazný nárast vo výskyte kandidémie spôsobovanej C. auris pozorovaný v Indii a Južnej Afrike [76, 77].
Incidencia kandidémie je v slovenskej populácii 2,16 prípadov na 100 000 obyvateľov/rok. C. albicans je zodpovedná za 38 % prípadov a zvyšných 62 % predstavujú non-albicans druhy [78]. Údaje z Českej republiky zodpovedajú európskym dátam. Ako najčastejší pôvodcovia invazívnej kandidózy boli identifikované druhy C. albicans, C. glabrata a parapsilosis [79, 80].
Kvasinky sa do krvného riečiska dostávajú najčastejšie po narušení prirodzených obranných bariér kože a slizníc, napr. po chirurgickom výkone, zavedení venózneho katétra alebo poranení. Následkom imunosupresie či dlhodobého a opakovaného užívania širokospektrálnych antibiotík môže dôjsť k premnoženiu prirodzenej kvasinkovej populácie, a invázii kvasiniek do tkaniva a krvného riečiska. Dochádza k diseminovaným infekciám, pri ktorých môže byť napadnutý ktorýkoľvek orgán. V abdominálnej oblasti vzniká absces alebo peritonitída. Invazívne infekcie sa prejavujú aj ako endokarditída, osteomyelitída, infekcia pečene, sleziny, obličiek, pľúc, dokonca aj očí a v ojedinelých, veľmi závažných prípadoch, býva napadnutý aj mozog [81, 82].
FAKTORY VIRULENCIE A INTERAKCIA S HOSTITEĽOM
Patogénne mikroorganizmy disponujú virulenčnými faktormi, ktoré im umožňujú kolonizovať hostiteľa a prenikať do tkanív, ako aj unikať hostiteľskej imunitnej odpovedi. K najdôležitejším virulenčným faktorom rodu Candida patrí schopnosť buniek adherovať a tvoriť biofilm, ako aj produkcia hydrolytických enzýmov, ktoré poškodzujú tkanivo hostiteľa (sekretované aspartylproteázy, fosfolipázy, hemolyzíny). Významným faktorom virulencie je tiež tvorba hýf, ktoré prispievajú k invázii do tkanív [83]. Na rozdiel od druhu C. albicans kvasinka C. glabrata nevylučuje aspartylproteázy a netvorí hýfy [40].
S ohľadom na neprítomnosť uvedených virulenčných faktorov nie je známy presný spôsob prenikania kvasiniek C. glabrata do tkanív a krvného riečiska hostiteľa. Vonkajšie narušenie prirodzených obranných bariér hostiteľa hrá významnú rolu, avšak nevysvetľuje všetky prípady invazívnych infekcií [84]. Uvažuje sa tiež o koinfekcii s kvasinkou C. albicans alebo baktériou Clostridium difficile, ktoré dokážu sprostredkovať inváziu buniek C. glabrata do tkaniva hostiteľa [85, 86]. Najpravdepodobnejší je prienik buniek kvasiniek do tkanív hostieľa sprostredkovaný endocytózou [87].
Hoci C. glabrata neprodukuje sekretované aspartylproteázy, nachádza sa v jej genóme 11 YPS génov, ktoré kódujú aspartylproteázy s glykozylfosfatidylinozitolovou (GPI) kotvou. Nazývané sú yapsíny a riadia mnohé životne dôležité bunkové procesy. Regulujú vnútrobunkové pH a udržujú homeostázu vo vakuolách [88, 89]. Sú spoluzodpovedné za vytváranie a udržiavanie architektúry bunkovej steny, ako aj za tvorbu biofilmu. Zohrávajú úlohu v interakcii s hostiteľskou bunkou potláčaním produkcie prozápalového cytokínu IL-1β [90, 91] a napomáhajú prežívaniu fagocytovaných buniek patogéna [92]. Výskum úlohy yapsínov vo virulencii kvasiniek C. glabrata prebiehal na myšacích modeloch a na vínnych muškách druhu Drosophila melanogaster [90, 91, 93].
Okrem sekretovaných aspartylproteáz produkujú kvasinky rodu Candida aj fosfolipázy, ktoré hydrolyzujú esterové väzby vo fosfolipidoch cytoplazmatickej membrány. Produkcia fosfolipáz nie je u kmeňov C. glabrata jednotná. Výskumy, ktoré sledovali aktivitu hydrolytických enzýmov u patogénnych kandíd, dokázali tvorbu fosfolipáz len u určitých kmeňov C. glabrata [94–98]. V porovnaní s kmeňmi druhu C. albicans je produkcia enzýmu výrazne nižšia. Príspevok fosfolipáz k virulencii kvasiniek C. glabrata preto ostáva diskutabilný [40]. Za účelom získania železa produkujú kvasinky C. glabrata hemolyzíny, ktoré spôsobujú rozpad červených krviniek (hemolýzu) [97].
Adherencia a tvorba biofilmu sú najvýznamejšie virulenčné faktory kvasinky C. glabrata. Povrchové adhezíny zabezpečujú adherenciu na tkanivá a zapájajú sa aj do formovania biofilmu. Biofilm zodpovedá za zvýšenú rezistenciu patogéna voči antifungálnym látkam a výrazným spôsobom sa podpisuje pod komplikovanie liečby katetrizovaných pacientov [7, 99].
Bunky kvasiniek C. glabrata interagujú s epitelovými a endotelovými bunkami, ako aj s bunkami imunitného systému. Detailnejšie informácie ohľadom spôsobu jednotlivých interakcií však stále chýbajú [16].
Väčšina štúdií venovaných hostiteľskej imunitnej odpovedi na kandidovú infekciu sa zameriavala na kvasinku C. albicans. Prvým krokom v sérii imunitných reakcií je rozpoznanie kvasinky na základe prítomnosti PAMP (pathogen-associated molecular patterns). PAMP sú intracelulárne alebo extracelulárne konzervované štruktúry prítomné u patogéna. Za rozpoznávanie PAMP sú zodpovedné PRR (pathogen recognition receptor) receptory imunitných buniek, ktoré spúšťajú kaskádu signalizačných reakcií. Medzi PRR receptory patria Toll-like receptory (TLR), NOD-like receptory (NLR) alebo C-lektínové receptory (CLR) [81, 100, 101]. Komponenty bunkovej steny, chitín, β-glukány, manány a manoproteíny, predstavujú PAMP kvasiniek rozpoznávané imunitnými bunkami hostiteľa [101]. CLR receptory sa podieľajú na rozpoznávaní β-glukánov, ako aj manánov a manoproteínov a predstavujú najdôležitejšiu skupinu receptorov zapojených v imunitnej reakcii voči kandidám [102, 103]. Najviac študovaný β-glukánovy receptor je dektín-1 exprimovaný najmä na monocytoch a makrofágoch [100]. Manány a manoproteíny sú rozpoznávané manózovým receptorom, ktorý je prítomný na povrchu makrofágov [102], a receptorom dektín-2, ktorý je exprimovaný na dendritických bunkách, makrofágoch a neutrofiloch [104]. CLR receptory spúštajú signál pre tvorbu prozápalových cytokínov (napr. IL-17) a reaktívnych foriem kyslíka (ROS) alebo vykonanie fagocytózy [100, 102].
Kľúčovú funkciu v obrane hostiteľa voči patogénnym kandidám majú fagocytujúce bunky ako neutrofily a makrofágy [81, 100]. Makrofágy fagocytujú bunky patogéna, ktoré prenikli do tkaniva. Produkujú tiež prozápalové cytokíny, ktoré atrahujú neutrofily na miesto infekcie. Makrofágy majú esenciálnu úlohu v kontrole diseminovaných fungálnych infekcií [100, 105]. Neutrofily sa dostávajú na miesto infekcie pôsobením chemokínov, ktoré produkujú aktivované epitelové bunky a tkanivové makrofágy. Neutropénia predstavuje rizikový faktor pre rozvoj invazívnej infekcie [100, 106]. Neutrofily vykonávajú svoju antifungálnu aktivitu produkciou ROS alebo pomocou lyzozýmu, laktoferínu, elastázay alebo β-defenzínov [107]. Produkcia ROS je sprostredkovaná pôsobením enzýmov NADPH-oxidáza a myeloperoxidáza. K odpovedi vrodeného imunitného systému na kvasinkovú infekciu prispievajú aj NK (natural killer) bunky [81, 100, 101]. Humorálna imunita v podobe komplementu má pravdepodobne v porovaní s bunkovou imunitou menšiu dôležitosť v obrane hostiteľa voči kandidovým infekciám [108]. Úloha B-lymfocytov a produkcia protilátok v obrane voči kvasinkám rodu Candida nie je stále jasná [100]. Porovnanie pacientov s deficienciami v T-lymfocytoch alebo B-lymfocytoch ukázalo vyššiu mieru prevalencie kandidových infekcií v prvej skupine pacientov. Bunková imunita preto pravdepodobne zohráva významnejšiu úlohu v obrane voči kvasinkovým infekciám z rodu Candida [81]. Th-lymfocyty sú nevyhnutné pre produkciu cytokínov (napr. IL-17, IL-22, IFNγ), ktoré regulujú antifungálnu odpoveď sprostredkovanú makrofágmi a neutrofilmi. Aktivácia Th-lymfocytov je spustená po vystavení fungálneho antigénu na povrchu dendritovej bunky [100, 109, 110]. Pokles Th17 lymfocytov spôsobený infekciou HIV spôsobí nedostatočnú imunitnú odpoveď na sliznici epitelu ústnej dutiny a vyvolá premnoženie a patogénny nástup kvasinky C. albicans [49]. Vrodená imunita je dôležitá pre obranu hostiteľa voči slizničným ako aj systémovým infekciám a adaptívna imunita je zapojená najmä v slizničnej imunite [100].
Makrofágy rozpoznávajú pomocou povrchových CLR receptorov (dektín-1 a dektín-2) polysacharidy prítomné v bunkovej stene kvasiniek C. glabrata, ktoré následne pohltia [104, 111]. Kvasinky druhu C. glabratadokážu prežiť pohltenie makrofágmi a následne sa vnútri fagozómu replikovať [112]. ROS a hydrolytické enzýmy zodpovedajú za deštrukciu fagocytovaného patogéna. Pohltená kvasinka odpovedá na nedostatok glukózy vo vnútri fagozómu zníženou expresiou génov zahrnutých v glykolýze. Zvýšená expresia génov pre β-oxidáciu mastných kyselín, glukoneogenézu a glyoxalátový cyklus presmeruje metabolizmus na využívanie alternatívnych zdrojov uhlíka [90]. C. glabrata však zápasí s nedostatkom glukózy aj v prostredí kolonizovaného hrubého čreva alebo vagíny. Prítomné baktérie rozkladnými procesmi produkujú laktát a acetát, ktoré slúžia pre bunky ako alternatívne zdroje uhlíka. Spektrum neskvasiteľných substrátov využívaných bunkami kvasiniek C. glabrata zahŕňa aj glycerol, etanol a oleát [113]. Fagocytované bunky patogéna aktivujú pochody spojené s autofágiou a pexofágiou, ktoré umožnia využívať zrecyklované komponenty vlastnej bunky. Príslušné zmeny v génovej expresii zabezpečuje remodelácia chromatínu [114, 115]. Centrálnu úlohu v regulácii génov inhibovaných prítomnosťou glukózy zohráva u kvasinky C. glabrata proteín kináza Snf1p [116]. Obranu voči pôsobeniu ROS zaisťujú antioxidačné enzýmy ako kataláza, superoxid dismutáza a peroxidázy závislé na tioredoxíne a glutatióne. Výskumy preukázali, že C. glabrata má vrodene vysokú rezistenciu voči oxidačnému stresu. Reguláciu génov, zapojených do antioxidačných procesov bunky, kontrolujú transkripčné faktory CgYap1p, CgSkn7p, CgMsn2p a CgMsn4p [117–119].
ADHEZÍNY A TVORBA BIOFILMU
Kolonizáciu a tvorbu biofilmu umožňuje adherencia buniek kvasiniek na tkanivo hostiteľa alebo povrch medicínskych nástrojov. Adherenciu kvasiniek zabezpečuje skupina proteínov s GPI-kotvou, ktoré sú prítomné v najvrchnejšej časti bunkovej steny, tzv. adhezíny [99].
Adhezíny kvasinky C. albicans ako aj niekoľkých ďalších druhov non-albicans kvasiniek (C. tropicalis, C. dubliniensis, parapsilosis) patria do rodiny Als proteínov (agglutinin-like sequence) [120]. Najdôležitejšiu rolu vo formovaní biofilmu má adhezín Als3p [121]. Adhezíny z rodiny Hwp proteínov sú taktiež zapojené do tvorby biofilmu u kvasinky C. albicans [122].
U kvasinky C. glabrata je v súčastnosti identifikovaných 67 adhezínov, ktoré klasifikujeme do 7 skupín na základe prítomnosti špecifickej substrát viažúcej domény na N konci proteínu. C koniec adhezínov nesie väzbové miesto pre GPI-kotvu. Oblasť medzi N a C koncom proteínu tvorí doména bohatá na serín a treonín [121, 123].
Najvýznamnejšia a dodnes najviac študovaná skupina adhezínov kvasiniek C. glabrata sú tzv. Epa (epithelial adhesin) proteíny kódované EPA génmi. V závislosti od konkrétneho kmeňa obsahuje genóm kvasiniek C. glabrata od 17 do 23 EPA génov. Lokalizované sú v subtelomerických oblastiach chromozómov [122, 124]. Gén EPA1 bol prvým identifikovaným génom s dokázanou významnou úlohou v adherencii. Deleční mutanti Cgepa1Δ mali v in vitro podmienkach o 95 % zníženú schopnosť adherovať v porovnaní s divým typom kvasiniek C. glabrata [99, 125]. Adhezín Epa1p je na vápniku závislý lektín, ktorý rozpoznáva a viaže sa na glykokonjugáty obsahujúce N-acetyllaktózamín. Epa1p zabezpečuje adhéziu na epitelové bunky a makrofágy [126, 127]. Zvýšenú expresiu génu EPA6 pozorovali počas infekcie urinárneho traktu na myšacom modeli. Zvýšená expresia je pravdepodobne vyvolaná nedostatkom niacínu v prostredí urinárneho traktu. Niacín funguje v bunkách ako prekurzor nikotínamidadeníndinukleotidu (NAD+), ktorý je kofaktorom množstva enzýmov. Znížená tvorba NAD+ v prostredí urinárneho traktu spôsobí inhibíciu histón deacetylázy Sir2p. Výsledkom inhibície Sir2p sú zmeny v expresii určitých génov, medzi ktoré patrí aj gén EPA6. Adhezíny Epa6p a Epa7p zodpovedajú za adherenciu na epitelové aj endotelové bunky. Oba adhezíny rozpoznávajú oligosacharidy, ktoré obsahujú galaktózové zvyšky [128, 129]. Gény EPA1, EPA6 a EPA7 sú najdôležitejšie pre adherenciu kvasiniek C. glabrata [122, 124].
Biofilm je trojrozmerná komplexná štruktúra, ktorú tvoria jednotlivé bunky mikroorganizmov a tzv. extracelulárny matrix (ECM). Mikroorganizmy vytvárajú biofilm na biotických ako aj na abiotických povrchoch. ECM je produkt metabolizmu prítomných kvasiniek a baktérií. Skladá sa z extracelulárnych polymérnych substancí (EPS), ku ktorým patria najmä extracelulárne polysacharidy a proteíny. Súčasťou EPS môžu byť v menšej miere aj nukleové kyseliny a lipidy [121]. Závažným problémom je vznik biofilmu na povrchoch medicínskych nástrojov, ako sú napr. venózne katétre, zubné protézy alebo kĺbové náhrady. Odstránenie biofilmu je neraz veľmi náročné a často zodpovedá za perzistentnú kolonizáciu a vznik invazívnych infekcií. Kvasinkové biofilmy zvyšujú rezistenciu patogénov voči antifungálnym látkam, a predstavujú tak riziko pre pacientov hospitalizovaných v nemocniciach [130]. Štúdiu biofilmu je preto venovaná osobitná pozornosť a v posledných rokoch prebieha intenzívny výskum aj v prípade kvasiniek druhu C. glabrata [99, 121, 124].
Kvasinky C. glabrata často tvoria biofilmy na povrchoch cievnych a urinárnych katétrov, protetických srdcových chlopní a pacemakerov [131]. Kľúčovú úlohu v tvorbe biofilmov majú adhezíny kódované EPA génmi, predovšetkým gén EPA6 [132]. Regulácia EPA génov je komplexná záležitosť, ktorá prebieha za pôsobenia CgYak1p kinázy a remodelácie chromatínu. Represiu EPA génov vyvoláva tzv. silencing subtelomerových oblastí, ktorý vypína expresiu veľkého množstva génov na chromozóme. V súčasnosti poznáme široké spektrum génov, z ktorých sa mnohé pravdepodobne podieľajú na regulácii expresie EPA génov a tým prispievajú k formovaniu biofilmu [99, 133]. Počiatočná fáza tvorby biofilmu vyžaduje taktiež prítomnosť adhezínov z rodiny Awp proteínov [123].
TERAPIA A MECHANIZMY ANTIFUNGÁLNEJ REZISTENCIE
V liečbe infekcií spôsobených kvasinkou C. glabrata sa využívajú antifungálne liečivá bežne aplikované v terapii iných kandidových či fungálnych infekcií. Mechanizmus pôsobenia je fungistatický alebo fungicídny [12]. Spektrum indikovaných antimykotík pozostáva z azolov, echinokandínov, polyénov a 5-fluorocytozínu (flucytozín), ktoré zasahujú rôzne životne dôležité metabolické dráhy kvasinky. Najčastejším cieľovým miestom dostupných antimykotík je biosyntetická dráha ergosterolu, ktorý je kľúčovou molekulou cytoplazmatickej membrány kvasiniek. Skupina antifungálnych látok pôsobiaca na úrovni biosyntézy ergosterolu zahŕňa azoly a polyény, ale aj allylamíny a morfolíny [134, 135].
Zlatý štandard v terapii kandidových infekcií predstavujú azolové antimykotiká, pričom najpoužívanejší v klinickej praxi je flukonazol. Výhodou je nízka cena, bezpečnosť a možnosť perorálneho, ako aj intravenózneho podania [136, 137]. Azoly sú heterocyklické zlúčeniny, ktoré podľa počtu dusíkových atómov v azolovom kruhu tvoria dve skupiny (imidazoly – 2 dusíky, triazoly – 3 dusíky). Medzi imidazoly aplikované v klinickej praxi patria klotrimazol, mikonazol, ketokonazol, ekonazol a tiokonazol. Triazoly zahŕňajú flukonazol, itrakonazol, posakonazol, vorikonazol a isavukonazol [135]. Mechanizmus účinku azolov je fungistatický a spočíva v inhibícii enzýmu lanosterol 14α-demetylázy, produktu génu ERG11, ktorá sa prejaví zastavením tvorby ergosterolu [61]. V prítomonsti azolov dochádza alternatívnou dráhou k tvorbe toxického 14α-metylergosta - 8,24(28)-dienolu, ktorý negatívne vplýva na rast a množenie kvasiniek [138]. K antifungálnej aktivite azolov prispieva aj tvorba ROS v bunkách [139]. Nahromadenie aberantných sterolov a ROS je príčinou fungistatickej povahy azolov. Prítomnosť antifungálnych látok však predstavuje selekčný tlak, ktorý vyvoláva vznik rezistentných kmeňov [140].
Rezistencia voči azolom je dôsledkom viacerých mechanizmov. Bodové mutácie v géne ERG11 vedú k zníženiu afinity azolového antimykotika k enzýmu lanosterol 14α-demetyláza. Za rezistenciu je zodpovedná aj zvýšená expresia génu ERG11 alebo génov kódujúcich tzv. efluxné pumpy. V prvom prípade dochádza k tvorbe väčšieho množstva cieľového enzýmu a zvýšený počet efluxných púmp výrazne znižuje koncentráciu antimykotika v bunke. Zmeny v metabolickej dráhe tvorby ergosterolu taktiež prispievajú k rezistencii voči azolom [134].
Klinicky najvýznamnejším mechanizmom rezistencie voči azolom je u kvasiniek C. glabrata zvýšená expresia efluxných púmp [137]. Efluxné pumpy sú transmembránové proteíny, ktoré podľa zdroja energie potrebnej pre aktivitu rozdeľujeme na ABC (ATP-binding cassette) transportéry (obr. 2) a MFS (major facilitator superfamily) permeázy (obr. 3) [25].
Obr. 2. Schématické znázornenie štruktúry ABC transportéra
Figure 2. Diagrammatic representation of the ABC transporter structure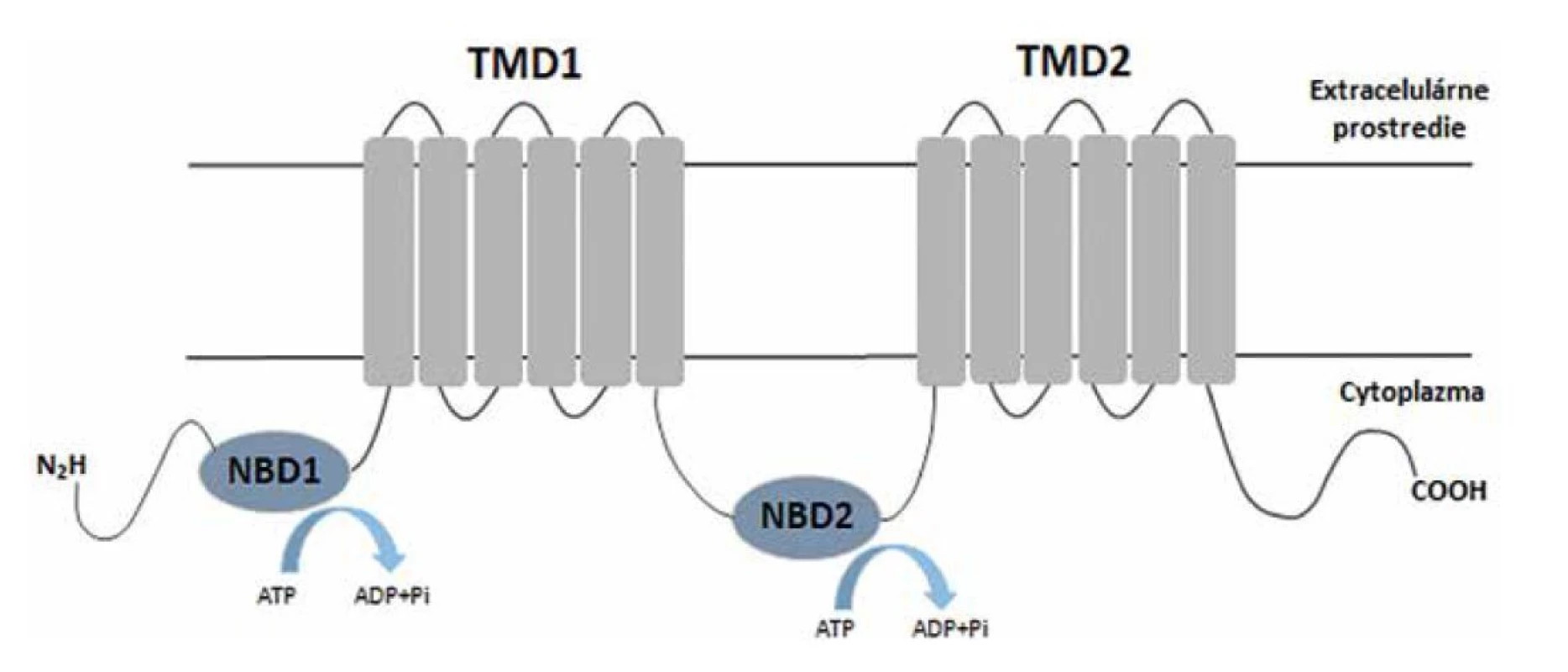
Schéma sa skladá z dvoch transmembránových domén (TMD), zodpovedných za transport substrátu a dvoch ATP viažucich domén (NBD), ktoré vytvárajú energiu pre transport.
It consists of two transmembrane domains (TMDs), responsible for substrate transport, and two ATP-binding domains (NBDs), which generate energy for transport.Obr. 3. Schématické znázornenie štruktúry MFS permeázy
Figure 3. Diagrammatic representation of the MFS permease structure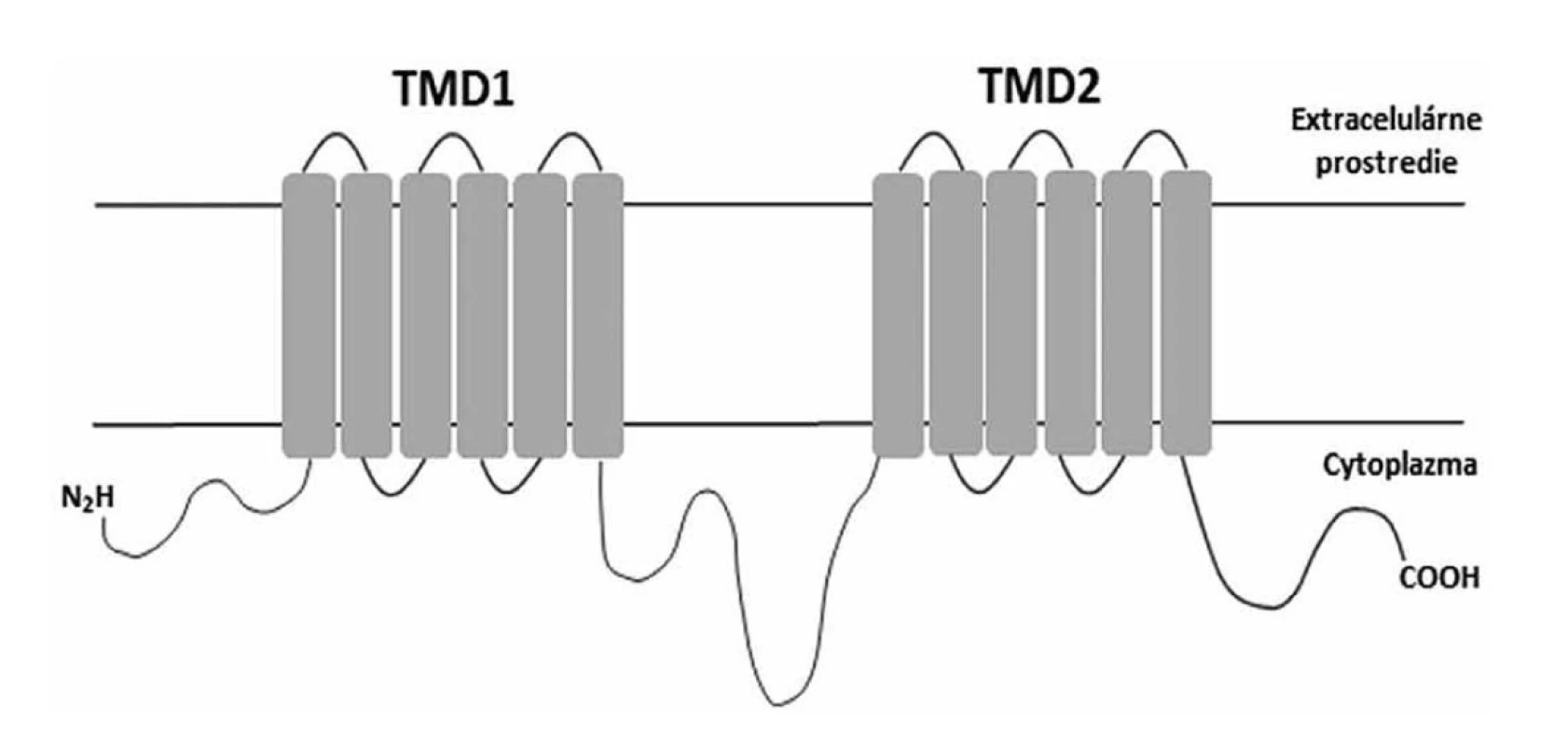
Schéma pozostáva z dvoch transmembránových domén (TMD) zložených z 12 alebo 14 segmentov. Energiu na prenos substrátu vytvára protónový gradient.
It consists of two transmembrane domains (TMDs) composed of 12 or 14 segments. The energy for substrate transfer is generated by a proton gradient.ABC transportéry patria k jednej z najviac zastúpených skupín proteínov v živej prírode. Napriek veľkému množstvu známych ABC transportérov zdieľajú všetky spoločnú základnú štruktúru. Skladajú sa z dvoch šesťčlenných transmembránových domén podieľajúcich sa na prenose substrátu a z dvoch nukleotid viažúcich domén. Nukleotid viažúce domény zodpovedajú za väzbu a hydrolýzu ATP, ktorá generuje energiu zabezpečujúcu transport [141]. Najdôležitejšie ABC transportéry kvasinky druhu C. glabrata kódujú gény CDR1, CDR2 a SNQ2. Podliehajú regulácii transkripčným faktorom Pdr1p, ktorý rozpoznáva gény obsahujúce v promótoroch tzv. PDRE (pleiotropic drug response elements) sekvencie [137].
MFS permeázy využívajú pre transportnú aktivitu energiu protónového gradientu. Pozostávajú z dvoch transmembránových domén zložených z 12 alebo 14 transmembránových segmentov [142]. Vo vybraných klinických izolátoch kvasiniek C. glabrata, ktoré boli rezistentné voči azolom, dochádzalo k zvýšeniu expresie MFS permeázy kódovanej génom QDR2. Expresia génu QDR2 je rovnako kontrolovaná transkripčným faktorom Pdr1p [143]. MFS permeázy Aqr1p, Tpo1_1p a Tpo3p taktiež pravdepodobne prispievajú k rezistencii kvasiniek C. glabrata voči azolom. Expresia príslušných génov bola u rezistentných izolátov vyššia v porovnaní s citlivými izolátmi [144, 145].
Molekulárny mechanizmus rezistencie voči azolom spočíva v tzv. GOF (gain-of-function) mutáciach génu CgPDR1. GOF mutácie sú substitúcie, ktoré pozitívne ovplyvňujú aktivitu transkripčného faktora Pdr1p a vedú ku konštitutívne zvýšenej expresii efluxných púmp [146]. Transkripčný faktor Pdr1p patrí do rodiny proteínov s motívom zinkového prstu Zn2Cys6 [147]. Kvasinky, ktoré nesú mutácie spôsobujúce mitochondriálne dysfunkcie (tzv. petite mutanty), sú in vitro rezistentné voči azolom. V dôsledku poruchy mitochondrií dochádza rovnako k zvýšeniu expresie ABC transportérov [148, 149].
Niekoľko experimentálnych prác poukázalo, že citlivosť, resp. rezistenciu, kvasiniek C. glabrata ovplyvňujú aj ďalšie gény. Delécia génu CgPDR16, ktorý kóduje proteín podieľajúci sa na vnútrobunkovom transporte lipidov, ako aj génu pre hlavný transkripčný regulátor biosyntézy ergosterolu CgUPC2A, viedla k zníženiu citlivosti daných delečných mutantov na sledované azoly [150–152].
Morfolíny a allylamíny slúžia na liečbu povrchových mykóz spôsobovaných dermatofytmi a kvôli nežiadúcim vedľajším účinkom sa na terapiu systémových kandidóz nepoužívajú [153]. Polyény (amfotericín B a odvodené lipidové formulácie, nystatín, natamycín) sú cyklické molekuly tvorené tzv. makrolaktónovým kruhom. Cyklická molekula pozostáva z 25–37 uhlíkov a konjugovaného aminoglykozidu d-mykozamínu. Amfifilný charakter polyénov je dôsledkom -OH skupín viazaných na hydrofilnej strane makrolaktónového kruhu a početných konjugovaných dvojitých väzieb medzi uhlíkmi na strane opačnej (hydrofóbna časť) [154]. Amfotericín B sa aplikuje intravenózne a je určený na liečbu systémovych infekcií, zatiaľ čo natamycín (známy tiež ako pimaricín) a nystatín sú aplikované len lokálne [154]. Polyény majú fungicídnu aktivitu. Mechanizmus účinku spočíva vo fyzickej väzbe polyénov s molekulou ergosterolu. Väzba vyvolá tvorbu pórov v cytoplazmatickej membráne kvasiniek, čo spôsobí vyliatie cytoplazmy a únik katiónov (K+ alebo Na+) von z bunky [155]. Medzi ergosterolom a cholesterolom existuje vysoká podobnosť v štruktúre molekuly. Dôsledkom uvedenej podobnosti je určitá miera väzby amfotericínu B aj s molekulou cholesterolu a nežiadúci nefro - alebo hepatotoxický účinok [154, 156]. Toxický efekt viedol k návrhu nových formulácií amfotericínu B v podobe lipozomálneho amfotericínu B alebo tzv. amfotericín B lipidového komplexu [156]. Výskyt kmeňov rezistených voči polyénom nie je, v porovaní s kmeňmi rezistentnými voči azolom, príliš častý. Znížená citlivosť na polyény je u klinických izolátov druhu C. glabrata dôsledkom bodových mutácií v génoch ERG6 [157–159] alebo ERG2 [159, 160]. Následkom zmien v uvedených génoch bola strata funkcie príslušných enzýmov a zástava tvorby ergosterolu, cieľovej molekuly polyénov. Prejavom na fenotypovej úrovni je zmena v sterolovom zložení cytoplazmatickej membrány dokázaná na základe plynovej chromatografie [159].
Echinokandíny (kaspofungín, anidulafungín a mikafungín) sú liekom prvej voľby pri liečbe systémových kandidóz spôsobených kmeňmi rezistentnými voči azolom. Ide o nové a veľmi účinné antimykotiká zavedené do klinickej praxe v roku 2001 [44, 161]. Po chemickej stránke sú echinokandíny syntetické deriváty lipopeptidov, ktoré prirodzene produkujú určité druhy húb, napr. Aspergillus rugulovalvus alebo Zalerion arboricola [162]. Vysoká molekulová hmotnosť echinokandínov zodpovedá za slabú vstrebateľnosť v GIT, a preto je nutné aplikovať echinokandíny intravenózne [153]. Zasahujú na úrovni enzýmu β-1,3-D-glukán syntáza, čím dochádza k inhibícii syntézy β-1,3-D-glukánu, ktorý je dôležitým štruktúrnym komponentom bunkovej steny kvasiniek. Inhibícia tvorby β-1,3-D-glukánu spôsobí destabilizáciu bunkovej steny a usmrtenie buniek kvasiniek [44]. β-1,3-D-glukán syntáza je membránovo viazaenzým, ktorý patrí do skupiny glukozyltransferáz. Ako substrát využíva UDP-glukózu, ktorú pripája na neredukujúci koniec vznikajúceho glukánového reťazca. Komplex β-1,3-D-glukán syntázy pozostáva z katalytickej a regulačnej podjednotky. Katalytická podjednotka, ktorá predlžuje glukánový reťazec, je kódovaná génmi FKS1 a FKS2. Regulačná podjednotka kódovaná génom RHO má GTP-ázovu aktivitu a reguluje aktivitu FKS 1/2 komplexu. Známy je aj gén FKS3, ktorého funkcia nie je známa [163]. Genóm kvasinky C. glabrata obsahuje homologické sekvencie všetkých troch FKS génov [164]. Rezistenciu voči echinokandínom vyvolávajú bodové mutácie v génoch FKS1 a FKS2, ktoré tvoria katalytickú podjednotku. Dosiaľ popísané bodové mutácie sú lokalizované do tzv. „hot spot“ oblastí v sekvenciách oboch génov. Výsledkom mutácie je znížená afinita antimykotika k enzýmovému komplexu [165, 166].
Antimetabolit 5-fluórocytozín je antimykotikum s dlhou históriou používania. Často je indikovaný pri liečbe závažných kandidových a kryptokokových infekcií [25]. Pri systémových infekciách by sa mal flucytozín podávať v kombinácii s amfotericínom B alebo azolmi. Nutnosť kombinovanej terapie vychádza zo schopnosti kvasiniek rýchlo nadobudnúť rezistenciu voči flucytozínu [153]. Pri lokálnych kandidových infekciách sa môže aplikovať aj samostatne [167]. Do bunky vstupuje flucytozín pomocou membránového transportéra cytozín permeáza. Vo vnútri bunky prebieha konverzia na 5-fluorouracil, ktorý podľa spôsobu metabolického spracovania inhibuje dva rozdielne bunkové procesy. Začlenenie do novovznikajúcej molekuly RNA v podobe 5-fluorouridín monofosfátu vedie k zástave syntézy proteínov. Dôsledkom konverzie 5-fluorouracilu na 5-fluorodeoxyuridín monofosfát je inhibícia enzýmu tymidylát syntáza, ktorá spôsobí zastavenie syntézy DNA. Oba spôsoby spracovania flucytozínu spôsobujú usmrtenie buniek patogéna. Schéma pôsobenia flucytozínu je ilustrovaná na obr. 4 [25, 135]. Bunky nadobúdajú rezistenciu voči flucytozínu mutáciami v génoch, ktoré kódujú enzýmy zodpovedné za transport antimykotika do bunky alebo spracovania antimykotika vnútri bunky [168].
Obr. 4. Mechanizmus účinku 5-fluorocytozínu
Figure 4. Mechanism of action of 5-fluorocytosine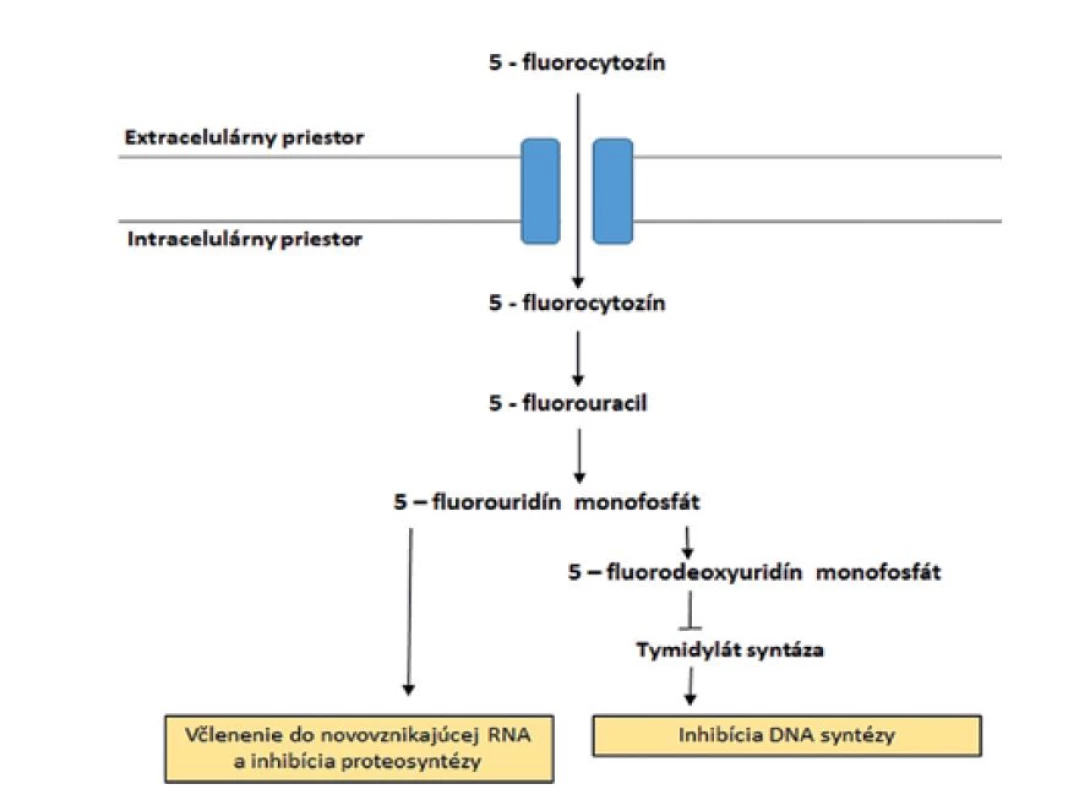
Transmembránový enzým cytozín permeáza je zodpovedný za transport 5-fluorocytozínu do vnútra bunky. Podľa ďalšieho metabolického spracovania dochádza k inhibícii proteosyntézy a DNA syntézy.
The transmembrane enzyme cytosine permease is responsible for the transport of 5-fluorocytosine into the interior of the cell. According to further metabolic processing, the inhibition of protein synthesis and DNA synthesis takes place.V celosvetovom meradle je odhadom asi 8–20 % kmeňov C. glabrata rezistentných voči azolom [169, 170]. V posledných rokoch narastá rezistencia aj voči echinokandínom, rôzne zdroje uvádzajú rozsah rezistentných kmeňov od 3 % do 15 % [171–173]. Kvasinky druhu C. glabrata pomerne často nadobúdajú tzv. mnohonásobnú rezistenciu (MDR), ktorej prejavom je strata citlivosti k antifungálnym látkam z viacerých skupín. MDR je najčastejšia ako súčasná rezistencia voči azolom a echinokandínom, menej v kombinácii voči azolom a polyénom [44]. Takmer jedna tretina kmeňov rezistentných voči echinokandínom vykazovala rezistenciu aj voči azolom [165].
ANTIFUNGÁLNA REZISTENCIA U VYBRANÝCH ZÁSTUPCOV RODU CANDIDA
Kvasinka C. albicans nadobúda rezistenciu voči azolom niekoľkými spôsobmi. Veľmi častým mechanizmom rezistencie je zvýšená expresia efluxných púmp Cdr1p a Cdr2p (ABC transportéry) ako aj Mdr1p (MFS permeáza) [174]. Príčinou zvýšenej expresie sú GOF mutácie v príslušných transkripčných faktoroch. ABC transportéry reguluje transkripčný faktor Tac1p a MFS permeázy sú pod kontrolou transkripčného faktora Mrr1p. Oba regulátory transkripcie patria k rodine proteínov s motívom zinkového prstu [175]. Zapojenie efluxných púmp v rezistencii voči azolom sa predpokladá aj u non-albicans kmeňov kvasiniek parapsilosis a C. tropicalis [134, 176, 177]. Zmeny v biosyntéze ergosterolu taktiež prispievajú k rezistencii voči azolom. Zvýšenie expresie génu ERG11, vyvolané chromozomálnymi prestavbami [178] alebo mutáciami v transkripčnom faktore Upc2p, je známe u množstva klinických izolátov kvasinky C. albicans [134]. Bodové mutácie génu ERG11 vedúce k zámenám aminokyselín v enzýme lanosterol 14α-demetyláza sú taktiež bežným mechanizmom rezistencie klinických izolátov kvasiniek C. albicans, C. tropicalis a parapsilosis [135, 176]. Kvasinka C. krusei vykazuje vrodene zníženú citlivosť na azoly. Rezistenciu dosahuje zníženou citlivosťou enzýmu lanosterol 14α-demetyláza na azoly, ako aj zvýšením expresie génu ERG11 a génov pre efluxné pumpy Abc1p a Abc2p [135, 179]. Málo frekventovaným mechanizmom rezistencie voči azolom sú mutácie v géne ERG3, ktoré vedú k zmenám v biosyntetickej dráhe ergosterolu. Rezistencia zapríčinená zmenami v géne ERG3 je známa u druhovC. albicans aj parapsilosis [180, 181].
Vznik rezistencie voči polyénom nie je u kandíd veľmi častý. Zapríčiňujú ju mutácie génov ERG6, ERG3 alebo ERG2, ktoré vedú k absencii ergosterolu a zmenám v sterolovom zložení cytoplazmatickej membrány kvasiniek [134, 135].
Spôsob nadobúdania rezistencie voči echinokandínom je medzi kvasinkami z rodu Candida pomerne uniformný. Rezistencia je vyvolaná bodovými mutáciami v „hot spot“ oblastiach génov FKS [176]. V porovaní s kvasinkou C. glabrata je zastúpenie kmeňov rezistentných voči echinokandínom u C. albicans a ostatných non-albicans druhov relatívne nízke [72, 182].
Pod komplikovanie liečby invazívnych kandidových infekcií sa negatívne podpisuje rozšírenie multirezistentnej kvasinky C. auris. Približne 90 % izolátov C. auris je rezistentných voči azolom a 30 % voči amfotericínu B [176]. Vzhľadom na zvýšenú rezistenciu voči daným antimykotikám sa odporúča pri infekcii kvasinkou C. auris podávanie echinokandínov, z ktorých najvyššiu efektivitu vykazuje mikafungín [183]. Nádej v boji s multirezistentnými kmeňmi C. auris predstavuje kombinovaná terapia viacerými antimykotikami [13].
Za rezistenciu voči azolom môžu byť zodpovedné efluxné pumpy [184], mutácie génu ERG11 [185] a duplikácia génu ERG11, ktorá vedie k zvýšenej produkcii enzýmu lanosterol 14α-demetyláza [186]. V rezistencii voči echinokandínom sa predpokladá zapojenie bodových mutácií génu FKS1 [186].
Zvyšujúca sa rezistencia voči antimykotikám, ako aj množstvo pacientov ohrozených závažnými invazívnymi kandidózami spolu s obmedzeným spektrom dostupných antifungálnych látok, sú príčinou neustáleho hľadania nových cieľov pre antifungálnu terapiu [187].
DRÁHA BIOSYNTÉZY ERGOSTEROLU A NOVÉ CIELE ANTIFUNGÁLNEJ TERAPIE
Steroly sú významné a univerzálne prítomné molekuly v cytoplazmatickej membráne eukaryotických buniek. Ovplyvňujú fluiditu a permeabilitu membrány a vplyv majú aj na aktivitu membránovo viazaných proteínov. Hlavným sterolom húb je ergosterol [188]. Steroly tvoria tiež kľúčovú súčasť rigidných a štruktúrovaných oblastí cytoplazmatickej membrány, ktoré sú známe ako lipidové rafty [189]. Metabolická dráha syntézy sterolov je mimoriadne konzervovaná. Celá dráha je rozdelená do troch väčších celkov, ktoré sa nazývajú moduly. Prvý modul zahŕňa kroky vedúce k syntéze mevalonátu, po ktorom nasleduje súbor reakcií, ktoré vytvárajú farnezylpyrofosfát. Jednotlivé kroky oboch dráh pre cholesterol aj ergosterol sú až po krok syntézy lanosterolu spoločné. V poslednom module reakcií vzniká samotný ergosterol [190, 191]. Syntézu ergosterolu, ktorá prebieha len v aeróbnych podmienkach, katalyzuje 25 enzýmov. Enzýmy skvalén monooxygenáza, lanosterol 14α-demetyláza, sterol C-4 metyl oxidáza a sterol C-22 desaturáza vyžadujú pre svoju aktivitu prítomnosť kyslíka [192]. Reguláciu biosyntézy ergosterolu u kvasinky S. cerevisiae zabezpečujú transkripčné faktory, ktoré kódujú gény ECM22 a UPC2. Transkripčné faktory Ecm22p a Upc2p rozpoznávajú v promótorových oblastiach ergosterolových génov tzv. SRE (sterol regulatory element) sekvencie [188, 190]. U kvasinky C. glabrata boli objavené homológy génov pre oba transkripčné regulátory, ktoré nesú pomenovanie CgUPC2A a CgUPC2B. Hlavnú úlohu v regulácii syntézy ergosterolu u druhu C. glabrata má prvý z uvedených génov [150]. V hypoxických podmienkach spúšťa Upc2p expresiu ABC transportérov Aus1p a Pdr11p, ktoré zabezpečia import sterolov z vonkajšieho prostredia do bunky [193]. Prebytočný ergosterol, ktorý pôsobí toxicky, kvasinka ukladá vo forme sterylesterov do lipidových kvapôčok alebo po acetylácii sekretuje von z bunky [190]. Delécia väčšiny génov biosyntetickej dráhy ergosterolu je pre kvasinky letálna. Výnimkou sú len tzv. neesenciálne gény (ERG28, ERG6, ERG2, ERG3, ERG5, ERG4), ktoré kódujú enzýmy zapojené v posledných krokoch metabolickej dráhy. Predpokladá sa, že metabolické intermediáty biosyntézy ergosterolu, ktoré vznikajú v záverečných krokoch, sú schopné zastúpiť funkciu ergosterolu v membráne [188]. Enzýmy posledných krokov biosyntetickej dráhy ergosterolu sú unikátne len pre huby, čím sa stávajú potenciálnymi novými cieľmi pre antifungálnu terapiu (Obr.5) [138]. Výsledky experimentálnych prác, ktoré sa venovali nepatogénnym kvasinkám S. cerevisiae a Kluyveromyces lactis naznačili, že sľubným novým cieľom antifungálnej terapie by mohol byť aj produkt génu ERG6. Delécia génu ERG6 viedla u delečných mutantov erg6Δ ku zvýšenej citlivosti na vybrané azoly, ako aj niektoré ďalšie inhibítory rastu [194, 195]. Gén ERG6 kóduje enzým S-adenozylmetionín dependentnú sterol C-24 metyltransferázu. Enzým katalyzuje prenos metylovej skupiny z S-adenozylmetionínu na uhlík C24 čím dochádza k premene zymosterolu na fekosterol (obr. 5) [188, 195].
Obr. 5. Záverečné kroky biosyntézy ergosterolu, katalyzované produktami neesenciálnych génov
Figure 5. Final steps of ergosterol biosynthesis catalysed by products of non-essential genes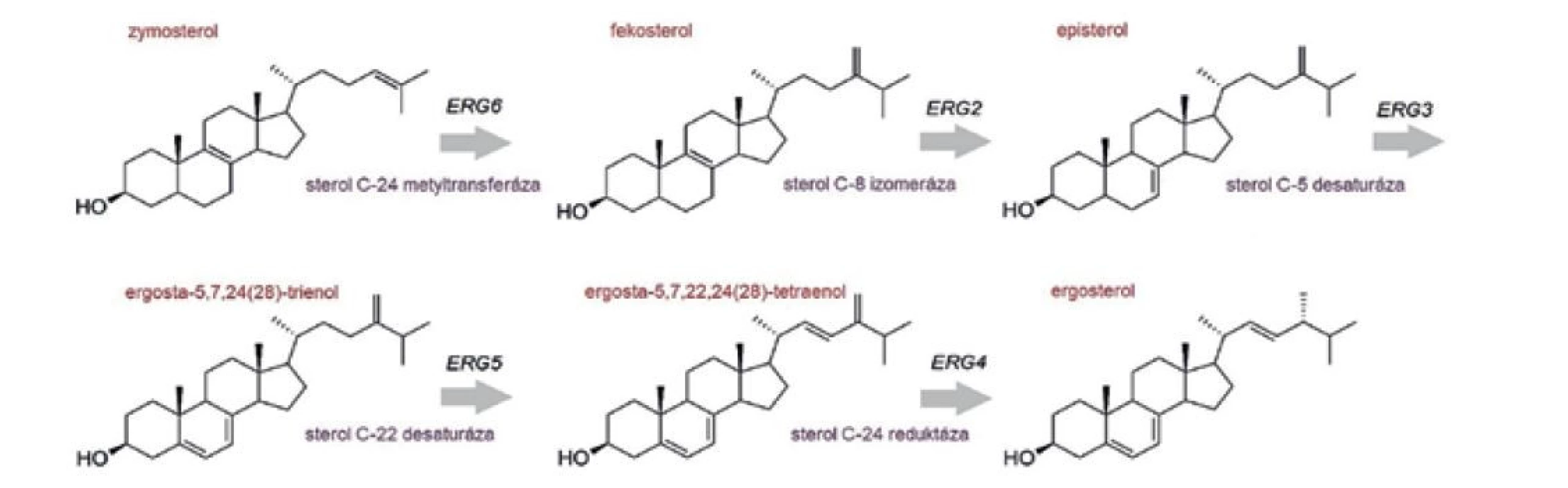
O niektorých z uvedených génov sa uvažuje ako o potenciálnych nových cieľoch antifungálnej terapie (prevzaté a upravené podľa [194]).
Some of these genes are being considered as potential new targets for antifungal therapy (taken and adapted from [194]).ZÁVER
C. glabrata je oportúnne patogénna kvasinka, ktorá spôsobuje povrchové, ako aj systémové infekcie. Dôvodom postupne narastajúcej prevalencie druhu C. glabrata je zvýšený počet imunokompromitovaných pacientov a jeho vrodená znížená citlivosť na azoly, ako aj schopnosť rýchlo nadobudnúť rezistenciu voči bežne aplikovaným antimykotikám. Nárast počtu MDR kmeňov kvasinky C. glabrata je alarmujúci a už v súčasnosti je príčinou vysokej mortality pacientov, ktorí vyžadujú intenzívnu starostlivosť. Rezistencia voči antifungálnym zlúčeninám je vážny a mimoriadne aktuálny problém. Spektrum účinných antifungálnych terapeutík pre liečbu kandidových infekcií je v súčasnosti obmedzené na azoly, echinokandíny, polyény a flucytozín. Narastajúca rezistencia nie je problémom len kvasinky C. glabrata. Nedávne objavenie vysokorezistentnej kvasinky C. auris len podčiarkuje vážnosť situácie. Jedným z riešení nepriaznivého stavu je hľadanie nových miest zásahu pre antifungálnu terapiu.
Do redakce došlo dne 5. 2. 2021.
Adresa pro korespondenci:
Mgr. Daniel Eliaš
Ul. Slatinská 78/59
018 61 Beluša
Slovenská republika
e-mail: elias25@uniba.sk
Zdroje
1. Anderson HW. Yeast-like fungi of the human intestinal tract. J Infect Dis, 1917;21(4):341–354.
2. Angoulvant A, Guitard J, Hennequin C. Old and new pathogenic Nakaseomyces species: epidemiology, biology, identification, pathogenicity and antifungal resistance. FEMS Yeast Res, 2016;16(2):1–13.
3. Kurtzman CP. Phylogenetic circumscription of Saccharomyces, Kluyveromyces and other members of the Saccharomycetaceae, and the proposal of the new genera Lachancea, Nakaseomyces, Naumovia, Vanderwaltozyma and Zygotorulaspora. FEMS Yeast Res, 2003;4(3):233–245.
4. Papon N, Courdavault V, Clastre M, et al. Emerging and emerged pathogenic Candida species: beyond the Candida albicans paradigm. PLoS Pathog, 2013;9(9):1–4.
5. Spivak ES, Hanson KE. Candida auris: an emerging fungal pathogen. J Clin Microbiol, 2018;56(2):1–10.
6. Gabaldón T, Carreté L. The birth of a deadly yeast: tracing the evolutionary emergence of virulence traits in Candida glabrata. FEMS Yeast Res, 2016;16(2):1–9.
7. Tam P, Gee K, Piechocinski M, et al. Candida glabrata, friend and foe. J Fungi (Basel), 2015;1(2):277–292.
8. Silva S, Negri M, Henriques M, et al. Candida glabrata, Candida parapsilosis and Candida tropicalis: Biology, epidemiology, pathogenicity and antifungal resistance. FEMS Microbiol Rev, 2012;36(2):288–305.
9. Csank C, Haynes K. Candida glabrata displays pseudohyphal growth. FEMS Microbiol Lett, 2000;189(1):115–120.
10. Sasani E, Khodavaisy S, Agha Kuchak Afshari S, et al. Pseudohyphae formation in Candida glabrata due to CO2 exposure. Curr Med Mycol, 2016;2(4):49–52.
11. Osei Sekyere J. Candida auris: A systematic review and meta - analysis of current updates on an emerging multidrug-resistant pathogen. Microbiologyopen, 2018;7(4):1–29.
12. Rodrigues CF, Silva S, Henriques M. Candida glabrata: a review of its features and resistance. Eur J Clin Microbiol Infect Dis, 2014;33(5):673–88.
13. Jeffery-Smith A, Taori SK, Schelenz S, et al. Candida auris: a review of the literature. Clin Microbiol Rev, 2017;31(1):1–18.
14. Lachke SA, Joly S, Daniels K et al. Phenotypic switching and filamentation in Candida glabrata. Microbiology, 2002;148(9):2661 – 2674.
15. Brockert PJ, Lachke SA, Srikantha T, et al. Phenotypic switching and mating type switching of Candida glabrata at sites of colonization. Infect Immun, 2003;71(12):7109–7118.
16. Kumar K, Askari F, Sahu MS, et al. Candida glabrata: A lot more than meets the eye. Microorganisms, 2019;7(2):39–61.
17. Dujon B, Sherman D, Fischer G, et al. Genome evolution in yeasts. Nature, 2004;430(6995):35–44.
18. Bolotin-Fukuhara M, Fairhead C. Candida glabrata: a deadly companion? Yeast, 2014;31(8):279–288.
19. Carreté L, Ksiezopolska E, Pegueroles C, et al. Patterns of genomic variation in the opportunistic pathogen Candida glabrata suggest the existence of mating and a secondary association with humans. Curr Biol, 2018;28(1):15–27.
20. Gabaldón T, Fairhead C. Genomes shed light on the secret life of Candida glabrata: not so asexual, not so commensal. Curr Genet, 2019;65(1):93–98.
21. Gabaldón T, Gómez-Molero E, Bader O. Molecular typing of Candida glabrata. Mycopathologia, 2020;185(5):755–764.
22. Ahmad KM, Kokošar J, Guo X, et al. Genome structure and dynamics of the yeast pathogen Candida glabrata. FEMS Yeast Res, 2014;14(4):529–535.
23. Koszul R, Malpertuy A, Frangeul L, et al. The complete mitochondrial genome sequence of the pathogenic yeast Candida (Torulopsis) glabrata. FEBS Lett, 2003;534(1–3):39–48.
24. Morio F, Lombardi L, Butler G. The CRISPR toolbox in medical mycology: state of the art and perspectives. PLoS Pathog, 2020;16(1):1–21.
25. Kabir MA, Ahmad Z. Candida infections and their prevention. ISRN Prev Med, 2012;2013 : 1–13.
26. Schabereiter-Gurtner C, Selitsch B, Rotter ML, et al. Development of novel real-time PCR assays for detection and differentiation of eleven medically important Aspergillus and Candida species in clinical specimens. J Clin Microbiol, 2007;45(3):906 – 914.
27. Zhang J, Hung GC, Nagamine K, et al. Development of Candida - specific Real-Time PCR assays for the detection and identification of eight medically important Candida species. Microbiol Insights, 2016;9(9):21–28.
28. Reyes-Montes MDR, Acosta-Altamirano G, Duarte-Escalante E, et al. Usefulness of a multiplex PCR for the rapid identification of Candida glabrata species complex in Mexican clinical isolates. Rev Inst Med Trop Sao Paulo, 2019;61(9):37–44.
29. Taei M, Chadeganipour M, Mohammadi R. An alarming rise of non-albicans Candida species and uncommon yeasts in the clinical samples; a combination of various molecular techniques for identification of etiologic agents. BMC Res Notes, 2019;12(1):779–786.
30. Mirhendi H, Makimura K, Khoramizadeh M, et al. A one-enzyme PCR-RFLP assay for identification of six medically important Candida species. Nihon Ishinkin Gakkai Zasshi, 2006;47(3):225 – 229.
31. Rivero-Menendez O, Navarro-Rodriguez P, Bernal-Martinez L, et al. Clinical and laboratory development of echinocandin resistance in Candida glabrata: molecular characterization. Front Microbiol, 2019;10 : 1–12.
32. Dodgson AR, Pujol C, Denning DW, et al. Multilocus sequence typing of Candida glabrata reveals geographically enriched clades. J Clin Microbiol, 2003;41(12):5709–5717.
33. Garcia-Hermoso D, Desnos-Ollivier M, Bretagne S. Typing Candida species using microsatellite length polymorphism and multilocus sequence typing. Methods Mol Biol, 2016;1356 : 199–214.
34. Oviaño M, Rodríguez-Sánchez B. MALDI-TOF mass spectrometry in the 21st century clinical microbiology laboratory. Enferm Infecc Microbiol Clin, 2021;39(4):192–200.
35. Posteraro B, De Carolis E, Vella A, et al. MALDI-TOF mass spectrometry in the clinical mycology laboratory: identification of fungi and beyond. Expert Rev Proteomics, 2013;10(2):151–164.
36. Bellanger AP, Gbaguidi-Haore H, Liapis E, et al. Rapid identification of Candida sp. by MALDI-TOF mass spectrometry subsequent to short-term incubation on a solid medium. APMIS, 2019;127(4):217–221.
37. Chalupová J, Raus M, Sedlářová M, et al. Identification of fungal microorganisms by MALDI-TOF mass spectrometry. Biotechnol Adv, 2014;32(1):230–241.
38. Clark AE, Kaleta EJ, Arora A, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry: a fundamental shift in the routine practice of clinical microbiology. Clin Microbiol Rev, 2013;26(3):547–603.
39. Patel R. MALDI-TOF MS for the diagnosis of infectious diseases. Clin Chem, 2015;61(1):100–111.
40. Galocha M, Pais P, Cavalheiro M, et al. Divergent approaches to virulence in C. albicans and C. glabrata: two sides of the same coin. Int J Mol Sci, 2019;20(9):2345–2370.
41. Kullberg BJ, Arendrup MC. Invasive candidiasis. N Engl J Med, 2015;373(15):1445–1456.
42. Pfaller MA, Diekema DJ. Epidemiology of invasive candidiasis: a persistent public health problem. Clin Microbiol Rev, 2007;20(1):133–163.
43. Kothalawala M, Jayaweera JAAS, Arunan S, et al. The emergence of non-albicans candidemia and evaluation of HiChrome Candida differential agar and VITEK2 YST® platform for differentiation of Candida bloodstream isolates in teaching hospital Kandy, Sri Lanka. BMC Microbiol, 2019;19(1):136–146.
44. Healey KR, Perlin DS. Fungal eesistance to echinocandins and the MDR phenomenon in Candida glabrata. J Fungi (Basel), 2018;4(3):105–119.
45. Álvaro-Meca A, Jensen J, Micheloud D, et al. Rate of candidiasis among HIV-infected children in Spain in the era of highly active antiretroviral therapy (1997–2008). BMC Infect Dis, 2013;13(1):115–123.
46. Marukutira T, Huprikar S, Azie N, et al. Clinical characteristics and outcomes in 303 HIV-infected patients with invasive fungal infections: data from the prospective antifungal therapy alliance registry, a multicenter, observational study. HIV AIDS (Auckl), 2014;6 : 39–47.
47. Li X, Lei L, Tan D, et al. Oropharyngeal Candida colonization in human immunodeficiency virus infected patients. APMIS, 2013;121(5):375–402.
48. Anwar KP, Malik A, Subhan KH. Profile of candidiasis in HIV infected patients. Iran J Microbiol, 2012;4(4):204–209.
49. Cassone A, Cauda R. Candida and candidiasis in HIV-infected patients: where commensalism, opportunistic behavior and frank pathogenicity lose their borders. AIDS, 2012;26(12):1457 – 1472.
50. Tamai IA, Pakbin B, Fasaei BN. Genetic diversity and antifungal susceptibility of Candida albicans isolates from Iranian HIV-infected patients with oral candidiasis. BMC Res Notes, 2021;14(1):93–100.
51. Mohamed AA, Lu XL, Mounmin FA. Diagnosis and treatment of esophageal candidiasis: current updates. Can J Gastroenterol Hepatol, 2019;2019(9):1–6.
52. Achkar JM, Fries BC. Candida infections of the genitourinary tract. Clin Microbiol Rev, 2010;23(2):253–273.
53. Gonçalves B, Ferreira C, Alves CT, et al. Vulvovaginal candidiasis: epidemiology, microbiology and risk factors. Crit Rev Microbiol, 2016;42(6):905–927.
54. Lim CS-Y, Rosli R, Seow HF, et al. Candida and invasive candidiasis: back to basics. Eur J Clin Microbiol Infect Dis, 2012;31(1):21 – 31.
55. Pfaller MA, Messer SA, Moet GJ, et al. Candida bloodstream infections: comparison of species distribution and resistance to echinocandin and azole antifungal agents in intensive care unit (ICU) and non-ICU settings in the SENTRY antimicrobial surveillance program (2008–2009). Int J Antimicrob Agents, 2011;38(1):65–69.
56. Montagna MT, Lovero G, Borghi E, et al. Candidemia in intensive care unit: a nationwide prospective observational survey (GISIA-3 study) and review of the European literature from 2000 through 2013. Eur Rev Med Pharmacol Sci, 2014;18(5):661–674.
57. Diekema D, Arbefeville S, Boyken L, et al. The changing epidemiology of healthcare-associated candidemia over three decades. Diagn Microbiol Infect Dis, 2012;73(1):45–48.
58. Guinea J. Global trends in the distribution of Candida species causing candidemia. Clin Microbiol Infect, 2014;20(6):5–10.
59. Chakrabarti A, Sood P, Rudramurthy SM, et al. Incidence, characteristics and outcome of ICU-acquired candidemia in India. Intensive Care Med, 2014;41(2):285–295.
60. Tan BH, Chakrabarti A, Li RY, et al. Incidence and species distribution of candidaemia in Asia: a laboratory-based surveillance study. Clin Microbiol Infect, 2015;21(10):946–953.
61. Arendrup MC, Patterson TF. Multidrug-resistant Candida: epidemiology, molecular mechanisms, and treatment. J Infect Dis, 2017;216(3):445–451.
62. Bongomin F, Gago S, Oladele RO, et al. Global and multi-national prevalence of fungal diseases-estimate precision. J Fungi (Basel), 2017;3(4):57–86.
63. Koehler P, Stecher M, Cornely OA, et al. Morbidity and mortality of candidaemia in Europe: an epidemiologic meta-analysis. Clin Microbiol Infect, 2019;25(10):1200–1212.
64. Lamoth F, Lockhart SR, Berkow EL, et al. Changes in the epidemiological landscape of invasive candidiasis. J Antimicrob Chemother, 2018;73(1):4–13.
65. Vasilyeva NV, Raush ER, Rudneva MV, et al. Etiology of invasive candidosis agents in Russia: a multicenter epidemiological survey. Front Med, 2018;12(1):84–91.
66. Cleveland AA, Farley MM, Harrison LH, et al. Changes in incidence and antifungal drug resistance in candidemia: results from population-based laboratory surveillance in Atlanta and Baltimore, 2008-2011. Clin Infect Dis, 2012;55(10):1352–1361.
67. Lockhart SR, Iqbal N, Cleveland AA, et al. Species identification and antifungal susceptibility testing of Candida bloodstream isolates from population-based surveillance studies in two U.S. cities from 2008 to 2011. J Clin Microbiol, 2012;50(11):3435 – 3442.
68. Lockhart SR. Current epidemiology of Candida Infection. Clin Microbiol Newsl, 2014;36(17):131–136.
69. Cleveland AA, Harrison LH, Farley MM, et al. Declining incidence of candidemia and the shifting epidemiology of Candida resistance in two US metropolitan areas, 2008–2013: results from population-based surveillance. PLoS One, 2015;10(3):1–12.
70. Wang H, Xu YC, Hsueh PR. Epidemiology of candidemia and antifungal susceptibility in invasive Candida species in the Asia-Pacific region. Future Microbiol, 2016;11(11):1461–1477.
71. Ghazi S, Rafei R, Osman M, et al. The epidemiology of Candida species in the Middle East and North Africa. J Mycol Med, 2019;29(3):245–252.
72. Pfaller MA, Diekema DJ, Turnidge JD, et al. Twenty years of the SENTRY antifungal surveillance program: results for Candida species from 1997–2016. Open Forum Infect Dis, 2019;6(1):79 – 94.
73. Ruiz Gaitán AC, Moret A, López Hontangas JL, et al. Nosocomial fungemia by Candida auris: First four reported cases in continental Europe. Rev Iberoam Micol, 2017;34(1):23–27.
74. Kohlenberg A, Struelens MJ, Monnet DL, et al. Candida auris: epidemiological situation, laboratory capacity and preparedness in European Union and European Economic Area countries, 2013 to 2017. Euro Surveill, 2018;23(13):18–136.
75. Saris K, Meis JF, Voss A. Candida auris. Curr Opin Infect Dis, 2018;31(4):334–340.
76. Mathur P, Hasan F, Singh PK, et al. Five-year profile of candidaemia at an Indian trauma centre: high rates of Candida auris blood stream infections. Mycoses, 2018;61(9):674–680.
77. Govender NP, Magobo RE, Mpembe R, et al. Candida auris in South Africa, 2012–2016. Emerg Infect Dis, 2018;24(11):2036 – 2040.
78. Drgoňa L. Diagnostika a liečba invazívnych mykóz u hematoonkologických pacientov. Onkologie, 2009;3(4):231–234.
79. Kocmanová I, Drgoňa L, Ráčil Z, et al. Invazivní kvasinkové infekce na vybraných hematoonkologických oddĕleních České a Slovenské republiky – mikrobiologické výsledky projektu CAN CELL. Klin Mikrobiol Infekc Lek, 2011;17(1):5–10.
80. Kocmanová I, Lysková P, Chrenkova V, et al. Nosocomial candidemia in the Czech Republic in 2012–2015: results of a microbiological multicentre study. Epidemiol Mikrobiol Imunol, 2018;67(1):3–10.
81. Pappas P, Lionakis M, Arendrup M, et al. Invasive candidiasis. Nat Rev Dis Primers, 2018;4(1):1–20.
82. Antinori S, Milazzo L, Sollima S, et al. Candidemia and invasive candidiasis in adults: a narrative review. Eur J Intern Med, 2016;34 : 21–28.
83. Staniszewska M. Virulence factors in Candida species. Curr Protein Pept Sci, 2020;21(3):313–323.
84. Perlroth J, Choi B, Spellberg B. Nosocomial fungal infections: epidemiology, diagnosis, and treatment. Med Mycol, 2007;45(4):321–346.
85. Tati S, Davidow P, McCall A, et al. Candida glabrata binding to Candida albicans hyphae enables its development in oropharyngeal candidiasis. PLoS Pathog, 2016;12(3):1–21.
86. Tsay S, Williams SR, Benedict K, et al. A tale of two healthcare-associated infections: Clostridium difficile coinfection among patients with candidemia. Clin Infect Dis, 2018;68(4):676–679.
87. Li L, Kashleva H, Dongari-Bagtzoglou A. Cytotoxic and cytokine - inducing properties of Candida glabrata in single and mixed oral infection models. Microb Pathog, 2007;42(4):138–147.
88. Bairwa G, Kaur RA. Novel role for a glycosylphosphatidylinositol - anchored aspartyl protease, CgYps1, in the regulation of pH homeostasis in Candida glabrata. Mol Microbiol, 2011;79(4):900 – 913.
89. Bairwa G, Rasheed M, Taigwal R, et al. GPI (glycosylphosphatidylinositol) - linked aspartyl proteases regulate vacuole homoeostasis in Candida glabrata. Biochem J, 2014;458(2):323–334.
90. Kaur R, Ma B, Cormack BP. A family of glycosylphosphatidylinositol - linked aspartyl proteases is required for virulence of Candida glabrata. Proc Natl Acad Sci USA, 2007;104(18):7628–7633.
91. Rasheed M, Battu A, Kaur R. Aspartyl proteases in Candida glabrata are required for suppression of the host innate immune response. J Biol Chem, 2018;293(17):6410–6433.
92. Seider K, Brunke S, Schild L, et al. The facultative intracellular pathogen Candida glabrata subverts macrophage cytokine production and phagolysosome maturation. J Immunol, 2011;187(6):3072–3086.
93. Quintin J, Asmar J, Matskevich AA, et al. The Drosophila toll pathway controls but does not clear Candida glabrata infections. J Immunol, 2013;190(6):2818–2827.
94. Fatahinia M, Halvaeezadeh M, Rezaei-Matehkolaei A. Comparison of enzymatic activities in different Candida species isolated from women with vulvovaginitis. J Mycol Med, 2017;27(2):188 – 194.
95. Sharma Y, Chumber S, Kaur M. Studying the prevalence, species distribution, and detection of in vitro production of phospholipase from Candida isolated from cases of invasive candidiasis. J Glob Infect Dis, 2017;9(1):8–11.
96. Rossoni RD, Barbosa JO, Vilela SFG, et al. Correlation of phospholipase and proteinase production of Candida with in vivo pathogenicity in Galleria mellonella. Braz J Oral Sci, 2013;12(3):199 – 204.
97. De Riceto ÉBM, de Menezes RP, Penatti MPA, et al. Enzymatic and hemolytic activity in different Candida species. Rev Iberoam Micol, 2015;32(2):79–82.
98. Canela HMS, Cardoso B, Vitali LH, et al. Prevalence, virulence factors and antifungal susceptibility of Candida spp. isolated from bloodstream infections in a tertiary care hospital in Brazil. Mycoses, 2018;61(1):11–21.
99. Timmermans B, De Las Peñas A, Castaño I, et al. Adhesins in Candida glabrata. J Fungi (Basel), 2018;4(2):60–76.
100. Netea MG, Joosten LAB, Van Der Meer JWM, et al. Immune defense against Candida fungal infections. Nat Rev Immunol, 2015;15(10):630–642.
101. Naglik, JR. Candida Immunity. New J Sci, 2014;2014 : 1–27.
102. Goyal S, Castrillón-Betancur JC, Klaile E, et al. The interaction of human pathogenic fungi with C-type lectin receptors. Front Immunol, 2018;9 : 1261–1286.
103. Lowman DW, Greene RR, Bearden DW, et al. Novel structural features in Candida albicans hyphal glucan provide a basis for differential innate immune recognition of hyphae versus yeast. J Biol Chem, 2014;289(6):3432–3443.
104. Ifrim DC, Bain JM, Reid DM, et al. Role of dectin-2 for host defense against systemic infection with Candida glabrata. Infect Immun, 2014;82(3):1064–1073.
105. Qin Y, Zhang L, Xu Z, et al. Innate immune cell response upon Candida albicans infection. Virulence, 2016;7(5):512–526.
106. Desai JV, Lionakis MS. The role of neutrophils in host defense against invasive fungal infections. Curr Clin Microbiol Rep, 2018;5(3):181–189.
107. Amulic B, Cazalet C, Hayes GL, et al. Neutrophil function: from mechanisms to disease. Annu Rev Immunol, 2012;30(1):459–489.
108. Cheng SC, Sprong T, Joosten LA, et al. Complement plays a central role in Candida albicans-induced cytokine production by human PBMCs. Eur J Immunol, 2012;42(4):993–1004.
109. Eyerich S, Wagener J, Wenzel V, et al. IL-22 and TNF-α represent a key cytokine combination for epidermal integrity during infection with Candida albicans. Eur J Immunol, 2011;41(7):1894 – 1901.
110. Zielinski CE, Mele F, Aschenbrenner D, et al. Pathogen-induced human TH17 cells produce IFN-γ or IL-10 and are regulated by IL-1β. Nature, 2012;484(7395):514–518.
111. Chen SM, Shen H, Zhang T, et al. Dectin-1 plays an important role in host defense against systemic Candida glabrata infection. Virulence, 2017;8(8):1643–1656.
112. Chew SY, Chee WJY, Than LTL. The glyoxylate cycle and alternative carbon metabolism as metabolic adaptation strategies of Candida glabrata: perspectives from Candida albicans and Saccharomyces cerevisiae. J Biomed Sci, 2019;26(1):52–62.
113. Chew SY, Ho KL, Cheah YK, et al. Physiologically relevant alternative carbon sources modulate biofilm formation, cell wall architecture, and the stress and antifungal resistance of Candida glabrata. Int J Mol Sci, 2019;20(13):3172–3185.
114. Roetzer A, Gratz N, Kovarik P, et al. Autophagy supports Candida glabrata survival during phagocytosis. Cell Microbiol, 2010;12(2):199–216.
115. Rai MN, Balusu S, Gorityala N, et al. Functional genomic analysis of Candida glabrata-macrophage interaction: role of chromatin remodeling in virulence. PLoS Pathog, 2012;8(8):1–16.
116. Roetzer A, Gregori C, Jennings AM, et al. Candida glabrata environmental stress response involves Saccharomyces cerevisiae Msn2/4 orthologous transcription factors. Mol Microbiol, 2008;69(3):603–620.
117. Briones-Martin-Del-Campo M, Orta-Zavalza E, Cañas-Villamar I, et al. The superoxide dismutases of Candida glabrata protect against oxidative damage and are required for lysine biosynthesis, DNA integrity and chronological life survival. Microbiology, 2015;161(2):300–310.
118. Vale-Silva LA, Sanglard D. Tipping the balance both ways: drug resistance and virulence in Candida glabrata. FEMS Yeast Res, 2015;15(4):1–8.
119. Briones-Martin-Del-Campo M, Orta-Zavalza E, Juarez-Cepeda J, et al. The oxidative stress response of the opportunistic fungal pathogen Candida glabrata. Rev Iberoam Micol, 2014;31(1):67 – 71.
120. de Groot PW, Bader O, de Boer AD, et al. Adhesins in human fungal pathogens: glue with plenty of stick. Eukaryot Cell, 2013;12(4):470–481.
121. Cavalheiro M, Teixeira MC. Candida Biofilms: threats, challenges, and promising strategies. Front Med, 2018;5 : 1–21.
122. Modrezewka B, Kurnatowski P. Adherence of Candida sp. to host tissues and cells as one of its pathogenicity features. Ann Parasitol, 2015;61(1):3–9.
123. de Groot PWJ, Kraneveld EA, Yin QY, et al. The cell wall of the human pathogen Candida glabrata: differential incorporation of novel adhesin-like wall proteins. Eukaryot Cell, 2008;7(11):1951 – 1964.
124. Rodrigues CF, Rodrigues ME, Silva S, et al. Candida glabrata biofilms: how far have we come? J Fungi (Basel), 2017;3(1):11–44.
125. Alves R, Kastora SL, Gomes-Gonçalves A, et al. Transcriptional responses of Candida glabrata biofilm cells to fluconazole are modulated by the carbon source. npj Biofilms Microbiomes, 2020;6(1):1–11.
126. Gallegos-García V, Pan SJ, Juárez-Cepeda J, et al. A novel downstream regulatory element cooperates with the silencing machinery to repress EPA1 expression in Candida glabrata. Genetics, 2012;190(4):1285–1297.
127. Kuhn DM, Vyas VK. The Candida glabrata adhesin Epa1p causes adhesion, phagocytosis, and cytokine secretion by innate immune cells. FEMS Yeast Res, 2012;12(4):398–414.
128. Domergue R. Nicotinic acid limitation regulates silencing of Candida adhesins during UTI. Science, 2005;308(5723):866–870.
129. Zupancic ML, Frieman M, Smith D, et al. Glycan microarray analysis of Candida glabrata adhesin ligand specificity. Mol Microbiol, 2008;68(3):547–559.
130. Silva S, Rodrigues CF, Araújo D, et al. Candida species biofilms antifungal resistance. J Fungi (Basel), 2017;3(1):8–25.
131. d‘Enfert C, Janbon G. Biofilm formation in Candida glabrata: What have we learnt from functional genomics approaches? FEMS Yeast Res, 2016;16(1):1–13.
132. Kucharíková S, Tournu H, Lagrou K, et al. Detailed comparison of Candida albicans and Candida glabrata biofilms under different conditions and their susceptibility to caspofungin and anidulafungin. J Med Microbiol, 2011;60(9):1261–1269.
133. Riera M, Mogensen E, d‘Enfert C, et al. New regulators of biofilm development in Candida glabrata. Res Microbiol, 2012;163(4):297–307.
134. Scorzoni L, de Paula E Silva AC, Marcos CM, et al. Antifungal therapy: new advances in the understanding and treatment of mycosis. Front Microbiol, 2017;8 : 1–23.
135. Bhattacharya S, Sae-Tia S, Fries BC. Candidiasis and mechanisms of antifungal resistance. Antibiotics, 2020;9(6):312–331.
136. Pais P, Galocha M, Viana R, et al. Microevolution of the pathogenic yeasts Candida albicans and Candida glabrata during antifungal therapy and host infection. Microb Cell, 2019;6(3):142–159.
137. Whaley SG, Rogers PD. Azole resistance in Candida glabrata. Curr Infect Dis Rep, 2016;18(12):41–51.
138. Bhattacharya S, Esquivel BD, White TC. Overexpression or deletion of ergosterol biosynthesis genes alters doubling time, response to stress agents, and drug susceptibility in Saccharomyces cerevisiae. mBio, 2018;9(4):1–14.
139. Delattin N, Cammue BP, Thevissen K. Reactive oxygen species - inducing antifungal agents and their activity against fungal biofilms. Future Med Chem, 2014;6(1):77–90.
140. Arendrup MC. Update on antifungal resistance in Aspergillus and Candida. Clin Microbiol Infect, 2014;20(6):42–48.
141. Prasad R, Singh A. Lipids of Candida albicans and their role in multidrug resistance. Curr Genet, 2013;59(4):243–250.
142. Redhu AK, Shah AH, Prasad R. MFS transporters of Candida species and their role in clinical drug resistance. FEMS Yeast Res, 2016;16(4):1–12.
143. Caudle KE, Barker KS, Wiederhold NP, et al. Genomewide expression profile analysis of the Candida glabrata Pdr1 regulon. Eukaryot Cell, 2011;10(3):373–383.
144. Costa C, Dias PJ, Sá-Correia I, et al. MFS multidrug transporters in pathogenic fungi: do they have real clinical impact? Front Physiol, 2014;5(197):197–205.
145. Costa C, Ribeiro J, Miranda IM, et al. Clotrimazole drug resistance in Candida glabrata clinical isolates correlates with increased expression of the drug:H(+) antiporters CgAqr1, CgTpo1_1, CgTpo3, and CgQdr2. Front Microbiol, 2016;7(74):526–537.
146. Moye-Rowley WS. Multiple interfaces control activity of the Candida glabrata Pdr1 transcription factor mediating azole drug resistance. Curr Genet, 2019;65(1):103–108.
147. Vu BG, Thomas GH, Moye-Rowley WS. Evidence that ergosterol biosynthesis modulates activity of the Pdr1 transcription factor in Candida glabrata. mBio, 2019;10(3):1–20.
148. Peng Y, Dong D, Jiang C, et al. Relationship between respiration deficiency and azole resistance in clinical Candida glabrata. FEMS Yeast Res, 2012;12(6):719–727.
149. Ferrari S, Sanguinetti M, De Bernardis F, et al. Loss of mitochondrial functions associated with azole resistance in Candida glabrata results in enhanced virulence in mice. Antimicrob Agents Chemother, 2011;55(5):1852–1860.
150. Nagi M, Nakayama H, Tanabe K, et al. Transcription factors CgUPC2A and CgUPC2B regulate ergosterol biosynthetic genes in Candida glabrata. Genes Cells, 2010;16(1):80–89.
151. Whaley SG, Caudle KE, Vermitsky JP, et al. UPC2A is required for high-level azole antifungal resistance in Candida glabrata. Antimicrob Agents Chemother, 2014;58(8):4543–4554.
152. Culakova H, Dzugasova V, Valencikova R, et al. Stress response and expression of fluconazole resistance associated genes in the pathogenic yeast Candida glabrata deleted in the CgPDR16 gene. Microbiol Res, 2015;174 : 17–23.
153. Vandeputte P, Ferrari S, Coste A. Antifungal resistance and new strategies to control fungal infections. Int J Microbiol, 2012;2012(3):1–26.
154. Howard KC , Dennis EK , Watt DS, et al. A comprehensive overview of the medicinal chemistry of antifungal drugs: perspectives and promise. Chem Soc Rev, 2020;49(8):2426–2480.
155. Kołaczkowska A, Kołaczkowski M. Drug resistance mechanisms and their regulation in non-albicans Candida species. J Antimicrob Chemother, 2016;71(6):1438–1450.
156. Van Daele R, Spriet I, Wauters J, et al. Antifungal drugs: What brings the future? Med Mycol, 2019;57(3):328–343.
157. Vandeputte P, Tronchin G, Bergès T, et al. Reduced susceptibility to polyenes associated with a missense mutation in the ERG6 gene in a clinical isolate of Candida glabrata with pseudohyphal growth. Antimicrob Agents Chemother, 2007;51(3):982–990.
158. Vandeputte P, Tronchin G, Larcher G, et al. A nonsense mutation in the ERG6 gene leads to reduced susceptibility to polyenes in a clinical isolate of Candida glabrata. Antimicrob Agents Chemother, 2008;52(10):3701–3709.
159. Ahmad S, Joseph L, Parker JE, et al. ERG6 and ERG2 are major targets conferring reduced susceptibility to amphotericin B in clinical Candida glabrata isolates in Kuwait. Antimicrob Agents Chemother, 2019;63(2):1–12.
160. Hull CM, Bader O, Parker JE, et al. Two clinical isolates of Candida glabrata exhibiting reduced sensitivity to amphotericin B both harbor mutations in ERG2. Antimicrob Agents Chemother, 2012;56(12):6417–6421.
161. Pappas PG, Kauffman CA, Andes DR, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the Infectious Diseases Society of America. Clin Infect Dis, 2016;62(4):1–50.
162. Hüttel W. Echinocandins: structural diversity, biosynthesis, and development of antimycotics. Appl Microbiol Biotechnol, 2021;105(1):55–66.
163. Papaspyridi LM, Zerva A, Topakas E. Biocatalytic synthesis of fungal β-glucans. Catalysts, 2018;8(7):274–297.
164. Katiyar SK, Alastruey-Izquierdo A, Healey KR, et al. Fks1 and Fks2 are functionally redundant but differentially regulated in Candida glabrata: implications for echinocandin resistance. Antimicrob Agents Chemother, 2012;56(12):6304–6309.
165. Pham CD, Iqbal N, Bolden CB, et al. Role of FKS mutations in Candida glabrata: MIC values, echinocandin resistance, and multidrug resistance. Antimicrob Agents Chemother, 2014;58(8):4690 – 4696.
166. Pristov KE, Ghannoum MA. Resistance of Candida to azoles and echinocandins worldwide. Clin Microbiol Infect, 2019;25(7):792 – 798.
167. Fisher JF, Sobel JD, Kauffman CA, et al. Candida urinary tract infections - treatment. Clin Infect Dis, 2011;52(6):457–466.
168. Vandeputte P, Pineau L, Larcher G, et al. Molecular mechanisms of resistance to 5-fluorocytosine in laboratory mutants of Candida glabrata. Mycopathologia, 2011;171(1):11–21.
169. Castanheira M, Deshpande LM, Davis AP, et al. Monitoring antifungal resistance in a global collection of invasive yeasts and molds: application of CLSI epidemiological cutoff values and whole-genome sequencing analysis for detection of azole resistance in Candida albicans. Antimicrob Agents Chemother, 2017;61(10):1–20.
170. Farmakiotis D, Kontoyiannis DP. Epidemiology of antifungal resistance in human pathogenic yeasts: Current viewpoint and practical recommendations for management. Int J Antimicrob Agents, 2017;50(3):318–324.
171. Alexander BD, Johnson MD, Pfeiffer CD, et al. Increasing echinocandin resistance in Candida glabrata: Clinical failure correlates with presence of FKS mutations and elevated minimum inhibitory concentrations. Clin Infect Dis, 2013;56(12):1724–1732.
172. Farmakiotis D, Tarrand JJ, Kontoyiannis DP. Drug-resistant Candida glabrata infection in cancer patients. Emerg Infect Dis, 2014;20(11):1833–1840.
173. Perlin D.S. Mechanisms of echinocandin antifungal drug resistance. Ann N Y Acad Sci, 2015;1354(1):1–11.
174. Bhattacharya S, Sobel JD, White TC. A combination fluorescence assay demonstrates increased efflux pump activity as a resistance mechanism in azole-resistant vaginal Candida albicans isolates. Antimicrob Agents Chemother, 2016;60(10):5858–5866.
175. Lohberger A, Coste AT, Sanglard D. Distinct roles of Candida albicans drug resistance transcription factors TAC1, MRR1, and UPC2 in virulence. Eukaryot Cell, 2014;13(1):127–142.
176. Arastehfar A, Gabaldón T, Garcia-Rubio R, et al. Drug-resistant fungi: an emerging challenge threatening our limited antifungal armamentarium. Antibiotics (Basel), 2020;9(12):877–906.
177. Zhang L, Xiao M, Watts MR, et al. Development of fluconazole resistance in a series of Candida parapsilosis isolates from a persistent candidemia patient with prolonged antifungal therapy. BMC Infect Dis, 2015;15(1):340–347.
178. Berkow EL, Lockhart SR. Fluconazole resistance in Candida species: a current perspective. Infect Drug Resist, 2017;10 : 237–245.
179. Ksiezopolska E, Gabaldón T. Evolutionary emergence of drug resistance in Candida opportunistic pathogens. Genes (Basel), 2018;9(9):461–486.
180. Branco J, Ola M, Silva RM, et al. Impact of ERG3 mutations and expression of ergosterol genes controlled by UPC2 and NDT80 in Candida parapsilosis azole resistance. Clin Microbiol Infect, 2017;23(8):575–583.
181. Whaley SG, Berkow EL, Rybak JM, et al. Azole antifungal resistance in Candida albicans and emerging non-albicans Candida species. Front Microbiol, 2017;7 : 1–12.
182. Perlin DS. Echinocandin resistance in Candida. Clin Infect Dis, 2015;61(6):612–617.
183. Lepak AJ, Zhao M, Berkow EL, et al. Pharmacodynamic optimization for treatment of invasive Candida auris infection. Antimicrob Agents Chemother, 2017;61(8):1–5.
184. Chatterjee S, Alampalli SV, Nageshan RK, et al. Draft genome of a commonly misdiagnosed multidrug resistant pathogen Candida auris. BMC Genomics, 2015;16(1):686–702.
185. Lockhart SR, Etienne KA, Vallabhaneni S, et al. Simultaneous emergence of multidrug-resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses. Clin Infect Dis, 2017;64(2):134–140.
186. ElBaradei A. A decade after the emergence of Candida auris: what do we know? Eur J Clin Microbiol Infect Dis, 2020;39(9):1617 – 1627.
187. Zheng YH, Ma YY, Ding Y, et al. An insight into new strategies to combat antifungal drug resistance. Drug Des Devel Ther, 2018;12 : 3807–3816.
188. Jordá T, Puig S. Regulation of ergosterol biosynthesis in Saccharomyces cerevisiae. Genes (Basel), 2020;11(7):795–813.
189. Pan J, Hu C, Yu JH. Lipid biosynthesis as an antifungal target. J Fungi (Basel), 2018;4(2):50–63.
190. Lv QZ, Yan L, Jiang YY. The synthesis, regulation, and functions of sterols in Candida albicans: well-known but still lots to learn. Virulence, 2016;7(6):649–659.
191. Hu Z, He B, Ma L, et al. Recent advances in ergosterol biosynthesis and regulation mechanisms in Saccharomyces cerevisiae. Indian J Microbiol, 2017;57(3):270–277.
192. Sokolov SS, Trushina NI, Severin FF, et al. Ergosterol turnover in yeast: an interplay between biosynthesis and transport. Biochemistry, 2019;84(4):346–357.
193. Zavrel M, Hoot SJ, White TC. Comparison of sterol import under aerobic and anaerobic conditions in three fungal species, Candida albicans, Candida glabrata, and Saccharomyces cerevisiae. Eukaryot Cell, 2013;12(5):725–738.
194. Kodedová M, Sychrová H. Changes in the sterol composition of the plasma membrane affect membrane potential, salt tolerance and the activity of multidrug resistance pumps in Saccharomyces cerevisiae. PLoS One, 2015;10(9):1–19.
195. Konecna A, Toth Hervay N, Valachovic M, et al. ERG6 gene deletion modifies Kluyveromyces lactis susceptibility to various growth inhibitors. Yeast, 2016;33(12):621–632.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2022 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Genetická rozmanitost humánních kmenů Listeria monocytogenes v České republice v letech 2016–2020
- První zhodnocení úplnosti dat a senzitivity systému surveillance u spalniček v České republice, 1. leden 2018 až 30. červen 2019
- Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
- Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
- Norovirové infekce v České republice v letech 2008–2020
- Colistin resistance and heteroresistance in Klebsiella pneumoniae & Escherichia coli clinical isolates from intensive care units
- Výskyt tuberkulózy u HIV pozitivních v České republice v letech 2000–2020
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
- Výskyt tuberkulózy u HIV pozitivních v České republice v letech 2000–2020
- Norovirové infekce v České republice v letech 2008–2020
- Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



