-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Genetická rozmanitost humánních kmenů Listeria monocytogenes v České republice v letech 2016–2020
Genetic diversity of human strains of Listeria monocytogenes in the Czech Republic in 2016–2020
Study aim: To determine the genetic diversity of human isolates of Listeria monocytogenes obtained in 2016–2020 from clinical laboratories in various locations of the Czech Republic with a focus on their possible epidemic links and virulence using whole genome sequencing data.
Methods: A total of 102 human L. monocytogenes isolates, serotyped by slide agglutination in combination with multiplex PCR serotyping, were used in this study. Whole genome sequencing was performed retrospectively, and based on the obtained data, the clonal relatedness of the tested strains and the presence of virulence genes were assessed using the Ridom SeqSphere+ software.
Results: In 2016-2020, 102 human isolates of L. monocytogenes were characterized, which represented 65% of all cases of listeriosis reported to the ISIN/EPIDAT systems in the Czech Republic in the monitored period. Serotype 1/2a (57%) was dominant, followed by serotype 4b (30%). Strains of serotype 1/2b (12%) and 1/2c (1%) were rarely detected. Based on the analysis of whole genome sequencing data, the strains were assigned to 26 clonal complexes and 27 sequence types. The cgMLST (core genome Multi-Locus Sequence Typing) analysis revealed four clusters of more than three strains, showing high relatedness (differences up to 10 alleles) with a possible epidemic link. The presence of all key virulence genes was confirmed in all strains. Only three strains (of serotypes 1/2a, 1/2b, and 1/2c) carried a point mutation in the inlA gene responsible for the expression of truncated internalin A protein, which is involved in the mechanism of intestinal barrier crossing by L. monocytogenes.
Conclusion: Molecular epidemiology based on whole genome sequencing is an effective tool to study the population structure of L. monocytogenes strains. This study found high heterogeneity of human L. monocytogenes strains, especially for serotype 1/2a, dominant in the Czech Republic. Several clusters with a possible epidemic link have been identified, and their occurrence will be further monitored.
Keywords:
Listeria monocytogenes – whole genome sequencing – listeriosis – serotyping – virulence
Autoři: L. Hlucháňová 1,2; T. Gelbíčová 3; R. Karpíšková 3*
Působiště autorů: Výzkumný ústav veterinárního lékařství, v. v. i., Brno 1; Ústav hygieny a technologie potravin živočišného původu a gastronomie, Fakulta veterinární hygieny a ekologie, Veterinární univerzita Brno 2; Ústav ochrany a podpory zdraví, Lékařská fakulta, Masarykova univerzita, Brno 3
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 71, 2022, č. 2, s. 102-108
Kategorie: Původní práce
Souhrn
Cíl práce: Cílem studie bylo určit genetickou rozmanitost humánních izolátů získaných v letech 2016–2020 z klinických laboratoří z různých lokalit České republiky (ČR) s ohledem na možné epidemické souvislosti a virulenci Listeria monocytogenes za využití dat celogenomového sekvenování.
Metody: Ve studii byl použit soubor 102 humánních izolátů L. monocytogenes, u kterých byl určen sérotyp sklíčkovou aglutinací v kombinaci s multiplex PCR sérotypizací. Retrospektivně bylo provedeno celogenomové sekvenování a na základě získaných dat byla posouzena klonální příbuznost testovaných kmenů a přítomnost genů virulence pomocí softwaru Ridom SeqSphere+.
Výsledky: V období let 2016–2020 bylo celkem charakterizováno 102 humánních izolátů L. monocytogenes, což činí 65 % ze všech hlášených případů listerióz registrovaných ve sledovaném období v ČR v systémech ISIN/EPIDAT. Dominantní zastoupení měl sérotyp 1/2a (57 %), následoval sérotyp 4b (30 %) a jen ojediněle byly detekovány kmeny sérotypu 1/2b (12 %) a 1/2c (1 %). Na základě analýzy celogenomových dat byly kmeny zařazeny k 26 klonálním komplexům a 27 sekvenačním typům. Porovnáním cgMLST (core genome Multi-Locus Sequence Typing) byly detekovány čtyři klastry o více jak třech kmenech vykazující vysokou příbuznost (rozdíly do 10 alel) s možnou epidemickou souvislostí. U všech kmenů byla potvrzena přítomnost klíčových genů virulence. Pouze u tří kmenů (sérotypu 1/2a, 1/2b a 1/2c) byla detekována bodová mutace v genu inlA spojovaná s expresí zkráceného proteinu internalinu A, který je zapojený do mechanismu přestupu L. monocytogenes intestinální bariérou.
Závěr: Molekulární epidemiologie založená na celogenomovém sekvenování představuje účinný nástroj ke studiu populační struktury kmenů L. monocytogenes. V této studii byla zjištěna vysoká heterogenita humánních kmenů L. monocytogenes, zejména u v České republice dominantního sérotypu 1/2a. Bylo identifikováno několik klastrů s možnou epidemickou souvislostí, jejichž výskyt bude dále sledován.
Klíčová slova:
Listeria monocytogenes – listerióza – sérotypizace – celogenomové sekvenování – virulence
ÚVOD
Listerióza je závažné infekční onemocnění s převážně alimentární cestou přenosu. Toto onemocnění vyvolané původcem Listeria monocytogenes obvykle postihuje rizikové skupiny obyvatel, zejména seniory, chronicky nemocné nebo osoby s imunodeficitem, gravidní ženy a novorozence. Invazivní formy onemocnění jsou manifestovány širokým spektrem klinických příznaků např. horečkou, septikémií, meningitidou, meningoencefalitidou nebo encefalitidou. Vzácněji může L. monocytogenes vyvolávat fokální infekce, jako je artritida, endokarditida, endoftalmitida a tvorba abscesů. U gravidních žen se onemocnění projevuje aborty, předčasným porodem nebo smrtí plodu po 20 týdnech těhotenství. U novorozenců do prvního měsíce života vyvolává meningitidu nebo meningoencefalitidu, septikemii, dyspnoe, granulomatosis infantiseptica, otitidu, léze na kůži, sliznicích nebo spojivkách [1].
I když je listerióza poměrně vzácné alimentární onemocnění, je spojována s vyšší smrtností a četností hospitalizací než u jiných gastrointestinálních infekcí bakteriálního původu [2]. Zatímco v posledních pěti letech počet případů listerióz v Evropské unii (EU) mírně vzrostl, v České republice (ČR) lze pozorovat spíše klesající trend. V roce 2019 bylo v zemích EU nahlášeno 2 621 případů listeriózy reprezentující incidenci 0,46 případů na 100 000 obyvatel, 300 osob v důsledku tohoto onemocnění zemřelo. V ČR činila incidence ve stejném období 0,25 případu na 100 000 obyvatel s celkem 27 hlášenými případy. Nejvyšší počet případů byl v EU v roce 2019 hlášen v Estonsku, Islandu, Švédsku a Dánsku (incidence 1,59; 1,12; 1,10; 1,05). Hlášená smrtnost v zemích EU v roce 2019 činila 17,5 %, v ČR činila 18,5 %. Nejvyšší smrtnost v EU uvádí Polsko (56,8 %) [3]. Listeriózy jsou obvykle hlášeny jako sporadické případy, nicméně vzhledem k dlouhé inkubační době, nízké incidenci onemocnění a výskytu geograficky vzdálených případů mohou být menší epidemie listerióz nerozpoznány [2, 4]. V posledních letech bylo zaznamenáno několik rozsáhlých epidemií listerióz. Doposud největší epidemii listeriózy na světě zaznamenala v roce 2017 Jihoafrická republika, odkud se onemocnění šířilo i do okolních států Jižní Afriky. Vehikulem nákazy byl masný výrobek, nakazilo se přes 1 000 osob, z nichž přes 200 zemřelo [5]. Jedna z největších epidemií v EU byla hlášena v roce 2018 v Německu a vehikulem listeriózy byl masný výrobek, který vyvolal onemocnění u 112 osob [2]. Jedna z posledních epidemií v České republice proběhla v období let 2012–2016 v Moravskoslezském kraji, vehikulem nákazy byly krůtí masné výrobky k přímé spotřebě produkované lokálním výrobcem a onemocnělo 26 osob. Genetická analýza kmenů L. monocytogenes získaných od pacientů, ve výrobcích a v prostředí potravinářského podniku potvrdila vysokou podobnost kmenů a také fakt, že kmen L. monocytogenes perzistoval v prostředí potravinářského podniku dlouhodobě, nejméně od roku 2012 [6]. Přenos listeriózy ve zdravotnických zařízeních je vzácný, v ČR byl nozokomiální přenos popsán na gynekologicko - porodnické klinice v Praze v roce 2013 [7].
Při sledování zdrojů a cest šíření listeriových infekcí je nutné kromě epidemiologických metod aplikovat i metody genotypizační. Kmeny L. monocytogenes lze rozdělit do čtyř evolučních linií a 13 sérotypů. Humánní listeriózy v České republice způsobují převážně kmeny sérotypů 1/2a (linie II), 4b a 1/2b (linie I) [8]. Kromě sérotypizace je k typizaci L. monocytogenes možné použít makrorestrikční analýzu s využitím pulzní gelové elektroforézy, která byla do nedávna považována za „zlatý standard“ v typizačních metodách. V posledních letech však dochází k jejímu nahrazování celogenomovým sekvenováním, které umožňuje mnohem precizněji rozlišovat příbuznost původců onemocnění, s velkou přesností identifikovat epidemické klastry a potvrzovat vehikula nákazy [9].
Cílem této studie bylo určit genetickou rozmanitost humánních izolátů získaných v letech 2016–2020 z klinických laboratoří z různých lokalit ČR, zhodnotit možné epidemické souvislosti a virulenci L. monocytogenes za využití dat celogenomového sekvenování.
MATERIÁL A METODY
Ve studii byl použit soubor 102 humánních izolátů L. monocytogenes získaných z klinických laboratoří z různých lokalit České republiky v letech 2016–2020. U všech získaných izolátů byl v reálném čase určen sérotyp sklíčkovou aglutinací s využitím komerčně dostupných antisér (Denka Seiken, Japonsko) v kombinaci s multiplex PCR sérotypizací [10]. Celogenomové sekvenování bylo prováděno retrospektivně. Genomová DNA byla extrahována pomocí kitu Blood and Tissue dle instrukcí výrobce (Qiagen, Německo). Příprava knihoven a samotná sekvenace na platformě Illumina (MiSeq n = 63; NextSeq n = 39) byla provedena externě. Získaná sekvenační data byla asemblována pomocí softwaru Velvet (verze 1.1.04), který je součástí softwaru Ridom SeqSphere+ (verze 6.0.2; Ridom GmbH, Münster, Německo). Klonální příbuznost testovaných kmenů byla porovnána pomocí softwaru Ridom SeqSphere+ na základě cgMLST (core genome Multi-Locus Sequence Typing) s využitím 1 701 cílových alel podle studie Ruppitsch et al. (2015), a pro hodnocení potenciální epidemické souvislosti byl zvolen maximální limit 10 rozdílných alel [11]. Sekvence genů, které jsou klíčové pro virulenci L. monocytogenes (inlA, inlB, prfA, hlyA, actA, plcA, plcB, mpl) byly staženy z webových stránek Institutu Pasteur, Francie [12]. K detekci genů virulence a posouzení přítomnosti bodových mutací vedoucích ke vzniku předčasných stop kodonů (PMSCs – premature stop codons) v těchto genech byl využit software Ridom SeqSphere+ [11].
VÝSLEDKY A DISKUSE
Typizované humánní izoláty L. monocytogenes představovaly 65 % ze všech hlášených případů listerióz registrovaných v systému EPIDAT (do roku 2017) a v systému ISIN (Informační systém infekčních nemocí), který slouží jako náhrada za předchozí systém EPIDAT od začátku roku 2018 [13]. Z celkového počtu 102 testovaných kmenů v 63 případech postihla listerióza muže (62 %) a v 39 případech ženy (38 %). Onemocnění nejvíce zasáhlo pacienty náležící do věkové kategorie 65+ (59 %). Tyto výsledky jsou srovnatelné se studií Gelbíčové et al. [14], která se věnovala charakteristice a diverzitě L. monocytogenes v humánní populaci České republiky v období let 2013–2016. Izoláty zaslané k typizaci nejčastěji pocházely z hemokultur (62 %), likvoru (19 %) a biologického materiálu od gravidních žen a novorozenců (10 %). Ojediněle byly izoláty získány také ze žlučníku, kloubního implantátu či kožního abscesu.
Typizované L. monocytogenes pocházely z 12 krajů (obr. 1). Z krajů Karlovarského a Pardubického nebyly ve sledovaném období zaslány k typizaci žádné kmeny L. monocytogenes, do systému ISIN však byly případy listerióz hlášeny [13]. Nejpočetnější zastoupení (n = 30; 29 %) měly kmeny z Moravskoslezského kraje, kde v roce 2016 ještě dobíhala epidemie vyvolaná po konzumaci krůtích masných výrobků od lokálního výrobce [6], následovaly kraje Olomoucký (n = 13; 13 %) a Plzeňský (n = 13; 13 %). Z kraje Ústeckého a Vysočina bylo zasláno a analyzováno po jednom kmeni.
Obr. 1. Geografická distribuce kmenů L. monocytogenes podle krajů ČR v letech 2016–2020 a jejich zařazení do sekvenačních typů
Figure 1. Geographical distribution of L. monocytogenes strains by administrative region in 2016–2020 and assignment to sequence type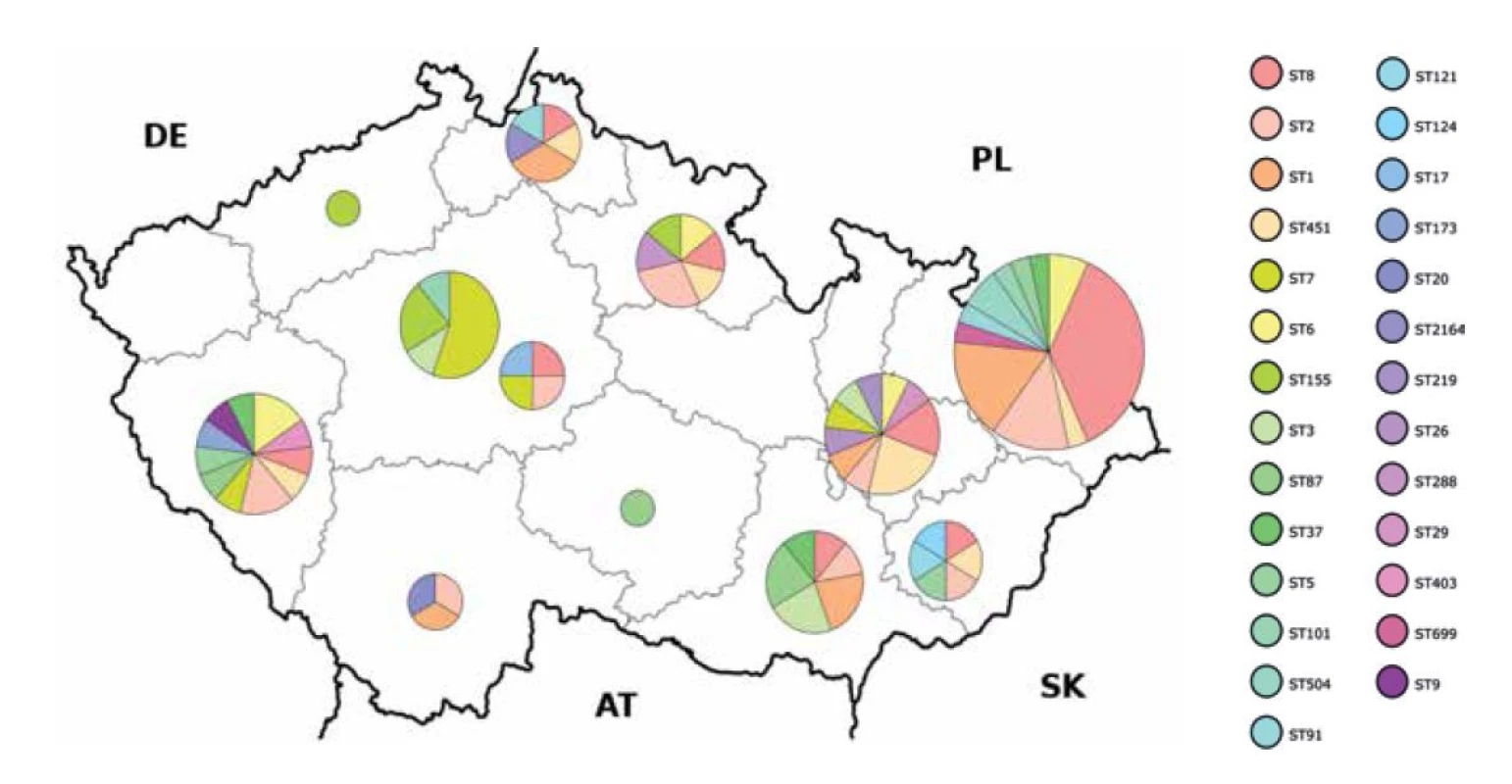
Sérotypizace je základní metodou při typizaci listerií. V České republice má dominantní zastoupení sérotyp 1/2a nejen u humánních, ale také u potravinových a environmentálních izolátů L. monocytogenes [8]. Zatímco ve většině zahraničních studií je nejčastěji spojován se vznikem onemocnění listeriózou sérotyp 4b [2, 5, 15, 16], největší podíl na vzniku humánních listerióz v České republice měly kmeny sérotypu 1/2a (n = 58; 57 %), následoval sérotyp 4b (n = 31; 30 %) a jen ojediněle i kmeny sérotypu 1/2b (n = 12; 12 %) a 1/2c (n = 1; 1 %). Podobné výsledky byly zjištěny ve studii Gelbíčové et al. (2017) zahrnující kmeny z období let 2013–2016 [14]. Kmeny L. monocytogenes pocházející z roku 2016 byly zahrnuty i v naší studii a na rozdíl od předchozí studie u nich byla pro posouzení diverzity provedena i celogenomová sekvenace. Z výsledků předchozí i této studie vyplývá, že v ČR za posledních 8 let nedošlo v tomto ohledu k významné změně v distribuci sérotypů.
Všechny kmeny L. monocytogenes byly charakterizovány metodou celogenomové sekvenace, byl stanoven klonální komplex (CC), sekvenační typ (ST) a bylo provedeno porovnání podobnosti kmenů na základě cgMLST. Kmeny byly zařazeny k 26 klonálním komplexům (CC) a 27 sekvenačním typům (ST) – tabulka 1. Geografickou distribuci kmenů L. monocytogenes podle sekvenačních typů ve sledovaném období zachycuje obrázek 1. Kmeny sérotypu 1/2a byly zařazeny k 17 klonálním komplexům a 18 sekvenačním typům, z nichž nejvyšší zastoupení (35 %) měly kmeny klonálního komplexu CC8. Devět z těchto kmenů CC8 (ST8) bylo v roce 2016 součástí lokální epidemie v Moravskoslezském kraji [6].
Tab. 1. Zařazení kmenů jednotlivých sérotypů L. monocytogenes do klonálních komplexů a sekvenačních typů
Table 1. Assignment of L. monocytogenes serotypes to clonal complexes and sequence types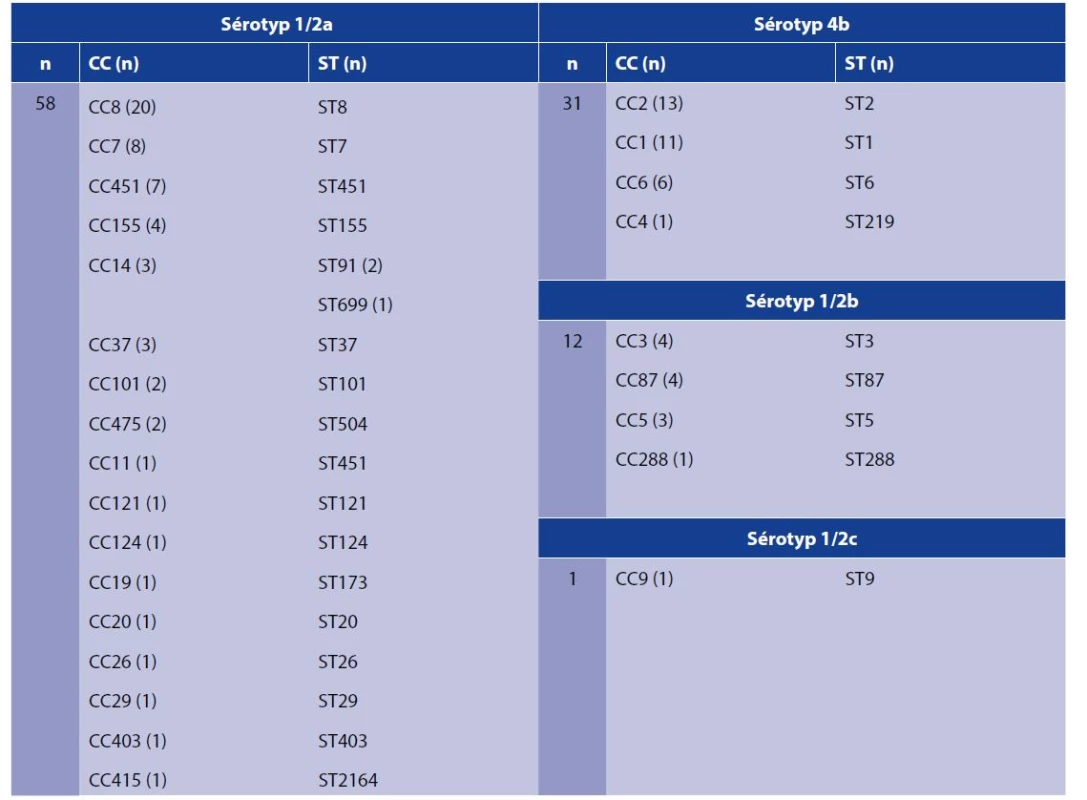
n – počet kmenů, CC – klonální komplex, ST – sekvenační typ. Tabulka je řazena podle četnosti výskytu klonálních komplexů.
n – number of strains, CC – clonal complex, ST – sequence type. The table is arranged according to the frequency of clonal complexes.V letech 2014–2019 způsobily kmeny CC8 (ST1247) nadnárodní epidemii listeriózy, která postihla pět států EU: Dánsko (n = 9), Estonsko (n = 6), Finsko (n = 2), Francii (n = 1) a Švédsko (n = 4). Pět případů skončilo fatálně. Vehikulem nákazy byly uzené rybí výrobky [17]. Nejvyšší heterogenita sekvenačních typů byla zaznamenána u sporadicky se vyskytujícího sérotypu 1/2b, kmeny byly zařazeny do čtyř klonálních komplexů a sekvenačních typů. Naopak nejnižší míra heterogenity byla detekována u kmenů sérotypu 4b, které byly zařazeny do čtyř klonálních komplexů a sekvenačních typů s nejvyšším zastoupením kmenů CC2, ST2 (42 %; n = 13) (viz tab. 1). Tento sekvenační typ vyvolal v roce 2015 v Německu epidemii neinvazivní gastroenteritidy způsobené L. monocytogenes u 163 osob (152 dětí a 11 dospělých) po konzumaci rýžového nákypu. Listerióza je definována jako invazivní onemocnění postihující zejména osoby z rizikových skupin, neinvazivní gastroenteritida způsobená L. monocytogenes může postihovat i zdravé jedince a je způsobena konzumací potravin kontaminovaných vysokým počtem L. monocytogenes [16]. Námi testované kmeny CC2 (ST2) byly spojeny výhradně s invazivní formou onemocnění.
Analýza dat celogenomového sekvenování umožňující detailní porovnání klíčových genů L. monocytogenes (cgMLST) prokázala u některých kmenů klonální shodu (obr. 2). Při použití typizačního schématu cg - MLST je hranice pro odlišení epidemicky souvisejících izolátů ≤ 10 alel [11]. Vysoký výskyt kmenů sérotypu 1/2a, CC8 (ST8) ve sledovaném období byl způsoben již zmíněnou epidemií listeriózy v Moravskoslezském kraji [6]. Kromě výše uvedené lokální epidemie s potvrzeným vehikulem infekce byla zjištěna klonální příbuznost (6–10 rozdílných alel) u dalších čtyř kmenů ST8 náležících do jednoho klastru, který se od epidemického klastru kmenů z Moravskoslezského kraje lišil pouze ve 12 alelách (viz obr. 2).
Obr. 2. MST (Minimum Spanning Tree) vytvořený na základě cgMLST (porovnáním 1701 genů) u kmenů L. monocytogenes izolovaných z klinických případů listerióz v České republice v letech 2016–2020 (n = 102)
Fig. 2. MST (Minimum Spanning Tree) generated based on cgMLST (by comparing 1701 genes) for L. monocytogenes strains isolated from clinical cases of listeriosis in the Czech Republic in 2016-2020 (n=102)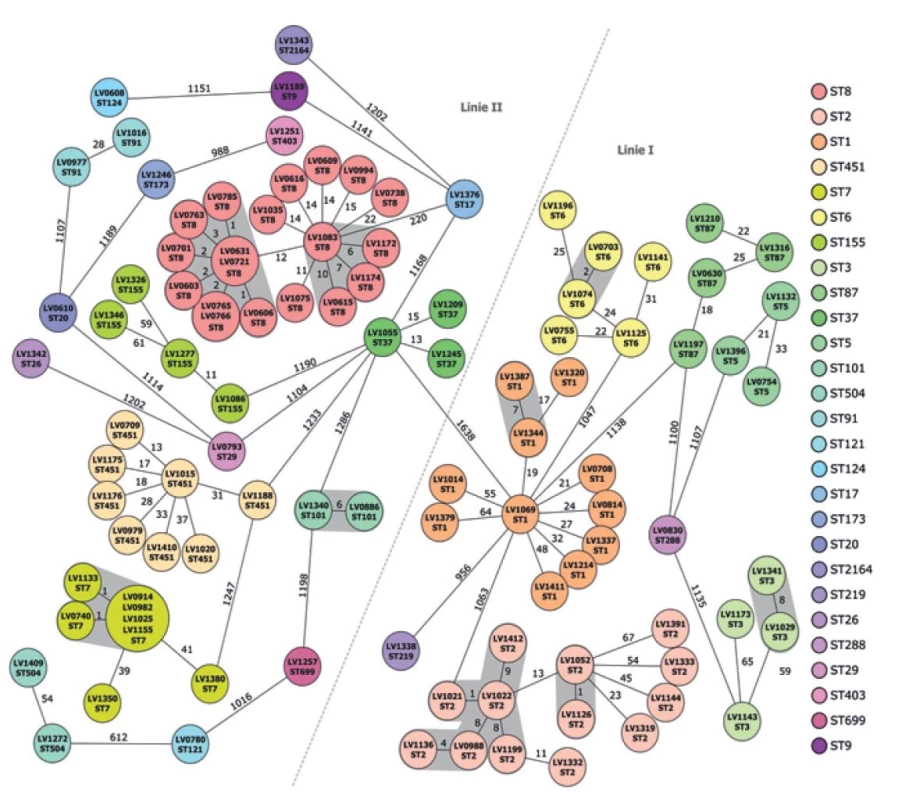
Jeden z těchto kmenů také pocházel z Moravskoslezského kraje, zbylé tři kmeny pocházely z kraje Olomouckého a Královéhradeckého. Dále byly detekovány dva klastry kmenů o více jak třech kmenech s možnou epidemickou souvislostí, u kterých však vehikulum nákazy zatím nebylo odhaleno. Jednalo se o kmeny sérotypu 1/2a CC7 (ST7), u kterých na základě cgMLST byla prokázána shoda. Šest kmenů tohoto sekvenačního typu izolovaných v letech 2016–2018 od pacientů z Prahy (n = 5) a Plzeňského kraje (n = 1) vykazovalo vysokou podobnost (0–1 rozdílná alela). Další dva kmeny ST7 získané v roce 2020 ze Středočeského a Olomouckého kraje se lišily v 39 a 41 alelách. Epidemie listeriózy vyvolané L. monocytogenes CC7 (ST7) je v současnosti šetřena i ve Spojených státech amerických ve spojitosti s konzumací hub enoki (penízovka sametonohá). Sporadické případy listerióz vyvolané kmenem CC7 (ST7) v České republice však s konzumací hub enoki nesouvisí. Analýzou sekvenačních dat nebyla potvrzena jejich klonální příbuznost (rozdíl v 74 alelách) [18].
V rámci výskytu humánních kmenů sérotypu 4b v ČR byla zjištěna klonální příbuznost u šesti kmenů CC2 (ST2) získaných v letech 2017–2018 z různých lokalit ČR (Plzeňský kraj, Královéhradecký kraj, Středočeský kraj, Moravskoslezský kraj).
V pěti případech byla detekována klonální příbuznost pouze mezi dvěma kmeny, a to u sekvenačních typů ST1, ST2, ST3, ST6 a ST101. Výsledná zjištění jsou ovlivněna i počtem zaslaných kmenů k typizaci, neboť bez testování mohou menší epidemie uniknout pozornosti.
V této studii byla také sledována přítomnost klíčových genů virulence L. monocytogenes. U všech testovaných kmenů byla přítomnost klíčových genů (inlA, inlB, prfA, hlyA, actA, plcA, plcB, mpl) potvrzena. U tří kmenů náležících do klonálních komplexů CC121, CC3, CC9 byla zjištěna přítomnost mutace typu PMSC v genu inlA, která vede k expresi zkráceného proteinu internalinu A. Kmeny patřící do komplexů CC121 a CC9, u kterých se PMSC v genu inlA typicky vyskytuje, jsou často popisovány v souvislosti s jejich perzistencí v potravinářských podnicích [19, 20]. V České republice byl popsán také výskyt suspektně perzistentních kmenů L. monocytogenes CC3 izolovaných z pařených sýrů v letech 2014–2019 [21]. Při srovnání genomu perzistentních kmenů a humánního kmene L. monocytogenes CC3 však byla detekována jiná forma mutace v genu inlA vedoucí k PMSC a na základě cgMLST kmeny netvořily epidemický klastr. I tyto potenciálně hypovirulentní kmeny však byly schopny vyvolat klinickou formu humánní listeriózy. Protein internalin A je sice jedním z klíčových faktorů virulence, ale míra virulence kmenů L. monocytogenes je dána přítomností i dalších faktorů a nehraje tedy výlučnou roli [22].
ZÁVĚR
Tato studie poskytuje aktuální přehled genetické rozmanitosti kmenů L. monocytogenes humánního původu v pětiletém sledovaném období v České republice. Na základě sekvenačních dat byly definovány nové epidemické klastry, které by mohly vést ke stejnému vehikulu nákazy a v budoucnosti vyústit v epidemii listeriózy. Nové metody představují účinný nástroj ke shromažďování, analýze, sdílení informací o původcích infekčních chorob za účelem včasné detekce hrozeb, monitorování a hodnocení rizik. Důležitou roli při dohledu nad výskytem listerióz hraje správná interpretace molekulárně-biologických dat ve vztahu k epidemiologickým šetřením.
Do redakce došlo 5. 8. 2021.
Adresa pro korespondenci:
doc. MVDr. Renáta Karpíšková, Ph.D.
Ústav ochrany a podpory zdraví LF MU
Kamenice 753/5
625 00 Brno
e-mail: renata.karpiskova@med.muni.cz
Zdroje
1. Commission implementing decision (EU) 2018/945 of 22 June 2018 on the communicable diseases and related special health issues to be covered by epidemiological surveillance as well as relevant case definitions. Official Journal of the European Union, 2018;L170/1 : 1–74.
2. Halbedel S, Wilking H, Holzer A, et al. Large nationwide outbreak of invasive listeriosis associated with blood sausage, Germany, 2018–2019. Emerg Infect Dis., 2020;26(7):1456–1464. 3. European Centre for Disease Prevention and Control: Surveillance atlas of infectious diseases 2019 [online]. [cit 2021-04-15] Dostupné na www:
3. European Centre for Disease Prevention and Control: Surveillance atlas of infectious diseases 2019 [online]. [cit 2021-04-15] Dostupné na www:<http://atlas.ecdc.europa.eu/public/index.aspx.
4. Desai AN, Anyoha A, Madoff LC, et al. Changing epidemiology of Listeria monocytogenes outbreaks, sporadic cases, and recalls globally: A review of ProMED reports from 1996 to 2018. Int Jl Infect Dis., 2019;84 : 48–53.
5. Thomas J, Govender N, McCarthy KM, et al. Outbreak of listeriosis in South Africa associated with processed meat. N Engl JMed.,2020;382(7):632–643.
6. Gelbíčová T, Zobaníková M, Tomáštíková Z, et al. An outbreak of listeriosis linked to turkey meat products in the Czech Republic, 2012–2016. Epidemiol Infect., 2018;146(11): 1407–1412.
7. Jágrová Z, Karpíšková R, Marešová M, et al. Nozokomiální přenos listeriózy. Epidemiol Mikrobiol Imunol., 2014;63(2):113–115.
8. Tomáštíková Z, Gelbíčová T, Karpíšková R. Population structure of Listeria monocytogenes isolated from human listeriosis cases and from ready-to-eat foods in the Czech Republic. J Food Nutrit Res., 2019;58(2):99–106.
9. Lüth S, Kleta S, Al Dahouk S. Whole genome sequencing as a typing tool for foodborne pathogens like Listeria monocytogenes – The way towards global harmonisation and data exchange. Trends Food Sci Technol., 2018;73 : 67–75.
10. Doumith M, Buchrieser C, Glaser P, et al. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR. J Clin Microbiol., 2004;42(8):3819–3822.
11. Ruppitsch W, Pietzka A, Prior K, et al. Defining and evaluation a core genome multilocus sequence typing scheme for whole-genome sequence-based typing of Listeria monocytogenes. J Clin Microbiol., 2015;53(9):2869–2876.
12. Institut Pasteur: Institut Pasteur MLST and whole genome MLST databases [online]. [cit 2021-04-22] Dostupné na www:<https://bigsdb.pasteur.fr/listeria/listeria.html.
13. Státní zdravotní ústav: ISIN (Informační systém infekční nemoci) [online]. [cit 2021-04-06] Dostupné na www: <http:// szu.cz/publikace/data/infekce-v-cr.
14. Gelbíčová T, Tomáštíková Z, Karpíšková R. Molekulárně epidemiologická charakteristika a diverzita Listeria monocytogenes v humánní populaci České republiky v letech 2013–2016. Epidemiol Mikrobiol Imunol., 2017;66(3):146–148.
15. Kuch A, Goc A, Belkiewicz K, et al. Molecular diversity and antimicrobial susceptibility of Listeria monocytogenes isolates from invasive infections in Poland (1997–2013). Sci Rep., 2018;8(1):14562.
16. Halbedel S, Prager R, Banerji S, et al. A Listeria monocytogenes ST2 clone lacking chitinase ChiB from an outbreak of non-invasive gastroenteritis. Emerg Microbes Infect., 2019;8 : 17–28.
17. European Centre for Disease Prevention and Control and European Food Safety Authority. Multi-country outbreak of Listeria monocytogenes sequence type 8 infections linked to consumption of cold – smoked fish products [online]. 2019-06-04 [cit 2021-04-12] Dostupné na www: <https:// ecdc.europa.eu/en/publications-data/multi-country-outbreak-listeria-monocytogenes-fish-products.
18. European Centre for Disease Prevention and Control: EpiPulse – the European surveillance portal for infectious diseases. [online]. [cit 2021-07-27]. Dostupné na www: <https:// ecdc.europa.eu/en/publications-data/epipulse-european-surveillance-portal-infectious-diseases.
19. Stessl B, Fricker M, Fox E, et al. Collaborative survey on the colonization of different types of cheese-processing facilities with Listeria monocytogenes. Foodborne Pathog Dis., 2014;11(1): 8–14.
20. Guidi F, Orsini M, Chiaverini A, et al. Hypo - and hyper-virulent Listeria monocytogenes clones persisting in two different food processing plants of Central Italy. Microorganisms, 2021;9(2):376.
21. Gelbicova T, Hluchanova L, Kalova A, et al. Dlouhodobé přežívání Listeria monocytogenes v mlékárenských provozech. Mlékařské listy, 2020;31(6):13–17.
22. VanStelten A, Roberts AR, Manuel CS, et al. Listeria monocytogenes isolates carrying virulence-attenuating mutations in Internalin A are commonly isolated from ready-to-eat food processing plant and retail environments. J Food Prot., 2016;79(10):1733–1740.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2022 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Genetická rozmanitost humánních kmenů Listeria monocytogenes v České republice v letech 2016–2020
- První zhodnocení úplnosti dat a senzitivity systému surveillance u spalniček v České republice, 1. leden 2018 až 30. červen 2019
- Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
- Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
- Norovirové infekce v České republice v letech 2008–2020
- Colistin resistance and heteroresistance in Klebsiella pneumoniae & Escherichia coli clinical isolates from intensive care units
- Výskyt tuberkulózy u HIV pozitivních v České republice v letech 2000–2020
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Candida glabrata – základná charakteristika, virulencia, terapia a rezistencia
- Výskyt tuberkulózy u HIV pozitivních v České republice v letech 2000–2020
- Norovirové infekce v České republice v letech 2008–2020
- Sledování změn invazivních onemocnění způsobených Haemophilus influenzae v České republice v letech 1999–2020
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



