-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaPostižení štítné žlázy po alogenní transplantaci kmenových buněk krvetvorby v dětském věku a v adolescenci, zkušenosti z 30 let sledování
Thyroid dysfunction in patients undergoing allogeneic stem cell transplantation in childhood and adolescence, thirty years follow-up
Radiotherapy and high-dose chemotherapy can cause a lot of early and late effects. Thyroid dysfunction is a known late complication following HSCT (hematopoietic stem cell transplantation). The objective of this study was to analyze the occurrence and characteristics of thyroid dysfunction in patients who have undergone HSCT in childhood and adolescence at our center (HSCT Unit, Department of Pediatric Hematology and Oncology, University Hospital Motol, Prague).
Patients and methods: A retrospective review of clinical records was conducted for patients who had undergone allogeneic HSCT in childhood and adolescence, and subsequently were diagnosed with thyroid involvement. Thyroid gland function was evaluated in regular terms (pre-HSCT, six months, one year and then annually after HSCT). Ultrasound examination was performed in patients with thyroid gland involvement and as a screening. We have evaluated data in 463 patients (295 male, 168 female) who underwent allogeneic transplantation at a median age of 7.8 years (range: 0.1–20.5) from 1989 till 2018 and were alive more than one year after transplantation at the time of evaluation. Three hundred one patient (65%) were treated for malignant disease. In one‑third of patients who underwent HSCT, total body irradiation (TBI) conditioning regimen was used, almost 50% of patients underwent Busulphan based condition regimen. Three hundred twenty-seven transplantations (66.6%) were performed from an unrelated donor, 33.4% from a matched sibling or other family donor.
Results: One hundred sixty-nine patients (36.5%) were diagnosed with thyroid gland involvement at a median of 2.0 (range: 0.4–21.3) years after HSCT. Primary hypothyroidism was the most common type of thyroid dysfunction (110 patients – 65.1%), only nine of them were with clinical signs. Thyroid anti-bodies (aTPO, aTG) were detected in 95 patients. Thyroid nodules were found during ultrasound examination in 29 patients at a median of 11.5 (range 5.1–23.4) years after HSCT, fifteen patients were treated due to thyroid dysfunction (hypo = 8, AITD = 7). Thyroid carcinoma was diagnosed in 8 patients (in 1.7% of all patients, 27.6% of patients with nodules) at a median of 10.8 (range 5.4–21.5) years after HSCT. All but one had received TBI based conditioning regimen.
Conclusions: Allogeneic hematopoietic stem cell transplantation is a potentially curative therapy for a variety of malignant and non-malignant disorders. With the improved outcome, increasing attention has been drawn to late complications in long-term survivors. Thyroid dysfunction is one of the most frequent complications. Regular evaluation of thyroid gland function (every 6–12 months) including laboratory parameters is highly recommended. The risk of secondary malignancies after HSCT is increasing within time. Careful follow-up of thyroid status including annual ultrasound examination every 1–3 years, is very important for early detection of tumor, namely in all patients exposed to TBI.
Keywords:
thyroid dysfunction – hematopoietic stem cell transplant – childhood – thyroid carcinoma – follow-up care
Autoři: P. Keslová 1; M. Šnajderová 2; R. Formánková 1; P. Říha 1; K. Personová 3; P. Sýkorová 3; B. Malinová 4; J. Starý 1; P. Sedláček 1
Působiště autorů: Klinika dětské hematologie a onkologie FN Motol a 2. LF UK, Praha 1; Pediatrická klinika FN Motol a 2. LF UK, Praha 2; Klinika nukleární medicíny a endokrinologie FN Motol a 2. LF UK, Praha 3; Onkologická klinika FN Motol a 2. LF UK, Praha 4
Vyšlo v časopise: Čes-slov Pediat 2021; 76 (2): 99-107.
Kategorie: Původní práce
Souhrn
Cíl studie: Použití léčebného ozáření a vysokodávkované chemoterapie je spojeno s rizikem časných i pozdních komplikací. Postižení štítné žlázy je známým problémem doprovázejícím alogenní transplantaci kmenových buněk krvetvorby (HSCT – hematopoietic stem cell transplantation). Cílem této práce je zhodnotit výskyt a projevy postižení štítné žlázy u pacientů, kteří v našem centru podstoupili alogenní transplantaci v dětském věku a adolescenci (Transplantační jednotka kostní dřeně, Klinika dětské hematologie a onkologie, Fakultní nemocnice Motol, Praha).
Pacienti a metody: Jedná se o retrospektivní analýzu dat pacientů, kteří podstoupili HSCT v dětském věku a v adolescenci a následně u nich bylo diagnostikováno postižení štítné žlázy. Funkci štítné žlázy jsme hodnotili klinicky a laboratorně v době před transplantací, šest měsíců a každý rok po transplantaci. Sonografické vyšetření bylo prováděno u pacientů s prokázanou tyreopatií a preventivně pak v delším časovém odstupu po transplantaci (více než pět let, zejména u skupiny ozářených pacientů). Zhodnotili jsme data 463 pacientů (295 mužů, 168 žen), transplantovaných v mediánu věku 7,8 roku (rozmezí 0,1–20,5) v letech 1989 až 2018. V době hodnocení přežíval každý z nich nejméně jeden rok po transplantaci. Pro maligní onemocnění bylo léčeno 301 pacientů (65 %). Jedna třetina pacientů měla jako součást předtransplantační přípravy celotělové ozáření (CTO), přípravný režim zahrnující použití Busulfanu byl uplatněn u téměř 50 % pacientů. Nepříbuzného dárce mělo 327 pacientů, u 33,4 % byl dárcem shodný sourozenec nebo jiný rodinný dárce.
Výsledky: Postižení štítné žlázy bylo diagnostikováno u 169 pacientů (36,5 % z celkového počtu) v mediánu dva roky (rozmezí: 0,4–21,3 roku) po HSCT. Primární hypotyreóza byla nejčastějším postižením (110 pacientů, 65,1 %), klinické příznaky mělo pouze devět pacientů. Zvýšené hladiny autoprotilátek (aTPO, aTG) byly detekovány u 95 pacientů. Uzly štítné žlázy byly v rámci ultrazvukového vyšetření nalezeny u 28 pacientů, v mediánu 11,5 roku (5,1–23,4) po transplantaci, 14 se již léčilo pro poruchu funkce štítné žlázy (hypotyreóza = 8, autoimunitní onemocnění štítné žlázy – AITD = 6). U osmi pacientů (1,7 % z celkového počtu, 28,5 % pacientů s uzlem) byl diagnostikován karcinom štítné žlázy v mediánu 10,8 roku (rozmezí 5,4–21,5 let) po transplantaci, sedm pacientů z osmi mělo přípravný režim s CTO.
Závěry: Alogenní transplantace kmenových buněk krvetvorby je léčebnou modalitou pro řadu maligních i nemaligních onemocnění. Se stále se zlepšujícími výsledky léčby je nyní pozornost věnována také oblasti pozdních následků léčby u dlouhodobě přežívajících pacientů. Postižení štítné žlázy je jednou z nejčastějších komplikací. Je proto nezbytné pravidelně (po 6–12 měsících) kontrolovat a vyšetřovat funkci štítné žlázy klinicky a zejména laboratorními parametry. Riziko sekundárních malignit těchto pacientů roste v čase. Pečlivé sledování zahrnující ultrazvukové vyšetření (za 1–3 roky) je velmi důležité pro časnou detekci nádorů, zejména u pacientů po celotělovém záření.
Klíčová slova:
postižení štítné žlázy – transplantace kmenových buněk krvetvorby – detský vek – karcinomy – dlouhodobé sledování
ÚVOD
Transplantace kmenových buněk krvetvorby je vysoce efektivním léčebným postupem nejen pro maligní, ale i pro řadu nemaligních onemocnění. V současné době je touto léčebnou modalitou vyléčeno více než 80 % pacientů. Rozlišujeme transplantace alogenní (od jiného dárce) či autologní (k převodu jsou použity vlastní kmenové buňky). Dárcem pro alogenní transplantaci je HLA shodný příbuzný dárce (zpravidla sourozenec, případně rodinný shodný dárce), nepříbuzný dárce s HLA plnou shodou či akceptovatelnou neshodou, méně často jsou používané tzv. haploidentické transplantace – od neshodného dárce po úpravě štěpu deplecí T-lymfocytů. V dětském věku jsou hlavními indikacemi k alogenní transplantaci u maligních onemocnění relapsy akutních leukémií (akutní lymfoblastická leukémie, akutní myeloidní leukémie), vzácněji se u dětí vyskytující myelodysplastický syndrom, juvenilní myelomonocytární leukémie či chronická myeloidní leukémie, méně často jiná maligní onemocnění (lymfomy, raritně solidní nádory). Z nemaligních onemocnění dominuje v našich podmínkách těžká aplastická anémie, vrozená selhání kostní dřeně (Fanconiho anémie, Blackfanova-Diamondova anémie aj.), vzácné těžké vrozené imunodeficitní stavy (syndrom těžké kombinované imunodeficience, Wiskottův-Aldrichův syndrom, ADA-deficience aj.), některé typy vrozených metabolických vad (mukopolysacharidóza typu I, adrenoleukodystrofie, kongenitální erytropoetická porfyrie aj.). Autologní transplantace jsou v současné době téměř výhradně používány v rámci komplexní léčby některých typů solidních nádorů či jejich recidivy (neuroblastomy vysokého rizika, Ewingův sarkom, lymfomy). Jako zdroj kmenových buněk krvetvorby u dětských pacientů slouží nejen kostní dřeň, stimulované periferní kmenové buňky, ale i pupečníková krev [1, 2].
Počty transplantovaných pacientů narůstají, v Evropě se v roce 2014 uskutečnilo více než 40 000 transplantací, z toho více než 4000 u dětí [3]. V České republice každoročně podstoupí alogenní transplantaci kolem 30 dětských pacientů. Od roku 1989, kdy byl zahájen transplantační pediatrický program na Klinice dětské hematologie a onkologie FN v Motole, bylo do konce roku 2019 alogenně transplantováno 634 pacientů. Díky zlepšujícím se výsledkům léčby, vývoji nových léčebných postupů i kvalitní podpůrné péči se zvyšuje počet dlouhodobě přežívajících pacientů. Očekává se, že v roce 2030 bude jen v USA více než 500 000 pacientů, kteří podstoupili HSCT (hematopoietic stem cell transplantation). Do popředí zájmu pak logicky vstupuje otázka kvality jejich dalšího života, otázka pozdních následků proběhlé terapie a předčasné možné morbidity vyléčených pacientů [4–8]. U dospělých pacientů stoupá použití přípravných předtransplantačních režimů s redukovanou intenzitou, u dětí se nadále obvykle používá intenzivní myeloablativní režim s využitím vysokodávkované chemoterapie (CHT), někdy v kombinaci s celotělovým ozářením (CTO). Vyšší intenzita předtransplantační přípravy snižuje riziko neúspěchu transplantace. To je ale spojeno s vyšším rizikem časných i pozdních komplikací. Některé následky mohou vznikat i v důsledku GVHD (reakce štěpu proti hostiteli), některé se mohou objevit i několik let po transplantaci a mohou být trvalé. Nejčastějšími komplikacemi v dětském věku jsou endokrinopatie, výrazné zastoupení má zejména postižení štítné žlázy [9]. I v běžné české populaci dětí a mladistvých je onemocnění štítné žlázy nejčastější endokrinopatií a autoimunitní onemocnění štítné žlázy (AITD) je nejčastější tyreopatií, se kterou se v ordinaci dětského praktického lékaře a endokrinologa setkávají [10, 11].
Článek shrnuje zkušenosti s problematikou postižení štítné žlázy za období 30 let fungování dětského transplantačního programu. Transplantovaní pacienti představují z hlediska rizika rozvoje tyreopatie velmi rizikovou populaci, s kterou se potkává nejen endokrinolog, ošetřující hematolog, ale samozřejmě i praktický lékař. Analýza dat poskytuje ucelený pohled na tuto specifickou problematiku.
PACIENTI A METODIKA
Zhodnotili jsme retrospektivně data pacientů, kteří podstoupili HSCT v dětském věku a v adolescenci a následně u nich bylo diagnostikováno postižení štítné žlázy. Celkový soubor tvoří 463 pacientů (295 mužů, 168 žen), kteří byli transplantování v mediánu věku 7,8 roku (rozmezí 0,1–20,5) v letech 1989 až 2018 a v době hodnocení žili nejméně jeden rok po transplantaci. V době vyhodnocení byl medián věku 20,5 roku (rozmezí 1,7–42,6), doba od transplantace byla v rozmezí 1,0–30,1 roku (medián 13,3). Tři sta jeden pacient (65 %) byl léčen pro maligní onemocnění. Třetina pacientů byla transplantována z důvodu nemaligního onemocnění, nejčastěji pro těžkou aplastickou anémii a kongenitální selhání kostní dřeně, závažný imunodeficit a metabolické vady. Před transplantací bylo již léčeno chemoterapií, případně radioterapií 219 pacientů (47,3 %). Téměř jedna třetina pacientů měla jako součást předtransplantační přípravy celotělové záření, přípravný režim zahrnující použití Busulfanu byl použit u téměř 50 % pacientů. Tři sta dvacet sedm pacientů bylo transplantováno od nepříbuzného dárce, 31,4 % od shodného sourozeneckého nebo rodinného dárce (tab. 1).
Tab. 1. Charakteristika skupiny transplantovaných pacientů. 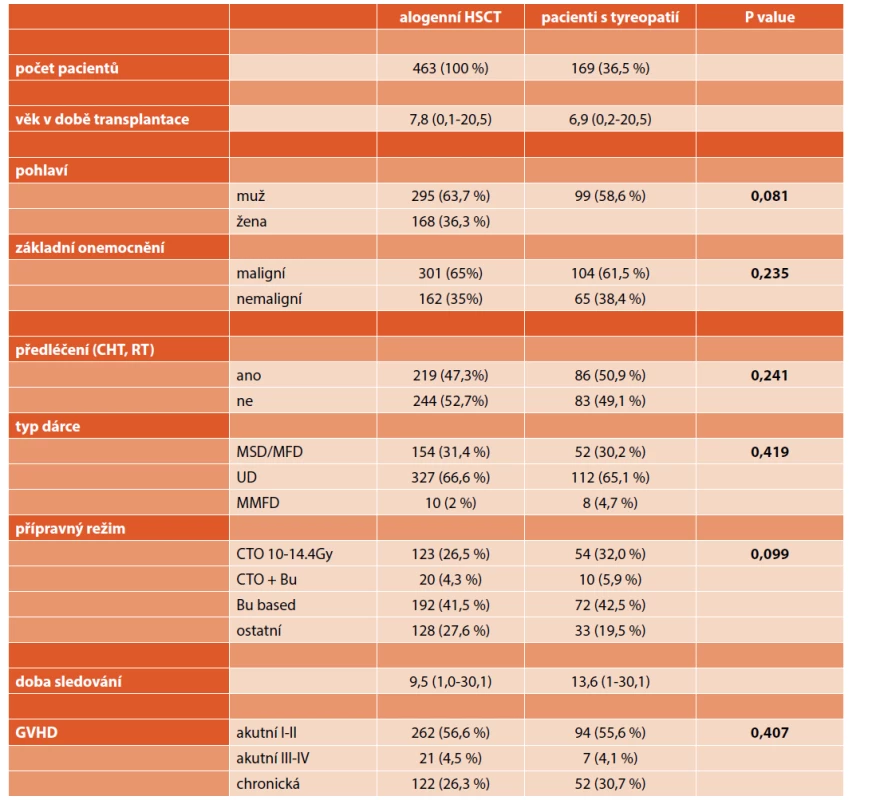
ALL: akutní lymfatická leukémie, AML: akutní myeloidní leukémie
MDS: myelodysplastický syndrom, CML: chronická myeloidní leukémie
JMML: juvenilní myelomonocytární leukémie, HD: Hodgkinův lymfom
NHL: non-Hodgkinův lymfom, SAA: těžká aplastická anémie
MSD: shodný sourozenecký dárce, MFD: shodný rodinný dárce
UD: nepříbuzný dárce, MMFD: neshodný rodinný dárce
CTO: celotělové záření, Bu: busulfan
GVHD: reakce štěpu proti hostiteli, HSCT: transplantace kostní dřeněÚvodní vyšetření štítné žlázy (klinické a laboratorní) jsme provedli před HSCT, dále pak šest a 12 měsíců po HSCT k detekci akutní poruchy funkce štítné žlázy. V rámci následného pravidelného sledování po HSCT proběhlo klinické a laboratorní vyšetření (fT4, TSH, a-Tg, anti-TPO) štítné žlázy jedenkrát ročně, u pacientů s příznaky tyreopatie častěji podle potřeby. Téměř polovina pacientů (45,1 %) měla v době sledování alespoň jedenkrát provedeno sonografické vyšetření štítné žlázy, které vykonal zkušený sonografista (obvykle tyreolog), část pacientů byla vyšetřena opakovaně v intervalu 1–3 let, při nálezu uzlu po 6–12 měsících.
DEFINICE PORUCH ŠTÍTNÉ ŽLÁZY
Primární hypotyreóza byla definována lehkou elevací TSH (tyreotropin, TSH <10 IU/ml) s normální koncentrací fT4 (volný tyroxin) při subklinické hypotyreóze či zvýšením TSH a snížením fT4 při manifestní primární hypotyreóze. Centrální hypotyreóza byla charakterizována snížením nebo nízkou hladinou fT4 při dolní hranici normy a snížením TSH. Hypertyreózu definuje snížená hladina TSH s normálním (subklinická) či zvýšeným (manifestní) fT4 a fT3. Autoimunitní onemocnění štítné žlázy je většinou doprovázeno pozitivitou autoprotilátek – proti tyroidální peroxidáze (aTPO) a/nebo proti tyreoglobulinu (aTG). U Gravesovy-Basedowovy choroby je hyperfunkce štítné žlázy spojena s pozitivitou protilátek proti receptoru pro TSH (aTSHR neboli TRAK). Uzly štítné žlázy byly zjištěny ultrazvukovým vyšetřením, při podezření na maligní proces bylo provedeno histologické vyšetření (aspirační biopsie tenkou jehlou, nález byl po operaci potvrzen histologickým vyšetřením).
VÝSLEDKY
U celkem 169 pacientů (36,5 % z celkového počtu) bylo diagnostikováno postižení štítné žlázy v mediánu dvou let (rozmezí: 0,4–21,3 roku) po transplantaci. Dalších sedm pacientů mělo hypofunkci štítné žlázy již před transplantací, tito pacienti byli z hodnoceného souboru vyloučeni. Nejčastější doba manifestace poruchy funkce štítné žlázy byla v prvních dvou letech po transplantaci (celkem 109 pacientů, 64,5 %), v prvních pěti letech pak byla nalezena u 78,7 % pacientů (graf 1). Primární hypotyreóza byla nejčastějším nálezem (110 pacientů, 65,1 %), v naprosté většině se jednalo o subklinickou formu (101 pacientů), manifestní formu mělo pouze devět pacientů. U žádného pacienta jsme nediagnostikovali centrální hypotyreózu. Hypertyreózu měl jeden pacient, další čtyři pacienti po fázi přechodné hypotyreózy přešli do fáze hypertyreózy, vyžadující tyreostatika. Zvýšené hladiny autoprotilátek (aTPO, aTG, TRAK) mělo celkem 95 pacientů (56,2 % ze souboru, 20,5 % všech transplantovaných pacientů), obvykle ve spojení s hypofunkcí (n = 50) či hyperfunkcí (n = 5) štítné žlázy, při eufunkci štítné žlázy byly protilátky detekovány u dalších 39 pacientů (tab. 2).
Graf 1. Manifestace postižení štítné žlázy v čase od transplantace. 
Tab. 2. Charakteristika postižení štítné žlázy u pacientů po transplantaci. 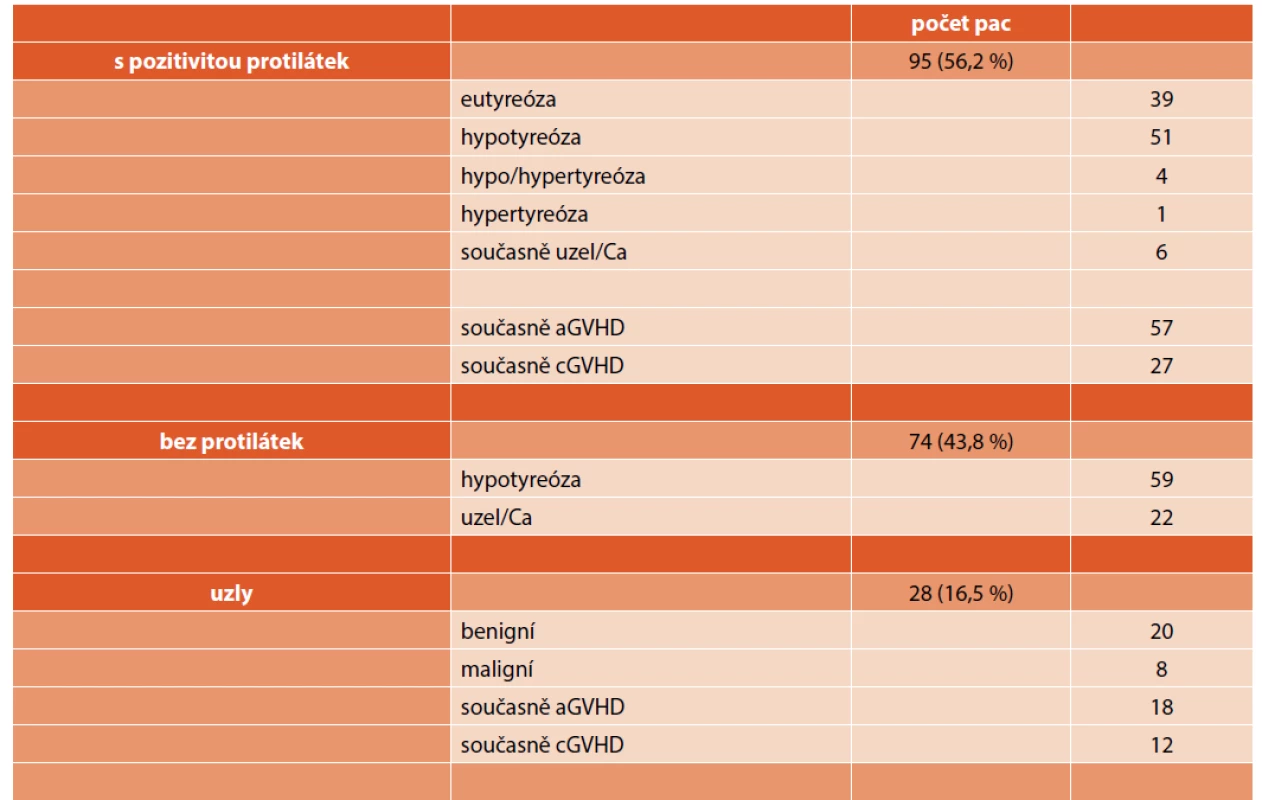
Uzly štítné žlázy byly zjištěny u 28 pacientů. U osmi z těchto pacientů byl diagnostikován karcinom štítné žlázy v rozmezí 5,4–21,5 let po transplantaci. Jednalo se o čtyři ženy a čtyři muže, věk v době transplantace byl 3,2–12,4 roku (medián 6,6). Sedm z osmi pacientů (88 %) pacientů mělo přípravný režim s CTO 10–14,4 Gy (graf 2). Akutní reakci štěpu proti hostiteli mělo sedm z osmi pacientů, chronickou reakci pak polovina. U všech pacientů se jednalo o papilární karcinom štítné žlázy, klinické stadium I T1–T2N0M0. Všichni podstoupili operační výkon (obvykle totální tyroidektomii), tři z nich ještě následně podání radiojodu. Všichni žijí 1,3–10,9 let po diagnóze malignity a jsou trvale dispenzarizováni (tab. 3).
Graf 2. Přípravný režim pacientů s karcinomem štítné žlázy.
Ca – karcinom, ŠŽ – štítná žláza, CTO – celotělové záření, CHT – chemoterapie
Tab. 3. Charakteristika pacientů s maligním onemocněním štítné žlázy. 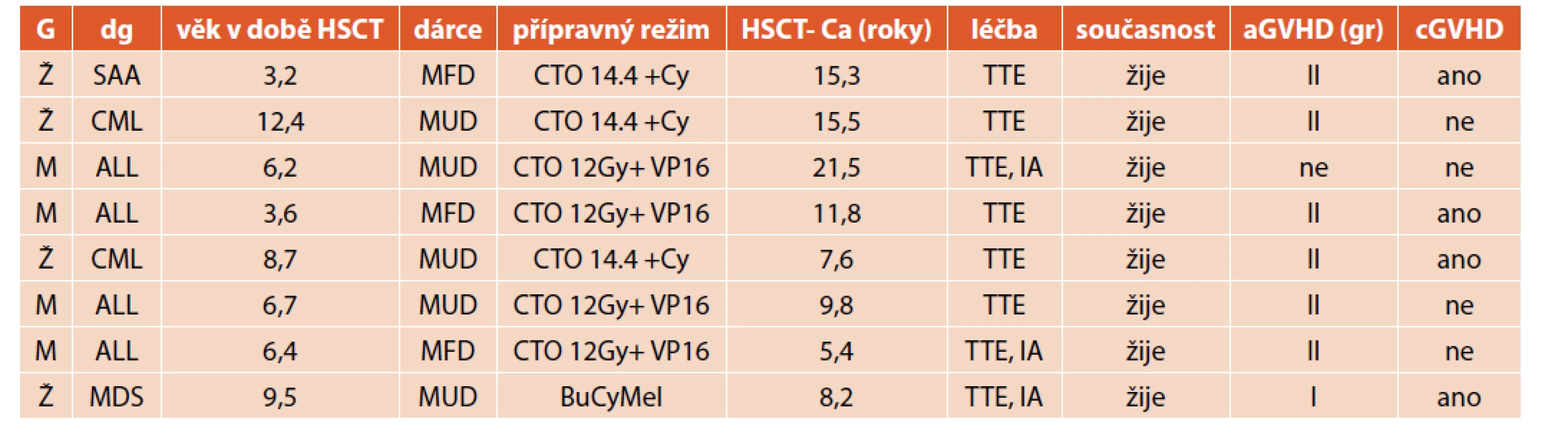
G: pohlaví, HSCT: transplantace kostní dřeně, Ca: karcinom, Ž: žena, M: muž
AA: těžká aplastická anémie, CML: chronická myeloidní leukémie
ALL: akutní lymfatická leukémie, MDS: myelodysplastický syndrom
MFD: shodný rodinný dárce, MUD: nepříbuzný dárce
CTO: celotělové zážení, Gy-gray, VP16: etoposid, Cy: cyklofosfamid, Bu: busulfan, Mel: melfalan
TTE: tyroidektomie, AI: léčba radiojódem, gr: grade, aGVHD: akutní reakce štěpu proti hostiteli
cGVHD: chronická reakce štěpu proti hostiteliLéčbu L-thyroxinem (Euthyrox, Letrox) mělo celkem 115 pacientů, většina pro projevy primární hypotyreózy. Jedenáct pacientů dostává léčbu jako substituci po tyroidektomii (TTE), dva pacienti pro pozitivní autoprotilátky a dva pro nález benigního uzlu při normální hladině TSH i fT4 (graf 3). Pacient s primárním projevem hypertyreózy včetně klinických projevů byl úspěšně léčen tyreostatiky, léčba byla po roce ukončena. Čtyři pacienti po přechodné fázi hypotyreózy se substituční léčbou pak vyžadovali při laboratorních známkách hypertyreózy tyreostatika, u jednoho z nich s ohledem na průběh onemocnění byla provedena TTE. Bez léčby je sledováno jedenáct pacientů s projevy subklinické hypotyreózy, 35 pacientů s pozitivitou autoprotilátek a normální hladinou TSH, fT4 a šest pacientů s nálezem malého a nerostoucího uzlu na ultrazvuku.
Graf 3. Pacienti léčení L-thyroxinem podle diagnózy.
TT – tyreoidektomie, PL– protilátky
U části pacientů byla tyreopatie přechodná a funkční projevy či hladiny autoprotilátek se normalizovaly. U 31 pacientů (32,6 %) vymizely autoprotilátky, u 18 z nich bez léčby. Sedmnáct pacientů s projevy hypotyreózy (15,5 %) po normalizaci hodnot hormonů štítné žlázy léčbu L-thyroxinem ukončilo a pokračuje v pravidelném sledování.
DISKUSE
Populace transplantovaných pacientů patří do rizikové skupiny s endokrinními komplikacemi, které vysoce převyšují frekvenci v běžné populaci a mají negativní dopad na kvalitu života vyléčených pacientů. Tyreopatie patří mezi komplikace nejčastější. Podle různých studií se uvádí výskyt v rozmezí 10–40 %, vyšší procento postižení udávají studie na dětských pacientech oproti skupině dospělých. V našem souboru má postižení štítné žlázy 36,5 % sledovaných pacientů. Nejčastější funkční poruchou je hypotyreóza, častěji je vyšší výskyt pozorován ve skupině ozařovaných pacientů, ale vyskytuje se i ve skupině pacientů léčených pouze chemoterapií. Méně častý je výskyt hypertyreózy, obvykle v souvislosti s autoimunitním postižením. Tvorba autoprotilátek je známou komplikací transplantace, může být spouštěčem poruchy funkce štítné žlázy, zejména projevů hypofunkce [12–14].
Autoimunitní onemocnění štítné žlázy je nejčastější získanou tyreopatií v běžné populaci dětí a dospívajících. Vyskytuje se u 2–3 % dětí, 8–10krát častěji u dívek, výskyt stoupá v období dospívání [10, 11]. V našem souboru byly zvýšené hladiny autoprotilátek zachyceny u 95 pacientů (20,5 % všech transplantovaných pacientů), toto číslo je významně vyšší než frekvence běžné populace, nicméně v souladu s publikovanými daty transplantovaných pacientů [15]. Tvorba autoprotilátek bývá spojována některými autory s rozvojem akutní a zejména chronické GVHD. V naší skupině nebyl výskyt GVHD vyšší ve srovnání s celkovým transplantačním souborem.
Nástup tyreopatií je obvykle velmi časný [16]. Naše výsledky jsou s tímto zjištěním v souladu. S výjimkou výskytu karcinomu štítné žlázy byla tyreopatie diagnostikována u 75 % pacientů během prvních pěti let po transplantaci. V našich datech nebyl nalezen statistický rozdíl výskytu tyreopatie podle základní diagnózy, pohlaví ani podle typu dárce, není rozdíl ani ve skupině pacientů předléčených chemoterapií či radioterapií. Ve skupině pacientů podstupující léčebnou radioterapii je výskyt nejvyšší, ale ani zde hodnoty nejsou na rozdíl od jiných studií statisticky signifikantní [14] (graf 4). Důvodem může být skutečnost, že v čase klesá počet zářených pacientů, je snaha redukovat režimy s CTO a nahrazovat je vysokodávkovanou chemoterapií. Výskyt akutní a zejména prolongované chronické GVHD je popisován některými studiemi jako významný rizikový faktor [7, 15, 16]. V našem souboru pacienti s chronickou GVHD mají vyšší výskyt tyreopatie, ale není signifikantní, akutní GVHD v našem souboru roli nehraje.
Graf 4. Kumulativní incidence rozvoje postižení štítné žlázy podle typu přípravného režimu. 
Vzhledem k vysokému riziku rozvoje tyreopatie je standardem dlouhodobého sledování monitorace funkce štítné žlázy. V našem centru podobně jako v zahraničí se vyšetření provádí v pravidelných intervalech, nejméně jednou ročně v rámci pravidelných kontrol nebo v případě zjištěné tyreopatie častěji. Sledují se klinické příznaky (struma, TK, puls a další příznaky tyreopatie), monitoruje se hladina fT4, TSH, aTPO, aTG. Jednoznačnou indikací k substituční léčbě L-thyroxinem jsou stavy po totální tyroidektomii, primární či centrální hypotyreóza. V případě subklinické hypotyreózy je vhodné vyšetření v odstupu tří měsíců zopakovat před případným zahájením léčby; důvodem je možné zvýšení tranzientního TSH. K časné léčbě se však často přistupuje při subklinické hypotyreóze s pozitivitou autoprotilátek. Jednotný přístup není k léčbě eutyroidních dětí s pouhou elevací autoprotilátek (tzv. izohormonální léčba s předpokladem možného ovlivnění patologické imunitní reakce), v současnosti je léčba v této situaci považována za neúčinnou. Po nasazení či úpravě dávky se doporučuje kontrola hladiny TSH a fT4 v odstupu alespoň 4–6 týdnů. Stejný postup provádíme u našich pacientů. Při zvýšené funkci štítné žlázy s obrazem tyreotoxikózy (Gravesova-Basedowova choroba) je metodou první volby podávání tyreostatik [8, 11].
Mezi nejzávažnější, život ohrožující potransplantační komplikace se řadí rozvoj sekundárních malignit. Karcinomy štítné žlázy patří mezi sekundárními malignitami mezi nejčastější. V běžné dětské populaci je výskyt karcinomů štítné žlázy raritní (3–5 případů na 100 000 ročně), po transplantaci je riziko výskytu signifikantně zvýšené. Histologicky se jedná nejčastěji o papilární karcinom, zejména jeho folikulární variantu. Hlavním rizikovým faktorem je radioterapie, z dalších pak mladší věk v době transplantace a ženské pohlaví, případně GVHD. Polovina pacientů je asymptomatická, s normální hladinou TSH. Ultrazvukové vyšetření se jeví jako nejdůležitější nejen v časné diagnostice karcinomů, ale i při odhalení uzlu s potenciální malignizací, která je v dětském věku výrazně vyšší než v dospělé populaci (10–25 % u dětí vs. 5 % u dospělých) [17, 18, 19]. V našem souboru byl karcinom štítné žlázy diagnostikován u 1,7 % všech pacientů. Tito pacienti byli transplantováni v časnějším věku, pohlaví jsou zastoupena stejně, ale naprostá většina pacientů (7/8) podstoupila celotělové záření jako předtransplantační přípravu v souladu s publikovanými daty [18, 19]. V této skupině je také vysoký výskyt jak akutní, tak chronické GVHD; podobně uvádějí vysoký výskyt GVHD některé studie, jiné však tento rizikový faktor nepotvrzují [17, 19]. Vzhledem k četným komplikacím, které léčbu transplantací provázejí, je nyní snaha redukovat toxicitu předtransplantační přípravy. Některé studie ale ukazují, že ani redukce intenzity chemoterapie a omezení záření nevedlo k snížení endokrinních komplikací zahrnujících tyreopatie a poruchu růstu [20].
Je tedy zřejmé, že monitorace endokrinopatií nadále zůstane důležitou součástí potransplantační péče. Zcela zásadní je spolupráce s endokrinology, kterými je léčba vedena, optimálně zejména v případě rozvoje uzlů s rizikem malignizace na zkušeném pracovišti. Nelze samozřejmě pominout ani roli praktických lékařů, kteří mohou na sledování a léčbě participovat. Záchyt tyreopatie v ordinaci praktických lékařů vyžaduje časnou referenci do transplantační ambulance. Vzhledem k tomu, že incidence uzlů štítné žlázy může být poddiagnostikována, ultrazvukové vyšetření by mělo být rutinním vyšetřením transplantovaných pacientů.
ZÁVĚR
Alogenní transplantace kmenových buněk krvetvorby je léčebnou modalitou pro řadu maligních i nemaligních onemocnění. Se stále se zlepšujícími výsledky léčby je detekce pozdních následků nezbytnou součástí péče po HSCT. Postižení štítné žlázy je jednou z nejčastějších komplikací, dominujícím projevem je hypotyreóza. Je tedy nutné pravidelně (po 6–12 měsících) kontrolovat a vyšetřovat funkci štítné žlázy klinicky a zejména laboratorními parametry. Závažnou a život ohrožující komplikaci představují sekundární malignity; jejich riziko po HSCT roste v čase a karcinomy štítné žlázy jsou dominující skupinou. Multioborová spolupráce, pravidelné laboratorní i ultrazvukové vyšetření je důležité k časnému odhalení nejen funkčních abnormit, ale i detekci časných stadií malignity.
Podpořeno projektem MZČR koncepčního rozvoje výzkumné organizace 00064203 (FN v Motole).
Za pomoc při grafickém a statistickém zpracování dat děkuji Aleši Lukšovi z Kliniky dětské hematologie a onkologie.
Došlo 31. 7. 2020
Přijato 20. 9. 2020
Korespondující autorka:
MUDr. Petra Keslová
Klinika dětské hematologie a onkologie
FN Motol a 2. LF UK
V Úvalu 84
150 06 Praha 5 – Motol
e-mail: petra.keslova@fnmotol.cz
Zdroje
1. Cetkovský P, Mayer J, Starý J, et al. Transplantace kostní dřeně a periferních hematopoetických buněk. 1. vydání. Praha: Galén, 2016 : 1–413.
2. Keslová P. Sledování pacientů po léčbě hematologických malignit v dětském věku, pozdní následky léčby. Postgrad Med 2013;15 (5): 489–492.
3. Passweg JR, Baldomero H, Bader P, et al. Hematopoietic stem cell transplantation in Europe 2014: more than 40000 transplants annually. Bone Marrow Transplant 2016; 51 : 786–792.
4. Majhail NS. Long-term complications after hematopoietic cell transplantation. Hematol Oncol Stem Cell Ther 2017; 10 (4): 220–227.
5. Wingard JR, Vogelsang GB, Deeg HJ. Stem cell transplantation: Supportive care and long-term complications. Hematology. Am Soc Hematol Educ Program. 2002; 422–444. doi: 10.1182/asheducation-2002.1.422. PMID: 12446435 Review.
6. Roziakova L, Mladosievicova B. Endocrine late effects after hematopoietic stem cell transplantation. Oncol Res 2010; 18 (11–12): 607–615.
7. Dvorak CHC, Gracia CR, Sanders JE, et al. NCI, NHLBI/PBMTC First International Conference on Late Effects after Pediatric Hematopoietic Cell Transplantation: Endocrine Challenges-Thyroid dysfunction, Growth Impairment, Bone Health, Reproductive Risk. Biol Blood Marrow Transplant 2011; 17 : 1725–1738.
8. Savani BN, Griffith ML, Jagasia S, et al. How I treat late effects in adults after allogeneic stem cell transplantation. Blood March 2011; 117 (11): 3002–3010.
9. Sanders JE, Hoffmeister PA, Woolfrey AE, et al. Thyroid dysfunction following hematopoietic cell transplantation in children: 30 years‘ experience. Blood 2009;113 (2): 306–308.
10. Al Taji E. Autoimunitní onemocnění štítné žlázy v ordinaci PLDD. Pediatr praxi 2018; 19(1): 13–17.
11. Al Taji E, Hnikova O. Tyreopatie v dětství a adolescenci. Pediatr praxi 2014;15 (3): 134–137.
12. Tauchmanova L, Selleri C, Rosa GD, et al. High prevalence of endocrine dysfunction in long-term survivors after allogeneic bone marrow transplantation for hematologic diseases. Cancer 2002; 95 : 1076–1084.
13. Isshiki Y, Ono K, Shono K, et al. Autoimmune thyroid dysfunction after allogeneic hematopoietic stem cell transplant. Leukemia Lymphoma 2016; 57 (5): 1227–1229.
14. Ferry C, Gemayel G, Rocha V, et al. Long-term outcomes after allogeneic stem cell transplantation for children with hematological malignancies. Bone Marrow Transplant 2007; 40 : 219–224.
15. Savani B, Koklanaris E, Le Q, et al. Prolonged chronic graft-versus-host disease is a risk factor for thyroid failure in long-term survivors after matched sibling donor stem cell transplantation for hematological malignancies. Biol Blood Marrow Transplant 2009; 15 : 377–381.
16. Jung YJ, Jeon YJ, Cho WK, et al. Risk factors for short term thyroid dysfunction after hematopoietic stem cell transplantation. Korean J Pediatr 2013; 56 (7): 298–303.
17. Hematological malignancies. Biol Blood Marrow Transplant 2009;.15 : 377–381.
18. Cohen A, Rovelli A, van Lint MT, et al. Secondary thyroid carcinoma after allogeneic bone marrow transplant during childhood. Bone Marrow Transplant 2001; 28 : 1125–1128.
19. Keslova P, Formankova R, Riha P, et al. Total body irradiation is a crucial risk factor for developing secondary carcinomas after allogeneic hematopoietic stem cell transplantation in childhood. Neoplasma accepted, ahead of print manuscript, cite article as https ://doi.org/10.4149/neo_2020_200214N131.
20. Vivanco M, Dalle JH, Alberti C, et al. Malignant and benign thyroid nodules after total body irradiation preceding hematopoietic cell transplantation durin childhood. Eur J Endocrinol 2012; 167 : 225–233.
21. Myers KC, Howell JC, Wallace G, et al. Poor growth, thyroid dysfunction and vitamin D deficiency remain prevalent despite reduced intensity chemotherapy for hematopoietic sten cell transplantation in children and young adults. Bone Marrow Transplant 2016; 51 (7): 980–984.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2021 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Předčasně narozené dítě
- Pleomorfní adenom v dětském věku
- Hantavírusová hemoragická horúčka s renálnym syndrómom – prvé prípady u detí na Slovensku
- Dysthymie jako méně známá forma deprese: klinický obraz a léčba
- Nadváha jako následek covidové izolace Lázně Luhačovice kombinují léčbu s redukčním režimem
- Dorostové lékařství
- Látkové a nelátkové závislosti v adolescencii
- Intoxikácie v adolescencii za rok 2019 konzultované s Národným toxikologickým informačným centrom
- Je čas rozísť sa s pediatrom – prestup pediatrických pacientov do starostlivosti všeobecného lekára pre dospelých
- Dôležitosť dlhodobého sledovania pacientov s nefropatiou
- Vývoj antropometrických parametrů moravských dětí v předškolním věku
- Postižení štítné žlázy po alogenní transplantaci kmenových buněk krvetvorby v dětském věku a v adolescenci, zkušenosti z 30 let sledování
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Dysthymie jako méně známá forma deprese: klinický obraz a léčba
- Látkové a nelátkové závislosti v adolescencii
- Hantavírusová hemoragická horúčka s renálnym syndrómom – prvé prípady u detí na Slovensku
- Dorostové lékařství
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



