-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba trombotických příhod u novorozenců a kojenců
Treatment of thrombosis in newborns and infants
Introduction: Thrombotic events in childhood are relatively rare; however there has been a rising trend in their incidence. They usually occur as a complication of another disease or its treatment. The single most important risk factor for thrombosis is central venous catheter placement. Current recommendation for treatment and prophylaxis of thrombosis in children are based on 9th ACCP consensus. The treatment strategy differs in some aspects to the treatment of adults. In small children, low-molecular-weight heparins and a more intense therapy are preferred in order to achieve maximum recanalization of affected vessels.
Cohort and methods: Thromboses in children up to 1 year of age, who were treated at the Department of Paediatric Haematology at University Hospital Brno from 2011 to 2018, are presented in this article.
Results: In above mentioned period of time, 30 children of this age were treated. There was a vast majority (almost 90%) of venous thromboses. They were mostly associated with central venous catheter placement (50% of them). All patients were treated with low-molecular-weight heparins. In most of the cases, the treatment was initiated via continuous infusion, later converted to standard subcutaneous administration. The median treatment length was 80 days. In 80% of patients, there was at least partial regression of thrombosis present at the end of the treatment. There was only one adverse event related to the therapy. In general, the treatment was well tolerated by both children and parents.
Conclusion: Diagnosis of thrombotic events in childhood requires an experienced laboratory and imaging. The treatment should be guided by a paediatric haematologist. Currently, low-molecular-weight heparins are the treatment of choice. A well guided therapy combined with the treatment of often underlying diseases has a high probability of thrombosis regression. Standardized treatment guidelines should be available at every department, where thromboses in children are treated.
Keywords:
Infants – thrombosis – newborns – LMWH – catheter-related thrombosis
Autoři: O. Zapletal; J. Máchal; J. Blatný
Působiště autorů: Oddělení dětské hematologie FN Brno a LF MU Brno
Vyšlo v časopise: Čes-slov Pediat 2020; 75 (2): 82-90.
Kategorie: Původní práce
Souhrn
Úvod: Trombotické příhody jsou v dětském věku relativně vzácná onemocnění, jejich incidence však v poslední době narůstá. Vyskytují se zpravidla jako komplikace jiného onemocnění či jeho léčby, přičemž nejvýznamnějším rizikovým faktorem v dětském věku je zavedení centrálního žilního katétru. Současná doporučení pro léčbu a profylaxi trombóz u dětí vycházejí z 9. konsensu ACCP. Strategie léčby se u dětí oproti dospělým pacientům v některých aspektech odlišuje, zejména u nejmenších dětí jsou výrazně upřednostňovány nízkomolekulární hepariny a rovněž je preferována intenzivnější léčba s cílem zachování maximálně průchodného cévního řečiště.
Soubor a metodika: Tato práce mapuje trombotické příhody u dětí do 1 roku věku, které byly léčeny na Oddělení dětské hematologie (ODH) Fakultní nemocnice Brno v letech 2011–2018.
Výsledky: Ve sledovaném období bylo pro trombózu léčeno 30 dětí v tomto věkovém rozmezí. V souboru výrazně převažovaly žilní trombotické příhody (90 %), nejčastěji asociované se zavedením centrálního žilního katétru (polovina z nich). Všichni pacienti byli léčeni podáváním nízkomolekulárního heparinu (LMWH), zpravidla nejprve ve formě kontinuální infuze a následně byli převedeni na podkožní aplikaci. Medián trvání léčby byl 80 dnů. Alespoň parciální regrese trombózy byla zaznamenána u 80 % léčených pacientů. Komplikace léčby byla zaznamenána pouze u jednoho dítěte, celkově byla léčba pacienty i rodiči dobře tolerována.
Závěr: Diagnostika trombotických příhod v dětském věku vyžaduje zkušené zázemí laboratoří a zobrazovacích metod. Léčba těchto onemocnění patří do rukou dětského hematologa na adekvátně vybaveném pracovišti. Lékem volby jsou v současnosti nízkomolekulární hepariny. Antikoagulace LMWH vede společně s léčbou obvykle přítomného základního onemocnění k vysoké šanci na regresi trombózy. Je vhodné, aby každé pracoviště mělo pro léčbu dětských trombotických příhod vytvořen standardní postup.
Klíčová slova:
trombózy – novorozenci – kojenci – LMWH – katétrové trombózy
ÚVOD
Trombózy u dětí jsou relativně vzácné stavy, které se obvykle vyskytují jako komplikace jiného onemocnění nebo jeho léčby. S rostoucí intenzitou a zvyšující se úspěšností léčby závažných onemocnění či stavů (například onkologických, kardiologických, revmatologických, péče o nedonošené novorozence apod.) narůstá i výskyt trombotických příhod u dětí. Ještě v devadesátých letech minulého století uváděla data z tzv. Kanadského registru trombóz incidenci žilního tromboembolismu 0,7/100 000 dětí a rok a 5,3 na 10 000 dětí hospitalizovaných, u novorozenců 0,24 na 10 000 přijetí na jednotky intenzivní péče [1–4]. Novější údaje uvádějí nárůst výskytu s incidencí o více než řád vyšší [5].
Tepenné trombózy u dětí postihují buď místa přímého poškození tepny (katetrizace, úrazy), nebo mozkové tepny, jiné lokalizace jen vzácně [2, 6]. Žilní trombózy se vyskytují u prepubertálních dětí nejčastěji v povodí horní duté žíly (80 % u novorozenců, přes 60 % u starších dětí), a to buď jugulární a podklíčkové žíly v souvislosti se zavedením centrálního žilního katétru, nebo jsou postiženy mozkové splavy. Centrální žilní katétry (CVK) jsou vůbec nejčastějším rizikovým faktorem pro žilní trombózu. Kanylace tepny je pak rizikovým faktorem i pro tepennou trombózu. Uvádí se, že katétry jsou asociovány s více než 90 % trombóz u novorozenců a více než 60 % trombóz u starších dětí [1, 2, 7, 8]. Hluboké žíly dolních končetin bývají postiženy vzácněji. U dospívajících je ale situace odlišná a distribuce trombóz se podobá dospělým s převažujícím postižením povodí dolní duté žíly – hlubokých žil dolních končetin a pánve [9].
Na rozdíl od dospělých, u nichž je preventivní antikoagulační zajištění indikováno pro vysoké riziko žilního tromboembolismu při většině operací, delší imobilizaci apod., není paušální antikoagulační léčba u dětí v takovýchto situacích doporučována, neboť riziko trombotické příhody je v tomto období velmi nízké [1]. Dokonce i vrozené trombofilní stavy se totiž manifestují trombotickou příhodou v dětském věku velmi vzácně, nárůst incidence nastává až postpubertálně [1, 10].
Současná doporučení pro léčbu tromboembolických příhod u dětí vycházejí z 9. konsensu ACCP z roku 2012 [11], případně z doporučení ASH (American Society on Hematology) z roku 2018 [12], která však do jisté míry jen aktualizuje doporučení ACCP. Použití antitrombotik u dětí je oproti dospělým pacientům odlišné. Je ovlivněno rozdíly v epidemiologii trombotických onemocnění, odlišnostmi v hemostatickém systému, zejména u nejmenších dětí, odlišnostmi ve farmakokinetice používaných léčiv oproti dospělým pacientům, výskytem a typem interkurentních onemocnění a další medikace a omezenou dostupností lékovým forem použitelných u nejmenších pacientů [13]. V doporučeních je výslovně uvedeno, že v případě, kdy je to možné, měl by terapii tromboembolických příhod v dětském věku řídit dětský hematolog se zkušenostmi s touto léčbou. Je také doporučena o něco intenzivnější léčba trombotických příhod u dětí, než doporučoval předchozí konsensus. Intenzivnější léčba je doporučena jak pro novorozence a kojence, tak i pro starší děti. Léčba je vedena snahou o zachování maximálně průchodného cévního řečiště i vzhledem k tomu, že děti před sebou mají obvykle ještě celý dlouhý život.
V léčbě dětských pacientů jsou preferovány nízkomolekulární hepariny (LMWH) před nefrakcionovaným heparinem (UFH) a často i před antagonisty vitaminu K (VKA), a to nezřídka i v navazující léčbě. LMWH jsou podávány standardně formou subkutánních injekcí při použití LMWH jednou či dvakrát denně. Je doporučena cílová anti-Xa aktivita 0,5–1 IU/ml ve vzorku odebraném po 4–6 hodinách od aplikace, anebo 0,5–0,8 IU/ml ve vzorku odebraném po 2–6 hodinách [14]. Použití LMWH ve formě kontinuální intravenózní infuze sice zůstává v současnosti „off-label“ podle SPC jednotlivých preparátů, nicméně i tato forma antikoagulační terapie je v ACCP konsensu citována, byť ne jako doporučení.
Naše pracoviště se dlouhodobě problematikou kontinuální infuze LMWH zabývá a i zmínka v ACCP konsensu právě na tyto zkušenosti odkazuje. Jak je zmíněno v původních publikacích, dávka i cílové hladiny při použití kontinuální infuze LMWH vycházejí ze subkutánního podání, monitoraci anti-Xa aktivity lze provádět kdykoliv, vždy však alespoň 12 hodin po změně podávané dávky [15–17]. Stejně, jako při použití nefrakcionovaného heparinu, i u LMWH bylo zvoleno stejné rozmezí hladin antiXa, což se podle našich zkušeností prokázalo jako efektivní a bezpečné. Tato práce to rovněž potvrzuje. Je-li použit nefrakcionovaný heparin, je dávka titrována na cílovou anti-Xa aktivitu 0,35–0,7 IU/ml, anebo s ní korespondující aPTT. Při iniciaci terapie UFH se doporučuje použití bolusu 75–100 IU/kg tělesné hmotnosti nebo vynechání bolusu v případě vysokého rizika krvácení. Dlouhodobé použití UFH u dětí není doporučeno. Při použití VKA je doporučeno cílové INR v rozmezí 2–3, pouze v případě mechanických chlopenních náhrad je cílové INR vyšší, podle doporučení u dospělých pacientů. Aspirin je používán pouze v antiagregační indikaci v dávce 1–5 mg/kg. Nová perorální antikoagulancia (NOAK) jsou v současnosti schválena k použití pouze u pacientů starších 18 let. Studie u dětí v současné době probíhají. Je do nich zapojeno i naše pracoviště.
Použití trombolýzy je u dětských pacientů indikováno pouze v případě život, orgán či končetinu ohrožující trombózy. U novorozenců je před zahájením této terapie vždy nutno doplnit hladinu plazminogenu prostřednictvím čerstvé zmražené plazmy či OctaPlasu®. Může být použita systémová i lokální trombolýza, případně mechanická trombektomie podle možností a zkušeností pracoviště.
U dětských pacientů s první idiopatickou žilní trombózou je doporučeno podávání antikoagulace po dobu 6–12 měsíců. U dětí se sekundární žilní trombózou, u nichž získaný rizikový faktor pominul, se doporučuje podávat antikoagulaci po dobu do 3 měsíců, pokud rizikový faktor nepominul, doporučuje se v podávání antikoagulační léčby či profylaxe pokračovat po dobu jeho trvání. U dětí s opakovanými idiopatickými žilními trombózami je doporučeno dlouhodobé podávání VKA.
Je-li příčinou manifestní žilní trombózy abnormalita v cévním řečišti, je doporučena antikoagulační léčba jako u idiopatických žilních tromboembolismů a zvážení chirurgického řešení malformace.
Rutinní profylaxe tromboembolických žilních příhod před chirurgickými zákroky není v dětském věku doporučena vzhledem k velmi nízké incidenci těchto komplikací u dětí. Ze stejného důvodu není indikován ani rutinní screening vrozených trombofilních rizik [11, 18, 19].
S centrálním venózním katétrem asociované trombózy představují podle literárních údajů 40–80 % trombóz v dětském věku. Při prokázané katétrové trombóze je doporučeno léčbu zahájit LMWH či UFH v terapeutické dávce a katétr neodstraňovat, pokud je funkční a bude dále využíván. Pokud je katétr nefunkční nebo dále nepotřebný, doporučuje se jej po 3–5 dnech extrahovat. V případě, že se jedná o septický katétr, je indikovaná okamžitá extrakce. Trvání následné léčby je doporučeno v délce do 3 měsíců. Pokud přetrvává nutnost zavedení centrálního venózního katétru, je doporučena sekundární antikoagulační profylaxe po dobu, kdy je katétr zavedený. Nově je doporučena i primární prevence vzniku s CVK asociované trombózy napříč věkovými kategoriemi. Tato doporučení připouštějí tři alternativy: opakované proplachy fyziologickým roztokem, opakované uzávěry katétru trombolytikem obsahujícím tPA, nebo, zejména u novorozenců, kontinuální infuze UFH v dávce 0,25–1 IU/kg/h. U umbilikálních katétrů je doporučeno zavedení konce katétru do vyšší polohy a kontinuální infuze UFH ve výše uvedené dávce [11].
Specifickým případem žilní trombózy je trombóza renálních žil. U unilaterální trombózy je v případě, že jsou postiženy renální funkce, anebo dochází k progresi trombózy, doporučeno zahájit podávání LMWH či UFH v terapeutické dávce. U bilaterální trombózy je doporučeno léčbu zahájit vždy.
V případě trombózy žilních splavů u novorozence je doporučeno zahájit antikoagulaci na dobu 6 týdnů až 3 měsíců ve všech případech, kdy není přítomno významné intrakraniální krvácení. U cévních mozkových příhod v raném dětství se doporučení liší v závislosti na přítomnosti prokázaného embolizačního zdroje: v případě, že embolizační zdroj není prokázán, je doporučeno pouze sledování a podpůrná léčba, naopak, je-li prokázán kardioembolizační zdroj, doporučuje se zahájení antikoagulační terapie. V případě opakovaných cévních mozkových příhod je doporučena buď antikoagulační, či antiagregační léčba.
V současné době používáme pro léčbu trombotických příhod tyto přípravky LMWH: nadroparin, dalteparin, enoxaparin a bemiparin. Nadroparin v adjustaci „Fraxiparine Multi“ není vhodný pro děti do 3 let. Vzhledem k podobnému farmakologickému profilu jsou všechny přípravky dávkovány obdobně v IU aXa/kg. Jako způsob podání volíme standardně doporučenou podkožní injekcí (s.c.) á 12–24 hodin, alternativně u dětí s již zavedeným žilním přístupem lze podat LMWH i.v. kontinuální infuzí (CI). Toto podání je v současnosti podle registrace SÚKL „off-label“. Tento stav ale nevylučuje takové podání LMWH, neboť je klinicky nejen v naší nemocnici v pediatrické populaci ověřeno [15, 16]. Tato práce si neklade za cíl postulovat doporučení podávat LMWH v kontinuální infuzi, pouze dokladuje další případy léčby tímto způsobem a prezentuje jeho efektivitu i bezpečnost u našich pacientů.
U pacientů s normální funkcí ledvin při terapeutickém podání volíme iniciální dávku LMWH 100–150 IU/kg/12 hod s.c. (150 IU u dětí do 3 měsíců věku a do 5 kg hmotnosti), ve stejné dávce lze podat i v kontinuální infuzi i.v. Cílové aXa je 0,5–1 IU/ml (odběr při s.c. podání 3–4 hod po aplikaci 3.–4. dávky, při CI kdykoli 2.–3. den podávání). Doba podávání iniciální terapeutické dávky je minimálně 5 dní, obvykle 7–14 dní. Jak již bylo zmíněno, dávka pro kontinuální infuzi vychází z s.c. podání , podobně jako je tomu u UFH. Sekundární profylaxe recidivy trombózy trvá minimálně 3 měsíce po proběhlé TEN příhodě (délku přesně určí hematolog). Pokud není pacient převeden na kumariny, pokračuje v dávce LMWH snížené na 2/3–3/4 iniciální dávky (tedy kolem 150 IU/kg/den), lze podávat i v jedné denní dávce. Cílové antiXa je okolo 0,5 IU/ml (odběr při s.c. podání 3–4 hod po aplikaci 3.–4. dávky, při CI kdykoli 2.–3. den podávání).
Pro primární (vzácně) či sekundární (častěji) profylaxi TEN (u dětí, kde z důvodu rizika TEN indikováno hematologem) je dávka LMWH 100–150 IU/kg/den 1x denně s.c., alternativně podáváme LMWH ve stejné dávce v kontinuální infuzi i.v. Cílové aXa je v tomto případě 0,1–0,5 IU/ml (odběr při s.c. podání 3–4 hod po aplikaci 3. dávky, při i.v. kdykoli 2.–3. den podávání). Převádíme-li pacienta z kontinuální i.v. infuze na s.c. podávání, lze s ohledem na poločas LMWH při i.v. podání podat 1. dávku s.c. šest hodin po ukončení infuze, ve většině případů zůstává celková denní dávka zachována.
Při podávání LMWH provádíme monitoraci krevního obrazu (riziko heparinem indukované trombocytopenie – HIT) u všech, kteří dostávají LMWH déle než 4 dny, každé 2–3 dny mezi 4. a 14. dnem podání. U pacientů, kteří dostávali UFH či LMWH v předchozích 100 dnech, je indikováno stanovení počtu trombocytů před podáním LMWH a následně za 24 hodin. Vyšetření aXa provádíme podle klinického stavu pacienta, renálních funkcí a dalších okolností, obecně 1x týdně první měsíc.
Cílem této práce je zmapovat výskyt jednotlivých typů trombotických příhod u novorozenců a kojenců na specializovaném dětském hematologickém pracovišti, popsat jejich léčbu, její efektivitu a získané poznatky konfrontovat s údaji uváděnými v literatuře.
SOUBOR A METODIKA
Do souboru byli zařazeni pacienti léčení pro trombotickou příhodu na našem pracovišti v letech 2011–2018 ve věku 0–12 měsíců v době diagnózy. Informace jsme čerpali z NIS (Nemocniční informační systém – ve FN Brno software AMIS H), pacienti byli vybráni podle MKN-10 kódu hlavní diagnózy (I26.*, I63.*, I67.*, I80.*, I81.*, I82.*). U těchto pacientů jsme z dokumentace doplnili následující údaje – věk při diagnóze trombotické příhody, pohlaví, typ trombotické příhody, lokalizaci trombózy, souvislost s centrálním žilním katétrem (CVK), další diagnózy pacienta a jeho trombofilní dispozice. Shromáždili jsme také údaje o dávkování a délce podávání LMWH, jakož i o efektu této léčby a jejích komplikacích.
Diagnóza trombotické příhody byla stanovena na základě anamnézy, klinického pediatrického vyšetření, laboratorních nálezů a zobrazovacích metod. Podle typu příhody se jednalo o dopplerovské ultrazvukové (UZ) vyšetření s kompresí (v lokalitách, kde to bylo možné), vyšetření počítačovou tomografií (CT, CT-Ag), nebo vyšetření magnetickou rezonancí (MR, MR-Ag). Zobrazovací vyšetření byla opakována podle stavu pacienta k posouzení efektu léčby obvykle po 10–14 dnech od zahájení léčby, dále za 6 týdnů až za 3 měsíce a/nebo před případným ukončením léčby. U jednotlivých pacientů jsme použili následující kategorie pro léčebnou odpověď: progrese trombózy, žádná odpověď, parciální regrese (zmenšení rozsahu trombotických změn s parciální rekanalizací trombotizované oblasti) a plná regrese trombotických změn.
Léčba byla vedena podle doporučení pro léčbu trombotických příhod u dětí platných na našem pracovišti (přílohy 1 a 2). Tato doporučení jsou založena na aktuálním konsensu ACCP a doporučeních ASH [11, 12]. Všichni pacienti byli léčeni LMWH, během hospitalizace podávaném většinou formou kontinuální infuze s následným přechodem na aplikace podkožními injekcemi.
Během léčby bylo nutné také laboratorní monitorování pacientů, zejména sledování krevního obrazu, koagulačních vyšetření (aktivovaný parciální trombinový čas (aPTT), protrombinový čas (PT), fibrinogen (Fbg), D-dimery (DD), antitrombin (AT), anti Xa (aXa)), renálních parametrů (urea, kreatitnin) a dalších vyšetření podle stavu jednotlivých pacientů.
Tab. 1. Typ příhody u dětí do jednoho roku věku podle lokalizace. 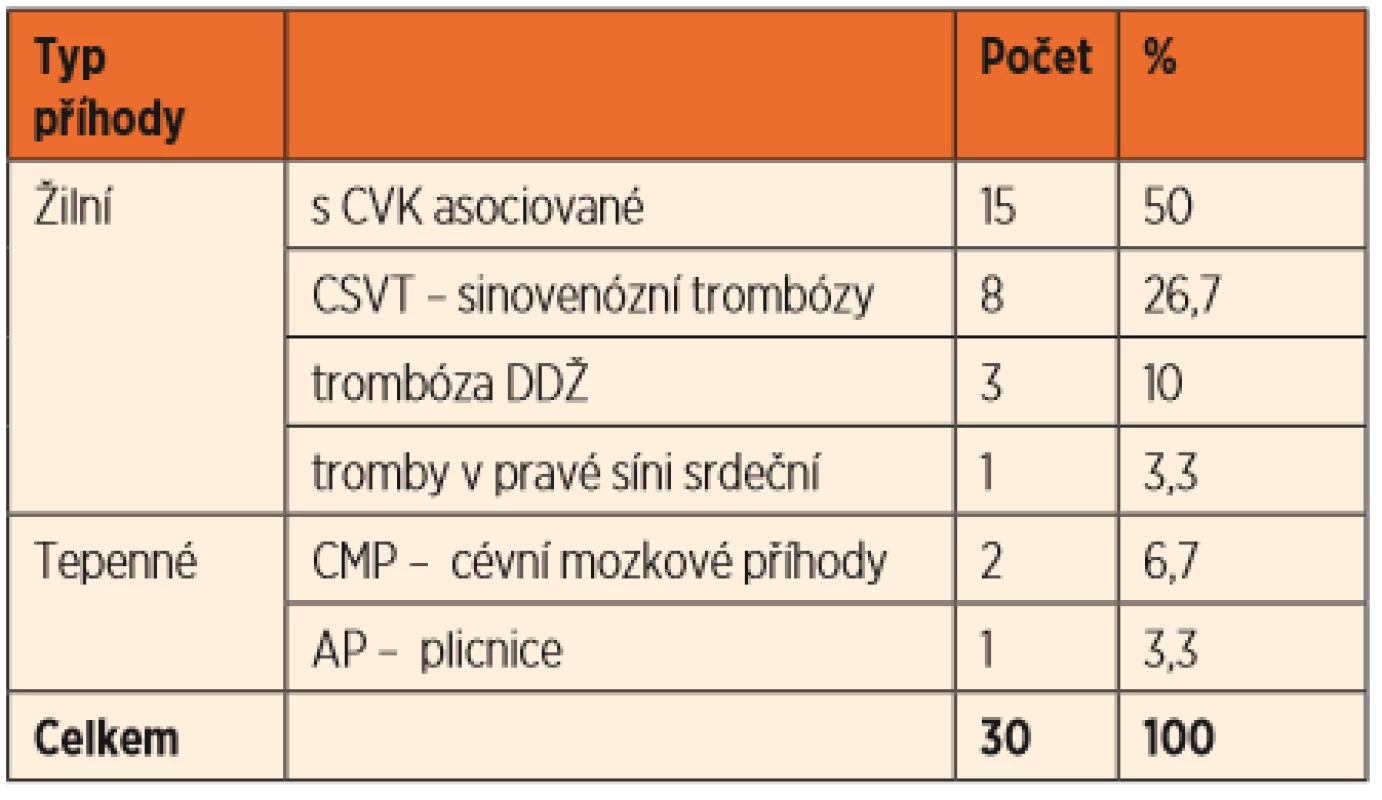
VÝSLEDKY
Ve sledovaném období let 2011–2018 jsme na našem pracovišti léčili celkem 412 trombotických příhod u dětí ve věku 0–18 let. Novorozenci a kojenci (věk při diagnóze 0–365 dní) tvořili z této kohorty pouze 7,3 % – celkem se jednalo o 30 dětí.
Převažovaly žilní trombotické příhody, které postihly 27 pacientů (90 %). Nejčastěji šlo o trombózy spojené se zavedením centrálního žilního katétru, zde u 15 pacientů (50 %). Dále se vyskytovaly mozkové sinovenózní trombózy u 8 pacientů, 3 trombózy dolní duté žíly a jeden trombus v pravé srdeční síni. Tepenné trombotické příhody jsme léčili u 3 pacientů, jednalo se o 2 cévní mozkové příhody a trombózu plicnice.
Základní diagnózy u našich pacientů byly rozmanité. Onkologičtí pacienti (9 dětí) jsou zastoupeni jak hematoonkologickými diagnózami (akutní lymfoblastová leukémie (ALL), akutní myeloidní leukémie (AML), histiocytóza z Langerhansových buněk (LCH)), tak i solidními tumory (neuroblastom, Wilmsův tumor, Ewingův sarkom, maligní rhabdoidní tumor). U šesti dětí byla trombotická příhoda spojena s infekcí nebo léčbou infekce. U čtyř pacientů byla základní diagnóza kardiologická a u dalších čtyř se jednalo o peripartální komplikace. Pouze u 4 dětí (13 %) nebyla žádná závažná choroba zjištěna a idiopatická trombotická příhoda tak byla jejich hlavní diagnózou.
Jak jsme již uvedli, všichni pacienti byli léčeni LMWH. Jednalo se o přípravky Fragmin, Clexane a Fraxiparine. Doba léčby se pohybovala ve značném časovém rozpětí 8–447 dní. Dva pacienti byli léčeni LMWH pouze 8 dní. U jednoho bylo důvodem velmi časného ukončení léčby úmrtí na infekční komplikace, u druhého byla léčba ukončena pro těžké progredující poškození mozku bez naděje na zlepšení. Jeden pacient s CMP byl po 11 dnech léčby LMWH převeden na antiagregační léčbu kyselinou acetylsalicylovou. Jeden pacient byl po čtyřech měsících léčby LMWH zařazen do studie s dabigatranem v orálním roztoku, ale nedosahoval potřebných hladin a po měsíci léčbu ve studii ukončil. Nejdelší doba podávání LMWH byla zaznamenána u tří pacientů s onkologickými diagnózami po s CVK asociovanými trombózami s dlouhodobě zavedenými žilními katétry (291, 328 resp. 447 dní). Pokud vyloučíme tyto extrémní případy, jedná se o 24 pacientů s typickou dobou léčby 6 týdnů až 3 měsíce, konkrétně 40–119 dní s mediánem 80 dní. Šestitýdenní doba léčby se týkala zejména dětí se sinovenózními trombózami, u kterých došlo po 6 týdnech léčby k plné regresi nálezu.
U většiny pacientů v souboru byl LMWH v úvodu léčby podáván formou kontinuální nitrožilní infuze, později pak v podkožních injekcích dvakrát nebo jednou denně. Podávání formou kontinuální infuze není, jak již bylo uvedeno, standardním způsobem aplikace LMWH při léčbě trombotických příhod a je vyhrazeno podle SPC pouze pro dialyzované pacienty. Na našem pracovišti má ale dlouhou tradici, publikovali jsme na toto téma vlastní práce [15, 16], které jsou citovány i v ACCP konsensu [11]. Jiné práce o kontinuálním podávání LMWH jsou poměrně vzácné [17] a netýkají se dětí. Podle našich znalostí se LMWH formou kontinuální infuze podává i na mnoha jiných pracovištích (osobní komunikace), byť to zatím nebylo doprovázeno publikacemi dohledatelnými v běžných evropských či amerických databázích. Tato práce tak je dalším přínosem v této oblasti.
Použití kontinuální infuze LMWH považujeme za vhodnou alternativu zejména pro pacienty s již existujícím žilním přístupem během hospitalizace, kdy zároveň probíhá jiná nitrožilní léčba. Tento způsob podávání může být výhodný například u trombotických příhod asociovaných s CVK. Díky možnosti kdykoli přerušit infuzi nebo modifikovat dávku je tato léčba výhodná také pro pacienty se současným rizikem krvácení nebo při náhlé potřebě provést operační výkon, poločas LMWH při i.v. podání je 1,5–4 hodiny, tedy významně kratší než po s.c. aplikaci [20–23]. Vyhneme se rovněž opakované potenciálně bolestivé podkožní aplikaci léku do podkoží, které u novorozenců a malých kojenců nemusí být plně vyvinuto. Detailní popis farmakokinetiky při i.v. podání LMWH je nad rámec tohoto sdělení, zmiňme jen, že podávaná denní dávka odpovídá dávce při s.c. aplikaci. Dosahované aX aktivity jsou obdobné jako při s.c. podání, je navíc dosaženo stabilní hladiny bez peaků a poklesů (vlastní nepublikovaná data farmakokinetické analýzy).
V úvodní fázi jsme LMWH podávali v terapeutických dávkách za pečlivé laboratorní monitorace s cílem dosažení anti-Xa 0,5–1 IU/ml. Dávky se v úvodních dvou až třech týdnech léčby pohybovaly v rozmezí 200–300 IU LMWH/kg a den. Následně byla dávka většinou snížena na 120–150 IU/kg a den pro následnou (profylaktickou) léčbu, podávanou jednou denně podkožní injekcí. Léčba kontinuální infuzí tedy respektuje stávající doporučené léčebné dávky a nevede k nutnosti jejich navyšování.
U žádného léčeného pacienta nedošlo k progresi trombotických změn. U 18 pacientů vedla léčba k plné rekanalizaci, resp. regresi trombózy. U 6 pacientů došlo k parciální regresi. Byli mezi nimi i 3 pacienti, u kterých byla léčba zahájena s časovým odstupem od vzniku trombózy. Šlo o chlapce po novorozenecké sepsi s nutností zavedení UVC postnatálně, u kterého byla po měsíci zjištěna na CT angiografii kavernózní přeměna porty s přetrvávajícím trombotickým uzávěrem levé větve porty, chlapce s metastatickým neuroblastomem a útlakem vzniklou trombózou DDŽ, kde byla antikoagulace zahájena 33 dní od zjištění trombózy kvůli opakovaným chirurgickým zákrokům, a dívku po traumatickém porodu s CNS krvácením a trombózou splavů, u které bylo zahájení antikoagulační léčby odloženo o 2 týdny od diagnózy právě kvůli krvácení. U šesti pacientů jsme hodnotili léčbu jako neúčinnou, kontrolní zobrazovací vyšetření prokazovala stacionární rozsah trombů s fibrotizací a již vytvořeným kolaterálním oběhem. Zde jsou zařazeni také dva výše uvedení pacienti s krátkou dobou léčby. Celkem byla tedy léčba úspěšná v 80 % případů (tab. 2).
Tab. 2. Hodnocení efektu antikoagulační léčby. 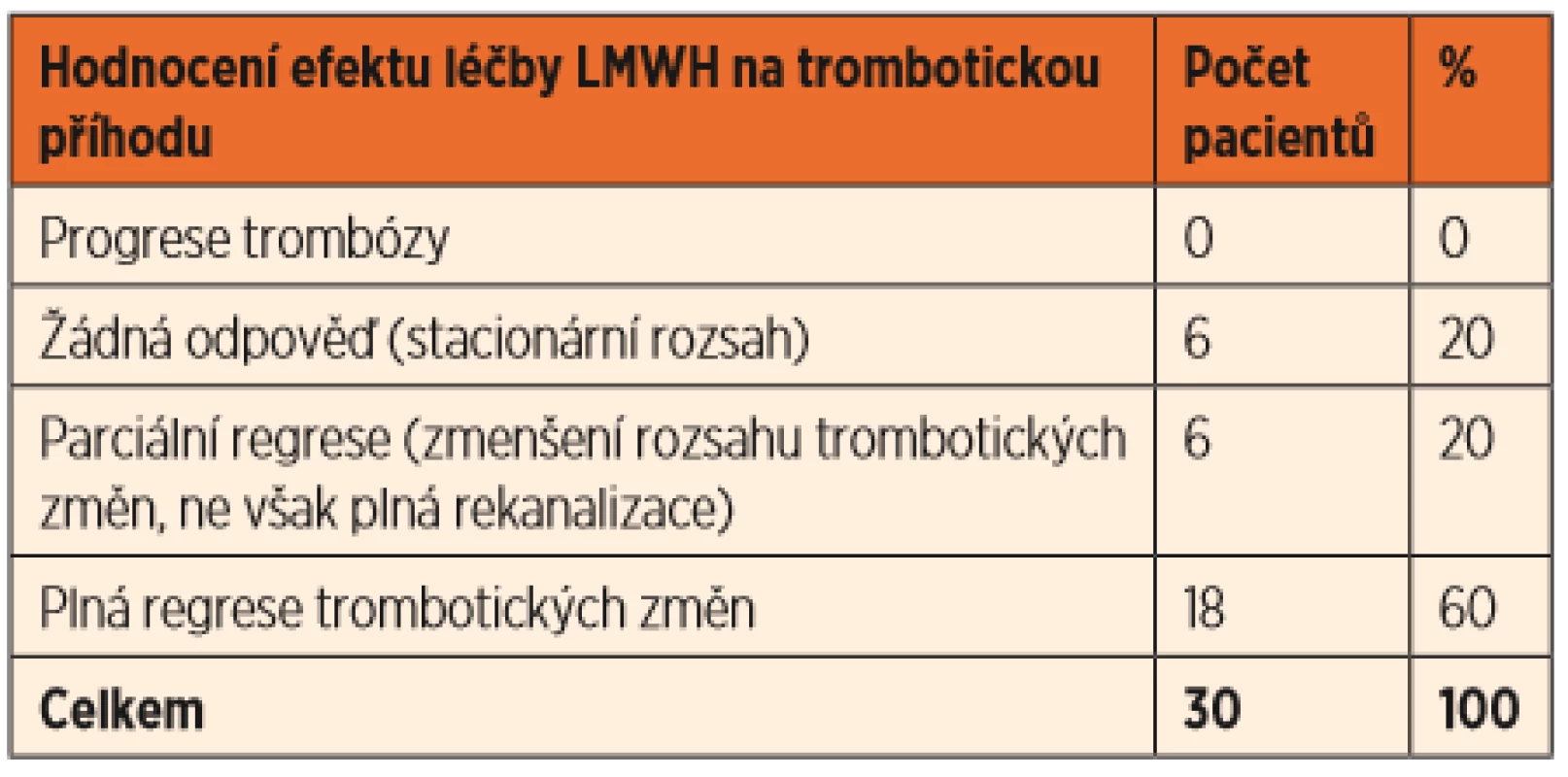
Graf 1. Počet pacientů v jednotlivých věkových skupinách při vzniku trombotické příhody ve studovaném souboru. 
Komplikace léčby jsme zaznamenali pouze u jednoho pacienta, u něhož došlo k mikroskopické hematurii. Jednalo se však o dítě s Wilmsovým tumorem ledviny. U této diagnózy bývá nález mikroskopické hematurie typicky přítomen i bez antikoagulační léčby. Žádné jiné krvácivé stavy jsme nezaznamenali, což mimo jiné svědčí u našich pacientů pro dobrou bezpečnost léčby kontinuální infuzí, která místo peaků a poklesů udržuje stabilní hladiny antiXa. Dále se vyskytovaly drobné lokální potíže při podkožních aplikacích, zejména hematomy a podkožní indurace. Celkově však byla léčba, a to i dlouhodobá, pacienty i rodiči dobře tolerovaná.
U pacientů s trombotickou příhodou se doporučuje pátrat také po vrozených trombofilních stavech. V našem souboru byla vyšetřena jen polovina pacientů. V době diagnózy a léčby byla u těchto malých pacientů upřednostněna nezbytná laboratorní vyšetření nutná pro monitoraci stavu a vedení léčby před extenzivním vyšetřením trombofilních rizik.
Výsledky dostupných trombofilních vyšetření jsou následující: u jednoho pacienta byl prokázán deficit antitrombinu (vstupně minimum 36 %, při kontrolních vyšetřeních ve starším věku hladina 49–60 % při normě 80–140 %), k trombóze splavů došlo po traumatickém porodu bez dalších rizikových faktorů. U tří pacientů byla prokázána Leidenská mutace FV v heterozygotní formě (3/15, tedy 20 %), všichni ale měli s CVK asociovanou trombotickou příhodu. Ostatní vyšetření byli bez nálezu Leidenské mutace FV, mutace G20210A v genu pro protrombin, deficitu AT, deficitu proteinu C (PC) či proteinu S (PS). S ohledem na malý počet vyšetřených nelze tyto výsledky generalizovat. Ukazují sice na možnou spojitost vyššího výskytu vrozených trombofilních stavů u kojenců a novorozenců s TEN, nemyslíme si však, že by to mělo změnit stávající doporučení, kdy trombofilní rizika vyšetřovat [18, 19].
DISKUSE
Zjištěné skutečnosti u pacientů v našem souboru odpovídají údajům z literatury. Věkové rozvrstvení ukazuje dvouvrcholovou křivku s prvním maximem výskytu trombotických příhod právě u dětí do 1 roku věku. Druhý peak je pak v období dospívání.
Nejčastějším rizikovým faktorem tromboembolického onemocnění u dětí do 15 let je zavedení centrálního žilního katétru, což se týká i novorozenců a kojenců. Ve studovaném souboru se jednalo o 50 % případů, tedy o něco méně, než se uvádí v literatuře. Šlo o děti s jinou primární diagnózou, jako jsou malignity, závažné infekční komplikace nebo těžká nedonošenost. Trombotická příhoda zde byla pouze jednou z diagnóz a komplikací léčby primárního onemocnění. Tato skutečnost také často modifikuje strategii antikoagulační léčby. V těchto případech není vždy možné podávat plné terapeutické dávky LMWH pro zvýšené riziko krvácení (současná chirurgická léčba, trombocytopenie, koagulopatie či jiné komplikující stavy).
Z dalších trombotických příhod se ve studovaném souboru vyskytují zejména sinovenózní trombózy ve spojení s porodním traumatem nebo infekcí. Tyto trombózy, pokud jsou včas léčeny, mají dobrou šanci na plnou regresi stavu a léčba po dobu 6 týdnů byla u našich pacientů většinou dostačující. Poměrně vzácně se naopak vyskytují idiopatické trombotické příhody u jinak zdravých dětí. To potvrzujeme i v našem souboru (pouze 4 z 30 pacientů – 13 %).
Jedná-li se o podávání LMWH, můžeme konstatovat, že léčba LMWH byla u našich pacientů dobře tolerovaná, měla minimum krvácivých komplikací, a pokud byla zahájena včas, vedla ve většině případů k plné regresi trombózy. Důvody k podávání LMWH formou kontinuální infuze jsou zmíněny výše. Jak už bylo řečeno, nemáme za cíl vytvořit doporučení, ale sdílet zkušenosti a rozmnožit tak publikovaná data o této léčebné modalitě. Léčba kontinuální infuzí je v našich rukou vždy vyhrazena pro již hospitalizované pacienty se zavedeným i.v. přístupem. Sama o sobě pochopitelně nikdy nebyla a neměla by být důvodem k přijetí do nemocnice a/nebo k zavádění CVK. Pro následnou ambulantní léčbu podávanou podkožními injekcemi je nezbytná detailní edukace rodičů k podávání velmi malých dávek LMWH. Zde vidíme zásadní roli erudované zdravotní sestry. Na našem pracovišti pak patří poděkování zejména sestrám novorozenecké JIP 56 Pediatrické kliniky, Kliniky dětské onkologie a Oddělení dětské hematologie FN Brno. Doporučovaná doba léčby 3 měsíce (v některých případech SVT jen 6 týdnů) byla ve většině případů dostačující. Při trvání rizikových faktorů může být třeba podávat profylaxi i déle. Léčba LMWH by u dětských pacientů měla být monitorována pomocí anti-Xa. Je to o to důležitější, používáme-li léčbu kontinuální infuzí, která je t.č. „off-label“.
V současnosti není pro děti k dispozici adekvátní perorální alternativa k LMWH. Využití NOAK je v této věkové kategorii prozatím omezeno pouze na klinické studie. V jejich rámci je v současnosti na vybraných pracovištích, včetně našeho, k dispozici dabigatran a edoxaban ve formě roztoku použitelného i pro nejmenší děti (od 0 resp. od 6 měsíců věku, ne však pro nedonošené). Příchod NOAK do pediatrické klinické praxe lze očekávat v průběhu několika let. Oba zmiňované přípravky se však standardně podávají až po úvodní 7–21denní léčbě LMWH. LMWH tak je a nadále bude lékem první volby pro léčbu trombotické příhody u malých dětí.
V akutní fázi léčby trombotické příhody u novorozenců a kojenců nehraje vyšetření vrozených trombofilních stavů zásadnější roli a nemění léčebný postup, s výjimkou deficitu AT či PC, kdy by v některých případech byla možná cílená substituce. V pozdějším věku by však mělo být toto vyšetření vždy doplněno. Pokud je nalezen vrozený trombofilní stav, je vhodné provést i rodinnou studii u rodičů a sourozenců [18, 19].
ZÁVĚR
Trombotické příhody se u novorozenců a kojenců vyskytují jen vzácně, většinou jsou spojeny se zavedením CVK nebo jde o sinovenózní trombózy. Diagnostika vyžaduje zkušené zázemí laboratoří a pracoviště zobrazovacích metod. Léčba těchto onemocnění patří do rukou dětského hematologa na adekvátně vybaveném pracovišti. Lékem volby jsou v současnosti LMWH. Dobře vedená léčba vede společně s léčbou obvykle přítomného základního onemocnění k vysoké šanci na kompletní regresi trombózy. Stávající léčba v principu vychází zejména z doporučení pediatrické části ACCP konsensu, případně doporučení ASH. Je vhodné, aby každé pracoviště mělo pro léčbu dětských TEN příhod vytvořen vlastní standardní postup. V přílohách 1 a 2 jsou jako příklad uvedena doporučení ODH FN Brno.
Došlo: 9. 7. 2019
Přijato: 16. 10. 2019
MUDr. Ondřej Zapletal, Ph.D.
Oddělení dětské hematologie
Fakultní nemocnice Brno
Černopolní 9
613 00 Brno
e-mail: zapletal.ondrej@fnbrno.cz
Zdroje
1. Andrew M, Monagle P, Brooker I. Thromboembolic Complications during Infancy and Childhood. Canada, Ontario: B. C. Decker, Hamilton, 2000.
2. Andrew M, David M, Adams M, et al. Venous thromboembolic complications (VTE) in children: first analyses of the Canadian registry of VTE. Blood 1994; 83 (5): 1251–1257.
3. Monagle M, Adams M, Mahoney M, et al. Outcome of pediatric thromboembolic disease: a report from the Canadian childhood thrombophilia registry. Pediatr Res 2000; 47 (6): 763–766.
4. Silverstein M, Heit J, Mohr D, et al. Trends in the incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study. Arch Intern Med 1998; 158 (6): 585–593.
5. Raffini L, Huang YS, Witmer C, et al. Dramatic increase in venous thromboembolism in children‘s hospitals in the United States from 2001 to 2007. Pediatrics 2009 Oct; 124 (4): 1001–1008.
6. Kenet G, Lütkhoff LK, Albisetti M, et al. Impact of thrombophilia on risk of arterial ischemic stroke or cerebral sinovenous thrombosis in neonates and children: a systematic review and meta-analysis of observational studies. Circulation 2010 Apr 27;121 (16): 1838–1847.
7. Male C, Chait P, Andrew M, et al. PARKAA Investigators. Central venous line-related thrombosis in children: association with central venous line location and insertion technique. Blood 2003 Jun 1;101 (11): 4273–4278.
8. Male C, Chait P, Ginsberg JS, et al. Comparison of venography and ultrasound for the diagnosis of asymptomatic deep vein thrombosis in the upper body in children: results of the PARKAA study: Prophylactic Antithrombin Replacement in Kids with ALL treated with Asparaginase. Thromb Haemost 2002 Apr; 87 (4): 593–598.
9. Zapletal O, Fiamoli V, Blatný J, et al. Rizikové faktory pro vznik tromboembolické nemoci u dospívajících v jihomoravském kraji v letech 2004–2010. Čes-slov Pediat 2012; 67 (2): 89–94.
10. Malý J, Kessler P, Gumulec J, et al. Trendy v profylaxi žilní tromboembolické nemoci. Praha, Mladá fronta a.s.:2010. ISBN 978-80-204-2021-3.
11. Monagle P, Chan AKC, Goldenberg NA, et al. Antithrombotic therapy in neonates and children: Antithrombotic therapy and prevention of thrombosis, 9th ed: American college of chest physicians evidence-based clinical practice guidelines. Chest 2012 Feb; 141 (Suppl 2): 737–801.
12. Monagle P, Cuello CA, Augustine C, et al. American Society of Hematology 2018 Guidelines for Management of Venous Thromboembolism: treatment of pediatric venous thromboembolism. Blood Adv 2018; 2 : 3292–3316.
13. Will A. Neonatal haemostasis and the management of neonatal thrombosis. Br J Haematol 2015; 169 : 324–332.
14. Romantsik O, Bruschettini M, Zappettini S, et al. Heparin for the treatment of thrombosis in neonates. Cochrane Database Syst Rev 2016 Nov 7; 11.
15. Fiamoli V, Blatny J, Zapletal O, et al. Treatment of deep vein thrombosis with continuous IV infusion of LMWH: a retrospective study in 32 children. Thrombosis 2011; 981497.
16. Blatný J, Fiamoli V. Treatment of deep vein thrombosis with continuous intravenous infusion of LMWH in children – an alternative to subcutaneous application when needed. Vnitr Lek 2009; 55 (3): 227–232.
17. Vahtera A, Valkonen M, Huhtala H, et al. Plasma anti-FXa concentration after continuous intravenous infusion and subcutaneous dosing of enoxaparin for thromboprophylaxis in critically ill patients. A randomized clinical trial. Thromb Res 2017 Oct; 158 : 71–75.
18. Blatný J. Kdy vyšetřovat vrozená trombofilní rizika u dětí? Čes-slov Pediat 2012; 67 (1): 60–63.
19. Kvasnička J. Molekulárně genetická vyšetření u trombofilních stavů spojených s žilním tromboembolismem a jeho komplikacemi – konsensus České společnosti pro trombózu a hemostázu ČLS JEP, Společnosti pro lékařskou genetiku ČLS JEP a České hematologické společnosti ČL JEP. https://www.slg.cz/stitky/trombofilie.
20. Lockner D, Bratt G, Törnebohm E, et al. Intravenous and subcutaneous administration of Fragmin in deep venous thrombosis. Haemostasis 1986; 16 (Suppl 2): 25–29.
21. Lockner D, Bratt G, Törnebohm E, Aberg W. Pharmacokinetics of intravenously and subcutaneously administered Fragmin in healthy volunteers. Haemostasis 1986;16 (Suppl 2): 8–10.
22. Boneu B, Caranobe C, Sie P. Pharmacokinetics of heparin and low molecular weight heparin. Review. Baillieres Clin Haematol 1990 Jul; 3 (3): 531–544.
23. Fossler MJ, Barrett JS, Hainer JW, et al. Pharmacodynamics of intravenous and subcutaneous tinzaparin and heparin in healthy volunteers. Am J Health Syst Pharm 2001 Sep 1; 58 (17): 1614–1621.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2020 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Hyponatriémia – vzácna komplikácia nefrotického syndrómu
- Úspěšná sklerotizace cyst štítné žlázy alkoholem pod ultrasonografickou kontrolou u adolescentů
- Moje úsmevné spomienky na Olomouc
- Editorial: Když si děti hrají, někdy z toho problém mají
- Cizí tělesa v polykacích cestách u dětí
- Pevné exogénne cudzie telesá v dolných dýchacích cestách u detí
- Aspirovaná cizí tělesa u dětí – kazuistiky
- Hračka – bezpečný předmět na dětských odděleních?
- Stravovací a pohybové zvyklosti v rodině – ověření reliability dotazníku
- Léčba trombotických příhod u novorozenců a kojenců
- Stanovenie hladín sukcinylacetónu u časti zdravej detskej populácie na Slovensku
- Opakovaná spontánní remise atypického hemolyticko-uremického syndromu vyvolaného chřipkou – kazuistika
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Cizí tělesa v polykacích cestách u dětí
- Úspěšná sklerotizace cyst štítné žlázy alkoholem pod ultrasonografickou kontrolou u adolescentů
- Léčba trombotických příhod u novorozenců a kojenců
- Aspirovaná cizí tělesa u dětí – kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





