-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVplyv dlhodobej kortikoterapie na kostné zdravie u detí s idiopatickým nefrotickým syndrómom
The impact of long-term corticotherapy on bone health in children with idiopathic nephrotic syndrome
Objective: The aim of the study was to assess the impact of prolonged corticotherapy on growth, bone metabolism and bone mineral density (BMD) parameters in children with idiopathic nephrotic syndrome (INS).
Methods: 39 patients with INS (24 boys, mean age 11.09±4.29 years) and 40 healthy controls of comparable age and gender were enrolled in the study. In the INS group, the mean daily dose of prednisone was 0.70±0.24 mg/kg/day (mean cumulative corticosteroid dose 367.13±268.45 mg/kg, mean duration of corticosteroid treatment was 551.15±343.10 days). The effect of corticotherapy on bone health was assessed by 1) anthropometric measurements 2) bone metabolism testing, taking into account laboratory deviations specific to INS 3) DXA (dual-energy X-ray absorptiometry).
Results: Compared with the control group of healthy children, we observed a significantly lower Z-score of body height (-0.81±1.34 vs 0.32±0.87; p<0.001) in the INS group, which correlated negatively with the cumulative dose of corticoids (p=0.03) and the length of corticotherapy (p=0.025). Patients taking prednisone at the time of measurement had a more pronounced decrease in body height Z-score compared to patients without steroids (-1.26±1.34 vs -0.33±1.2; p=0.002). BMD Z-scores in L1-L4 and TBLH (total body less head) in the INS group were also significantly lower compared to the control group (-0.29±1.30 vs 0.70±1.10; p˂0.001, 0.10±1.15 vs 0.99±1.10; p=0.001). In patients receiving corticoids, we found a statistically significant decrease in BMD Z-score of L1-L4 and TBLH compared with patients free of steroids (L1-L4: p=0.001; TBLH: p=0.003). BMD Z-score significantly correlated with the cumulative corticosteroid dose (L1-L4: p˂0.001, TBLH: p=0.002) and correlated with the length of corticotherapy (L1-L4: p=0.006; TBLH: p=0.043). We did not confirm statistically significant differences in serum concentrations of 25-OH-D, ALP, iPTH, calcium and phosphorus depending on the cumulative corticosteroid dose or the duration of corticosteroid therapy.
Conlusion: Linear growth and BMD Z-scores in the L1-L4 and TBLH regions are during long-term corticosteroid treatment in the comparison to the healthy control group significantly reduced and negatively correlate with the cumulative corticosteroid dose and the length of corticotherapy. The role of a first contact pediatrician (during the long-term corticotherapy) is to monitor the clinical and laboratory indicators (in cooperation with a specialist) of corticoid-induced bone damage and to monitor the effectiveness of preventive regimens.
Keywords:
idiopathic nephrotic syndrome – linear growth – DXA – aBMD
Autoři: K. Kubejová 1; L. Turoňová 2; V. Vargová 1; M. Čaprnda 3; G. Koľvek 1; Ľ. Podracká 4
Působiště autorů: Klinika detí a dorastu LF UPJŠ a DFN Košice, Slovensko 1; Klinika detí a dorastu JLF UK a UNM, Martin, Slovensko 2; 1. interná klinika LFUK a UNB, Bratislava, Slovensko 3; Detská klinika (DK) LF UK a NÚDCH, Bratislava, Slovensko 4
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (4): 224-232.
Kategorie: Původní práce
Souhrn
Cieľ štúdie: Posúdiť vplyv dlhodobej kortikoterapie na rast, parametre kostného metabolizmu a kostnú minerálovú denzitu (BMD) u detí s idiopatickým nefrotickým syndrómom (INS).
Materiál a metódy: Do štúdie sme zaradili 39 pacientov s INS (24 chlapcov/15 dievčat, priemerný vek v čase denzitometrického vyšetrenia 11,09 ± 4,29 roka) a 40 zdravých kontrol zodpovedajúceho veku a pohlavia. V skupine pacientov s INS sa priemerná denná dávka prednizónu pohybovala na úrovni 0,70 ± 0,24 mg/kg/deň (priemerná kumulatívna dávka kortikoidov 367,13 ± 268,45 mg/kg, priemerná doba kortikoterapie 551,15 ± 343,10 dní). Účinok kortikoterapie na kostné zdravie sme hodnotili pomocou 1) antropometrických meraní, 2) vyšetrenia vybraných parametrov kostného metabolizmu a hormonálneho profilu, s prihliadnutím na laboratórne odchýlky špecifické pre INS a 3) DXA (dvojenergetická röntgenová absorbciometria).
Výsledky: V porovnaní s kontrolnou skupinou zdravých detí sme v skupine pacientov s INS zaznamenali signifikantne nižšiu hodnotu Z-skóre telesnej výšky (-0,81 ± 1,34 vs. 0,32 ± 0,87; p –0,001), ktorá štatisticky signifikantne negatívne korelovala s výškou kumulatívnej dávky kortikosteroidov (p = 0,03) a dobou kortikoterapie (p = 0,025). U pacientov, ktorí v čase realizácie DXA scanu užívali prednizón, sme v porovnaní s pacientmi bez kortikosteroidnej liečby v čase merania, zaznamenali štatisticky významnejší pokles Z-skóre telesnej výšky (-1,26 ± 1,34 vs. -0,33 ± 1,2; p = 0,002). Hodnota BMD Z-skóre v meraných oblastiach L1-L4 a TBLH (total body less head) bola v skupine chorých s INS v porovnaní s kontrolnou skupinou rovnako signifikantne nižšia (-0,29 ± 1,30 vs. 0,70 ± 1,10; p –0,001; 0,10 ± 1,15 vs. 0,99 ± 1,10; p = 0,001). U pacientov liečených v čase realizácie DXA glukokortikoidmi sme taktiež pozorovali štatisticky významnejší pokles BMD Z-skóre v porovnaní s pacientmi bez kortikosteroidnej liečby v čase DXA merania (L1-L4: p = 0,001; TBLH: p = 0,003). Hodnota BMD Z-skóre štatisticky signifikantne negatívne korelovala s výškou kumulatívnej dávky kortikoidov (L1-L4: p –0,001; TBLH: p = 0,002) a s dobou kortikoterapie (L1-L4: p = 0,006; TBLH: p = 0,043). Štatisticky významné rozdiely sérových koncentrácií 25(OH)D, ALP, iPTH, vápnika a fosforu v závislosti od kumulatívnej dávky kortikoidov alebo doby trvania kortikoterapie, sme v našom súbore nepotvrdili.
Záver: Lineárny rast a hodnota BMD Z-skóre v oblastiach L1-L4 a TBLH sú v období užívania dlhodobej kortikoterapie signifikantne nižšie v porovnaní so zdravou kontrolou a negatívne korelujú s výškou kumulatívnej dávky kortikoidov ako aj s dobou trvania kortikosteroidnej liečby. Úlohou pediatra primárneho kontaktu je v spolupráci so špecialistom počas dlhodobej kortikoterapie klinické a laboratórne ukazovatele kortikoidmi indukovaného poškodenia kostí monitorovať a sledovať tiež účinnosť preventívnych režimových opatrení.
Klíčová slova:
idiopatický nefrotický syndróm – rast – DXA – aBMD
ÚVOD
Nefrotický syndróm, na rozdiel od iných chorôb liečených glukokortikoidmi (GK), nesprevádza systémová zápalová odpoveď [1]. Považujeme ho preto za ochorenie ideálne na štúdium vplyvu dlhodobej liečby GK na detský skelet. Liečba idiopatického nefrotického syndrómu (INS) vysokými dávkami GK (prednizón 2 mg/kg resp. 60 mg/m2/deň) je u väčšiny detských pacientov účinná a do 4 týždňov sa zvyčajne dosiahne remisia. Žiaľ, pri znižovaní dávky, resp. po ukončení glukokortikoidnej liečby, môže dôjsť k relapsu, ktorý vyžaduje opakované a dlhodobé podávanie kortikoidov, čo je spojené so znížením kostnej formácie, poruchou lineárneho rastu a zvýšenou incidenciou fraktúr [2].
Glukokortikoidy viacerými patomechanizmami narúšajú optimálnu rovnováhu medzi tvorbou a odbúravaním kostného tkaniva. Na jednej strane inhibujú osteoblastami mediovanú kostnú formáciu, na strane druhej podporujú osteoklastami sprostredkovanú kostnú resorpciu. Okrem toho vstupujú do kalcium-fosfátového metabolizmu. Znižujú absorpciu vápnika v čreve (nepriamo antagonizovaním účinku vitamínu D a priamo znížením expresie vápnikových kanálov v duodene) a potencujú kalciúriu. Následná hypokalciémia vedie k sekundárnej hyperparatyreóze. V neposlednom rade, na viacerých úrovniach tlmia hypotalamo-hypofýzo-gonádovú os, čím potláčajú tvorbu pohlavných hormónov, ktoré majú osteoanabolické a antiresorpčné účinky. Pre úplnosť treba uviesť, že riziko vzniku zlomenín indukovaných glukokortikoidnou liečbou u detí zvyšuje aj kortikoidmi indukovaná myopatia [3]. Je nutné zdôrazniť, že kým útlm kostnej formácie pretrváva počas celej doby užívania GK, urýchlená kostná resorpcia je len prechodná a pozorovaná maximálne v priebehu prvých 6‒12 mesiacov trvania kortikoterapie [4].
Úbytok kostnej hmoty indukovaný GK má teda dvojfázový priebeh. V úvodnej, tzv. „rýchlej“ fáze (počas prvých mesiacov liečby) sa úbytok kostnej hmoty odhaduje až na 10‒15 %. Druhá fáza je pomalšia, s ročným úbytkom cca 2‒5 % [5]. Z klinického hľadiska je alarmujúce, že osteoporóza dospelých vzniká už pri nízkych dávkach GK (t.j 2,5‒7,5 mg prednizónu/deň) podávaných po dobu 1‒3 mesiacov [6]. U detí však nie je známe, aká minimálna dávka GK môže viesť k strate kostnej hmoty. Predpokladá sa, že okrem dávky sú v detskom veku rozhodujúcimi faktormi i doba liečby, genetická predispozícia, pridružené komorbidity (napr. porucha výživy, dlhodobá imobilizácia) a tiež vek, v ktorom bola kortikoterapia indikovaná/ukončená.
Viaceré štúdie detí s INS dokumentujú pokles BMD (kostná minerálová denzita) v priebehu prvých 2‒3 mesiacov kortikoidnej liečby [2, 7]. Štúdia indických autorov u prepubertálnych detí s novodiagnostikovaným INS potvrdzuje, že po 12 týždňoch kortikoterapie, BMC (obsah kostného minerálu) v oblasti lumbálnej chrbtice klesá až o 8,9 % [2]. Podobné závery deklaruje štúdia amerických autorov [5]. Autori uvádzajú, že deti s INS, opakovane liečené vysokodávkovanou kortikosteroidnou liečbou (opakované relapsy, steroid-dependentný a steroid-rezistentný nefrotický syndróm), mali signifikantne nižšie hodnoty aBMD (areálna BMD) v porovnaní s deťmi, ktoré užívali nižšie dávky kortikoidov (BMD Z-skóre ˂ -1,65 ± 1,35 vs. -1,08 ± 1,0; p = 0,01). Medzi prediktívne faktory zníženia BMD patrili vyšší vek v čase manifestácie ochorenia, vyššia kumulatívna dávka GK a znížený denný príjem vápnika [5].
S ohľadom na vyššie uvedené skutočnosti bolo cieľom našej štúdie posúdiť vplyv dlhodobej kortikoterapie na rast, kostný metabolizmus a kostnú minerálovú denzitu u detí s idiopatickým nefrotickým syndrómom.
MATERIÁL A METÓDY
Do prierezovej štúdie, trvajúcej 24 mesiacov (január 2014 ‒ január 2016) sme zaradili 39 pacientov, z toho 24 chlapcov (61,54 %), 15 dievčat (38,46 %) s idiopatickým nefrotickým syndrómom, vo veku 5‒17 rokov (priemerný vek v čase denzitometrického vyšetrenia 11,09 ± 4,29 roka, trvanie choroby do obdobia realizácie DXA (dvojenergiová röntgenová absorbciometria) scanu 6,14 ± 4,40 roka. V kontrolnej skupine detí bez chronického ochorenia a liečby ovplyvňujúcej kostný metabolizmus (n = 40) bolo zastúpenie oboch pohlaví porovnateľné, t.j. 24 (60 %) chlapcov, 16 (40 %) dievčat, priemerný vek v čase realizácie DXA scanu predstavoval 10,08 ± 3,55 roka.
Všetky deti sme vyšetrovali na Klinike detí a dorastu LF UPJŠ a DFN Košice. Zaradení pacienti boli kaukazskej etnickej skupiny a mali glomerulovú filtráciu kalkulovanú podľa Schwartzovho vzorca ˃90 ml/min/1,73 m2. Vplyv dlhodobej kortikoterapie na kostné zdravie sme hodnotili pomocou 1) antropometrických meraní, 2) vyšetrenia vybraných parametrov kostného metabolizmu a hormonálneho profilu, s prihliadnutím na laboratórne odchýlky špecifické pre INS, 3) denzitometrického vyšetrenia, ktoré sa napriek opodstatneným výhradám stále považuje za zlatý štandard diagnostiky zníženia BMD.
Vstupným kritériom pre zaradenie do súboru bola predchádzajúca liečba prednizónom v dávke >5 mg/deň minimálne počas 3 mesiacov. Takto definovaná liečba je považovaná za „prahovú“ pre vznik kortikoidmi indukovanej osteoporózy u dospelých a vytvára predpoklad pre hodnotenia dlhodobého účinku kortikoidov na kostný metabolizmus, rast a kostnú minerálovú denzitu aj u detí. U všetkých pacientov prezentujeme kumulatívnu dávku kortikoidov, pričom intravenózne bolusy metylprednizolónu sme prepočítavali na ekvivalent prednizónu. Antropometrické merania a laboratórne vyšetrenia sme vykonali v čase realizácie DXA scanov. Súborne sme u všetkých zaradených detí zaznamenávali vek, pohlavie, výšku, hmotnosť a BMI (body mass index). Výstupy z antropometrických meraní sme hodnotili špecificky pre vek a pohlavie (Z-skóre). U pacientov s poruchou rastu definovanou poklesom Z-skóre telesnej výšky pod -2 SD, sme vyhodnocovali kostný vek z RTG snímky ľavej ruky a zápästia, metódou Tanner-Whitehouse 2 (Tanner-Whitehouse 2, 1950‒1960). U každého dieťaťa sme ohodnotili štádium puberty, Tanner staging 1‒5 (Tanner, 1962).
Vyšetrili sme základné ukazovatele kostného metabolizmu (sérová koncentrácia vápnika a fosforu, ALP a kalcium/kreatinínový index v moči), iPTH a 25(OH)D. U pacientov s hypoalbuminémiou sme sérovú koncentráciu vápnika korigovali k albumínu Cakorig.= Cacelkový + 0,02 x (41,3-albumín) [8]. DXA scany v oblasti lumbálnej chrbtice (L1‒L4) a celotelový scan (TBLH ‒ total body less head) sme realizovali za použitia prístroja LUNAR Prodigy č. 350322QA. DXA merania sme uskutočnili za použitia štandardných techník polohovania. Z AP (anteroposteriórny) DXA scanov sme automaticky získali dvojdimenzionálne hodnoty aBMD (areálna BMD), AP BMC a BMD Z-skóre. U pacientov s poruchou rastu sme hodnoty BMD v oblasti chrbtice a TBLH korigovali k výške (height Z-score) [1, 9]. Pred zaradením do štúdie sme účasť všetkých pacientov ošetrili písomným informovaným súhlasom získaným od rodičov alebo od legitímnych zákonných zástupcov.
Štatistická analýza
Numerické výsledky prezentujeme ako priemer ± smerodajná odchýlka (SD) a nominálne dáta priamo číselným a percentuálnym vyjadrením. Štatistickú analýzu sme realizovali štatistickým programom SPSS (verzia 14.0, SPSS Inc. Chicago, IL 60606-6412, USA). Na overenie rozdielov dát medzi skupinami sme použili dvojcestný nepárový Studentov t-test, jednocestný ANOVA test s post-hoc Bonferroniho analýzou a chí-kvadrátový test. Na posúdenie asociácie dvoch parametrických premenných sme použili Pearsonovu korelačnú analýzu. Za signifikantnú hladinu významnosti sme považovali p ˂0,05, resp. po post-hoc Bonferroniho korekcii, ktorá reflektuje veľmi vysokú štatistickú významnosť a definitívne vylučuje náhodný proces, p ≤0,005.
VÝSLEDKY
Základná charakteristika súboru.
V skupine pacientov s INS sme vyšetrili celkom 39 detí. Podľa priebehu puberty sme pacientov rozdelili do 3 skupín: Tanner 1 (prepubertálny vek) 12 (30,77 %), Tanner 2‒3 (stredná puberta) 15 (38,46 %) a Tanner 4‒5 (rozvinutá puberta) 12 (30,77 %). Renálna biopsia bola realizovaná u 31 (79,49 %) pacientov {minimálne zmeny glomerulov (MCD) 27/31 (87,10 %), fokálna segmentálna glomeruloskleróza (FSGS) 4/31(12,90 %)}. Z hľadiska účinnosti kortikoterapie steroid-senzitívny nefrotický syndróm (SSNS) malo 18 (46,15 %) pacientov, steroid-dependentný nefrotický syndróm (SDNS) 11 (28,21 %) a steroid-rezistentný nefrotický syndróm (SRNS) 10 (25,64 %) pacientov. Priemerný počet relapsov u jedného pacienta bol 3,82 ± 2,87 (rozpätie 0‒10). Nefrotická proteinúria pretrvávala v čase realizácie DXA scanov a laboratórnych vyšetrení u 6 (15,38 %) pacientov, priemerná koncentrácia albumínu u pacientov s nefrotickou proteinúriou bola 20,39 ± 1,71 g/L.
Priemerná denná dávka prednizónu bola 0,70 ± 0,24 mg/kg/deň (priemerná kumulatívna dávka 367,13 ± 268,45 mg/kg, priemerná doba kortikoterapie 551,15 ± 343,10 dní). V čase realizácie DXA scanu užívalo prednizón 20 pacientov (51,28 %), suplementáciu vápnika a vitamínu D malo18 (46,15 %) pacientov (vápnik 500‒1200 mg/deň a vitamín D3 400‒800 IU/deň). Cyklosporín A bol počas trvania INS ordinovaný u 24 (61,54 %) pacientov, v dávke 4‒6 mg/kg (dĺžka terapie 12‒24 mesiacov). V kontrolnej skupine (n = 40) bolo zastúpenie oboch pohlaví porovnateľné. V prepubertálnom veku sme vyšetrili 19 (47,5 %) detí, v období strednej puberty 15 (37,5 %) a v štádiu rozvinutej puberty 6 (15 %) detí. Vybrané charakteristiky vyšetrovaného súboru uvádzame v tabuľke 1.
Tab. 1. Vybrané charakteristiky vyšetrovaného súboru. 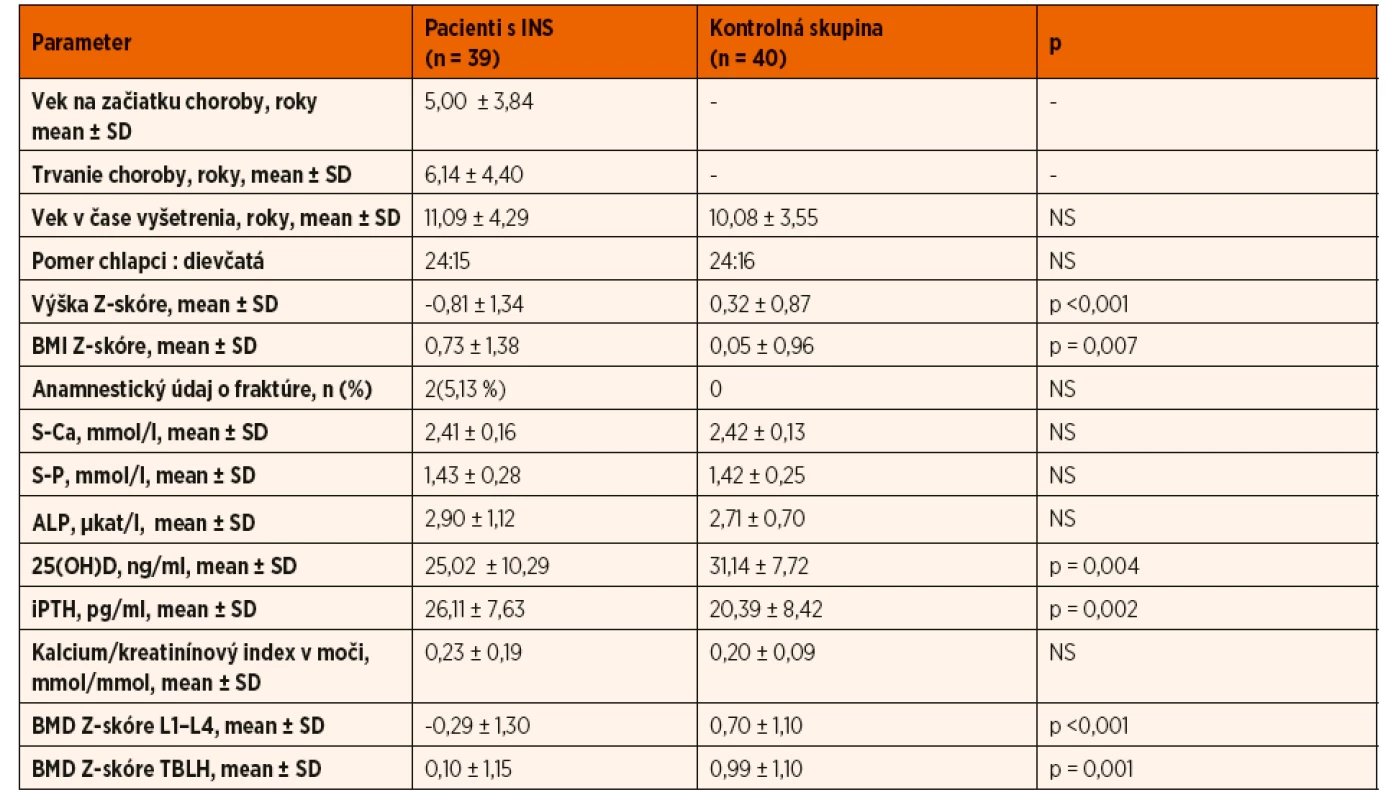
INS – idiopatický nefrotický syndróm; BMI – body mass index; S-Ca – sérová koncentrácia vápnika, S-P – sérová koncentrácia fosforu; ALP – sérová koncentrácia alkalickej fosfatázy; 25(OH)D – sérová koncentrácia 25-hydroxycholekalciferolu; iPTH – sérová koncentrácia intaktného parathormónu; BMD – kostná minerálová denzita; TBLH – total body less head; n – počet subjektov; NS – nesignifikantný Antropometrické merania
Hodnota Z-skóre telesnej výšky bola v skupine pacientov s INS v porovnaní s kontrolnou skupinou signifikantne nižšia (-0,81 ± 1,34 vs. 0,32 ± 0,87; p ˂0,001) a pohybovala sa v rozmedzí -4,02 až 1,75 SD. Z vyšetrených detí 7 (17,9 5%) malo poruchu rastu definovanú jej poklesom pod -2 SD. U pacientov s poruchou rastu sme vyhodnotili kostný vek z RTG snímky ľavej ruky a zápästia, ktorý zaostával oproti skutočnému veku v priemere o -1,40 ± 0,28 roka. Hodnota Z-skóre telesnej výšky negatívne korelovala s kumulatívnou dávkou GK (R = -0,468; p = 0,030) a dobou kortikoterapie (R = -0,521; p = 0,025) (tab. 2).
Tab. 2. Zhodnotenie efektu kumulatívnej dávky kortikoidov a doby kortikoterapie. 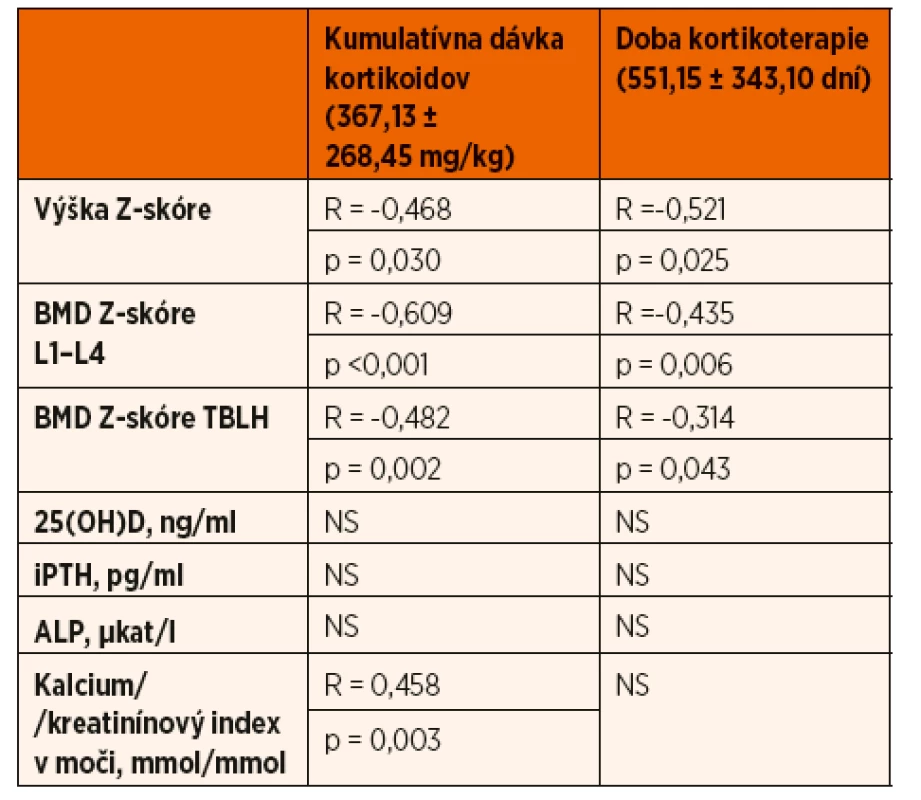
BMD – kostná minerálová denzita; TBLH – total body less head; 25(OH)D – sérová koncentrácia 25-hydroxycholekalciferolu; iPTH – sérová koncentrácia intaktného parathormónu; ALP – sérová koncentrácia alkalickej fosfatázy; NS – nesignifikantný Zároveň pacienti, ktorí užívali v čase merania prednizón, mali štatisticky významnejší pokles Z-skóre telesnej výšky v porovnaní s pacientmi bez kortikoterapie v čase realizácie DXA scanu (-1,26 ± 1,34 vs. -0,33 ± 1,2; p = 0,002) (tab. 3). Porovnaním pohlavia, veku, štádia puberty a kumulatívnej dávky GK sme štatisticky významný rozdiel medzi oboma skupinami pacientov nepotvrdili. Rovnako sme nepotvrdili vplyv predchádzajúcej imunosupresívnej liečby (cyklosporín A) a aktuálnej suplementácie vápnika a vitamínu D v čase vyšetrení na lineárny rast pacientov s INS (tab. 4).
Tab. 3. Zhodnotenie vplyvu liečby prednizónom v čase vyšetrení na rast a kostnú minerálovú denzitu v oblasti L1–L4. 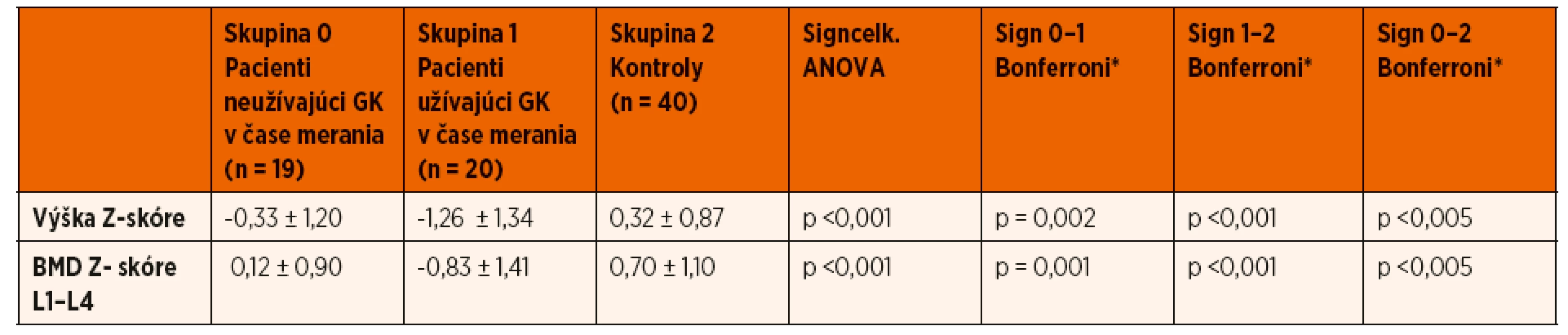
BMD – kostná minerálová denzita; GK – glukokortikoidy
ANOVA test (analysis of variance)
*post hoc Bonferroniho analýzaTab. 4. Zhodnotenie vplyvu suplementácie vápnika a vitamínu D v čase štúdie a cyklosporínu A v anamnéze na parametre kostného metabolizmu. 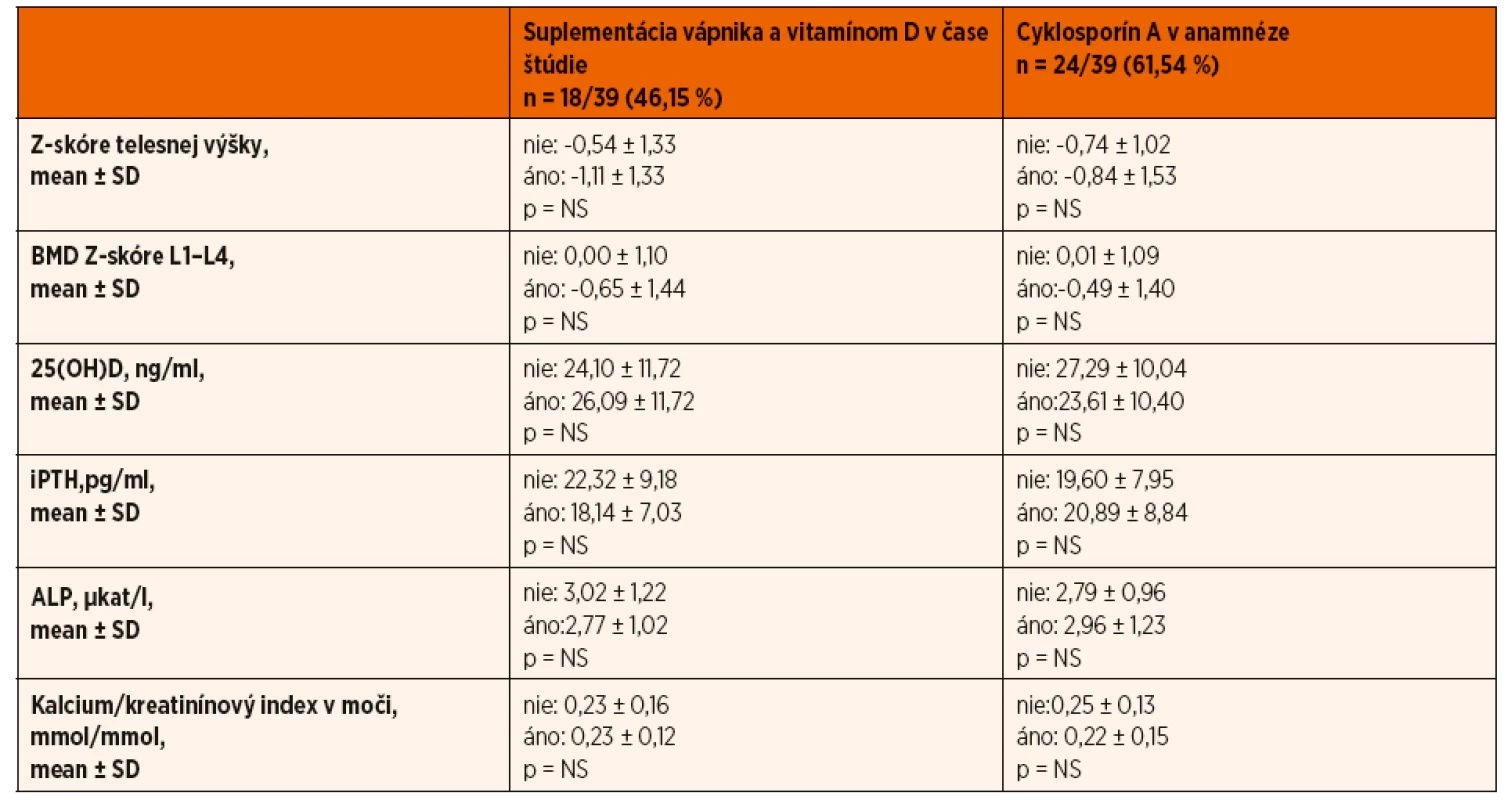
BMD – kostná minerálová denzita; TBLH – total body less head; 25(OH)D – sérová koncentrácia 25-hydroxycholekalciferolu; iPTH – sérová koncentrácia intaktného parathormónu; ALP – sérová koncentrácia alkalickej fosfatázy; NS – nesignifikantný Vybrané laboratórne ukazovatele
Hypovitaminózu D {25(OH)D 12‒20 ng/ml}sme diagnostikovali u 6 pacientov s INS (15,38 %). Ani u jedného z nich sme v čase vyšetrenia nezaznamenali nefrotickú proteinúriu. Na druhej strane, závažný deficit vitamínu D definovaný poklesom 25(OH)D ˂12 ng/ml, sme pozorovali iba u pacientov s nefrotickou proteinúriou (5/6; 83,33 %). Sérová koncentrácia 25(OH)D štatisticky signifikantne negatívne korelovala so sérovou koncentráciou albumínu (p ˂0,001) a bola porovnateľná v skupine pacientov bez a so suplementáciou vitamínom D. V porovnaní s kontrolnou skupinou sme zaznamenali nižšiu sérovú koncentráciu 25(OH)D (25,02 ± 10,29 ng/ml vs.31,14 ± 7,72 ng/ml; p = 0,004) a vyšší iPTH (26,11 ± 7,63 pg/ml vs. 20,39 ± 8,42 pg/ml; p = 0,002).
Hypovitaminózu D sme zachytili aj u 5 (12,5 %) detí z kontrolnej skupiny. Hyperkalciúriu (kalcium/kreatinínový index v moči ˃0,6 mmol/mmol) mal iba jeden pacient s nefrotickým syndrómom, ktorý bol v čase vyšetrenia liečený prednizónom a súčasne užíval vápnikové preparáty a vitamín D. Kalcium/kreatinínový index v moči pozitívne koreloval s kumulatívnou dávkou GK (R = 0,458; p = 0,003). Nepotvrdili sme štatisticky významné rozdiely sérových koncentrácií 25(OH)D, ALP, iPTH, vápnika a fosforu v závislosti od kumulatívnej dávky glukokortikoidov alebo doby trvania kortikoterapie, predchádzajúcej imunosupresívnej liečby (cyklosporín A), či aktuálnej liečby v čase vyšetrení (tab. 2 a 4).
Denzitometrické vyšetrenie
BMD Z-skóre v oblastiach L1‒L4 a TBLH bolo v skupine pacientov s INS v porovnaní s kontrolnou skupinou signifikantne nižšie (-0,29 ± 1,30 vs. 0,70 ± 1,10; p ˂0,001 a 0,10 ± 1,15 vs. 0,99 ± 1,10; p = 0,001). Vo vyšetrovanom súbore pacientov s INS sme zaznamenali pokles BMD Z-skóre ≤-2 SD (vzhľadom na vek, výšku a pohlavie dieťaťa) len u 4 (10,26 %) pacientov, z toho dvaja pacienti s anamnézou patologických zlomenín spĺňali kritériá osteoporózy v detskom veku podľa International Society for Clinical Densitometry (ISCD) (1. pacient: zlomenina predlaktia a femoru vo veku 8 rokov, počas kortikoterapie, 2. pacient: zlomenina tíbie vo veku 6 rokov v období bez GK liečby, zlomenina predlaktia vo veku 9 rokov počas kortikoterapie) [9].
U pacientov užívajúcich v čase merania GK sme zaznamenali štatisticky významnejší pokles BMD Z-skóre v porovnaní s pacientmi bez kortikoterapie (L1‒L4: -0,83 ± 1,41 vs. 0,12 ± 0,90; p = 0,001; TBLH: -0,42 ± 1,08 vs. 0,65 ± 0,97; p = 0,003) (tab. 3). Výška BMD Z-skóre významne negatívne korelovala s výškou kumulatívnej dávky kortikoidov (L1‒L4: R = -0,609; p ˂0,001; TBLH: R = -0,482; p = 0,002) a signifikantne tiež korelovala s dobou kortikoterapie (L1‒L4: R = -0,435; p = 0,006; TBLH: R = -0,314; p = 0,043) (tab. 2).
V našom súbore sme nepotvrdili vplyv predchádzajúcej imunosupresívnej liečby (cyklosporín A), či aktuálnej suplementácie vápnika a vitamínu D v čase vyšetrení, na kostnú minerálovú denzitu (tab. 4). Hodnota BMD Z-skóre štatisticky významne korelovala s hodnotou telesnej výšky (zaostávaním v raste) (R = 0,428; p ˂0,001).
DISKUSIA
V pediatrii sa protizápalový a imunosupresívny účinok GK v liečbe autoimunitných ochorení široko využíva. Údajne až 10 % detí vyžaduje v priebehu detstva určitú formu kortikoterapie [10]. Kostné straty indukované GK sa často prekrývajú s primárnym chronickým ochorením (aktívny zápalový proces, malnutrícia, imobilizácia atď.). Zvýšené koncentrácie prozápalových cytokínov, najmä TNF-α (tumor necrosis factor-alfa) a interleukínu-6 (IL-6) kostný minerálový deficit jednoznačne prehlbujú. Rozdielny vplyv základného chronického ochorenia na úbytok kostnej hmoty indukovaný GK potvrdzujú aj recentné klinické štúdie u detí s Crohnovou chorobou a idiopatickým nefrotickým syndrómom. Vplyv GK na vznik osteoporózy bol výraznejší u detí s Crohnovou chorobou, ktorá je asociovaná s dlhodobou systémovou zápalovou odpoveďou organizmu a búrlivou cytokínovou reakciou [11, 12].
Idiopatický nefrotický syndróm, na rozdiel od iných chorôb liečených glukokortikoidmi, nesprevádza systémová zápalová odpoveď a preto toto ochorenie predstavuje najvhodnejší model pre zhodnotenie vplyvu GK na rastúci skelet [1]. Približne 90 % pacientov s idiopatickým nefrotickým syndrómom je kortikosenzitívnych. Rýchlo reagujú na liečbu vysokými dávkami GK (prednizón 2 mg/kg resp. 60 mg/m2/deň, max. 60 mg/deň) a remisia nastáva už v priebehu prvých 4 týždňov liečby. U 30 % z nich v ďalšom priebehu pozorujeme časté relapsy. Prognosticky závažnejšiu skupinu tvoria kortikodependentní a kortikorezistentní pacienti. Dokonca sú popisované prípady, kedy kortikorezistencia vznikla u predtým kortikosenzitívnych pacientov [13]. Každý relaps choroby si vyžaduje opakované a dlhodobé podávanie GK, ktoré negatívne ovplyvňuje rast aj hodnotu BMD [14].
V našom súbore deklarujeme vyššiu frekvenciu relapsov INS, ako aj výšku incidencie kortikodependencie/kortikorezistencie v porovnaní s dostupnými literárnymi zdrojmi. Uvedená skutočnosť zodpovedá faktu, že naše pracovisko predstavuje terciálne centrum, ktoré lieči práve týchto komplikovaných pacientov, čo nám umožnilo lepšie posúdiť vplyv dlhodobej kortikoterapie na kostné zdravie.
Zhodnotenie antropometrických meraní
GK potláčajú kostnú formáciu, tlmia sekréciu kľúčového rastového faktora kosti IGF-I (insulin-like growth factor-I) a pohlavných hormónov, spôsobujú poruchu syntézy kolagénu a retenciu dusíkatých látok [15]. Ich účinok na rast je podmienený nielen dávkou a trvaním kortikoterapie, ale aj biologickou aktivitou kortikoidu. Porucha rastu je výraznejšia u preparátov s dlhším biologickým polčasom (dexametazón ˃ metylprednizolón ˃ prednizón ˃ hydrokortizón) a vtedy, keď sa liek podáva denne a nie v alternatívnom režime. Útlm lineárneho rastu môže byť pozorovaný už pri minimálnych ‒ suplementačných dávkach kortikoidov (prednizón 3‒5 mg/m2 denne, resp. 0,075‒0,125 mg/kg/deň) [16].
Priemerná denná dávka kortikoidov u našich pacientov s INS bola až 0,7 ± 0,24 mg/kg/deň (0,16‒1,29 mg/kg/deň). Takmer 1/5 našich pacientov s INS mala poruchu rastu charakterizovanú poklesom Z-skóre výšky pod -2 SD. Z-skóre telesnej výšky štatisticky signifikantne negatívne korelovalo s kumulatívnou dávkou kortikoidov a trvaním kortikoterapie. Pokles Z-skóre výšky bol výraznejší u pacientov, ktorí užívali v čase merania prednizón. Niektoré štúdie potvrdzujú, že negatívny efekt dlhodobej kortikoterapie na rast môže pretrvávať ešte dlho po jej ukončení, a to najmä u chlapcov [17].
Zhodnotenie laboratórnych vyšetrení
Pri hodnotení skutočných zásob vitamínu D v tele pacientov s INS je potrebná veľká opatrnosť. Viaceré štúdie popisujú nízke sérové koncentrácie 25-hydroxycholekalciferolu {25(OH)D} v priebehu relapsu nefrotického syndrómu, čo je spôsobené stratou samotného vitamínu a jeho väzbového proteínu močom pri nefrotickej proteinúrii [18]. Skutočné zásoby vitamínu D v tele je teda možné hodnotiť až 1 mesiac po vymiznutí nefrotickej proteinúrie a to meraním koncentrácie 25(OH)D, ktorá je v tom čase už stabilná (naopak 1,25-dihydroxycholekalciferol má veľmi krátky biologický polčas a jeho sérová koncentrácia sa rýchlo mení v závislosti na koncentrácii vápnika a parathormónu v krvi). Tieto závery potvrdzuje aj štúdia indických autorov Banerjee a kol. [18]. Sérová koncentrácia 25(OH)D bola signifikantne nižšia u pacientov do 3 mesiacov po relapse v porovnaní s meraniami realizovanými viac ako 3 mesiace po relapse INS (medián 14,23 ng/ml vs. medián 19,75 ng/ml; p = 0,039) [18].
V našom súbore sme zaznamenali hypovitaminózu D {25(OH)D 12‒20 ng/ml}u 6 z 39 vyšetrených pacientov s INS (15,38 %). Ani jeden z nich nemal v čase vyšetrenia nefrotickú proteinúriu. Na druhej strane, závažný deficit vitamínu D, t.j. 25(OH)D ˂12 ng/ml, sme zaznamenali iba u pacientov s nefrotickou proteinúriou, čo nám potvrdzuje vyššie popísanú teóriu straty väzbového proteínu vitamínu D močom, ktorá mohla vystupňovať už existujúci deficit vitamínu D. Z hľadiska kostného metabolizmu je dôležité posúdiť najmä ukazovatele kostnej formácie, z ktorých najdostupnejšia a v detskom veku a najjednoduchšie interpretovateľná je sérová ALP.
Pokles ALP, dokumentovaný viacerými klinickými štúdiami, súvisí s útlmom kostnej formácie, ktorý sa považuje za hlavný patomechanizmus vzniku glukokortikoidmi indukovanej osteoporózy [18]. Zdôrazňujeme, že sérová koncentrácia ALP koreluje s časom uplynutým od relapsu choroby, t.j. najnižšia je v úvode liečby GK, postupne so znižovaním dávky prednizónu a rýchlosti úbytku kostnej hmoty („druhá fáza úbytku kostnej hmoty“) sa upravuje [18]. V súlade s týmito poznatkami vieme vysvetliť, prečo sa sérová koncentrácia ALP v skupine našich „dlhodobo liečených“ pacientov s INS nelíšila od sérovej koncentrácie ALP v kontrolnej skupine.
Počas kortikoterapie, najmä pri súčasnej suplementácii vápnikom a vitamínom D, je potrebné pravidelne kontrolovať kalciúriu, ktorá môže byť vystupňovaná. Banerjee a kol. uvádzajú, že počas suplementácie vápnikom (500‒1000 mg/deň 3 mesiace) a vitamínom D3 (60 000 IU perorálne, raz týždenne po dobu 4 týždňov) mala až polovica pacientov hyperkalciúriu [19]. V našom súbore pacientov mal hyperkalciúriu charakterizovanú vzostupom kalcium/kreatinínového indexu v moči ˃0,6 mmol/mmol iba jeden suplementovaný pacient. V súlade s mechanizmom účinku kortikoidov, kalcium/kreatinínový index v moči u pacientov v našom súbore pozitívne koreloval s kumulatívnou dávkou prednizónu.
Zhodnotenie denzitometrických meraní
Najdostupnejšou metódou na hodnotenie kostnej minerálovej denzity je dvojenergiová röntgenová absorbciometria ‒ DXA. Pri interpretácii výsledkov merania však treba zohľadniť jej limitácie. DXA poskytuje dvojrozmerné meranie trojrozmernej kosti. Denzita vyšetrovanej kosti sa meria v plošných jednotkách, v g/cm2a zanedbáva jej tretí rozmer ‒ hĺbku. U detí s nižším vzrastom sa preto môže zdať hodnota aBMD falošne nízka a naopak, hodnota aBMD vyššieho dieťaťa s úplne identickou objemovou BMD (vBMD) môže byť desinterpretovaná ako neprimerane vysoká [1].
Veľkou nevýhodou DXA je tiež skutočnosť, že prístroj nedokáže rozlíšiť kortikálnu kosť od trabekulárnej. Účinok glukokortikoidov je pritom 3 až 4-krát silnejší na trabekulárnu ako na kortikálnu kosť. Autori Tsampalieros a kol.vo svojej štúdii uvádzajú, že dlhodobá expozícia kortikoidom u pacientov s INS je asociovaná s oneskorením rastu a zvýšením kortikálnej vBMD, čo svedčí pre výrazný pokles práve trabekulárnej kostnej hmoty [20]. Pri hodnotení BMD je preto potrebné zohľadniť antropometrické parametre pacienta (najmä výšku), štádium puberty, prípadne aj kostný vek [1].
Nízku kostnú minerálovú denzitu definovanú poklesom Z-skóre pre aBMD v oblasti L1‒L4 pod -2 SD sme zaznamenali u 4 (10,26 %) pacientov, z toho dvaja anamnézou patologických zlomenín spĺňali kritériá osteoporózy v detskom veku [9]. Pokles BMD Z-skóre v meraných oblastiach L1‒L4 a TBLH negatívne koreloval s kumulatívnu dávkou GK a trvaním kortikoterapie. Podobne, ako pri hodnotení rastu, najvýraznejší pokles BMD Z-skóre sme zaznamenali práve u pacientov, ktorí užívali v čase denzitometrického vyšetrenia kortikoidy. Zdôrazňujeme, že negatívne účinky GK na detský skelet môžu závisieť aj od veku, v ktorom bola kortikoterapia začatá resp. ukončená. Normalizácia BMD je totiž efektívnejšia u detských pacientov, u ktorých sa kortikoterapia ukončila ešte pred nástupom puberty [21]. Môžeme to vysvetliť faktom, že takmer 90 % z celkového objemu kostnej hmoty, tvz. peak bone mass (PBM), sa vytvára v prvých dvoch dekádach života, pričom najväčšie prírastky akvizície kostného minerálu pozorujeme v adolescencii. Nakoľko tempo akvizície kostného minerálu je počas včasnej a strednej puberty, oproti obdobiu od narodenia po nástup dospievania dvojnásobné, možno obdobie puberty považovať za „kritické“ pre formovanie kostného zdravia a každý negatívne pôsobiaci faktor v tomto období môže zásadným spôsobom ovplyvniť kostné zdravie [1].
V našom súbore pacientov sme však signifikantný rozdiel kostnej minerálovej denzity vo vzťahu k jednotlivým štádiám puberty nepotvrdili, čo si vysvetľujeme malým počtom pacientov pri rozdelení puberty na jednotlivé štádiá (štatistika malých čísel). K limitáciám našej štúdie ďalej uvádzame, že nakoľko nie u každého pacienta bola úvodná GK liečba indikovaná na našom pracovisku, nie u každého pacienta bol pri stanovení diagnózy zrealizovaný DXA scan. Z dôvodu nedostupnosti údajov tak nebolo možné úroveň BMD Z-skóre v „čase 0“, t.j. pred začatím GK liečby, zhodnotiť. Nemáme však dôvod sa domnievať, že by hodnota BMD u „predtým zdravých pacientov“ bola štatisticky signifikantne rozdielna voči hodnote BMD Z-skóre kontrolného súboru detí zodpovedajúceho veku a pohlavia vo vyšetrovaných oblastiach. Viac ako polovica pacientov v našom súbore (61,54 %) užívala v priebehu liečby nefrotického syndrómu cyklosporín A. Štúdie na zvieracích modeloch často naznačujú, že cyklosporín A zvyšuje kostnú resorpciu a môže sa spolupodieľať na vzniku osteoporózy s vysokým kostným obratom [22]. Účinok cyklosporínu A na metabolizmus kostného tkaniva u detí je jednak menej objasnený a zároveň býva ovplyvnený prítomnosťou iných ochorení alebo liekov, ktoré ovplyvňujú kosť. Dôležitý je aj fakt, že na rozdiel od kortikoterapie sa pri liečbe cyklosporínom žiadna „osteoprotektívna“ terapia neodporúča. Z tohto dôvodu sme pacientov liečených cyklosporínom A zo štúdie nevylúčili. Realizovanou štatistickou analýzou sme u nich nepotvrdili negatívny účinok cyklosporínu A na rast, kostný obrat a ani kostnú minerálovú denzitu.
Prevencia zníženia kostnej minerálovej denzity počas dlhodobej kortikoterapie
Preventívny účinok vitamínu D a vápnika pri kortikoterapii má exaktnú patofyziologickú podstatu. Glukokortikoidy interferujú s vitamínom D pri vstrebávaní vápnika z čreva a jeho vylučovaní obličkami. Porucha kalcium-fosforovej rovnováhy vedie k sekundárnemu hyperparathyreoidizmu, ktorý deštruuje rastovú platničku chrupavky a priľahlú kosť. Vitamín D má aj viaceré špecifické účinky na diferenciáciu chondrocytov, mineralizáciu a resorpciu kostí [23].
Pozitívny efekt suplementácie vápnika a vitamínu D na BMD dokumentuje aj prospektívna štúdia Gulati a kol. [24]. U 88 detí s relabujúcim NS bolo súbežné podávanie vápnika (500 mg/deň) a vitamínu D (200 IU/deň) spojené až s 8,19% zvýšením BMD v oblasti driekovej chrbtice po 6 mesiacoch liečby. Bak a kol. v randomizovanej prospektívnej štúdii 40 tureckých detí s NS užívajúcich prednizón potvrdili 8,4% zlepšenie BMD pri vyšších dávkach vápnika (1 g denne) a vitamínu D (400 IU) [25]. Štúdia indických autorov u prepubertálnych detí s novodiagnostikovaným INS potvrdzuje, že suplementácia vitamínu D a vápnika počas kortikoterapie INS nielenže predchádza poklesu BMC, ale jej hodnotu výrazne zvyšuje. Toto zvýšenie bolo na úrovni až 11,2 % [2].
V našej štúdii sme nepotvrdili pozitívny efekt suplementácie vápnika a vitamínu D na rast a kostnú minerálovú denzitu, otáznou však ostáva adherencia pacientov pri užívaní vitamínových preparátov, ktorá mohla ovplyvniť výsledky. Je nutné zdôrazniť, že existujú aj práce, ktoré taktiež zlepšenie kostnej minerálovej denzity nepreukázali, napriek tomu však suplementáciu odporúčajú [19].
ZÁVER
Napriek pokrokom v problematike glukokortikoidmi indukovanej osteoporózy, u detí ostáva veľa nevyjasnených otázok. Intenzívne sa diskutuje o vzťahu medzi stupňom kostných strát a kumulatívnou dávkou kortikoidov, formou podania steroidov (perorálne, intravenózne či inhalačne), či o „bezpečnej“ prahovej dávke prednizónu, pri ktorej nedochádza k osteoporóze.
Pokles BMD Z-skóre L1‒L4 resp. TBLH je významný v období užívania dlhodobej kortikoterapie a negatívne koreluje s kumulatívnou dávkou kortikoidov a dĺžkou kortikoterapie. Úlohou primárneho pediatra je počas dlhodobej kortikoterapie, v spolupráci so špecialistom, monitorovať potrebné klinické a laboratórne ukazovatele kortikoidmi indukovaného poškodenia kostí a sledovať účinnosť preventívnych režimových opatrení. Súčasťou komplexnej liečebnej stratégie u každého dieťaťa s dlhodobou kortikoterapiou má byť dostatočná fyzická aktivita a suplementácia vápnika a vitamínu D.
Došlo: 25. 4. 2018
Přijato: 25. 5. 2018
Korešpondujúci autor:
MUDr. Lenka Turoňová, PhD.
Klinika detí a dorastu
JLF UK a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail:lenosko@centrum.sk
Zdroje
1. Fung BE, Sawyer AJ, Bachrach KL. Bone Health Assessment in Pediatrics – Guidelines for Clinical Practice. 2nd ed. Springer International Publishing, 2016 : 1–347.
2. El-Mashad GM, El-Hawy MA, El-Hefnawy SM, Mohamed SM. Bone mineral density in children with idiopathic nephrotic syndrome. J Pediatr 2016; 93 : 142–147.
3. Canalis E, Mazziotti G, Giustina A, Bilezikian JP. Glucocorticoid-induced osteoporosis: pathophysiology and therapy. Osteoporos Int 2007; 18 : 1319.
4. Bayer M, Růžičková O, Pavelka K, Palička V. Doporučení pro prevenci a léčbu glukokortikoidy indukované osteoporózy u pacientů s revmatickým onemocněním (společné stanovisko České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu). Čes Revmatol 2004; 4 : 163–174.
5. Gulati S, Godbole M, Singh U, et al. Are children with idiopathic nephrotic syndrome at risk for metabolic bone disease? Am J Kidney Dis 2003; 41 : 1163–1169.
6. Waljee AK, Rogers MA, Lin P, et al. Short term use of oral corticosteroids and related harms among adults in the United States: population based cohort study. BMJ 2017; 357 : 1415.
7. Aceto G, D’Addato O, Giovanni Messina G, et al. Bone health in children and adolescents with steroid-sensitive nephrotic syndrome assessed by DXA and QUS. Pediatr Nephrol 2014; 29 : 2147–2155.
8. Jabor A. Vnitřní prostředí. Praha: Grada, 2008 : 1–530.
9. Gordon CM, Leonard MB, Zemel BS. Pediatric Position Development Conference: executive summary and reflections. J Clin Densitom 2014; 17 : 219–224.
10. Choudhary S, Agarwal I, Seshadri MS. Calcium and vitamin D for osteoprotection in children with new-onset nephrotic syndrome treated with steroids: a prospective, randomized, controlled, interventional study. Pediatr Nephrol 2014; 29 : 1025–1032.
11. Leonard MB. Glucocorticoid-induced osteoporosis in children: impact of the underlying disease. Pediatrics 2007; 119 (3): 166–174.
12. Leonard MB, Feldman HI, Shults J, et al. Long-term, high-dose glucocorticoids and bone mineral content in childhood glucocorticoid-sensitive nephrotic syndrome. N Engl J Med 2004; 351 (8): 868–878.
13. Srivastava RN, Agarwal RK, Moudgil A, Bhuyan UN. Late resistance to corticosteroids in nephrotic syndrome. J Pediatr 1986; 108 : 66.
14. Gulati S, Gulati K. Bone disease in nephrotic syndrome-prevention is better than cure. Pediatr Nephrol 2005; 20 : 111–112.
15. Allen DB. Growth suppression by glucocorticoid therapy. Endocrinol Metab Clin North Am 1996; 25 : 699.
16. Allen DB, Julius JR, Breen TJ, Attie KM. Treatment of glucocorticoid-induced growth suppression with growth hormone. National Cooperative Growth Study. J Clin Endocrinol Metab 1998; 83 : 2824.
17. Lai HC, Fitz Simmons SC, Allen DB, et al. Risk of persistent growth impairment after alternate-day prednisone treatment in children with cystic fibrosis. N Engl J Med 2000; 342 : 851.
18. Banerjee S, Basu S, Sen A, Sengupta J. Vitamin D in nephrotic syndrome remission: a case-control study. Pediatr Nephrol 2013; 28 : 1983–1989.
19. Banerjee S, Basu S, Sen A, Sengupta J. The effect of vitamin D and calcium supplementation in pediatric steroid-sensitive nephrotic syndrome. Pediatr Nephrol 2017; 32 : 2063–2070.
20. Tsampalieros A, Gupta P, Denburg MR, et al. Glucocorticoid effects on changes in bone mineral density and cortical structure in bone mineral density and cortical structure in childhood nephrotic syndrome. J Bone Miner Res 2013; 28 : 480–488.
21. Hogler W, Blimkie CJ, Cowell CT, et al. A comparison of bone geometry and cortical density at the mid-femur between prepuberty and young adulthood using magnetic resonance imaging. Bone 2013; 33 : 771–778.
22. Movsowitz C, Epstein S, Fallon M, et al. Cyclosporin-A in vivo produces severe osteopenia in the rat: effect of dose and duration of administration. Endocrinology 1988; 123 : 2571.
23. Šašinka M, Furková K. „Slnečný“ vitamín. Bratislava: Herba, 2012 : 1–184.
24. Gulati S, Sharma RK, Gulati K, et al. Longitudinal follow-up of bone mineral density in children with nephrotic syndrome and the role of calcium and vitamin D supplements. Nephrol Dial Transplant 2005; 20 : 1598–1603.
25. Bak M, Serdaroglu E, Guclu R. Prophylactic calcium and vitamin D treatments in steroid-treated children with nephrotic syndrome. Pediatr Nephrol 2006; 21 : 350–354.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2019 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Editorial: Dětská a dorostová psychiatrie ve 21. století
- Longitudinální sledování vývoje sociálních schopností u pacientů s autismem: problematika spolehlivosti rodičovské výpovědi v telefonickém interview
- Význam maternálních autoprotilátek při vzniku poruch autistického spektra
- Možnosti farmakoterapie depresívnej poruchy u detí a adolescentov
- Specifika posttraumatické stresové poruchy v dětství a dospívání
- Psychiatrické poruchy s převahou somatických projevů v dětství a adolescenci
- Vplyv dlhodobej kortikoterapie na kostné zdravie u detí s idiopatickým nefrotickým syndrómom
- Odešel prof. MUDr. Josef Koutecký, DrSc.
- Intrakraniální krvácení u pacientů s hemofilií A
- Dieťa s príznakmi akútneho zápalu hrtana na urgentnom príjme – analýza súboru pacientov ošetrených v rokoch 2016 a 2017
- Profesor Dr. Leopold Moll *2. 3. 1877 Česká Lípa – ✞21. 2. 1933 Vídeň
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Specifika posttraumatické stresové poruchy v dětství a dospívání
- Psychiatrické poruchy s převahou somatických projevů v dětství a adolescenci
- Možnosti farmakoterapie depresívnej poruchy u detí a adolescentov
- Význam maternálních autoprotilátek při vzniku poruch autistického spektra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



