-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam maternálních autoprotilátek při vzniku poruch autistického spektra
The role of maternal autoantibodies in the pathogenesis of autism spectrum disorders
Autism spectrum disorders (ASD) are heterogeneous group of neurodevelopmental disorders characterized by impairments in social interaction, communication and stereotyped, repetitive patterns of behavior, interests and activities. The causes and risk factors of ASD are largely unknown with a complex etiology combining genetic as well as environmental factors. In the last two decades it has been well established that an important role in the prenatal brain development is played by the immune system. Deregulation of the immune system during embryonic development may lead to neurodevelopmental changes resulting in ASD and one of the potential etiologic factors in the development of ASD has been identified as presence of maternal autoantibodies targeting the fetal brain proteins. The type of ASD associated with the presence of maternal autoantibodies has been referred to as MAR autism (maternal antibodies related autism). The link between the maternal autoantibodies and ASD has been demonstrated in both clinical studies and animal models. Several protein targets of ASD-related maternal autoantibodies have been identified. In this article we focus on Collapsin response mediator protein 2 (CRMP2), which has been previously shown to play an important role in regulation of axon growth and guidance during brain development.
In addition, we discuss the potential effect of CRMP2 targeting by maternal antibodies in ASD pathogenesis and future possibilities of MAR ASD treatment.
Keywords:
therapy – Animal models – maternal autoantibodies – Autism spectrum disorder – CRMP2
Autoři: I. Dudová 1; K. Horáčková 2; M. Hrdlička 1; M. Balaštík 3
Působiště autorů: Dětská psychiatrická klinika 2. LF UK a FN Motol, Praha 1; Psychiatrická klinika 1. LF UK a VFN, Praha 2; Oddělení molekulární neurobiologie, Fyziologický ústav AV ČR, Praha 3
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (4): 205-210.
Kategorie: Sympozium: Dětská a dorostová psychiatrie
Souhrn
Poruchy autistického spektra (PAS) jsou heterogenní skupinou neurovývojových poruch charakterizovanou narušením sociálních interakcí, komunikace a stereotypními, opakujícími se vzorci chování, zájmů a aktivit. Příčiny vzniku a rizikové faktory PAS nejsou dosud plně objasněny, etiologie je komplexní se zastoupením jak genetických faktorů, tak faktorů vnějšího prostředí. V posledních dvou dekádách je stále více zkoumán vliv imunitního systému na vyvíjející se nervovou soustavu během prenatálního období. Dysregulace maternálního imunitního systému během gestace může vést k neurovývojovým změnám a vzniku neurovývojového onemocnění jako je PAS. Jedním z potenciálních etiologických imunologických faktorů ve vztahu k PAS jsou maternální autoprotilátky reaktivní vůči proteinům fetálního mozku. Pro takto podmíněný typ PAS používají výzkumné studie pojem MAR autism (maternal autoantibody related autism, autismus související s maternálními autoprotilátkami). Spojení bylo prokázáno jak klinickými studiemi, tak zvířecími modely. Je známo několik proteinů, proti kterým jsou namířeny maternální autoprotilátky ve vztahu k PAS.
V článku se zaměříme na collapsin response mediator protein 2 (CRMP2), který hraje důležitou roli v regulaci růstu a navádění axonů v průběhu vývoje mozku, a roli autoprotilátek proti CRMP2 při vzniku PAS. Závěrem ještě krátce zmíníme hypotetickou možnost léčby PAS spojených s maternálními autoprotilátkami.
Klíčová slova:
maternální autoprotilátky – porucha autistického spektra – zvířecí modely – CRMP2 – terapie
ÚVOD
Poruchy autistického spektra (PAS) jsou charakterizovány narušením sociálních interakcí, komunikace a stereotypními, opakujícími se vzorci chování, zájmů a aktivit. PAS zahrnují diagnózy dětský autismus, Aspergerův syndrom, atypický autismus a dětská desintegrační porucha [1], které patří v mezinárodní klasifikaci nemocí MKN-10 do kategorie Pervazivní vývojové poruchy. Americký klasifikační manuál DSM-5 místo jednotlivých poruch vytváří jednu diagnostickou kategorii Porucha autistického spektra [2].
Příčiny vzniku PAS jsou komplexní se zastoupením jak genetických faktorů, tak faktorů vnějšího prostředí. Podíl genetických faktorů neboli heritabilita se u autismu odhaduje nad 60 % [3]. Pro zásadní podíl genetických faktorů na vzniku autismu svědčí významně zvýšený výskyt autismu u dvojčat a sourozenců. PAS jsou také součástí řady chorob se známou genetickou etiologií. Hlavními genetickými onemocněními asociovanými s PAS jsou syndrom fragilního chromosomu X, tuberózní skleróza, Downův syndrom, Angelmanův syndrom a choroby související s mutacemi v genu MECP2. Pro PAS asociovaný s genetickým onemocněním se vžil pojem syndromický autismus [4].
Mechanismus vzniku PAS není dosud znám. Zahrnuje pravděpodobně změny vývoje mozku záhy po početí. PAS zřejmě začíná kaskádou patologických jevů, které jsou výrazně ovlivněny environmentálními faktory. Jedním z těchto faktorů může být nesprávná činnost imunitního systému během kritického období vývoje mozku.
VZTAH MEZI IMUNITNÍM SYSTÉMEM A PAS
Interakce mezi imunitní a nervovou soustavou začínají záhy během embryonálního stadia života. Úspěšný vývoj nervové soustavy závisí i na vyvážené imunitní reakci. Imunitní dysregulace může být etiologickým faktorem pro vznik PAS. Souvislost mezi narušením imunitního systému a vznikem PAS se udává například u rodinného výskytu autoimunitních onemocnění, virové nebo bakteriální infekce matky v těhotenství a dysregulace cytokinů a chemokinů.
Reprezentativní populační švédská studie z roku 2010 vykázala vyšší riziko vzniku autismu u dětí matek s diabetem 1. typu, idiopatickou trombocytopenickou purpurou, myastenií gravis a revmatickou horečkou, u otců bylo prokázáno spojení revmatické horečky a autismu u potomků. Celkově byla o 50 % vyšší pravděpodobnost diagnózy autismu ve věku 10 let u dětí, jejichž rodiče měli nějaké autoimunitní onemocnění [5]. Metaanalýza z roku 2015 prokázala, že výskyt autoimunitního onemocnění v rodinné anamnéze je spojen o 28 % s vyšším rizikem vzniku autismu. U konkrétních autoimunitních onemocnění bylo v případě výskytu hypotyreózy riziko vyšší o 64 %, u psoriázy o 59 %, u revmatoidní artritidy o 51 % a u diabetes mellitus 1. typu o 49 % [6]. Dánská studie odhalila spojení diagnózy PAS u dítěte s hospitalizací matky pro virovou infekci během prvního trimestru nebo bakteriální infekci během druhého trimestru těhotenství. Zdůraznila tím přítomnosti více specifických faktorů ‒ patogenu, tíže i načasování infekčního onemocnění matky [7]. Cytokiny a chemokiny jsou pleiotropní proteiny produkované buňkami imunitního systému, které koordinují a regulují imunitní odpovědi organismu. Atypický cytokinový a chemokinový profil dětí s PAS byl prokázán v několika studiích, v některých z nich koreloval s vyšší mírou narušeného chování [8].
Další potenciální etiologickou cestou, kterou může imunitní systém matky ovlivnit neurovývojový proces, je přítomnost maternálních autoprotilátek reagujících proti proteinům vyvíjejícího se fetálního mozku [9]. Pro tento vyhraněný typ PAS se v odborných kruzích prosazuje pojem MAR autism (maternal autoantibody related autism, autismus související s maternálními autoprotilátkami) [10, 11], nebo MAR ASD (maternal autoantibody related autism spectrum disorder, MAR PAS ‒ porucha autistického spektra související s maternálními autoprotilátkami) [12].
MATERNÁLNÍ AUTOPROTILÁTKY A VÝVOJ MOZKU
Plod je během těhotenství chráněn proti infekcím mateřskými IgG protilátkami, které se přes placentu dostávají do fetálního krevního oběhu. Stejným způsobem může dojít k přenosu specifických maternálních protilátek, které u plodu vyvolají patologickou reakci. Nezralá hematoencefalická bariéra je pro maternální autoprotilátky propustná, proto se mohou dostat do fetálního mozku a blokovat zde funkci specifických proteinů klíčových pro vývoj CNS. Významnými proteiny, proti kterým byly detekovány maternální protilátky ve vztahu k PAS, jsou laktátdehydrogenáza (LDH) A a B, stresem indukovaný fosfoprotein 1 (STIP1), guanin deamináza (GDA) známá také pod názvem cypin, collapsin response mediator protein (CRMP) 1 a 2 a Y-box vazebný protein (YBX1) [10]. Tyto proteiny jsou rozhodující pro normální vývoj mozku, hrají důležitou roli v migraci neuronů a tvorbě neuronálních sítí [13, 14]. Přehled proteinů a jejich neurovývojovou roli uvádí tabulka 1.
Tab. 1. Úloha proteinů zacílených maternálními autoprotilátkami spojenými s PAS při vývoji nervové soustavy (upraveno podle Jones and Van de Water, 2019). 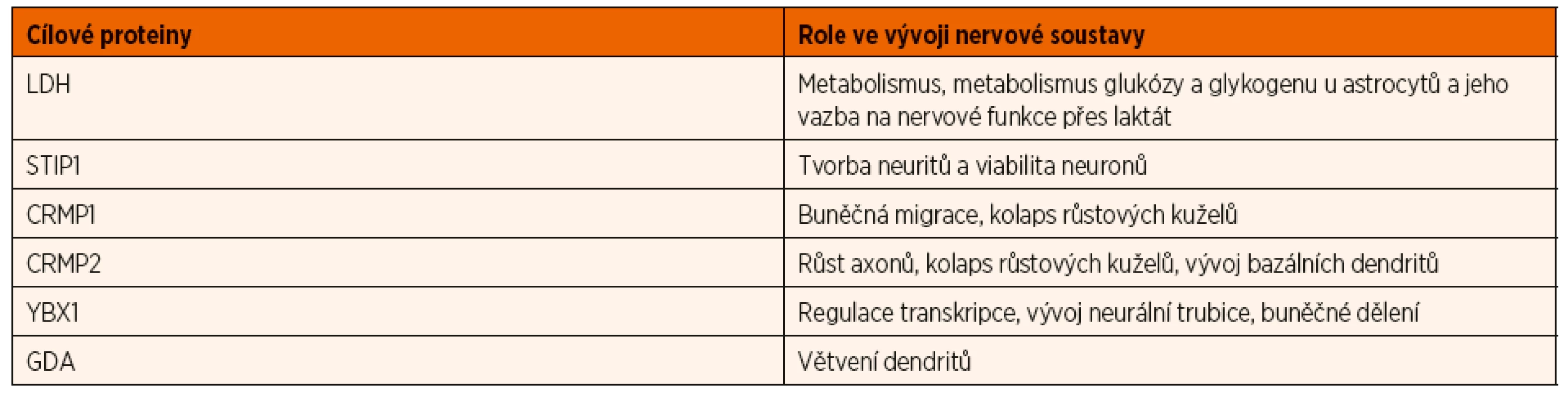
LDH – lactate dehydrogenase (laktátdehydrogenáza); STIP1 – stress-induced phosphoprotein 1 (stresem indukovaný fosfoprotein 1); CRMP1 – collapsin response mediator protein 1; CRMP2 – collapsin response mediator protein 2; YBX1 – Y-box bindet protein 1 (Y-box vazebný protein); GDA – guanin deaminase (guanin deamináza) Úvaha, že maternální autoprotilátky mohou vést k vývojovému defektu fetálního nervového systému, není nová. Experimenty s myšími modely, které připisovaly maternálním autoprotilátkám přímé působení na mozek a nervovou soustavu embryí vedoucí k velkým změnám v mozku potomků, byly uskutečněny již koncem padesátých let minulého století. V sedmdesátých letech byla prokázána přítomnost mateřských IgG protilátek ve fetálním mozkomíšním moku a jejich přestup nezralou hematoencefalickou membránou do fetálního mozku během těhotenství [13]. Další zvířecí experimenty prokázaly, že protilátky proti proteinům fetálního mozku mohou vyvolat změny v chování u exponovaných potomků [15, 16]. Teprve od devadesátých let minulého století se objevují první studie, které zkoumají maternální autoprotilátky ve vztahu k PAS a uvádí je jako jeden z rizikových faktorů pro vznik PAS [13].
MATERNÁLNÍ AUTOPROTILÁTKY A PAS
Animální modely
Pro ověření významu maternálních autoprotilátek při vzniku neurovývojových onemocnění byly vytvořeny různé zvířecí modely. Ve studii provedené Martinem et al. byly pasivním transferem přeneseny purifikované neuroprotilátky od matek dětí s PAS březím samicím opic makak rhesus. Potomci této skupiny opic vykazovali vyšší míru stereotypního chování a motorické aktivity, když byli umístěni do neznámého sociálního prostředí, v porovnání s potomky opičích samic, kterým byly transferovány IgG protilátky od matek typicky se vyvíjejících dětí [17]. Výsledky byly replikovány v následující rozsáhlejší studii, která u potomků samic opic makak rhesus, kterým byly podávány specifické IgG protilátky matek dětí s PAS (proti proteinům s molekulovou hmotností 37 a 73 kDa odpovídající velikosti proteinů LDH, CRMP1 a STIP1), prokázala abnormální sociální chování a překvapivě zvětšený mozkový objem v porovnání s kontrolní skupinou potomků opičích samic, které dostaly protilátky od matek běžně se vyvíjejících dětí. Samice makaka, které byly vystaveny působení protilátek matek dětí s PAS, vykazovaly vyšší míru mateřské protektivity vůči potomstvu [18].
Paralelně se studiemi zkoumajícími nehumánní primáty probíhal výzkum i na hlodavcích. Podobně jako u primátů byla březím myším samicím intravenózně podána lidská maternální plazma obsahující neuroprotilátky reaktivní vůči proteinům o molekulové hmotnosti 37 a 73 kDa. Potomci těchto myší vykazovali v dospívání zvýšenou anxietu a odpověď na stres společně s narušeným motorickým a senzorickým vývojem, v dospělosti změny v sociálním začlenění na rozdíl od potomků myší, kterým byla podána plazma matek typicky se vyvíjejících dětí. Podle autorů studie tak potomci myší exponovaných plazmě matek dětí s PAS vykazovali patologické symptomy srovnatelné s projevy PAS [19].
Klinické studie
Zásadní klinické studie publikovali Braunschweig et al. První z nich zahrnovala 61 dětí s autismem, 40 dětí s opožděným vývojem, 62 dětí běžně se vyvíjejících a jejich matek. Studie našla signifikantní korelaci mezi spárovanou reaktivitou maternálních protilátek vůči fetálním proteinům s molekulovou hmotností 37 a 73 kDa a diagnózou autismu u dítěte [20]. Dalším typem maternálních protilátek byly protilátky reaktivní vůči fetálním proteinům s molekulovou hmotností 39 a 73 kDa. Oba typy byly unikátně nalezeny u matek dětí s PAS [20]. Maternální reaktivita vůči těmto typům protilátek byla také pozorována v prospektivně shromážděných krevních vzorcích matek z období středního těhotenství, které následně porodily dítě, u kterého byla diagnostikována PAS [21].
Druhá Braunschweigova studie zahrnovala 246 matek dětí s PAS a 149 matek běžně se vyvíjejících dětí. Autoři zkoumali maternální reaktivitu vůči jednotlivým antigenům (LDH, cypin, STIP1, CRMP1, CRMP2 a YBX1) a jejich různým kombinacím a prokázali vysoce signifikantní spojení přítomnosti jednotlivých maternálních autoprotilátek proti proteinům fetálního mozku a především jejich kombinací s diagnózou PAS. Kombinace dvou a více antigenů byla nalezena u 23 % matek dětí s PAS proti necelému 1 % matek typicky se vyvíjejících dětí [10].
Vědci zkoumali také behaviorální charakteristiky dětí s PAS, jejichž matky měly protilátky proti fetálním proteinům. Studie u těchto dětí prokázaly zvýšenou incidenci stereotypního chování [10, 11], zvýšenou iritabilitu a narušení v oblasti expresivní řeči [22].
Výsledky zobrazovacích metod
Velmi zajímavé výsledky ukázaly studie využívající zobrazovací metody. Je známo, že rozvoj autistické symptomatologie je spjat s abnormálním růstem mozku. Jak nalezli například Courchesne et al., děti postižené autismem mají menší obvod hlavy při narození než zdravé děti s průměrem na 25. percentilu, což je následováno excesivním růstem hlavy mezi 1.‒2. měsícem a 6.‒14. měsícem života. Na konci tohoto období pak mají autistické děti významně vyšší průměrný obvod hlavy, než je populační norma (nachází se na 84. percentilu). Období nadměrného růstu mozku je po čtvrtém roce života následováno abnormálně nízkým tempem růstu. Během adolescence a v dospělosti se již celkový objem mozku u autistických pacientů a kontrol nijak neliší [23].
Tento nález akcelerovaného růstu mozku a zvětšeného mozkového objemu v raném dětství ale není obecnou charakteristikou všech jedinců s autismem. Abnormální velikost mozku byla prokázána například u chlapců s regresivním typem autismu, tj. se ztrátou již dříve nabytých schopností, nejčastěji řečových a sociálních, po 15. až 24. měsíci věku [24]. Stejný vzorec abnormálního růstu mozku byl prokázán také u chlapců s PAS, jejichž matky měly 37 a 73 kDa IgG autoprotilátky reagující proti fetální mozkové tkáni opic makak rhesus. Mozek těchto chlapců vykazoval zvětšení o 12 % na rozdíl od dětí běžně se vyvíjejících. Byl také o 7 % větší než mozek chlapců s PAS, jejichž matky neměly uvedené protilátky [25]. Tento nález koresponduje s nálezem zvětšení mozkového objemu u samců opic makak rhesus exponovaných prenatálně 37 a 73 kDa autoprotilátkami [18].
Výsledky výzkumu ukazují na to, že maternální autoprotilátky spojené s PAS mohou mít dopad na vývoj mozku vedoucí k jeho abnormální velikosti. Průkaz rozdílu v celkovém objemu mozku dětí s PAS, který byl prokázán například ve spojitosti s regresivním typem autismu nebo s přítomností maternálních autoprotilátek vůči proteinům vyvíjejícího se fetálního mozku, podporuje teorii, že poruchy autistického spektra jsou skupinou vysoce heterogenních, multifaktoriálně podmíněných poruch, které však sdílí stejné rysy.
ÚLOHA PROTEINU CRMP2 V EMBRYONÁLNÍM VÝVOJI MOZKU
Významná část maternálních autoprotilátek byla ve studiích zaměřena vůči proteinům CRMP1 a CRMP2. CRMP proteiny jsou exprimovány převážně v nervovém systému, kde se účastní diferenciace neuronů, organizace a přestavby nervové sítě či větvení axonů a dendritů. CRMP patří do skupiny proteinů asociovaných s mikrotubuly, vazbou na mikrotubuly ovlivňují dynamiku buněčného cytoskeletu [26]. Proteiny rodiny CRMP jsou silně exprimovány v oblasti předního mozku, středního mozku, Varolova mostu, mozečku, mozkové kůře a hipokampu. Ze zvířecích modelů víme, že jsou nejvíce exprimovány v průběhu embryonálního vývoje, jejich množství se s narůstající dobou po porodu snižuje.
V mozcích dospělých jedinců se CRMP vyskytují hlavně v oblastech s vysokou plasticitou neuronů, jako je např. hipokampus [27]. CRMP2 je prvním objeveným proteinem z pětičlenné rodiny CRMP. Je důležitým mediátorem určení polarity axonů, růstu neuronů a retrakce axonů za využití dynamiky mikrotubulů, aktinového cytoskeletu a endocytózy adhezivních molekul neuronů [28]. Nedostatek genu CRMP2 vede u myší k významným změnám ve vývoji i chování [29]. CRMP2 hraje důležitou úlohu nejen v procesu ontogeneze nervové soustavy, ale také při vývoji neurodegenerativních onemocnění, například Alzheimerovy nemoci. Aktivita CRMP2 je závislá na posttranslačních modifikacích proteinu, z nichž nejvýznamnější a nejvíce studovanou je fosforylace. Hyperfosforylovaný CRMP2 je součástí neurofibrilárních klubek [30] a zvýšená míra fosforylace proteinu CRMP2 je jednou z časných událostí vývoje Alzheimerovy nemoci [31]. CRMP2 má dvě izoformy ‒ CRMP2A o molekulové hmotnosti 75kDa a CRMP2B s molekulovou hmotností 62 kDa [32]. CRMP2A je exprimován převážně v tělech a axonech neuronů, zatímco CRMP2B se vyskytuje v dendritech nervových buněk a v oligodendrocytech [33]. CRMP2A je důležitý pro růst axonů do délky, CRMP2B umožňuje jejich větvení a růst axonů inhibuje [32].
Rovnováha v expresi obou izoforem je důležitým regulačním mechanismem růstu axonů a určení polarity neuronů. Role CRMP2 izoforem u PAS není dosud známá, ale předchozí data prokazující jejich rozdílnou regulaci, distribuci a funkci v neuronech naznačují, že autoprotilátky působící proti jednotlivých izoformám CRMP2 mohou mít rozdílný efekt na neurální vývoj [34]. Role CRMP2 v patogenezi PAS je v současné době detailně analyzována za pomoci gen-deficitních myší.
TERAPIE MAR PAS
I když specifický proces vzniku autoprotilátek proti mozku je nejasný a detailní patogenetický proces není dosud známý, identifikace cílů, proti kterým jsou zaměřeny maternální autoprotilátky, zvyšuje možnosti budoucí terapie [11]. Pokud se prokáže příčinná souvislost mezi maternálními autoprotilátkami a vznikem PAS, nabízí se možnosti takto podmíněnou PAS úspěšně léčit, respektive zabránit tomu, aby vůbec vznikla.
Podle dnešních poznatků by přicházelo do úvahy více strategií, jak předejít přenosu patogenických autoprotilátek. První strategií je odstranění autoprotilátek ex vivo, například pomocí léčebné výměnné plazmaferézy. Tato metoda je dnes úspěšně používána například u autoimunitních nervosvalových onemocnění, jako je Guillainův-Berréův syndrom, myastenia gravis nebo chronická zánětlivá demyelinizační neuropatie, dále např. u PANDAS (Pediatric Autoimmune Neuropsychiatric Disorders Associated with Streptoccocal infections, dětská autoimunní neuropsychická porucha spojená se streptokokovou infekcí), akutní diseminované encefalomyelitidy a roztroušené sklerózy [35].
Další metodou je odstranění maternálních autoprotilátek in vivo inhibicí placentárního transferu prostřednictvím neonatálního Fc receptoru. Terapie, která by saturovala neonatální Fc receptory, by zvyšovala degradaci imunoglobulinu G, tedy potenciálně degradaci maternálních autoprotilátek. Toho by se dalo docílit kompeticí s endogenními protilátkami o vazbu na neonatální Fc receptor nebo zablokováním vazby protilátek na tento receptor. Bohužel obě zmiňované metody by mohly vést k vyvolání degradace všech IgG kvůli své relativní nespecificitě [36].
Poslední metodou, kterou zmiňují autoři přehledového článku, je zabránění tvorby autoprotilátek samotných pomocí imunosupresivní léčby. Jako nadějné uvádějí autoři léky, které blokují proteazom, proteinový komplex, který selektivně proteolyticky degraduje označené bílkovinné molekuly.
Bylo by zapotřebí klinických studií, které by prokázaly bezpečnost užívání během těhotenství, stejně jako upřesnění dávkování a délky suprese. Pokud by se podařilo zabránit tvorbě maternálních autoprotilátek supresí v dostatečném předstihu, daly by se tyto léky potencionálně terapeuticky využít již před těhotenstvím [11].
ZÁVĚR
Sérum matek dětí s PAS obsahuje autoprotilátky, které působí proti proteinům vyvíjejícího se fetálního mozku. Tyto specifické proteiny jsou rozhodující pro normální vývoj mozku. Jedním z nich je collapsin response mediator protein CRMP2 potřebný pro určení polarity a růst neuronů v průběhu embryonálního vývoje nervové soustavy. Role CRMP2 v patogenezi PAS je v současné době detailně analyzována za pomoci gen-deficitních myší.
Pro objasnění kauzální úlohy CRMP2 a významu autoprotilátek proti CRMP2 proteinům na vzniku PAS u lidí bude zapotřebí dalšího výzkumu. Možnost léčby poruch autistického spektra souvisejících s maternálními autoprotilátkami je prozatím hypotetická a zdá se být dnes ještě fantazií. Specifická eliminace patologických maternálních autoprotilátek by mohla být v budoucnosti jednou z možností léčby významné části PAS.
Podpořeno grantem AZV NV18-04-00085, interním grantem č. 6030 v rámci projektu (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol) a programem UK Progres č. Q15 s názvem „Životní dráhy, životní styly a kvalita života z pohledu individuální adaptace a vztahu aktérů a institucí“.
MUDr. Iva Dudová
Dětská psychiatrická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: iva.dudova@lfmotol.cuni.cz
Zdroje
1. Fombonne E. Epidemiology of pervasive developmental disorders. Pediatr Res 2009; 65 : 591–598.
2. DSM-5 – Diagnostický a statistický manuál duševních poruch. 1. české vydání. Praha: Hogrefe - Testcentrum, 2015.
3. Gaugler T, Klei L, Sanders SJ, et al. Most genetic risk for autism resides with common variation. Nat Genet 2014; 46 (8): 881–885.
4. Hrdlička M, Komárek V (eds). Dětský autismus: přehled současných poznatků. Vyd. 2., dopl. Praha: Portál, 2014.
5. Keil A, Daniels JL, Forssen U, et al. Parental autoimmune diseases associated with autism spectrum disorders in offspring. Epidemiology 2010; 21 : 805–808.
6. Wu S, Ding Y, Wu F, et al. Family history of autoimmune diseases is associated with an increased risk of autism in children: A systematic review and meta-analysis. Neurosci Biobehav Rev 2015; 55 : 322–332.
7. Atlandottir HO, Thorsen P, Ostergaard I, et al. Maternal infection requiring hospitalization during pregnancy and autism spectrum disorders. J Autism Dev Disord 2010; 40 : 1423–1430.
8. Matelski L, Van de Water J. Risk factors in autism: Thinking outside the brain. J Autoimmun 2016; 67 : 1–7.
9. Jones KL, Pride MC, Edmiston E, et al. Autism-specific maternal autoantibodies produce behavioral abnormalities in an endogenous antigen-driven mouse model of autism. Mol Psychiatry 2018 Jun 28. dog:10.1038/s41380-018-0126.1. [Epub ahead of print].
10. Braunschweig D, Krakowiak P, Duncanson P, et al. Autism-specific maternal autoantibodies recognize critical proteins in developing brain. Transl Psychiatry 2013; 3: e277.
11. Fox-Edmiston E, Van de Water J. Maternal anti-fetal brain IgG autoantibodies and autism spectrum disorder: current knowledge and its implications for potential therapeutics. CNS Drugs 2015; 29 : 715–724.
12. Jones KL, Van de Water J. Maternal autoantibody related autism: mechanisms and pathways. Mol Psychiatry 2019; 24 : 252–265.
13. Edmiston E, Ashwood P, Van de Water J. Autoimmunity, autoantibodies, and autism spectrum disorders (ASD). Biol Psychiatry 2017; 81 (5): 383–390.
14. Bagasra O, Heggen C. Autism and Environmental Factors. NJ: Wiley, 2018.
15. Karpiak SE Jr, Rapport MM. Behavioral changes 2-month-old rats following prenatal exposure to antibodies against synaptic membranes. Brain Res 1975; 92 : 405–413.
16. Rick JT, Gregson AN, Leibowitz S, Adinolfi M. Behavioural changes in adult rats following administration of antibodies again brain gangliosides. Dev Med Child Neurol 1980; 22 : 719–724.
17. Martin LA, Ashwood P, Braunschweig D, et al. Stereotypies and hyperactivity in rhesus monkeys exposed to IgG from mothers of children with autism. Brain Behav Immune 2008; 22 (6): 806–816.
18. Bauman MD, Josif AM, Ashwood P, et al. Maternal antibodies from mothers of children with autism alter brain growth and social behavior development in the rhesus monkey. Transl Psychiatry 2013; 3: e278.
19. Singer HS, Morris C, Gause C, et al. Prenatal exposure to antibodies from mothers of children with autism produces neurobehavioral alterations: A pregnant dam mouse model. J Neuroimmunol 2009; 211 (1–2): 39–48.
20. Braunschweig D, Ashwood P, Krakowiak P, et al. Autism: Maternally derived antibodies specific for fetal brain proteins. Neurotoxicology 2008; 29 : 226–231.
21. Croen LA, Braunschweig D. Maternal mid-pregnancy autoantibodies to fetal brain protein: the early markers for autism study. Biol Psychiatry 2008; 64 : 583–588.
22. Braunschweig D, Duncaston P, Boyce R, et al. Behavioral correlates of maternal antibody status mong chidren with autism. J Autism Dev Disord 2011; 42 : 1435–1445.
23. Courchesne E, Karns CM, Davis HR, et al. Unusual brain growth patterns in early life in patients with autistic disorder: an MRI study. Neurology 2001; 57 : 245–254.
24. Nordahl CW, Lange N, Li DD, et al. Brain enlargement is associated with regression in preschool-age boys with autism spectrum disorders. Proc Natl Acad Sci U S A 2011; 108 : 20195–20200.
25. Nordahl CW, Braunschweig D, Iosif AM, et al. Maternal autoantibodies are associated with abnormal brain enlargement in a subgroup of children with autism spectrum disorder. Brain Behav Immun 2013; 30 : 61–65.
26. Lin PC, Chan PM, Hall, C, Manser E. Collapsin response mediator proteins (CRMPs) are a new class of microtubule-associated protein (MAP) that selectively interacts with assembled microtubules via a taxol-sensitive binding interaction. J Biol Chem 2011; 286 : 41466–41478.
27. Wang LH, Strittmatter SM. A family of rat CRMP genes is differentially expressed in the nervous system. J Neurosci 1996; 16 : 6197–6207.
28. Škrlantová A. Změny fosforylace proteinu CRMP2 spjaté s patogenezí Alzheimerovy choroby a jejich vliv na funkci neuronů. Bakalářská práce. Praha: Univerzita Karlova v Praze. Přírodovědecká fakulta, 2015.
29. Nakamura H, Yamashita N, Kimura A, et al. Comprehensive behavioral study and proteomic analyses of CRMP2-deficient mice. Genes Cells 2016; 21 : 1059–1079.
30. Gu Y, Hamajima N, Ihara Y. Neurofibrillary tangle-associated collapsing response mediator protein-2 (CRMP-2) is highly phosphorylated on The-509, Ser-518, and Ser-522. Biochemistry 2000; 39 : 4267–4275.
31. Cole AR, Soutar MPM, Rembutsu M, et al. Collapsin response mediator protein-2 hyperphosphorylation is an early event in Alzheimer`s disease progression. J Neurochem 2007; 103 : 1132–1144.
32. Yuasa-Kawada J, Suzuko R, Kano F, et al. Axonal morphogenesis controlled by antagonistic roles of two CRMP subtypes in microtubule organization. Eur J Neurosci 2003; 17 : 2329–2343.
33. Bretin S, Reibel S, Charrier E, et al. Differential expression of CRMP1, CRMP2A, CRMP2B, and CRMP5 in axons or dendrites of distinct neurons in the mouse brain. J Comp Neurol 2005; 486 : 1–17.
34. Balastik M, Zhou XZ, Alberich-Jorda M, et al. Prolyl isomerase Pin1 regulates axon guidance by stabilizing CRMP2A selectively in distal axons. Cell Rep 2015; 13 (4): 812–828.
35. Bednařík J. Léčebná výměnná plazmaferéza v léčbě autoimunitních nervosvalových onemocnění. Neurol praxi 2011; 12 (6): 394–397.
36. Vaccaro C, Zhou J, Ober RJ, Ward ES. Engineering the Fc region of immunoglobulin G to modulate in vivo antibody levels. Nat Biotechnol 2005; 23 (10): 1283–1288.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2019 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Editorial: Dětská a dorostová psychiatrie ve 21. století
- Longitudinální sledování vývoje sociálních schopností u pacientů s autismem: problematika spolehlivosti rodičovské výpovědi v telefonickém interview
- Význam maternálních autoprotilátek při vzniku poruch autistického spektra
- Možnosti farmakoterapie depresívnej poruchy u detí a adolescentov
- Specifika posttraumatické stresové poruchy v dětství a dospívání
- Psychiatrické poruchy s převahou somatických projevů v dětství a adolescenci
- Vplyv dlhodobej kortikoterapie na kostné zdravie u detí s idiopatickým nefrotickým syndrómom
- Odešel prof. MUDr. Josef Koutecký, DrSc.
- Intrakraniální krvácení u pacientů s hemofilií A
- Dieťa s príznakmi akútneho zápalu hrtana na urgentnom príjme – analýza súboru pacientov ošetrených v rokoch 2016 a 2017
- Profesor Dr. Leopold Moll *2. 3. 1877 Česká Lípa – ✞21. 2. 1933 Vídeň
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Specifika posttraumatické stresové poruchy v dětství a dospívání
- Psychiatrické poruchy s převahou somatických projevů v dětství a adolescenci
- Možnosti farmakoterapie depresívnej poruchy u detí a adolescentov
- Význam maternálních autoprotilátek při vzniku poruch autistického spektra
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



