-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transplantace kmenových buněk krvetvorby v terapii akutní lymfoblastické leukémie dětského věku
Hematopoietic stem cell transplantation in therapy of acute lymphoblastic leukemia in children
Hematopoietic stem cell transplantation is a therapeutic method used in a variety of malignant and non-malignant diseases. Acute lymphoblastic leukemia is the most common diagnosis indicated for this treatment in children. History of successful transplantation has begun in the late sixties, more widespread application in the treatment of childhood leukemia occurred since the nineties. The transplantation is from the beginning focused on patients with a very poor prognosis. Pretransplant preparative regimen using total body irradiation or high dose chemotherapy performs suppression of malignant cells clone. Gradual reconstitution of donor immune system after transplantation leads not only to recovery of anti-infective immunity but also to reduction of relapse risk due to anti-leukemic effect. Continuously improving results of transplantation are achieved by progress in basic treatment of leukemia leading to refinement of indication criteria, better timing of transplantation in more favorable state of remission. Many other factors are involved in reducing the incidence and improving the prognosis of severe post-transplant complications. The aim of the prospective multicenter studies is to ensure standards of care and obtain valid data enable more thorough analyses.
This article summarizes the history of transplantation and current indication criteria in children with acute lymphoblastic leukemia, describes the process of preparation and transplantation, delineates issues of transplantation-related complications and their solution.Key words:
hematopoietic stem cell transplantation, acute lymphoblastic leukemia, indication criteria, preparative regimen, graft versus host disease, toxic complications, relapse
Autoři: P. Říha
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. J. Starý, DrSc
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (2): 114-128.
Kategorie: Dětské akutní leukémie
Souhrn
Transplantace kmenových buněk krvetvorby je léčebnou metodou využívanou u řady maligních i nemaligních onemocnění. V dětském věku představuje akutní lymfoblastická leukémie nejčastější diagnózu indikující k této léčbě. Historie úspěšných transplantací začíná na konci šedesátých let minulého století, k většímu rozšíření v terapii dětských leukémií dochází od let devadesátých. Transplantace je od počátku cílena na pacienty s velmi nepříznivou prognózou. Předtransplantační přípravný režim s použitím celotělového ozáření či vysokodávkované chemoterapie způsobí potlačení klonu maligních buněk. Postupná obnova funkce dárcovského imunitního systému po transplantaci vede nejen k návratu protiinfekční obranyschopnosti, ale protileukemickým efektem také ke snížení rizika relapsu. Trvale zlepšujících se výsledků transplantace je dosahováno pokrokem v základní léčbě leukémie vedoucím k zpřesňování indikačních kritérií, dosažení příznivějšího stavu remise a načasování transplantace. Na snížení výskytu a zlepšení prognózy vážných potransplantačních komplikací se podílí řada dalších faktorů. Cílem prospektivních multicentrických studií je zajištění standardů péče i získávání validních dat umožňujících důkladnější analýzy.
Článek shrnuje historii transplantací a současná indikační kritéria u dětí s akutní lymfoblastickou leukémií, popisuje proces přípravy a provedení transplantace, přibližuje problematiku potransplantačních komplikací a jejich řešení.Klíčová slova:
transplantace kmenových buněk krvetvorby, akutní lymfoblastická leukémie, indikační kritéria, přípravný režim, reakce štěpu proti hostiteli, toxické komplikace, relapsÚvod
Od prvních úspěšných alogenních transplantací hematopoetických kmenových buněk (HSCT) provedených v roce 1968 u dětí s těžkou vrozenou poruchou imunity bylo celosvětově provedeno více než 1 milion transplantací pro maligní i nemaligní onemocnění. V průběhu uplynulých 40 let se HSCT stala součástí terapie akutních leukémií dětského věku a diagnóza akutní lymfoblastické leukémie (ALL) představuje nejčastější indikaci k transplantaci (Tx) u dětí.
Historie HSCT
Historie HSCT začíná ve 40. letech minulého století prvními experimenty na zvířecích modelech. Letálně ozářené myši byly v pokusech schopny přežít po aplikaci vlastních buněk kostní dřeně odebraných před ozářením nebo po retransplantaci vlastní sleziny. V padesátých letech byly potvrzeny teorie o obnově krvetvorby z hematopoetických kmenových buněk kostní dřeně a pozornost se obrací k jejímu potenciálnímu využití u maligních hematologických nemocí a selhání kostní dřeně. Primárním zájmem do té doby prováděného výzkumu byla především ochrana a terapie pacientů zasažených ionizujícím zářením při výbuchu jaderné bomby či havárii jaderné elektrárny. V roce 1957 byla publikována první práce popisující podání alogenního štěpu u 6 pacientů v terminální fázi maligního hematologického onemocnění. Pouze u jednoho z nich bylo dokumentováno přechodné přihojení a toto selhání provázelo v následujících letech většinu dalších pokusů. Neúspěch v klinické praxi vedl k návratu k intenzivní výzkumné práci soustředěné na biologii transplantace.
Zásadní význam mělo objevení existence hlavního histokompatibilního systému. V roce 1966 byla detailně popsána biologie reakce štěpu proti hostiteli, nazývaná tehdy sekundární nemocí, incidence a intenzita nemoci byla vztažena k antigenním rozdílům mezi dárcem a příjemcem. V roce 1968 byla provedena první ze tří úspěšných alogenních transplantací kostní dřeně u dětí s vrozenou těžkou poruchou imunity. Tyto děti nepotřebovaly z důvodu těžkého imunodeficitu předtransplantační imunosupresi v podobě ozařování a po úspěšném přihojení všechny tři dlouhodobě přežily. V průběhu roku 1968 se v Seattlu na podkladě vědeckého grantu začal konstituovat multioborový tým zaměřený na rozvoj HSCT se zvláštním důrazem na kvalitu potransplantační klinické péče. Tento tým publikoval v roce 1975 souhrn zkušeností, které se staly základem pro další rozvoj transplantací, zdůraznil význam histokompatibility, popsal techniky transplantace a následnou podpůrnou léčbu, nastínil možnost využití nepříbuzných dárců. Objevují se termíny „reakce štěpu proti leukémii“ a „adoptivní imunoterapie“. V roce 1979 byla poprvé publikována úspěšná transplantace od nepříbuzného dárce u pacienta s leukémií. Tento úspěch výrazně ovlivnil vznik prvních registrů dobrovolných dárců kostní dřeně. Objev imunosupresivního efektu cyklosporinu A a jeho uvedení do klinické praxe v prevenci rozvoje reakce štěpu proti hostiteli (GVHD) v polovině osmdesátých let znamenal další krok k zlepšení výsledků hlavně nepříbuzenských transplantací. Efekt prokázal především v kombinaci s do té doby používaným metotrexátem.
Od konce padesátých let se také rozvíjí snahy o využití autologního štěpu hematopoetických kmenových buněk (HSC). Z důvodu nedostatku shodných příbuzenských dárců, nezkušenosti a omezeného přístupu k nepříbuzenským dárcům a s ohledem na senzitivitu leukémií k vysokodávkované chemoterapii byl tento postup u akutních leukémií poměrně široce používán v 80. a na počátku 90. let především v Evropě. Pro vysoký výskyt relapsů byly jeho výsledky neuspokojivé a v dalším vývoji se od autologních Tx u dětských pacientů s akutní leukémií až na určité výjimky ustoupilo. U autologních transplantací bylo časně využito poznatku, že v krvi cirkulující HSC jsou také schopné obnovy krvetvorby. Jejich získání technikou aferézy významně ulehčila komerční výroba hematopoetických růstových faktorů, po jejichž aplikaci mnohonásobně vzrůstá množství HSC v krvi. Po stimulaci růstovým faktorem a separaci HSC z krve získáváme štěpy periferních kmenových buněk (PBSC), které se k širšímu využití při alogenních HSCT dostávají v druhé polovině devadesátých let. S průkazem účinnosti a zlepšujícími se výsledky dlouhodobého přežívání po HSCT rostla snaha poskytnout tuto léčebnou modalitu všem potřebným pacientům. Přes rozvoj programů alogenních nepříbuzenských transplantací a prudký nárůst počtu dobrovolných dárců ve vznikajících registrech zůstávala stále velká část pacientů bez vhodného dárce. Jako alternativní postupy se proto začaly rozvíjet metody transplantace pupečníkovou krví a transplantace od HLA neshodného příbuzného dárce (haploidentické transplantace) [1].
Historie HSCT u dětí s ALL
První práce shrnující zkušenosti transplantačních center s dětskými pacienty s relapsy ALL a HSCT od shodného sourozeneckého dárce (MSD) se v literatuře objevují v druhé polovině osmdesátých let. Dlouhodobé přežití se v těchto souborech pohybovalo v rozmezí 40–64 % pro pacienty transplantované v druhé kompletní remisi (CR2), horší výsledky měly děti transplantované v pozdějších fázích nemoci (≥CR3). Tyto výsledky znamenaly jednoznačně zlepšení prognózy pro děti s relapsem leukémie. Na počátku 80. let vzniká řada léčebných protokolů velkých pracovních skupin zaměřených na terapii dětské ALL, jejichž aplikace vedla postupně k výraznému zlepšení celkových výsledků léčby. V rámci těchto protokolů bylo věnováno nemalé úsilí identifikaci podskupin pacientů se špatnou prognózou na stávající terapii. Byla potvrzena významně horší prognóza pacientů s translokací (9,22), (4,11), dětí špatně odpovídajících na iniciální fázi léčby.
Narůstající zkušenosti a povzbudivé výsledky u pa-cientů podstupujících HSCT v druhé remisi a přetrvávající špatné výsledky podskupin pacientů s velmi vysokým rizikem relapsu na konvenční chemoterapii vedly v průběhu osmdesátých let k rozšíření indikací k HSCT od shodného sourozeneckého dárce i na děti v první remisi leukémie (CR1). Větší publikované soubory dětských pacientů s ALL transplantovaných od sourozeneckých dárců v CR1 v osmdesátých letech a první polovině devadesátých let prokázaly významnou redukci relapsů, ale také zvýšenou mortalitu spojenou s komplikacemi transplantace. Především však zlepšení celkového přežití v porovnání s konvenční chemoterapií. Přežití bez nemoci (DFS) se v publikovaných souborech z tohoto období pohybuje v rozmezí 58–84 % (Francie, UK, skandinávské země, USA). DFS těchto pacientů na konvenční chemoterapii bylo v této době méně než 15 % [1]. Na sourozenecké transplantace navázaly v devadesátých letech nepříbuzenské transplantace u pacientů, kteří rodinného dárce postrádali. K redukci výskytu těžkých forem akutní reakce štěpu proti hostiteli (aGVHD) a snížení transplantační mortality (TRM), kterou byly zatíženy počátky nepříbuzenských HSCT, přispělo významně zlepšení výběru a dostupnosti dárců. Zavedení molekulárně genetických metod typizace znaků hlavního histokompatibilního systému (HLA) zajistilo lepší shodu mezi příjemcem a dárcem, rozvoj systému registrů dobrovolných dárců zlepšil jejich nabídku. Významným přínosem v hodnocení odpovědi na chemoterapii, stratifikaci do rizikových skupin v průběhu základní léčby a indikaci k HSCT bylo zavedení monitorování minimální reziduální nemoci (MRN) prostřednictvím specifických klonálních přestaveb těžkých řetězců imunoglobulinů a T buněčných receptorů (IgH/TCR) metodou kvantitativní PCR. Pro pacienty v primární léčbě znamenal tento přístup identifikaci velmi rizikových dětí se špatnou prognózou, které do té doby nebyly rozpoznány pomocí tzv. „klasických kritérií“, tedy genových přestaveb, jako jsou translokace (9;22), (4;11) a odpovědi na iniciální léčbu hodnocenou podle hematologických kritérií (odpověď na prednisonovou předfázi a dosažení hematologické remise 33. den indukční léčby).
V letech 2000–2006 provedlo konsorcium německé a italské pracovní skupiny pro ALL rozsáhlou mezinárodní studii (AIEOP – BFM-ALL 2000), ve které byli pacienti stratifikováni do rizikových skupin na základě MRN den 33 a týden 12 léčby. Hodnota MRN ve 12. týdnu léčby se stala jedním ze samostatných indikačních kritérií k HSCT v první remisi nemoci [2]. Děti s relapsem ALL představovaly od počátku početně významnější část transplantovaných. Data publikovaná v devadesátých letech potvrzovala, že prognóza pacientů s relapsem ALL je závislá především na délce trvání první remise. Analýza relapsů z databáze studií německé BFM pracovní skupiny (ALL-REZ BFM studie) z období 1983–1998 ukázala v souladu s výsledky vyplývajícími z dat dalších pracovních skupin a větších center, že děti s nejrizikovějšími typy relapsu mají bez transplantace EFS (event free survival = přežití bez události, kterou je relaps nebo úmrtí na toxicitu léčby) méně než 5 %. Do této skupiny patřily především časné a velmi časné relapsy B prekurzorové ALL (BCP ALL) s postižením dřeně a jakékoliv dřeňové relapsy T ALL. Stejná skupina dětí měla na následujícím protokolu ALL-REZ BFM95/96 v průběžné analýze provedené v roce 2001 lepší prognózu při použití HSCT s 5letým EFS 37 ± 6 %. Současně byla prokázána uspokojivá prognóza po chemoterapii pro děti s pozdním izolovaným mimodřeňovým relapsem, nepotřebující další intenzifikaci léčby [3, 4]. Výsledky uvedené analýzy se staly základem pro stratifikaci a indikaci pacientů k HSCT v relapsovém protokolu ALL-REZ BFM 2002 otevřeném v roce 2002. Rozdělení do rizikových skupin zohledňovalo kromě doby manifestace relapsu také jeho lokalizaci (dřeňový, mimodřeňový, kombinovaný), imunofenotyp blastů (původ z B nebo T prekurzorové linie lymfocytů), jejich počet v periferní krvi, pozitivitu bcr-abl mutace. Pro pozdní dřeňové relapsy byla stanovena indikace k HSCT na základě odpovědi na iniciální léčbu hodnocené podle MRN. Na základě potřeby sjednocení transplantačních postupů, získání porovnatelných dat s lepší možností jejich vyhodnocení a zlepšení výsledků HSCT u dětí s ALL zahájila BFM pracovní skupina v roce 2003 mezinárodní prospektivní multicentrickou studii SZT-BFM-ALL 2003. Indikační kritéria k HSCT reflektovala soudobé protokoly primární a relapsové léčby, byly stanoveny předpoklady (HR HLA typizace v 10 znacích) a kritéria výběru dárců pro jednotlivé indikační skupiny, jednotný přípravný režim včetně imunosupresivní terapie a jejího vysazování. Studie byla v roce 2007 rozšířena pro nábor pacientů z více zemí a transplantačních center včetně České republiky (ALL SCT I-BFM 2006) [5].
Současnost
V důsledku lepší stratifikace a intenzifikace léčby pro pacienty vysokého rizika se ve stávajících léčebných protokolech daří vyléčit stále více pacientů. Pomocí MRN určené molekulárně geneticky a/nebo průtokovou cytometrií (FACS) jsou také dosud nejlépe identifikovány děti mající prospěch z HSCT provedené v první remisi nemoci. Zkušenost transplantačních týmů, standardizace transplantačních postupů, zlepšování podpůrné péče vedly k snížení léčebných komplikací do té míry, že se rozdíly ve výsledcích transplantací od shodných rodinných a nepříbuzných dárců staly nevýznamnými. Vzrůstající mezinárodní spolupráce vrcholí v projektu „ALL SCTped 2012 Forum“, multicentrické prospektivní randomizované mezinárodní klinické studii fáze III, otevírající se postupně od roku 2013 náboru dětských pacientů v řadě evropských i mimoevropských center.
Indikace k HSCT pro děti s ALL
Pacienti jsou indikováni k HSCT na základě faktorů určujících jejich prognózu při léčbě konvenční chemoterapií. Většina pracovních skupin definuje jako velmi rizikové pacienty s potenciální indikací k HSCT ty, jejichž EFS je bez HSCT méně než 50 %. Konkrétní indikace k HSCT jsou určené léčebnými protokoly, podle kterých jsou děti léčeny při primární diagnóze či relapsu, odráží aktuální poznatky o prognóze a její porovnání s výsledky HSCT. Případné změny v indikačních kritériích jsou upravovány formou dodatků k stávajícím protokolům. Indikace k HSCT pro děti s ALL používané v současnosti v ČR jsou shrnuty v tabulce 1 (pacienti v první remisi nemoci) a tabulce 2 (relapsy).
Tab. 1. Indikace k HSCT u pacientů v první remisi nemoci (CR1). 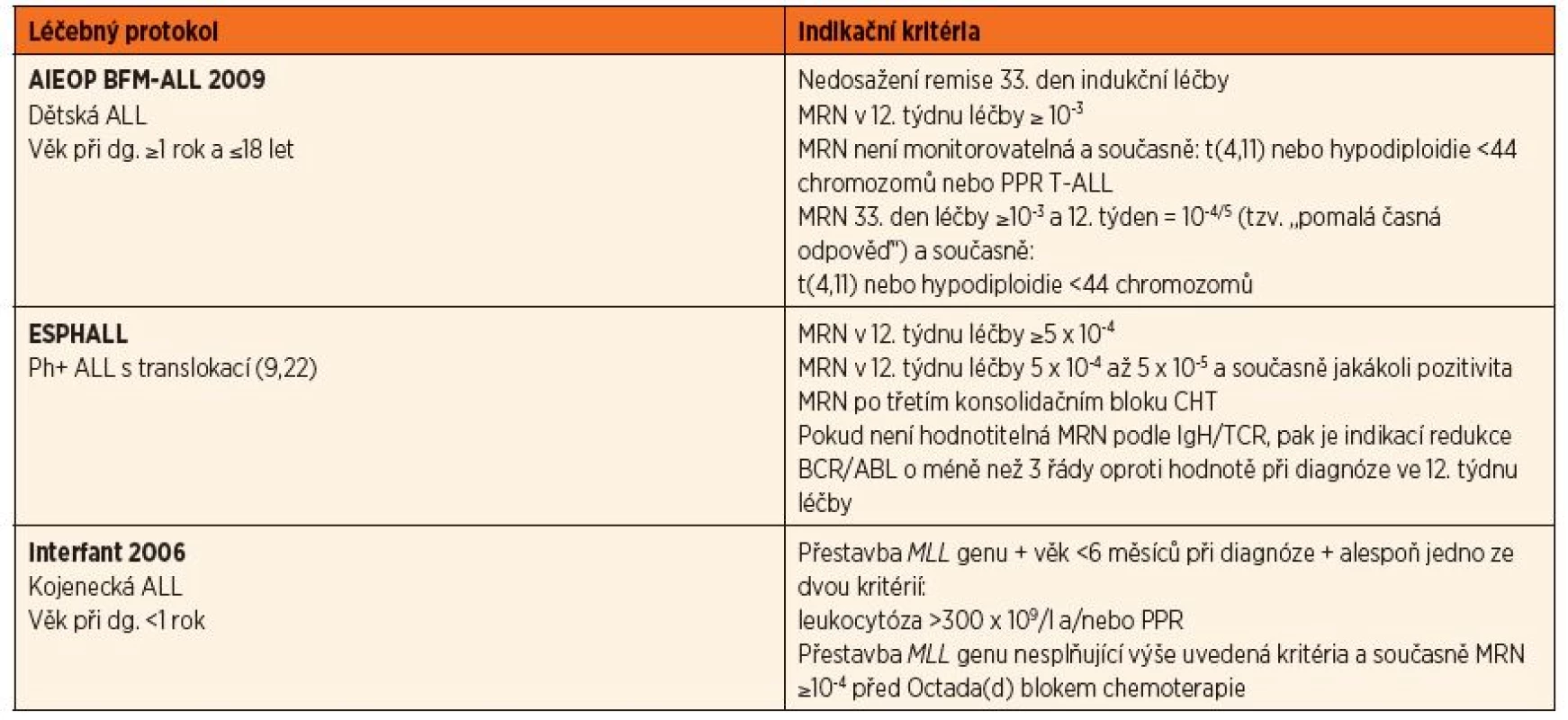
Tab. 2. Indikace k HSCT u pacientů s relapsem nemoci v druhé a další remisi (≥CR2). 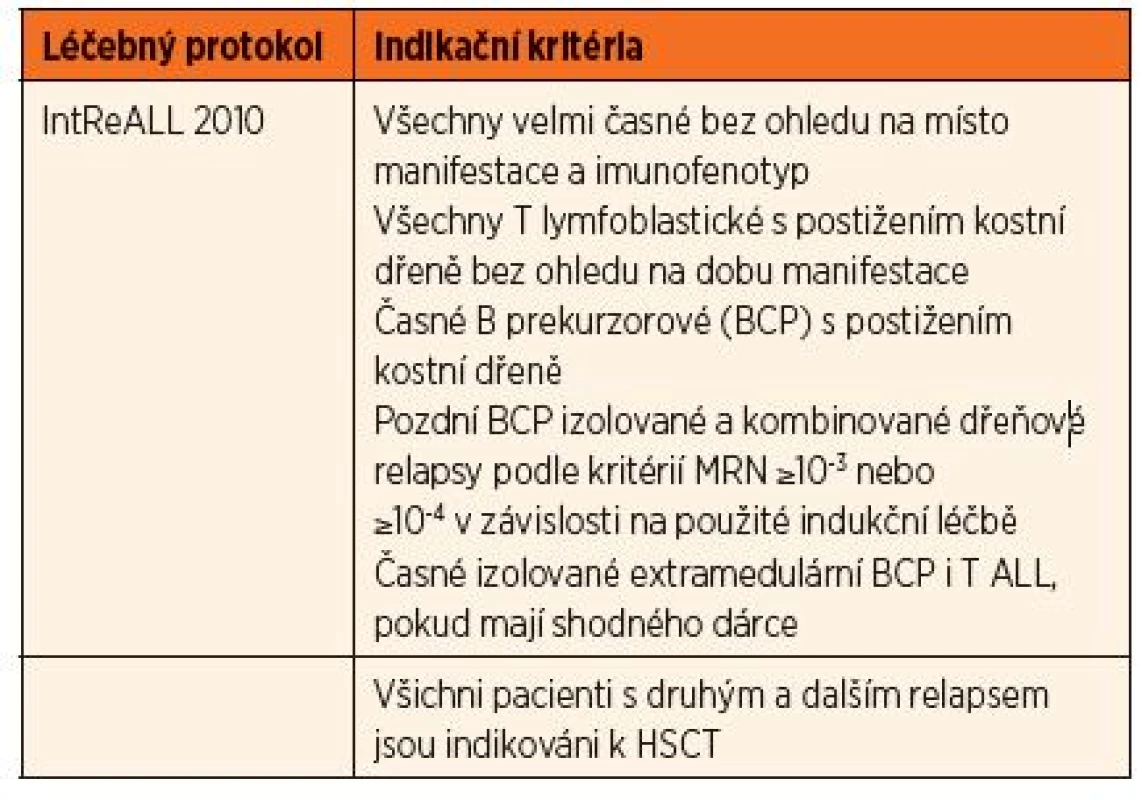
Rozdělení na velmi časné, časné a pozdní relapsy viz tab. 3 Indikace podle jednotlivých protokolů v CR1
AIEOP BFM-ALL 2009
Samostatným kritériem v indikaci k HSCT je odpověď na iniciální léčbu vypovídající o senzitivitě nádorových buněk k chemoterapii. Pacienti, kteří nedosáhnou 33. den od zahájení léčby (TP1 – time point 1) hematologické remise, jsou indikováni k HSCT bez ohledu na všechny ostatní ukazatele. Všechny ostatní indikace jsou na základě hodnot MRN v dvanáctém týdnu (TP2) trvání terapie. Vysokou hodnotou MRN indikující k HSCT bez ohledu na jakékoli jiné parametry nemoci je ≥10–3. Kromě výše uvedených kritérií platných u všech pacientů se u dětí s t(4,11) nebo hypodiploidií s méně než 44 chromozomy indikuje HSCT také v případě tzv. pomalé časné odpovědi na léčbu (SER – slow early response), znamenající hodnoty MRN v TP1 ≥10–3 a v TP2 = 10–4/5. Z dětí, které nemají hodnotitelnou MRN pomocí PCR, jsou indikovány k HSCT v CR1 pouze ty, u kterých je současně prokázána t(4,11), hypodiploidie <44 chromozomů a také děti s T lymfo-blastickou ALL, které odpověděly nedostatečně na úvodní prednisonovou léčbu (PPR – prednisone poor response).
Interfant 2006
Indikovány jsou všechny děti s kojeneckou leukémií splňující kritéria vysokého rizika, tedy věk při diagnóze méně než 6 měsíců společně s prokázanou přestavbou MLL genu a současně alespoň s jedním ze dvou následujících kritérií, kterými jsou leukocytóza více než 300 x 109/l při diagnóze a/nebo špatná odpověď na iniciální léčbu prednisonem (PPR). Děti s MLL přestavbou, které nesplňují plně výše uvedená kritéria pro HR, a ty, u kterých je MLL status neznámý, jsou indikovány k HSCT v CR1 při hodnotě MRN ≥10–4 před podáním pátého bloku chemoterapie Octada(d). Všichni ostatní indikováni nejsou.
EsPhALL
U dětí s Ph+ leukémií je indikací k HSCT opět hodnota MRN (PCR IgH/TCR). Pro pacienty, kteří nemají v uvedeném systému identifikovatelné specifické cíle, je určující stanovení MRN podle množství BCR/ABL transkriptu (PCR). Pokud ve vzácných případech není ani tento postup informativní, může být použita v indikaci průtoková cytometrie se stejnými kvantitativními kritérii, jaká platí pro molekulární metody. Indikováni jsou pacienti, kteří v časovém bodě TP2 mají hodnotu MRN ≥5 x 10-4 v IgH/TCR, případně redukci v PCR BCR/ABL o méně než 3 řády oproti hodnotě stanovené při diagnóze. Děti s MRN v rozmezí 10–4 až 10–5 ve výše uvedeném časovém bodě a současně s jakoukoli pozitivitou po třetím konsolidačním HR bloku jsou také indikovány k Tx v CR1.
Indikace v CR ≥2
Pod záštitou mezinárodní BFM studijní skupiny (I-BFM SG) vzniká v roce 2009 pracovní skupina pro rezistentní nemoci (Resistant Disease Committee) sdružující zástupce jednotlivých národních skupin pro léčbu relapsů ALL. Na základě analýzy výsledků dosavadních léčebných postupů byly touto skupinou připraveny nové léčebné protokoly, jejichž součástí je také indikace k HSCT. Pro stratifikaci pacientů s relapsem je nadále určujícím kritériem časový interval, který uplynul od stanovení primární diagnózy a ukončení udržovací léčby k datu stanovení diagnózy relapsu rozdělující skupinu na velmi časné, časné a pozdní relapsy (tab. 3.), dále místo manifestace (izolovaný dřeňový, kombinovaný dřeňový a mimodřeňový) a imunofenotyp blastů. Děti početné skupiny pozdních relapsů postihujících kostní dřeň (izolované dřeňové a kombinované) jsou indikovány také na základě odpovědi na iniciální léčbu posuzované podle hodnoty MRN.
Tab. 3. Kritéria rozdělení relapsů na velmi časné, časné a pozdní. 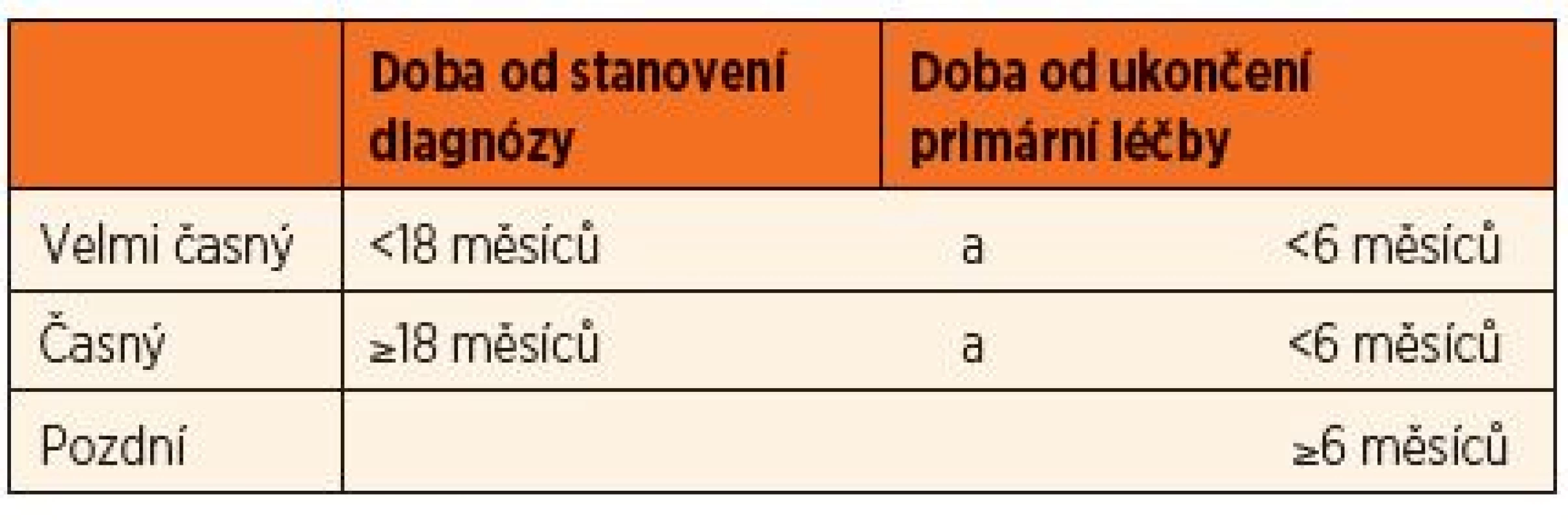
Příprava transplantace
Dostupnost vhodného dárce je jedním z hlavních parametrů úspěšnosti Tx. Testování a porovnávání HLA znaků pacienta i dárce je nutné provést pomocí molekulárně genetické metody genotypizací na úrovni rozlišení sekvence nukleotidů (high resolution – HR) v deseti alelách lokusů A, B, C, DRB1 a DQB1. Rozlišení na této tzv. alelické úrovni je přesnější a v současné době je standardem při výběru nepříbuzenských dárců. Low resolution (LR) vyšetření stanovuje typ HLA na úrovni antigenu, určí příslušnost HLA molekuly k alelické skupině, používá se především v počátečním testování potenciálních rodinných dárců, v tzv. rodinné studii. Pravděpodobnost HLA shody mezi sourozenci či rodinnými dárci (shodný rodič je výjimkou) je kolem 20 %, pravděpodobnost nalezení vhodného nepříbuzného dárce je značně závislá na etnické příslušnosti.
Algoritmus hledání dárce u pacienta indikovaného k Tx začíná vyšetřením HLA rodičů a sourozenců. Shodný sourozenecký, případně rodinný dárce má vždy přednost před dárcem nepříbuzným. Pokud rodinný dárce není k dispozici, začíná hledání v registrech nepříbuzenských dárců. Celosvětová databáze Bone Marrow Donor Worldwide registrující více než 25 milionů dospělých dárců a 600 tisíc štěpů pupečníkové krve je dostupná pro lékařské transplantační týmy k získání rychlé orientační informace o potenciálních dárcích [6]. Přesné vytipování dárců, jejich kontaktování, ověření zdravotního stavu, doplnění laboratorních vyšetření včetně konfirmace HLA probíhá prostřednictvím národních registrů. Na základě zhodnocení výsledků doplňujících vyšetření a informací o jednotlivých dárcích dochází ke konečné volbě a požádání o termín odběru. Pokud možno si vždy ponecháváme jednoho dárce jako rezervu pro případ selhání odběru dárce prvního. Celá procedura od zahájení vyhledávání dospělého nepříbuzného dárce po realizaci odběru trvá běžně kolem šesti týdnů, nejméně však 4 týdny. Rychleji dostupný je zamražený štěp pupečníkové krve. V případě naléhavé potřeby je možné jej získat i během několika dnů.
Vyhledávání nepříbuzného dárce je třeba začít ihned po naplnění indikačních kritérií. Identifikovaný dárce je pak v registru pro budoucí HSCT blokován. Standardním dárcem je v současnosti HLA identický sourozenec (MSD – match sibling donor), vzácně je shodný jeden z rodičů (MFD – match family donor) a také shodný nepříbuzný dárce se shodou v nejméně devíti z deseti znaků (9/10 nebo 10/10 MUD – match unrelated donor). Pupečníková krev (UCB) je z důvodu větší imunitní tolerance běžně testována a její shoda je posuzována v šesti alelách. V lokusech A a B na antigenní (LR) a v DRB1 na alelické (HR) úrovni. Za shodný je považován štěp UCB identický nejméně v 5 z uvedených 6 znaků. Pro děti, které nenajdou dárce splňující výše uvedená kritéria, je možností transplantace od alternativního dárce. Za ty jsou v současnosti považováni nepříbuzný dárce se shodou v méně než 9 znacích (7–8/10 MMUD – mismatch unrelated donor), haploidentický, tedy neshodný rodinný dárce (MMFD – mismatch family donor) či pupečníková krev se shodou 4/6. Transplantace od alternativních dárců mají horší výsledky v důsledku vyšší mortality na komplikace transplantace (TRM) i vyššího výskytu relapsů po Tx [7]. Proto jsou k tomuto postupu indikovány pouze skupiny velmi rizikových pacientů, mezi které patří všechny velmi časné relapsy, všechny relapsy T ALL s izolovaným i kombinovaným postižením dřeně, dále časné izolované dřeňové relapsy BCP ALL a také časné kombinované BCP ALL relapsy se špatnou odpovědí na iniciální léčbu hodnocenou podle MRN. V první remisi pak děti, které nedosáhnou hematologické remise den 33 indukce (IF – induction failure), a všechny s vysokou hodnotou MRN (≥10–2) (TP2). Žádný z výše uvedených alternativních postupů nebyl prokázán jako jednoznačně výhodnější a jejich volba je i v současném mezinárodním protokolu plně v kompetenci transplantačního centra. Závisí na jeho preferenci a zkušenostech s jednotlivými postupy a na individuální situaci pacienta.
Při výběru dárce zohledňujeme další parametry, kterými jsou kombinace CMV statutu dárce a příjemce (důležitá je především CMV pozitivita dárce při pozitivitě příjemce), pohlaví (pro chlapce je vhodnějším dárcem muž, u dárkyň dáváme pro riziko aloimunizace v těhotenství přednost těm, které dosud nebyly gravidní) a věk dárce s preferencí mladších. Standardem u sourozeneckých transplantací je použití štěpu kostní dřeně. Štěp PBSC od sourozence vede k nepřiměřeně vysokému výskytu chronické extenzivní reakce štěpu proti hostiteli (GVHD) zhoršující dlouhodobé výsledky léčby.
U nepříbuzenských transplantací je první volbou také kostní dřeň, použití PBSC je i zde zatíženo vyšším výskytem chronické GVHD, rozdíly ale nejsou tak výrazné a v praxi jsou situace, kdy požadujeme přednostně štěp PBSC. Konečné rozhodnutí o způsobu odběru štěpu při nepříbuzenské HSCT spočívá na dárci. Transplantace pupečníkové krve (CBTx) od sourozence je možná v případě, kdy je štěp zamražen ve veřejné bance pupečníkové krve. Je tomu tak hlavně u dětí s diagnózou leukémie, u kterých je v případě narození sourozence pupečník mražen plánovaně. Nepříbuzenská CBTx je variantou v případě, že pacient nemá vhodného shodného rodinného či nepříbuzného dospělého dárce a pupečník nabízí shodu v nejméně 5 z 6 testovaných znaků. CBTx je za těchto podmínek považována za standardní postup, i když jsou její výsledky v porovnání se sourozeneckými nebo dospělými shodnými dárci horší. Vhodnější je u malých dětí, u kterých je s ohledem na jejich hmotnost významně lepší buněčnost štěpu. Buněčný obsah štěpů se hodnotí podle počtu CD34 pozitivních a jaderných buněk na kilogram hmotnosti příjemce, zohledňuje se také množství příměsi CD3+ buněk.
Přípravný režim a imunosupresivní léčba
Zahájení přípravného režimu přímo navazuje na předchozí chemoterapii, termín transplantace je třeba určit v době objednání odběru štěpu, tedy několik týdnů před samotným zahájením přípravného režimu. Interval od podání předchozí chemoterapie k zahájení přípravy by měl být 3–5 týdnů. Cytotoxický efekt přípravného režimu má za cíl provést dostatečnou imunosupresi k umožnění přihojení dárcovských buněk a eradikovat v maximální možné míře reziduální leukemické buňky. Historický vývoj směřoval od celotělového ozáření (TBI) v jedné dávce přes frakcionované ozáření ke kombinaci TBI s cyklofosfamidem. Ve snaze o redukci toxicity a zvýšení efektu přípravy následovaly pokusy nahradit cyklofosfamid (Cyc) či přidat do kombinace s ním a TBI jiná vysokodávkovaná cytostatika. Německá centra publikovala na konci osmdesátých let své zkušenosti s kombinací TBI + Vepesid (VP-16) s výslednou redukcí výskytu relapsů. Pozdní následky celotělového ozáření ovlivňující po mnoha letech po terapii morbiditu i mortalitu pacientů v důsledku výskytu sekundárních malignit, endokrinních deficitů apod. vedou nadále ke snaze nahradit celotělové ozáření v přípravě dětských pacientů s ALL, tak jak se to podařilo u většiny ostatních diagnóz. Nově otevřená studie ALL SCTped 2012 srovnává prospektivním randomizovaným způsobem u dětí od 4 let výsledky léčby po přípravě TBI (12 Gy) + Vepesid s výsledky režimů Busilvex + Fludarabin + Thiotepa nebo Threosulfan + Fludarabin + Thiotepa. Cílem této studie je ověřit dostatečný antileukemický efekt těchto přípravných režimů prokázaný srovnatelným výskytem relapsů při přijatelné akutní toxicitě a snížení pozdních nežádoucích následků.
Součástí přípravného režimu všech nepříbuzenských transplantací je podání antilymfocytárních protilátek, tzv. séroterapie. Nejčastěji využíváme anti-T lymfocytární globulin získaný ze séra králíků po jejich imunizaci lidskými T lymfoblastickými buněčnými liniemi. Jeho podání v rámci přípravného režimu vede k posílení lymfocytární deplece v organismu pacienta a sníží riziko nepřihojení štěpu. Antilymfocytární přípravky přetrvávají v těle příjemce ještě v době podání štěpu, způsobují rozpad lymfocytů ze štěpu a tímto mechanismem in vivo provedené lymfodeplece významně snižují riziko vzniku těžké reakce štěpu proti hostiteli.
Základním lékem potransplantační preventivní imunosupresivní léčby je cyklosporin A (CsA). Pacienti po nepříbuzenské Tx dostanou den +1, +3 a +6 po převodu nízkou dávku metotrexátu. Cílem všech imunosupresivních postupů je snížení rizika vzniku těžké GVHD. Vysazování imunosuprese je u akutních leukémií poměrně časné, zahajujeme ji v nepřítomnosti projevů aktivní GVHD u Tx od sourozeneckých dárců dva měsíce, u nepříbuzenských tři měsíce po HSCT, CsA vysazujeme postupným snižováním dávek v průběhu 4–6 týdnů.
Monitorace MRN, chimérismus, imunomodulační postupy
Všichni pacienti, u kterých je možné sledovat MRN, jsou před HSCT vyšetřeni. Pozitivita MRN před HSCT je nezávislým rizikovým faktorem relapsu [8, 9]. Proto je v současnosti doporučován v případě její zvýšené hodnoty odklad termínu transplantace a další intenzifikace léčby. Po transplantaci je MRN monitorována v daných časových bodech: 30, 60 a 100 dnů po HSCT a dále s prodlužujícími se intervaly až do doby 36 měsíců po HSCT. Vyšetřuje se z aspirátu kostní dřeně. V případě záchytu pozitivity MRN je vyšetření opakováno časněji. Vyšetření chimérismu po Tx detekuje případnou perzistenci příjemcovy původní krvetvorby, potenciálně přežívání leukemických buněk. Monitorace spočívá v detekci polymorfismů sekvencí určitých úseků DNA, konkrétně amplifikací krátkých tandemových repetitivních úseků (STR) v populaci neselektovaných jaderných buněk. Stanovení cílů specifických pro příjemce, tzv. informativita, je provedeno před HSCT. Monitoraci z krve provádíme v prvních měsících v týdenních, později v prodlužujících se intervalech. Cílem monitorace MRN i chimérismu po HSCT je časná identifikace pacientů ohrožených relapsem. U těchto dětí je pak možné volit postupy tzv. adaptivní imunoterapie, spočívající především ve vysazování imunosuprese, případně podávání infuze dárcovských lymfocytů (DLI) za účelem posílení efektu reakce štěpu proti leukémii (GvL). Přechodné záchyty nekvantifikovatelné pozitivity MRN odpovídající většinou hodnotám <10-4, které se častěji vyskytují po dni 100 po Tx, mohou být nespecifické [10].
Relaps po HSCT
Relaps po Tx je při snižující se TRM nejdůležitější příčinou selhání transplantace. Postihuje v různých souborech 20–40 % pacientů. Dvouleté kumulativní riziko relapsu v SCT-ALL BFM studiích v období od 2003 do 2009 bylo 18 % po MSD, 20 % po MUD a 37 % po HSCT od alternativního neshodného dárce (MMFD, MMUD) [11]. Identifikace rizikových faktorů relapsu a intervencí vedoucích k jejich eliminaci je nutným předpokladem dalšího zlepšování výsledků léčby. Jedním z nezávislých prediktivních faktorů relapsu se ukazuje být hodnota MRN před HSCT. Tato skutečnost vede k strategiím cílícím na snížení MRN, tedy množství leukemických buněk u pacientů vstupujících do Tx. Dochází k zařazování nových experimentálních léků a postupů vedoucích k zvýšení efektivity léčby v jejím průběhu (např. anti-CD22 monoklonální protilátka, bortezomib, clofarabin, dasatinib). Další možností je vložení intenzivního bloku chemoterapie složeného z cytostatik v dosavadní léčbě nepoužitých (např. DNX-FLA, CYCLET) u pacientů vstupujících do Tx s nedostatečnou redukcí MRN po předchozí léčbě. Experimentálně je možné v této situaci také použití některé z monoklonálních protilátek cílené na blasty exprimované antigeny (CD22+, CD19+, CD20+, CD33+, CD52+).
Po HSCT je pro časný záchyt nastupujícího relapsu důležitá pravidelná monitorace MRN. Efekt vysazení imunosuprese a podání DLI je u ALL omezený a účinný může být pouze ve fázi takzvaného molekulárního relapsu. Indikaci k provedení druhé alogenní HSCT u pacientů s relapsem je třeba posuzovat zcela individuálně. Zohledňuje se doba manifestace relapsu po 1. HSCT, fyzický stav pacienta, schopnost spolupráce a ochota podstoupit další léčbu, typ leukémie a relapsu. Předpokladem je opětovné uvedení do remise nemoci intenzivní chemoterapií, případně její kombinací s některým z experimentálních léků. Nízké úrovně MRN se často snažíme dosáhnout zahájením transplantačního přípravného režimu ještě před regenerací krvetvorby z předchozí chemoterapie, v takzvané aplazii. Ke zvýšení alogenní reaktivity štěpu vede snížení preventivní imunosuprese, především podání nižší dávky anti-T lymfocytárních protilátek. Tento přístup s sebou nese zvýšené riziko toxických orgánových komplikací, infekcí i těžké formy akutní a chronické GVHD. Přesto mají pacienti vstupující za uvedených podmínek do 2. HSCT určitou šanci na dlouhodobé vyléčení [12].
V současnosti se teoreticky nabízí řada dalších experimentálních postupů s potenciálem prevence vzniku relapsu či jeho terapie po HSCT. Využití jednotlivých léčebných modalit je nutné testovat v rámci dobře projektovaných klinických studií fáze I/II ověřujících toxicitu a efektivitu jednotlivých postupů. Příkladem tohoto přístupu jsou studie využití tyrosin-kinázových inhibitorů u Ph+ ALL po HSCT nebo použití bispecifické anti-CD19+/CD3+ protilátky u BCP ALL. Rozvíjející se metodou testovanou také u pacientů s relapsem ALL po Tx je využití chimérických antigenních receptorů (CAR) cytotoxických lymfocytů cílených proti molekulám exprimovaným na povrchu lymfoblastů (CD19, CD22) [13, 14].
Komplikace transplantace
Přípravný režim spočívá v expozici pacienta vysokým dávkám radioterapie a/nebo chemoterapie, způsobuje řadu nežádoucích účinků projevujících se v různých obdobích po HSCT. Pacienti s ALL vstupují do přípravy po předchozí náročné chemoterapii, kterou provází řada komplikací. V důsledku toxicity cytostatické léčby mohou vznikat dlouhodobější orgánové dysfunkce. Řada infekčních agens může po prodělaných infekcích perzistovat v organismu se schopností následné reaktivace v období imunitního útlumu po transplantaci. Na podkladě orgánové dysfunkce může po transplantaci dojít k respiračnímu, renálnímu, jaternímu či oběhovému selhání, rozvoji neurologických komplikací. Provedení transplantace časně po dosažení kvalitní remise, v dobrém fyzickém stavu a nepřítomnosti aktivní infekce je důležité z hlediska prevence potransplantačních komplikací.
Riziko úmrtí na komplikace transplantace (TRM) se neustále snižuje. Tento trend je důsledkem řady faktorů, především snížení incidence těžkých forem akutní reakce štěpu proti hostiteli související s lepší nabídkou a výběrem nepříbuzenských dárců, zlepšení možností imunosupresivní terapie. Větší nabídka efektivních antiinfekčních léků, kvalitnější laboratorní monitorace a preemptivní strategie léčby infekcí jsou příčinou snížení celkové mortality na tyto komplikace s relativně četnějším zastoupením virových infekcí. V současnosti je TRM u dětských pacientů s ALL transplantovaných od shodných sourozeneckých dárců kolem 5 %, od shodných nepříbuzenských dárců v rozmezí 5–15 % a více než 20 % zůstává u transplantací od alternativních dárců.
Reakce štěpu proti hostiteli
Reakce štěpu proti hostiteli (GVHD) zůstává spolu s infekcemi hlavní příčinou úmrtí na komplikace HSCT. Klasické rozdělení odlišuje akutní (rozvíjí se do dne 100 po Tx) a chronickou GVHD, která se manifestuje později. Akutní GVHD postihuje především kůži (exantém až těžké bulózní epidermolýzy), gastrointestinální trakt (zvracení, průjmy, při větším poškození krvácení do GIT) a játra (cholestatické postižení jater, hepatální insuficience až selhání). Diagnózu stanovujeme na základě klinických kritérií, laboratorní vyšetření mají doplňující úlohu, ve sporných případech může být k ověření provedeno histopatologické vyšetření. V patogenezi rozvoje GVHD rozlišujeme tři fáze procesu: iniciální poškození tkání přípravným režimem, které vede k aktivaci antigen-prezentujících buněk příjemce. Následně dochází k aktivaci a proliferaci dárcovských T lymfocytů s uvolněním zánětlivých cytokinů (IL-1, TNF-alfa) prohlubujících tkáňové poškození. Tento proces je částečně tlumen inhibiční schopností některých buněk imunitního systému, především T regulatorními lymfocyty (T-regs). Hlavním rizikovým faktorem vzniku GVHD je neshoda v HLA antigenech. Mezi dalšími faktory zvyšujícími riziko především chronické GVHD je uváděn vyšší věk dárce, dárkyně žena, zejména pokud je příjemcem muž, použití štěpu PBSC. Předmětem výzkumu jsou také další rizikové faktory, například polymorfismy v genech kódujících některé zánětlivé cytokiny a protektivní úloha střevního mikrobiomu.
Rozlišujeme 4 stupně akutní GVHD, podle míry postižení jednotlivých orgánů. Stupeň I postihuje pouze kůži v omezeném rozsahu do 50 % tělesného povrchu, léčíme jej lokální aplikací imunosupresivních mastí. Stupeň II postihuje jeden nebo více z hlavních orgánů manifestace (kůže, GIT, játra), působí pouze mírné potíže. Stupeň III a IV aGVHD je spojen s významnou morbiditou a také mortalitou v důsledku orgánového postižení, krvácení, infekčních komplikací [15]. Preventivní podávání imunosuprese má zabránit rozvoji těžkých forem GVHD. Lékem volby při její manifestaci jsou kortikosteroidy, které přidáváme do kombinace k stávající imunosupresi. Při dobré odpovědi vysazujeme postupně opět nejprve kortikoidy a poté ostatní léky. V případě špatné klinické odpovědi (steroid-rezistentní GVHD) je situace komplikovanější. Neexistuje standardní postup dalšího rozvoje imunosupresivní léčby, který by jednoznačně prokázal vyšší efektivitu vůči jiným modalitám. Podle typu postižených orgánů, klinického stavu pacienta, dostupnosti jednotlivých metod volíme do kombinace některý z imunosupresivních léků (např. mykofenolát, sirolimus), podání anti-T lymfocytárních protilátek, další možností je metoda extrakorporální fotoforézy, v klinickém zkoušení je využití stromálních mezenchymálních buněk. Efekt jednotlivých postupů je omezený a prognóza steroid-rezistentní GVHD je stále nepříznivá [16].
Chronická reakce štěpu proti hostiteli má rysy autoimunitního onemocnění a imunodeficience. Může mít charakter jiných autoimunitních nemocí, jako jsou Sjögrenův syndrom, sklerodermie, primární biliární cirhóza, imunitní cytopenie. Patofyziologie chronické GVHD je komplexnější a méně objasněná, než je tomu u akutní GVHD. Akutní GVHD ale zůstává hlavním rizikovým faktorem pozdějšího vzniku její chronické formy. Postihuje různé orgánové systémy, především kůži a kožní adnexa, sliznice dutiny ústní, oči, genitálie, játra, plíce, svaly, fascie a klouby. Její manifestace může být omezena na jeden orgánový systém. V některých případech jsou ale její projevy rozsáhlé, výrazně omezující kvalitu života a zvyšující riziko úmrtí především na infekční virové či mykotické komplikace.
Toxické komplikace
Běžnými časnými potížemi způsobenými přípravou jsou nechutenství, zvracení, poškození sliznic (mukositida) a s ní spojené bolesti. Komplexní podpůrná terapie (antiemetika, kontinuální analgezie, parenterální a enterální výživa) mírní potíže, jejichž výskyt vrcholí v období 1–2 týdnů po převodu štěpu. Řada závažných časných toxických komplikací vzniká v důsledku postižení endoteliálních buněk přípravným režimem [17]. Manifestují se obvykle v prvních 30–60 dnech, mohou se projevovat jako klinické syndromy, mezi které patří venookluzivní nemoc jater (VOD), syndrom kapilárního úniku, engraftment syndrom, difuzní alveolární hemoragie, trombotická mikroangiopatie. Venookluzivní nemoc jater, výstižněji také nazývaná sinusoidální obstrukční syndrom, je vážná komplikace charakterizovaná hepatomegalií, retencí tekutin a hyperbilirubinémií vznikající v důsledku toxického poškození sinusoidálních endoteliálních buněk jater. Vzniká sinusoidální a portální hypertenze, ascites, břišní compartment syndrom s rozvojem renální a respirační insuficience, koagulopatie a těžké trombocytopenie. V těžké formě jde o jednu z komplikací spojených s vysokou mortalitou.
Infekční komplikace
Infekční komplikace jsou nadále důležitou příčinou potransplantační morbidity a mortality. V různých časových obdobích po HSCT dominují odlišné typy patogenů. V časné fázi prvních 2–3 týdnů převažují v důsledku těžké neutropenie a porušení slizničních bariér bakteriémie s různou mírou septických projevů. Jedná se o endogenní infekce způsobené bakteriálními kmeny kolonizujícími pacienty. V této době jsou rizikem také invazivní kvasinkové infekce, které se mohou rozvinout i přes profylaktickou terapii širokospektrými antimykotiky. Možnost rozvoje mykotické infekce vyvolané některým z patogenů patřících mezi vláknité houby existuje u pacientů významně exponovaných před vstupem do transplantace. Z virových agens se už časně po HSCT může aktivovat především HSV, hlavně v případech rozvoje rezistence na preventivně podávaný acyklovir. K přihojení štěpu, formálně určeném přítomností více než 500 granulocytů dárcovského původu v krvi příjemce, dochází většinou mezi 14.–28. dnem po jeho převodu. Z pohledu spektra infekčních patogenů se po přihojení dostávají do popředí především virové infekce. CMV, EBV a adenovirus (ADV) jsou nejčastější z nebezpečných patogenů s potenciálně fatálním průběhem nemoci. Všechny herpetické viry perzistují v těle pacienta po prodělané primoinfekci. Dlouhodobé přetrvávání v lymfoidních tkáních se podařilo prokázat také u adenoviru.
Počet lymfocytů, zastoupení jednotlivých subpopulací a funkčnost především T lymfocytů je u jednotlivých pacientů závislá na řadě faktorů. Obecně platí, že proces takzvané imunitní rekonstituce, tedy obnovy imunitních funkcí schopných plnohodnotné cílené obranné reakce, trvá řadu měsíců. Intenzita imunosupresivní léčby a přítomnost reakce štěpu proti hostiteli jsou hlavními faktory ovlivňujícími tento proces. Roli hraje také typ dárce a štěpu. Virové patogeny jsou monitorovány v krvi pacientů pomocí kvantitativní PCR v pravidelných časových intervalech po HSCT. Preemptivní strategie terapie je založena na časné detekci reaktivace viru umožňující zahájení léčebných opatření (protivirové léky, rychlejší vysazování imunosuprese) ještě před rozvojem klinických či laboratorních příznaků samotné infekce. Pozdější fáze virové reaktivace projevující se postižením orgánů a rozvojem symptomů nemoci jsou už farmakologicky obtížně ovlivnitelné. Ve fázi klinických experimentů jsou různé postupy získávání, úpravy a aplikace virus specifických T lymfocytů, připravují se nové protivirové léky. Těžce imunitně kompromitovaní pacienti s chronickou reakcí štěpu proti hostiteli a dlouhodobou imunosupresivní léčbou jsou také ohroženi mykotickými infekcemi, především rody Aspergillus a Mucor. Profylaxe širokospektrými antimykotiky je u nich nezbytnou součástí léčby.
Pozdní následky
Za pozdní následky (PN) transplantace jsou považovány komplikace manifestující se déle než 100 dnů po transplantaci, které nejsou způsobeny primárním onemocněním, většinou přímo či nepřímo související s expozicí radioterapii a/nebo vysokodávkované chemoterapii přípravného režimu. Jejich incidence je u dětských pacientů transplantovaných pro ALL více než 90 %. Do současné doby prakticky všichni pacienti starší dvou roků podstupovali v přípravném režimu celotělové ozáření (TBI) dávkou 12 Gy. TBI je v porovnání s jinými formami přípravy založenými především na cytostatiku busulfanu zatíženo o něco vyšším výskytem většiny z pozdních následků. V incidenci PN po TBI hraje významnou roli věk dětí při transplantaci. Malé děti mají zvýšenou vnímavost k rozvoji neurokognitivních a endokrinních poruch a k rozvoji sekundárních malignit v pozdějším věku. Proto nebyly dosud ozařovány děti ve věku do dvou roků a v novém protokolu se tato věková hranice posouvá na čtyři roky.
Na rozvoji pozdních následků se kromě přímého poškození tkání radio/chemoterapií významným způsobem podílí také chronická reakce štěpu proti hostiteli společně s dlouhodobou imunosupresivní léčbou. Mezi komplikace, které stojí svou četností či závažností v popředí problematiky pozdních následků, patří postižení fertility, endokrinních a metabolických funkcí, poruchy růstu, neurokognitivních funkcí, postižení očí a kostí, závažnou komplikací je výskyt sekundárních malignit. Porucha gonadálních funkcí s hypergonadotropním hypogonadismem se u dívek projevuje především opožděným nástupem puberty s poruchou vývoje sekundárních pohlavních znaků, u většiny chlapců zůstává hormonální funkce Leydigových buněk zachována. Fertilita je u obou pohlaví po HSCT s použitím TBI nebo busulfanu zachována pouze ve výjimečných případech. Větší šance je u dívek podstupujících transplantaci v prepubertálním věku. Porucha růstu je důsledkem endokrinní dysfunkce, především deficitu růstového hormonu a periferních lézí kostí a epifyzeálních růstových chrupavek. Velmi časté jsou poruchy funkce štítné žlázy, běžná je subklinická i manifestní hypotyreóza, méně časté jsou autoimunitní tyreoiditidy. S poruchou endokrinních a metabolických funkcí souvisí častější výskyt metabolického syndromu s hypertenzí, dyslipidémií a hypeglykémií zvyšujícího z dlouhodobé perspektivy riziko kardiovaskulárních komplikací. Katarakta v důsledku radioterapie a dlouhodobé kortikosteroidní léčby při chronické GVHD společně se sníženou produkcí slz jsou nejčastějšími příčinami poruch zraku po HSCT. Projevem sicca syndromu je i snížená tvorba slin se zvýšenou kazivostí zubů. Hlavní komplikací postihující pohybový aparát je aseptická kostní nekróza. Manifestuje se především u adolescentů, postihuje hlavně konce dlouhých kostí, nejčastěji femur s poškozením kyčelního kloubu, také kosti v oblasti kolenního, ramenního kloubu, kotníků, v pokročilých fázích je jediným způsobem léčby ortopedický výkon s použitím kloubní náhrady. Přetížení železem v důsledku velkého množství podaných transfuzí se projevuje hlavně hepatopatií, méně často poruchou kardiální funkce. Vývoj neurokognitivních funkcí bývá narušen hlavně u dětí podstupujících TBI v nízkém věku, roli u pacientů s ALL hraje také případná předchozí expozice radioterapii cílené na CNS a intrathekální chemoterapie. Nejvážnějšími zřídka se vyskytujícími neurologickými komplikacemi jsou nekrotizující leukoencefalopatie a mozková atrofie.
Vážným problémem ovlivňujícím pozdní mortalitu pacientů po HSCT je výskyt sekundárních maligních nádorů. Nejčastěji se vyskytují karcinomy štítné žlázy a orofaryngeální oblasti, dále maligní nádory kůže, mozku, prsu, vzácněji i jiné. Sekundární malignitou je také posttransplantační lymfoproliferativní nemoc indukovaná aktivitou EBV, která se ve své maligní monoklonální formě manifestuje nejčastěji vznikem B-buněčného lymfomu [18, 19].
Spektrum pozdních následků je velmi široké. Dispenzární péče o pacienty, kteří podstoupili HSCT, je založena na systému specializovaných vyšetření koordinovaných lékařem transplantačního centra. Vychází ze znalosti rizika rozvoje jednotlivých komplikací, je cílená na jejich včasný záchyt a řešení na odpovídajících pracovištích.
Výsledky léčby
Interpretace výsledků HSCT je ovlivněna velkou nesourodostí porovnávaných dat. V roce 2003 otevřela BFM studijní skupina největší prospektivní mezinárodní multicentrickou studii ALL-SCT-BFM 2003. Od roku 2007, kdy došlo k rozšíření počtu participujících center, patřila mezi země účastnící se studie také Česká republika. Výsledky léčby pacientů zařazených v roce 2003 až 2009 ukazují následující data: 4leté EFS (event free survival = přežití bez události, kterou je relaps nebo úmrtí na toxicitu léčby) bylo pro HSCT od MSD 70 %, MUD 68 %. Naopak nejhorší výsledek zaznamenala skupina pacientů transplantovaná pro relaps ALL od alternativních dárců s 2letým EFS pouze 28 ± 8 %, a to jak v důsledku vysokého výskytu relapsů (37 %), tak také vysoké TRM (30 %) [11].
Závěr
Dětská ALL je heterogenní skupinou onemocnění se stále se zlepšující prognózou dlouhodobého přežití blížící se v současných protokolech 90 %. Pacienti s velmi rizikovou formou ALL nebo relapsem nemoci mají významně menší šance na uzdravení a vyžadují odlišný léčebný postup po dosažení remise nemoci. HSCT kombinující imunologický účinek (GvL) s vysokodávkovanou chemo/radioterapií je efektivní kurativní metodou pro velkou část z nich. K zlepšení výsledků léčby HSCT vedlo snížení mortality na toxické komplikace v důsledku komplexních změn zahrnujících lepší výběr a dostupnost dárců, časnější identifikaci a indikaci rizikových pacientů, zlepšení podpůrné péče i větší zkušenost transplantačních týmů.
Cílem identifikace faktorů predikujících vyšší riziko relapsu po HSCT, preventivních i léčebných intervencí včetně využití možností cílené farmakologické, imunologické a buněčné terapie, je další snížení výskytu relapsů po HSCT. Neuspokojivé jsou nadále výsledky léčby u dětí transplantovaných od alternativních dárců. K zlepšení výsledků transplantací přispívá také organizace prospektivních multicentrických studií zajišťující standardy péče i získávání validních dat umožňujících důkladnější analýzy. Pozornost je v současnosti zaměřena také na ovlivnění pozdních následků po HSCT. Cílem je nejen zlepšení výsledků dlouhodobého přežití po HSCT ale také kvality života vyléčených pacientů a jejich zařazení do společnosti.
Podpořeno MZ ČR – RVO, FN v Motole 00064203.
MUDr. Petr Říha
Klinika dětské hematologie a onkologie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: petr.riha@fnmotol.cz
Zdroje
1. Appelbaum RF, Forman JS, Negrin SR, et al. Thomas´Hematopoietic Cell Transplantation. 4th ed. Singapore: Blackwell Publishing Ltd, 2009 : 3–20, 806–825.
2. Conter V,Valsecchi MG, Basso G, et al. Childhood high-risk acute lymphoblastic leukemia in first remission: results after chemoterapy or transplant from AIEOP ALL 2000 study. Blood 2014 : 1470–1478.
3. Einsiedel HG, von Stackelberg A, Hartmann R, et al. Long-term outcome in children with relapsed ALL by risk-stratified salvage therapy: results of trial acute lymphoblastic leukemia-relapse study of the Berlin--Frankfurt-Munster Group 87. J Clin Oncol 2005; (23): 7942–7950.
4. Tallen G, Ratei R, von Stackelberg A, et al. Long-term outcome in children with relapsed acute lymphoblastic leukemia after time-point and site-of-relapse stratification and intensified short-course multidrug chemotherapy: results of trial ALL-REZ BFM 90. J Clin Oncol 2010; (14): 2339–2347.
5. Schrauder A, von Stackelberg A, Peters Ch, et al. Allogeneic hematopoietic SCT in children with ALL: current concepts of ongoing prospective SCT trials. Bone Marrow Transplantation 2008; 41 (Suppl 2): S71–S74.
6. http://www.bmdw.org.
7. Klingebiel T, Cornish J, Rocha V, et al. Pediatric Diseases and Acute Leukemia Working Parties of the European Group for Blood and Marrow Transplantation (EBMT). Results and factors influencing outcome after fully haploidentical hematopoietic stem cell transplantation in children with very high-risk acute lymphoblastic leukemia: impact of center size: an analysis on behalf of the Acute Leukemia and Pediatric Disease Working Parties of the European Blood and Marrow Transplant Group. Blood 2010; 17 : 3437–3446.
8. Šrámková L, Mužíková K, Trka J, et al. Detectable minimal residual disease before allogeneic hematopoietic stem cell transplantation predicts extremely poor prognosis in children with acute lymphoblastic leukemia. Pediatr Blood Cancer 2007; 48 (1): 93–100.
9. Leung W, Pui CH, Coustan-Smith E. Detectable minimal residual disease before hematopoietic cell transplantation is prognostic but does not preclude cure for children with very-high-risk leukemia. Blood 2012; 12;120 (2): 468–472.
10. Fronkova E, Muzikova K, Trka J, et al. B-cell reconstitution after allogeneic SCT impairs minimal residual disease monitoring in children with ALL. Bone Marrow Transplant 2008; 42 (3): 187–196.
11. Pulsipher A, Peters Ch, Pui Ch. High-risk pediatric acute lympho-blastic leukemia: To transplant or not to transplant? Biol Blood Marrow Transplant 2011; 17: S137–S148.
12. Formankova R, Sedlacek P, Stary J, et al. Adoptive immunotherapy, chemotherapy, and second allogeneic transplant in the treatment of post-transplant relapse of acute leukemia in children: a single center experience. Leuk Lymphoma 2010; 51 (10): 1936–1940.
13. Talano JM, Pulsipher MA, Cairo MS. New frontiers in pediatric Allo-SCT. Bone Marrow Transplant 2014; 49 (9): 1139–1145.
14. Pulsipher MA, Wayne AS, Schultz KR. New frontiers in pediatric Allo-SCT: novel approaches for children and adolescents with ALL. Bone Marrow Transplant 2014; 49 (10): 1259–1265.
15. Apperley J, Carreras E, Gluckman E, et al. The EBMT Handbook, Haematopoietic Stem Cell Transplantation. 6th ed. Genoa: Litoprint, 2012 : 176–270.
16. Ram R, Storb R. Pharmacologic prophylaxis tegimens for acute GVHD – past present and future. Leuk Lymphoma 2013; 54 (8): 1591–1601.
17. Carreras E, Diaz-Ricart M. The role of the endothelium in the short-term complications of hematopoietic SCT. Bone Marrow Transplant 2011; 46 (12): 1495–1502.
18. Cohen A, Békássy AN, Dini G, et al. EBMT Paediatric and Late Effects Working Parties. Endocrinological late complications after hemato-poietic SCT in children. Bone Marrow Transplant 2008; 41 (Suppl 2): S43–S48.
19. Faraci M, Békássy AN, Dini G, et al. EBMT Paediatric and Late Effects Working Parties. Non-endocrine late complications in children after allogeneic haematopoietic SCT. Bone Marrow Transplant 2008; 41 (Suppl 2): S49–S57.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2015 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Akutní myeloidní leukémie v dětském věku
- Transplantace kmenových buněk krvetvorby v terapii akutní lymfoblastické leukémie dětského věku
-
Pavel Kabíček, Jana Hamanová, Ladislav Csémy a kolektiv:
Rizikové chování v dospívání a jeho vztah ke zdraví - Dětské akutní leukémie – Editorial
- Leukémie u dětí ve 21. století
- Etiologie dětských ALL a AML, molekulární genetika a minimální reziduální nemoc
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
- Cytogenetika akútnych leukémií u detí
- Akútna lymfoblastová leukémia
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní myeloidní leukémie v dětském věku
- Akútna lymfoblastová leukémia
- Leukémie u dětí ve 21. století
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



