-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní myeloidní leukémie v dětském věku
Acute myeloid leukemia in children
Acute myeloid leukemia (AML) in children constitute only 15% of all leukemias and is therefore considerably less frequent than acute lymphoblastic leukemia (ALL). The diagnosis in suspected haematological malignancy is based on bone marrow aspiration in a specialized centers with morphology, cytometry, cytogenetic and molecular genetic examination, which distinguishes AML from the more common ALL and can divide the subtypes of AML. In recent years the importance of molecular genetic analysis increases with the aim of finding targeted therapies for individual subtypes of AML. Treatment is based on the short cycle high-dose chemotherapy, thus can be achieved complete remission in 90% of patients, children with high risk of relapse are later indicated for allogeneic bone marrow transplantation in first remission. Supportive therapy is an important pillar of comprehensive care for patients with AML due to the risk of fatal complications most infectious or bleeding. Despite the very intensive treatment, approximately 30% of children will experience relapse, the treatment of relapse has not reached satisfactory results.
Patients after successful treatment of AML require long term follow up focused on cardiological controls due to the risk of cardiomyopathy after treatment with anthracyclines. Chance to be cured for AML patient in the last 20 years has increased significantly, currently reaches 65–70%, mainly thanks to advances in supportive therapy and bone marrow transplantation.Key words:
acute myeloid leukemia, children, chemotherapy, bone marrow transplantation
Autoři: L. Šrámková
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. J. Starý, DrSc.
Vyšlo v časopise: Čes-slov Pediat 2015; 70 (2): 108-113.
Kategorie: Dětské akutní leukémie
Souhrn
Akutní myeloidní leukémie (AML) tvoří u dětí pouze 15 % všech leukémií a je tedy významně méně častá než akutní lymfoblastická leukémie (ALL). Základem diagnostiky při podezření na hematologickou malignitu je včasné provedení aspirace kostní dřeně na specializovaném pracovišti s vyšetřením morfologickým, cytometrickým, cytogenetickým a molekulárně genetickým, které odliší AML od běžnější ALL a dále odliší jednotlivé subtypy AML. V posledních letech roste význam molekulárně genetické diagnostiky se snahou o hledání cílené léčby pro jednotlivé subtypy AML. Léčba se opírá o krátké cykly vysokodávkované chemoterapie, kterými lze dosáhnout kompletní remise až u 90 % pacientů, část pacientů s vysokým rizikem relapsu je následně indikována k alogenní transplantaci kostní dřeně již v 1. remisi onemocnění. Podpůrná léčba je důležitým pilířem komplexní péče o pacienty s AML vzhledem k riziku fatálních komplikací nejčastěji infekčních či krvácivých. Přes velmi intenzivní léčbu přibližně 30 % dětí prodělá relaps onemocnění, jehož léčba zatím nedosahuje uspokojivých výsledků.
Pacienti po úspěšné léčbě AML vyžadují dlouhodobou dispenzarici se zaměřením na kardiologické kontroly vzhledem k riziku rozvoje kardiomyopatie po léčbě antracykliny. Šance na vyléčení v posledních 20 letech významně vzrostla, v současné době dosahuje 65–70 %, a to hlavně díky pokroku v podpůrné léčbě a rozvoji transplantace kostní dřeně.Klíčová slova:
akutní myeloidní leukémie, děti, chemoterapie, transplantace kostní dřeněÚvod
Akutní myeloidní leukémie (AML) tvoří u dětí pouze 15 % všech leukémií a je tedy významně méně častá než akutní lymfoblastická leukémie (ALL). Biologicky má AML u dětí určité odlišnosti oproti dospělým, zvláště u kojenců a batolat, kde převažuje akutní monocytární leukémie. Zvýšené riziko AML mají děti s Downovým syndromem a děti s některými dalšími vzácnými vrozenými onemocněními, jako jsou Fanconiho anémie, ataxie-teleangiektázie, Bloomův syndrom, Schwachmanův-Diamondův syndrom a těžká vrozená agranulocytóza.
Šance na vyléčení v posledních 20 letech významně vzrostla, v současné době dosahuje 65–70 %, a to hlavně díky pokroku v podpůrné léčbě a rozvoji transplantace kostní dřeně. V posledních letech roste význam molekulárně genetické diagnostiky se snahou o hledání cílené léčby pro jednotlivé subtypy AML.
Klinické projevy
Klinické projevy mohou být nespecifické, pacienti mívají projevy anémie, celkovou slabost, únavnost, bolesti kostí, bolesti břicha, časté jsou subfebrilie až febrilie, alarmujícím příznakem bývá krvácení do kůže a sliznic při trombocytopenii a koagulopatii. Infiltrace lymfatických uzlin, jater a sleziny bývá přítomna přibližně u třetiny až poloviny pacientů, leukemická infiltrace v centrálním nervovém systému (CNS) s počtem leukocytů nad 5/µl se vyskytuje asi u 5 % dětí. Jiné mimodřeňové projevy se vyskytují hlavně u pacientů s myelomonocytární nebo monocytární leukémií, a to především v oblasti kůže (leukemia cutis), dásní nebo orbity (obr. 1).
Obr. 1. Extramedulární postižení při AML: infiltrace orbit u dítěte s akutní monocytární leukémií. 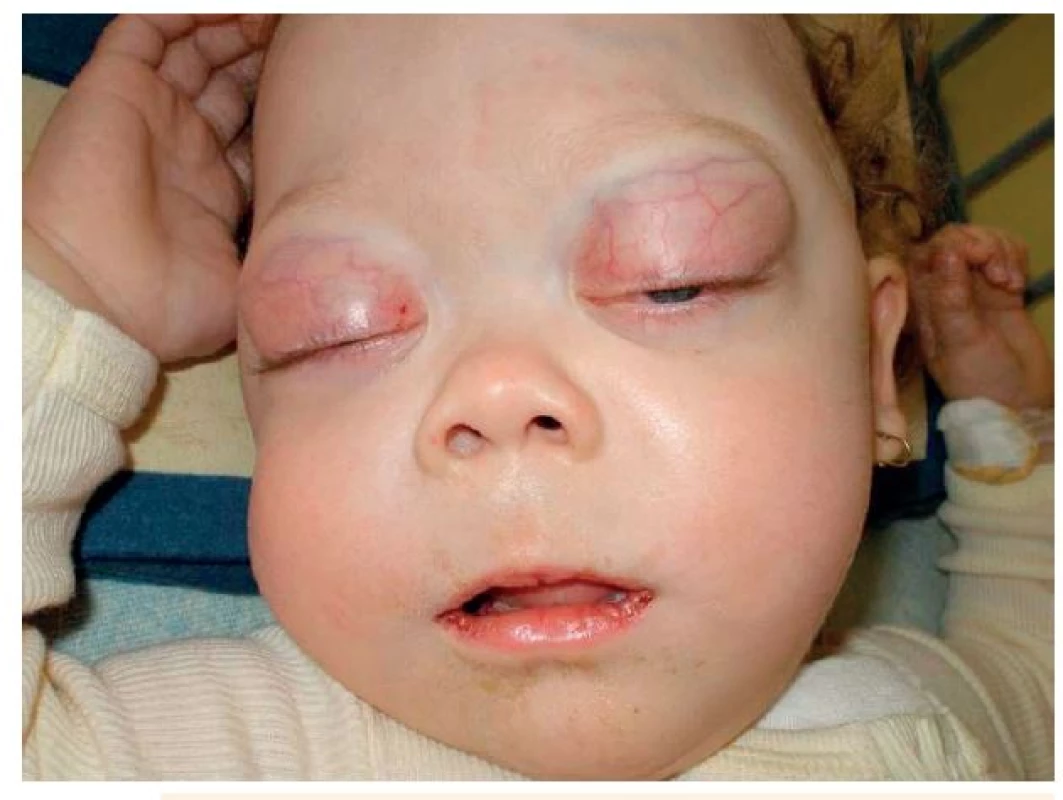
Výjimečně můžeme diagnostikovat extramedulární masu bez postižení kostní dřeně, takové onemocnění pak nazýváme myeloidní sarkom. Vzácně jsou při významné hyperleukocytóze nad 150–200 x 109/l leukocytů přítomny známky leukostázy při hyperviskózním syndromu s dominujícími respiračními (tachydyspnoe, hyposaturace) nebo neurologickými projevy (somnolence, kóma). V takových případech se jedná o pacienty bezprostředně ohrožené na životě s nutností urgentního transportu do dětského hematoonkologického centra po zajištění intravenózního vstupu, zahájení hyperhydratace fyziologickým roztokem při podávání oxygenoterapie a monitorování základních životních funkcí. Transfuze erymasy je indikována s opatrností pouze při velmi těžké anémii, neboť její podání může zhoršit projevy hyperviskózního syndromu. Z laboratorních vyšetření je pro diagnostiku leukémie nejdůležitější krevní obraz s diferenciálním rozpočtem, kde nacházíme obvykle anémii a trombocytopenii, počet leukocytů kolísá u jednotlivých pacientů od leukopenie po hyperleukocytózu, v diferenciálním rozpočtu bývají zachyceny blastické elementy. Koagulační vyšetření může odhalit koagulopatii s prodlouženým aktivovaným parciálním tromboplastinovým (APTT) a/nebo protrombinovým časem (PT). Známky fibrinolýzy se zvýšenými fibrin degradačními produkty jsou poměrně časté a vzácněji detekujeme i významný pokles fibrinogenu pod 1 g/l. Koagulopatie i s klinickými projevy krvácení dominuje zvláště u akutní promyelocytární a akutní monocytární leukémie. V biochemickém vyšetření obvykle nacházíme elevaci laktátdehydrogenázy, méně často projevy urátové nefropatie se vzestupem kyseliny močové, urey a kreatininu, event. elevaci transamináz při infiltraci jater.
Diagnóza
Základem diagnostiky při podezření na hematologickou malignitu je včasné provedení aspirace kostní dřeně na specializovaném pracovišti s vyšetřením morfologickým, cytometrickým, cytogenetickým a molekulárně genetickým, které odliší AML od běžnější ALL a dále odliší jednotlivé podtypy AML [1, 2] důležité pro další rozhodnutí o terapii (tab. 1 a 2).
Tab. 1. Podtypy akutní myeloidní leukémie podle morfologie. 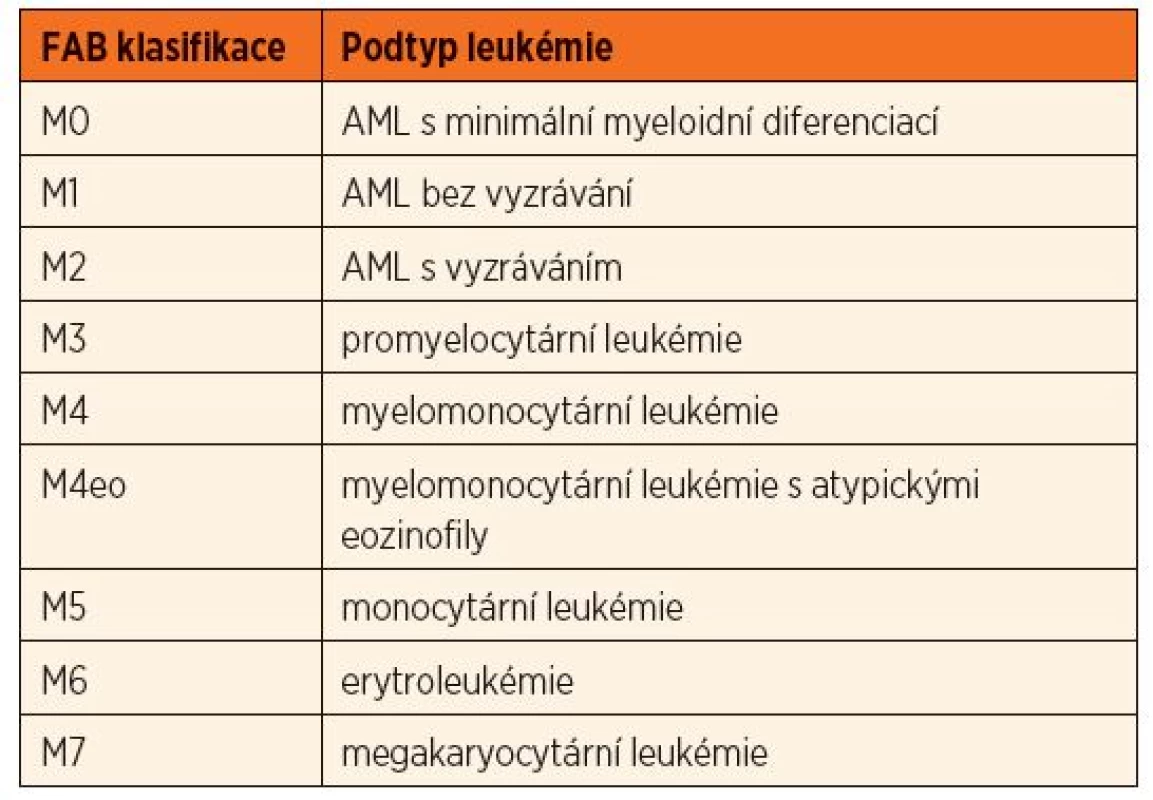
(podle Mayer J, Starý J a kol. Leukémie. Praha: Grada, 2002) FAB – French-American-British, AML – akutní myeloidní leukémie Tab. 2. Podtypy akutní myeloidní leukémie podle cytogenetiky a molekulární genetiky. 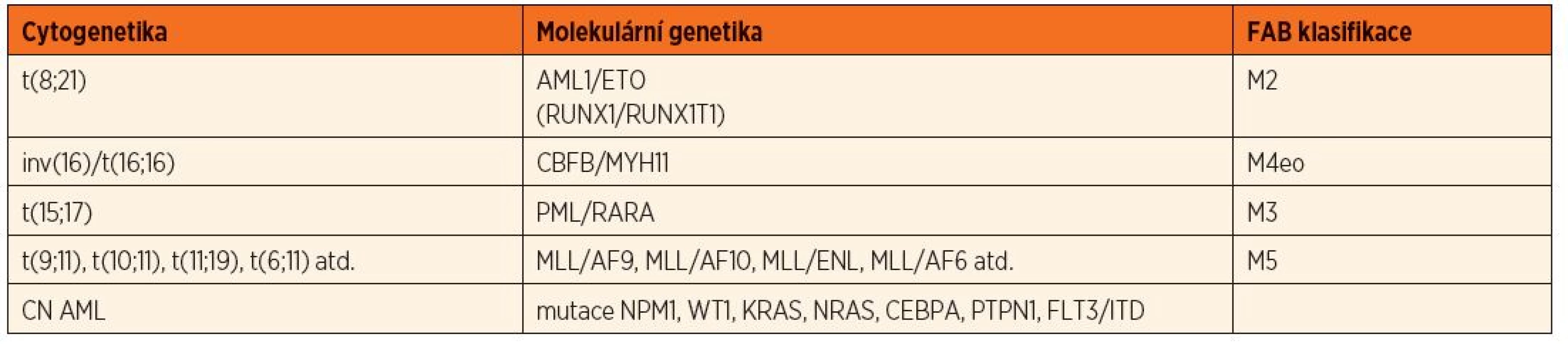
CN AML – cytogeneticky normální AML Součástí iniciálního vyšetření u pacienta s AML je i vyšetření mozkomíšního moku k odhalení nádorové infiltrace a zobrazovací vyšetření ke zjištění celkového rozsahu onemocnění (ultrazvuk břicha, rentgen hrudníku, event. magnetická rezonance mozku při nádorové mase v oblasti hlavy či průkazu blastů v mozkomíšním moku). Vstupní vyšetření je prováděno i s cílem odhalit event. preexistující orgánové postižení vzhledem k náročné následné chemoterapii.
Léčba
Cílem léčby je eradikace nádorového klonu pomocí krátkých cyklů vysokodávkované chemoterapie. Terapie se skládá se z 1–2 cyklů indukční chemoterapie, která slouží k navození remise, tzn. méně než 5 % blastů v kostní dřeni při obnově normální krvetvorby, a následně 2–3 cyklů konsolidační chemoterapie, jejímž cílem je eradikace reziduální leukémie. Prognostický význam minimální reziduální nemoci (MRN) kromě pacientů s promyelocytární leukémií není zatím zcela objasněn, avšak studie z posledních let ukazují, že v časných fázích léčby je MRN u AML ve většině případů dobře monitorovatelná průtokovou cytometrií a hladina MRN má dopad na prognózu pacienta. V pozdních fázích léčby a po léčbě se s výhodou využívá kvantitativní detekce specifických fúzních genů nebo mutací pomocí PCR [3, 4]. Počet cyklů chemoterapie vychází ze zařazení pacienta do jedné z rizikových skupin podle biologických vlastností leukémie a odpovědi na 1. cyklus indukční chemoterapie [5]. Rozdělení jednotlivých rizikových skupin podle aktuálně používaného protokolu Register AML BFM 2012 shrnuje tabulka 3.
Tab. 3. Rozdělení dětských AML do rizikových skupin (podle protokolu Register AML BFM 2012). 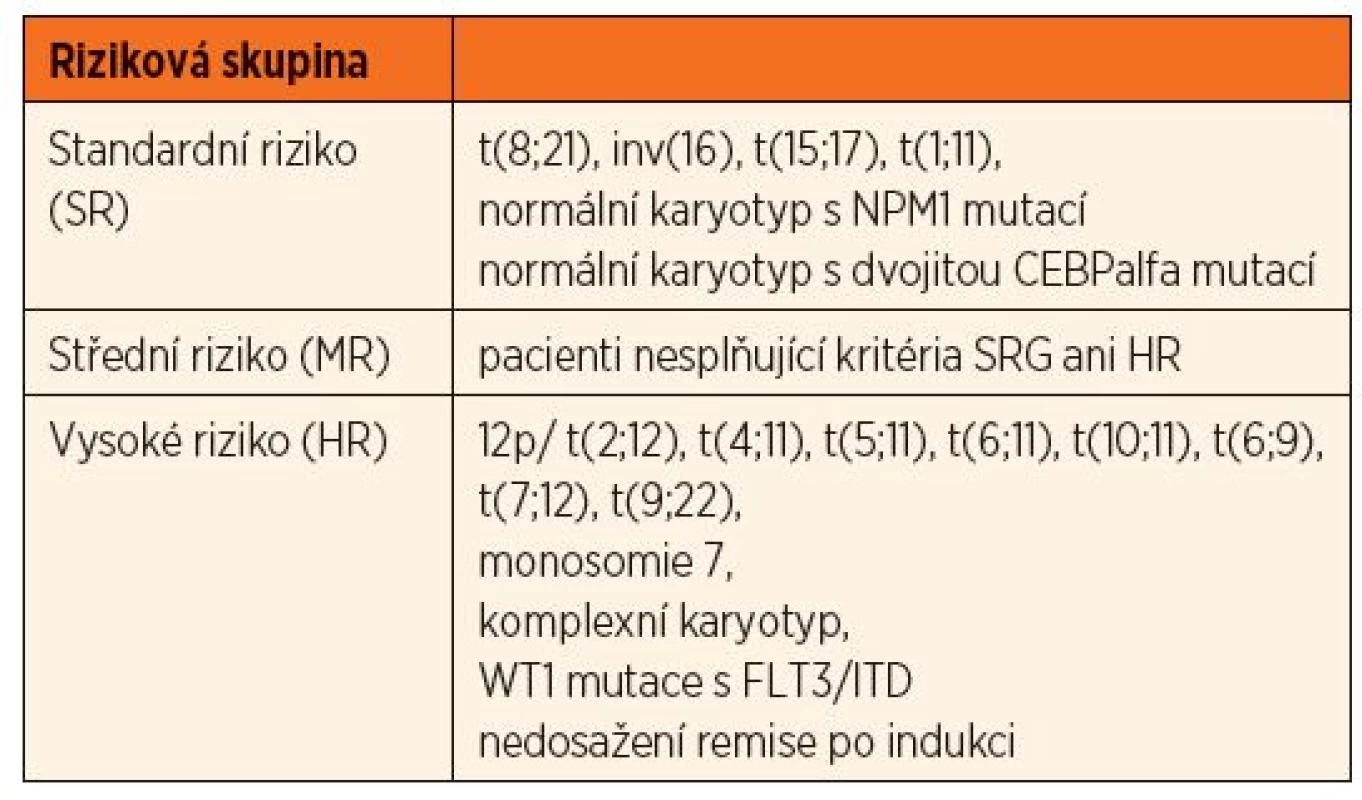
Chemoterapie u AML se opírá o podávání vysokodávkovaného cytosinarabinosidu a antracyklinů (lipozomální daunorubicin, idarubicin, mitoxantron), lepších výsledků je dosahováno při navyšování kumulativních dávek obou těchto důležitých cytostatik [6, 7, 8]. Dále je používán etoposid, cladribin a intrathekální aplikace cytosinarabinosidu jako prevence, event. léčba CNS infiltrace. Doba intenzivní chemoterapie je 5–6 měsíců. Udržovací chemoterapie trvá maximálně 1 rok, u AML není tak důležitou součastí léčby jako u ALL a většina léčebných protokolů ji nepoužívá nebo jen v omezené míře. Radioterapie jako součást léčby se používá u AML jen v situaci infiltrace CNS či testes, tedy míst, která jsou hůře dostupná systémové chemoterapii [9].
Specifickou podskupinou je akutní promyelocytární leukémie (AML M3), kde je vedle chemoterapie používána diferenciační léčba kyselinou alfa-trans-retinovou (ATRA). Moderní protokoly dokonce zcela vynechávají chemoterapii a léčí pacienty s AML M3 pouze kombinací oxidu arseničitého a ATRA. Jiné cílené léky jsou dostupné pouze experimentálně pro pacienty s primárně rezistentní či opakovaně relabující leukémií, jedná se o některé monoklonální protilátky, kinázové inhibitory nebo proteazomové inhibitory. Alogenní transplantace kostní dřeně má své nezastupitelné místo v léčbě pacientů s vysokým rizikem relapsu onemocnění (HR) z důvodu specifického biologického podtypu nebo nedostatečné odpovědi na indukční léčbu již v první remisi onemocnění a je zásadní součástí léčby pacientů s relapsem AML.
Výsledky léčby v České republice
Do počátku 90. let nebyla léčba dětské AML v České republice sjednocena, v roce 1993 byl zahájen první multicentrický léčebný protokol AML BFM 93 a následně byly postupně otevřeny další léčebné protokoly (AML BFM 98, 2004, 2012) na národní úrovni a léčba dětské AML jako vzácné malignity byla centralizována [10, 11]. Všechny tyto kroky umožnily postupné zlepšování léčebných výsledků a jejich srovnatelnost s pracovními skupinami v zahraničí. Základními parametry, které v průběhu léčby hodnotíme, je především včasnost dosažení remise, procento fatálních komplikací léčby, ať již v prvních týdnech léčby nebo po dosažení remise. Dalším důležitým ukazatelem úspěšnosti léčby je procento relapsů a sekundárních malignit. Výsledky léčby jsou prezentovány jako procento pacientů, kteří přežívají bez události (EFS – event free survival), kterou je relaps onemocnění, sekundární malignita nebo úmrtí na komplikace. Nejdůležitějším parametrem je celkové přežití (OS – overall survival).
Analyzovali jsme data všech dětských pacientů s AML v České republice s dostatečnou dobou sledování za období od 6/1993 do 9/2009. V této době byli pacienti léčeni podle tří po sobě následujících protokolů AML BFM 93, 98 a 2004, pro další analýzu jsme posuzovali společně pa-cienty léčené podle protokolu AML BFM 93 a 98 (6/93 – 2/04), kdy bylo zařazeno celkem 138 dětí v porovnání s pacienty léčenými podle protokolu AML BFM 2004 (3/04 – 12/09), kam bylo zařazeno celkem 57 dětí. Pacienti s Downovým syndromem, pacienti, kteří zemřeli před zahájením terapie, a pacienti s předchozím myelodysplastickým syndromem nebyli zavzati do naší analýzy.
Přes stabilní procento relapsů onemocnění (cca 30 %) se kontinuálně daří díky specializované péči snižovat počet úmrtí na komplikace léčby (tab. 4), za první sledované období (AML BFM 93 a 98) zemřelo před dosažením remise na komplikace 15,2 % dětí, v dalším období (AML BFM 04) již jen 5,2 %. Obdobných výsledků bylo dosaženo i v počtu úmrtí na komplikace v pozdních fázích léčby po dosažení remise (12,1 vs. 3,8 %). Současně se daří zlepšovat šanci na vyléčení relapsu AML, což vede k zlepšení celkových výsledků, 5leté celkové přežití (OS) za první období činí 46,5 % pacientů, v druhém sledovaném období již 73,7 % (graf 1) [12].
Tab. 4. Výsledky léčby pacientů s AML na protokolech AML BFM 93 a 98 ve srovnání s AML BFM 04. 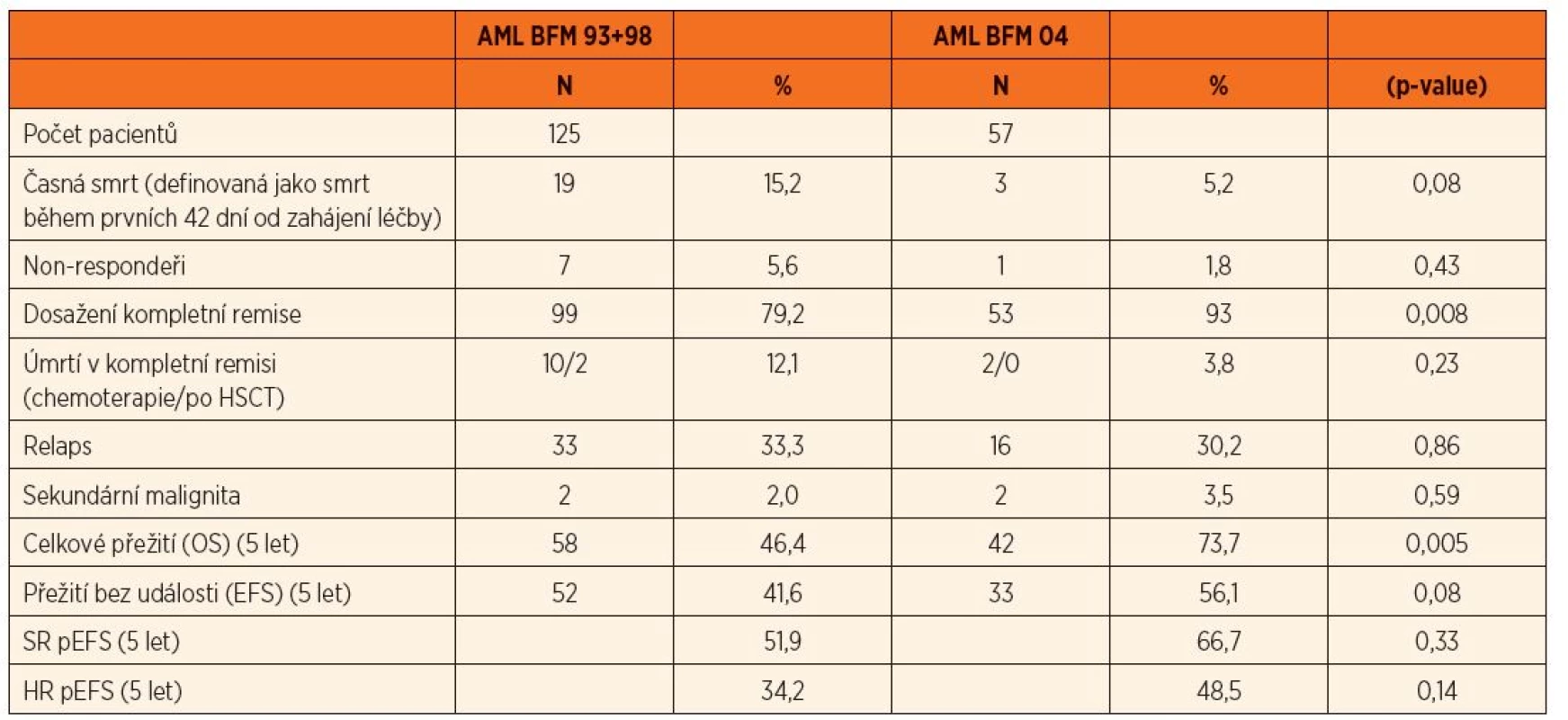
HSCT – transplantace hematopoetických kmenových buněk, OS – celkové přežití, EFS – přežití bez událostí, SR – skupina dětí standardního rizika relapsu, HR – skupina dětí vysokého rizika relapsu Graf 1. Pravděpodobnost celkového přežití (OS) pacientů v protokolech AML BFM 93, 98 ve srovnání s protokolem AML BFM 2004. <i>AML BFM 93 + 98 (n = 125): 5leté OS 46,4 % AML BFM 2004 (n = 57): 5leté OS 73,7 % p = 0,005</i> 
Podpůrná léčba a komplikace léčby
Podpůrná léčba je důležitým pilířem komplexní péče o pacienty s leukémií. V iniciálních fázích léčby je často nutná korekce koagulopatie čerstvě mraženou plazmou, antitrombinem III, u některých subtypů AML spojených s rozvojem diseminované intravaskulární koagulopatie (M3, M4, M5) i s použitím nízkomolekulárního heparinu, event. substituce fibrinogenu. Neméně důležité je i podávání trombocytárních transfuzí při těžké trombocytopenii pro vysoké riziko krvácivých komplikací v iniciálních fázích léčby. Anémii korigujeme transfuzí ozářené a deleukotizované erymasy. Pokud je přítomna významná hyperleukocytóza nad 150–200 x 109/l s klinickými projevy, je před zahájením chemoterapie indikováno provedení výměnné transfuze nebo leukaferézy.
Po celou dobu léčby je důležitá antimykotická a pneumocystová profylaxe (trimetoprim/sulfomethoxazol) [13], současně s režimovými opatřeními, jako je nízkobakteriální strava a izolace od kolektivu. Každý projev infekce (febrilie, oběhová nestabilita, GIT obtíže atd.) musí být léčen ihned po odebrání materiálu na mikrobiologii kombinací širokospektrých intravenózních antibiotik (např. aminopenicilin + aminoglykosid, cefalosporin 3.–4. generace + aminoglykosid) vzhledem k riziku rozvoje perakutní sepse. Antimykotická léčba je indikována cíleně při podezření na mykotickou infekci z klinických či zobrazovacích vyšetření a je dále upravována podle prokázaného agens. Granulocytární kolonie stimulující růstový faktor (G-CSF), event. podávání granulocytárních transfuzí jsou indikovány při závažných život ohrožujících infekcích v neutropenii.
V diagnostice virových, bakteriálních a mykotických infekcí se kromě standardních mikrobiologických metod používají ve stále větší míře i molekulárně genetické metody. Enterální, parenterální výživa a analgezie jsou běžnou součástí náročné léčby AML vzhledem k recidivujícím stomatitidám po chemoterapii či zánětlivým komplikacím v oblasti gastrointestinálního traktu. Přes veškerou podpůrnou léčbu stále umírá přibližně 5 % dětí s AML v iniciálních fázích léčby a dalších 5 % po dosažení remise onemocnění na komplikace léčby, a to nejčastěji na infekce a krvácivé komplikace [14, 15].
Pozdní následky a dlouhodobé sledování
Děti s AML mají na moderních léčebných protokolech šanci na vyléčení v 65–70 %, těchto výsledků je dosahováno s použitím velmi intenzivní vysokodávkované chemoterapie, která se opírá o cytosinarabinosid a antracykliny. Antracykliny jsou známé svými kardiotoxickými účinky. Riziko rozvoje kardiomyopatie stoupá s kumulativní dávkou antracyklinů, za významně rizikové jsou považovány dávky nad 400–450 mg/m2, což jsou dávky, které jsou v současných protokolech běžně dosahovány [16, 17, 18]. Proto jsou u pacientů po prodělané léčbě AML nutné pravidelné echokardiografické kontroly v intervalu minimálně 1x ročně po ukončení intenzivní chemoterapie [19].
Dalšími častějšími pozdními následky jsou poruchy funkce štítné žlázy, event. opožděný nástup puberty. Kromě toho mají pacienti po léčbě AML přibližně 2% riziko vzniku sekundární malignity, nejčastěji pokročilého myelodysplastického syndromu či akutní lymfoblastické leukémie, event. jiné nehematologické malignity [20].
Relaps AML
Relaps onemocnění se může objevit kdykoliv v průběhu léčby a dalšího sledování, prodělá ho přibližně 30 % pa-cientů. Do 1 roku od diagnózy mluvíme o relapsu časném, po roce od diagnózy pozdním. Toto rozdělení má význam pro další prognózu pacienta, časný relaps vždy znamená významně horší šanci na uzdravení.
Relaps onemocnění může postihovat pouze kostní dřeň nebo CNS, event. varlata u chlapců, někdy můžeme zachytit i kombinaci těchto postižení. Relaps se léčí podáním dalších cyklů vysokodávkované chemoterapie kombinací lipozomálního daunorubicinu, cytosinarabinosidu a fludarabinu, která je vždy následována alogenní transplantací hematopoetických kmenových buněk (HSCT). Naděje na vyléčení relapsu AML pouze chemoterapií je zcela minimální. Souhrnná data o léčbě relapsu AML byla publikována v analýze týkající se mezinárodního protokolu Relapsed AML 2001/01 [21]. V období VIII/2001 – III/2009 bylo v ČR léčeno 20 pacientů ve věku 0–18 let s primárně rezistentní nebo relabující AML. Po dosažení remise vysokodávkovanou chemoterapií byly děti indikovány k alogenní transplantaci hematopoetických kmenových buněk (HSCT). Z 20 zařazených pacientů 6 dětí neodpovědělo na léčbu, 2 zemřely časnou smrtí, dvanáct (60 %) pacientů dosáhlo remise a 11 z nich podstoupilo alogenní HSCT. Celkem žilo s mediánem sledování 5,8 roku 6 (30 %) dětí, všechny po alogenní transplantaci (2 děti po 2. HSCT). Pravděpodobnost 5letého přežití bez události (EFS) je pro celou skupinu 18 ± 9 %, pravděpodobnost celkového přežití (OS) 34 ± 11 %. Léčba ve studii Relapsed AML 2001 zlepšila prognózu dětí s relapsem AML v České republice ve srovnání s předchozím obdobím 1993–2001 (n = 22 dětí, OS 14 %).
Transplantace hematopoetických kmenových buněk
Alogenní transplantace hematopoetických kmenových buněk (HSCT) je indikována u pacientů s vysoce rizikovou AML v první remisi onemocnění a u všech pacientů s relapsem AML. Při nedostupnosti vhodného dárce je některými pracovními skupinami indikována v 1. remisi i transplantace autologní [22], v 2. remisi vzhledem k velmi nepříznivé prognóze onemocnění je transplantace prováděna i od alternativního dárce (tzn. neshodný nepříbuzný dárce, event. haploidentický dárce po úpravě štěpu CD34+ selekcí).
Po přípravném myeloablativním režimu založeném na podání kombinace chemoterapie, event. malé dávky celotělového ozáření (CTO), je podán štěp hemato-poetických kmenových buněk. Přípravný režim je podle současně používaného protokolu AML SCT BFM 2007 indikován v závislosti na odpovědi na léčbu, u pacientů se špatnou odpovědí je používána kombinace FLAMSA (fludarabin, amsacrin, cytosinarabinosid, cyklofosfamid, CTO 4 Gy), pacienti s dobrou odpovědí jsou připravováni režimem BuCyMel (busulfan, cyklofosfamid, melfalan). Součástí přípravného režimu je i lymfodeplece antithymocytárním globulinem (ATG). Prevence reakce štěpu proti hostiteli (GVHD) je standardně prováděna kombinací metotrexátu a cyklosporinu A (CsA). Podávání CsA probíhá po dobu měsíců výjimečně i let v závislosti na aktivitě GVHD.
V potransplantačním období jsou prováděny pravidelné kontroly kostní dřeně vzhledem k riziku potransplantačního relapsu onemocnění. Dlouhodobé sledování je zaměřené na prevenci a léčbu pozdních komplikací endokrinologických (hypofunkce štítné žlázy, hypergonadotropní hypogonadismus), pohybových (postižení kloubů při GVHD, aseptické nekrózy), očních (katarakta), kardiologických (kardiomyopatie, hypertenze), metabolických (hyperlipidémie) a dalších.
Závěr
AML je u dětí vzácné onemocnění, jeho léčba je velmi náročná a je zatížena vysokým rizikem fatálních komplikací nejčastěji infekčních či krvácivých.
Pacienti s hyperleukocytózou při diagnóze nebo s projevy DIC jsou ohroženi časnou smrtí a vyžadují urgentní transport do dětského hematoonkologického centra. Vysokodávkovanou chemoterapií lze dosáhnout kompletní remise až u 90 % pacientů, část pacientů s vysokým rizikem relapsu je indikována k alogenní HSCT již v 1. remisi onemocnění. Přes velmi intenzivní léčbu přibližně 30 % dětí prodělá relaps onemocnění, jehož terapie zatím nedosahuje uspokojivých výsledků.
Pacienti po úspěšné léčbě AML vyžadují dlouhodobou dispenzarizaci se zaměřením na kardiologické kontroly vzhledem k riziku rozvoje kardiomyopatie po léčbě antracykliny.
MUDr. Lucie Šrámková, Ph.D.
Klinika dětské hematologie a onkologie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: lucie.sramkova@fnmotol.cz
Zdroje
1. Bennett JM, Catovsky D, Daniel MT, et al. Proposed revised criteria for the classification of acute myeloid leukemia: A report of the French--American-British Cooperative Group. Ann Intern Med 1985; 103 : 620–625.
2. Neuhoff Ch, Reinhardt D, Sander A, et al. Prognostic impact of specific chromosomal aberrations in a large group of pediatric patients with acute myeloid leukemia treated uniformly according to trial AML-BFM 98. J Clin Oncol 2010; 28 : 2682–2689.
3. van der Velden VH, van der Sluijs-Geling A, Gibson BE, et al. Clinical significance of flowcytometric minimal residual disease detection in pediatric acute myeloid leukemia patients treated according to the DCOG ANLL97/MRC AML12 protocol. Leukemia 2010; 24 : 1599–1606.
4. Rubnitz JE, Inaba H, Dahl G, et al. Minimal residual disease-directed therapy for childhood acute myeloid leukaemia: results of the AML02 multicentre trial. Lancet Oncol 2010; 11 : 543–552.
5. Creutzig U, Zimmermann M, Ritter J, et al. Definition of a standard-risk group in children with AML. Br J Haematol 1999; 104 : 630–639.
6. Creutzig U, Ritter J, Zimmermann M, et al. Improved treatment results in high-risk pediatric acute myeloid leukemia patients after intensifica-tion with high-dose cytarabine and mitoxantrone: Results of study Acute Myeloid Leukemia-Berlin-Frankfurt-Munster 93. J Clin Oncol 2001; 19 : 2705–2713.
7. Creutzig U, Ritter J, Zimmermann M, et al. Idarubicin improves blast cell clearance during induction therapy in children with AML: Results of study AML-BFM 93. Leukemia 2001; 15 : 348–354.
8. Fernandez HF, Sun Z, Yao X, et al. Anthracycline dose intensification in acute myeloid leukemia. N Engl J Med 2009; 361 (13): 1249–1259.
9. Creutzig U, van den Heuvel-Eibrink MM, Gibson B, et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: recommendations from an international expert panel. Blood 2012; 120 (16): 3187–3205.
10. Stary J, Gajdos P, Blazek B, et al. Sjednocení léčby dětí s akutní mye-loidní leukémií v České republice podle protokolu AML-BFM 93. Cas Lek ces 2004; 143 : 257–263.
11. Stary J, Vavra V, Gajdos P, et al. Druhá celostátní léčebná studie AML--BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukémií v České republice. Trans Hemat dnes 2008; 14 : 166–174.
12. Sramkova L, Sterba J, Stary J, et al. Development of treatment and clinical results in childhood acute myeloid leukemia in the Czech Republic. Memo February 2013; 6 (1): 41–45.
13. Lehrnbecher T, Sung L. Anti-infective prophylaxis in pediatric patients with acute myeloid leukemia. Expert Rev Hematol 2014 Dec; 7 (6): 819–830.
14. Lehrnbecher T, Varwig D, Kaiser J, et al. Infectious complications in pediatric acute myeloid leukemia: Analysis of the prospective multiinstitutional clinical trial AML-BFM 93. Leukemia 2004; 18 : 72–77.
15. Creutzig U, Zimmermann M, Reinhardt D, et al. Early deaths and treatment-related mortality in children undergoing therapy for acute mye-loid leukemia: Analysis of the multicenter clinical trials AML-BFM 93 and AML-BFM 98. J Clin Oncol 2004; 22 : 4384–4393.
16. Barlogis V, Auquier P, Bertrand Y, et al. Late cardiomyopathy in childhood acute myeloid leukemia survivors: an L.E.A. study. Haematologica 2015; Jan 23 [Epub ahead of print].
17. Kremer LC, van der Pal HJ, Offringa M, et al. Frequency and risk factors of subclinical cardiotoxicity after anthracycline therapy in children: a systematic review. Ann Oncol 2002; 13 (6): 819–829.
18. Lipshultz SE, Adams MJ, Colan SD, et al. Long-term cardiovascular toxicity in children, adolescents, and young adults who receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation 2013; 128 (17): 1927–1995.
19. Shankar SM, Marina N, Hudson MM, et al. Monitoring for cardiovascular disease in survivors of childhood cancer: report from the Cardiovascular Disease Task Force of the Children‘s Oncology Group. Pediatrics 2008; 121 (2): e387–e396.
20. Berbis J, Michael G, Baruchel A, et al. Cohort profile: The French Childhood Cancer Survivor Study for Leukaemia (LEA Cohort). Int J Epidemiol 2014 : 1–9.
21. Zdrahalova K, Sedlacek P, Smisek P, et al. Léčebná studie Relapsed AML 2001/01, 02 pro děti s relapsem akutní myeloidní leukemie nebo primárně rezistentní nemocí zlepšila jejich naději na vyléčení. Trans Hemat dnes 2011; 17 : 113–121.
22. Locatelli F, Masetti R, Rondelli R, Zecca M, et al Outcome of children with high-risk acute myeloid leukemia given autologous or allogeneic hematopoietic cell transplantation in the aieop AML-2002/01 study. Bone Marrow Transplant 2014; Nov 10.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2015 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Akutní myeloidní leukémie v dětském věku
- Transplantace kmenových buněk krvetvorby v terapii akutní lymfoblastické leukémie dětského věku
-
Pavel Kabíček, Jana Hamanová, Ladislav Csémy a kolektiv:
Rizikové chování v dospívání a jeho vztah ke zdraví - Dětské akutní leukémie – Editorial
- Leukémie u dětí ve 21. století
- Etiologie dětských ALL a AML, molekulární genetika a minimální reziduální nemoc
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
- Cytogenetika akútnych leukémií u detí
- Akútna lymfoblastová leukémia
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní myeloidní leukémie v dětském věku
- Akútna lymfoblastová leukémia
- Leukémie u dětí ve 21. století
- Imunofenotypizace a jiné využití průtokové cytometrie u akutních leukémií
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



