-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv perikoncepční expozice kouření na mužskou reprodukci: poměr pohlaví a nástup puberty
Influence of periconceptional and prenatal exposure to smoking on male reproduction: sex rate and puberty
Background:
Associations between periconceptional and antenatal exposure to paternal smoking and morphological and functional changes of reproduction among their male offspring, including the earlier sexual maturation, have been described in number recent studies.Methods:
In the prospective European Longitudinal Study of Pregnancy and Childhood (ELSPAC) the data about parental periconceptional smoking behaviour were collected at 18th week of pregnancy and were available for every child. Physicians´ observations of male offsprings when they reached the ages 11 (210 persons), 13 (256 persons), and 15 (326 persons) years included also evaluation of their secondary sexual markers development. Unified criteria distinguishing five developmental stages were described in details and filled out with practical graphic pictograms. The differences between the frequency of the start of puberty among exposed and non-exposed boys were evaluated by the statistic programme EPI INFO, version 6.04a (Mantel-Haenszel, chi-square and Yates tests).Results:
Parental periconceptional smoking was associated with the earlier start of puberty: higher frequency of 2nd and 3rd stadium of penile, testes and pubic hair development at age 11 years (OR 2.73, 95% CI 1.00, 7.49; p=0.02) and higher frequency of 2nd and 3rd stadium of pubic hair development at age 13 years (OR 3.61, 95% CI 0.88, 14.61; p=0.03). The last observation at age 15 years found no differences between non-exposed and prenatally exposed boys. Maternal smoking before and during pregnancy was associated with no-significant decreasing of newborns´ male/female sex ratio (0.65; p=0.065).Conclusion:
In the ELSPAC cohort, parental smoking during periconceptional period accelerated the earlier start of puberty among their male offspring. The newborns male/female sex ratio was not influenced by their antenatal exposure to parental smoking.Key words:
periconceptional exposure to smoking, male offspring puberty, sex ratio
Autoři: D. Hrubá 1; L. Kukla 2; P. Okrajek 2; V. Šikolová 1
Působiště autorů: Ústav preventivního lékařství LF MU, Brno přednostka prof. MUDr. Z. Derflerová Brázdová, DrSc. 1; Výzkumné pracoviště preventivní a sociální pediatrie LF MU, Brno přednosta doc. MUDr. L. Kukla, CSc. 2
Vyšlo v časopise: Čes-slov Pediat 2013; 68 (5): 283-292.
Kategorie: Původní práce
Souhrn
Úvod:
Výsledky řady studií popisují vliv perikoncepční a prenatální expozice kouření rodičů na morfologické a funkční změny pohlavního ústrojí včetně časnějšího nástupu pohlavního dozrávání u jejich mužských potomků.Metody:
V prospektivní Evropské longitudinální studii o těhotenství a dětství (ELSPAC) byly údaje o kuřáckém chování rodičů v perikoncepčním období získávány v 18. týdnu těhotenství a byly dostupné pro každé individuální dítě. Lékařská vyšetření mužských potomků v době, kdy dosáhli věku 11 (210 osob), 13 (256 osob) a 15 (326 osob) let, zahrnovala i hodnocení vývoje jejich sekundárních pohlavních znaků. Jednotná kritéria pro rozlišení 5 vývojových stadií byla detailně popsána včetně názorných grafických piktogramů. Rozdíly ve frekvenci nástupu puberty mezi exponovanými a neexponovanými chlapci byly hodnoceny testy Mantelův-Haenszelův, chí-kvadrát a Yates v programu EPI INFO, verze 6.04a.Výsledky:
Kouření obou rodičů v době početí urychlilo nástup puberty u chlapců: vyšší výskyt 2. a 3. stupně vývoje penisu, testes i pubického ochlupení v 11 letech věku (OR 2,73, 95% CI 1,00, 7,49; p = 0,02) a vyšší četnost 2. a 3. stupně pubického ochlupení ve věku 13 let (OR 3,61, 95% CI 0,88, 14,61; p = 0,03). Při posledním vyšetření v 15 letech již nebyly nalezeny žádné rozdíly mezi neexponovanými a prenatálně exponovanými hochy. Kuřáctví matky před těhotenstvím bylo asociováno se snížením poměru mužského/ženského pohlaví novorozenců (0,65; p = 0,065); rozdíly byly jen na hranici statistické významnosti.Závěr:
V kohortě ELSPAC kouření rodičů v perikoncepčním období urychlilo dřívější nástup puberty u signifikantně většího počtu mužských potomků. Poměr mužského/ženského pohlaví novorozenců nebyl jejich antenatální expozicí kouřícím rodičům ovlivněn.Klíčová slova:
perikoncepční expozice kouření, puberta mužských potomků, poměr pohlavíÚvod
Meta-analytická studie Carlsenové, publikovaná začátkem 90. let minulého století, popisovala trend postupného snižování objemu ejakulátu a hustoty spermií v období let 1938–1991. Nejnovější práce tento nepříznivý trend nejen potvrdily, ale zabývaly se i hypotézou, že jednou z příčin poruch mužské fertility mohou být i podmínky ve fetálním období života [1].
Dalším zajímavým epidemiologickým jevem je, že podle dlouholetých statistik dochází od poloviny 20. století ke snižování poměru narozených chlapců na 100 dívek [2]. Poměr pohlaví u novorozenců se pokládá za určitý indikátor zdraví populace, neboť zahrnuje fakta o přirozené menší odolnosti spermií a plodů mužského pohlaví k působení různých rizikových faktorů zevního prostředí, které vychylují očekávaný poměr 1 : 1 [3]. Za jeden z možných faktorů ovlivňujících zmíněný trend je pokládáno kouření rodičů v době koncepce a těhotenství [4, 5, 6]. Uvedené epidemiologické souvislosti a z nich odvozené hypotézy iniciovaly organizaci studií cíleně zaměřených na sledování vlivu expozice při početí a během prenatálního života na změny vývoje a funkce mužského pohlaví.
Poškození morfologie a funkce varlat v důsledku expozice matčinu kouření bylo pozorováno už během embryonálního a fetálního období. Vyšetření mužských plodů získaných z legálních interrupcí v 1. trimestru prokázalo redukci počtu zárodečných i somatických buněk v testes v závislosti na velikosti expozice (počet denně vykouřených cigaret) [7]. Byly popsány i vývojové změny receptorů luteotropního hormonu a hladin luteotropního hormonu u exponovaných plodů [8]. Obdobné vyšetření prováděné ve 2. trimestru však rozdíly v počtu zárodečných, Leydigových a Sertoliho buněk mezi exponovanými a neexponovanými plody už neprokázalo [9]. Podobné nálezy byly zjištěny i po expozici experimentálních zvířat [10, 11].
Jiné studie potvrdily, že výše uvedené poruchy vývoje orgánů a funkcí ovlivňujících reprodukci nacházené v prenatálním období mohou přetrvávat až do dospělosti. U mužů narozených matkám kouřícím v těhotenství se častěji vyskytují menší testes, snížení celkového počtu spermií i jejich koncentrace, menší zastoupení motilních a morfologicky normálních spermií [12, 13, 14, 15, 16, 17]. Mnohé z těchto studií našly i vztah mezi dávkou (počet denně vykouřených cigaret, hladiny kotininu – specifický metabolit nikotinu) a účinkem. Naopak vztahy mezi kouřením otců a poruchami spermiogeneze či zvýšeným rizikem oligozoospermie nalezeny nebyly [12, 14, 15, 16].
Výsledky sledování produkce pohlavních hormonů u mužů s rozdílnou prenatální expozicí kouření nejsou jednotné. Zatímco některé práce hormonální změny po expozici prokázaly [12, 17, 18], jiné studie tyto výsledky nepotvrdily [14, 15, 19, 20].
Zatím není jasné, které chemické látky z celkového počtu asi 5000 vdechovaných kuřáky cigaret, z nichž mnohé pronikají k rodičovským zárodečným buňkám a také placentální bariérou až do plodu, jsou kauzálními faktory nacházených poruch fertility. Předpokládá se, že polycyklické aromatické uhlovodíky z cigaretového kouře mohou mít v prenatálním období přímý škodlivý účinek na lidské zárodečné buňky, indukují apoptózu, v jejímž důsledku může dojít ke snížení spermatogeneze v dospělosti [21].
Některé epidemiologické studie našly mírně zvýšené riziko výskytu kryptorchismu u hochů, jejichž matky kouřily v těhotenství [22], které bylo významné u potomků silných kuřaček [23, 24] a dokonce i u chlapců narozených ženám používajících přípravky náhradní nikotinové terapie [25]. Naopak prenatální expozice kouření se zdá být protektivním faktorem ve smyslu snížení rizika hypospadie [22] a incidence rakoviny testes [26].
Hormonální a morfologické změny pozorované u exponovaných plodů iniciovaly hypotézu o možném ovlivnění hypotalamo-pituitárních funkcí s následným posunem nástupu puberty u prenatálně exponovaných chlapců [17]. Tuto hypotézu jsme ověřovali ve studii ELSPAC (European Longitudinal Study of Pregnancy and Childhood), zahájené v letech 1990–1991 v kohortě těhotných žen v Brně a okrese Znojmo. Ve studii jsou získávány anamnestické údaje od obou rodičů v každé etapě, kdy jsou vyšetřováni jejich potomci. První anamnestické šetření se uskutečnilo v 18. týdnu těhotenství při prvním ultrazvukovém vyšetření ženy, poslední data o kohortě byla získávána při dosažení věku 18–19 let. Kromě mnoha znaků charakterizujících zdravotní stav a sociální prostředí každého z rodičů od dětství do současnosti, byli rodiče tázáni i na jejich kuřácké chování v anamnéze, v době kolem početí sledovaného dítěte, na začátku těhotenství i v jeho průběhu. Z těchto záznamů je možno odvozovat prenatální expozici dětí cigaretovému kouři a ta byla vztažena k mužským potomkům v jejich věku 11, 13 a 15 let. Informace o zdravotním stavu dítěte a jeho tělesném i psychickém vývoji a podmínkách, v nichž vyrůstá a vyvíjí se, jsou ve studii ELSPAC získávány v předem stanovených časových etapách z několika zdrojů: od matky, od spolupracujících a proškolených lékařů, ze specializovaných vyšetření prováděných výzkumným týmem u vybraných skupin dětí, později od učitelů a od jedenáctého roku věku i od samotných dětských probandů. Pro tuto analýzu jsme zvolili údaje z objektivních opakovaných lékařských vyšetření hochů realizovaných ve dvouletých intervalech mezi 11. a 15. rokem jejich života.
Metodika a soubory
Podle údajů rodičů o kouření před otěhotněním matky byly děti rozděleny do 4 skupin: (1) oba rodiče nekuřáci (NK), (2) oba rodiče kuřáci (K), (3) kouřil jen otec (OK), (4) kouřila jen matka (MK). V dotaznících s instrukcemi pro lékaře jsou uváděny u každého zdravotního znaku podrobné diagnostické charakteristiky, které mají sjednotit kritéria hodnocení zdravotního stavu získávaná od různých lékařů. Pro posouzení nástupu a vývoje sekundárních pohlavních znaků byla stanovena kritéria podle Tannerovy škály (slovní popis byl doplněn piktogramy):
Vývoj pubického ochlupení
- žádné ochlupení
- krátké světlé chloupky (rovné nebo vlnité)
- tmavší, hrubší, vlnitější chloupky, pokrývají větší oblast
- struktura chloupků jako v dospělosti, ochlupení nezasahuje na stehna
- ochlupení tvoří trojúhelník, zasahuje na stehna
Vývoj penisu a testes
- velikost a tvar nezměněn proti předchozímu období
- větší penis i testes, změna vzhledu kůže skrota
- další růst penisu, pokles varlat
- další růst penisu i varlat, zvětšení žaludu, tmavší skrotum
- velikost i tvar dospělého genitálu
Informace o kouření rodičů v období kolem početí byly získány pro 1122 rodičovských párů z Brna. Z tohoto souboru byly lékaři vyšetřeny děti (hoši i dívky) od 787 rodičovských párů. Oddíl dotazníku pojednávající o vyšetření sekundárních pohlavních znaků u chlapců byl někdy lékaři vynechán, takže znaky charakterizující průběh pohlavního dozrávání byly popsány u 210 jedenáctiletých, 256 třináctiletých a 326 patnáctiletých hochů. Složení rodičovských párů podle zastoupení nekuřáků a kuřáků bylo v celkovém a analyzovaném souboru velmi podobné (tab. 1).
Tab. 1. Kouření rodičů v perikoncepčním období (9 měsíců před otěhotněním ženy). 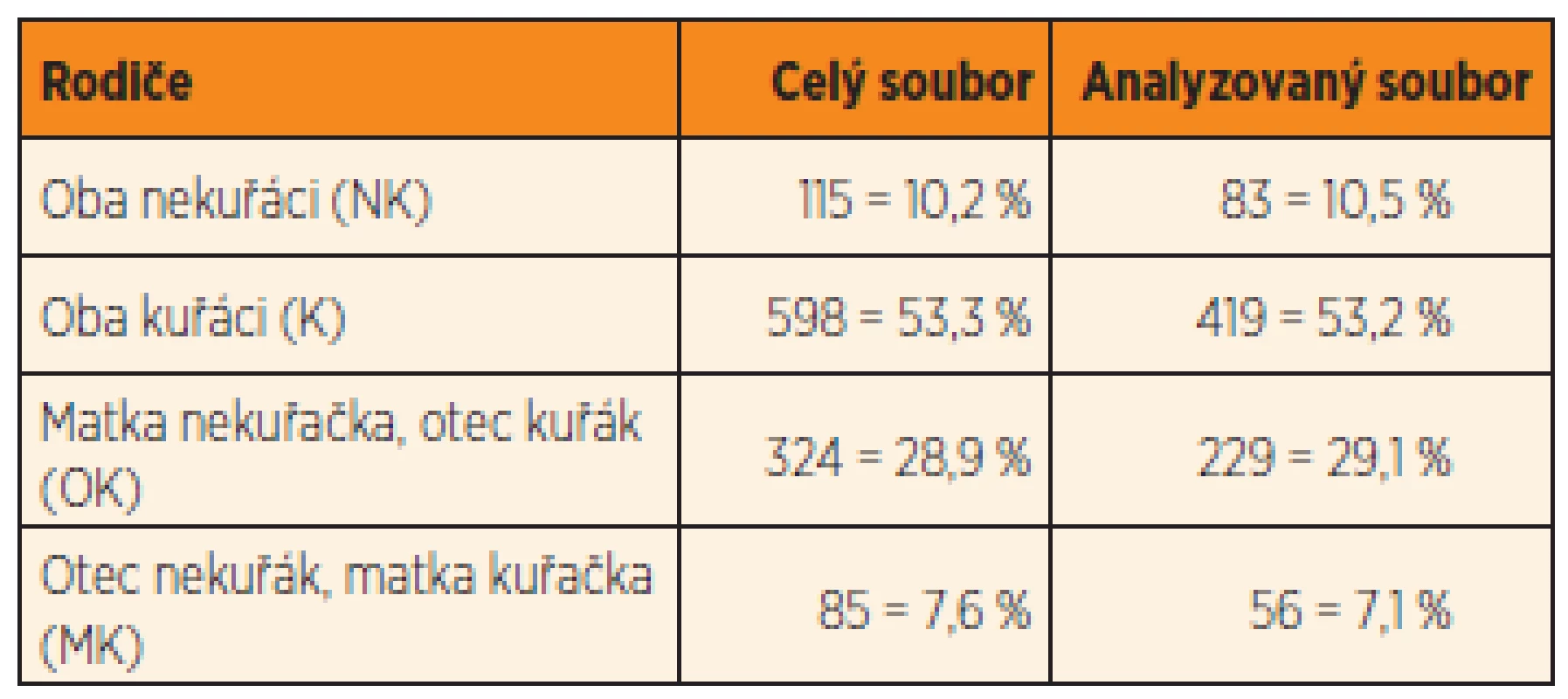
Rozdíly ve frekvenci výskytu jednotlivých stadií pohlavního dozrávání byly porovnávány mezi chlapci nekouřících rodičů a těmi, kteří byli exponováni v době početí; testovány byly ve statistickém programu EPI INFO verze 6.04a (testy Mantelův-Haenszelův, chí-kvadrát, Yates).
Výsledky
U hochů ve věku 11 let kouření rodičů v době početí urychlilo nástup puberty, a to jak vývojem penisu, testes, tak i pubického ochlupení hodnocených stupněm 2 a 3; stupeň 4 se vyskytoval jen u jednotlivců (dohromady u 3 hochů) a stupeň 5 zjištěn nebyl ani v jednom případě. Statistická významnost byla nalezena ve vyšší frekvenci časného nástupu vývoje sekundárních pohlavních znaků mezi potomky obou kouřících rodičů při početí v porovnání se syny nekouřících rodičů (OR 2,73, 95% CI 1,00, 7,49; p = 0,02). Tendence k urychlení nástupu puberty byla patrná i v souvislosti s kouřením samotné matky, ovšem vzhledem k malému počtu probandů nebyly rozdíly statisticky významné. Naopak ve skupině, kde kouřili výhradně jen otcové, se urychlení nástupu puberty proti nekuřácké skupině neprojevilo (tab. 2). Trend urychlení nástupu puberty (2. a 3. stadium) u exponovaných byl patrný ještě ve věku 13 let, ale statisticky významné rozdíly v porovnání s potomky nekuřáků se projevily jen při hodnocení pubického ochlupení (OR 3,61, 95% CI 0,88, 14,61; p = 0,03). V tomto věku se ve všech skupinách vyskytovalo stadium 4 shodně u necelé pětiny vyšetřených, sta-dium 5 jen u jednoho jedince (tab. 2). Ve věku 15 let už většina chlapců (60 a více procent) ze všech skupin s rozdílnou prenatální expozicí byla hodnocena ve stadiu 4 a 5, ostatní ve stadiu 2 a 3; rozdíly nebyly statisticky významné (tab. 2).
Tab. 2. Začátek puberty a další vývoj sekundárních pohlavních znaků u chlapců ve věku 11, 13 a 15 let ve vztahu ke kuřáctví rodičů v perikoncepčním období (%). 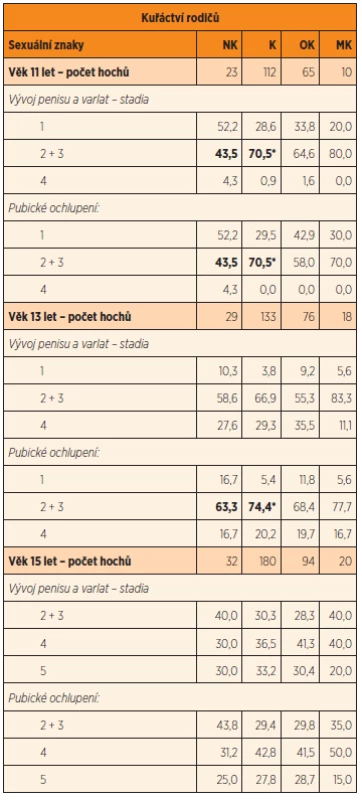
Urychlení nástupu puberty v 11 letech nemělo vztah k porodní hmotnosti hochů: ve skupině, u níž puberta ještě nezačala, byla průměrná porodní hmotnost 3427 g (s.d. 359 g), ve skupině hodnocené stupněm 2 byla porodní hmotnost 3454 g (s.d. 333 g) a ve skupině hodnocené stupněm 3 byla porodní hmotnost 3439 g (s.d. 351 g). Rozdíly nebyly statisticky významné (obr. 1).
Obr. 1. Porodní hmotnost (průměr, směrodatná odchylka) u jedenáctiletých hochů v různém stadiu puberty. 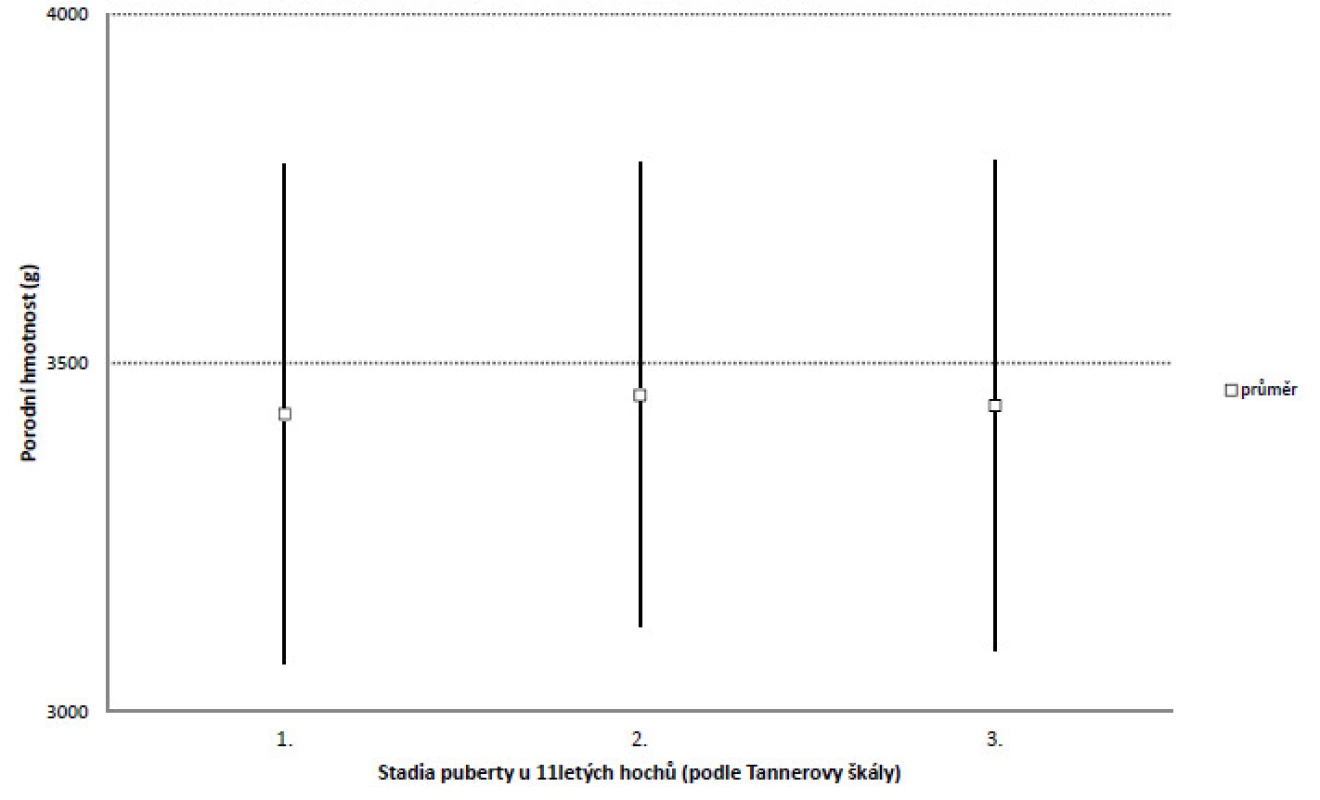
Údaje o kouření kolem početí byly vztahovány také k pohlaví narozeného dítěte. Pokud byli oba rodiče nekuřáci, byl poměr pohlaví lehce vychýlen ve prospěch dívek: v celém sledovaném souboru byl poměr mužského k ženskému pohlaví 1,07 (tab. 3). Kouření otce v rodičovském páru přispívalo k většímu zastoupení hochů; rozdíly však nejsou statisticky významné. Kuřáctví matky bylo asociováno se snížením počtu narozených chlapců (poměr 0,65), ale v porovnání s poměrem pohlaví u dětí nekuřáckých rodičů jsou rozdíly jen na hranici statistické významnosti (p = 0,06).
Tab. 3. Poměr pohlaví novorozenců ve vztahu ke kouření rodičů v perikoncepčním období. 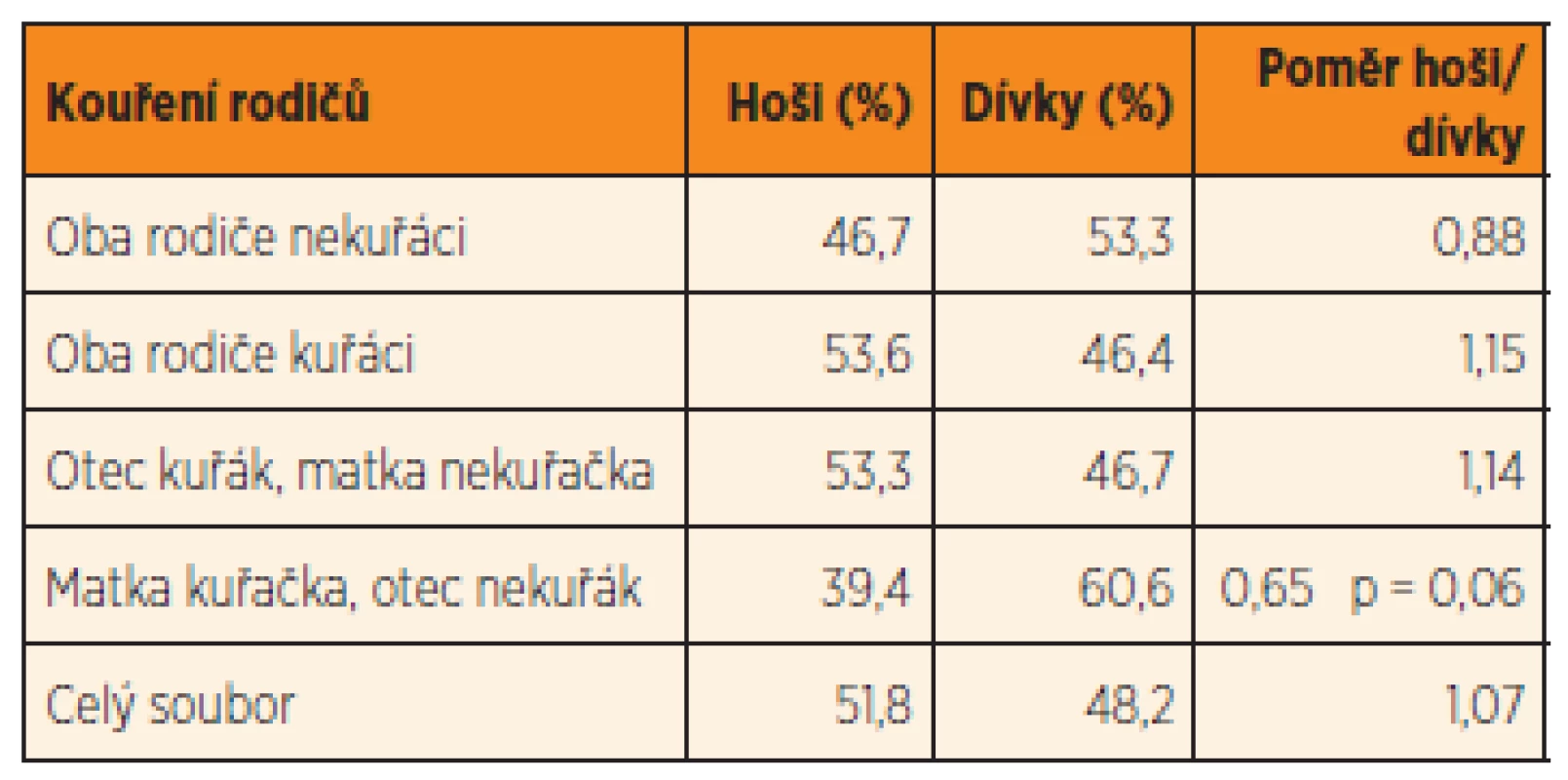
Diskuse
V analyzovaném souboru studie ELSPAC bylo v době kolem početí jen 10 % nekouřících rodičovských párů, zatímco více než polovina potomků měla oba rodiče kuřáky. V průběhu těhotenství ženy postupně přestávaly kouřit, frekvence kuřaček klesla z 60,9 % při početí na 15,8 % při porodu; zásadní zlom v prevalenci kuřaček byl v období diagnostiky těhotenství, tj. ve 2. měsíci. V souboru byl jen ojedinělý výskyt silných kuřaček (více než 15, resp. 20 cigaret denně), a pokud ženy nepřestaly zcela kouřit během těhotenství, počet cigaret omezily.
Poměr pohlaví u novorozenců v celém souboru ELSPAC (tj. u 5548 dětí z Brna a Znojma) byl 1,07 ve prospěch mužského pohlaví a zcela shodný poměr byl i v té skupině, u které bylo možno hodnotit kuřáctví rodičů při početí. Ve studii ELSPAC jsme nepotvrdili vliv kouření rodičů na změny poměru pohlaví v neprospěch hochů; matky kouřící při početí a v těhotenství měly sice nižší zastoupení hochů v jejich potomstvu, ale statisticky nevýznamně. K podobným výsledkům dospěly i studie Obela et al. [27] a Herona a Nesse, jejichž longitudinální studie používá stejnou metodiku jako česká verze ELSPAC [28]. Významně zvýšený poměr narozených chlapců kouřícím rodičům popsali Beratis et al. [29], naopak nižší počet mužských potomků kuřáků byl nalezen v jiných studiích [4, 5, 6]; takto vychýlený poměr pohlaví byl častější u potomků silných kuřáků [6, 30]. Protože není znám mechanismus působení, jsou zvažovány různé hypotézy pro vysvětlení různých výsledků: anti-estrogenní účinky nikotinu, různý vliv cigaretového kouření na motilitu spermií s X a Y chromozomy, hormonální dysbalance ovlivňující implantaci mužského embrya apod. [6].
Významně častěji byl zjištěn časný nástup puberty ve skupině potomků obou kouřících rodičů, a to jak ve věku 11 let, tak i 13 let; při dalším vyšetření u patnáctiletých už rozdíly mezi jednotlivými skupinami hochů nebyly významné. Také kouření samotných matek v době početí bylo asociováno s vyšší – ale vzhledem k máločetnému souboru v této skupině statisticky nevýznamnou – četností časného nástupu puberty u jejich synů, hodnoceného podle vývoje penisu, testes a pubického ochlupení. Naše výsledky potvrzují dříve publikované závěry studie zahrnující 3500 mladých dánských mužů [17]. U mužů s pozitivní anamnézou perikoncepční expozice našli signifikantně snížené hladiny inhibinu B a poměru inhibinu B/FSH (folikulární stimulační hormon). Obdobné výsledky popsala i studie Storgaarda et al. [12]. Hormonální dysbalance, která se často objevuje u kuřáků a přetrvává po určitou dobu i během abstinence, může ovlivnit funkce hypotalamo-pituitární osy, což by vysvětlovalo zmíněné nálezy [17]. Může však také iniciovat primární redukci testikulární spermiogenetické kapacity, kterou autoři obou studií skutečně prokázali, neboť našli u perinatálně a prenatálně exponovaných mladých mužů kromě nástupu puberty v mladším věku a nižší průměrné tělesné výšky také nižší obsah i hustotu spermií, menší rozměry testes. Časná puberta zkracuje dětské období růstu, což pak vysvětluje i menší vzrůst hochů, u nichž puberta nastupuje v mladším věku [31, 32]. Pro úplnost je však třeba připomenout, že jiné studie asociace mezi perinatální a intrauterinní expozicí kouření a hodnotami inhibinu B nezjistily [18, 19, 20].
Nástup puberty může ovlivnit řada životních podmínek během intrauterinního vývoje i po narození. Pro možný přímý vliv expozice kouření rodičů v perikoncepčním a intra-uterinním období svědčí výsledky relativně mladého vědního oboru zaměřeného na výzkum epigenetických mechanismů, kterými zevní faktory mohou modifikovat fenotyp v období prenatální expozice. Práce zaměřené na studium úlohy nekódujících RNA (nc-RNA) popisují odlišné zastoupení některých podskupin mikroRNA ve spermiích kuřáků a nekuřáků [33–35]. Předpokládá se, že některé mikroRNA mohou ovlivňovat buněčnou proliferaci, diferenciaci a apoptózu v tkáních, v nichž se specificky vyskytují. Pokud spermie obsahující změněné mikroRNA oplodní vajíčko, přenesou změny fenotypu na další, přímo neexponovanou generaci [36]. Ještě významnější úloha je připisována další skupině ncRNA, třídě PIWI-RNA. Z experimentálních prací je zřejmé, že mají klíčový význam během vývoje linie zárodečných pohlavních buněk v embryonálním období savců. Výsledky epigenetických modifikací těchto PIWI-RNA se mohou manifestovat při spermiogenezi, aktivaci oocytů a schopností fertility u dospívajících a dospělých jedinců [37, 38]. Zatím ovšem ještě nevíme, které zevní faktory ovlivňují tvorbu nebo změny PIWI-RNA. Také další epigenetický mechanismus – modifikace histonových proteinů – byl popsán v souvislosti s kouřením v těhotenství. V placentárních buňkách modifikace histonu nepříznivě ovlivňují růst a diferenciaci placentární tkáně a přispívají k intrauterinní růstové retardaci plodu [39, 40].
Nástup puberty může ovlivňovat řada zevních faktorů, zejména sociálních a výživových. V posledních letech je věnována pozornost chemickým látkám, které ovlivňují hormonální rovnováhu a jsou zahrnovány pod pojem „endokrinní disruptory, resp. modulátory“. Představují nesourodou skupinu přírodních i syntetických hormonů, přírodních součástí rostlin, pesticidů, látek používaných při výrobě umělých hmot, různé konzumní, průmyslové i odpadní látky. Mohou působit prostřednictvím řady mechanismů (např. vazbou na receptory, ovlivněním syntézy a transportu hormonů) a vyvolávat funkční změny v různých orgánech. Jejich možné účinky na člověka jsou studovány ve čtyřech oblastech: reprodukce, nervové a psychické, imunologické a možné karcinogeneze. Výsledky studií jsou zatím spíše v oblasti epidemiologických souvislostí: ve vztahu k možné expozici endokrinním dis-ruptorům byl pozorován i vyšší výskyt předčasné puberty [41].
I když tyto další faktory nemůžeme vyloučit, zvažujeme, že náš soubor byl v těchto souvislostech velice homogenní: výsledky publikovaného šetření se týkaly jen brněnských dětí, jejichž expozice environmentálním faktorům byla podle našeho mínění obdobná. Děti žily ve 3–4členných rodinách, takže i sociální prostředí v období jejich dětství a začátků dospívání v 90. letech nevykazovalo významné rozdíly.
Ve studii ELSPAC nebylo možné provádět detailnější klinická nebo laboratorní sexuologická vyšetření. Mezi jedenáctiletými chlapci bylo v jednotlivých skupinách s rozdílnou perikoncepční expozicí 20–50 % těch, u nichž puberta nezačala, naopak 4. stadium bylo jen u jednotlivců a 5. u žádného vyšetřovaného. Ve 13 letech naopak jen u jedinců ještě nenastal nástup puberty, necelá pětina dosáhla stupně 4. V těchto dvou věkových kategoriích byla porovnávána prevalence 2. a 3. stadia v jednotlivých skupinách a byly nalezeny předpokládané rozdíly mezi potomky rodičů kouřících a nekouřících v perikoncepčním období. Ve věku 15 let už proces vývoje sekundárních pohlavních znaků postoupil u všech sledovaných chlapců tak, že rozdíly mezi jednotlivými skupinami zcela vymizely.
Za limitující faktory naší studie pokládáme to, že výpovědi rodičů o jejich kuřáckém chování byly pouze subjektivní, nepotvrzené objektivním laboratorním vyšetřením; nicméně tento problém mají i ostatní studie, s nimiž naše výsledky konfrontujeme. Naopak v prospektivním designu ELSPAC bylo možno přesně definovat nástup puberty při odborném a jednotném posuzování lékaři, zatímco mnohé retrospektivní studie byly postaveny také jen na subjektivních údajích starších respondentů.
Závěr
Studie ELSPAC našla vztahy mezi kouřením obou rodičů v období kolem početí a dřívějším nástupem puberty u takto exponovaných chlapců. Naznačila i souvislosti mezi kouřením samotné matky před otěhotněním a časnějším nástupem puberty u hochů. Ve skupině, kde kouřili jen otcové, se významné urychlení nástupu puberty proti nekuřácké skupině neprokázalo. Studie ukazuje, že jedním z faktorů přispívajícím k časnějšímu nástupu puberty je i kouření rodičů, a to už v perikoncepčním období. Naopak kouření rodičů v perinatálním období neovlivnilo poměr pohlaví u novorozenců.
Studie byla podpořena grantem IGA MZ ČR č. NS 9669 – 4/2008.
Došlo: 16. 5. 2012
Přijato: 31. 7. 2013
Prof. MUDr. Drahoslava Hrubá, CSc.
Ústav preventivního lékařství LF MU
Kamenice 5
625 00 Brno
e-mail: hruba@med.muni.cz
Zdroje
1. Wohlfahrt-Veje C, Main K, Skakkebaek N. Testicular dysgenesis syndrome: foetal origin of adult reproductive problems. Clin Endocrinol 2009; 74 : 459–465.
2. Davis DL, Gottlieb MB, Stampnitzky JR. Reduced ratio of male to female births in several industrial countries: a sentinel health indicator? JAMA 1998; 279 : 1018–1023.
3. Jongbloet PH, Roeleveld N, Groenewound HM. Where the boys aren´t? Dioxin and the sex ratio. Environ Health Perspect 2002; 110 : 1–3.
4. Fukuda M, Fukuda K, Shimizu T, Andersen YC, Byskov AG. Parental periconceptional smoking and male-female ratio of newborn infants. Lancet 2002; 359 : 1407–1408.
5. Parazzini F, Chatenoud L, Maffioletti C, Chiaffarino F, Caserta D. Periconceptional smoking and male:female ratio of newborns. Eur J Public Health 2005; 15 : 613–614.
6. Koshy G, Delpisheh A, Brabin L, Attia E, Brabin BJ. Parental smoking and increased likelihood od female births. Ann Hum Biol 2010; Early Online: 1-12; doi: 10.3109/03014461003742803.
7. Mamsen LS, Lutterpdt MC, Andersen EW, Skouby SO, Sorensen KP, et al. Cigarette smoking during early pregnancy reduces the number of embryonic germ and somatic cells. Hum Reprod 2010; 25 : 2755–2761.
8. Fowler PA, Bhattacharya S, Gromoll J, Monteiro A, O´Shaughnessy PJ. Maternal smoking and developmental changes in luteinizing hormone (LH) and the LH receptor in the fetal testis. J Clin Endocrinol Metab 2009; 94 : 4688–4695.
9. Fowler PA, Cassie S, Rhind SM. Maternal smoking during pregnancy specifically reduces human fetal desert hedgehog gene expression during testis development. J Clin Endocrinol Metab 2008; 93 : 619–626.
10. Scott HM, Hutchison GR, Mahood JK, Hallmark N, Welsh M, et al. Role of androgens in fetal testis development and dysgenesis. Endocrinology 2007; 148 : 2027–2036.
11. Sharpe RM. Environmental/lifestyle effects on spermiogenesis. Philos Trons R Soc B Biol Sci 2010; 365 : 1697–1712.
12. Storgaard L, Bonde JP, Ernst E, Spano M, Andersen CY, et al. Does smoking during pregnancy affect sons´ sperm counts? Epidemiology 2003; 14 : 278–286.
13. Jensen TK, Jorgernsen N, Punab M, Haugen TB, Suominen J, et al. Association of in utero exposure to maternal smoking with reduces semen quality and testis size in adulthood: a cross-sectional study of 1,770 young men from the general population in five European countries. Am J Epidemiol 2004; 159 : 49–58.
14. Jensen MS, Mabeck LM, Toft G, Thulstrup AM, Bonde JP. Lower sperm counts following prenatal tobacco exposure. Hum Reprod 2005; 20 : 2559–2566.
15. Ramlau-Hansen CH, Thulstrup AM, Storgaard L, Toft G, Olsen J, Bonde JP. Is prenatal exposure to tobacco smoking a cause of poor semen quality? A follow-up study. Am J Epidemiol 2007; 165 : 1372–1379.
16. Paasch U, Salzbrunn A, Glander, HJ, Plambeck K, Salzbrunn H, et al. Semen quality in sub-fertile range for a significant proportion of young men from the general German population: a co-ordinated, controlled study of 791 men from Hamburg and Leipzing. Int J Androl 2008; 31 : 93–102.
17. Ravnborg TL, Jensen TK, Andersson AM, Toppari J, Skakkebaek NE, Jorgensen N. Prenatal and adult exposures to smoking are associated with adverse effects on reproductive hormones, semen quality, final height and body mass index. Hum Reprod 2011; 26 : 1000–1011
18. Ramlau-Hansen CH, Thulstrup AM, Olsen J. Maternal smoking in pregnancy and reproductive hormones in adult sons. Ant J Androl 2007; 31 : 565-572.
19. Kerkhof GF, Leunissen RW, Willemsen RH, deJong FH, Stijnen T, Hokken-Koelega AC. Influence of preterm birth and birth size on gonadal function in young men. J Clin Endocrinol Metab 2009; 94 : 4243–4250.
20. Richthoff J, Elzanaty S, Rylander L. Association between tobacco exposure and reproductive parameters in adolescent males. Int J Androl 2007; 31 : 31–39.
21. Coutts SM, Fulton N, Anderson RA. Environmental toxicant-induced germ cell apoptosis in the human fetal testis. Hum Reprod 2007; 22 : 2912–2918.
22. Hackshaw A, Rodeck C, Boniface S. Maternal smoking in pregnancy and birth defects: a systematic review based on 173 687 malformed cases and 11.7 million controls. Hum Reprod Update 2011; 17 : 589–604.
23. Thorup J, Cortes D, Petersen BL. The incidence of bilateral cryptorchidism is increased and the fertility potential is reduces in sons born to mothers who have smoked during pregnancy. J Urol 2006; 176 : 734–737.
24. Jensen MS, Toft G, Thulstrup AM. Cryptorchidism according to maternal gestational smoking. Epidemiology 2007; 18 : 220–225.
25. Damgaard IN, Jensen TK, Petersen JH. Risk factors for congenital cryptorchidism in a prospective birth cohort study. PLoS One 2008; 3: e3051.
26. Tuomisto J, Holl K, Rantakokko P. Maternal smoking during pregnancy and testicular cancer in the sons: a nested case-control study and a meta-analysis. Eur J Cancer 2009; 45 : 1640–1648.
27. Obel C, Henriksen TB, Hedegaard M, Bech BH, Wisborg K, Olsen J. Periconceptional smoking and the male to female ratio in the offspring – re-assessment of a recently proposed hypothesis. Int J Epidemiol 2003; 32 : 470–471.
28. Heron J, Ness A. Lack of association between smoking behaviour and the sex ratio of offspring in the Avon longitudinal study of newborn infants. Fertil Steril 2004; 81 : 700–702.
29. Beratis NG, Asimacopoulou A, Varbarigou A. Association of secondary sex ratio with smoking and parity. Fertil Steril 2007; 89 : 662–667.
30. Voight M, Hermanussen M, Wittwer-Backofen U, Fusch C, Hesse V. Sex-specific differences in birth weight due to maternal smoking during pregnancy. Eur J Pediatr 2006; 165 : 757–761.
31. Crel JC, Eugster EA, Rogol A, Ghizzoni L, Palmert MR. Consensus statement on the use of gonadotropin-releasing hormone analogs in children. Pediatrics 2009; 123: e752–e762.
32. Varvarigou AA, Asimakopoulou A, Beratis NG. Impact of maternal smoking on birth size: effect of parity and sex dimorphism. Neonatology 2009; 95 : 61–67.
33. Lian J, Zhang X, Tian H, Liang N, Wang Y, Liang C, Altered microRNA expression in patients with non-obstructive azoospermia. Reprod Biol Endocrinol 2009; 7 : 13; doi.org/10.1186/1477-7828-7-13.
34. Wang C, Yang C, Chen X, Yao B, Zhu C. Altered profile of seminal plasma microRNAs in the molecular diagnosis of male infertility. Clin Chem 2011; 57 : 1722–1731.
35. Marczylo EL, Amoako AA, Konje JC, Gam TW, Marczylo TH. Smoking induces differential miRNAs expression in human spermatozoa. Epigenetics 2012 May; 7 (5); http://dx.doi.org/10.416/epi.7.5.19794.
36. Cuzin F, Rassoulzadegan M. Non-Mendelian epigenetic heredity: gametic RNAs as epigenetic regulators and transgenerational signals. Essays Biochem 2010; 48 : 101–106.
37. Thomson T, Lin H. The biogenesis and function of PIWI protein and piRNAs: Progress and prospect. Annu Rev Cell Dev Biol 2009; 25 : 355–376.
38. Siomi MC, Sato K, /ezic D, Aravin AA. PIWI interacting small RNAs: the vanguard of genome defence. Nat Rev Mol Cell Biol 2011; 12 : 246–258.
39. Maccani MA, Marsit CJ. Epigenetics in the placenta. Am J Reprod Immunol 2009; 62 : 78–89.
40. Suter MA, Abramovici A, Aagard-Tillery KM. Genetic and epigenetic influences associated with intrauterine growth restriction due to the tobacco exposure. Pediatr Endocrinol Rev 2010; 8 : 94–102.
41. Hrubá D. Endokrinní dysruptory. Hygiena 2009; 54 (1): 23–26.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2013 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Vliv perikoncepční expozice kouření na mužskou reprodukci: poměr pohlaví a nástup puberty
- Alkoholové a drogové intoxikace u dospívajících přijatých na dětská oddělení v ČR
- Je prostredie detských pieskovísk pre zdravie detí bezpečné?
- Rozdiely v duševnom zdraví žiakov v meste a na vidieku
- Neurokristopatie: Význam poruchy vývinu buniek neurálnej lišty pri vzniku vrodených chýb na príklade Hirschsprungovej choroby
- XV. Hradecké pediatrické dny 2013
- Klinické souvislosti vývoje štítné žlázy a jeho poruch u plodu a novorozence (2. část)
- Obezita
- Hubnutí
- Struma
- Abnormální nálezy hladin TSH, hormonů štítné žlázy a protilátek proti štítné žláze
- Vzpomínka na paní docentku Libuši Hradcovou, CSc. (1920 – 2012)
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Abnormální nálezy hladin TSH, hormonů štítné žlázy a protilátek proti štítné žláze
- Struma
- Hubnutí
- Alkoholové a drogové intoxikace u dospívajících přijatých na dětská oddělení v ČR
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



