-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kompozitní folikulární lymfom a in situ mantle cell neoplázie lymfatické uzliny: identifikace na základě vyšetření průtokovou cytometrií
Composite follicular lymphoma and in situ mantle cell neoplasia of lymph node: identification based on flow cytometry investigation
The aim of the presented case report is to acquaint the wider professional public with a rare case of composite follicular lymphoma (FL) and in situ mantle cell neoplasia (ISMCN) in a lymph node. In both components, characteristics of tumor cells populations were investigated primarily using flow cytometry. The patient was diagnosed with a combination of composite FL grade 3A (FL-G3A) and ISMCN, this finding was also confirmed by histopathological and immunohistochemical examination of the lymph node and complemented by fluorescence in-situ hybridization (FISH). The described case shows the diagnostic difficulties in detecting this rare lesion and an important role of flow cytometry in diagnostics of lymphomas.
Keywords:
Flow cytometry – follicular lymphoma – Composite lymphoma – In-situ mantle cell neoplasia
Autoři: Tomáš Jirásek 1; Marcela Mrhalová 2; Tomáš Zajíc 3; Miroslav Genský 4; Tomáš Klinger 1; Vít Campr 2
Působiště autorů: Oddělení patologie, Centrum PATOS, Krajská nemocnice Liberec, a. s. 1; Ústav patologie a molekulární medicíny 2. LF UK a Fakultní nemocnice v Motole, Praha 2; Oddělení molekulární genetiky a diagnostiky, Centrum PATOS, Krajská nemocnice Liberec, a. s. 3; Oddělení klinické hematologie, Centrum laboratorní medicíny, Krajská nemocnice Liberec, a. s. 4
Vyšlo v časopise: Čes.-slov. Patol., 59, 2023, No. 4, p. 177-183
Kategorie: Původní práce
Souhrn
Kazuistika popisuje vzácný případ kompozitního folikulárního lymfomu (FL) a in situ mantle cell neoplázie (ISMCN) v lymfatické uzlině. Obě nádorové populace byly primárně charakterizovány pomocí průtokové cytometrie. Nález kompozitního FL grade 3A (FL-G3A) a ISMCN byl potvrzen histopatologickým vyšetřením lymfatické uzliny, metodami imunohistochemickými a pomocí fluorescenční in situ hybridizace (FISH). Popsaný případ ukazuje na významnou roli průtokové cytometrie při záchytu tohoto vzácného nálezu.
Klíčová slova:
průtoková cytometrie – folikulární lymfom – Kompozitní lymfom – In-situ mantle cell neoplázie
Termín kompozitní lymfom (KL) označuje případy dvou nebo více morfologicky a imunofenotypicky odlišných lymfomů pozorovaných současně v jedné anatomické lokalizaci (1). Jedná se o vzácné postižení, četnost záchytu KL se pohybuje od 1 do 4,7 % všech lymfomů. Nejčastěji jde o kombinaci B nonHodgkinského maligního lymfomu s Hodgkinovým lymfomem nebo o kombinaci dvou různých B non-Hodgkinských lymfomů, i když kompozitní B a T-buněčné lymfomy byly také popsány (2). KL složené z folikulárního lymfomu (FL) a lymfomu z buněk pláště (MCL) jsou vzácné a nejsou zatím plně charakterizovány z genetického ani klinicko-patologického hlediska. Popisovaný případ demonstruje klinicko-patologickou, imunofenotypovou a genetickou charakteristiku KL složeného z „časné“ neoplázie z plášťových buněk a FL. Léze byla zachycena v lymfatické uzlině, která byla bezprostředně po chirurgickém odběru v nativním stavu zaslána i k vyšetření průtokovou cytometrií. Právě toto vyšetření jako první odhalilo v materiálu přítomnost dvou distinktních klonálních populací nádorových buněk. Následné histologické a molekulárně genetické vyšetření potvrdilo nálezy průtokové cytometrie. Cílem předloženého sdělení je popsat obraz vzácného nádoru, včetně jeho charakterizace v průtokové cytometrii a upozornit odbornou veřejnost na přínosy této metody v diagnostice maligních lymfomů.
Obr. 1. Průtoková cytometrie. 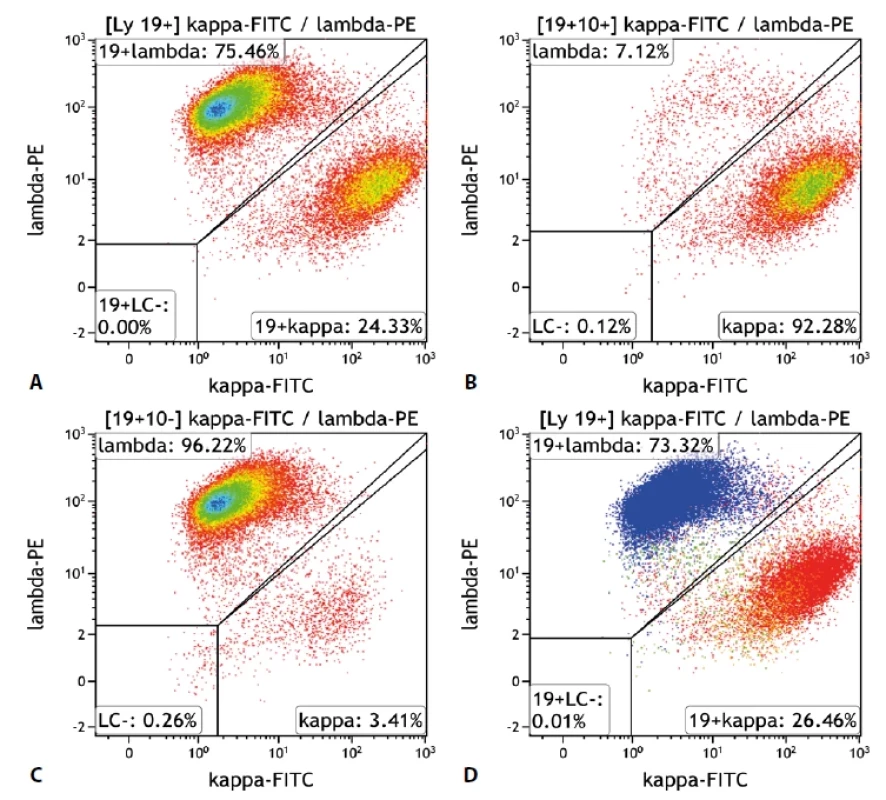
A. „Density plot“, gate na B-lymfocyty. Poměr exprese K/L je 0,32, což je hraniční hodnota pro průkaz klonální proliferace B lymfocytů s lehkým Ig řetězcem lambda. Při zobrazení dalších odchylek v imunofenotypu i morfologii B lymfocytů však zjistíme, že jsou zde přítomny dva klony. Jeden s expresí řetězců kappa a druhý s expresí řetězců lambda. B. „Density plot“, gate na B-lymfocyty CD19+/CD10+. Patrná monoklonalita lehkých imunoglobulinových řetězců kappa. Odpovídá folikulárnímu lymfomu. C. „Density plot“, gate na B-lymfocyty CD19+/ CD10-. Patrná monoklonalita lehkých imunoglobulinových řetězců lambda. Odpovídá mantle cell lymfomu. D. „Dot plot“, gate na B-lymfocyty. Barevně odlišeny dvě populace B-lymfocytů s monoklonální expresí lehkých imunoglobulinových řetězců – folikulární lymfom červeně = kappa, mantle cell lymfom modře = lambda. Oranžově benigní B-lymfocyty, zeleně příměs non-B-lymfocytů. Obr. 2. Průtoková cytometrie. 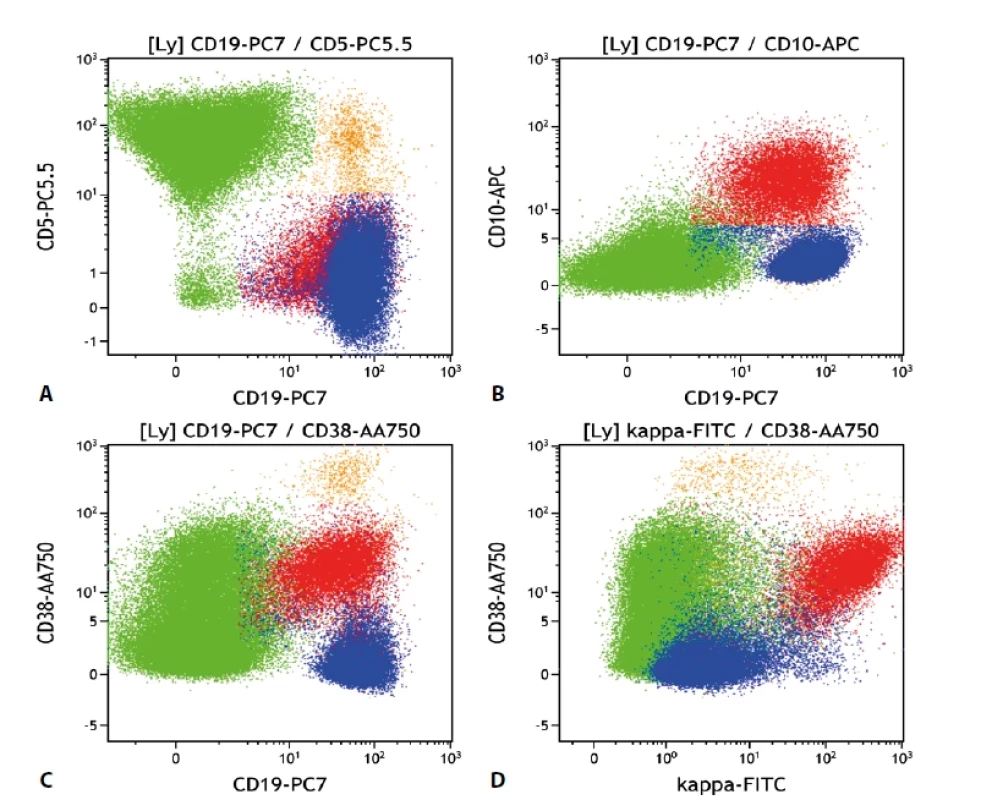
Gate na lymfocyty. Folikulární lymfom červeně, mantle cell lymfom modře, ostatní B-lymfocyty oranžově, non-B- -lymfocyty zeleně. Vše „Dot plot“. a) B-lymfocyty kromě drobné fyziologické populace neexprimují CD5, oba zastižené lymfomy jsou CD5 negativní (pro mantle cell lymfom netypické). CD19-/CD5+ jsou T lymfocyty. b) Populace folikulárního lymfomu je CD10 pozitivní, mantle cell lymfom negativní. c) Ilustrace odlišné exprese CD38 – folikulární lymfom pozitivní, mantle cell lymfom negativní. d) Exprese CD38 znázorněná na grafu se signálem kappa. Folikulární lymfom CD38 pozitivní v souvislosti s kappa variantou lehkých imunoglobulinových řetězců. Obr. 3. Průtoková cytometrie. 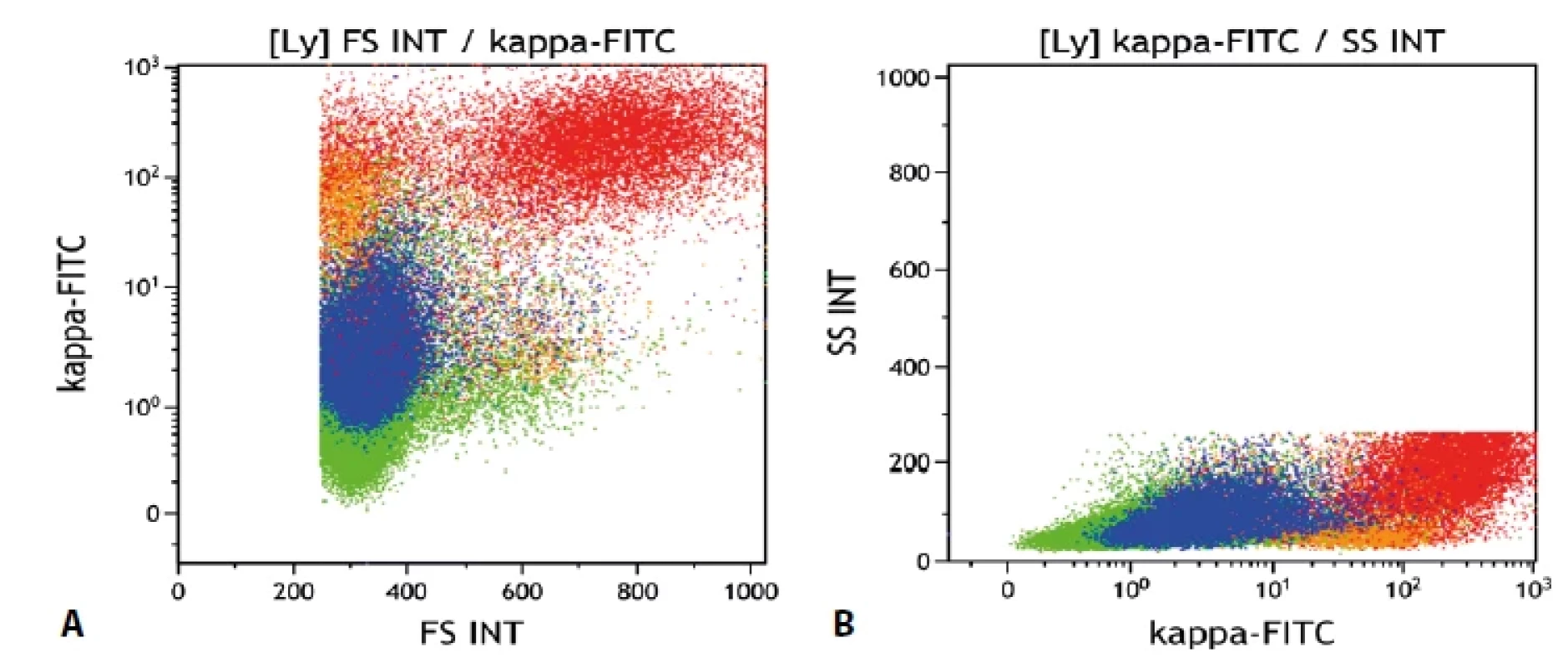
Gate na lymfocyty. Folikulární lymfom červeně, mantle cell lymfom modře, ostatní B-lymfocyty oranžově, non-B- -lymfocyty zeleně. Vše „dot plot“. a) Znázornění relativní velikosti buněk (FS Int = forward scatter, odpovídá velikosti buněk). b) Znázornění relativní „granularity“ buněk (SS Int = side scatter, odpovídá granularitě buněk) POPIS PŘÍPADU
77letá diabetička a hypertonička přichází do spádové hematologické ambulance pro nově vzniklou lymfadenopatii v oblasti krku. Byla provedena sonografie krku, která prokázala oboustrannou mnohočetnou lymfadenopatii, sonograficky patologického vzhledu. Dle vstupního vyšetření si pacientka stěžovala na výraznou únavu a nevýkonnost, jiné známky B-symptomatologie nebo jiné obtíže nepociťovala. Další vyšetření prokázalo normocytární anémii, vstupně s podílem sideropenie a zvýšené hodnoty beta-2mikroglobulinu. Vzhledem k nálezu byla pacientka indikovaná k exstirpaci suspektní uzliny. Exstirpace byla provedena z oblasti levého nadklíčku.
V dalším vyšetřovacím procesu byl proveden kompletní staging vyšetření kostní dřeně, CT a PET/CT trupu, které prokázalo nález viabilní neoplázie s lymfadenopatií od krku do třísel, bez průkazu postižení kostní dřeně. Metabolická aktivita FDG viabilní neoplázie byla velice různorodá podle lokalizace. V oblasti stěny rekta byla aktivita výrazně vyšší oproti jiným lokalitám, bylo zde podezření na postižení duplicitou nebo infiltrací lymfomem. Histologické vyšetření postižené lokality ale neprokázalo infiltraci neoplázií a vzhledem ke zdravotnímu stavu a akceleraci onemocnění nebylo další vyšetřování indikováno.
Makroskopický nález
Na oddělení patologie KNL, a.s. byla dodána nativní nefixovaná lymfatická uzlina rozměrů cca. 15x11x8 mm. Makroskopicky nevykazovala tkáň pozoruhodnější změny. Po provedení odběru nativní tkáně uzliny pro vyšetření průtokovou cytometrií a zamrazení malého vzorku tkáně uzliny v tekutém dusíku (tkáň byla uchovávána v hlubokomrazicím boxu) byla zbylá tkáň zpracována v celém rozsahu ve třech blocích po formolové fixaci standardní parafínovou technikou.
Výsledky vyšetření průtokovým cytometrem
Vyšetření průtokovou cytometrií na přístroji NaviosEx (Beckman Coulter) prokázalo přítomnost dvou populací B-lymfocytů. Jedna z populací vykazovala imunofenotyp s pozitivitou znaků CD19, CD20, lehkých imunoglobulinových řetězců lambda, CD79b a FMC7 a CD22low, při negativitě znaků CD5, CD10, CD23, CD200, CD38 a tato populace představovala asi 75% z B-lymfocytů. Druhá populace byla pozitivní ve znacích CD20, CD10, lehkých imunoglobulinových řetězcích kappa, CD22, CD79b, CD38, CD19low a negativní ve znacích CD5, CD23, FMC7 a CD200, tato populace představovala pak asi 25% z B-lymfocytů (obr. 1-3). Výsledky vyšetření průtokovým cytometrem tedy ukazovaly na infiltraci tkáně dvěma distinktními populacemi lymfoidních elementů se zcela odlišnou klonalitou.
Mikroskopický nález
Odebrané vzorky tkáně byly fixovány v 10% pufrovaném formolu a zpracovány standardní parafínovou technikou. Histologické řezy byly barveny hematoxylinem-eosinem. Mikroskopicky byla zastižena tkáň lymfatické uzliny a nehojné přiléhající měkké tkáně. Struktura uzliny byla setřelá nodulárně a folikulárně uspořádaným denzním lymfoidním infiltrátem, který sestával převážně z menších lymfocytů (obr. 4), poměrně hojně však byly zachyceny i větší lymfoidní elementy vzhledu centroblastů a imunoblastů (obr. 5). Tento infiltrát pronikal ložiskově i do perinodálních měkkých tkání, v dodaném rozsahu byl materiál bez regresivních změn. Metodou PAS nebyla zachycena přítomnost patologických depozit.
Při imunohistochemickém vyšetření infiltrát vykazoval silnou membránovou expresi CD20 (obr. 6), CD79α, dále expresi BCL2, BCL6 a CD10 (obr. 7), průkazem CD23 byly zachyceny sítě folikulárně-dendritických buněk a malé lymfocyty disperzně, průkazem CD3 a CD5 pak malé, poměrně hojné T-lymfocyty na pozadí infiltrátu. Průkazem CD30 byly zachyceny shora popsané centroblasty a imunoblasty, které nevykazovaly morfologii buněk RS, či buněk Hodgkinových. Exprese cyklínu D1 (obr. 8) byla zachycena v poměrně hojných elementech na periferii folikulárních formací, do kterých místy tyto buňky i pronikaly. Proliferační aktivita (Ki-67, klon MIB-1) byla v infiltrátech nerovnoměrná, akcentovaná ve folikulárních formacích, kde dosahovala až 35% buněčnosti, interfolikulárně byla nižší, maximálně do 10% buněčnosti. Nález byl hodnocen jako infiltrace lymfatické uzliny folikulárním lymfomem (FL grade 3A). Struktury druhého lymfomu popsaného v průtokové cytometrii pak odpovídaly neoplázii z plášťových buněk in situ (ISMCN). Materiál byl zaslán do Ústavu patologie a molekulární medicíny FN v Motole, kde bylo provedeno vyšetření nádorových populací metodou fluorescenční in situ hybridizace (FISH). V populaci FL byla zjištěna přítomnost zlomu v chromozomální oblasti 18q21.33 (gen BCL2) a translokace t(14;18) (q32;q21) IGH/BCL2, bez přítomnosti přestavby genu CCND1 (obr. 9 A-D). V populaci ISMCN byla detekována přítomnost zlomu v chromozomální oblasti 11q13.3 (gen CCND1) a přítomnost translokace t(11;14)(q13;q32) IGH/CCND1 (obr. 10 A-B), bez přítomnosti přestavby genu BCL2. Byly tak potvrzeny chromozomální přestavby charakteristické pro tyto dva odlišné typy non-Hodgkinských lymfomů. V obou komponentách byly přítomné početní změny signálů vyšetřovaných chromozomálních oblastí – zvýšený počet signálů (tzv. zisky – „gains“). Patrně jsou tedy v nádorových buňkách přítomné další komplexní genové a / nebo chromozomální změny, které však s použitými sondami na jádrech v interfázi v histologických řezech nešlo blíže specifikovat.
Obr. 4. Mikroskopický obraz lymfatické uzliny setřelé folikulárně uspořádaným lymfoidním infiltrátem. Hematoxylin-eosin, zvětšení 40x. 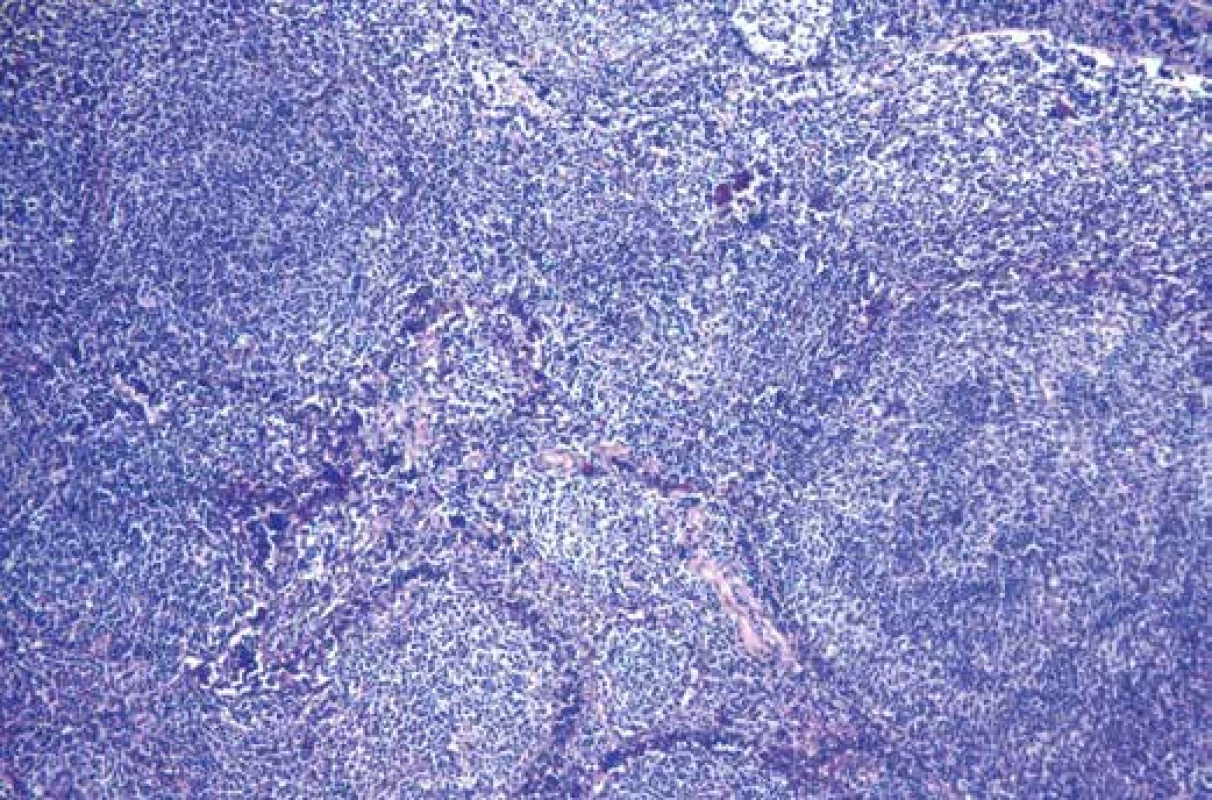
Obr. 5. Detail infiltrátu sestávajícího převážně z menších lymfocytů, ale i z hojných lymfoidních elementů vzhledu centroblastů a imunoblastů. Hematoxylin- eosin, zvětšení 200x. 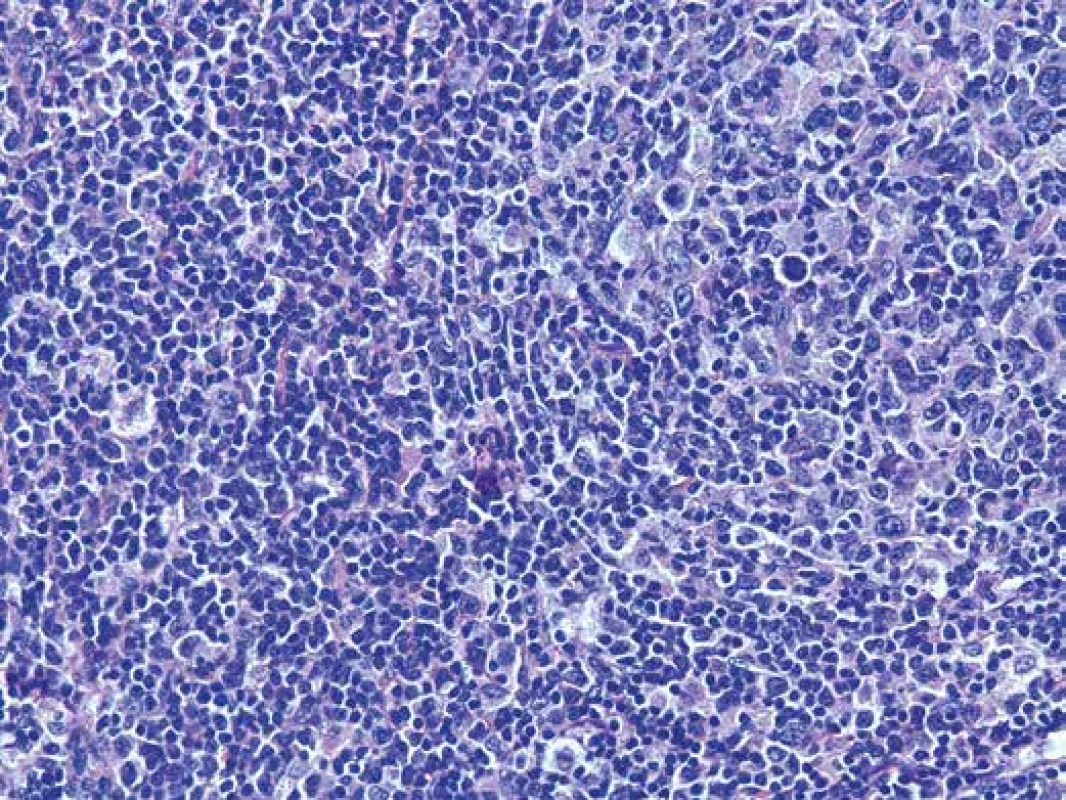
Obr. 6. Imunohistochemický průkaz exprese CD20. Zvětšení 100x. 
Obr. 7. Imunohistochemický průkaz exprese CD10. Zvětšení 100x. 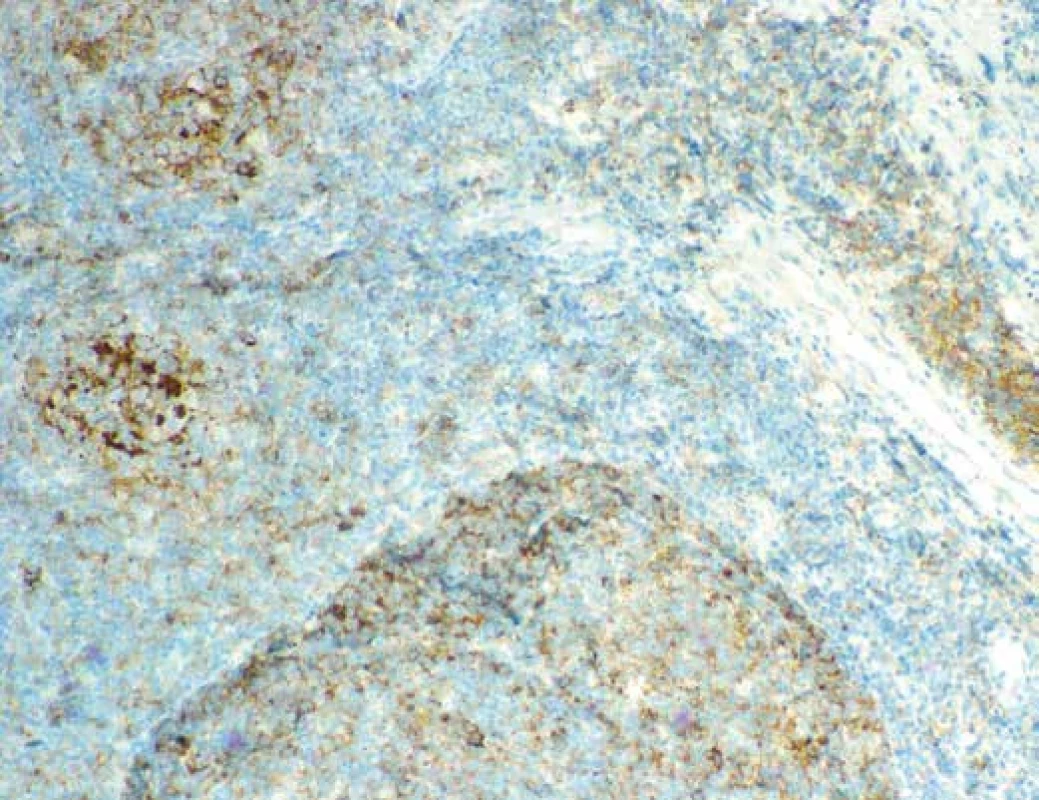
Obr. 8. Imunohistochemický průkaz exprese cyklínu D1 v elementech na periferii folikulárních formací, do kterých místy tyto buňky i pronikaly. Zvětšení 200x. 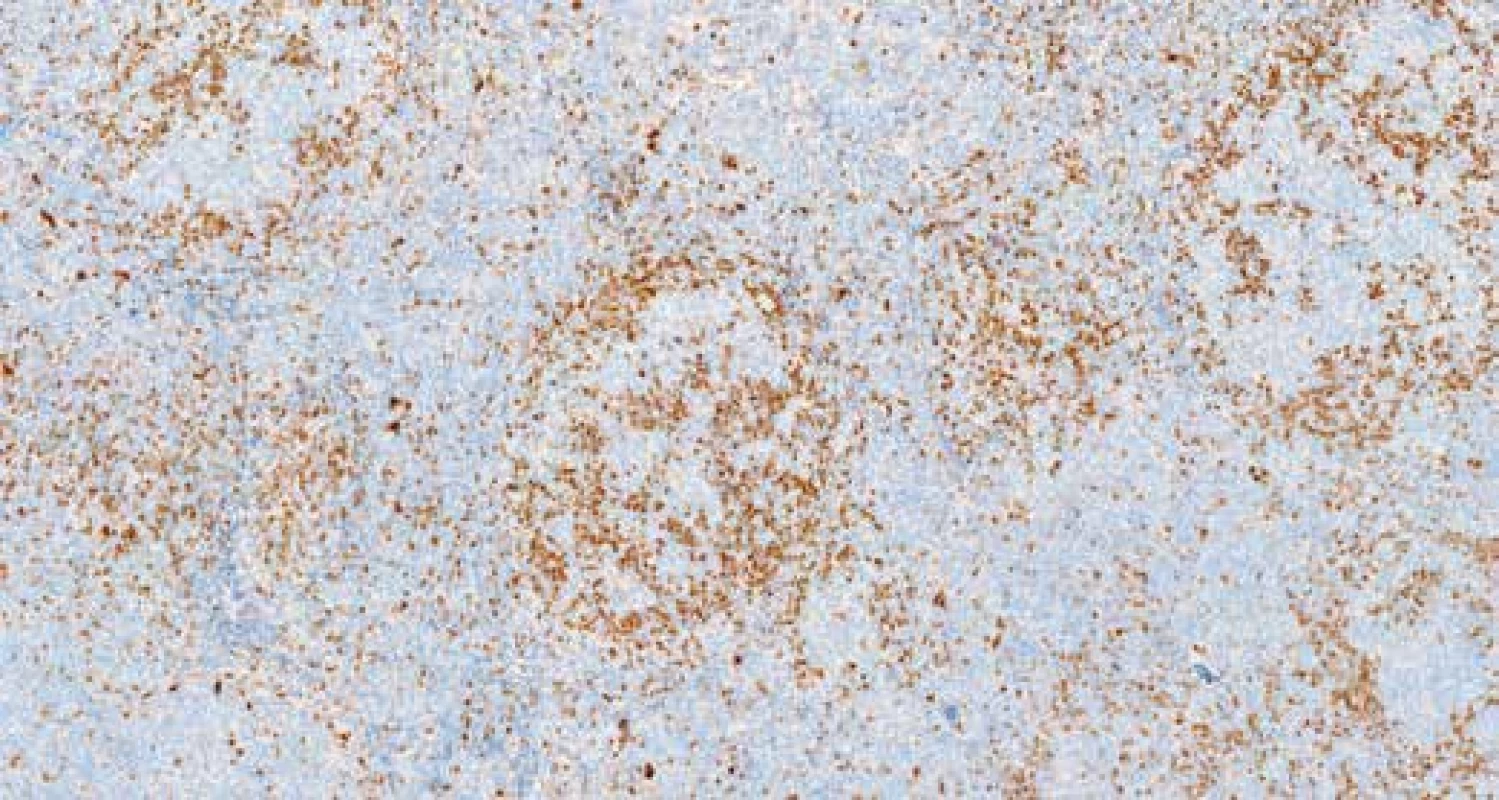
Obr. 9. Fluorescenční in situ hybridizace – jádra buněk komponenty FL. 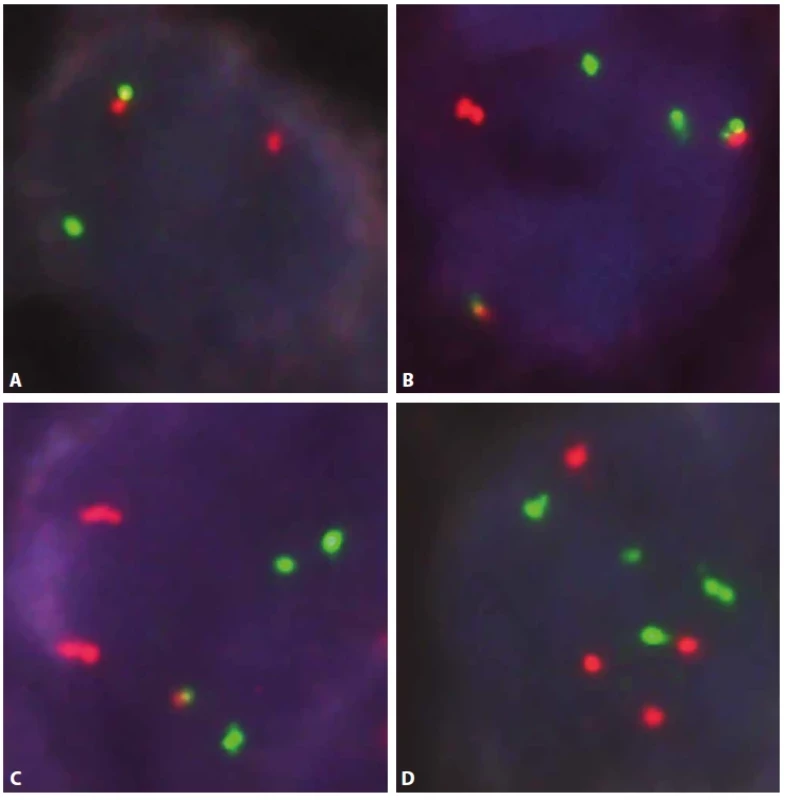
A. Jádro buňky komponenty FL se zlomem v oblasti genu BCL2. V jádře je přítomný jeden zelený signál (oblast za místem zlomu směrem k centromeře
chromozomu 18), jeden červený signál (oblast za místem zlomu směrem k telomeře chromozomu 18) a jeden zeleno-žluto-červený signál
(intaktní oblast 18q21.33 z druhého chromozomu 18). Oddálení zeleného a červeného signálu je charakteristické pro přítomnost zlomu v oblasti
genu BCL2.
B. Jádro buňky komponenty FL se zlomem v oblasti genu BCL2 a s početními změnami signálů. V jádře jsou přítomné dva zelené signály (oblast za
místem zlomu směrem k centromeře chromozomu 18), jeden červený signál (oblast za místem zlomu směrem k telomeře chromozomu 18) a dva
zeleno-žluto-červené signály (intaktní oblasti 18q21.33 z dalších dvou, touto translokací nepostižených, chromozomů 18). Oddálení zelených
a červených signálů je charakteristické pro přítomnost zlomu v oblasti genu BCL2.
C. Jádro buňky komponenty FL s translokací IGH/BCL2 t(14;18)(q32;q21) a s početními změnami signálů. V jádře je přítomen jeden zeleno-žluto-
-červený signál (fúze genů IGH a BCL2), tři zelené signály (chromozomální oblast 14q32.33, gen IGH) a dva červené signály (chromozomální oblast
18q21.33, gen BCL2). Fúze zelených a červených signálů je charakteristická pro přítomnost translokace IGH/BCL2 t(14;18)(q32;q21).
D. Jádro buňky FL bez přítomnosti translokace IGH/CCND1 t(11;14)(q13;q32) a s početními změnami signálů. V jádře jsou přítomné čtyři zelené
signály chromozomální oblasti 14q32.33 (gen IGH) a čtyři červené signály chromozomální oblasti 11q13.3 (gen CCND1). Nejsou přítomny fúzní
zeleno-žluto-červené signály, které by byly pro translokaci charakteristické.Obr. 10. Fluorescenční in situ hybridizace – jádra buněk komponenty ISMCN. 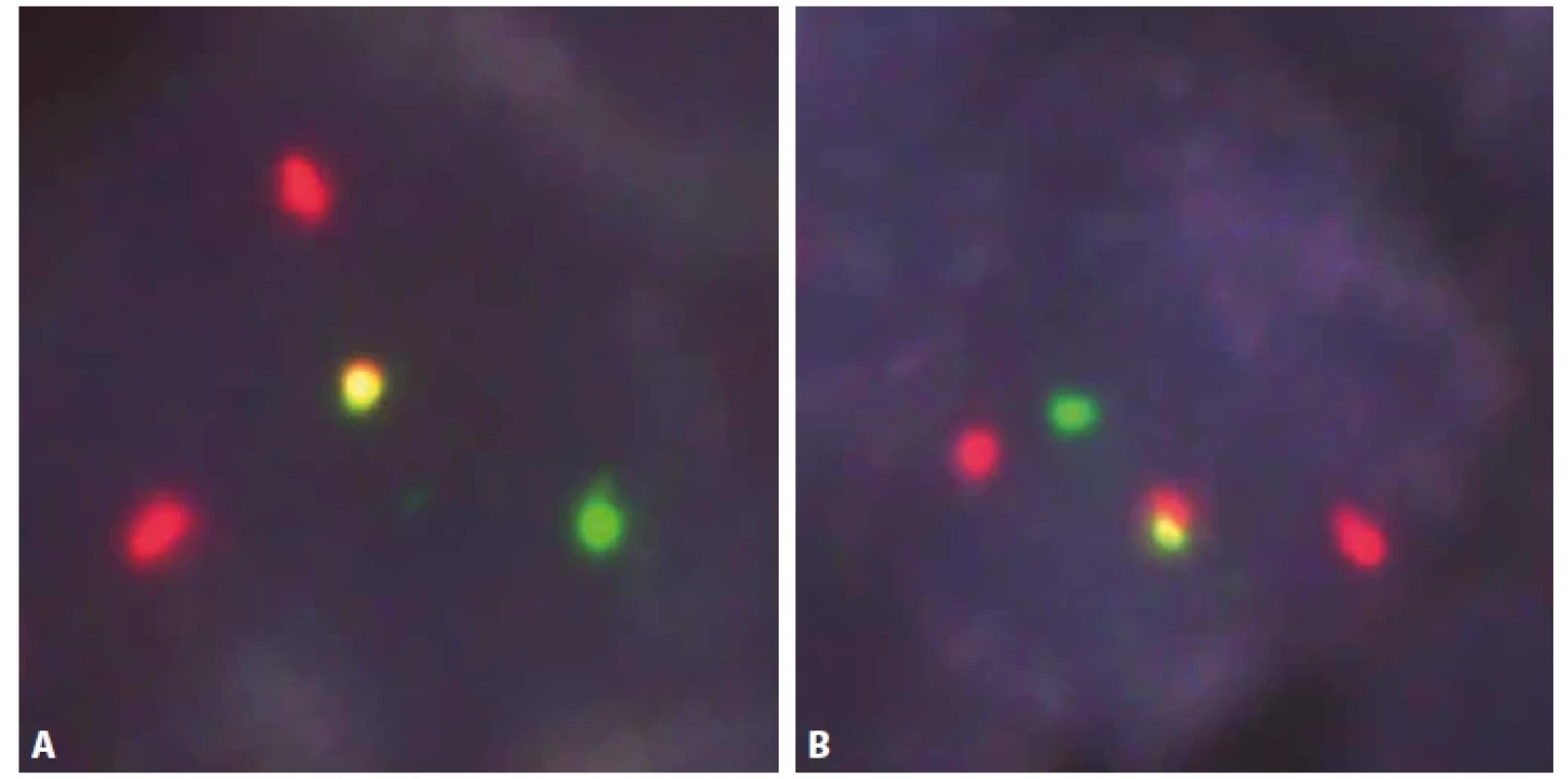
A, B. Jádra buněk ISMCN se zlomem v oblasti genu CCND1 a s početními změnami signálů. V jádře buněk je přítomný jeden zelený signály (oblast za místem zlomu směrem k centromeře chromozomu 11), dva červené signály (oblast za místem zlomu směrem k telomeře chromozomu 11) a jeden zeleno-žluto-červený signál (intaktní oblasti 11q13.3 z dalšího, nezlomeného, chromozomu 11). Oddálení zelených a červených signálů je charakteristické pro přítomnost zlomu v oblasti genu CCND1. DISKUZE
Koncept kompozitního lymfomu byl představen v roce 1954 a prošel jen drobnými změnami (3). Jedná se o současný výskyt dvou nebo více morfologicky a imunofenotypicky odlišných lymfomů ve stejném anatomickém místě / tkáni, které mohou, ale i nemusí být klonálně příbuzné (1). Kompozitní lymfomy představují pro patologa zvláštní diagnostickou výzvu, protože jde o vzácný nález a složky nádorů se často prolínají a bývá obtížné je od sebe odlišit. Léčba takových nádorů je zase obtížným úkolem pro hematoonkologa, protože v současnosti neexistují terapeutické standardy pro tyto léze a každý případ je třeba posuzovat samostatně podle konkrétní kombinace lymfomů přítomných u pacienta a klinického stavu nemocného.
Kompozitní FL a MCL jsou extrémně vzácné a podle našich znalostí je v literatuře popsáno pouze malé množství případů (417). Klinicky se jedná o nádory typicky dospělého věku medián věku při diagnóze je 65 let, bez významnější pohlavní predilekce. Nádory nejčastěji postihují lymfatické uzliny, zejména na hlavě a v krční oblasti, popsány jsou však i případy s extranodálním postižením (tenké střevo, oční adnexa a slezina) (4,5,8).
FL představuje podle literárních údajů obvykle majoritní komponentu léze, je popsána přítomnost různě diferencovaných FL jako součásti kompozitního lymfomu, častěji je přítomen klasický FL low grade (G1 a G2), méně často i FL G3. Typický imunofenotyp FL představuje expresi molekul CD20, CD10, BCL-2 a BCL6, bez exprese molekul CD5 a cyklínu D1 v nádorové populaci.
Ve většině případů bývá v buňkách FL prokázána pomocí metody in situ hybridizace translokace t (14;18)(q32;q21) IGH/BCL2 (18). FL je nejčastějším non-Hodgkinským maligním lymfomem v západní populaci. V případech, kdy byla u kompozitního FL a MCL k dispozici dlouhodobá klinická data (follow up), představovala progrese FL hlavní onkologickou obtíž pacientů a nejvýrazněji ovlivňovala jejich celkovou prognózu (4).
MCL bývá v kompozitních lymfomech s FL zastoupen dvěma různými vidy – jedná se jednak o ISMCN, jednak o tzv. „mantle zone growth pattern“ (MZGP). ISMCN je definována jako přítomnost cyklínu D1 pozitivních nádorových buněk s chromozomální přestavbou genu CCND1 (11q13.3), kdy se tyto buňky nacházejí ve vnitřní části plášťové zóny; naproti tomu případy s rozšířením a náhradou plášťové zóny takovými buňkami by měly již být klasifikovány jako MZGP MCL. Typický imunofenotyp MCL představuje expresi molekul CD20, CD5 a cyklínu D1 v nádorových buňkách, bez exprese molekuly CD10. Ve většině případů bývá v buňkách MCL prokázána pomocí metody FISH translokace t (11;14)(q13;q32) IGH/CCND1 (18), i když i zde mohou existovat výjimky. V popsaných případech kompozitního FL a MCL bylo možno zachytit jednak izolovanou přítomnost pouze ISMCN, jednak kombinace ISMCN a MZGP; v žádném z případů nebyla pozorována výhradně přítomnost MZGP MCL (4); v jediném případě byl zachycen velmi zvláštní růstový vzor MCL, kdy buňky MCL byly rozptýleny v neoplastických folikulech FL (14). Morfologicky byly buňky FL a MCL odlišitelné v situacích, kdy MCL vykazoval alespoň náznaky nodulárního nebo difúzního vzoru růstu. Naopak v případech s ISMCN a v MZGP MCL představoval imunohistochemický průkaz exprese cyklínu D1 a/nebo CD5 základní diagnostickou metodu, protože na úrovni běžného histologického barvení nebylo nádorové populace možno rozlišit (4).
Informace o výsledcích vyšetření průtokovým cytometrem u kompozitních FL a MCL jsou velmi limitované (5). Z těch popsaných případů, kdy lze dohledat informaci o klonalitě nádorových populací FL a MCL u kompozitních lymfomů vyplývá, že FL tvořily lehké imunoglobulinové řetězce kappa, zatímco MCL řetězce lambda; zobecnění těchto výsledků je však obtížné vzhledem k celkově malému množství analyzovaných nádorů.
Pokud budeme posuzovat náš případ ve světle informací popsaných výše, lze říci, že se jedná o lézi, která se u naší pacientky manifestovala v typickém věkovém období dospělého věku, v typické lokalizaci oblasti lymfatických uzlin nadklíčku (levé strany těla). Histologicky jsme nejprve zastihli komponentu FL, která odpovídala FL G3A, kde plášťové zóny nádorových folikulů nebyly nápadněji expandovány. Vstupně cennou informací byl údaj o záchytu dvou klonálně odlišných nádorových lymfoidních populací pomocí průtokové cytometrie. Právě tento nález vedl k cílenému pátrání po druhé komponentě této kompozitní afekce v histologických preparátech, kterou se ukázal být MCL, převážně ve formě ISMCN, zčásti však již se suspektním přechodem do MZGP MCL. Z hlediska imunoprofilu nádorů se jako klíčový ukazuje imunohistochemický průkaz exprese molekul CD10 a cyklínu D1, umožňující odlišit obě nádorové populace kompozitního lymfomu. Průkaz exprese CD10 znázornil buňky FL a průkaz cyklínu D1 pak ISMCN; buňky ISMCN v tomto případě neexprimovaly molekulu CD5, což představuje méně častou, nicméně v literatuře známou variantu (18). Výsledky našeho vyšetření nádorových populací v průtokovém cytometru se výrazněji neliší od literárních údajů, kdy FL komponenta vykazovala tvorbu lehkých řetězců kappa a ISMCN komponenta řetězců lambda. Vyšetření metodou in situ hybridizace v majoritní nádorové populaci prokázalo chromozomální translokaci t(14;18) (q32;q21), typickou pro FL a v minoritní nádorové populaci chromozomální translokaci t(11;14)(q13;q32), charakteristickou pro MCL. Z klinického hlediska je vzhledem ke krátké době sledování nemocné t. č. obtížné se k průběhu a perspektivám vývoje onemocnění vyjádřit. I s ohledem na akceleraci onemocnění byla u pacientky zahájená léčebná prefáze kortikoidy a bude zahájená klasická chemoterapie a biologická léčba s brzkou kontrolou efektu terapie za pomocí PET/CT vyšetření.
ZÁVĚR
V této kazuistice přinášíme popis málo obvyklé nádorové jednotky, která je i ve světovém písemnictví popsána jako relativně raritní nález. Podle názoru autorů případ názorně ukazuje na význam průtokové cytometrie v diagnostickém procesu lymfomů, kdy záchyt dvou odlišných nádorových populací v lymfatické tkáni vedl k dalšímu podrobnému vyšetřování a konečné diagnóze raritního typu nádoru.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Correspondence address:
doc. MUDr. Tomáš Jirásek, Ph.D.
Oddělení patologie, Centrum PATOS
Husova 357/10, 460 63, Liberec
tel: 485 312 303
e-mail: tomas.jirasek@nemlib.cz
Zdroje
- Kim H. Composite lymphoma and related disorders. American Journal of Clinical Pathology 1993; 99(4): 445–451.
- Wang E, Papavassiliou P, Wang RA, et al. Composite lymphoid neoplasm of B-cell and T-cell origins: a pathologic study of 14 cases. Human Pathology 2014; 45 : 768-784.
- Custer RP. Pitfalls in the diagnosis of lymphoma and leukemia from the pathologist‘s point of view. Proceedings of the Second National Cancer Conference, American Cancer Society 1954; 554-557.
- Vivian LF, Magnoli F, Campiotti L, et al. Composite follicular lymphoma and „early“ (in situ and mantle zone growth pattern) mantle cell neoplasia: A rare entity with peculiar cytogenetic and clinical features. Pathol Res Pract 2020; 216(9): 153067.
- Sabater-Marco V, Santonja-López N, Ortíz-Zuluaga S, et al. Orbital soft tissue composite lymphoma presenting as recurrence of a nodal lymphoma with mantle and follicular cell components: A case report, literature review and guideline for the treatment of patients. Rev Esp Patol 2020; 53(1): 48-54.
- Yuan J, Li S, Liu X, et al. Mantle Cell Lymphoma With Mantle Zone Growth Pattern. Am J Clin Pathol 2019; 152(2): 132-145.
- Tsang P, Pan L, Cesarman E, et al. A distinctive composite lymphoma consisting of clonally related mantle cell lymphoma and follicle center cell lymphoma. Human Pathology 1999; 30(8): 988–992.
- Looi A, Gascoyne RD, Chhanabhai M, et al. Mantle cell lymphoma in the ocular adnexal region. Ophthalmology 2005; 112(1):114–119.
- Zamò A, Zanotti R, Lestani M, et al. Molecular characterization of composite mantle cell and follicular lymphoma. Virchows Archiv 2006; 448(5): 639–643.
- Aqel N, Barker F, Patel K, et al. In-situ mantle cell lymphoma a report of two cases. Histopathology 2008; 52(2): 256–260.
- Ilgenfritz RB, Le Tourneau A, Arborio M et al. Composite mantle cell and follicular lymphoma. A case report. Human Pathology 2009; 40(2): 259–263.
- Roullet MR, Martinez D, Ma L et al. Coexisting follicular and mantle cell lymphoma with each having an in situ component: a novel, curious, and complex consultation case of coincidental, composite, colonizing lymphoma. American Journal of Clinical Pathology, 2010;133(4): 584–591.
- Wang S, Tzankov A, Xu-Monette ZY, et al. Clonally related composite follicular lymphoma and mantle cell lymphoma with clinicopathologic features and biological implications. Hum Pathol 2013; 44(12): 2658-2667.
- Liu Y, Li P, Guo Y, et al. A unique composite follicular lymphoma and mantle cell lymphoma with a mixed cell pattern and aggressive course. American Journal of Clinical Pathology 2014; 141 : 737–741.
- Marì-Jimenez P, Martinez-Losada C, Centeno-Haro M, et al. A rare composite lymphoma: follicular and in situ mantle cell. Annals of Hematology 2016; 95 : 1351-1352.
- Subtil A, Xu Z. Follicular lymphoma with composite in situ mantle cell neoplasia. Blood 2019; 133(22): 2460.
- Matsuoka A, Tsushima T, Tanibuchi M, et al. Composite lymphoma consisting of mantle cell lymphoma and follicular lymphoma. The Japanese Journal of Clinical Hematology 2013; 54(11): 2056–2061.
- Swerdlow SH, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissue (Revised 4th edition). Lyon: IARC; 2017 : 215-342.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2023 Číslo 4-
Všechny články tohoto čísla
- Lymfom, či nelymfom, toť otázka
- … od svých vrstevníků jsem se lišil při řezání žížal žiletkou - oni příčně, já podélně …
- MONITOR aneb nemělo by vám uniknout, že
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Kompozitní folikulární lymfom a in situ mantle cell neoplázie lymfatické uzliny: identifikace na základě vyšetření průtokovou cytometrií
- Post mortem vyšetření případů náhlé srdeční smrti. Česká zkušenost a možnost zapojení patologů do multidisciplinárního procesu
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Imunofenotypizační vyšetření punktátů kostní dřeně v diagnostice hematoonkologických onemocnění
- Role průtokové cytometrie při vyšetřování vzorků lymfatických uzlin a extranodálních tkání
- Nízkotučná varianta vřetenobuněčného lipomu: kazuistika
- Úloha průtokové cytometrie v diagnostice hematologických a imunologických onemocnění u dětí
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



