-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tkáňové kultury
Cell cultures
Cell or tissue cultures (both terms are interchangeable) represent a complex process by which eukaryotic cells are maintained in vitro outside their natural environment. They have a broad usage covering not only scientific field but also diagnostic one since they represent the most important way of monoclonal antibodies production which are used for both diagnostic and therapeutic purposes. Cell cultures are also used as a “cultivation medium” in virology and for establishing proliferating cells in cytodiagnostics. They are well-established and easy-to-handle models in the area of research, e.g. as a precious source of nucleic acids or proteins. This paper briefly summarizes their importance and methods as well as the pitfalls of the cultivation and new trends in this field.
Keywords:
cell cultures – tissue culture – antibodies – pathology
Autoři: Šimon Cipro 1; Tomáš Groh 2
Působiště autorů: Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha 1; Klinika dětské hematologie a onkologie 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 1, p. 30-32
Kategorie: Přehledový článek
Souhrn
Buněčné či tkáňové kultury (oba termíny jsou prakticky zaměnitelné) představují způsob, jak in vitro kultivovat eukaryotní buňky mimo jejich přirozené podmínky. Jejich využití zdaleka nespadá pouze do akademické sféry, neboť buněčné kultury představují nejvýznamnější způsob produkce monoklonálních protilátek využívaných jak diagnosticky, tak terapeuticky. Vedle toho se uplatňují jako „kultivační médium“ ve virologii a jako prostředek pro získání proliferujících buněk v cytogenetické diagnostice. Své nezastupitelné místo mají i na poli výzkumu, kde poskytují finančně i technicky relativně snadno dostupný model. Mimo to jsou neocenitelným zdrojem materiálu v podobě nukleových kyselin či proteinů pro řadu molekulárně biologických metod. Článek ve stručnosti shrnuje význam buněčných kultur, metodiku a úskalí jejich kultivace a nové trendy na tomto poli.
Klíčová slova:
buněčné kultury – tkáňové kultury – protilátky - patologieTkáňové nebo také buněčné kultury (oba termíny jsou prakticky zaměnitelné) reprezentují způsob, jakým lze eukaryotní buňky udržovat mimo jejich přirozené podmínky. Rozsah jejich současného využití je enormní. Buněčné kultury opustily v posledních 50 letech laboratoře základního výzkumu a široce se uplatňují i na poli diagnostiky a farmaceutického průmyslu a jakkoliv se to může zdát málo pravděpodobné, setkává se s jejich existencí, byť nepřímo, i každý diagnostikující patolog.
Význam buněčných kultur
Existuje několik oblastí využití savčích buněčných kultur. Na poli diagnostiky se jedná převážně o produkci monoklonálních protilátek, kterou buněčné kultury umožňují v odpovídajícím množství a čistotě. V minulosti se k produkci protilátek využívaly tzv. hybridomy, tedy buněčné linie vzniklé fůzí nádorových buněk myelomu s nenádorovými B-lymfocyty, které byly před fůzí imunizované antigenem, proti kterému měla být zamýšlená protilátka namířena. Myelomové buňky poskytovaly takto vzniklé kultuře „nesmrtelnost“ a lymfocyty antigenní specifitu. V současné době se však stále více používají rekombinatní technologie, kdy se do speciálně upravených savčích buněk (nejčastěji buněk morčecích ovárií) vnese uměle připravená genetická informace kódující konkrétní monoklonální protilátku. Touto technologií se vyrábí jak diagnosticky, tak i terapeuticky využívané protilátky. Za všechny uveďme například rituximab (anti-CD20) nebo trastuzumab (anti-HER2/neu) (1).
Buněčné kultury se široce uplatňují i v oblasti výzkumu, kde slouží jako snadno dostupný a v porovnání s použitím živých zvířat i poměrně levný model in vivo podmínek. Rozsah jejich využití na tomto poli má široký záběr a sahá od hájemství základního výzkumu nádorové biologie po zcela rutinní aplikace při preklinickém testování nových protinádorových léčiv, kterému jsme se věnovali i v naší laboratoři (2). Tím však možnosti použití buněčných kultur zdaleka nekončí; hojně se využívají při produkci složitých proteinů (například vakcín), ve virologické diagnostice, kde se slouží jako kultivační médium pro pomnožení viru a v cytogenetice pro přípravu dělících se buněk pro karyotypování.
Původ buněčných kultur
Získání buněčné kultury je principiálně jednoduchý proces, při kterém se z organismů explantuje tkáň obsahující buňky našeho zájmu. Tu následně podrobíme šetrnému enzymatickému či mechanickému rozvolnění za účelem získání buněčné suspenze, kterou je již možné smíchat s kultivačním médiem (viz níže). Tímto způsobem získaná buněčná kultura se označuje jako primární. Pochází-li buňky z jiné než nádorové tkáně, je jejich životaschopnost a tím i délka, po kterou je můžeme in vitro kultivovat, značně omezena. Naproti tomu u buněk pocházejících z maligních nádorů, je toto období prakticky neomezené a mluvíme o tzv. buněčných liniích.
Příprava buněčných kultur, ať už z nádorové či nenádorové tkáně, však přináší řadu technických obtíží, je časově nákladná a výsledek je nejistý. Většina zavedených a široce používaných linií je proto dostupná i komerčně.
V praxi se můžeme čas od času setkat s požadavkem na založení kultury fibroblastů a to např. při pitvách pacientů s podezřením na vrozenou metabolickou vadu. Takový proces obnáší pouze odebrání malého vzorku kůže a jeho vložení do kultivačního média, které nám zpravidla poskytne specializovaná laboratoř metabolických vad, která se rovněž postará o následné zpracování kultury. Jediný požadavek kladený na patologa je absolutní sterilita odběru, neboť i malá kontaminace může celý odběr znehodnotit (viz níže).
Technika práce s buněčnými kulturami
Ať už buňky získáme nákupem nebo „vlastní výrobou“, udržují se v uzavřených nádobách v kultivačním médiu, které je směsí všech základních nutričních látek, růstových faktorů a pH pufrů. Kultivačních médií je celá řada, liší se složením, přítomností krevního séra i dalšími parametry. Volbu určitého typu média pak určují potřeby konkrétní buněčné linie, např. pro kultivaci kmenových buněk se často využívají bezsérová média.
Nezbytným nástrojem pro práci s buněčnými kulturami je laminární box, ve kterém se odehrává veškerá přímá manipulace s buňkami. Tento přístroj o velikosti průměrné šatní skříně je možné jednak pravidelně sterilizovat UV zářením, jednak vytváří takové proudění vzduchu, které zamezí nežádoucí kontaminaci kultury z okolního prostředí (viz níže).
Nádoby s buněčnými kulturami se uchovávají v inkubátorech, které udržují stálou teplotu 37°C a vysokou vlhkost atmosféry, která zamezuje vysychání kultivačního média.
Průběh kultivace se pravidelně sleduje pomocí inverzního mikroskopu, což je běžný optický mikroskop, jehož objektivy jsou však umístěny pod posuvným stolem a zdroj světla se nachází nad pozorovaným objektem. To nám umožní sledovat průběh kultivačního procesu, morfologii buněk a potřebu výměny média. Buňky se prohlíží nativně, zpravidla ve fázovém kontrastu (obr. 1). Inverzní mikroskopy existují i ve fluroscenčním nebo konfokálním provedení (obr. 2).
Obr. 1. Obrázek z inverzního mikroskopu pořízený ve fázovém kontrastu v průběhu kultivace neuroblastomové buněčné linie UKF-NB-4 (originální zvětšení 200x). 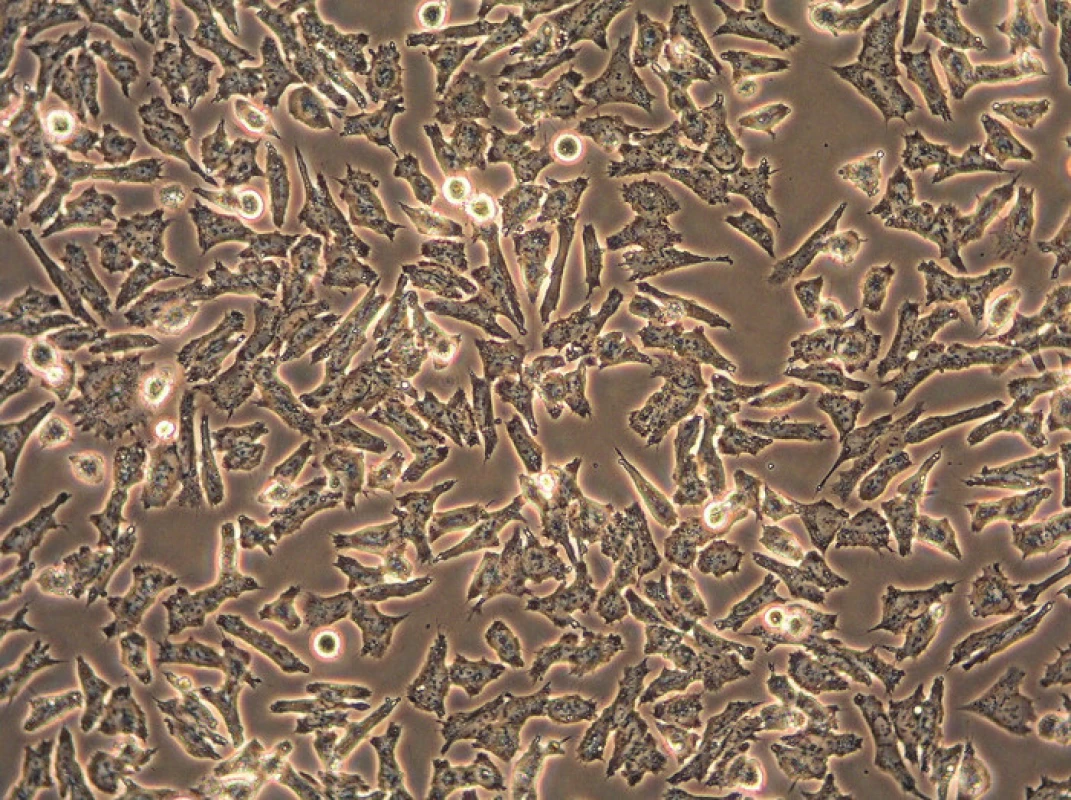
Obr. 2. Fotografie z konfokálního inverzního mikroskopu zobrazující neuroblastomovou buněčnou linii UKF-NB-4. Cytostatikum ellipticin zelený signál, lysozomy červený signál, žlutá barva pak značí jejich kolokalizaci (originální zvětšení 400x). 
Každá buněčná kultura prochází pravidelně se opakujícím cyklem (graf). Bezprostředně po založení kultury se buňky postupně adaptují na nové prostředí a celkový počet buněk v kultuře je zhruba konstantní nebo mírně poklesne. Buňky, které fázi adaptace přežijí, se začnou záhy intenzivně dělit a následuje období exponenciálního růstu. Během toho dochází nejen k rychlé konzumpci živin, kterých je v uzavřeném prostředí kultivační nádoby jen omezené množství, ale i k rychlému snižování pH. Oba faktory způsobí zpomalení až úplnou zástavu proliferace a přechod celé kultury do plató fáze.
Graf 1. Graf růstového cyklu buněčné kultury. Expo. - exponenciální fáze. Šipka ukazuje vhodnou dobu pro pasážování buněk (viz text). 
Kultury, které se do této fáze dostanou, jsou vystaveny značnému nutričnímu a metabolickému stresu, který nevyhnutelně vede k aktivaci alternativních metabolických drah. V plató fázi se tedy buněčná kultura, která je už z podstaty pouze experimentálním modelem, ještě více odlučuje od reálných podmínek in vivo. Navíc dochází k akumulaci celé řady odpadových produktů metabolismu, které mohou významně ovlivňovat následující experimenty (např. PCR) a vnášet do výsledků značnou míru nejistoty. Výsledky experimentů provedených na buňkách pohybujících se na hranici přežití jsou z uvedených důvodů zcela nereprodukovatelné.
Ve snaze zabránit přechodu z exponenciální fáze do fáze plató se buňky tzv. pasážují. Jedná se o postup, kdy se v kultivační nádobě ponechá jen malá část z celkového množství buněk a ostatní se odstraní. Zároveň s tím se staré kultivační médium, které je již zcela prosté živin a obsahuje vysokou koncentraci nežádoucích metabolitů, vymění za čerstvé. Tím se kultura „restartuje“ a celý cyklus jejího růstu začíná od začátku.
Proces pasážování buněk, nejedná-li se o permanentní nádorovou linii, však není možné opakovat donekonečna. Mohou za to především při každém cyklu se zkracující telomery, jejichž zmenšení pod kritickou hranici způsobí, že buňka v lepším případě do dalšího replikačního cyklu nevstoupí, v tom horším se indukuje apoptóza a buňka zahyne (3).
Vlastní kultivace buněk je však pouze prostředkem nikoliv cílem a hlavní část práce zpravidla přichází až po ní. Buňky je možné zpracovat jako jakoukoliv jinou tkáň. Z mnoha možností patří mezi ty nejčastější příprava suspenze pro průtokovou cytometrii nebo izolace nukleových kyselin či proteinů, které se stávají materiálem pro další metody (např. PCR nebo Western blot). Izolace proteinů i nukleových kyselin začíná rozrušením – chemickým či mechanickým – buněčných membrán a následnou extrakcí DNA, RNA či proteinů za pomoci jakékoliv z mnoha dostupných metod.
Jedná-li se o buňky určené pro produkci protilátek, pak se tyto izolují přímo z kultivačního média. Buňky je však možné zpracovat i pro patologa obvyklým způsobem a to jejich zalitím do parafínového cytobloku s možností následných morfologických nebo imunohistochemických vyšetření.
Úskalí kultivace
Jedním z největších problémů, který techniku kultivace buněk provází, je kontaminace kultur plísněmi a bakteriemi (4). Kontaminace v lepším případě znamená znehodnocení právě probíhajícího experimentu, v horším případě přijde laboratoř o cennou buněčnou kulturu. Z toho důvodu je nezbytné dodržovat při manipulaci s buňkami sterilní podmínky, případně obohacovat kultivační médium o antibiotika, která nežádoucí kontaminaci eliminují hned v počátku.
Plošné a trvalé používání antibiotika má však i své stinné stránky. Jednak bakteriální kmeny vyskytující se v té které laboratoři získají (dříve či později) rezistenci na používaná antibiotika a vedle toho vstupují antibiotika do experimentálního modelu jako další faktor potenciálně ovlivňující konečný výsledek experimentu (5).
Mimo mikroskopicky dobře detekovatelných agens je však možná, a naneštěstí poměrně častá, i kontaminace mykoplasmaty. Ta při rutinním prohlížení buněčné kultury v inverzním mikroskopu unikají detekci a mohou tak být po dlouhou dobu „černým pasažérem“. Udává se, že 5 - 35 % buněčných kultur je kontaminováno mykoplasmaty (6). Takto postižené kultury nevykazují na první pohled žádné nápadné známky infekce, nicméně výsledky na nich provedených experimentů lze považovat za zcela nevypovídající a nereprodukovatelné. Je proto nezbytné buněčné kultury na přítomnost mykoplasmat pravidelně testovat (dnes nejčastěji pomocí PCR) a případnou kontaminaci řešit antibiotiky či lépe postiženou kulturu zničit (7).
V laboratorní praxi je třeba většinu experimentů opakovat a často se k nim i v budoucnu vracet, a to ideálně za použítí stejných buněk jako v experimentech původních. Jinými slovy, je třeba mít buňky „stejné šarže“, aby byly výsledky relevantní a reprodukovatelné. Z toho důvodu se nepostradatelným pomocníkem všech laboratoří pracujících s buněčnými kulturami stala metoda kryoprezervace. Při ní se buňky ve speciálním médiu zabraňujícím tvorbě vodních krystalů zamrazí v tekutém dusíku, ve kterém potom mohou být několik měsíců až let uchovávány a být připraveny pro další použití, aniž by došlo k výrazné změně jejich vlastností oproti době před zamražením.
Budoucnost tkáňových kultur
Práce s buněčnými kulturami je ve své podstatě velice jednoduchá a tato vlastnost je vítána všude tam, kde se buněčné kultury používají k rutinním diagnostickým účelům nebo k produkci protilátek. Naproti tomu tam, kde mají být buňky výzkumným modelem a věrně simulovat reálné podmínky živých organismů, je jejich jednoduchost na škodu. Z pohledu solidních nádorů, které in vivo představují složitý trojrozměrný systém, jsou totiž buněčné kultury až příliš nedokonalým modelem (8).
Již více než tři dekády se proto setkáváme se snahou vyvinout trojrozměrnou buněčnou kulturu, která by svým prostorovým uspořádáním a složením více odrážela realitu živých organismů. Jeden z prvních trojrozměrných modelů, který je dodnes široce používán, představila Hynda Kleinmanová se svým týmem už v roce 1982 (9) a dnes je znám pod pojmem Matrigel. Jedná se o směs izolovanou z extracelulární matrix myšího nádoru, která je v teplotách nižších než 4°C kapalná a při zahřívání se proměňuje v gel. Tato substance obsahuje celou řadu strukturálních proteinů, růstových faktorů a sloučenin, které simulují podmínky in vivo a umožňují buňkám trojrozměrný růst. Tento model má však celou řadu omezení, jejichž popis přesahuje rámec tohoto sdělení.
Nové možnosti na poli trojrozměrných buněčných kultur otevřel nedávný rozmach nanotechnologií, s jejichž pomocí je dnes možné vyrábět trojrozměrné „sítě“, po kterých se studované buňky šíří obdobně jako po strukturálních proteinech extracelulární matrix. Do těchto sítí jsou navíc zabudovány růstové faktory a další přesně definované látky, které věrně napodobují původní složení studované tkáně.
Takové technologie otevírají nové možnosti výzkumu, žel svou metodickou i finanční náročností jsou v rámci tkáňových kultur spíše okrajovou záležitostí a podobně jako je tomu se světelnou mikroskopií v molekulární éře patologie, zůstávají standardní buněčné kultury pro většinu aplikací dobře čitelnou a robustní metodou a jejich odchod ze scény v nejbližších letech zcela jistě nehrozí.
Poděkování
Podpořeno MZ ČR – RVO, FN v Motole 00064203.
Adresa pro korespondenci
MUDr. Šimon Cipro
Ústav patologie a molekulární medicíny 2. LF UK a FN Motol, Praha
V Úvalu 84, Praha 5, Motol, 150 06
tel.: +420 602 439 413
e-mail: simon.cipro@gmail.com
Zdroje
1. Li F, Vijayasankaran N, Shen A, Kiss R, Amanullah A. Cell culture processes for monoclonal antibody production. mAbs 2010; 2(5): 466-479.
2. Cipro Š, Hřebačková J, Hraběta J, Poljaková J, Eckschlager T. Valproic acid overcomes hypoxia - induced resistance to apoptosis. Oncol Rep 2012; 27(4): 1219-1226.
3. Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res 1961; 25 : 585-621.
4. Uphoff CC, Denkmann S-A, Drexler HG. Treatment of Mycoplasma contamination in cell cultures with plasmocin. J Biomed Biotechnol 2012; 2012 (1): 267678.
5. Lincoln CK, Gabridge MG. Cell culture contamination: sources, consequences, prevention, and elimination. Methods Cell Biol 1998; 57 : 49 - 65.
6. Young L, Sung J, Stacey G, Masters JR. Detection of Mycoplasma in cell cultures. Nat Protoc 2010; 5(5): 929-934.
7. Volokhov DV, Graham LJ, Brorson KA, Chizhikov VE. Mycoplasma testing of cell substrates and biologics: Review of alternative nonmicrobiological techniques. Mol Cell Probes 2011; 25(2-3): 69-77.
8. Abbott A. Biology´s new dimension. Nature 2003; 424 : 870-872.
9. Kleinman HK, McGarvey ML, Liotta LA, et al. Isolation and characterization of type IV procollagen, laminin, and heparan sulfate proteoglycan from the EHS sarcoma. Biochemistry 1982; 21(24): 6188-6193.
Štítky
Patologie Soudní lékařství Toxikologie
Článek vyšel v časopiseČesko-slovenská patologie

2014 Číslo 1-
Všechny články tohoto čísla
- Padesát let v patologii
- MONITOR aneb nemělo by vám uniknout, že...
- Lynchův syndrom v rukách patologa
- Průkaz chromozomálních změn u nádorových onemocnění pomocí CGH, array-CGH a SNP array
- Otevíráme jubilejní 50. ročník našeho časopisu
- Tkáňové kultury
- Jaká je vaše diagnóza?
- Granular cell varianta atypického fibroxantomu. Popis případu
- Prof. MUDr. Josef Stejskal, CSc.
-
Jaká je vaše diagnóza?
Odpověď: Cystická hydatidóza jater. - www.eurocytology.eu
- 50 let historie časopisu Česko-slovenská patologie
- Exprese aktivní kaspázy 3 u dětí a adolescentů s klasickým Hodgkinovým lymfomem
- Uterine tumors resembling ovarian sex cord tumors (UTROSCT) - popis případu s metastázou do lymfatické uzliny
- Gynecomastia with pseudoangiomatous hyperplasia and multinucleated giant cells in a patient without neurofibromatosis
- Prof. MUDr. Zdeněk Nožička, DrSc.
- HLAVOVA CENA a LAMBLOVA CENA za rok 2013
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Lynchův syndrom v rukách patologa
- Tkáňové kultury
- Průkaz chromozomálních změn u nádorových onemocnění pomocí CGH, array-CGH a SNP array
- Uterine tumors resembling ovarian sex cord tumors (UTROSCT) - popis případu s metastázou do lymfatické uzliny
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



