-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Biomarkery progrese onemocnění a prognózy u pacientů s roztroušenou sklerózou
Autoři: M. Petržalka 1; E. Meluzínová 1; J. Libertínová 1; J. Hanzalová 1,2; P. Marusič 1
Působiště autorů: Neurologická klinika 2. LF UK a FN Motol, Praha 1; Ústav imunologie, 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(4): 404-409
Kategorie: Přehledný referát
doi: https://doi.org/10.14735/amcsnn2018404Souhrn
Roztroušená skleróza je chronické autoimunitní a neurodegenerativní onemocnění CNS. Průběh choroby je interindividuálně značně variabilní. I přes významný pokrok v diagnostice RS v posledních desetiletích stále neexistuje spolehlivý test, který by identifikoval pacienty s relativně příznivým průběhem a pacienty s těžkou agresivní formou nemoci. Prognózu onemocnění je do určité míry možné stanovit dle klinických projevů či charakteru postižení na MR. V současné době se hledají nové parametry lépe vyjadřující průběh onemocnění již na jeho začátku. Přesnější stratifikace nemoci má umožnit volbu terapie přiměřenou formě nemoci. V článku předkládáme aktuální přehled potenciálních biomarkerů průběhu RS vyšetřovaných v séru, periferní krvi a likvoru. V bližším detailu představujeme ty, které jsou v současné době středem zájmu –neurofilamenta, chitinase 3-like proteiny, vitamin D a mikroRNA.
Klíčová slova:
roztroušená skleróza – klinicky izolovaný syndrom – biomarkery – prognóza – neurofilamenta – chitinase 3-like proteiny – vitamin D – mikroRNAÚvod
Roztroušená skleróza je chronické autoimunitní a degenerativní onemocnění CNS. Již v časných fázích onemocnění dochází na podkladě chronického zánětu k poškození myelinu a také ke ztrátě neuronů a axonů. Prevalence onemocnění v ČR je 170 až 200/100 000, postihuje hlavně mladé jedince, častěji ženy v poměru 2 : 1 [1]. Diagnóza onemocnění je v současnosti stanovena na základě McDonaldových kritérií z roku 2017 [2]. Klinicky izolovaný syndrom (CIS) označuje klinické projevy, které při nálezu charakteristických lézí CNS na MR, případně i typického nálezu v mozkomíšním moku, svědčí pro první příznak RS.
Průběh choroby je interindividuálně značně variabilní. U některých pacientů na sebe od začátku onemocnění rychle navazují těžké ataky s neúplnou úpravou stavu a choroba vede během několika let k závažné invaliditě. Jiní nemocní vyvinou druhou ataku až po mnoha letech od CIS a i neléčené onemocnění může mít relativně příznivou prognózu. Průběh onemocnění lze hodnotit podle klinických a paraklinických parametrů. V klinických studiích se uplatňují zejména následující: doba do konverze CIS do definitivní RS, počet relapsů (většinou vyjádřen jako počet za 1 rok, tzv. annual relaps-rate), objem lézí a počet nových lézí (lesion load) na MR a vývoj mozkové atrofie. K hodnocení funkčního postižení pacienta slouží evaluační škály – nejrozšířenější je Expanded Disability Status Scale (EDSS), dále jsou využívány Multiple Sclerosis Functional Composite (MSFC) či Multiple Sclerosis Severity Scale (MSSS).
Pojem biomarker zahrnuje širokou škálu objektivních ukazatelů zdravotního stavu, které mohou být přesně a opakovaně měřeny [3]. Tyto ukazatele se uplatňují jak v diagnostice patologického procesu, tak při sledování vývoje nemoci a také při monitoraci efektu zvolené léčby. Biomarkery mohou být různé povahy – od klinických a fyzikálních charakteristik pacienta, až po výsledky laboratorních vyšetření. V podmínkách výzkumu RS se již tradičně jedná o markery likvorologické, sérologické, klinické a radiologické. V současné době jsou k predikci průběhu onemocnění využívány zejména některé klinické či radiologické ukazatele, např. první těžká ataka s kmenovými příznaky nebo mnohaložiskový proces s enhancementem po podání gadolinia na MR mohou již v době CIS identifikovat pacienty s těžkou formou nemoci. Důležitým likvorologickým prognostickým markerem (zejména konverze CIS do RS) jsou oligoklonální pásy (oligoclonal bands; OB). Pozitivita OB je od prosince 2017 opět součástí diagnostických kritérií pro RS a doplňuje původní kritérium o diseminaci v čase [2].
Etablovaných laboratorních biomarkerů je málo, přičemž zatím neexistuje spolehlivý test, který by byl schopen odhalit pacienty, kteří na počátku onemocnění jeví známky mírného průběhu a posléze vyvinou těžkou, invalidizující formu nemoci. Takové ukazatele by umožnily lépe rozhodnout, u kterého pacienta je již na počátku onemocnění nutná agresivní imunomodulační léčba. V minulosti byly již zkoumány stovky biomarkerů predikujících u pacientů s RS průběh onemocnění, ale potenciál spolehlivě prokázat prediktivní hodnotu, a najít tak uplatnění v klinické praxi, má zatím jen několik málo z nich [4]. Asi nejblíže k úspěchu měly antimyelinové protilátky (protilátky proti myelinovému oligodendrocytárnímu proteinu; anti-MOG, protilátky proti myelinovému bazickému proteinu; anti-MBP) [5], od nichž však muselo být po sérii protichůdných studií upuštěno. Ukázalo se, že problémem byl nevhodný metodologický postup (nevhodné použití Western blotu), který měřil nespecifickou reakci protilátek [6,7]. S podobnými problémy se potýká většina zkoumaných biomarkerů.
Cílem tohoto článku je poskytnout přehled recentně publikovaných biomarkerů ze séra (případně periferní krve) a likvoru, které by umožnily stanovit prognózu u pacientů s CIS a relaps-remitentní formou RS (RR RS). Je třeba zdůraznit, že zatím žádný z níže uvedených biomarkerů není běžně používán v rutinní klinické praxi.
Potenciální biomarkery
Potenciální biomarkery uvádíme pro přehlednost ve dvou velkých skupinách: 1. markery, u kterých lze očekávat zavedení do klinické praxe; 2. markery, které jsou zatím předmětem výzkumu.
Do první skupiny patří zejména neurofilamenta (Nf), ale uvádíme zde i chitinase 3-like proteiny, které již sice jsou jako markery prognózy etablovány, nicméně v praxi zatím běžně využívány nejsou. Druhá skupina je dále rozdělena do několika podskupin dle funkce jednotlivých molekul – mikroRNA, vitamin D, antioxidanty a metabolizmus lipidů, buněčné biomarkery, exprese genů, protilátky a různé. Na závěr uvádíme ještě vícesložkové modely predikce.
Markery, u kterých lze očekávat zavedení do klinické praxe
Neurofilamenta
Neurofilamenta jsou v současné době zřejmě nejslibnějším biomarkerem průběhu RS. Jsou hlavní komponentou axonálního cytoskeletu [8]. Skládají se z podjednotek lehkých (NfL, 68 – 70 kDa), středních (NfM, 145 – 160 kDa) a těžkých (NfH, 200 – 220 kDa) řetězců. Ke stanovování jsou vzhledem k dostatečné stabilitě vhodné jen NfL a NfH [4]. Při neuronálním poškození jsou uvolňovány do okolí, a proto o nich hovoříme jako o markeru neurodegenerace. Tato hypotéza byla potvrzena i na myším modelu experimentální autoimunitní encefalomyelitidy (EAE), ve kterém zvýšené hladiny NfL v séru i v likvoru u transgenních myší (s indukovanou expresí p25) korelovaly s neurodegenerací, zatímco inhibice této exprese snížila jejich hladiny v séru i v likvoru a zároveň zastavila i progresi neurodegenerace [9]. Hladiny NfL i NfH lze detekovat v likvoru i v séru a jsou obecně vyšší u pacientů s RS, zejména během relapsů [8]. Pro přehlednost popisujeme samostatně NfL v likvoru, NfH v likvoru a Nf v séru.
Neurofilamenta detekovaná v likvoru pacientů – lehké řetězce
Nejvíce prostudovanými Nf jsou NfL. Jejich vyšší hladiny v likvoru korelují s větším počtem relapsů (relaps rate), vyšším stupněm funkčního postižení (hodnoceno dle MSSS), větším počtem (lesion load) gadolinium enhancujících lézí a mozkovou i míšní atrofii v 15letém horizontu [4,8]. NfL měřená na začátku nemoci predikují další průběh s 85% specificitou (stanoveno dle počtu relapsů, aktivitou na MR a zhoršením v EDSS po 2 letech). Zlepšení přesnosti odhadu (o 2 %) je možné při současné detekci hladin některých dalších látek v likvoru, zejména osteopontinu nebo NfH [10]. Vzhledem k tomu, že hladiny Nf v likvoru odrážejí stupeň neurodegenerace a vyšší hladiny NfL byly nalezeny u CIS, RR RS i primárně či sekundárně progresivních forem RS (PP RS, SP RS), je možné, že neurodegenerace hraje roli během celé nemoci [4]. NfL by také mohly sloužit jako markery odpovědi na léčbu – jejich hladiny se snižují na léčbě fingolimodem [8,11,12], natalizumabem [8,12] i injekčními léky první linie [12].
Neurofilamenta detekovaná v likvoru pacientů – těžké řetězce
Vyšší hladiny NfH v likvoru na začátku nemoci lze označit za samostatný marker horší prognózy a také dřívější konverze CIS do definitivní RS. Hodnoty NfH rovněž korelují s vyšším EDSS v průřezových i longitudinálních studiích [4].
Neurofilamenta detekovaná v séru pacientů
Výhodou Nf (zejména NfL) je, že vzhledem k těsné korespondenci jejich hladin v séru a v likvoru lze využít pouze vyšetření séra [4,11]. Dle výsledků recentních studií vyšší sérové hladiny NfL na začátku onemocnění korelují s vyšším počtem gadolinium enhancujících lézí a EDSS, rychlejším nárůstem mozkové atrofie a nepřímo úměrně i s výsledky v neuropsychologických testech. Rovněž predikují rychlejší nárůst funkčního postižení (EDSS) a vyšší relaps-rate v dalším průběhu [12,13]. NfH v séru jsou zvýšena u pacientů s CIS, kteří rychle konvertují do RS, dále u RR RS i progresivních forem, proto se považují spíše za marker chronického axonálního poškození [4]. Před případným zavedením Nf do klinické praxe bude potřebné ověřit dosavadní výsledky na větších souborech pacientů a zdravých kontrol. Je nutné stanovit referenční meze Nf pro zdravou populaci, definovat senzitivitu a specificitu predikce založené na těchto biomarkerech, zohlednit komorbidity a možný spolupodíl imunomodulační léčby a dalších faktorů na dosažených výsledcích [14]. Zavedení do rutinní praxe může bránit poměrně komplikovaná metodika a zatím vysoká cena vyšetření Nf.
Chitinase 3-like proteiny
Chitinase-like proteiny patří do rodiny glykohydroláz, kam jsou řazeny i chitinázy. V případě chitináz se jedná o enzymy, které hydrolyzují chitin (polysacharid, jenž není v lidském organizmu syntetizován, je přítomen u členovců), zatímco chitinase-like proteiny chitin jen vážou, ale enzymatickou aktivitu nemají [15]. Tyto molekuly jsou exprimovány astrocyty a mikroglii zejména v reakci na zánět [4], hrají roli ve vrozené i získané imunitě, jejich přesná funkce však dosud není zcela známa [15]. Do skupiny chitinase-like proteinů patří i detailně zkoumaný chitinase 3-like 1 protein (CHI3L1), který se jeví jako přesný ukazatel dalšího vývoje onemocnění již v době CIS [15], a také chitinase 3-like 2 protein (CHI3L2), který je asociován s ještě přesnější predikcí rozvoje funkčního postižení v dalším průběhu (dle EDSS a MSFC) [4,15]. Hodnota CHI3L1 v likvoru koreluje s progresí EDSS (rychlejší dosažení stupně 3 a 6) a predikuje dřívější konverzi do klinicky definitivní RS [16,17]. Chitinase 3-like proteiny mají potenciál i jako markery odpovídavosti na léčbu – zatímco jejich hladiny zůstávají neměnné při účinné terapii interferonem β, u non-respondérů na tuto terapii či u pacientů léčených glatiramer acetátem jejich hladina stoupá [18], na terapii fingolimodem [19] či natalizumabem [20] se naopak snižuje. Vyšší hladiny CHI3L1 i CHI3L2 v likvoru v době prvního příznaku RS jsou asociovány se zhoršováním kognice v dlouhodobém horizontu (Paced Auditory Serial Addition Test u CHI3L2, MSFC u CHI3L1) [15,17]. CHI3L1 byl na konferenci ECTRIMS (European Committee for Treatment and Research in Multiple Sclerosis) v roce 2014 v Kodani prezentován jako validovaný marker konverze CIS do RS [21].
Markery, které jsou zatím předmětem výzkumu
MikroRNA
MikroRNA (miRNA) jsou malé jednovláknové nekódující molekuly ribonukleové kyseliny (RNA), které regulují expresi genů [22]. Molekuly miRNA se dostávají do periferní krve prostřednictvím exozomů, což jsou mikrovezikuly tvořené v cytoplazmě buněk, prostřednictvím kterých mezi sebou buňky komunikují [23]. Jsou důležité v mechanizmech vrozené i získané imunity, regulují zánětlivé procesy a podílejí se i na vzniku autoimunitních reakcí [22]. Pro účast na těchto funkcích se předpokládá i jejich podíl v patogenezi některých imunitně podmíněných chorob. Spektrum zastoupení různých exozomálních miRNA v séru je dle některých autorů [23,24] pro pacienty s RS charakteristické. Snížení(čtyři typy Homo sapiens-miRNA; hsa-miRNA)či naopak zvýšení (dva typy virus Epstein-Barrové miRNA; EBV miRNA) některých miRNA se ukazuje jako specifická reakce během relapsů onemocnění [23,24]. Hladiny těchto miRNA rovněž korelují s progresí invalidity (dle zhoršení v EDSS) [24] či s vývojem na MR [25]. U některých vybraných miRNA jsou již známy i konkrétní geny, které jsou jimi regulovány. V případě výše zmíněné studie [23] se jedná o čtyři miRNA, které regulují diferenciaci lymfocytů Th17, Treg a Tr1 – buněk hrajících důležitou roli v patogenezi RS. Dalším příkladem je miRNA-384 a gen SOCS3. Snížení exprese tohoto genu zlepšuje klinický průběh EAE, zatímco její zvýšení vede naopak ke zhoršení průběhu onemocnění [26]. Podobně je známý i gen NCAM1 z rodiny adhezivních molekul, který hraje důležitou roli v mezibuněčné komunikaci, zejména během vývoje nervové soustavy. Transkript NCAM1 je cílovou molekulou pro miRNA-572, jejíž sérové hladiny jsou snížené u pacientů s RS. Toto snížení však není specifické jenom pro RS, ale bylo prokázáno i u dalších onemocnění [27]. Vyšetřování sérových hladin některých miRNA se známým patogenetickým působením se proto nabízí jako možnost pro predikci průběhu onemocnění.
Vitamin D
Vitamin D, hlavně ve formě měřeného metabolitu kalcidiolu (25-hydroxycholekalciferol), a jeho role v patogenezi RS byla a stále je intenzivně zkoumána. Vitamin D má kromě své funkce v kostním metabolizmu ještě další významnou úlohu, a to jako modulátor imunitního systému, kdy posouvá nastavení imunity do stavu imunotolerance. Tento efekt je zprostředkován zejména inhibicí diferenciace dendritických buněk a Th17 lymfocytů, utlumením aktivity Th1 lymfocytů, a naopak indukcí lymfocytů Treg [28]. Známý je fenomén zvyšujícího se rizika RS se stoupající zeměpisnou šířkou, a tedy nižší expozicí slunečnímu záření a nižší hladinou vitaminu D [29]. Toto riziko se analogicky mění u jedinců, kteří se ze zemí s nižší zeměpisnou šířkou přestěhovali do zemí s vyšší zeměpisnou šířkou a obráceně [30]. Významná je dle dosavadních studií zejména hladina vitaminu D v dětství [31], která je odrazem času stráveného venku [30], nebo dokonce již i hladina během prenatálního vývoje. Roli tak hraje např. i měsíc narození a děti, které se narodily na podzim a jejichž matky měly během těhotenství dostatečnou expozici slunečnímu záření, mají nižší riziko RS v porovnání s dětmi narozenými na jaře [30]. Nižší hladina vitaminu D byla rovněž pozorována během relapsů a u pacientů v progresivní fázi nemoci [24]. Prediktivní hodnota vyšších hladin vitaminu D u pacientů s RR RS je dávána do korelace zejména s efektem na relaps-rate [32 – 34]. Některé studie poukazují na podobný efekt i při suplementaci vitaminu D, přičemž udávají snížení relaps-rate o 12–13,7 % na každé zvýšení sérové hladiny vitaminu D o 10 nmol/ l [33,34]. Takový efekt by byl na úrovni některých současných imunomodulačních léků používaných v léčbě RS, problémem je však spolupodíl četných třetích faktorů (confounderů).
V rámci recentní systematické review pojednávající o vlivu nutrice na průběh nemoci u pacientů s RS byl vitamin D identifikován jako jediný významný prognostický marker z celé řady nutrientů [35]. Analyzováno bylo 47 studií hodnotících efekt substancí jako karnitin, melatonin, koenzym Q10 a dalších (extrakt z hroznového vína, ženšen, borůvky, zelený čaj). Byla prokázána korelace vyšších hladin vitaminu D se snížením rizika rozvoje RS. U pacientů s již stanovenou diagnózou RS byla nalezena negativní korelace s rizikem vzniku nových MR lézí, rovněž s hodnotou relapse-rate a rychlostí nárůstu funkčního postižení (EDSS). Během relapsů se potvrdila nižší hladina vitaminu D.
Antioxidanty a metabolizmus lipidů
Zánětlivé procesy CNS hrají důležitou roli v patogenezi RS, a to zejména v době relapsů onemocnění. Narůstá počet studií, které se zabývají hypotézou, že přítomnost volných radikálů a oxidativní stres mohou být nejenom důsledkem zánětu CNS, nýbrž i jeho příčinou. V podobné souvislosti je rovněž zkoumán metabolizmus lipidů – ateroskleróza je dnes chápána jako zánětlivý stav organizmu. I u pacientů s RS bylo pozorováno zvýšení aterogenního indexu, zvýšená inzulinová rezistence, ale i zvýšení hladin dalších látek, jako jsou triacylglyceroly, kyselina močová či elevace feritinu asociovaná s nárůstem CRP [36]. Nárůst hladiny feritinu v séru u pacientů s RS je v kombinaci s dalšími markery oxidativního stresu asociován se 14% nárůstem v EDSS [37].
Další oblastí výzkumu jsou i některé adipokiny – cytokiny produkované tukovou tkání. Ve studii porovnávající pacienty s klasickým průběhem RS (ve studii pacienti s EDSS > 3 po 10 letech od stanovení diagnózy RS) proti benignímu průběhu (EDSS < 3), se u první skupiny ukázaly signifikantně vyšší hladiny zejména dvou adipokinů: adiponektinu a monocyte chemoattractant proteinu-1 [38].
Ze spektra antioxidantů byl zkoumán sérový glutathion, součást metabolizmu methioninu, kdy hladina glutathionu i methioninu byla v porovnání se zdravými kontrolami u pacientů s RS významně snížena. [39]. Také větší míra karbonylace proteinů v likvoru u EAE než u zdravých kontrol naznačuje roli oxidativního stresu a vzhledem k nárůstu této hodnoty odpovídající vývoji CIS → RR RS → SP RS se nabízí i jako potenciální biomarker progrese onemocnění [40].
Buněčné biomarkery, exprese genů, protilátky a další
Ostatní potenciální biomarkery se objevily v literatuře ojediněle nebo jen v malém počtu studií. Pro přehlednost je uvádíme ve formě tabulky (tab. 1) [41 – 58].
Tab. 1. Buněčné biomarkery, exprese genů, protilátky a další biomarkery. 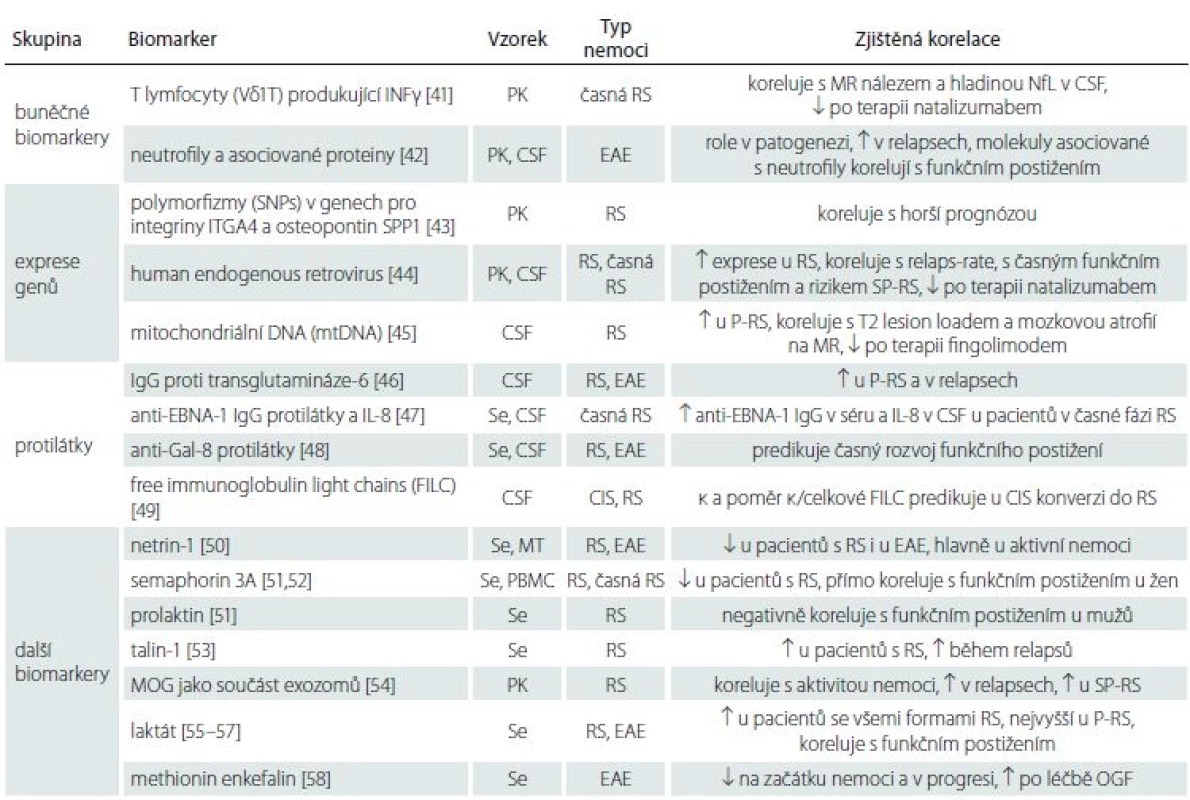
CIS – klinicky izolovaný syndrom; CSF – likvor; EAE – experimentální autoimunitní encefalomyelitida; EDSS – Expanded Disability Status Scale; IgG – imunoglobulin G; INFγ – interferon γ; MOG – myelin oligodendrocyte protein; MT – myší tkáně (mícha, mozeček); NfL – lehké řetězce neurofi lament; OGF – opioidní růstový faktor; P-RS – progresivní RS (primární i sekundární); PBMC – exprese v mononukleárních leukocytech periferní krve; PK – periferní krev; Se – sérum; SP-RS – sekundárně progresivní RS
↑ – zvýšení, ↓ – sníženíVícesložkové modely predikce
Ke stanovení predikce vývoje onemocnění byly vytvořeny i modely vícesložkové využívající většího počtu markerů zároveň. Skupina španělských autorů sledovala 12 biomarkerů validovaných v jejich předchozí studii [59]. Jako nejspolehlivější se ukázal model s rozdělením pacientů do skupin nejdříve podle hladiny interleukinu 7 (IL-7) v séru a následně podle sérové hladiny C-X-C motif chemokine 10 (CXCL10). Tímto způsobem se odlišily rizikové skupiny – zatímco RS byla pravděpodobnější u nízkého IL-7 (cut-off 141 pg/ ml), jeho zvýšené hodnoty onemocnění prakticky vylučovaly. Hodnoty CXCL10 poté analogicky rozlišily primárně progredientní formu (< 570 pg/ ml) od relaps-remitentní (570 – 1 243 pg/ ml) a od zdravých kontrol (> 1 243 pg/ ml) [60]. Jiná studie se zabývala metabolomickým profilem pacientů s RS, ve kterém se sfingomyelin a lysofosfatidyl etanolamin ukázaly jako nejsilnější prediktory průběhu onemocnění. Tento model byl ve studii schopen odlišit pacienty s RS od zdravých kontrol a následně identifikovat pacienty, kteří budou po 2 letech sledování bez relapsu či bez progrese v EDSS, s malým nárůstem v EDSS (< 3) nebo s vysoce aktivní nemocí (EDSS > 4,5) [61]. Podobně byl zkoumán i rozsáhlý set lidských autoprotilátek namířených proti zhruba 9 500 antigenům. Z tohoto spektra bylo u pacientů s RS potvrzeno signifikantní zvýšení hladin 54 autoprotilátek, které dle analýzy úspěšně detekovaly pacienty s RR RS nebo SP RS [62]. Další panel biomarkerů byl navržen skupinou australských autorů, kteří zkoumali metabolizmus tryptofanu. Pomocí šesti metabolitů byli schopni s prediktivní hodnotou 91 % v pěti krocích odlišit SP RS, PP RS, RR RS a zdravé kontroly [63]. Na závěr této části ještě zmiňme výsledek bioinformatické analýzy dat z 99 studií proteinů v likvoru [64], která odhalila unikátní proteomický profil 76 bílkovin zvýšených výhradně u RS (většina z nich patřících mezi proteiny koagulace, aktivace komplementu, regulace apoptózy či regulace axonogeneze). Tento výsledek sice sám o sobě není významný stran predikce prognózy, může však být cenným zdrojem biomarkerů pro budoucí výzkum.
Závěr
Biomarkery průběhu onemocnění jsou důležité pro optimalizaci terapie pacientů s RS. Rutinně není vyšetřován zatím žádný ze zmíněných biomarkerů, snad s výjimkou vitaminu D. Ten je jediným významným prognostickým markerem, jehož snížené hladiny je možné kompenzovat perorální suplementací. Za nejslibnější biomarker jsou považována Nf, u nichž je možné očekávat zařazení do portfolia vyšetření u pacientů na počátku onemocnění RS. CHI3L1 je významným markerem konverze CIS do klinicky definitivní RS, proto není vyloučeno i jeho stanovování v rámci základního vyšetřovacího algoritmu. Zatím není dostatek důkazů pro stanovování hladin miRNA v séru, očekává se však rozsáhlý výzkum v této oblasti.
Potenciálních biomarkerů stále přibývá. Velmi dobrým výstupem se zdají být vícesložkové modely predikce, které by mohly do budoucna nabídnout algoritmy pro použití i interpretaci konkrétních významných biomarkerů v klinické praxi.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 19. 10. 2017
Přijato do tisku: 17. 4. 2018
MUDr. Marko Petržalka
Neurologická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: markopetrzalka@gmail.com
Zdroje
1. Souhrnná zpráva z registru k 31. 12. 2016, zapojeno 15 center, počet pacientů v analýze 9 044. [online] Nadační fond Impuls 2017. Dostupné z URL: http: / / nfimpuls.cz/ index.php/ roztrousena-skleroza-registr/ remus-zaverecne-zpravy.
2. Thompson AJ, Banwell BL, Barkhof F et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17(2): 162– 173. doi: 10.1016/ S1474-4422(17)30470-2.
3. Strimbu K, Tavel JA. What are biomarkers? Curr OpinHIV AIDS 2010; 5(6): 463– 466. doi: 10.1097/ COH.0b013e32833ed177.
4. Dubuisson N, Puentes F, Giovannoni G et al. Science is 1% inspiration and 99% biomarkers. Mult Scler 2017; 23(11): 1442– 1452. doi: 10.1177/ 1352458517709362.
5. Berger T, Rubner P, Schautzer F et al. Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. N Eng J Med 2003; 349(2): 139– 145. doi: 10.1056/ NEJMoa022328.
6. Kuhle J, Pohl C, Mehling M et al. Lack of association between antimyelin antibodies and progression to multiple sclerosis. N Eng J Med 2007; 356(4): 371– 378. doi: 10.1056/ NEJMoa063602.
7. Pelayo R, Tintoré M, Montalban X et al. Antimyelin antibodies with no progression to multiple sclerosis. N Eng J Med 2007; 356(4): 426– 428. doi: 10.1056/ NEJMc062467.
8. van Munster CEP, Uitdehaag BMJ. Outcome measures in clinical trials for multiple sclerosis. CNS Drugs 2017; 31(3): 217– 236. doi: 10.1007/ s40263-017-0412-5.
9. Brureau A, Blanchard-Bregeon V, Pech C et al. NF-L in cerebrospinal fluid and serum is a biomarker of neuronal damage in an inducible mouse model of neurodegeneration. Neurobiol Dis 2017; 104 : 73– 84. doi: 10.1016/ j.nbd.2017.04.007.
10. Håkansson I, Tisell A, Cassel P et al. Neurofilament light chain in cerebrospinal fluid and prediction of disease activity in clinically isolated syndrome and relapsing-remitting multiple sclerosis. Eur J Neurol 2017; 24(5): 703– 712. doi: 10.1111/ ene.13274.
11. Piehl F, Kockum I, Khademi M et al. Plasma neurofilament light chain levels in patients with MS switching from injectable therapies to fingolimod. Mult Scler 2017 : 135245851771513. [Epub ahead of print]. doi: 10.1177/ 1352458517715132.
12. Disanto G, Barro C, Benkert P et al. Serum Neurofilament light: A biomarker of neuronal damage in multiple sclerosis. Ann Neurol 2017; 81(6): 857– 870. doi: 10.1002/ ana.24954.
13. Kuhle J, Nourbakhsh B, Grant D et al. Serum neurofilament is associated with progression of brain atrophy and disability in early MS. Neurology 2017; 88(9): 826– 831. doi: 10.1212/ WNL.0000000000003653.
14. Disanto G, Barro C, Benkert P et al. Serum neurofilament light: a biomarker of neuronal damage in multiple sclerosis. Ann Neurol 2017; 81(6): 857– 870. doi: 10.1002/ ana.24954.
15. Møllgaard M, Degn M, Sellebjerg F et al. Cerebrospinal fluid chitinase-3-like 2 and chitotriosidase are potential prognostic biomarkers in early multiple sclerosis. Eur J Neurol 2016; 23(5): 898– 905. doi: 10.1111/ ene.12960.
16. Comabella M, Sastre-Garriga J, Montalban X. Precision medicine in multiple sclerosis. Curr Opin Neurol 2016; 29(3): 254– 262. doi: 10.1097/ WCO.0000000000000336.
17. Modvig S, Degn M, Roed H et al. Cerebrospinal fluid levels of chitinase 3-like 1 and neurofilament light chain predict multiple sclerosis development and disability after optic neuritis. Mult Scler 2015; 21(14): 1761– 1770. doi: 10.1177/ 1352458515574148.
18. Matute-Blanch C, Río J, Villar LM et al. Chitinase 3-like 1is associated with the response to interferon-beta treatment in multiple sclerosis. J Neuroimmunol 2017; 303 : 62– 65. doi: 10.1016/ j.jneuroim.2016.12.006.
19. Novakova L, Axelsson M, Khademi M et al. Cere-brospinal fluid biomarkers of inflammation and degeneration as measures of fingolimod efficacy in multiple sclerosis. Mult Scler 2017; 23(1): 62– 71. doi: 10.1177/ 1352458516639384.
20. Stoop MP, Singh V, Stingl C et al. Effects of natalizumab treatment on the cerebrospinal fluid proteome of multiple sclerosis patients. J Proteome Res 2013; 12(3): 1101– 1107. doi: 10.1021/ pr3012107.
21. Fernández O, Álvarez-Cermeño JC, Arnal-García C (eds). Review of the novelties presented at the 29th Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS) (I) 2013, Copenhagen, Denmark. Madrid: Rev Neurol 2014; 59(06): 269– 280.
22. Selmaj I, Mycko MP, Raine CS et al. The role of exosomes in CNS inflammation and their involvement in multiple sclerosis. J Neuroimmunol 2017; 306 : 1– 10. doi: 10.1016/ j.jneuroim.2017.02.002.
23. Selmaj I, Cichalewska M, Namiecinska M et al. Global exosome transcriptome profiling reveals biomarkers for multiple sclerosis. Ann Neurol 2017; 81(5): 703– 717. doi: 10.1002/ ana.24931.
24. Wang YF, He DD, Liang HW et al. The identification of up-regulated ebv-miR-BHRF1-2-5p targeting MALT1 and ebv-miR-BHRF1-3 in the circulation of patients with multiple sclerosis. Clin Exp Immunol 2017; 189(1): 120– 126. doi: 10.1111/ cei.12954.
25. Regev K, Healy BC, Khalid F et al. association between serum microRNAs and magnetic resonance imaging measures of multiple sclerosis severity. JAMA Neurol 2017; 74(3): 275– 285. doi: 10.1001/ jamaneurol.2016.5197.
26. Qu X, Han J, Zhang Y et al. MiR-384 Regulates the Th17/ treg ratio during experimental autoimmune encephalomyelitis pathogenesis. Front Cell Neurosci 2017; 11 : 88. doi: 10.3389/ fncel.2017.00088.
27. Mancuso R, Agostini S, Marventano I et al. NCAM1 is the target of miRNA-572: validation in the human oligodendroglial cell line. Cell Mol Neurobiol 2018; 38(2): 431– 440. doi: 10.1007/ s10571-017-0486-0.
28. Miclea A, Miclea M, Pistor M et al. Vitamin D supplementation differentially affects seasonal multiple sclerosis disease activity. Brain Behav 2017; 7(8): e00761. doi: 10.1002/ brb3.761.
29. Havrdová E (ed). Vitamin D a zeměpisná šířka. In: Roztroušená skleróza. Praha: Mladá fronta 2013 : 105.
30. Pierrot-Deseilligny C, Souberbielle JC. Vitamin D and multiple sclerosis: an update. Mult Scler Relat Disord 2017; 14 : 35– 45. doi: 10.1016/ j.msard.2017.03.014.
31. Gianfrancesco MA, Stridh P, Rhead B et al. Evidence for a causal relationship between low vitamin D, high BMI, and pediatric-onset MS. Neurology 2017; 88(17): 1623– 1629. doi: 10.1212/ WNL.0000000000003849.
32. Ascherio A, Munger KL, White R et al. Vitamin D as an early predictor of multiple sclerosis activity and progression. JAMA Neurol 2014; 71(3): 306– 314. doi: 10.1001/ jamaneurol.2013.5993.
33. Pierrot-Deseilligny C, Rivaud-Péchoux S, Clerson P et al. Relationship between 25-OH-D serum level and relapse rate in multiple sclerosis patients before and after vitamin D supplementation. Ther Adv Neurol Disord 2012; 5(4): 187– 198. doi: 10.1177/ 1756285612447090.
34. Simpson S, Taylor B, Blizzard L et al. Higher 25-hydroxyvitamin D is associated with lower relapse risk in MS. Ann Neurol 2010; 68(2): 193– 203. doi: 10.1002/ ana.22043.
35. Bagur MJ, Murcia MA, Jiménez-Monreal AM et al. Influence of diet in multiple sclerosis: a systematic review. Adv Nutr 2017; 8(3): 463– 472. doi: 10.3945/ an.116.014191.
36. Oliveira SR, Kallaur AP, Lopes J et al. Insulin resistance, atherogenicity, and iron metabolism in multiple sclerosis with and without depression: associations with inflammatory and oxidative stress biomarkers and uric acid. Psychiatry Res 2017; 250 : 113– 120. doi: 10.1016/ j.psychres.2016.12.039.
37. Ferreira KPZ, Oliveira SR, Kallaur AP et al. Disease progression and oxidative stress are associated with higher serum ferritin levels in patients with multiple sclerosis. J Neurol Sci 2017; 373 : 236– 241. doi: 10.1016/ j.jns.2016.12.039.
38. Çoban A, Düzel B, Tüzün E et al. Investigation of the prognostic value of adipokines in multiple sclerosis. Mult Scler Relat Disord 2017; 15 : 11– 14. doi: 10.1016/ j.msard.2017.04.006.
39. Bystrická Z, Laubertová L, Ďurfinová M et al. Methionine metabolism and multiple sclerosis. Biomarkers 2017; 22(8): 747– 754. doi: 10.1080/ 1354750X.2017.1334153.
40. Irani DN. Cerebrospinal fluid protein carbonylation identifies oxidative damage in autoimmune demyelination. Anna Clin Transl Neurol 2017; 4(2): 145– 150. doi: 10.1002/ acn3.379.
41. Singh AK, Novakova L, Axelsson M et al. High interferon-γ uniquely in Vδ1 T cells correlates with markers of inflammation and axonal damage in early multiple sclerosis. Front Immunol 2017; 8 : 260. doi: 10.3389/ fimmu.2017.00260.
42. Casserly CS, Nantes JC, Whittaker Hawkins RF et al. Neutrophil perversion in demyelinating autoimmune diseases: Mechanisms to medicine. Autoimmun Rev 2017; 16(3): 294– 307. doi: 10.1016/ j.autrev.2017.01.013.
43. Dardiotis E, Panayiotou E, Provatas A et al. Gene variants of adhesion molecules act as modifiers of disease severity in MS. Neurol Neuroimmunol Neuroinflamm 2017; 4(4): e350. doi: 10.1212/ NXI.0000000000000350.
44. Morandi E, Tarlinton RE, Tanasescu R et al. Human endogenous retroviruses and multiple sclerosis: causation, association, or after-effect? Mul Scler 2017; 23(8): 1050– 1055. doi: 10.1177/ 1352458517704711.
45. Leurs CE, Podlesniy P, Trullas R et al. Cerebrospinal fluid mtDNA concentration is elevated in multiple sclerosis disease and responds to treatment. Mult Scler 2017; 24(4): 472– 480. doi: 10.1177/ 1352458517699874.
46. Cristofanilli M, Gratch D, Pagano B et al. Transglutaminase-6 is an autoantigen in progressive multiple sclerosis and is upregulated in reactive astrocytes. Mult Scler 2016; 23(13): 1707– 1715. doi: 10.1177/ 1352458516684022.
47. Sisay S, Lopez-Lozano L, Mickunas M et al. Untreated relapsing remitting multiple sclerosis patients show antibody production against latent Epstein Barr Virus (EBV) antigens mainly in the periphery and innate immune IL-8 responses preferentially in the CNS. J Neuroimmunol 2017; 306 : 40– 45. doi: 10.1016/ j.jneuroim.2017.02.017.
48. Pardo E, Cárcamo C, Uribe-San Martín R et al. Galectin-8 as an immunosuppressor in experimental autoimmune encephalomyelitis and a target of human early prognostic antibodies in multiple sclerosis. PLoS One 2017; 12(6): e0177472. doi: 10.1371/ journal.pone.0177472.
49. Nazarov VD, Makshakov GS, Mazing AV et al. Diagnostic value of immunoglobulin free light chains at the debut of multiple sclerosis. Zh Nevrol PsikhiatrIm S S Korsakova 2017; 117(2): 60– 65. doi: 10.17116/ jnevro20171172260-65.
50. Mulero P, Córdova C, Hernández M et al. Netrin-1 and multiple sclerosis: a new biomarker for neuroinflammation? Eur J Neurol 2017; 24(9): 1108– 1115. doi: 10.1111/ ene.13340.
51. Jacob S, Al-Kandari A, Alroughani R et al. Assessment of plasma biomarkers for their association with Multiple Sclerosis progression. J Neuroimmunol 2017; 305 : 5– 8. doi: 10.1016/ j.jneuroim.2017.01.008.
52. Rezaeepoor M, Shapoori S, Ganjalikhani-hakemi M et al. Decreased expression of Sema3A, an immune modulator, in blood sample of multiple sclerosis patients. Gene 2017; 610 : 59– 63. doi: 10.1016/ j.gene.2017.02.013.
53. Muto M, Mori M, Liu J et al. Serum soluble Talin-1 levels are elevated in patients with multiple sclerosis, reflecting its disease activity. J Neuroimmunol 2017; 305 : 131– 134. doi: 10.1016/ j.jneuroim.2017.02.008.
54. Galazka G, Mycko MP, Selmaj I et al. Multiple sclerosis: Serum-derived exosomes express myelin proteins. Multiple Sclerosis Journal 2018; 24(4): 449– 458. doi: 10.1177/ 1352458517696597.
55. Ghareghani M, Zibara K, Sadeghi H et al. Fluvoxamine stimulates oligodendrogenesis of cultured neural stem cells and attenuates inflammation and demyelination in an animal model of multiple sclerosis. Sci Rep 2017; 7(1): 4923. doi: 10.1038/ s41598-017-04968-z.
56. Amorini AM, Nociti V, Petzold A et al. Serum lactate as a novel potential biomarker in multiple sclerosis. Biochim Biophys Acta 2014; 1842(7): 1137– 1143. doi: 10.1016/ j.bbadis.2014.04.005.
57. Ghareghani M, Ghanbari A, Dokoohaki S et al. Methylprednisolone improves lactate metabolism through reduction of elevated serum lactate in rat model of multiple sclerosis. Biomed Pharmacother 2016; 84 : 1504– 1509. doi: 10.1016/ j.biopha.2016.11.042.
58. Ludwig MD, Zagon IS, McLaughlin PJ. Elevated serum [Met 5]-enkephalin levels correlate with improved clinical and behavioral outcomes in experimental autoimmune encephalomyelitis. Brain Res Bull 2017; 134 : 1– 9. doi: 10.1016/ j.brainresbull.2017.06.015.
59. Tejera-Alhambra M, Casrouge A, de Andrés Cet al. Plasma biomarkers discriminate clinical forms of multiple sclerosis. PLoS One 2015; 10(6): e0128952. doi: 10.1371/ journal.pone.0128952.
60. Fernández-Paredes L, Casrouge A, Decalf J et al. Multimarker risk stratification approach at multiple sclerosis onset. Clin Immunol 2017; 181 : 43– 50. doi: 10.1016/ j.clim.2017.05.019.
61. Villoslada P, Alonso C, Agirrezabal I et al. Metabolomic signatures associated with disease severity in multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2017; 4(2): e321. doi: 10.1212/ NXI.0000000000000321.
62. DeMarshall C, Goldwaser EL, Sarkar A et al. Autoantibodies as diagnostic biomarkers for the detection and subtyping of multiple sclerosis. J Neuroimmunol 2017; 309 : 51– 57. doi: 10.1016/ j.jneuroim.2017.05.010.
63. Lim CK, Bilgin A, Lovejoy DB et al. Kynurenine pathway metabolomics predicts and provides mechanistic insight into multiple sclerosis progression. Sci Rep 2017; 7 : 41473. doi: 10.1038/ srep41473.
64. Bastos P, Ferreira R, Manadas B et al. Insights into the human brain proteome: Disclosing the biological meaning of protein networks in cerebrospinal fluid. Crit Rev Clin Lab Sci 2017; 54(3): 185– 204. doi: 10.1080/ 10408363.2017.1299682
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANOČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2018 Číslo 4- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANO
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
- Agresívna liečba intracerebrálnej hemoragie so znižovaním krvného tlaku a indikáciou operácie
- Léčba cílená na B lymfocyty – významný pokrok v léčbě roztroušené sklerózy
- Biomarkery progrese onemocnění a prognózy u pacientů s roztroušenou sklerózou
- Možnosti regulace neuroimunitních a neuroendokrinních dějů pomocí fyzioterapie
- Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Rozdíly v klinických, radiologických a léčebných modalitách intramedulárních arachnoidálních cyst a syringomyelie v oblasti krční páteře – 12 případů
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Skoré pooperačné komplikácie po plánovaných operáciách degenerovanej driekovej chrbtice u starších pacientov
- Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
- Soubor obrázků s protikladnou náročností pojmenovatelnosti
- Faryngo-cerviko-brachiální varianta Guillain-Barrého syndromu
- Bradykininem indukovaný angioedém po podání tkáňového aktivátoru plazminogenu u akutní cévní mozkové příhody – terapie s nebo bez inhibitoru C1 esterázy
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
- Analýza dat v neurologii - LXX. Kovariance
- Výroční setkání věnované novinkám v léčbě roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



