-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
Parietal atrophy score on magnetic resonance imaging of the brain in normally aging people
Aim:
Our intention was to create a simple visual evaluation of parietal atrophy on MRI of the brain useful in identifying neurodegenerative dementias, especially Alzheimer‘s disease. We assessed the changes of the parietal regions during natural aging.Patients and methods:
We created a new rating scale that we named the Parietal atrophy score. This method is based on semiquantitativescoring of three structures on coronal slices in the entire parietal lobe: parietal gyri, sulcus cingularis posterior and precuneus. Each structure was rated according to the visual classification size as 0 – a normal size without atrophy, 1 – a borderline finding or 2 – a considerable atrophy. These ratings were summarized into one score for each hemisphere and then these two were integrated into one score for the entire brain. Using a visual rating scale, we classified the parietal regions in 74 elderly subjects with a normal Mini-Mental State Examination score (29 ± 1 point) with a wide range of ages between 48 – 87 years.Results:
Increasing age is associated with a mild progression of the parietal lobe atrophy (r = 0.2; p = 0.05). The overall score of the parietal tissue was not associated with education, gender or hand dominance.Conclusion:
Our new visual rating system of parietal atrophy is an easy and fast method for use in clinical practice. Natural aging is accompanied with negligible parietal atrophic changes.Key words:
parietal atrophy – magnetic resonance imaging – Alzheimer‘s disease – normal aging – sulcus cingularis posterior – precuneus – parietal gyriThe authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manu script met the ICMJE “uniform requirements” for biomedical papers
Autoři: D. Šilhán 1; I. Ibrahim 2; Jaroslav Tintěra 2; A. Bartoš 1,3
Působiště autorů: Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha 1; Základna radiodiagnostiky a intervenční radiologie, Institut klinické a experimentální medicíny, Praha 2; Národní ústav duševního zdraví, Klecany 3
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(4): 414-419
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2018414Souhrn
Cíl:
Naším záměrem bylo vytvořit jednoduché vizuální hodnocení parietální atrofie na MR mozku využitelné u neurodegenerativních demencí, především u Alzheimerovy nemoci. Posoudili jsme parietální oblast v průběhu přirozeného stárnutí.Soubor a metodika:
Vytvořili jsme nové hodnocení, které jsme nazvali Parietální atrofický skór. Je založeno na semikvantitativním skórování tří struktur na koronárních řezech v rozsahu celého parietálního laloku: parietálních gyrů, sulcus cingularis posterior a precuneu. Každá struktura byla podle vizuálního posouzení velikosti hodnocena stupněm 0 –bez atrofie, 1 – hraniční nález nebo 2 – významná atrofie. Z nich vznikl jeden výsledný skór pro každou stranu a ze skórů obou stran jeden celkový skór pro celý mozek. Užitím vizuální hodnotící škály jsme klasifikovali parietální oblasti u 74 starších osob s normálním testem kognitivních funkcí Mini-Mental State Examination (29 ± 1 bod) v širokém věkovém rozmezí 48–87 let.Výsledky:
Se vzrůstajícím věkem dochází k mírné progresi parietální atrofie (r = 0,2; p = 0,05). Celkový skór parietální tkáně nesouvisel se vzděláním, pohlavím či dominancí ruky.Závěr:
Naše nová vizuální klasifikace velikosti parietálních laloků na MR je snadná a rychlá metoda pro klinickou praxi. Podle ní dochází k zanedbatelnému úbytku parietálního laloku při stárnutí.Klíčová slova:
parietální atrofie – magnetická rezonance –Alzheimerova nemoc – normální stárnutí –sulcus cingularis posterior – precuneus – parietální gyryÚvod
Magnetická rezonance je jedna ze základních metod využívaných při diagnostice demence a její nejčastější příčiny Alzheimerovy nemoci (AN). Umožňuje zjistit hydrocefalus nebo nádorovou, cévní či zánětlivou etiologii demence. Také ji lze využít při posuzování atrofie mozkových struktur u demencí neurodegenerativní etiologie, jako je AN [1]. Mozková atrofie se dá hodnotit metodami kvantitativními, jako je ruční nebo automatická segmentace [2,3]. Vizuální hodnocení je rychlý semikvantitativní způsob [4 – 6]. Výhodou kvantitativních metod je větší přesnost, avšak vyžadují specializovaný software, hlubší znalosti hodnotitele a jsou podstatně náročnější na čas [7]. Předností vizuálních způsobů hodnocení je jednoduchost a rychlost provedení, díky nimž mají větší potenciál pro uplatnění v klinické praxi.
V případě AN je nejčastěji hodnocena atrofie hipokampu v mediotemporální oblasti. Z různých metod se převážně používá skóre mediotemporální atrofie (MTA) [8]. Tento systém jsme poprvé představili v českém písemnictví před několika lety [6]. Řada studií dokazuje, že rychlejší úbytek mozkové tkáně v tomto regionu souvisí s přechodem mírné kognitivní poruchy do demence u AN [9–11]. Mediotemporální oblast ovšem atrofuje i v průběhu normálního stárnutí a také u jiných typů demence, především u frontotemporální lobární degenerace, což snižuje specifitu tohoto regionu pro diagnostiku AN [12]. Naopak existují typy AN se zachováním hipokampální tkáně [13].
Parietální lalok je další oblast, na kterou se zaměřuje výzkum AN. Atrofie v tomto regionu se častěji vyskytuje u AN s časným začátkem, tj. u jedinců mladších 65 let. U této formy AN se také poměrně často nachází intaktní hipokampus, což poukazuje na důležitost parietální atrofie (PA) v diagnostice AN především u mladších jedinců [14,15]. Na stejnou lokalizaci upozorňují i funkční zobrazovací metody jako perfuzní MR (ASL MR), funkční MR a PET, na kterých jsou u pacientů s AN detekovány poruchy perfuze, aktivity a metabolizmu právě v oblastech parietálních laloků [16,17]. Hodnocení PA může přispět i v diferenciální diagnostice AN a frontotemporální demence, při které se PA ve srovnání s AN téměř nevyskytuje [18].
Hlavní a prakticky jediná metoda vizuální klasifikace PA na MR je skóre zadní atrofie (posterior atrophy score nebo také Koedam score) [5]. Toto skórování je založeno na posuzování atrofie mnoha struktur na sagitálních, koronárních i axiálních řezech. Konkrétně se hodnotí: 1. na sagitálním řezu – šířka sulcus parietooccipitalis, sulcus cingularis posterior a atrofie precuneu; 2. na koronárním řezu – šířka sulcus cingularis posterior a atrofie parietálních gyrů; 3. na axiálním řezu – šířka sulcus cingularis posterior a atrofie parietálních gyrů. Výhoda tohoto přístupu je, že k jeho provedení není potřeba žádný software a postačí tedy prostý zrak a jistá zkušenost. Domníváme se však, že pro svou složitost a delší dobu potřebnou k vyhodnocení bude obtížné, aby se tato metoda stala běžně využívanou pomůckou v klinické praxi.
Naším hlavním cílem bylo vytvořit jednoduché a rychle proveditelné vizuální skórování PA na MR, které by posloužilo velkému spektru pracovišť a odborníků, zejména při diagnostice AN. Touto metodikou jsme nejdříve chtěli posoudit vývoj parietálních oblastí v průběhu přirozeného stárnutí. Zajímalo nás, které faktory souvisí s velikostí parietálního laloku na MR mozku u starších jedinců (věk, vzdělání, pohlaví, dominance ruky, kognitivní skór).
Metodika a osoby
Nové hodnocení parietálních oblastí na MR mozku jsme pojmenovali Parietální atrofický skór (PAS). Je založeno na skórování atrofie tří struktur na T1 vážených koronárních řezech. Konkrétně se jedná o tyto části parietálních laloků: 1. sulcus cingularis posterior; 2. precuneus; 3. parietální gyry, které jsou ukázány na obr. 1. Při jejich výběru jsme se inspirovali zahraniční klasifikací tzv. posterior atrophy score neboli Koedam score a výsledky z funkčních zobrazovacích metod. Naše hodnocení PAS probíhalo na sekvenci T1 vážených koronárních řezů pořízených přístrojem Siemens Trio Tim 3T (Siemens Medical Solutions, Malvern, PA, USA). Hranice byla ventrálně stanovena počínajícím rozvíjením mozečkových hemisfér. Prohlížení řezů bylo dorzálně ukončeno v úrovni přechodu parietálního a okcipitálního laloku. Stupeň atrofie dané oblasti byl určen na základě posouzení její struktury na sekvenci koronárních řezů celým parietálním lalokem. Vzhledem k rozsahu parietální oblasti a její variabilitě jsme to považovali za nutnost. Výsledek z jednoho řezu by neměl adekvátní výpovědní hodnotu. Každá struktura byla skórována semikvantitativně ve třech stupních: 0 – normální velikost tkáně bez atrofie; 1 – hraniční nález; 2 – významná atrofie. Oba krajní nálezy na MR mozku ukazuje obr. 2.
Obr. 1. Ukázka tří skórovaných struktur parietálního laloku na jednom vybraném koronárním řezu z mnoha hodnocených T1 vážených snímků.
Fig. 1. Example of three rated parietal lobe structures on one selected coronary slice from many T1 weighted images.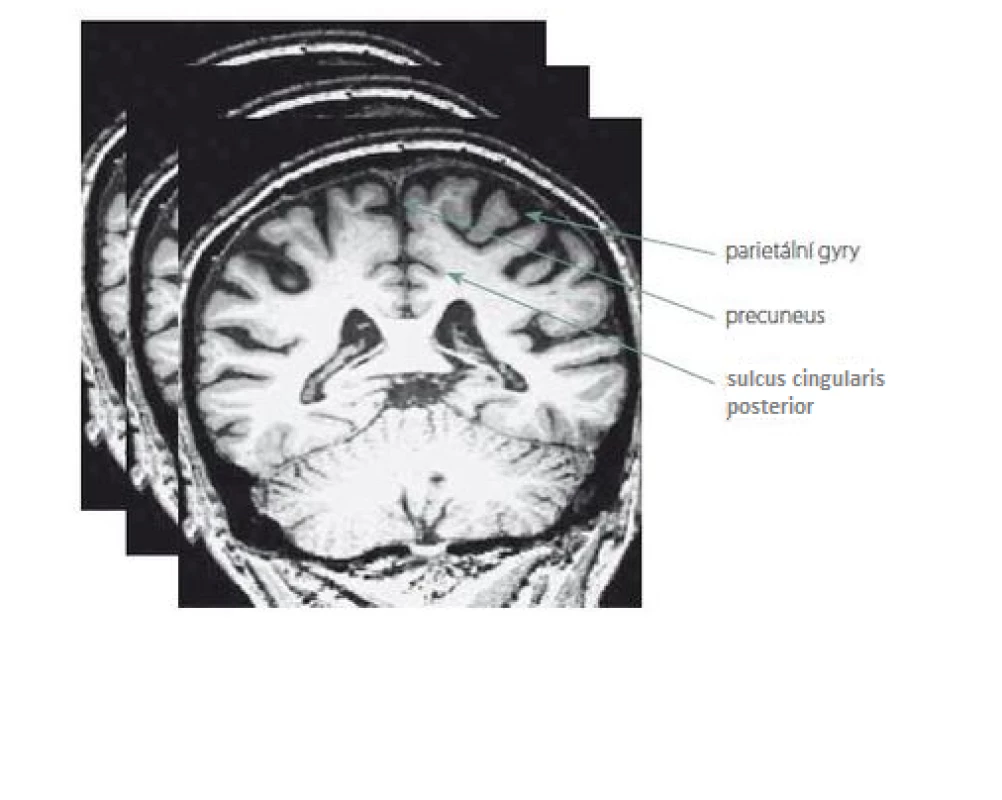
Obr. 2. Ilustrativní ukázky semikvantitativního hodnocení tří parietálních struktur (sulcus cingularis posterior, precuneus, parietální gyry). V pravém parietálním laloku je přítomna významná atrofie všech tří struktur. Naopak v levém parietálním laloku jsou všechny tři struktury normální velikosti bez atrofie.
Fig. 2. Ilustrative examples of semiquantitative scoring of three parietal structures (sulcus cingularis posterior, precuneus, parietal gyri). In the right parietal lobe, there is a considerable atrophy of all three structures. In contrast, in the left parietal lobe, all three structures are of normal size without atrophy.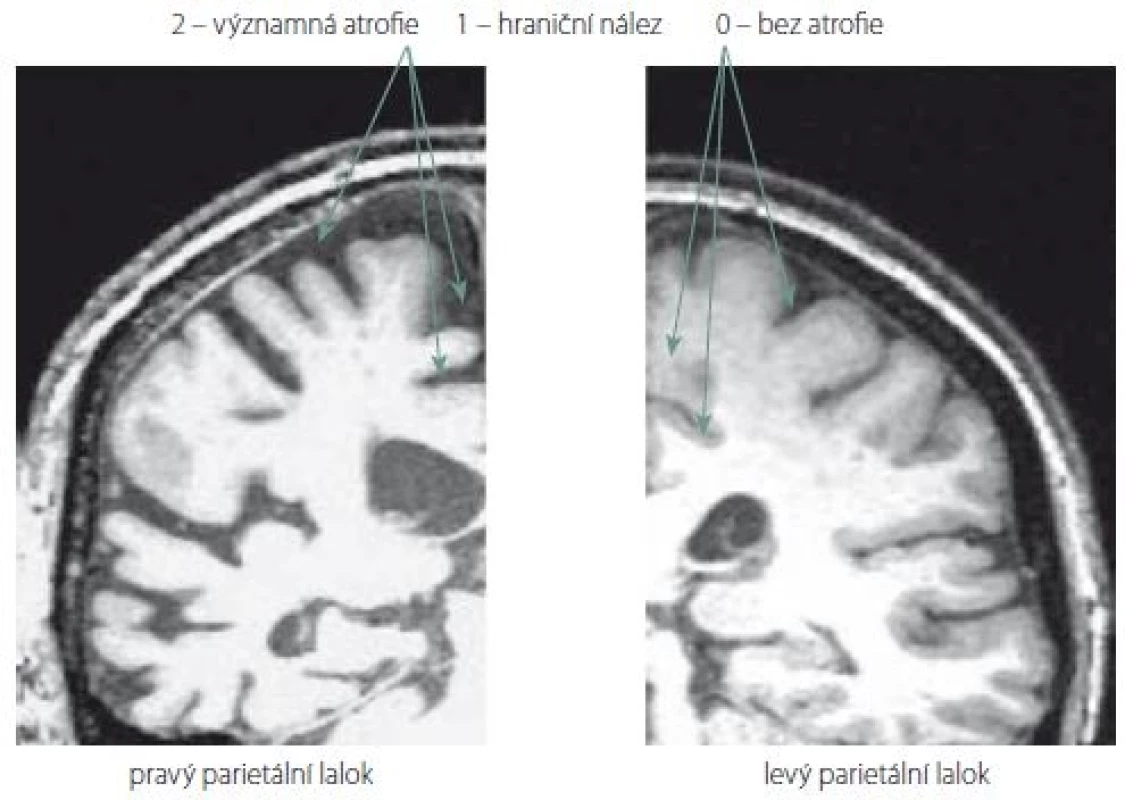
Každé hodnocené struktuře byl přiřazen jeden ze tří stupňů velikosti. Z jejich kombinace se podle kritérií uvedených v tab. 1 určil výsledný skór zvlášť pro pravý a zvlášť pro levý parietální lalok. Výsledný skór pro jeden lalok může nabývat hodnot: 0 – lalok bez atrofie; 1 – hraniční nález; 2 – významná atrofie laloku. Zápis vyhodnocení od jedné osoby uvedeme na příkladu a vypadal by takto: PAS = výsledný skór pravého/ levého parietálního laloku. Například PAS 2/ 1 znamená významná atrofie vpravo a hraniční nález vlevo.
Tab. 1. Podmínky pro stanovení výsledného skóru pravého nebo levého parietálního laloku. 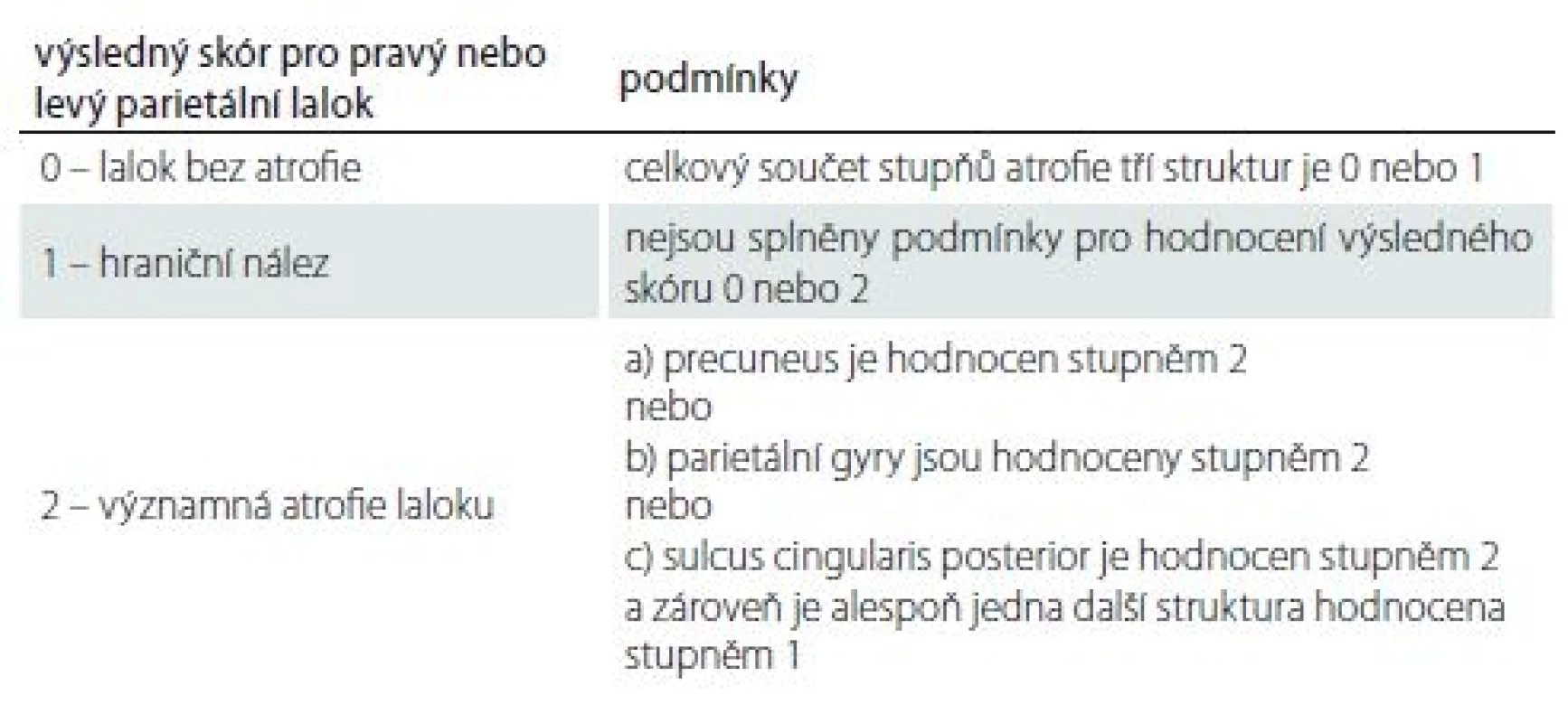
Nakonec jsme z kombinace výsledných skórů obou stran určili celkový skór obou parietálních laloků tzv. PASglob. Ten může být: 0 – bez atrofie; 1 – hraniční nález; 2 – významná atrofie jednoho laloku; 3 – významná atrofie bilaterálně. Jednoduchý způsob určení PASglob. vysvětluje tab. 2.
Tab. 2. Princip stanovení celkového parietálního atrofického skóru (PASglob.) z výsledných skórů každé hemisféry. Celkový skór vzniká z kombinace skórů pro každý parietální lalok. 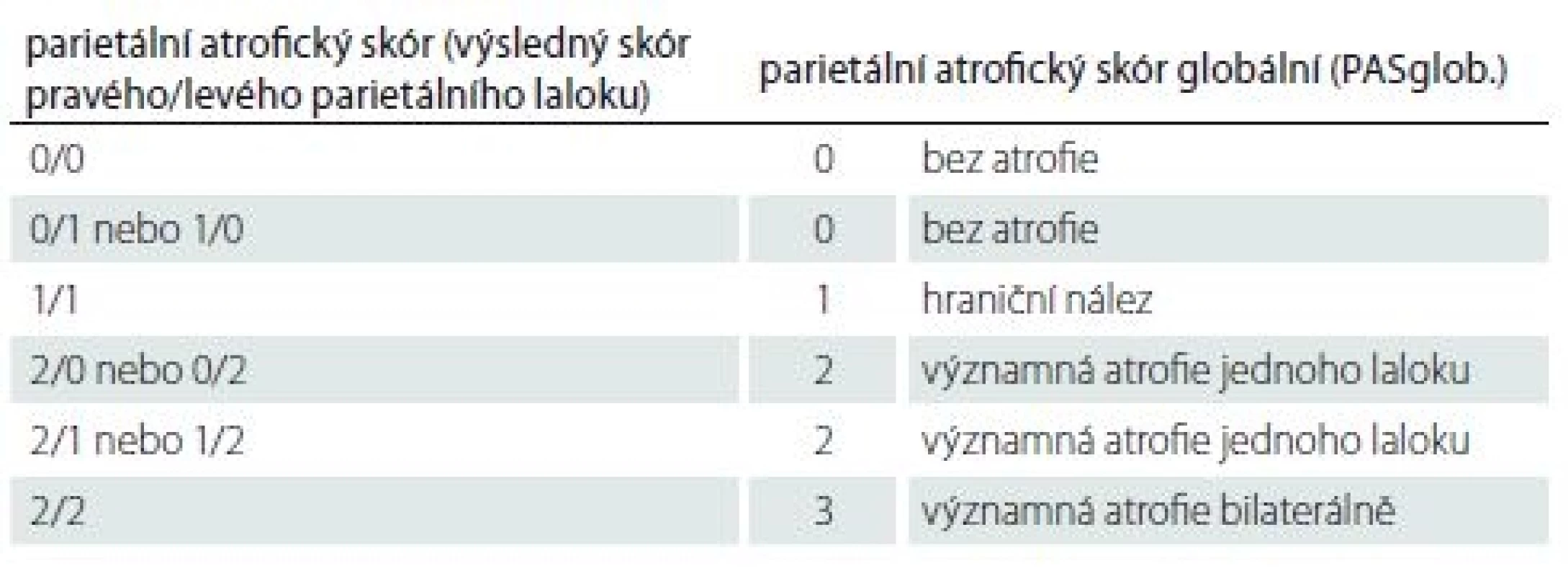
Celý proces skórování si vysvětlíme na příkladu z praxe. Parietální lalok vpravo je oskórován takto: sulcus cingularis posterior – 1; precuneus – 1; parietální gyry – 1. Výsledný skór pro pravý lalok je 1. Parietální lalok vlevo je oskórován takto: sulcus cingularis posterior – 2; precuneus – 0; parietální gyry – 1. Výsledný skór pro levý lalok je podle stanovených kritérií 2. Zápis bude vypadat takto: PAS = 1/ 2 (hraniční PA vpravo/ významná PA vlevo), z čehož jednoduše určíme PASglob. = 2 (významná atrofie jednoho laloku). Způsob stanovení PAS a PASglob. vyplývá z tab. 1, 2.
Naše skórování jsme nejdříve uplatnili k popisu normálního stárnutí parietálních oblastí na třech strukturách v obou hemisférách a celkově v jednom mozku. Parietální oblast jsme hodnotili na koronárních T1 vážených řezech mozkem u 74 normálních starších dobrovolníků, kteří byli vyšetřeni na 3T přístroji (viz specifikaci výše) v Institutu klinické a experimentální medicíny (IKEM) v letech 2007 – 2011. Jejich klinické charakteristiky byly následující: věk 66 ± 7 let, rozsah 48 – 87 let, 52 (70 %) žen, nejčastější středoškolské vzdělání s maturitou, 16 ± 3 let vzdělání v mládí, 61 (84 %) praváků, vyšetření kognitivních funkcí podle Mini-Mental State Examination (MMSE) [19] s normálními skóry 29 ± 1 bod podle nedávné normativní studie [20]. Rozložení kategorie vzdělání v mládí bylo následující: středoškolské bez maturity (n = 5,7 %), středoškolské s maturitou (n = 33,45 %), vysokoškolské (n = 30,40 %), postgraduální (n = 6, 8 %). Zhruba u poloviny (n = 35) byly navíc k dispozici normální výsledky dalších kognitivních testů nebo dotazníků: Sedmiminutový skríningový test – pravděpodobnost AN 0,003 ± 0,003; test orientace 0,1 ± 0,2; učení 16 obrázků bez nápovědy 11 ± 2 obrázky; učení 16 obrázků s nápovědou 5 ± 2 obrázky; učení 16 obrázků celkem 16 ± 0 obrázků; test kreslení hodin 7 ± 0; slovní vyjadřování (test slovní produkce zvířat) 23 ± 5; jednominutová slovní produkce fonémická na počáteční písmena N 13 ± 4 slov, K 16 ± 4 slov, P 18 ± 4 slova slovní produkce, kategoriální na skupinu ovoce 15 ± 3 slov, zvířata 23 ± 5 slov, nákupní seznam 23 ± 4 slova; sebeposouzení v Dotazníku funkčního stavu – subjektivní FAQ 0,03 ± 0,2 bodů, tj. 99,9 ± 0,6 %; objektivní posouzení blízkou osobou – objektivní FAQ 0 ± 0 bodů, tj. 100 ± 0 %; Dotazník změněných schopností seniora AD8 – subjektivně 0,09 ± 0,4 obrázky, objektivně od blízké osoby 0,01 ± 0,3. V odstupu několika let od vyšetření MR mozku byl v letech 2014 – 2015 u všech osob jejich normální kognitivní statut ověřen dvěma způsoby – jednak experimentálními krátkými testy a jednak komplexní neuropsychologickou baterií (standardizované testy RAVLT, ROCFT, TMT, WAIS-III) [21 – 24].
Celou skupinu osob jsme rozdělili na dvě podskupiny podle věku 65 let. Chtěli jsme vytvořit přibližně stejně početné skupiny podle mediánu věku, který byl 66 let. Dále jsme se přidržovali mezinárodní klasifikace nemocí, kde se dělí Alzheimerova nemoc s časným a pozdním začátkem právě podle arbitrárního věku 65 let. Metodiku plánujeme využít u tohoto neurodegenerativního onemocnění. Vzorek jsme nečlenili do více podskupin jak kvůli snížení počtu osob v jednotlivých podskupinách na nereprezentativní počty, tak kvůli minimální vazbě skóru PAS na věk, tj. je téměř nezávislý s hraniční hodnotou p = 0,05.
Z celého souboru jsme vybrali 25 MR mozků tak, aby v nich byly rovnoměrně zastoupeny všechny čtyři stupně podle PASglob. (0 – 3) po 25 %. U nich byly prohlédnuty a klasifikovány míry PA ve třech rovinách podle skóru zadní atrofie (posterior atrophy score nebo také Koedam score) slepě (tj. bez znalosti klasifikace podle PAS) a po několika měsících, aby výsledky nebyly ovlivněny primárním hodnocením podle metodiky PAS. Statistické analýzy byly provedeny v programech STATISTICA version 9.1 (StatSoft, Inc., Palo Alto, CA, USA) a MedCalc (MedCalc Software, Ostend, Belgie). Spearmanovým korelačním koeficientem byla zhodnocena souvislost PAS s jednotlivými sociodemografickými charakteristikami (věk, počet let vzdělání, MMSE skór) a korelace mezi skóry PAS a skóry zadní atrofie (posterior atrophy score podle Koedamové [5]). Chí-kvadrát test byl použit k porovnání skórů PAS ve dvou nebo více podskupinách rozdělených podle pohlaví, kategorie vzdělání nebo dominance ruky. Stranové rozdíly PASu jsme posoudili párovým Wilcoxonovým testem. Účastníci podepsali informovaný souhlas s výzkumem, který byl schválen etickými komisemi FN Královské Vinohrady a Psychiatrického centra Praha.
Výsledky
U skupiny přirozeně stárnoucích osob uvádíme výsledky PAS vpravo, vlevo a pro celý mozek jak v celé skupině, tak ve dvou podskupinách mladších a starších 65 let v tab. 3. Z ní je patrná stabilita výsledků i po rozdělení na podskupiny, a tudíž zanedbatelný vliv věku. Směrodatné odchylky ukazují na biologickou variabilitu této oblasti mozku bez ohledu na věk. PAS koreloval mírně a pozitivně s věkem (vpravo r = 0,3; p = 0,004, vlevo nesignifikantní, bilaterálně r = 0,2; na hranici významnosti p = 0,05). Tomu odpovídá i zjištění slabého vztahu podle regrese. Podle regresní rovnice skór PAS = – 1,1444 + 0,0437 × věk se celkový skór PASglob. zhorší o jeden stupeň na každých 25 let zestárnutí. Rozdíl mezi pravou a levou hemisférou v PAS skórech jsme nenalezli. V mladších věkových kategoriích našeho výběru je řada jedinců s významnou PA bilaterálně. Naopak řada osob ve vyšším věku nemá PA vůbec.
Tab. 3. Parietální atrofický skór (PAS) pro pravou a levou hemisféru a celkově pro celý mozek (PAS glob.) u všech starších osob a ve dvou podskupinách rozdělených podle věku 65 let. 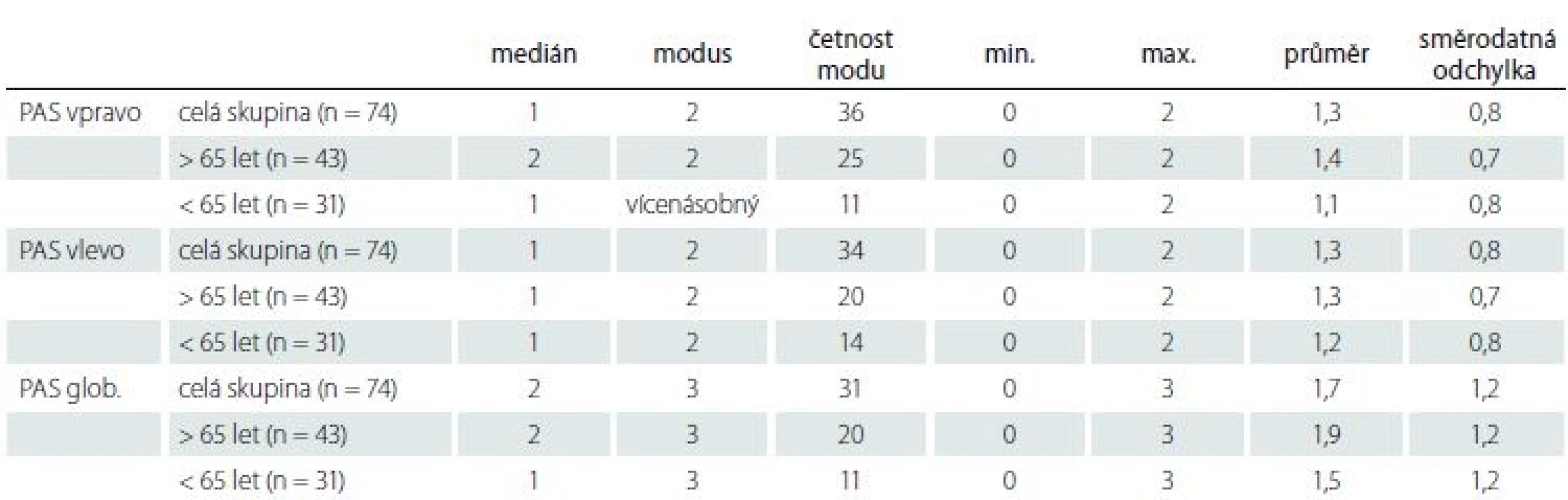
PAS nesouvisel s dalšími faktory – počet let vzdělání, dominance ruky, pohlaví nebo skór MMSE.
Hodnocení parietálních oblastí jen na koronárních řezech pomocí skóru PAS a ze všech tří rovin pomocí skóru zadní atrofie podle Koedamové vykazuje statisticky velmi významnou korelaci jak vlevo (r = 0,75; p = 0,00001), tak vpravo (r = 0,63; p = 0,0008). Rovněž PASglob. koreluje dobře se skórem zadní atrofie obou stran (vlevo r = 0,74; p = 0,00002, vpravo r = 0,68; p = 0,0002).
Hodnocení PA pomocí PAS je po krátkém zacvičení snadno a rychle proveditelné. Posouzení obou parietálních oblastí a jejich skórování pro jednu osobu trvalo 1 ± 0,25 min.
Diskuze
V práci představujeme hodnocení velikosti parietálních laloků na MR u přirozeně stárnoucí populace s širokým věkovým rozpětím 48 – 87 let. Vizuální skórování pomocí PAS je nová metoda, která umožňuje snadno a rychle posoudit PA. K jejímu provedení stačí prostý zrak a znalost jednoduchých principů skórování. Hodnocení PAS může po krátkém zacvičení provádět i nespecializovaný pracovník se základními vědomostmi o MR mozku. Čas potřebný na zhodnocení PA jedné osoby je jen kolem 1 min. Vzhledem k velikosti a rozmanitosti parietálního laloku to považujeme za velmi dobrý výsledek. Výhoda našeho hodnocení PAS v porovnání se stávajícím skórováním zadní atrofie (Koedam score) spočívá především v redukci hodnocení ze tří základních rovin do jedné koronární roviny. O této rovině se domníváme, že je nejpřehlednější. Naše skórování PAS hodnotí pouze tři struktury, zatímco Koedam score vychází ze struktur čtyř [5]. Další předností našeho přístupu je také skutečnost, že nejužívanější vizuální hodnocení velikosti hipokampu (skóre MTA) je prováděno právě v koronární rovině [4,6]. Skórování na řezech jedné roviny může podstatně ušetřit čas při hodnocení obou oblastí MTA a PAS společně.
Z našich výsledků plyne, že u kognitivně normálních osob dochází s rostoucím věkem k sotva znatelnému úbytku parietální tkáně, což je v souladu s předchozími nálezy [25,26]. Globální PAS složený z obou stran byl na samé hranici statistické významnosti a změna o 1 stupeň ve skórování nastává se změnou věku o 25 let. Levý parietální lalok je dokonce nezávislý na věku, takže může být považován za referenční. Naopak překvapivě vpravo parietální tkáň ubývá s přibývajícím věkem. Pro různou korelaci mezi věkem a stranou hemisféry nemáme jasné vysvětlení. Tuto skutečnost je třeba vzít v úvahu při hodnocení pomocí PAS. Přitom jsme prokázali, že parietální oblast je symetrická.
Ostatní faktory (vzdělání, pohlaví, dominance ruky či skór MMSE) vliv na PAS neměly, čímž odpadá starost se jimi zabývat při hodnocení PA. U skóru MMSE je chybějící korelace pochopitelná, protože výsledky MMSE byly ve velmi úzkém rozmezí normálních skórů.
Hlavní nedostatek našeho skórování PAS spatřujeme v subjektivním hodnocení, takže může docházet k odchylkám v určování míry atrofizace. Proto jsme se přidržovali jen hrubého rozdělení na pozitivní, negativní a neurčitý nález, abychom zvýšili shodu v posouzení. V našem dalším snažení nás povzbudila vysoká korelace mezi naším novým systémem a již zavedeným detailnějším škálováním pomocí skórů zadní atrofie podle Koedamové. V dalším kroku bude vhodné posoudit shodu v rámci jednoho hodnotitele a mezi různými hodnotiteli. Přesnější výsledky by mohly poskytnout kvantitativní segmentační techniky, které lze navíc považovat za objektivnější. Využití manuální a automatické segmentace v běžné klinické praxi je však vzhledem k časové náročnosti a potřebě specializovaného softwaru v současnosti nereálné. Velikost a variabilita struktury parietálního laloku představuje další překážku pro aplikaci kvantitativních metod na tuto oblast.
Poměrně překvapivé bylo, že řada kognitivně normálních osob v celém věkovém spektru skupiny měla významnou PA, a to často i bilaterálně. Tomu odpovídá modus (tedy nejčastěji se vyskytující skór) vpravo, vlevo i bilaterálně odpovídající výrazné atrofii u poloviny normálně stárnoucích osob. Tento výsledek do určité míry snižuje specifitu PA pro diagnostiku AN. Vzhledem k nízkému vlivu věkových změn se může jednat o dlouhodobou charakteristiku dané osoby z předchozího života, a to včetně stavu od narození. Otázka je, zda není za PA odpovědná i jiná patologie, která neovlivňuje kognitivní funkce. V úvahu přichází klasická populační onemocnění typu diabetes mellitus, ateroskleróza, arteriální hypertenze a řada dalších, která by mohla ovlivňovat např. vaskulární faktory. K ověření těchto hypotéz chybí data.
Předpokládáme, že skórování PAS bude využito především pro hodnocení PA v rámci diagnostiky AN. Řada prací prokazuje, že je PA přítomna především u AN s časným začátkem, u které se zároveň často vyskytuje intaktní hipokampus [13,27,28]. V tomto případě tedy zřejmě nemá skór MTA takový význam jako u častější klasické AN s pozdním začátkem. Naše hodnocení PAS by se mohlo tedy uplatnit hlavně při odlišení pacientů s AN s časným začátkem od normálních osob. Nutno však podotknout, že i řada kognitivně normálních jedinců staršího věku má významnou PA, jak ukazuje náš výsledek. Druhou oblastí, kde by mohlo skórování PAS najít svoje uplatnění, je diferenciální diagnostika mezi AN s časným začátkem a frontotemporální lobární degenerací, která patří mezi demence s časným nástupem (po 50. roce věku). U frontotemporální lobární degenerace se totiž na rozdíl od AN s časným začátkem PA prakticky nevyskytuje, zatímco MTA je poměrně častá u obou [29 – 31].
Jednoduchost a časová nenáročnost našeho vizuálního skórování PAS je určena radiologům a také neurologům, kteří by si chtěli hodnotit míru PA sami. Domníváme se, že by metodiku mohli uvítat zejména specialisté zabývající se AN a dalšími neurodegenerativními demencemi. Skórování je myšleno jako rychlé a orientační měřítko parietální oblasti mozku, které by se dalo předávat s vyšetřovanou osobou při komunikaci mezi pracovišti. Doposud určité kvantitativní vyjádření v radiologických popisech chybí a systém zadní atrofie podle Koedamové se standardně nepoužívá. Vzhledem k dobré vzájemné korelaci nabízíme rychlejší variantu do běžné lékařské praxe.
Práce byla podpořena projekty PROGRES Q35, „Udržitelnost pro Národní ústav duševního zdraví“, č. LO1611, za finanční podpory MŠMT v rámci Národního programu udržitelnosti I (NPU I) a MZ ČR – RVO „Národní ústav duševního zdraví – NUDZ“ a grantem AZV MZ NV18-07-00272. Práce byla prezentována a oceněna na Studentské vědecké konferenci 3. LF UK a Celostátní konferenci studentských vědeckých prací v Olomouci v roce 2017.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 31. 1. 2018
Přijato do tisku: 28. 5. 2018
doc. MUDr. Aleš Bartoš, Ph.D.
Neurologická klinika 3. LF UK
a FN Královské Vinohrady
Šrobárova 1150/50
100 00 Praha
e-mail: ales.bartos@nudz.cz
Zdroje
1. Harper L, Barkhof F, Scheltens P et al. An algorithmic approach to structural imaging in dementia. J Neurol Neurosurg Psychiatry 2014; 85(6): 692 – 698. doi: 10.1136/ jnnp-2013-306285.
2. Vemuri P, Jack CR Jr. Role of structural MRI in Alzheimer‘s disease. Alzheimers Res Ther 2010; 31 : 2(4): 23. doi: 10.1186/ alzrt47.
3. Mrzílková J, Zach P, Bartoš A et al. Volumetric analysis of the pons, cerebellum and hippocampi in patients with Alzheimer‘s disease. Dement Geriatr CognDisord 2012; 34(3 – 4): 224 – 234. doi: 10.1159/ 000343445.
4. Scheltens P, Leys D, Barkhof F et al. Atrophy of medial temporal lobes on MRI in “probable” Alzheimer’s disease and normal ageing: diagnostic value and neuropsychological correlates. J Neurol Neurosurg Psychiatry 1992; 55(10): 967 – 972.
5. Koedam EL, Lehman M, van der Flier WM et al. Visual assessment of posterior atrophy development of a MRI rating scale. Eur Radiol 2011; 21(12): 2618 – 2625. doi: 10.1007/ s00330-011-2205-4.
6. Bartoš A, Zach P, Diblíková F et al. Vizuální kategorizace mediotemporální atrofie na MR mozku u Alzheimerovy nemoci. Psychiatrie 2007; 11 (Suppl 3): 49 – 52.
7. Rathakrishnan BG, Doraiswamy PM, Petrella JR et al. Science to practice: translating automated brain MRI volumetry in Alzheimer’s Disease from research to routine diagnostic use in the work-up of dementia. Front Neurol 2014; 4 : 216. doi: 10.3389/ fneur.2013.00216.
8. Scheltens P, Pasquier F, Weerts JG et al. Qualitative assessment of cerebral atrophy on MRI: inter - and intra-observer reproducibility in dementia and normal aging. Eur Neurol 1997; 37(2): 95 – 99. doi: 10.1159/ 000117417.
9. Liu Y, Paajanen T, Zhang Y et al. Analysis of regional MRI volumes and thicknesses as predictors of conversion from mild cognitive impairment to Alzheimer‘s disease. Neurobiol Aging 2010; 31(8): 1375 – 1385. doi: 10.1016/ j.neurobiolaging.2010.01.022.
10. Fennema-Notestine C, McEvoy LK, Hagler DJ Jr et al. The Alzheimer‘s Disease Neuroimaging Initiative: structural neuroimaging in the detection and prognosis of pre-clinical and early AD. Behav Neurol 2009; 21(1): 3 – 12. doi: 10.3233/ BEN-2009-0230.
11. Jack CR, Shiung MM, Gunter JL et al. Comparison of different MRI brain atrophy rate measures with clinical disease progression in AD. Neurology 2004; 24 : 62(4): 591 – 600.
12. van de Pol LA, Hensel A, van der Flier WM et al. Hip-pocampal atrophy on MRI in frontotemporal lobar degeneration and Alzheimer’s disease. J Neurol Neurosurg Psychiatry 2006; 77(4): 439 – 442. doi: 10.1136/ jnnp.2005.075341.
13. Frisoni GB, Pievani M, Testa C et al. The topography of grey matter involvement in early and late onset Alzheimer‘s disease. Brain 2007; 130(3): 720 – 730. doi: 10.1093/ brain/ awl377.
14. Galton CJ, Patterson K, Xuereb JH et al. Atypical and typical presentations of Alzheimer‘s disease: a clinical, neuropsychological, neuroimaging and pathological study of 13 cases. Brain 2000; 123(3): 484 – 498.
15. Frisoni GB, Testa C, Sabattoli F et al. Structural correlates of early and late onset Alzheimer’s disease: voxel based morphometric study. J Neurol Neurosurg Psychiatry 2005; 76(1): 112 – 114.
16. Hu WT, Wang Z, Lee VM et al. Distinct cerebral perfusion patterns in FTLD and AD. Neurology 2010; 75(10): 881 – 888. doi: 10.1212/ WNL.0b013e3181f11e35.
17. Landau SM, Harvey D, Madison CM et al. Associations between cognitive, functional, and FDG-PET measures of decline in AD and MCI. Neurobiol Aging 2011; 32(7): 1207 – 1218. doi: 10.1016/ j.neurobiolaging.2009.07.002.
18. Lehmann M, Koedam EL, Barnes J et al. Posterior cerebral atrophy in the absence of medial temporal lobe atrophy in pathologically-confirmed Alzheimer’s disease. Neurobiol Aging 2012; 33(3): 627.e1 – 627.e12. doi: 10.1016/ j.neurobiolaging.2011.04.003.
19. Folstein MF, Folstein SE, McHugh PR. „Mini-mental state“. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189 – 198.
20. Bartoš A, Raisová M. The Mini-Mental State Examination: Czech norms and cutoffs for mild dementia and mild cognitive impairment due to Alzheimer‘s disease. Dement Geriatr Cogn Disord 2016; 42(1 – 2): 50 – 57. doi: 10.1159/ 000446426.
21. Bartoš A, Raisová M. Testy a dotazníky pro vyšetřování kognitivních funkcí, nálady a soběstačnosti. Praha: Mladá fronta 2015.
22. Bartoš A, Orlíková H, Raisová M et al. Česká tréninková verze Montrealského kognitivního testu (MoCA-CZ1) k časné detekci Alzheimerovy nemoci. Cesk Slov Neurol N 2014; 77/ 110(5): 587 – 594.
23. Bartoš A. Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška. Cesk Slov Neurol N 2016; 79/ 112(6): 671 – 679.
24. Bartoš A. Test gest (TEGEST) k rychlému vyšetření epizodické paměti u mírné kognitivní poruchy. Cesk Slov Neurol N 2018; 81/ 114(1): 37 – 44. doi: 10.14735/ amcsnn201837.
25. Fjell AM, Walhovd KB, Fennema-Notestine C et al. One year brain atrophy evident in healthy aging. J Neurosci 2009; 29(48): 15223 – 15231. doi: 10.1523/ JNEUROSCI.3252-09.2009.
26. Peters R. Ageing and the brain. Postgrad Med J 2006; 82(964): 84 – 88. doi: 10.1136/ pgmj.2005.036665.
27. Ishii K, Kawachi T, Sasaki H et al. Voxel-based morphometric comparison between early - and late-onset mild Alzheimer‘s disease and assessment of diagnostic performance of Z score images. AJNR Am J Neuroradiol 2005; 26(2): 333 – 340.
28. Shiino A, Watanabe T, Kitagawa T et al. Different atrophic patterns in early - and late-onset Alzheimer‘s disease and evaluation of clinical utility of a method of regional z-score analysis using voxel-based morphometry. Dement Geriatr Cogn Disord 2008; 26(2): 175 – 186. doi: 10.1159/ 000151241.
29. Galton CJ, Patterson K, Graham K et al. Differing patterns of temporal atrophy in Alzheimer‘s disease and semantic dementia. Neurology 2001; 57(2): 216 – 225.
30. Mesulam MM. Primary progressive aphasia. Ann Neurol 2001; 49(4): 425 – 432.
31. Thompson SA, Patterson K, Hodges JR. Left/ right asymmetry of atrophy in semantic dementia: Behavioral-cognitive implications. Neurology 2003; 61(9): 1196 – 1203.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANOČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2018 Číslo 4- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANO
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
- Agresívna liečba intracerebrálnej hemoragie so znižovaním krvného tlaku a indikáciou operácie
- Léčba cílená na B lymfocyty – významný pokrok v léčbě roztroušené sklerózy
- Biomarkery progrese onemocnění a prognózy u pacientů s roztroušenou sklerózou
- Možnosti regulace neuroimunitních a neuroendokrinních dějů pomocí fyzioterapie
- Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Rozdíly v klinických, radiologických a léčebných modalitách intramedulárních arachnoidálních cyst a syringomyelie v oblasti krční páteře – 12 případů
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Skoré pooperačné komplikácie po plánovaných operáciách degenerovanej driekovej chrbtice u starších pacientov
- Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
- Soubor obrázků s protikladnou náročností pojmenovatelnosti
- Faryngo-cerviko-brachiální varianta Guillain-Barrého syndromu
- Bradykininem indukovaný angioedém po podání tkáňového aktivátoru plazminogenu u akutní cévní mozkové příhody – terapie s nebo bez inhibitoru C1 esterázy
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
- Analýza dat v neurologii - LXX. Kovariance
- Výroční setkání věnované novinkám v léčbě roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



