-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
Antiplatelet and anticoagulant therapy in carotid endarterectomies
Aim:
The influence of antiplatelet agents and anticoagulants on hemorrhagic complications and the development of ischaemic brain lesions during carotid endarterectomies (CEAs) was studied.Methods:
During 559 CEAs antithrombotic therapy, as administrated by a referral doctor, was kept. The influence of antithrombotic therapy on the: 1. incidence of wound hematoma; 2. incidence of symptomatic intracerebral hematoma after CEA; 3. length of hospital stay; 4. incidence of new brain ischaemic lesions were studied.Results:
In total, wound hematoma was found in 43 (7.69%) cases. Of those there were: 1. 2.94% in „no antithrombotic“ group; 2. 5.18% (p = 0.55) in the acetylsalicylic acid (ASA)/ASA + derivates group; 3. 18.36% (p = 0.008) in clopidogrel group; 4. 0% in ticlopidin group; 5. 20% = 0.022) in low molecular weight heparin (LMWH) group; 6. 19.05% (p = 0.026) in LMWH + ASA group; 7. 36,36% (p = 0.003) in clopidogrel + ASA group. Incidence of symptomatic intracerebral hematoma after CEA was 0.89% in five cases. The mean length of hospital stay was 4.7 days for uncomplicated cases, 5.1 days for cases with hematoma without reoperation and 7.2 days for cases with hematoma with reoperation. Incidence of new ischaemic lesions after CEA was 10.91%, not related to antithrombotic therapy (p > 0.18).Conclusion:
Clopidogrel, LMWH and LMWH + ASA groups showed app. 4 times higher risk of wound hematoma, dual antiplatelet therapy 5.5 times higher compared to ASA therapy only. Therefore, their use preoperatively in CEA should be restricted for cases of symptomatic stenosis with high recurrent risk of stroke. No influence of antithrombotics on the incidence of new ischaemic brain lesions during CEA was showed.Key words:
antiplatelet therapy – anticoagulants – wound hematoma – ischaemic brain lesions – carotid endarterectomyThe authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Orlický 1,2; P. Vachata 1; P. Waldauf 3
; M. Sameš 1
Působiště autorů: Neurochirugická klinika UJEP a Masarykova nemocnice, o. z., Krajská zdravotní, a. s., Ústí nad Labem 1; Neurochirurgická klinika UNLP, Košice 2; Klinika anesteziologie a resuscitace FN Královské Vinohrady, Praha 3
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(4): 444-449
Kategorie: Původní práce
doi: https://doi.org/10.14735/amcsnn2018444Souhrn
Cieľ:
Vyhodnotiť vplyv antiagregancií a antikoagulancií na vznik perioperačných mozgových ischémií a hemoragických komplikácií pri karotickej endarterektómii (CEA).Metodika:
Pri 559 CEA bola ponechaná antitrombotická liečba indikovaná referujúcim lekárom. Štúdia sledovala vplyv antitrombotickej liečby na: 1. výskyt hematómu v rane; 2. výskyt symptomatickej intracerebrálnej hemoragie po CEA; 3. dĺžku hospitalizácie; 4. vznik nových ischemických lézií mozgu pri CEA.Výsledky:
Akýkoľvek hematóm v rane bol zistený v 43 (7,69 %) prípadoch. Z toho v skupine: 1. žiadne antitrombotikum v 2,94 %; 2. kyselina acetylsalicylová (ASA)/ ASA + deriváty v 5,18 % (p = 0,55); 3. klopidogrel v 18,36 % (p = 0,008); 4. tiklopidin 0 %; 5. low molecular weight heparin (LMWH) v 20 % (p = 0,022); 6. LMWH + ASA v 19,05 % (p = 0,026); 7. klopidogrel + ASA v 36,36 % (p = 0,003). Výskyt symptomatického intracerebrálneho hematómu po CEA bol v piatich prípadoch (0,89 %). Medián dĺžky hospitalizácie bez hematómu v rane bol 4,7 dní, s hematómom bez revízie 5,1 dní a s hematómom s revíziou 7,2 dní. Výskyt nových ischemických lézií mozgu po CEA bol v 10,91 %, nezávislý na antitrombotiku (p > 0,18).Záver:
Klopidogrel, LMWH a LMWH + ASA majú proti ASA cca 4× väčšie riziko hematómu v rane, duálna antiagregačná liečba 5,5× vyššie. Preto ich užívanie perioperačne je opodstatnené len u CEA pre symptomatické stenózy s rizikom včasnej recidívy príhody. Nie je rozdiel vo vplyve sledovaných antitrombotík na vznik nových ischemických lézií mozgu pri CEA.Kľúčové slová:
antiagregačná liečba – antikoagulačná liečba – hematómy v rane – ischemické lézie mozgu – karotická endarterektómiaÚvod
Protidoštičkové lieky sú hlavná skupina medikamentóznej sekundárnej prevencie pre všetky subtypy ischemických cievnych mozgových príhod (iCMP) s výnimkou kardioembolického. Skupina derivátov kyseliny acetylsalicylovej (ASA) samostatne či v kombinácii s dipyridamolom bola v roku 2006 doplnená o blokátor adenosín difosfát (ADP) doštičkových receptorov, derivát tienopyridinu, klopidogrel [1]. S vypršaním patentu v máji 2012 [2] a znížením ceny generík sa jeho užívanie plošne rozšírilo v neurologických a kardiologických indikáciách a do ambulancií neurochirurga či cievneho chirurga k naplánovaniu karotickej endarterektómie (CEA) prichádza stále viac pacientov užívajúcich klopidogrel samostatne alebo v kombinácii s vyššie uvedenými liekmi.
Pre CEA je antiagregačná príprava ASA či jej derivátmi chirurgami dlhodobo tolerovaná. Názory na užívanie iných antitrombotík perioperačne, hlavne z pohľadu rizika vzniku hemoragických komplikácii, nie sú jednotné [3,4] a často nesúhlasné s profylaktickým názorom indikujúceho neurológa. Na druhej strane benefit CEA je úmerný počtu komplikácií. Táto skutočnosť nás viedla k príprave štúdie, ktorej cieľom bolo vyhodnotiť vplyv rozdielnych antitrombotík na vznik hemoragických komplikácií u CEA a tiež posúdiť prípadný rozdielny benefit jednotlivých liekov na vznik perioperačných ischemických lézií mozgu pri tejto operácii. Vniesť takto do problematiky názor podložený výsledkom nemalej štúdie a tiež, možno, zbaviť konverzáciu neurológa a neurochirurga ďalšieho sporného bodu pokladáme za hlavný prínos tohto zdelenia.
Súbor a metodika
Celkom 559 CEA vykonaných na Neurochirurgickej klinike UJEP a Masarykovej nemocnice v Ústí nad Labem bolo zaradených do štúdie. Indikácie boli v súlade s aktuálnymi odporučeniami štúdií NACSET, ACST, ECST [5– 7]. U všetkých pacientov bola ponechaná vstupná antiagregačná liečba tak, ako bola indikovaná referujúcim neurológom či kardiológom. Antikoagulačná liečba warfarínom tolerovaná nebola, jej náhrada nízkomolekulárnym heparínom (low molecular weight heparin; LMWH) v preventívnej dávke pri INR do 1,5 v deň operácie áno. V prípade, že pacient neužíval žiadnu antiagregačnú liečbu, bola mu nasadená až prvý pooperačný deň. Všetky výkony prebiehali v regionálnej anestézii (blok cervikálneho plexu), priamou suturou a so selektívnym použitím karotického skratu podľa vývoja neurologického stavu hodnoteného v priebehu uzavretia karotídy svorkami (v postupnosti – arteria thyroidea superior, arteria carotis externa [ACE], arteria carotis communis [ACC] a arteria carotis interna [ACI]). Perioperačná antikoagulačná liečba heparínom sa riadila štandardizovaným protokolom pripraveným na základe výsledkov našej predchádzajúcej štúdie [8], oproti ktorej sa naviac zjednotilo dávkovanie heparínu na 5 000 IU u každého pacienta pred uzavretím cievy svorkami s monitoráciou vývoja koagulačných parametrov. Aplikácia protamínu na konci operácie nie je štandardná a v našom súbore nebola používaná. Pooperačné tri dávky 5 000 IU heparínu i.v. každá po 8 h a jedna profylaktická dávka LMWH (low molecular weight heparin) po ďalších 8 h boli podané u každého pacienta. Predoperačná antiagregačná liečba pokračovala trvale; predoperačná antikoagulačná liečba LMWH, pokiaľ bola naďalej indikovaná, pokračovala pooperačne v profylaktickej dávke s odporučením návratu k warfarínu po 14 dňoch od operácie [9]. MR mozgu (v sekvenciách T2, difúziou vážených [DW] b0, b500, b1000, aparentný difúzny koeficient [ADC]) podstúpil každý pacient približne 24 h pred výkonom a po ňom [10]. V súlade s predchádzajúcimi štúdiami [11,12] boli nové ischemické lézie na mozgu definované ako hyperintenzívne oblasti v sekvencii DW b1000 diagnostikované po intervencii, ktoré neboli prítomné na snímkach pred liečbou. Objem bol vypočítaný ako celková plocha hyperintenzity v každom jednotlivom reze vynásobená efektívnou hrúbkou rezu. Pooperačné rozšírenie už prítomnej lézie v DW obraze sa nepovažovalo za novú ischemickú léziu. Nové ischemické lézie v mozgu boli klasifikované podľa klasifikácie Szabo [13]. V stručnosti, typ I zodpovedá plošnému infarktu (veľká lézia postihujúca kôru), typ II subkortikálnemu infarktu (subkortikálna lézia s ďalšími menšími léziami alebo bez nich), typ III infarktu teritoriálnemu s fragmentáciou (veľká lézia zahŕňajúca kôru s ďalšími menšími léziami), typ IV je definovaný niekoľkými roztrúsenými malými léziami a typ V infarktu hraničnej zóny (malé lézie v hemodynamických rizikových zónach). Pri deteriorácii neurologického stavu pooperačne bolo u každého pacienta indikované natívne CT vyšetrenie mozgu a CTA vyšetrenie krčných a intrakraniálnych ciev.
V aktuálnej štúdii boli sledované tieto parametre:
- vplyv antitrombotickej liečby na výskyt hematómu v rane:
- a) bez nutnosti revízie,
- b) s nutnosťou revízie;
- vplyv antitrombotickej liečby na výskyt intracerebrálneho symptomatického hematómu;
- dĺžka hospitalizácie s hematómom s komplikovaným a nekomplikovaným priebehom;
- vplyv antitrombotickej liečby na výskyt nových perioperačných mozgových ischémií – detekovaných MR DW mozgu.
Ako hematóm v rane bola hodnotená prítomnosť krvi v podkoží a/ alebo v operačnom prístupe, posudzovaná a zaznamenaná ošetrujúcim lekárom. Hematómy akútne z ruptúry sutury cievy neboli do tejto štúdie zaradené.
Grafické vyšetrenia boli hodnotené nezávislým radiológom.
Štúdia bola retrospektívnym vyhodnotením prospektívne vedenej databáze. Dáta boli vyhodnotené štatisticky využitím Fisherovho priameho exaktného testu. Na spracovanie bol použitý program IBM SPSS Statistics v22.0 (IBM Corp., Chicago, IL, USA).
Výsledky
Zo 559 operovaných CEA bolo 239 (43 %) prípadov pre symptomatickú stenózu, 320 (57 %) prípadov pre asymptomatickú.
Podľa antiagregačnej a/ alebo antikoagulačnej liečby, ktorú pacienti užívali, sme získali skupiny uvedené v tab. 1. Skupinu ASA a jej derivátov sme z praktického pohľadu, vysvetleného v časti diskusia, viedli ako jednu skupinu, skupinu tiklopidin a klopidogrel, deriváty tienopyridinu, sme vzhľadom k zameraniu článku rozlíšili. Skupina LMWH zahŕňa všetky typy v ČR užívaných prípravkov. Posledné dve skupiny sú kombináciou predchádzajúcich.
Tab. 1. Počet prípadov podľa užívaného antiagregačného/antikoagulačného lieku. 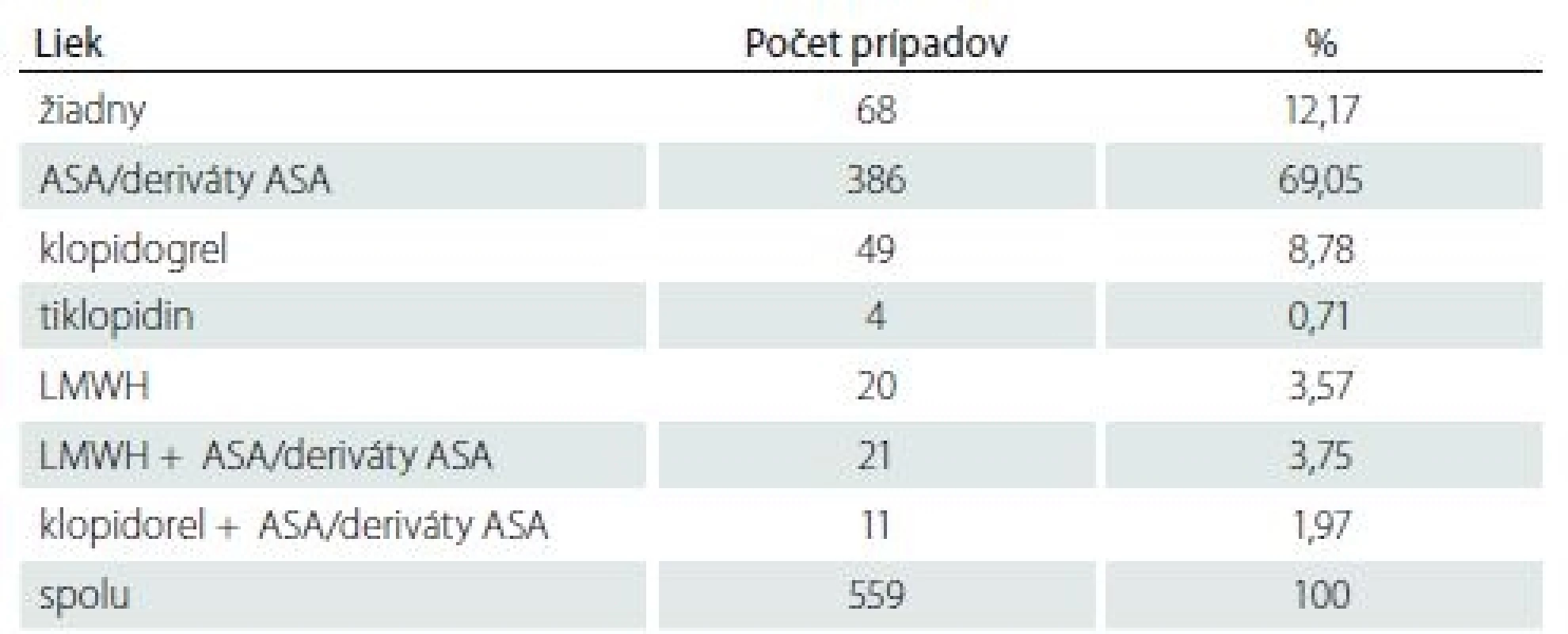
ASA – kyselina acetylsalicylová; LMHW – nízkomolekulárny heparín Ad 1) Výskyt akéhokoľvek hematómu v rane nebol častou komplikáciou, a bol zistený v 43 (7,69 %) prípadoch. Počet hematómov indikovaných k revízii bol nízky, v 13 prípadoch (2,32 %) (tab. 2, obr. 1).
Tab. 2. Počet hematómov v rane v jednotlivých skupinách a štatistické hodnotenie. 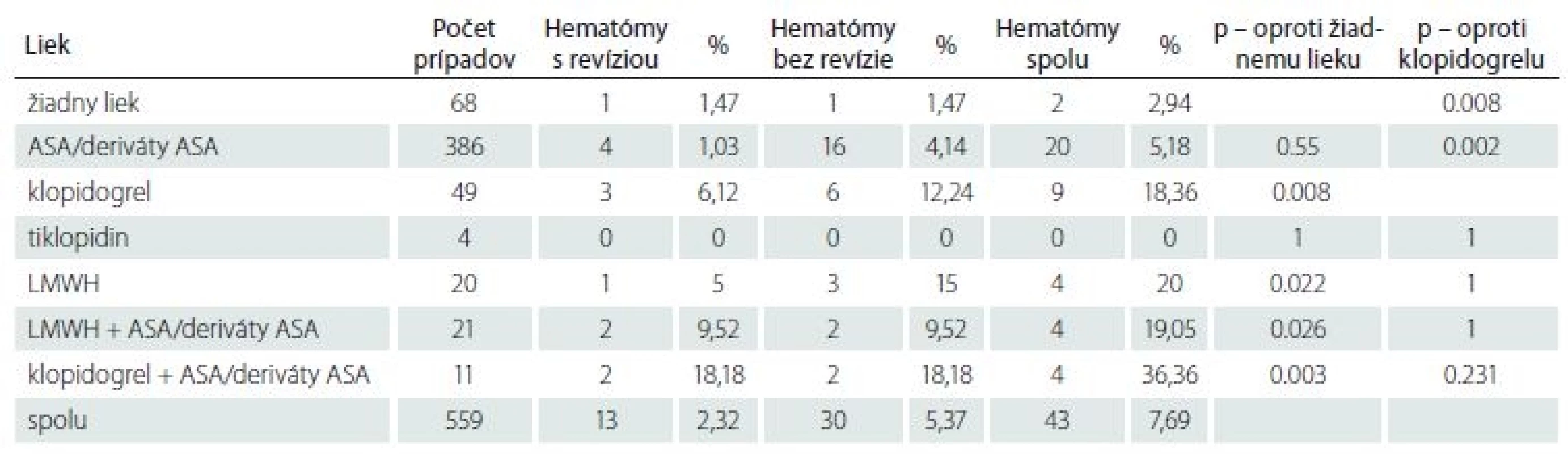
ASA – kyselina acetylsalicylová; LMHW – nízkomolekulárny heparín Obr. 1. Zastúpenie prípadov karotickej endarterektómie s hematómom v rane a bez, n = 559.
Fig. 1. Number of carotid endarterectomy cases with/without wound hematoma, n = 559.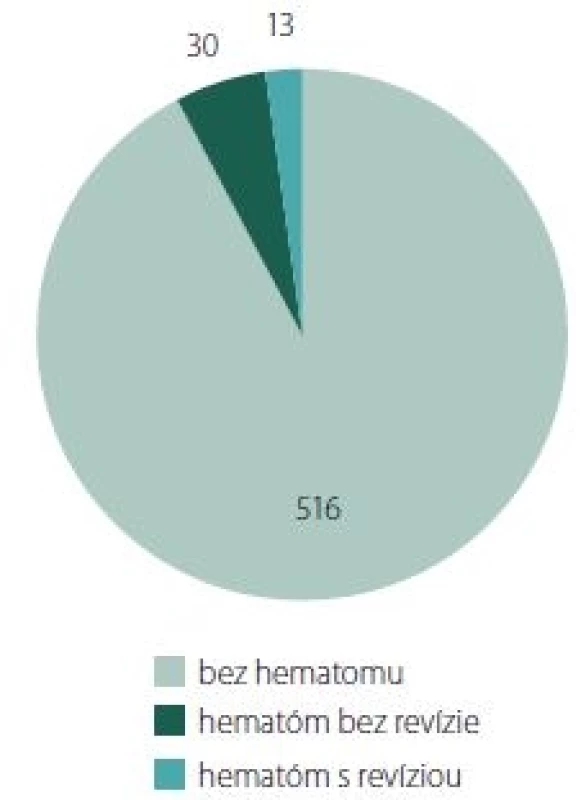
Zaujímavejšie bolo relatívne zastúpenie hematómov v rane vyjadrené pre jednotlivé skupiny liekov. Očakávane, v skupine pacientov, ktorí neužívali predoperačne žiaden antitrombotický liek, bol výskyt hematómov najnižší, v necelých 3 %. V skupine najčastejšie používanej antiagregačnej liečby ASA, resp. jej derivátmi bol výskyt hematómov tiež nízky, spolu len v 5,18 % a revidovaných len v 1 % prípadov. Rozdiely v týchto dvoch skupinách neboli štatisticky významné (p = 0,55).
Klopidogrel nás prekvapil relatívne vyšším počtom hematómov – v 18,37 % prípadoch; v 6 % bola nutná operačná revízia.
Podobný výsledok mala i skupina pacientov užívajúcich LMWH; v 20 % prípadoch sme zaznamenali hematóm v rane, revidovali sme v 5 %. Výsledky sa nelíšili ani pre skupinu LMWH v kombinácii s ASA, resp. jej derivátmi: 19,05 % hematómov v rane, necelých 10 % revidovaných. Najnepriaznivejší výsledok mala skupina duálnej antiagregačnej terapie. Z 11 prípadov s touto kombináciou liekov sme hematóm zaznamenali až u štyroch pacientov, čo je 36,36 %, a revidovali polovicu prípadov. U všetkých týchto výsledkov sme preukázali štatistickú významnosť s minimálnom p = 0,05 v porovnaní so skupinou bez antitrombotickej liečby. Na druhej strane častejší výskyt hematómu v rane v skupine klopidogrelu s ASA v porovnaní s klopidogrelom samotným je pre nízky počet prípadov štatisticky nepreukázateľný a môžeme tak hodnotiť len trend (tab. 2).
Ad 2) Akákoľvek deteriorácia neurologického stavu pooperačne indikovala prevedenie natívneho CT mozgu a CTA karotíd a mozgu. Intracerebrálny hematóm bol prítomný v piatich prípadoch (0,89 %). Štyri prípady boli v skupine ASA a jej derivátov, jeden v prípade LMWH. Použitím štatistických metód (univariantná a následná multivariantná regresná analýza) sa nepodarilo preukázať závislosť vzniku hematómu k užívanému lieku, resp. iným sledovaným faktorom; ich etiológia je však určite multifaktorialna a venujeme sa jej v diskusii.
Ad 3) Medián dĺžky pooperačnej hospitalizácie pre všetky prípady bez komplikácie hematómom v rane bol 4,7 dní. Pre prípady s hematómom bez revízie 5,1 dní a s hematómom s revíziou sa predĺžil na 7,2 dňa.
Ad 4) K overeniu vzťahu antitrombotickej liečby ku vzniku nových ischemických lézií mozgu perioperačne u CEA sme využívali výsledky vyšetrenia MR DW. Počet nových ischemických lézií zistených na pooperačnej MR DW mozgu bol vo všetkých skupinách vrátane skupiny bez antitrombotickej liečby v rozmedzí 9– 14 %, výraznejšie sa líšil len v skupine LMWH, 25 %. Tieto rozdiely sú štatisticky nesignifikantné. Podrobné výsledky sú uvedené v tab. 3.
Tab. 3. Počet nových ischemických lézii na MR DW v jednotlivých skupinách a štatistické hodnotenie. 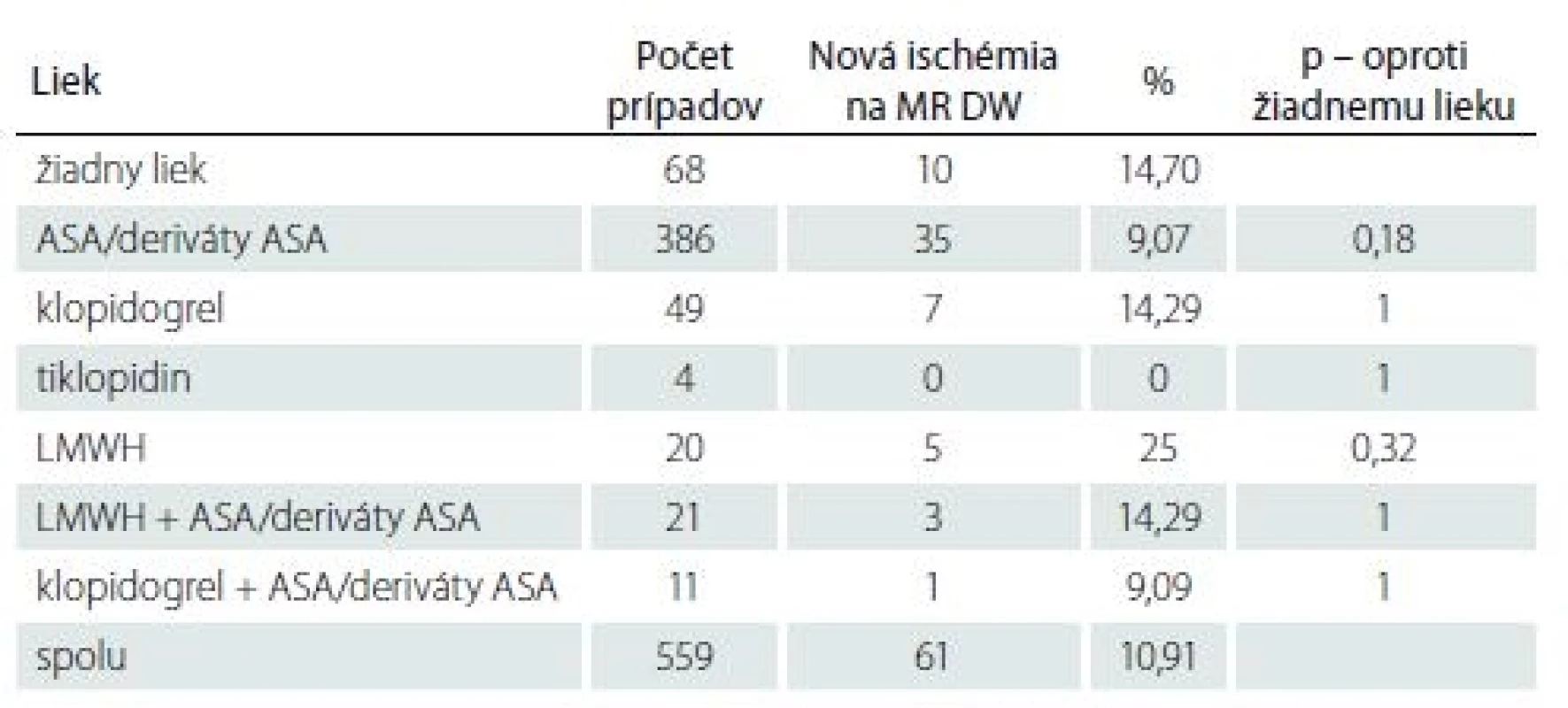
ASA – kyselina acetylsalicylová; DW – difúziou vážený; LMHW – nízkomolekulárny heparín Diskusia
Antiagregačná liečba znížením zhlukovania trombocytov pôsobí protektívne v primárnej i sekundárnej prevencii iCMP, zároveň zvyšuje riziko krvácania pri operáciách všeobecne, CEA nevynímajúc. Antiagregačný efekt jednotlivých podskupín prípravkov tejto širokej skupine sa líši dĺžkou trvania a silou účinku a odvíja sa od farmakokinetiky konkrétneho lieku. Najčastejšie používaná skupina ASA a jej derivátov blokáciou enzýmu cyklooxygenázy I a II, inhibuje v doštičkách tvorbu tromboxanov, a bráni tak ich zhlukovaniu [14]. Tento efekt je ireverzibilný a pretrváva po celu dobu života doštičky (8– 9 dní) [15]. V priemerne užívanej dávke 100 mg/ d znižuje podľa rôznych štúdií relatívne riziko recidívy iCMP o 13– 25 % [16– 18]. Dypiridamol v kombinovanej liečbe (napr. v lieku Aggrenox, Boehringer Ingelheim International GmbH, Ingelheim am Rhein, Nemecko) blokáciou fosfodiesterázy doštičiek a inhibíciou absorpcie adenosínu potencuje efekt kyseliny acetylsalicylovej, znižuje riziko recidívy iCMP o ďalších 10– 12 % [19] a nezvyšuje však riziko krvácania v porovnaní s ASA [20]. Z tohto dôvodu sme tieto lieky zaradili v našej štúdii do rovnakej skupiny.
Tiklopidin a klopidogrel sú lieky zo skupiny derivátov tienopyridinu. Antiagregačný efekt je daný ireverzibilnou blokáciou receptoru ADP a zabranením napojenia fibrínu na krvnú doštičku po celú dobu jej života [1]. Zníženie relatívneho rizika recidívy iCMP sa udáva u oboch prípravkov až 30 % a dávka klopidogrelu 75 mg/ d sa javí bezpečnejšia ako dávka 2 × 250 mg tiklopidinu pre dosiahnutie rovnaného efektu [21,22]. Pre tento argument sme v našom hodnotení tieto dva lieky posudzovali samostatne.
Antikoagulačná liečba je najčastejšie indikovaná u fibrilácie siení, náhradách chlopní či iných tromboembolických príhodách v anamnéze. Pre pripomenutie, nízkomolekulárny heparín blokádou faktoru Xa inhibuje aktiváciu trombínu a blokuje koagulačnú kaskádu. U pacientov užívajúcich warfarín bola predoperačne nevyhnutá korekcia INR pod hodnotu 1,5 (vrátane) a náhrada lieku LMWH, aplikovaným najneskôr 12 h pred výkonom. Dávka a frekvencia subkutánneho užívania bola indikovaná interným lekárom pred príjmom na naše oddelenie. Títo pacienti tvorili v štúdii jednu skupinu. Samostatne sme tiež odlíšili skupinu pacientov, kde neurológ či interný lekár indikoval predoperačne kombináciu LMWH a ASA.
Hematóm v rane
Než sa vrátime späť k hodnoteniu počtu krvácavých komplikácií v jednotlivých skupinách, musíme si uvedomiť význam vzťahov jednotlivých faktorov. Antiagregačná či antikoagulačná liečba má hlavný prínos v sekundárnej prevencii recidívy iCMP [23], ktorý sa dá kvantifikovať napr. relatívnym rizikom recidívy iktu pre jednotlivé lieky, spomínanom v predchádzajúcich odstavcoch. Naviac, keď Rothwell et al v roku 2005 publikovali výsledky metaanalýzy, kde kvantifikovali riziko recidívy iCMP po prekonanej tranzitórnej ischemickej atake na 17 % v 0. deň s kumulatívnym rizikom 43 % do 14. dňa, posunula sa operatíva symptomatických karotických stenóz do prvých dní po príhode [24– 27]. V našej štúdii získané riziká vzniku hematómov ako operačných komplikácií musíme teda hodnotiť vo vzťahu k týmto faktorom. Zároveň si musíme uvedomiť, že i prítomnosť hematómu v rane, ak nevyžaduje operačnú revíziu, nemôžeme konfrontovať s benefitom časnej operácie z pohľadu prevencie iktu. Naopak, nutnosťou operačnej revízie pre hematóm sa už tento benefit stráca.
Najmenšie riziko vzniku pooperačného hematómu v rane mala skupina pacientov neužívajúcich žiadnu antitrombotickú liečbu (2,94 %). Len málo vyššie riziko bolo u skupiny užívajúcej ASA a jej deriváty (5,1 %). Takto nízke riziko (revidovaných i nerevidovaných hematómov) plne vykompenzuje kumulatívne riziko recidívy iktu, ktoré by hrozilo pri vyčkávaní na odoznenie antiagregačného účinku tohto lieku. Naviac je stále tak nízke, že môže byť tolerované i pre operácie asymptomatických stenóz karotíd.
Na druhej strane, zistili sme, že riziko vzniku hematómu pri užívaní klopidogrelu je približne 4× vyššie než v predchádzajúcej skupine, 18,37 %. Využitím rovnakej stratégie uvažovania vidíme, že i táto hodnota má dôvod byť akceptovaná v indikáciách CEA u symptomatických stenóz karotíd, kde zníženie recidívy iktu nečakaním na odoznenie účinku klopidogrelu určite ospravedlní relatívne vyššie riziko vzniku hematómu v rane, a to i pre prípad nutnosti operačnej revízie, kde musíme pripočítať operačné riziko ďalšej operácie [27]. Na rozdiel od predchádzajúcej skupiny takto vysoké riziko pochopiteľne už nemôže byť tolerované u CEA pre asymptomatické stenózy – vysadenie a nahradenie derivátom ASA je žiadúce.
Podobné hodnotenie môžeme použiť i pre ďalšie skupiny pacientov užívajúcich LMWH a LMWH v kombinácii s ASA a jej derivátmi, však s jedným rozdielom. S celkovým rizikom vzniku hematómu 20 %, resp. 19,04 % je opodstatnená indikácia pre CEA pre symptomatickú stenózu. Pre CEA pre asymptomatickú stenózu je stále nutná rozvaha. Pokiaľ je LMWH nasadená ako profylaxia tromboembolických príhod (kardiálnych, pľúcnych a iných) pri inak chronickej terapii warfarínom, je potrebné zvážiť riziko týchto príhod a korelovať s popísaným rizikom vzniku hematómu. V ostatných situáciách je indikácia tejto terapie neopodstatnená [28].
Posledná skupina klopidogrelu v kombinovanej terapii s ASA či jej derivátom má vysoké riziko hematómu ako s nutnosťou revízie, tak i bez. Pokiaľ je indikácia tejto duálnej terapie správna, má operácia CEA opodstatnenie len v prípade symptomatickej stenózy. Na druhú stranu, v tejto situácii je vhodné zvážiť i riešenie stenózy stentom. Pre operáciu asymptomatických stenóz nie je táto kombinácia vhodná.
Dĺžka hospitalizácie
Hodnotení dĺžky hospitalizácie v závislosti na prítomnosti hematómu v rane ukázalo asi očakávane vzťahy. Medián dĺžky hospitalizácie v skupine pacientov bez komplikácie hematómom bol 4,7 dní. V skupine hematómov bez revízie len menšina pacientov vyžaduje predlženie hospitalizácie, čo sa prejavilo len neveľkým posunom mediánu k 5,1 dňom. Nutnosť revízie pre hematóm očakávane predĺži hospitalizáciu približne o 2 dni, na medián 7,2 dňa. Musíme pripomenúť, že i podiel iných komplikácií v priebehu hospitalizácie ovplyvňoval tieto výpočty.
Výskyt intracerebrálneho hematómu
Incidencia vzniku intracerebrálneho hematómu po CEA sa v literatúre uvádza od 0,016 až k 1 % [29– 31]. V našej štúdii sme zaznamenali 5 prípadov (0,89 %), symptomatických. Riziko ich vzniku vo vzťahu k antiagregačnej či antikoagulačnej liečbe, resp. k ďalším sledovaným faktorom (arteriálna hypertenzia, diabetes mellitus, vek, pohlavie, miera stenózy, symptomatičnosť stenózy, časovanie operácie od príhody, atď.) sa použitím štatistických metód (univariantná a následná multivariantná regresná analýza) nepodarilo preukázať vzhľadom k ich nízkemu počtu v štúdii. Však môžeme predpokladať, že závislosť vzniku intracerebrálneho hematómu po CEA je určite multifaktorialna. Významné faktory ako hyperperfúzny syndróm [32,33], prítomnosť ischemického ložiska predoperačne [34] či časový faktor jeho vzniku a operácie [35,36] – tieto všetky a určite i ďalšie majú vplyv na získaný výsledok.
Vzťah antitrombotickej liečby na výskyt nových perioperačných mozgových ischémií
Nové klinicky manifestné ischemické léziemozgu vznikajú pri CEA v 2– 4 % prípadov [37,38], grafické, klinicky nemé až v 6– 34 % [39,40]. Z našich získaných výsledkov vyplýva, že rozdielny antiagregačný či antikoagulačný efekt jednotlivých liekov nemá protektívny vplyv na vznik nových ischemických lézií mozgu perioperačne (tab. 3). Je možné preto predpokladať, že nie embolizácia koagul či zhlukov trombocytov, ale detritus plátu, poškodenej cievnej steny, resp. hypoperfúzia sú hlavné zdroje nových ischemických lézií pri CEA, viditeľných na MR DW mozgu [10].
Na záver musíme priznať slabú stránku štúdie, a to subjektívnosť hodnotenia prítomnosti hematómu v rane ošetrujúcim lekárom. Presnejšia metóda ultrazvukovým vyšetrením narazila na personálnu dostupnosť školeného špecialistu a interpersonálne odchýlky. Meranie obvodu krku pred výkonom a po výkone neprinieslo benefit v interpretácii prítomnosti hematómu. Preto bola zvolená z chirurgického pohľadu jednoduchá metóda – klinické hodnotenie prítomnosti hematómu v rane bez ďalších parametrov s cieľom minimalizovať narastanie chybovosti.
Záver
Riziko vzniku hematómu v rane je u pacientov bez antitrombotickej terapie nízke. Pri terapii ASA a jej derivátov je riziko taktiež nízke a nevyžaduje ich vysadenie v perioperačnom období CEA. Klopidogrel zvyšuje riziko hematómu v rane skoro 4násobne proti predchádzajúcej skupine, preto ho pre operácie asymptomatických stenóz karotíd doporučujeme včas predoperačne vysadiť a nahradiť derivátom ASA; symptomatické stenózy doporučujme operovať včasne, bez vysadzovania klopidogrelu. Tolerancia užívania LMWH, prípadne v kombinácii s ASA pri CEA je tiež doporučená pre symptomatické stenózy; v asymptomatických prípadoch je nutné posúdiť riziko tromboembolických komplikácií pri ich vysadení na strane jednej a riziko hematómu na strane druhej. Duálnu antiagregačnú liečbu môžeme akceptovať opäť len v symptomatických prípadoch. Rôzne typy antitrombotickej liečby neovplyvňujú riziko vzniku perioperačných ischemických lézií mozgu v priebehu CEA.
Práca bola podporená grantom Krajské zdravotní, a.s., Ústí nad Labem IGA-KZ-2016-1-20.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 26. 11. 2017
Přijato do tisku: 13. 4. 2018
MUDr. Michal Orlický
Neurochirurgická klinika UJEP
Masarykova nemocnice o.z.
Krajská zdravotní, a.s.
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: orlicky@gmail.com
Zdroje
1. Liu Q, Dang DS, Chen YF et al. The influence of omeprazole on platelet inhibition of clopidogrel in various CYP2C19 mutant alleles. Genet Test Mol Biomarkers 2012; 16(11): 1293 – 1297. doi: 10.1089/ gtmb.2012.0119.
2. Duck B. FDA gives plavix a 6 month extension-patent now expires on may 17 2012-in Europe patent expired in 2009. [online]. Available from URL: http:/ / ducknetweb.blogspot.com/ 2011/ 01/ fda-gives-plavix-6-month-extension.html.
3. Fleming MD, Stone WM, Scott P et al. Safety of carotid endarterectomy in patients concurrently on clopidogrel. Ann Vasc Surg 2009; 23(5): 612 – 615. doi: 10.1016/ j.avsg.2009.06.004.
4. Wait SD, Abla AA, Killory BD et al. Safety of carotid endarterectomy while on clopidogrel (Plavix). Clinical article. J Neurosurg 2010; 113(4): 908 – 912. doi: 10.3171/ 2009.12.JNS09707.
5. Ferguson GG, Eliasziw M, Barr HW et al. The North American Symptomatic Carotid Endarterectomy Trial: surgical results in 1415 patients. Stroke 1999; 30(9): 1751 – 1758.
6. Halliday A, Harrison M, Hayter E et al. 10-year stroke prevention after successful carotid endarterectomy for asymptomatic stenosis (ACST-1): a multicentre randomised trial. The Lancet 2010; 376(9746): 1074 – 1084. doi: 10.1016/ S0140-6736(10)61197-X.
7. European Carotid Surgery Trialists‘ Collaborative Group. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). The Lancet 1998; 351(9113): 1379 – 1387.
8. Sameš M, Provazníková E, Cihlář F et al. Perisurgical monitoring of activated coagulation time in carotid endarterectomy. Cesk Slov Neurol N 2011; 74/ 107(3): 325 – 329.
9. Loftus CM (ed). Anticoagulation and hemostasis in neurosurgery. Basel: Springer 2016.
10. Orlický M, Vachata P, Bartoš R et al. Skrat u karotických endarterektomií zvyšuje riziko ischemického iktu. Cesk Slov Neurol N 2015; 78/ 111(2): 163 – 166. doi: 10.14735/ amcsnn2015163.
11. Bonati LH, Jongen LM, Haller S et al. New ischaemic brain lesions on MRI after stenting or endarterectomy for symptomatic carotid stenosis: a substudy of the International Carotid Stenting Study (ICSS). Lancet Neurol 2010; 9(4): 353 – 362. doi: 10.1016/ S1474-4422(10)70057-0.
12. Lacroix V, Hammer F, Astarci P et al. Ischemic cerebral lesions after carotid surgery and carotid stenting. Eur J Vasc Endovasc Surg 2007; 33(4): 430 – 435. doi: 10.1016/ j.ejvs.2006.11.012.
13. Szabo K, Kern R, Gass A et al. Acute stroke patterns in patients with internal carotid artery disease a diffusion--weighted magnetic resonance imaging study. Stroke 2001; 32(6): 1323 – 1329.
14. AHFS DI Essentials. Drugs.com: Aspirin. [online]. Available from URL: https:/ / www.drugs.com/ monograph/ aspirin.html.
15. Catella F, Healy D, Lawson JA et al. 11-Dehydrothromboxane B2: a quantitative index of thromboxane A2 formation in the human circulation. Proc Natl Acad Sci U S A 1986; 83(16): 5861 – 5865.
16. Gouya G, Arrich J, Wolzt M et al. Antiplatelet treatment for prevention of cerebrovascular events in patients with vascular diseases: a systematic review and meta-analysis. Stroke 2014; 45(2): 492 – 503. doi: 10.1161/ STROKEAHA.113.002590.
17. Diener HC, Bogousslavsky J, Brass LM et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo-controlled trial. Lancet 2004; 364(9431): 331 – 337. doi: 10.1016/ S0140-6736(04)16721-4.
18. Šaňák D, Neumann J, Tomek A et al. Guidelines for recanalization therapy of acute cerebral infarction – version 2016. Cesk Slov Neurol N 2016; 79/ 112(2): 231 – 234.
19. European Stroke Initiative Executive Committee, EUSI Writing Committee, Olsen TS et al. European stroke initiative recommendations for stroke management-update 2003. Cerebrovasc Dis 2003; 16(4): 311 – 337. doi: 10.1159/ 000072554.
20. Brown DG, Wilkerson EC, Love WE. A review of traditional and novel oral anticoagulant and antiplatelet therapy for dermatologists and dermatologic surgeons. J Am Acad Dermatol 2015; 72(3): 524 – 534. doi: 10.1016/ j.jaad.2014.10.027.
21. Kalita Z. Akutní cévní mozkové příhody: diagnostika, patofyziologie, management. Praha: Maxdorf 2006 : 423 – 434.
22. Hankey GJ, Sudlow CL, Dunbabin DW. Thienopyridine derivatives (ticlopidine, clopidogrel) versus aspirin for preventing stroke and other serious vascular events in high vascular risk patients. Cochrane Database Syst Rev 2000; (2): CD001246.
23. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016; 79/ 112(3): 351 – 363. doi: 10.14735/ amcsnn2016351.
24. Rothwell PM, Warlow CP. Timing of TIAs preceding stroke: time window for prevention is very short. Neurology 2005; 64(5): 817 – 820. doi: 10.1212/ 01.WNL.0000152985.32732.EE.
25. Orlický M, Vachata P, Sameš M. Results of early endarterectomies after transient ischaemic attack. Cesk Slov Neurol N 2015; 78/ 111(5): 550 – 554. doi: 10.14735/ amcsnn2015550.
26. Mraček J, Holečková I, Mork J et al. Timing karotické endarterektomie. Cesk Slov Neurol N 2008; 104(4)(71): 414 – 421.
27. Sacco RL, Adams R, Albers G et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack: a statement for healthcare professionals from the American Heart Association/ American Stroke Association Council on Stroke: co-sponsored by the Council on Cardiovascular Radiology and Intervention: the American Academy of Neurology affirms the value of this guideline. Circulation 2006; 113(10): e409 – 449.
28. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Members AF, Steg PG et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33(20): 2569 – 2619. doi: 10.1093/ eurheartj/ ehs215.
29. Timaran CH, Veith FJ, Rosero EB et al. Intracranial hemorrhage after carotid endarterectomy and carotid stenting in the United States in 2005. J Vasc Surg 2009; 49(3): 623 – 628. doi: 10.1016/ j.jvs.2008.09.064.
30. Henderson RD, Phan TG, Piepgras DG et al. Mechanisms of intracerebral hemorrhage after carotid endarterectomy. J Neurosurg 2001; 95(6): 964 – 969. doi: 10.3171/ jns.2001.95.6.0964.
31. Moulakakis KG, Mylonas SN, Sfyroeras GS et al. Hyperperfusion syndrome after carotid revascularization. J Vasc Surg 2009; 49(4): 1060 – 1068. doi: 10.1016/ j.jvs.2008.11.026.
32. Ogasawara K, Sakai N, Kuroiwa T et al. Intracranial hemorrhage associated with cerebral hyperperfusion syndrome following carotid endarterectomy and carotid artery stenting: retrospective review of 4494 patients. J Neurosurg 2007; 107(6): 1130 – 1136. doi: 10.3171/ JNS-07/ 12/ 1130.
33. Wang GJ, Beck AW, DeMartino RR et al. Insight into the cerebral hyperperfusion syndrome following carotid endarterectomy from the national Vascular Quality Initiative. [abstrakt]. J Vasc Surg 2016; 81 (2 Suppl) 29S – 36S: e1 – e2. doi: 10.1016/ j.jvs.2015.10.004.
34. Yaghi S, Eisenberger A, Willey JZ. Symptomatic intracerebral hemorrhage in acute ischemic stroke after thrombolysis with intravenous recombinant tissue plasminogen activator: a review of natural history and treatment. JAMA Neurol 2014; 71(9): 1181 – 1185. doi: 10.1001/ jamaneurol.2014.1210.
35. Kang BK, Na DG, Ryoo JW et al. Diffusion--weighted MR imaging of intracerebral hemorrhage. Korean J Radiol 2001; 2(4): 183 – 191.
36. Linfante I, Llinas RH, Caplan LR et al. MRI features of intracerebral hemorrhage within 2 hours from symptom onset. Stroke 1999; 30(11): 2263 – 2267.
37. Ricotta JJ, Aburahma A, Ascher E et al. Updated Society for Vascular Surgery guidelines for management of extracranial carotid disease. J Vasc Surg 2011; 54(3): e1 – e31. doi: 10.1016/ j.jvs.2011.07.031.
38. Ederle J, Dobson J , Featherstone RL et al. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study): an interim analysis of a randomised controlled trial. Lancet 2010; 375(9719): 985 – 997. doi: 10.1016/ S0140-6736(10)60239-5.
39. Brott TG, Hobson RW, Howard G et al. Stenting versus endarterectomy for treatment of carotid - artery stenosis. N Engl J Med 2010; 363(1): 11 – 23. doi: 10.1056/ NEJMoa0912321.
40. Školoudík D, Kuliha M, Hrbáč T et al. Sonolysis in prevention of brain infarction during carotid endarterectomy and stenting (SONOBUSTER): a randomized, controlled trial. Eur Heart J 2016; 37(40): 3096 – 3102. doi: 10.1093/ eurheartj/ ehv492
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek EditorialČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANOČlánek Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2018 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Editorial
- Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - ANO
- Agresivní léčba intracerebrální hemoragie se snižováním krevního tlaku a indikací operace - NE
- Agresívna liečba intracerebrálnej hemoragie so znižovaním krvného tlaku a indikáciou operácie
- Léčba cílená na B lymfocyty – významný pokrok v léčbě roztroušené sklerózy
- Biomarkery progrese onemocnění a prognózy u pacientů s roztroušenou sklerózou
- Možnosti regulace neuroimunitních a neuroendokrinních dějů pomocí fyzioterapie
- Parietální atrofický skór na magnetické rezonanci mozku u normálně stárnoucích osob
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Rozdíly v klinických, radiologických a léčebných modalitách intramedulárních arachnoidálních cyst a syringomyelie v oblasti krční páteře – 12 případů
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Vzťah medzi intenzitou tinnitu a mierou senzorineurálnej straty sluchu z aspektu prínosu hyperbarickej oxygenoterapie
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Skoré pooperačné komplikácie po plánovaných operáciách degenerovanej driekovej chrbtice u starších pacientov
- Srovnání účinnosti subkutánně podávaného interferonu β-1a 44 μg, dimetyl fumarátu a fingolimodu v reálné klinické praxi – multicentrická observační studie
- Soubor obrázků s protikladnou náročností pojmenovatelnosti
- Faryngo-cerviko-brachiální varianta Guillain-Barrého syndromu
- Bradykininem indukovaný angioedém po podání tkáňového aktivátoru plazminogenu u akutní cévní mozkové příhody – terapie s nebo bez inhibitoru C1 esterázy
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
- Analýza dat v neurologii - LXX. Kovariance
- Výroční setkání věnované novinkám v léčbě roztroušené sklerózy
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



