-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neurologické syndromy sdružené s protilátkami proti membránovým a synaptickým antigenům
Neurological Syndromes Associated with Antibodies against Neuronal Surface Antigens
Background:
Neuronal surface antibodies are associated with numerous neurological symptoms. Better knowledge of these symptoms may improve identification of potential candidates for immunotherapy.Aim:
Characterize clinical signs in patients with neuronal surface antibodies positivity.Methods:
We detected neuronal surface antibodies in 11/2011–12/2013 in 224 patients (224 in serum and 37 in cerebrospinal fluid). We investigated anti-NMDAR, anti-AMPAR1, anti-AMPAR2, anti-GABABR, anti-LGI1, anti-CASPR2 using cell-based assays for indirect immunofluorescence (Euroimmun AG). We retrospectively analyzed clinical characteristics of patients with positive neuronal surface antibodies in serum or cerebrospinal fluid other than anti-NMDAR positive patients.Results:
Neuronal surface antibodies were detected in 11 patients (seven males, median age 58). Six patients had anti-LGI1, four anti-CASPR2 and two anti-AMPAR1 antibodies (one patient had both anti-CASPR2 and anti-AMPAR1 antibodies). Clinical symptoms included chronic epilepsy (n = 5), acute encephalopathy (n = 5) accompanied by epileptic seizures in four patients and one patient presented with cerebellar syndrome and cognitive deficit. Two patients had coincidence of paraneoplastic antibodies (anti-Hu, anti-Ma2). Tumor (small cell lung carcinoma) was diagnosed in one patient (anti-AMPAR1). Eight patients improved following immunotherapy (corticosteroids, IVIG). Early immunotherapy was associated with better outcome.Conclusion:
NS-Abs were mostly associated with limbic encephalitis and chronic temporal lobe epilepsy. Immunotherapy had better effect when applied early in the disease course.Key words:
autoimmune diseases – encephalitis – antibodies to cell-surface proteins – limbic encephalitis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Elišák 1; D. Krýsl 1,2; J. Hanzalová 1,3; I. Gažová 1; I. Doležalová 4,5
; J. Slonková 6; P. Marusič 1
Působiště autorů: Neurologická klinika 2. LF UK a FN Motol, Praha 1; Klinisk Neurofysiologi, Sahlgrenska Universitetssjukhuset, Göteborg, Švédsko 2; Ústav imunologie, 2. LF UK a FN Motol, Praha 3; Centrum pro epilepsie Brno, I. neurologická klinika LF MU a FN u sv. Anny v Brně 4; CEITEC – Středoevropský technologický institut, MU, Brno 5; Neurologická klinika LF OU a FN Ostrava 6
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(4): 453-458
Kategorie: Krátké sdělení
doi: https://doi.org/10.14735/amcsnn2015453Souhrn
Úvod:
Protilátky proti membránovým a synaptickým antigenům jsou přímo patogenní protilátky sdružené s pestrou paletou neurologických syndromů. Různorodost příznaků komplikuje stanovení diagnózy, a tím i včasné zahájení imunoterapie.Cíl:
Cílem práce bylo popsat klinické charakteristiky pacientů s pozitivitou uvedených protilátek.Metodika a soubor:
V období dvou let jsme zjišťovali přítomnost protilátek proti membránovým a synaptickým antigenům u 224 pacientů. Metodou nepřímé imunofluorescence byly vyšetřeny protilátky proti N ‑ metyl ‑ D ‑ aspartátovému receptoru (anti‑NMDAR), α ‑ amino ‑ 3 - hydroxy ‑ 5 - metyl ‑ 4 - izoxazolepropionátovému receptoru (anti‑AMPAR 1 a 2), B ‑ receptoru kyseliny γ ‑ aminomáselné (anti‑GABABR), proti leucin‑rich ‑ glioma ‑ inactivated proteinu ‑ 1 (anti‑LGI1) a proti contactin‑associated proteinu ‑ 2 (anti‑CASPR2). U pozitivních pacientů byly retrospektivně zhodnoceny klinické projevy, nálezy pomocných metod a vývoj onemocnění. Pacienti s pozitivitou anti‑NMDAR protilátek nebyli do hodnocení zahrnuti.Výsledky:
Autoprotilátky byly prokázány v séru 11 pacientů (medián 58 let, sedm mužů) – u šesti pacientů anti‑LGI1, u čtyř anti‑CASPR2, u dvou anti‑AMPAR1 (u jednoho pacienta současně anti‑AMPAR1 a anti‑CASPR2). Příznaky zahrnovaly epilepsii (n = 5), subakutní encefalopatii (n = 5), doprovázenou ve čtyřech případech epileptickými záchvaty, a mozečkový syndrom s doprovodným kognitivním deficitem (n = 1). U dvou pacientů byly současně přítomny dobře charakterizované onkoneurální protilátky (anti‑Hu, anti‑Ma2). Nádor (malobuněčný karcinom plic) byl zjištěn u jedné pacientky (anti‑AMPAR1). U osmi pacientů došlo po podání imunosuprese k remisi nebo částečnému zlepšení klinického stavu.Závěr:
Přítomnost protilátek proti membránovým antigenům je sdružena nejčastěji s limbickou encefalitidou nebo fokální epilepsií, vzácněji s jinými neurologickými syndromy. Efekt imunoterapie závisí na jejím časném podání.Klíčová slova:
autoimunitní onemocnění – encefalitidy – protilátky proti membránovým a synaptickým antigenům – limbická encefalitidaÚvod
Během posledních let byla u řady neurologických syndromů popsána přítomnost specifických autoprotilátek, které lze rozdělit na dvě podskupiny. První skupinu tvoří protilátky proti intracelulárním antigenům (např. dobře charakterizované onkoneuronální protilátky – PNP ‑ Abs, nebo protilátky proti glutamátdekarboxyláze – anti‑GAD). Tyto protilátky zřejmě nejsou přímo patogenní a onemocnění s nimi sdružená jsou pravděpodobně zprostředkována T ‑ buněčnou imunitou. Druhou skupinu tvoří protilátky proti membránovým a synaptickým antigenům (M ‑ Abs). Tyto protilátky jsou přímo patogenní – svojí vazbou na extracelulární epitop proteinu vázaného na buněčné membráně ovlivňují jeho funkci – způsobují internalizaci, nebo navozují komplementem zprostředkovanou buněčnou smrt. Přímá patogenita protilátek proti N‑metyl‑D‑aspartát receptoru (NMDAR) a protilátek proti proteinům sdruženým s napěťově řízenými draslíkovými kanály byla prokázána jak in vivo, tak in vitro [1,2]. Zatímco protilátky proti intracelulárním antigenům jsou (s výjimkou anti‑GAD) obvykle sdruženy s nádorovým onemocněním, M ‑ Abs jsou často přítomny u syndromů neparaneoplastických.
Konsenzuální klasifikace autoimunitních encefalitid sdružených s M ‑ Abs dosud neexistuje stejně jako všeobecně akceptovaná kritéria pro jejich diagnostiku. V literatuře se nejčastěji setkáváme s dělením dle jednotlivých typů protilátek či dle specifických syndromů. Kromě syndromů limbické encefalitidy, anti‑NMDAR encefalitidy, Morvanova syndromu, PERM syndromu a získané cerebrální ataxie – podrobněji viz [3] – byla přítomnost M ‑ Abs dokumentována u izolované epilepsie [4 – 6], psychózy [7] či spánkových poruch [8].
Klinické příznaky syndromů sdružených s M ‑ Abs jsou dány predilekčním postižením těch oblastí CNS, kde je daný antigen exprimován ve zvýšené míře – limbický systém, mozeček, hypothalamus, bazální ganglia. Postižení více oblastí CNS způsobuje značnou pestrost symptomů. Významnou roli z hlediska tíže a charakteru klinických projevů hraje zřejmě i titr protilátek v séru a likvoru [9]. Příznaky syndromů sdružených s M ‑ Abs mohou být obtížně rozlišitelné od paraneoplastických syndromů asociovaných s PNP ‑ Abs, efekt imunosupresivní léčby je ale u této skupiny (M ‑ Abs) dobrý a celková prognóza nemocných je příznivější. Imunoterapie musí být zahájena co nejdříve, a proto je pro další osud pacientů včasné určení diagnózy stěžejní.
Cílem této práce bylo popsat klinický obraz pacientů s pozitivitou M ‑ Abs diagnostikovaných v rámci Likvorové laboratoře Ústavu imunologie FN Motol v období od listopadu 2011 do prosince 2013.
Metodika a soubor
Vyšetření M ‑ Abs u pacientů s podezřením na autoimunitní encefalitidu bylo indikováno na základě konzultace s ošetřujícím lékařem. Posuzovány byly zejména klinické příznaky, ale také nálezy na zobrazovacích metodách, biochemické, likvorové nálezy, EEG atd. Přítomnost protilátek byla hodnocena pomocí komerčně dostupných kitů pro nepřímou imunofluorescenci na buňkách HEK293 transfektovaných genem pro daný antigen (Autoimmune encephalitis mosaic 1, Euroimmun AG). Pomocí tohoto kitu je detekována přítomnost protilátek anti‑NMDAR, anti‑AMPAR1, anti‑AMPAR2, anti‑GABABR, anti‑LGI1 a anti‑CASPR2. Poslední dvě zmíněné protilátky patří pod skupinu protilátek proti proteinům sdruženým s napěťově řízenými draslíkovými kanály (anti‑VGKC).
V období od listopadu 2011 do prosince 2013 bylo uvedenou metodikou vyšetřeno 224 pacientů (224 vzorků séra a 37 vzorků likvoru). Všichni pacienti byli současně vyšetřeni na přítomnost dobře charakterizovaných onkoneurálních protilátek (anti‑amphiphysin, anti‑CV2, anti‑Ma2/ Ta, anti‑Ri, anti‑Yo a anti‑Hu) pomocí komerčně dostupných kitů EUROLINE (Euroimmun, AG). U všech pacientů proběhlo také sérologické i likvorologické vyšetření protilátek proti běžným neurotropním agens – lymeské borrelióze a herpetickým virům. Pozitivita M ‑ Abs byla vždy hodnocena dvěma nezávislými hodnotiteli (J. H., D. K.). Opakované vyšetření protilátek bylo k dispozici v sedmi případech ze séra a v jednom případě z likvoru. U všech pacientů bylo provedeno neurologické vyšetření, magnetická rezonance (MR) mozku, EEG, likvorologické vyšetření a onkologický skríning (celotělové PET/ CT nebo CT hrudníku a břicha s aplikací kontrastní látky spolu s urologickým nebo gynekologickým vyšetřením). Pacienti s pozitivitou anti‑NMDAR protilátek (n = 8) nebyli do hodnocení zahrnuti – u všech klinický obraz odpovídal typickým projevům anti‑NMDAR encefalitidy.
Výsledky
Identifikovali jsme celkem 11 pacientů s pozitivitou M ‑ Abs v séru (po vyloučení anti-NMDAR pozitivních). Sedm pacientů byli muži, čtyři ženy. Medián věku v době diagnózy byl 58 let (rozmezí 40 – 73 let), medián věku při prvních příznacích dle anamnézy 51 let (20 – 72 let). Od výskytu prvních příznaků do vyšetření protilátek uplynulo 375 dnů (medián; rozmezí 19 dnů až 28 let). Šest pacientů bylo anti‑LGI1 pozitivních (čtyři muži a dvě ženy), u čtyř pacientů (mužů) byla zjištěna pozitivita anti‑CASPR2 (u jednoho z těchto pacientů byly zároveň přítomny protilátky anti‑AMPAR1 a anti‑Hu, u dalšího protilátky anti‑Ma2). U jedné pacientky byla zjištěna izolovaná přítomnost anti‑AMPAR1 protilátek. U osmi pacientů byly vyšetřeny protilátky též z likvoru, přičemž pozitivních nálezů bylo pět (4× anti‑LGI1 a 1× anti‑CASPR2). Negativní protilátky v likvoru při pozitivitě v séru byly přítomny u třech pacientů (1× anti‑LGI1 a 2× anti‑CASPR2). Izolovaná pozitivita protilátek v likvoru nebyla zaznamenána. U žádného pacienta neprokázala sérologická vyšetření přítomnost infekčního agens. Klinické charakteristiky jednotlivých pacientů jsou uvedeny v tab. 1.
Tab. 1. Klinické charakteristiky pacientů s pozitivitou protilátek proti membránovým a synaptickým antigenům. 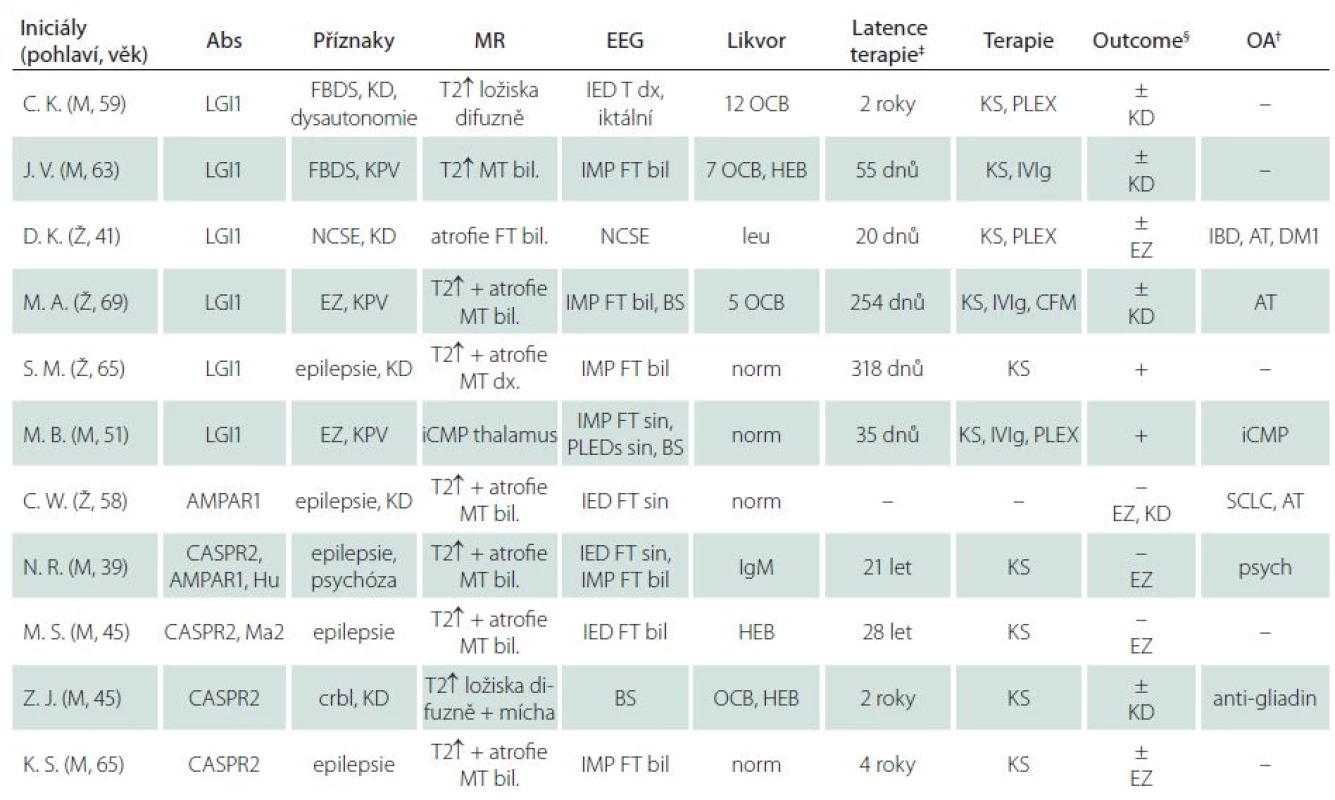
‡ Časový interval od počátku klinických příznaků k zahájení imunoterapie. § Outcome: + úprava, ± částečná úprava, – bez zlepšení (v závorce uvedeny přetrvávající obtíže). † Osobní anamnéza (komorbidity). Abs – protilátky v séru při prvním vyšetření, AT – autoimunitní thyroiditida, bil. – bilaterálně, BS – zpomalení základní aktivity, crbl – mozečkový syndrom, CFM – cyklofosfamid, DM1 – diabetes mellitus 1. typu, dx. – vpravo, EZ – epileptické záchvaty, FBDS – faciobrachiální dystonické záchvaty, FT – frontotemporálně, HEB – porucha hematoencefalické bariéry, IBD – inflammatory bowel disease (M. Crohn), iCMP – ischemická cévní mozková příhoda, IED – interiktální epileptiformní výboje, IgM – intratékální syntéza IgM, IMP – intermitentní pomalá aktivita, IVIg – intravenózní imunoglobuliny, KD – kognitivní defi cit, KS – kortikosteroidy (i.v. metylprednizolon s následným převedením na p.o. prednizon), KPV – kvalitativní porucha vědomí, leu – pleocytóza, MR – magnetická rezonance, MT – mediotemporálně, norm – normální nález, NCSE – non-konvulzivní status epilepticus, OA – osobní anamnéza, PLEDs – periodic lateralized epileptiform discharges, OCB – oligoklonální pásy, PLEX – plazmaferéza, psych – psychiatrické příznaky, SCLC – malobuněčný karcinom plic, T2↑ – zvýšený signál na T2 vážených obrazech, T – temporálně. Klinický obraz
U čtyř pacientů byla prvním příznakem onemocnění subakutně (v řádu několika týdnů) se rozvíjející encefalopatie a u všech byla zjištěna pozitivita anti‑LGI1 protilátek. U jedné pacientky (D. K.) z této skupiny odpovídal klinický i EEG nález non‑konvulzivnímu epileptickému statu (NCSE). U další nemocné (M. A.) bylo přítomno prudké kolísání vigility, kdy krátké periody dezorientované bdělosti s agresivitou náhle přecházely do areaktivního stuporu. EEG korelátem tohoto stavu byla difuzní pomalá aktivita z pásma theta‑delta odpovídající spánkovému stadiu NREM III, střídaná úseky bdělého EEG. Kolísání vědomí bylo doprovázeno mimovolními pohyby levé horní končetiny. U dalšího pacienta (J. V.) v této skupině byly pozorovány faciobrachiální dystonické záchvaty (FBDS). Klinický obraz FBDS, avšak bez doprovodné encefalopatie, se objevil u dalšího pacienta s pozitivitou anti‑LGI1 (C. K.). Kromě FBDS byl u tohoto pacienta přítomen kognitivní deficit a dysautonomie.
U dalších pěti pacientů byla hlavním projevem fokální epilepsie (anamnéza záchvatů byla u všech delší než jeden rok). K vyšetření protilátek nás vedl současně přítomný kognitivní deficit nebo MR nález bilaterálních signálových změn mediotemporálně. U těchto pacientů byly ve třech případech zjištěny protilátky anti‑CASPR2 (M. S., N. R.,K. S.), u jedné pacientky anti‑LGI1 (S. M.) a u jedné pacientky anti‑AMPAR1 (C. W.). Jeden z anti‑CASPR2 pozitivních pacientů s epilepsií byl několik let psychiatricky léčen pro těžkou poruchu osobnosti a byla u něj přítomna též senzorická fatická porucha (N. R.).
U posledního pacienta dominoval v klinickém obraze mozečkový syndrom spolu s lehkým kognitivním deficitem (Z. J.) a byla u něj zjištěna pozitivita anti‑CASPR2.
Epileptické záchvaty se vyskytly celkem u devíti pacientů (82 %). U jednoho pacienta (N. R.) byla provedena stereotaktická termoléze levého amygdalohipokampálního komplexu pro refrakterní epilepsii (bez příznivého efektu) dva roky před vyšetřením autoprotilátek. U jednoho pacienta (M. S.) se chirurgické řešení epilepsie nyní zvažuje vzhledem k jejímu refrakternímu průběhu i po podání imunosuprese.
EEG
EEG bylo abnormní u všech pacientů – v nálezech dominovala pomalá základní aktivita a/ nebo intermitentní pomalá aktivita v pásmu theta‑delta (většinou s maximem frontotemporálně bilaterálně), ve třech případech se současným nálezem specifických epileptiformních grafoelementů. V jednom případě odpovídal EEG obraz nekonvulzivnímu statu. U žádného z pacientů nedošlo k úplné normalizaci EEG nálezu, a to ani po úspěšné imunosupresivní léčbě.
Video ‑ EEG monitorování podstoupilo celkem pět pacientů, ve třech případech byly zachyceny epileptické záchvaty – semiologicky automotorické se sekundární generalizací u dvou pacientů, v jednom případě již zmíněný NCSE (repetitivní iktální vzorce s počátkem nezávisle v obou temporálních lalocích).
Komorbidity
Tři pacientky (dvě s pozitivitou anti‑LGI1 a jedna anti‑AMPAR1) byly léčeny pro tyreopatii – pouze u jedné pacientky s prokázanou autoimunitní etiologií. U jedné pacientky s pozitivitou anti‑LGI1 byla rok před rozvojem limbické encefalitidy diagnostikována Crohnova nemoc. Jeden pacient s pozitivitou anti‑CASPR2 a mozečkovým syndromem měl současně pozitivní protilátky proti gliadinu, avšak bez klinických projevů celiakie. Další pacient (s pozitivitou anti‑CASPR2) byl léčen pro diabetes mellitus 2. typu. Jeden pacient utrpěl v době rozvoje příznaků ischemickou cévní mozkovou příhodu v oblasti thalamu, která ale nevysvětlovala jeho klinické obtíže.
MR mozku
U osmi pacientů byl na MR pozorován nález charakteristický pro limbickou encefalitidu – hyperintenzita v T2 vážených obrazech a/ nebo atrofie v mediotemporálních oblastech, bilaterální nebo unilaterální. Tíže těchto nálezů však byla rozdílná (obr. 1). U jednoho pacienta (C. K.) byl nález nespecifické difuzní gliózy, u pacientky D. K. nález atrofie fronto ‑ temporoparietálně oboustranně. U pacienta s rozvojem mozečkového syndromu a mírného kognitivního deficitu s pozitivitou anti‑CASPR2 (Z. J.) byly přítomny difuzní T2 hyperintenzní změny supratentoriálně s maximem v oblasti mozečkových pedunklů a obraz cervikální myelopatie (vedlejší nález). U jednoho pacienta (M. B.) MR prokázala akutní ischemii v oblasti thalamu.
Likvorologické vyšetření
Vyšetření mozkomíšního moku bylo provedeno u všech pacientů, z čehož abnormní bylo v sedmi případech (64 %). Pouze u jediné pacientky s pozitivitou anti‑LGI1 a iniciálním NCSE byla přítomna pleocytóza (28/ 3 mm3). Známky porušené hematoencefalické bariéry (dle Reibera) jsme nalezli u dvou pacientů (1× anti‑LGI1, 1× anti‑CASPR2). Oligoklonální pásy (OCB) byly přítomny u tří pacientů (všichni s pozitivitou anti‑LGI1) – vzorec měl vždy charakter tzv. mirror‑pattern (shodné OCB v séru a likvoru), přičemž porucha hematoencefalické bariéry byla výpočtem prokázána pouze u jednoho z těchto pacientů. Normální likvorový nález byl přítomen u dvou pacientů s pozitivitou anti‑LGI1, u jednoho pacienta s pozitivitou anti‑CASPR2 a u pacientky s pozitivitou anti‑AMPAR1.
Malignity
Opakovaný onkologický skríning odhalil malignitu u jediné pacientky (s pozitivitou anti‑AMPAR1) – jednalo se o histopatologicky potvrzený malobuněčný plicní karcinom (C. W.). Tumor byl diagnostikován jeden měsíc od zjištění pozitivity protilátek, ale až 12 let po začátku onemocnění (poruchy paměti, následované do dvou let rozvojem temporální epilepsie). U jednoho pacienta s pozitivitou anti‑LGI1 bylo identifikováno suspektní nádorové ložisko v oblasti štítné žlázy. Rozsah ložiska na kontrolním zobrazovacím vyšetření (za 4 měsíce) byl nezměněn a tenkojehlová biopsie nádor nezastihla. Pacient následně navrhovanou tyroidektomii odmítl. U ostatních pacientů nadále probíhající onkologický skríning zatím neodhalil nádorové onemocnění – medián sledování 235 dnů (rozmezí 11 měsíců až 2 roky).
Léčba
Imunosupresivní terapii podstoupilo 10 pacientů. Medián doby od rozvoje příznaků do zahájení imunosuprese byl 534 dnů (rozmezí 20 dnů až 28 let). Jedinou pacientkou, u které nebyla imunosuprese indikována, byla pacientka s paraneoplastickou limbickou encefalitidou (LE) s protilátkami anti‑AMPAR1 při bronchogenním karcinomu. Tato pacientka podstoupila chemoterapii. Imunoterapie zahrnovala u všech pacientů i.v. pulz metylprednizolonu a pokračování v p.o. prednizonu. U tří pacientů byla následně podány IVIg (v dávce 0,4 g/ kg/ den po dobu 5 dnů) a u dalších dvou byla provedena plazmaferéza (pět sezení). Ta byla dále podána u jednoho z pacientů nereagujících na léčbu KS a IVIg (M. B.). U jedné pacientky nereagující na léčbu první linie (KS a IVIg) bylo přistoupeno k léčbě měsíčními pulzy cyklofosfamidu. Všichni tito pacienti splňovali klinická kritéria limbické encefalitidy. U pacientů s epilepsií zahrnovala imunoterapie pouze i.v. metylprednizolon s následným převedením na p.o. kortikosteroidy.
K úplné remisi příznaků došlo u dvou pacientů – M. A., u které došlo k normalizaci poruchy paměti potvrzené kontrolním neuropsychologickým vyšetřením a kompenzaci záchvatů na léčbě antiepileptiky, a u pacienta M. B., u kterého došlo ke kompenzaci epilepsie, rovněž při podávání antiepileptik. Jako částečně zlepšený byl stav hodnocen u šesti pacientů pacientů – u třech z nich došlo ke snížení frekvence epileptických záchvatů (C. K., K. S., D. K.), které ale nejsou plně kompenzovány na terapii, u pacientky M. A. došlo ke zlepšení kvalitativní poruchy vědomí, ale přetrvává kognitivní deficit, u pacienta J. V. došlo k vymizení epileptických záchvatů, ale přetrvává zpomalení psychomotorického tempa, u pacienta Z. J. přetrvává mozečkový syndrom a kognitivní deficit, ale po podání imunosuprese se zastavila klinická i radiologická progrese. Medián doby od výskytu prvních příznaků do podání imunosuprese byl u těchto klinicky zlepšených pacientů 318 dnů (rozmezí 20 dnů až 4 roky). Kontrolní vyšetření pozitivity protilátek v séru bylo provedeno u čtyř z těchto pacientů a ve třech případech (S. M, J. V., M. B.) protilátky vymizely.
U zbývajících tří pacientů nedošlo k významnému zlepšení. Jedna pacientka (C. W. – anti‑AMPAR1) byla vzhledem k nálezu SCLC léčena chemoterapií a přetrvává u ní kognitivní deficit a zůstala nezměněna frekvence epileptických záchvatů. U dvou léčených pacientů (oba s pozitivitou anti‑CASPR2 a několik let probíhající temporální epilepsie) došlo po podání kortikoidů k přechodnému vymizení generalizovaných tonicko‑klonických záchvatů (které se předtím vyskytovaly ve frekvenci přibližně 1× měsíčně). Četnost fokálních záchvatů se ale nezměnila a po třech měsících došlo u obou k recidivě sGTCS. Medián doby k podání imunosuprese byl u těchto pacientů 25 let.
Tab. 2. Diagnostická kritéria limbické encefalitidy (volně dle Biena). 
Diskuze
V literatuře byla popsána řada syndromů sdružených s protilátkami proti membránovým a synaptickým antigenům (anti‑NMDAR encefalitida, limbická encefalitida, Morvanův syndrom, získaná neuromyotonie, progresivní encefalomyelitida s rigiditou a myoklonem, epilepsie, mozečková ataxie s pozdním nástupem). Míra vyjádření jednotlivých příznaků těchto syndromů může být různá a jednotlivé syndromy se mezi sebou mohou překrývat. Někdy může být obdobný klinický obraz podmíněn přítomností různých protilátek a naopak – přítomnost určité protilátky může být u jednotlivých pacientů sdružena s odlišnými klinickými projevy. To potvrzuje i naše pozorování. Pozitivita anti‑CASPR2 byla u třech pacientů sdružena s anamnézou několik let trvající temporální epilepsie, zatímco u jednoho pacienta se projevila rozvojem mozečkového syndromu a kognitivního deficitu bez epileptických záchvatů. Zatímco u jedné pacientky (M. A.) probíhala anti‑LGI1 encefalitida pod obrazem těžkého kognitivního deficitu refrakterního na imunoterapii, u druhé pacientky (S. M.) v obdobném věku došlo k rozvoji několika neprovokovaných epileptických záchvatů a lehké poruchy paměti, která ale pacientce nebránila ve vykonávání vysokoškolské profese. U první pacientky vedla imunoterapie pouze k mírnému zlepšení stavu při přetrvávající pozitivitě protilátek v likvoru, u druhé pacientky došlo po podání kortikoidů a nasazení antiepileptik ke kompenzaci epilepsie a vymizení protilátek. Zásadně odlišný byl i nález na MR (obr. 1).
Obr. 1. Různá intenzita změn meziotemporálně na MR mozku (axiální FLAIR) u pacientek s pozitivitou anti-LGI1 a klinickými projevy limbické encefalitidy – vlevo S. M., vpravo M. A. 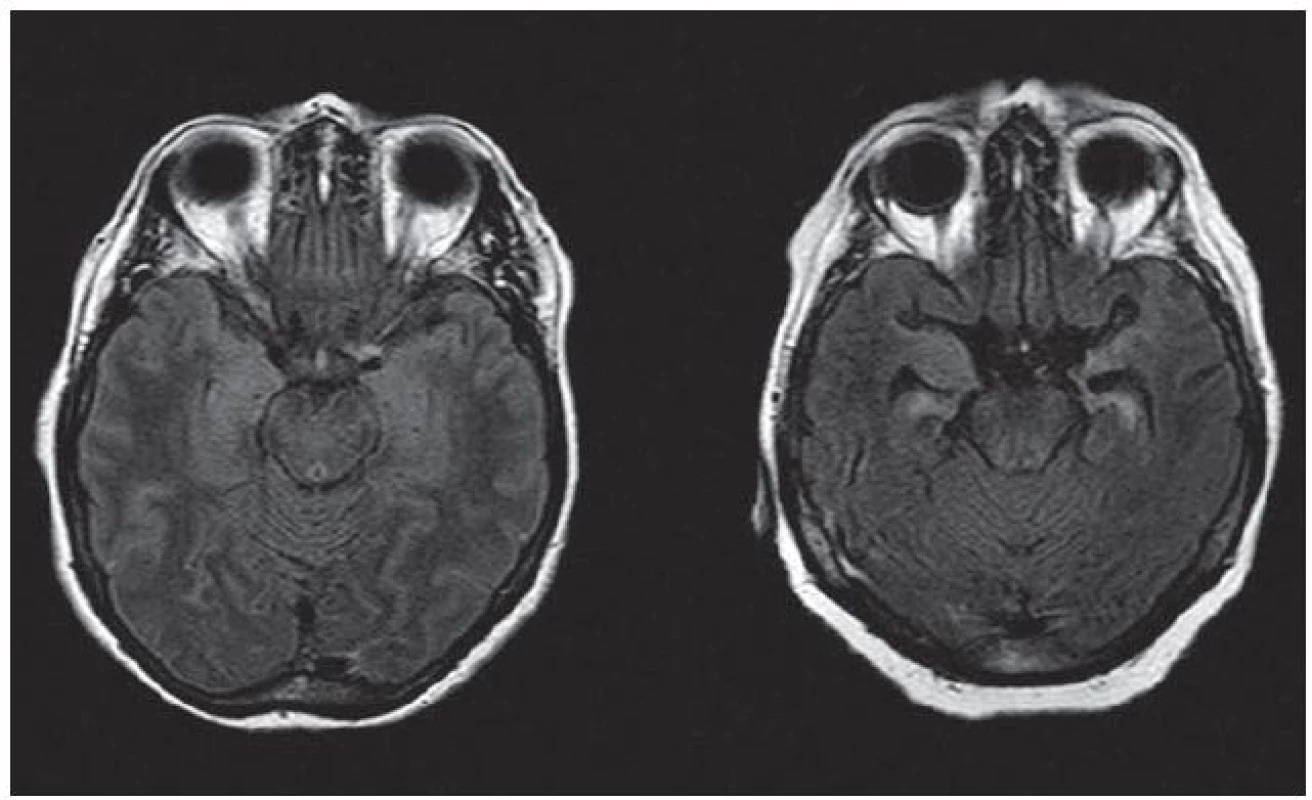
Faktory ovlivňující charakter a míru vyjádření klinických příznaků nejsou známy. Významnou roli může hrát premorbidní stav nemocného a komorbidity, přítomnost dalšího typu protilátek, délka trvání onemocnění, přítomnost okultního tumoru nebo titr protilátek. U většiny pacientů s limbickou encefalitidou sdruženou s anti‑VGKC (tato skupina zahrnuje i anti‑LGI1 a anti‑CASPR2) jsou tyto přítomny ve vysokých titrech a příznivá odpověď na léčbu koreluje s jejich poklesem [10]. Naproti tomu klinický význam nízkých titrů anti‑VGKC je sporný. Dle retrospektivní studie byly nízké titry anti‑VGKC sdruženy se zvýšenou neuromuskulární dráždivostí, ale pouze u 13 % (4/ 32) pacientů byla jejich přítomnost hodnocena jako klinicky relevantní [9]. Rozdílný klinický význam vysokých a nízkých titrů protilátek se týká pravděpodobně také protilátek anti‑CASPR2 (Bien, osobní sdělení) a lze ho patrně zvažovat i u protilátek anti‑GAD. Ty sice nepatří mezi protilátky proti membránovým a synaptickým antigenům, ale jsou sdruženy s podobnými klinickými projevy. U protilátek anti‑LGI1, anti‑GABABR, anti‑AMPAR a anti‑GlyR není tato otázka zatím vyřešena. Metody využívané pro stanovení protilátek u našich pacientů stanovení titrů nezahrnovaly, což je jistě jedna z významných limitací naší práce.
U osmi z našich pacientů byla testována přítomnost protilátek v likvoru, v šesti případech byla potvrzena. Izolovanou pozitivitu protilátek v likvoru jsme (na rozdíl od několika pacientů s anti‑NMDAR encefalitidou) neodhalili. Zatímco u NMDAR encefalitidy koreluje tíže postižení lépe s titry protilátek v likvoru [11], význam intratékální syntézy ostatních protilátek proti membránovým a synaptickým antigenům je dosud sporný. Vzhledem k tomu, že jsou protilátky proti membránovým a synaptickým antigenům přímo patogenní a rozvoj klinických příznaků souvisí s jejich působením na úrovni synapse, je logické předpokládat nutnost jejich přítomnosti v mozkomíšním moku. U čtyř našich pacientů s pozitivitou protilátek v mozkomíšním moku došlo ke klinickému zlepšení po podání imunoterapie. U dvou pacientů s negativitou protilátek v likvoru byla lumbální punkce provedena buď ve velmi časném stadiu onemocnění – 15 dnů (D. K.), nebo naopak až po několika letech trvání epilepsie (M.S., N. R.). Je tedy možné, že u první pacientky nebyla hladina protilátek v likvoru ještě detekovatelná a u zbylých dvou pacientů již vymizela. Tyto kazuistiky dokládají důležitost opakovaného párového vyšetření séra a likvoru u pacientů s pozitivitou protilátek v séru.
Imunoterapie může zásadně zlepšit stav pacientů a vést k úplnému vymizení příznaků nemoci, jak jsme pozorovali např. u pacientky S. M. U neléčených pacientů existuje riziko rozvoje sekundární mozkové atrofie s ireverzibilními následky – např. anti‑LGI1 protilátky navozují komplementem zprostředkovanou buněčnou smrt a u LE spojené s těmito protilátkami byl pozorován rozvoj sekundární hipokampální sklerózy [12]. Byly sice popsány případy spontánní remise, ale nepodání imunosuprese je u řady syndromů spojeno s horší prognózou a rizikem relapsů [13 – 14]. Z těchto důvodů je nasazení imunoterapie vhodné již v případě klinického podezření (klinický obraz, MR nález, zánětlivý obraz v likvoru) při vyloučení infekční příčiny. Konsenzus stran nejvhodnějšího typu imunoterapie, dávky a délky podávání zatím neexistuje. Rozlišují se léky první linie – metylprednizolon, intravenózní imunoglobuliny (IVIg), plazmaferéza (PE) – a léky druhé linie – rituximab (RTX) a cyklofosfamid (CFM). U refrakterních pacientů s anti‑NMDAR encefalitidou byly publikovány kazuistiky s podáním alemtuzumabu či intratékální aplikací metotrexátu. Randomizovaná prospektivní studie porovnávající efekt jednotlivých strategií léčby však dosud nebyla provedena. Imunoterapie se proto v současné době volí individuálně s přihlédnutím k možným nežádoucím účinkům u daného pacienta. Pomocným vodítkem výběru mohou být zkušenosti s jednotlivými imunosupresivy u ostatních autoimunitních onemocnění a známé farmakodynamické a farmakokinetické vlastnosti. Vzhledem k popisované možnosti relapsů je doporučováno pokračovat v udržovací imunosupresivní léčbě minimálně jeden rok, a to i v případech klinického zlepšení [15].
Mezi prognosticky příznivé faktory v naší skupině pacientů patřila přítomnost anti‑LGI1 protilátek, nepřítomnost nádoru a zejména kratší doba od vzniku příznaků k zahájení imunoterapie (medián 258 dnů vs. 12 let). U tří pacientů, u kterých bylo pozorováno klinické zlepšení, došlo k vymizení protilátek v séru. U žádného pacienta s přetrvávajícími příznaky naopak k vymizení protilátek nedošlo. Za prognosticky příznivou známku lze zřejmě považovat také vymizení protilátek v likvoru v návaznosti na podanou imunoterapii. Otázka, zda je u syndromů sdružených s M‑Abs nezbytné léčit do úplného vymizení protilátek v séru, není v současné době uspokojivě zodpovězena a záleží pravděpodobně na typu přidružené protilátky. Při klinickém rozhodování je nezbytné řídit se především klinickým stavem pacienta. Kontrolní vyšetření protilátek ze séra a likvoru je i při zlepšení klinického stavu vhodné, ale je nutné jej provádět s dostatečným odstupem 6 – 12 měsíců.
Závěr
S přihlédnutím k metodologickým limitacím dokládá naše práce relativně četný výskyt LE sdružené s protilátkami anti‑LGI1 v České republice (včetně oligosymptomatických případů) a její poměrně dobrou prognózu při včasném zahájení imunoterapie. Spektrum syndromů spojených s protilátkami anti‑CASPR2 je pestřejší a zahrnuje mimo jiné epilepsii temporálního laloku a mozečkový syndrom. Tyto syndromy hůře reagují na imunoterapii, zejména v případě mnohaletého trvání příznaků. Anti‑AMPAR1 protilátky byly sdruženy s epilepsií doprovázenou kognitivním deficitem a v jednom případě signalizovaly přítomnost okultního tumoru. Naše práce dále ukazuje také na výskyt M ‑ Abs u vybraných pacientů s déletrvající fokální epilepsií. Efekt imunoterapie však byl u těchto pacientů poměrně nízký. Identifikace vhodných kandidátů pro imunoterapii bude předmětem dalších studií.
Použité zkratky
AMPAR – α ‑ amino ‑ 3 - hydroxy ‑ 5 - metyl ‑ 4 - izoxazolepropionátové receptory
CASPR2 – Contactin Associated Protein 2
FBDS – faciobrachiální dystonické záchvaty
GABABR – B receptor kyseliny γ ‑ aminomáselné
GAD – glutamát dekarboxyláza
LGI1 – Leucin‑rich Glioma Inactivated protein 1
M ‑ Abs – protilátky proti membránovým a synaptickým antigenům
NCSE – nonkonvulzivní status epilepticus
PNP ‑ Abs – dobře charakterizované onkoneuronální protilátky
PERM syndrom – syndrom progresivní encefalitida – rigidita – myoklonus
VGKC – makromolekulární komplex proteinů sdružených s napěťově řízenými draslíkovými kanály
NMDAR – N ‑ metyl ‑ D ‑ aspartátový receptor
IVIG – intravenózní imunoglobulin
Poděkování patří prof. MUDr. Robertu Kubovi, Ph.D. (in memoriam), MUDr. Kláře Musilové, Ph.D. a MUDr. Lence Svobodové.
Výzkum byl podpořen Grantovou agenturou Univerzity Karlovy (projekt č. 189215) a grantem IGA MZ ČR NT/14489.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 2. 4. 2015
Přijato do tisku: 25. 5. 2015
MUDr. Martin Elišák
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: martin.elisak@gmail.com
Zdroje
1. Hughes EG, Peng X, Gleichman AJ, Lai M, Zhou L, Tsou Ret al. Cellular and synaptic mechanisms of anti‑NMDA receptor encephalitis. J Neurosci 2010; 30(17): 5866 – 5875. doi: 10.1523/ JNEUROSCI.0167 ‑ 10.2010.
2. Lalic T, Pettingill P, Vincent A, Capogna M. Human limbic encephalitis serum enhances hippocampal mossy fiber ‑ CA3 pyramidal cell synaptic transmission. Epilepsia 2011; 52(1): 121 – 131. doi: 10.1111/ j.1528 ‑ 1167.2010.02756.x.
3. Krysl D, Elisak M. Autoimunitní encefalitidy. Cesk Slov Neurol N 2015; 78/ 111(1): 7 – 23. doi: 10.14735/ amcsnn20157.
4. Lilleker JB, Jones MS, Mohanraj R. VGKC complex antibodies in epilepsy: diagnostic yield and therapeutic implications. Seizure 2013; 22(9): 776 – 779. doi: 10.1016/ j.seizure.2013.06.004.
5. Brenner T, Sills GJ, Hart Y, Howell S, Waters P, Brodie MJ et al. Prevalence of neurologic autoantibodies in cohorts of patients with new and established epilepsy. Epilepsia 2013; 54(6): 1028 – 1035. doi: 10.1111/ epi.12127.
6. Ekizoglu E, Tuzun E, Woodhall M, Lang B, Jacobson L, Icoz S et al. Investigation of neuronal autoantibodies in two different focal epilepsy syndromes. Epilepsia 2014; 55(3): 414 – 422. doi: 10.1111/ epi.12528.
7. Zandi MS, Irani SR, Lang B, Waters P, Jones PB, McKenna P et al. Disease ‑ relevant autoantibodies in first episode schizophrenia. J Neurol 2011; 258(4): 686 – 688. doi: 10.1007/ s00415 ‑ 010 ‑ 5788 ‑ 9.
8. Cornelius JR, Pittock SJ, McKeon A, Lennon VA, Aston PA, Josephs KA et al. Sleep manifestations of voltage ‑ gated potassium channel complex autoimmunity. Arch Neurol 2011; 68(6): 733 – 738. doi: 10.1001/ archneurol.2011.106.
9. Paterson RW, Zandi MS, Armstrong R, Vincent A,Schott JM. Clinical relevance of positive voltage ‑ gated potassium channel (VGKC) – complex antibodies: experience from a tertiary referral centre. J Neurol Neurosurg Psychiatry 2014; 85(6): 625 – 630. doi: 10.1136/ jnnp ‑ 2013 ‑ 305218.
10. Vincent A, Buckley C, Schott JM, Baker I, Dewar BK, Detert N et al. Potassium channel antibody‑associated encephalopathy: a potentially immunotherapy ‑ responsive form of limbic encephalitis. Brain 2004; 127(3): 701 – 712.
11. Gresa ‑ Arribas N, Titulaer MJ, Torrents A, Aguilar E, McCracken L, Leypoldt F et al. Antibody titres at diagnosis and during follow‑up of anti‑NMDA receptor encephalitis: a retrospective study. Lancet Neurol 2014; 13(2): 167 – 177. doi: 10.1016/ S1474 ‑ 4422(13)70282 ‑ 5.
12. Bien CG, Urbach H, Schramm J, Soeder BM, Becker AJ, Voltz R et al. Limbic encephalitis as a precipitating event in adult ‑ onset temporal lobe epilepsy. Neurology 2007; 69(12): 1236 – 1244.
13. Gabilondo I, Saiz A, Galán L, González V, Jadraque R, Sabater L et al. Analysis of relapses in anti‑NMDAR encephalitis. Neurology 2011; 77(10): 996 – 999. doi: 10.1212/ WNL.0b013e31822cfc6b.
14. Irani SR, Stagg CJ, Schott JM, Rosenthal CR, Schneider SA, Pettingill P et al. Faciobrachial dystonic seizures: the influence of immunotherapy on seizure control and prevention of cognitive impairment in a broadening phenotype. Brain 2013; 136(10): 3151 – 3162. doi: 10.1093/ brain/ awt212.
15. Dalmau J, Lancaster E, Martinez ‑ Hernandez E, Rosenfeld MR, Balice ‑ Gordon R. Clinical experience and laboratory investigations in patients with anti‑NMDAR encephalitis. Lancet Neurol 2011; 10(1): 63 – 74. doi: 10.1016/ S1474 ‑ 4422(10)70253 ‑ 2.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Projekt ncRNAPainČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Experimentální léčba poranění míchy
- Význam magnetické rezonance v diagnostice epilepsie
- Možnosti sledování a hodnocení kvality života u dětí a dospívajících s epilepsií ve světě a v České republice
- Prionový protein, jeho úloha v buněčné proliferaci, diferenciaci a vývoji nervové soustavy
- Předpověď úspěšnosti a selhání endoskopické ventrikulocisternostomie III. komory
- Změny efektivní konektivity po facilitační fyzioterapii u roztroušené sklerózy mozkomíšní
- Projekt ncRNAPain
- Snížení rizika vzniku mozkového infarktu v průběhu kardiochirurgické operace pomocí sonolýzy – pilotní výsledky
- Zachování sluchu při mikrochirurgické léčbě vestibulárního schwannomu
- Validace české verze komplexního protokolu kvantitativního testování senzitivity
- Neurologické syndromy sdružené s protilátkami proti membránovým a synaptickým antigenům
- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Syndrom Freyové (aurikulotemporální syndrom) po parotidektomii a jeho prevence
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
- Úspěšná léčba anti‑MAG neuropatie asociované s monoklonální gamapatií nejistého významu kombinací rituximabu s dexametazonem – kazuistika
- Žilní trombóza jako komplikace ventrikuloatriálního shuntu – kazuistika
- Spinocerebelární ataxie typu 6 – kazuistika
- Diastematomyelie u dospělých – kazuistika
- Webové okénko
-
Analýza dat v neurologii
LII. Odhad poměru šancí u složitějších tabulek četností
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Význam magnetické rezonance v diagnostice epilepsie
- Experimentální léčba poranění míchy
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



