-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zachování sluchu při mikrochirurgické léčbě vestibulárního schwannomu
Hearing Preservation Following Vestibular Schwannoma Microsurgery
Aim:
The aim of the study was to conduct a comprehensive analysis of the factors influencing the success rate of hearing preservation in patients undergoing microsurgical removal of vestibular schwannoma (VS).Materials and methods:
A total of 81 consecutive patients with serviceable hearing underwent surgical removal of unilateral vestibular schwannoma via retrosigmoid-transmeatal approach between 2008 and 2010. Patient, tumor and audiometric parameters together with intraoperative findings were prospectively analyzed. Data were statistically processed including a regression analysis of independent variables.Results:
Serviceable hearing was preserved in 17 patients (useful hearing in nine and non-useful in eight cases). We observed improvement of hearing from non-useful to useful level in two patients. Average size of VS was smaller in the preserved hearing group (p < 0.001) where lower stage tumors prevailed (p = 0.001). Extent of internal auditory canal filling did not correlate with the result. Preoperative hearing level (p < 0.001) and the type of brainstem auditory evoked response (p = 0.03) arose as significant prognostic factors. Employment of intraoperative BERA was crucial for the outcome (p < 0.001) but success rate of its preservation was not correlated with the result. Identification of the cochlear nerve (p < 0.001), employment of endoscopic technique (p < 0.001), soft consistency of the tumor (p = 0.05) and the lack of adhesions to the neurovascular structures (p < 0.001) proved to be crucial factors affecting the preservation of hearing. Neither hypervascularity nor the presence of cystic component affected outcome.Conclusions:
Apart from the experience of the surgical team, size of the tumor, preoperative hearing level and possibility of intraoperative hearing monitoring represented the main factors for hearing preservation. Early identification of the cochlear portion of the CN VIII is key. For this, the use of endoscopic technique seems to be beneficial. Soft consistency of tumor and lack of adhesions to the neurovascular structures represent crucial intraoperative factors.Key words:
vestibular schwannoma – acoustic neuroma – hearing preservation – microsurgery – retrosigmoid approach – intraoperative neuromonitoring
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: Martin Chovanec 1
; E. Zvěřina 1; J. Kluh 1; J. Bouček 1; O. Profant 1,2
; Z. Balogová 1,2; J. Syka 2
; J. Betka 1
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku 1. LF UK a FN v Motole, Praha 1; Oddělení neurofyziologie sluchu, Ústav experimentální medicíny AV ČR, v. v. i., Praha 2
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(4): 435-441
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce bylo provést komplexní zhodnocení faktorů ovlivňujících úspěšnost zachování sluchu při mikrochirurgické léčbě vestibulárního schwannomu (VS).Soubor a metodika:
Prospektivně jsme hodnotili soubor 81 pacientů, kteří v období 2008 – 2010 podstoupili radikální exstirpaci VS retrosigmoidním ‑ transmeatálním přístupem a v době zákroku měli zachovaný sluch. Hodnotili jsme faktory stran pacienta, nádoru, audiometrické parametry a technické aspekty operace. Parametry byly statisticky vyhodnoceny včetně regresivní analýzy nezávislých proměnných.Výsledky:
Sluch se podařilo zachovat u 17 pacientů (tzv. užitečný sluch: devět; tzv. neužitečný sluch: osm). U dvou pacientů jsme zaznamenali zlepšení z neužitečné úrovně na sluch užitečný. Velikost VS byla ve skupině se zachovaným sluchem menší (p < 0,001), převažovaly tak nádory nižších stadií (p = 0,001). Hloubka zasahování do vnitřního zvukovodu nevykazovala vztah k úspěšnosti zachování sluchu. K významným faktorům ovlivňujícím výsledek patřila předoperační úroveň sluchu (p < 0,001) včetně typu odpovědi v BERA (p = 0,03). Užití intraoperační BERA bylo pro výsledek klíčové (p < 0,001). Úspěšnost zachování BERA však s výsledkem nekorelovala. Ke klíčovým faktorům ovlivňujícím uchování sluchu patřila úspěšná identifikace kochleárního nervu (p < 0,001), užití endoskopické techniky (p < 0,001), měkká konzistence tumoru (p = 0,05) a absence adhezí k neurovaskulárním strukturám (p < 0,001). Krvácivost ani přítomnost cystické komponenty úspěšnost uchování sluchu neovlivnily.Závěry:
Mimo zkušenost chirurgického týmu patří k hlavním faktorům ovlivňujícím uchování sluchu velikost nádoru, úroveň sluchu před operací a možnost užití intraoperačního monitoringu sluchu. Klíčová je identifikace kochleární porce n. VIII. Z tohoto hlediska se jeví přínosné užití endoskopické techniky. K významným intraoperačním faktorům pak náleží měkká konzistence tumoru a absence adhezí k neurovaskulárním strukturám.Klíčová slova:
vestibulární schwannom – neurinom akustiku – uchování sluchu – mikrochirurgie – retrosigmoidní přístup – intraoperační neuromonitoringÚvod
Pokroky v diagnostice, širší povědomí a porozumění biologii vestibulárního schwannomu (VS), pokroky v terapii, interdisciplinární přístup i centralizace pacientů výrazným způsobem změnily vyhlídky pacientů diagnostikovaných pro toto onemocnění [1]. S dramatickou redukcí mortality, následků onemocnění a jeho léčby se dostávají do popředí otázky kvality života. Četné studie demonstrují, že pouhá, ale bedlivá observace těchto benigních a obecně pomalu rostoucích procesů je opodstatněná v případě asymptomatických nádorů do 2,5 cm s minimálním rizikem pro funkci lícního nervu a sluchu [2]. Zachování neurologických funkcí, především funkce hlavových nervů (n. VII, n. VIII – sluch), patří mimo odstranění, resp. kontrolu nádoru k hlavním cílům obou postupů aktivní léčby [3,4]. Zatímco indikace mikrochirurgie v případě rostoucích a symptomatických schwannomů nad 2 – 2,5 cm je obecně akceptována, rozhodování o volbě léčebného postupu v případě progredujících malých nádorů zůstává i nadále kontroverzní s četnými faktory demonstrujícími výhody mikrochirurgie nebo naopak stereoradiochirurgie [1,3,5 – 9].
Pro potřeby detailnější analýzy dopadů onemocnění a jeho léčby na sluch bylo vypracováno několik klasifikací hodnotících úroveň sluchu na základě subjektivních audiometrických metod (tónové a slovní audiometrie). K celosvětově rozšířeným a užívaným systémům patří tzv. Gardner ‑ Robertsonova klasifikace (Gardner Robertson’s Classification; GRC) (tab. 1) a klasifikace Americké akademie pro otorinolaryngologii a chirurgii hlavy a krku (AAO ‑ HNS) [10,11]. Obě metody užívají jako limit pro tzv. užitečný sluch průměrnou ztrátu v tónové audiometrii (Pure Tone Average; PTA) do 50 dB a slovní diskriminaci (Speech Discrimination Score; SDS) vyšší než 50 %. Obdobný pohled na hodnocení užitečného a neužitečného sluchu mají i další užívaná klasifikační schémata [3,12,13].
Tab. 1. Gardner-Robertsonova klasifikace sluchové poruchy (GRC). 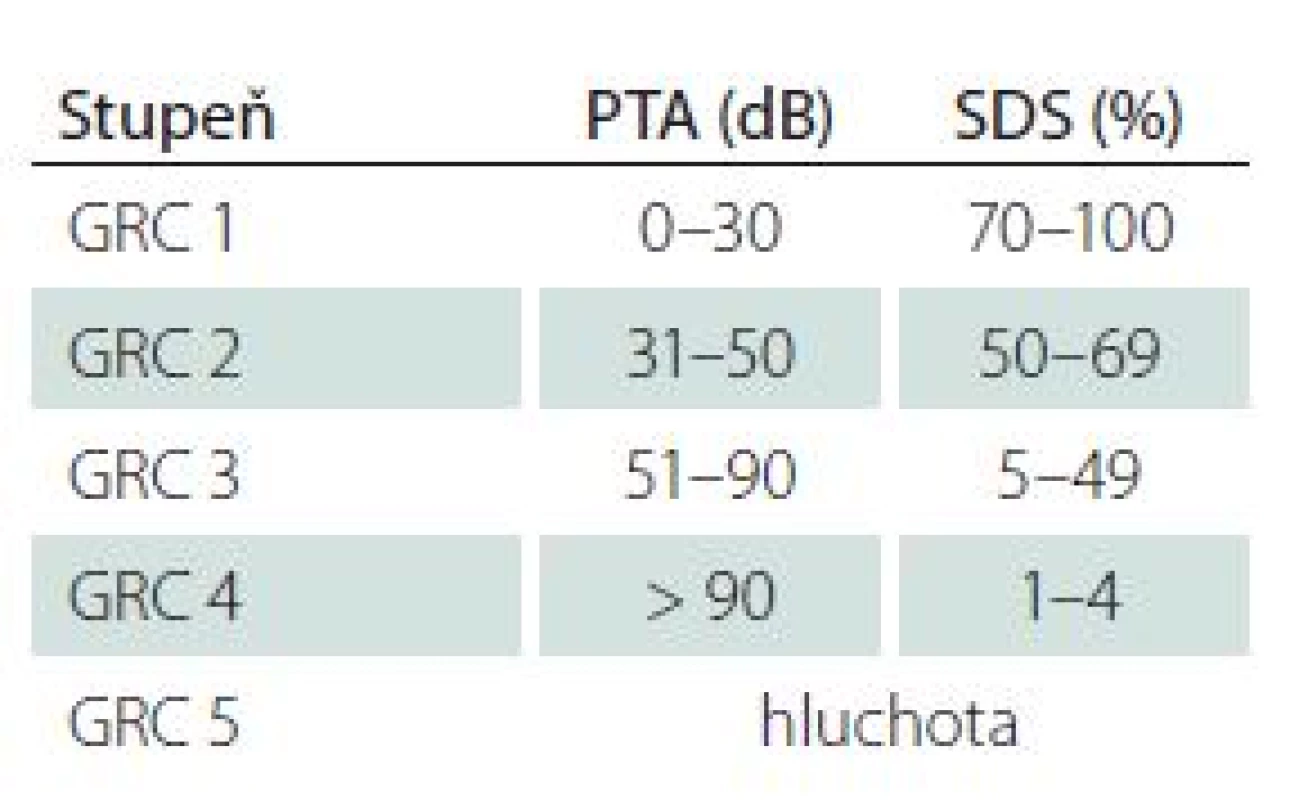
PTA – Pure Tone Average hodnocený z tónové audiometrie na frekvencích 0,5; 1; 2 a 4 kHz, SDS – Speech Discrimination Score hodnocené ze slovní audiometrie na hladině hlasitosti 60 dB. S ohledem na diagnostiku typu sluchové poruchy i možnosti peroperačního neuromonitoringu jsou klíčové z objektivních audiometrických metod především sluchové kmenové evokované potenciály (Brainstem Auditory Evoked Potentials; BAEP). Spolu s elektrokochleografií a snímáním akčních potenciálů z nervus cochlearis umožňují peroperační sledování sluchových funkcí [14 – 16]. Otoakustické emise pak pomáhají předoperačně hodnotit funkci vnitřního ucha jako takového, která je s ohledem na možnosti zachování sluchu neméně významná.
Zachování sluchu při mikrochirurgické léčbě VS zůstává i nadále problematické, především u velkých nádorů. Bližší identifikace prediktivních faktorů uchování sluchu je klíčová pro správné rozhodování o optimálním postupu. Tento fakt vystupuje do popředí v případech, kdy je eventuální jednostranná ztráta sluchu pro pacienta devastující (např. jediné slyšící ucho na straně nádoru či bilaterální sluchová porucha).
Cílem práce bylo provést analýzu faktorů ovlivňujících úspěšnost uchování sluchu při mikrochirurgické léčbě VS v neselektovaném souboru pacientů. Hodnoceny byly parametry stran tumoru, pacienta i intraoperační nálezy. Sledován byl také vývoj sluchové poruchy v čase po léčbě.
Soubor a metodika
Prospektivně jsme hodnotili soubor pacientů, kteří byli indikováni k mikrochirurgické léčbě sporadického vestibulárního schwannomu v letech 2008 – 2010. Vstupním kritériem k zařazení do studie byla přítomnost sluchu (PTA < 120 dB a SDS > 1 %) na straně nádoru. Předchozí operace či stereoradiochirurgický zákrok patřily k exkluzivním kritériím ve studii. Pacienti byli plně informováni o plánovaném operačním zákroku i charakteru studie a svou účast stvrdili informovaným souhlasem. Celkově tak bylo zařazeno do studie 81 z 89 pacientů indikovaných v tomto období k operaci. Obecně byli k mikrochirurgické léčbě indikovány tumory s extrameatální komponentou ≥ 2 cm (n = 53). Mikrochirurgie u nádorů menších byla volena pro obtěžující vertigo/ rovnovážné obtíže při ipsilaterální periferní vestibulopatii (n = 10), prokázaný růst v observaci (n = 6), horšení užitečného sluchu v observaci (n = 6) a s ohledem na preferenci pacientů (n = 6).
Ve všech případech byl k odstranění tumoru volen retrosigmoidní ‑ transmeatální přístup. Operace prováděl identický multidisciplinární tým dvou neurootochirurgů a neurochirurga. Standardem byl peroperační neuromonitoring funkce lícního nervu. Monitorování sluchu bylo možné jen u 12 operovaných. Ve zbylých 69 případech nebyla zachovaná odpověď v BAEP umožňující monitoring sluchu. Mimo mikrochirurgickou techniku jsme během 38 operací užili endoskopickou techniku k mapování anatomických poměrů s cílem časné identifikace nervových a cévních struktur, k hodnocení poměrů v oblasti vnitřního zvukovodu (radikalita, identifikace struktur labyrintu a otevření pneumatického systému spánkové kosti) i pro preparaci v oblastech operačním mikroskopem nepřehledných.
Sledovanými demografickými parametry byl věk pacientů a pohlaví. Velikost nádoru byla stanovena měřením max. rozměru na MR v axiální rovině paralelně s dlouhou osou vnitřního zvukovodu, kdy byla měřena jak intra ‑ tak extrameatální část nádoru. K hodnocení stadia jsme pak užívali mezinárodní klasifikaci hodnotící maximální rozměr extrameatální části nádoru (tab. 2) [17]. Hloubka zasahování do vnitřního zvukovodu byla hodnocena v T2 váženém obraze, kdy přítomnost tekutiny laterálně od tumoru byla považována za volný fundus. Sluch byl klasifikován dle GRC (tab. 1). Dále byly analyzovány výsledky subjektivních audiometrických testů (prahy tónové audiometrie na frekvencích 0,5; 1; 2 a 4 kHz, PTA; slovní audiometrie: SDS a práh srozumitelnosti řeči – SRT). Pro hodnocení výsledku BAEP jsme užívali Hannoverskou klasifikaci (tab. 3) [18]. K peroperačním nálezům, které byly analyzovány, patřila krvácivost, konzistence, adheze tumoru k neurovaskulárním strukturám, přítomnost cystické komponenty a úspěšnost identifikace kochleární porce n. VIII. Zajímal nás také dopad užití endoskopické techniky na možnosti zachování kochleárního nervu a sluchu.
Tab. 2. Mezinárodní klasifikace velikosti VS. 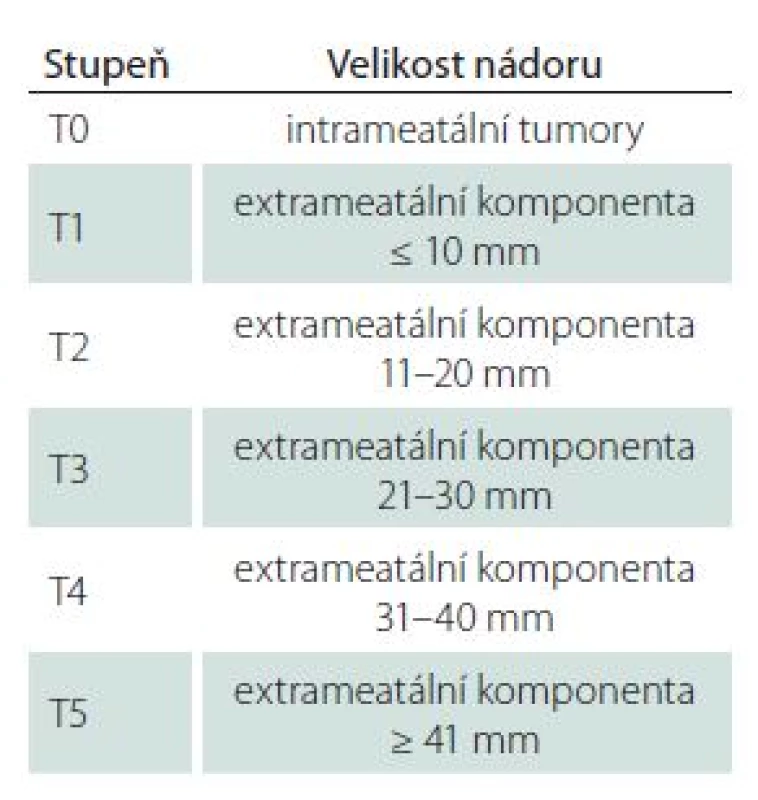
Tab. 3. Hannoverská klasifikace výsledku BAEP (Brainstem Auditory Evoked Potentials). 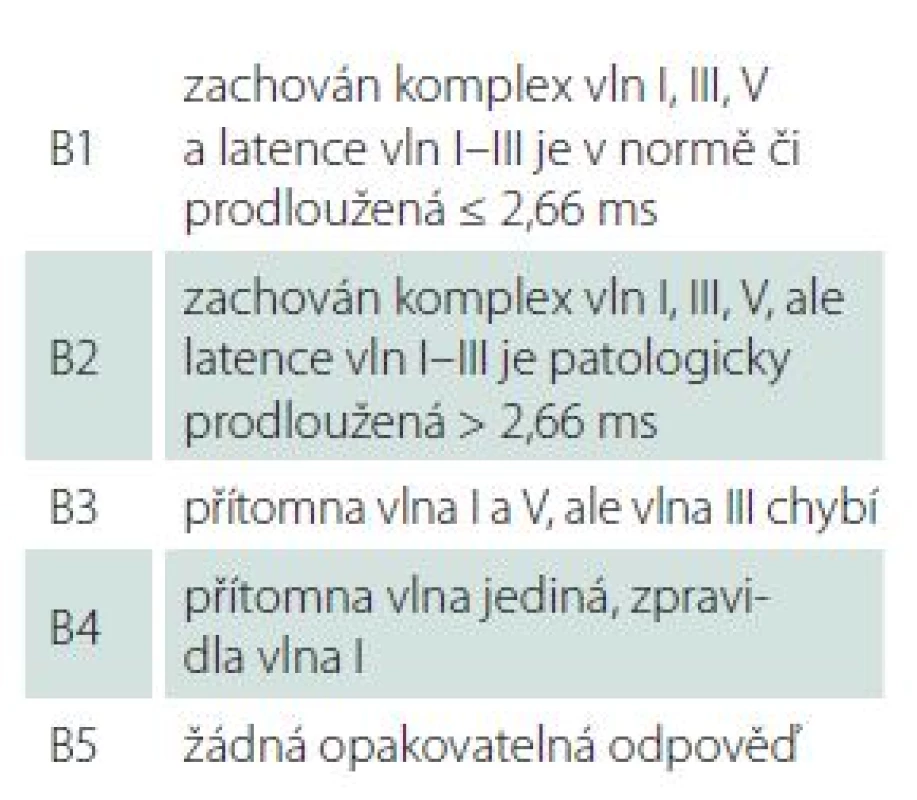
Vzhledem k možnosti deteriorace sluchové funkce s odstupem po výkonu byli pacienti podrobeni dalšímu sledování po dobu dvou let s pravidelnými kontrolami audiometrických parametrů po 6, 12, 24, 36, 48 a event. 60 měsících.
K hodnocení dopadu zachování, resp. ztráty sluchu po operaci byl užit validovaný dotazník hendikepu daného sluchovou poruchou (Hearing Handicap Inventory; HHI) [19].
Statistická analýza byla provedena pomocí programu softwaru Statistica (chí kvadrát test, t‑test, regresivní analýza nezávislých proměnných).
Výsledky
Všechny nádory byly odstraněny makroskopicky radikálně (Gross Total Resection; GTR). U jediné pacientky jsme na kontrolní MR po 24 měsících identifikovali nodulární postkontrastní enhancement ve fundu vnitřního zvukovodu suspektní z recidivy původního onemocnění. Léze je na kontrolních MR stacionární nevyžadující další intervenci. Ve zbylých 80 případech jsou pacienti bez známek původního onemocnění. Výsledky a komplikace léčby shrnují tab. 4 a 5.
Tab. 4. Komplikace mikrochirurgické léčby. 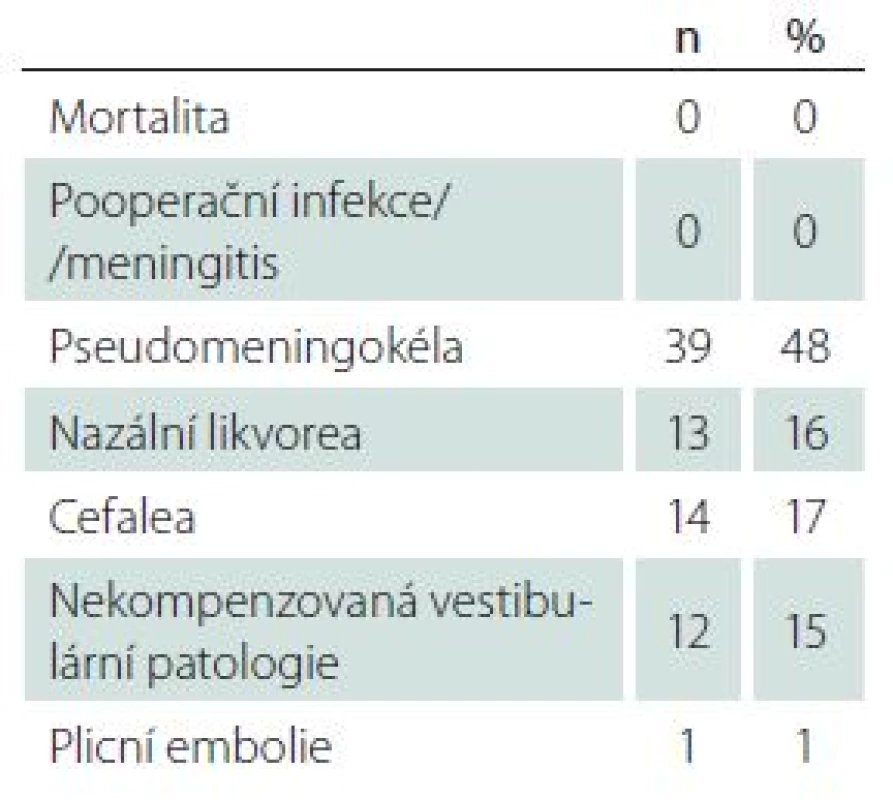
Tab. 5. Výsledky mikrochirurgické léčby. 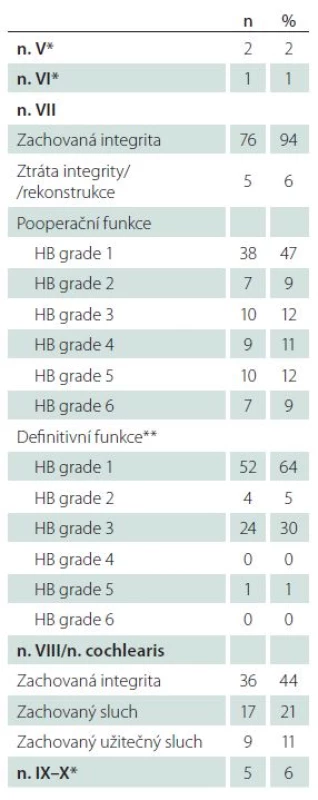
HB – House-Brackmannova klasifikace, *přechodná léze se spontánní úpravou, **hodnoceno při poslední klinické kontrole (36–60 měsíců po léčbě). Přes anatomické zachování kochleárního nervu v 36 případech se podařilo zachovat sluch jen u 17 pacientů (M/ Ž = 11/ 6; 49 ± 11 let, min. 27, max. 64 let). U 64 pacientů je pooperačně prokazována hluchota (M/ Ž = 36/ 28; 45 ± 14 let, min. 19, max. 73 let). Pohlaví, věk pacientů ani strana, na které bylo operováno, neměly vztah k dosaženému výsledku (p = 0,68, p = 0,18, respektive p = 0,13).
Velikost VS byla ve skupině se zachovaným sluchem menší (19 ± 9 mm vs. 29 ± 11 mm) (p < 0,01). Převažovaly tak nádory nižších stadií (p < 0,01) (obr. 1, tab. 6). Míra zasahování do meatu nevykazovala vztah k úspěšnosti zachování sluchu (p = 0,21) (tab. 7).
Tab. 6. Pooperační úroveň sluchu dle Gardner-Robertsonovy (GRC) klasifikace ve vztahu k velikosti nádoru. 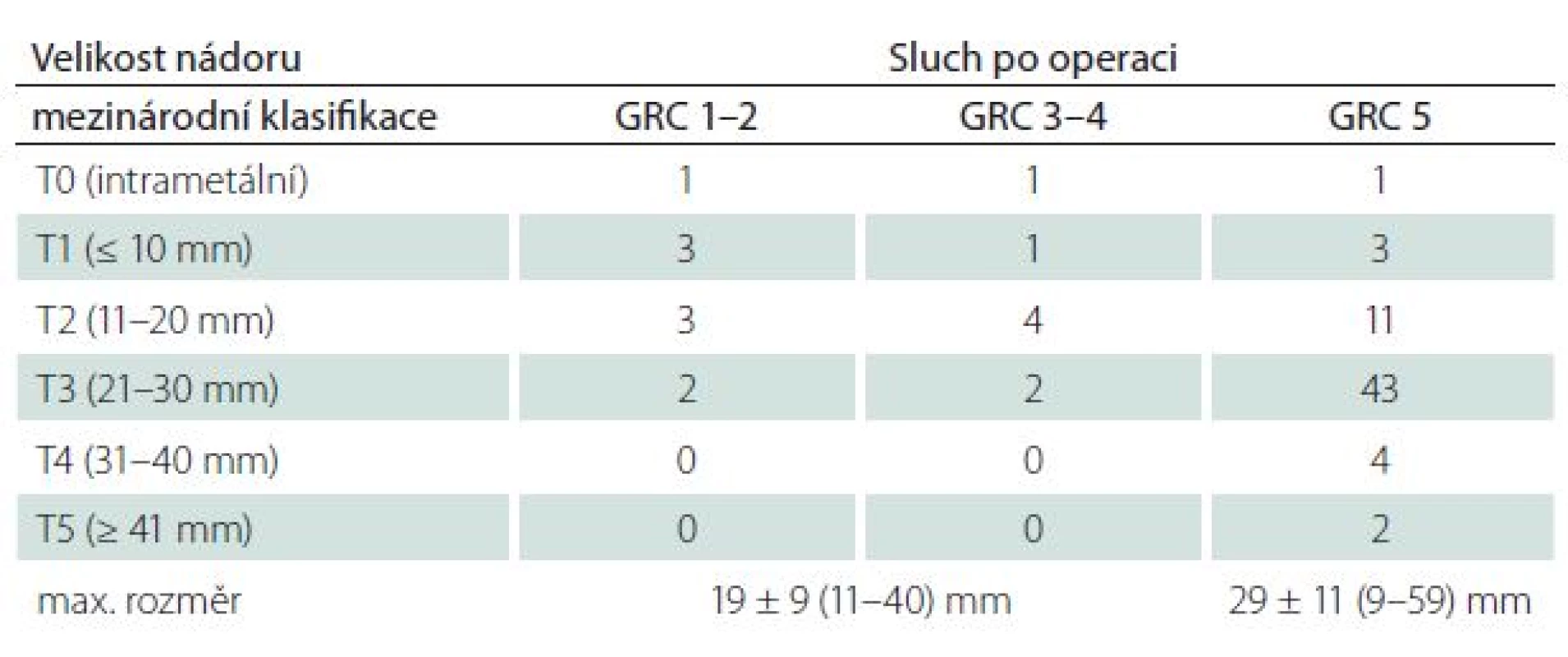
GRC 1–2 – užitečný sluch, GRC 3–4 – neužitečný sluch, GRC 5 – hluchota. Tab. 7. Pooperační úroveň sluchu dle Gardner-Robertsonovy klasifikace (GRS) ve vztahu k zasahování tumoru do fundu vnitřního zvukovodu v T2W MR zobrazení. 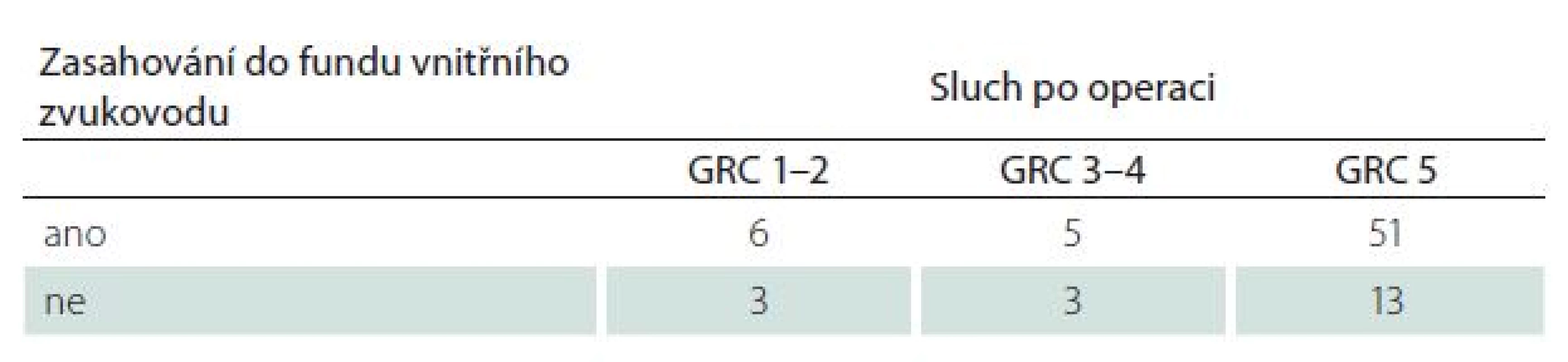
K významným faktorům ovlivňujícím výsledek patřila předoperační úroveň sluchu (sluch uchován: GRC 1 = 6, GRC 2 = 7, GRC 3 = 2, GRC 4 = 2 vs. ztráta sluchu: GRC 1 = 12, GRC 2 = 18, GRC 3 = 20, GRC 4 = 14) (p < 0,01) (obr. 1). Ve skupině pacientů se zachovaným sluchem byl pooperačně prokazován užitečný sluch u devíti pacientů (GRC 1 = 3, GRC 2 = 6) a neužitečný sluch u osmi pacientů (GRC 3 = 3, GRC 4 = 5). U dvou pacientů jsme zaznamenali pooperačně zlepšení sluchu z neužitečné úrovně na sluch užitečný. Ve skupině pacientů s pooperačně zachovaným sluchem byly hodnoty tři měsíce po zákroku PTA 52 ± 22 (23 – 105) dB a SDS 51 ± 43 (0 – 100) %. V souladu s výsledkem kategorizace sluchové poruchy dle GRC korelovaly i vybrané parametry jednotlivých subjektivních audiometrických metod s úspěšností uchování sluchu po operaci. Ve skupině se zachovaným sluchem byly nižší ztráty na frekvencích 0,5; 1 a 2 kHz, celkově nižší hodnoty PTA i SRT (všechny parametry p < 0,01) a současně vyšší hodnota SDS (p = 0,05).
Obr. 1. Ilustrační foto – endoskopicky asistovaná mikrochirurgická exstirpace VS retrosigmoidním-transmeatálním přístupem s uchováním intaktního n. VII a užitečného sluchu. 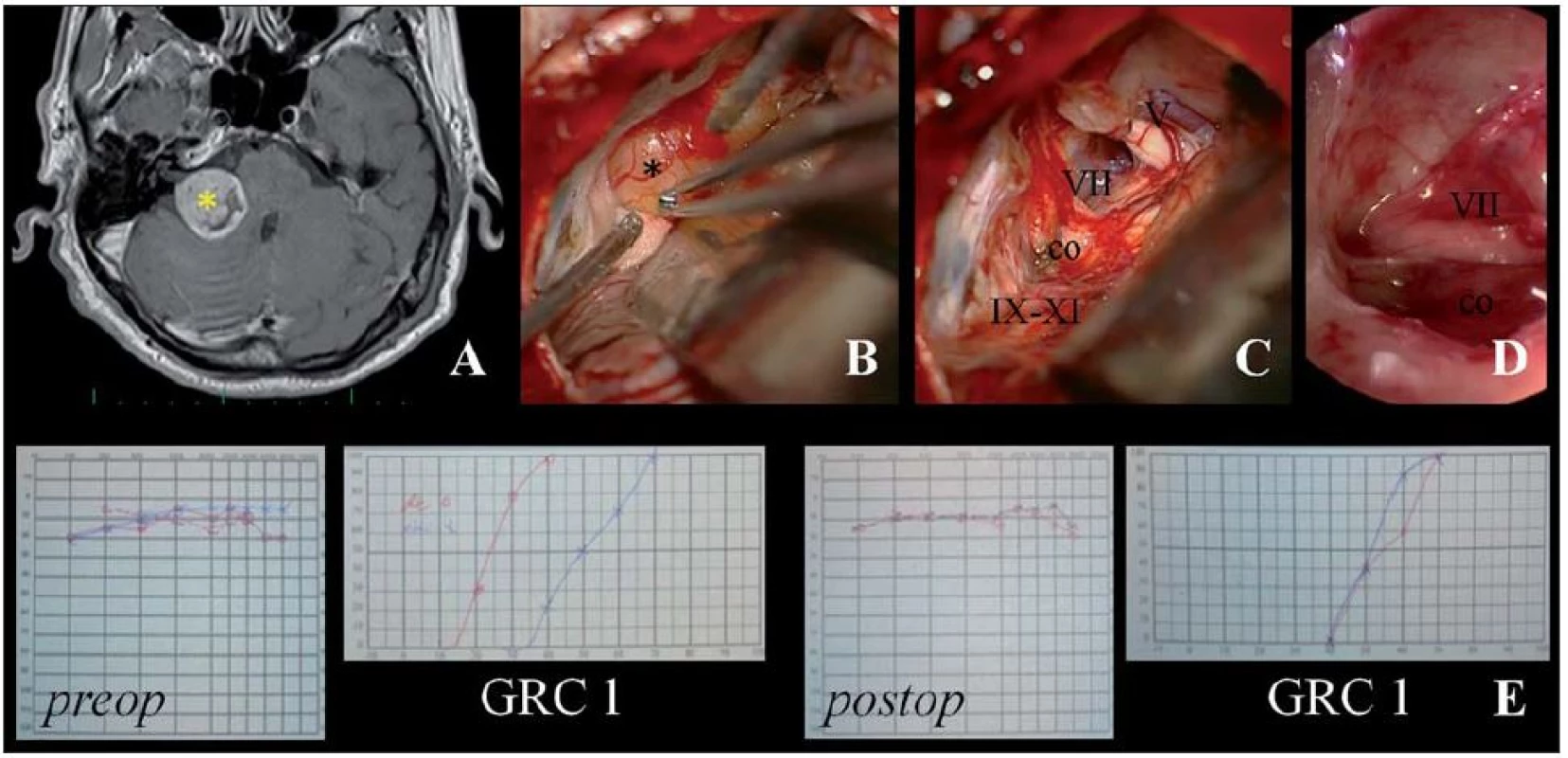
Obr. 1A) Předoperační MR demonstrující VS vpravo ve stadiu T3 (*). Obr. 1B) Pohled operačním mikroskopem s identifikací n. cochlearis na spodní ploše tumoru. Obr. 1C) Stav po radikálním odstranění tumoru (co: n. cochlearis, VII: n. facialis, V: n. trigeminus, IX–XI: n. glossopharyngeus, vagus a akcesorius). Obr. 1D) Endoskopický pohled do vnitřního zvukovodu ověřující radikální odstranění, integritu n. cochlearis, n. facialis, a. labyrinthi. Obr. 1E) Předoperační (preop) a pooperační (postop) nález v tónové a slovní audiometrii demonstrující uchování užitečného sluchu – 1. stupeň dle Gardner-Robertsonovy klasifikace (GRC 1). Úspěšnost uchování sluchu určovala také nález předoperační BAEP (sluch uchován: B2 = 5, B3 = 4, B4 = 1, B5 = 7 vs. ztráta sluchu: B1 = 1, B2 = 8, B3 = 10, B4 = 2, B5 = 51) (p = 0,03). S ohledem na nález byla klíčovým parametrem přítomnost vlny V (p < 0,01). Přes potenciální limity intraoperačních BAEP, neuromonitoring sluchu jako takový umožňoval jako jediný hodnotit zachování integrity sluchového aparátu. Nepřekvapilo tedy, že užití intraoperačních BAEP představovalo jeden z nejvýznamnějších prognostických parametrů (p < 0,01). Po ukončení exstirpace VS byla zachována odpověď v BAEP jen v pěti z 12 případů monitoringu sluchu. I tak zůstal sluch zachován v pěti případech s vymizením odpovědi v průběhu odstraňování nádoru a dále v sedmi případech, kdy nebylo možné monitorování sluchu užít pro nevýbavnou odpověď. V tomto kontextu je zajímavé, že úspěšnost zachování BAEP během operace s uchováním sluchu nekorelovala. Nebyl prokázán vztah k zachování odpovědi v BAEP ve vztahu k úrovni uchovaného sluchu (p = 0,48).
Uchování sluchu bylo příznivě ovlivněno užitím endoskopické techniky (p < 0,01). Ke klíčovým faktorům ovlivňujícím možnost uchování sluchu logicky patřila intraoperační identifikace struktur kochleárního nervu (p < 0,01). Rozpoznání n. VIII včetně kochleární porce nečinilo větší obtíže u nádorů ve stadiu T0 – T2. U nádorů větších bylo zpravidla možné diferencovat struktury n. VIII ve vnitřním zvukovodu. V oblasti mozkového kmene a mostomozečkového koutu se podařilo domnělou kochleární porci n. VIII identifikovat jen v 18 z 53 případů, vždy na inferiorním či posteroinferiorním pólu tumoru (obr. 1). Pro zachování sluchu bylo neméně významné šetření cévního zásobení doprovázejícího akustikofaciální svazek k fundu vnitřního zvukovodu. Jasně diferencovatelnou a. labyrinthi jsme prokázali jen během 31 operací.
Možnost šetření neurovaskulárních struktur odrážející uchování sluchu byla korelována s některými vlastnostmi nádoru, především absencí adhezí ke kochleárnímu nervu (p < 0,01) a měkká konzistence tumoru (p = 0,05). Krvácivost nádoru ani přítomnost cystické komponenty úspěšnost uchování sluchu neovlivnily.
Snaha o zachování sluchu měla negativní dopad na eliminaci předoperačně přítomného tinnitu (p = 0,04). Ve skupině pacientů se zachovaným sluchem pooperačně tinnitus vymizel u tří ze 13 pacientů, vždy v případě uchování užitečného sluchu. Naopak ve skupině s pooperační hluchotou došlo k vymizení tinnitu ve 28 z 53 pacientů.
S ohledem na vývoj funkce po operaci jsme ve skupině pacientů s uchovaným sluchem zaznamenali vývoj u čtyř pacientů. U jedné pacientky s užitečným sluchem v úrovni GRC 2 došlo v intervalu šesti měsíců ke zlepšení sluchu do úrovně GRC 1. K horšení sluchu došlo u tří pacientů, vždy ve skupině s neužitečným sluchem. Jednalo se o zhoršení sluchu izolovaně na straně provedené operace. Vývoj sluchové poruchy nebyl zaznamenán samotnými pacienty. V tónové audiometrii bylo sledováno zhoršení na středních a vysokých frekvencích se změnou PTA o 10 – 20 dB doprovázené poklesem SDS o 10 – 25 %. Ve všech případech došlo k deterioraci mezi 12 a 24 měsícem po operaci. Přes zhoršení všech sledovaných parametrů tónové i slovní audiometrie zůstala úroveň sluchové poruchy v GRC beze změn. Ve skupině pacientů s pooperačně zachovaným sluchem byly recentní hodnoty PTA 54 ± 23 (17 – 105) dB a SDS 53 ± 45 (0 – 100) %.
Bez ohledu na úspěšnost zachování sluchu jsme obecně zaznamenali horšení HHI v důsledku operace. Ve skupině se zachovaným sluchem dosahovaly hodnoty HHI před operací 23 ± 26 (0 – 86) a po operaci 30 ± 20 (10 – 64). Ve skupině se ztrátou sluchu byly hodnoty HHI před operací 18 ± 19 (0 – 80) a po operaci 31 ± 22 (0 – 100). Přes trend k výraznějšímu poklesu skóre HHI ve skupině se ztrátou sluchu nebyl ve skóre před - ani pooperačního HHI v obou skupinách statisticky významný rozdíl (p = 0,48 a p = 0,85).
Diskuze
Zda patří zachování sluchu k hlavním cílům léčby VS, zůstává v mnohém kontroverzní. Řada studií však prokazuje, že jednostranná hluchota výrazným způsobem narušuje kvalitu života [20,21].
Jako první o zachování sluchu při mikrochirurgické léčbě VS referovali již v roce 1954 Elliott a McKissock, a to u dvou ze tří operovaných pacientů [22]. Zvrat do problematiky vnesl pionýr neurootochirurgie House, který v 60. letech 20. století rozpracoval mikrochirurgii VS subtemporálním přístupem. Zachování sluchu se tak stalo reálným cílem především u intrameatálních nádorů [23]. Na dosažené výsledky navázali především neurochirurgové v 70. a 80. letech 20. století úspěchy v uchování sluchu retrosigmoidním ‑ transmeatálním přístupem [3,24,25]. V bývalém Československu jako první referovali o zachování sluchu při užití mikrochirurgické techniky Zvěřina et al již v roce 1983 [26]. Z českých autorů pak o zachování sluchu ve větším souboru pacientů dále informovali Mrázek et al a Skřivan et al [27,28].
Ve vztahu k zachování sluchu obdobně jako v případě mikrochirurgie prošla významným vývojem i léčba stereoradiochirurgická. Mimo inovace technické bylo pro optimalizaci výsledků klíčové snížení léčebné dávky ozáření ve snaze o eliminaci rizik a komplikací léčby bez současného negativního dopadu na ovlivnění růstu léčených schwannomů. Při stávajících dávkách ozáření, kdy po léčbě gama nožem je dosahováno kontroly nádoru ve více než 90 %, je úspěšnost zachování sluchu kolem 50 % (0 – 100 %). K hlavním faktorům ovlivňujícím výsledek patří dávka dosažená na periferii, kdy při dávce ≤ 13 Gy je dosahováno lepších výsledků. Na rozdíl od mikrochirurgie nebyl prokázán vztah mezi celkovými rozměry léčených nádorů, resp. jejich volumem a zachováním sluchu. I některé z dalších významných faktorů ovlivňujících výsledky mikrochirurgie (např. věk) se nezdají mít pro výsledky ozáření významnější dopad [4,9].
Zachování sluchu při operaci VS představuje vysoce komplexní problematiku závislou na řadě proměnných. Četné studie prokázaly, že k hlavním faktorům ovlivňujícím dosažené výsledky patří typ operačního přístupu, velikost nádoru, věk pacientů a užití monitoringu sluchu [29]. V souladu s publikovanými daty se i v našem souboru jeví velikost tumoru, stupeň sluchové poruchy, typ odpovědi a možnost intraoperačního užití BAEP jako klíčové faktory uchování sluchu.
Někteří přední světoví odborníci považují nádory s extrameatální komponentou větší než 2 cm za neperspektivní ke sluch šetřícímu přístupu, a preferují tak labyrint nešetřící přístupy s ohledem na menší zátěž, excelentní výsledky zachování n. VII a minimum komplikací [12]. Jiní autoři naopak demonstrují úspěšnost zachování sluchu i v této skupině v rozmezí 9 – 28 % [13,18,30 – 35]. V analyzovaném souboru tvořily velké nádory s extrameatální komponentou > 2 cm 65 % případů. Přestože se podařilo zachovat kochleární porci n. VIII v této skupině jen v 34 % případů a celková úspěšnost uchování sluchu činila pouze 8 %, byl současně podíl zachování předoperačně užitečného sluchu 20 %. Výsledky této studie tak prokazují úspěšnost zachování sluchu i v selektované skupině velkých nádorů. Mnohem optimističtější výsledky byly dosaženy u nádorů malých. V této skupině činila úspěšnost uchování kochleárního nervu 64 % při současně uchovaném sluchu v 46%, resp. užitečném sluchu v 44 % případů.
Studie nepotvrdila, že stupeň zasahování tumoru do vnitřního zvukovodu je klíčovým faktorem determinujícím výsledek [30]. Naopak multifaktoriální analýza demonstrovala, že některé z vlastností nádoru, především konzistence a stupeň adhezi k neurovaskulárním strukturám, patří mezi klíčové prediktivní faktory ovlivňující úspěšnost uchování sluchu. Tento fakt nabývá na významnosti i s ohledem na možnost předoperačního zhodnocení konzistence tumoru v MR obraze [36].
V literatuře bývají popisovány případy zlepšení sluchu po operaci VS [37]. V našem souboru jsme zlepšení sluchu, a to z úrovně neužitečné do úrovně užitečné, zaznamenali jen v 2 % případů. V jednom případě šlo o malý tumor, kdy jsme změnili strategii z observace v mikrochirurgii právě pro horšení sluchu z užitečné do neužitečné úrovně. V druhém případě šlo o velký tumor s relativně krátkou anamnézou rychle progredující sluchové poruchy. Celkově tak považujeme zlepšení sluchu po operaci VS za raritní záležitost.
Jen omezené množství prací se zaměřilo na dlouhodobé výsledky a stabilitu uchovaného sluchu po mikrochirurgické léčbě. K potenciálním příčinám pozdního horšení sluchu patří narušení cévního zásobení labyrintu a struktur vnitřního zvukovodu v důsledku fibrózy a jizvení, i mikroskopická recidiva tumoru s infiltrací n. VIII nebo endolymfatický hydrops. Shelton et al udávají, že k významnému poklesu sluchu po exstirpaci VS subtemporálním přístupem došlo v 56 % případů [38]. Pozdější práce ze stejného pracoviště udává, že s odstupem více než pět let po operaci nedošlo k horšení sluchu [39]. V případě retrosigmoidního ‑ transmeatálního přístupu bylo pozdní horšení sluchu zaznamenáno v rozmezí 18 – 40 % [40 – 43]. Nebyl zaznamenán vztah k věku, velikosti nádoru ani předoperační úrovni sluchu. V našem souboru s pooperačním sledováním 4 – 6 let jsme zjistili pozdní horšení sluchu jen ve třech ze 17 případů (18 %) uchovaného sluchu. Vždy šlo o horšení již tzv. neužitečného sluchu. Nepozorovali jsme žádnou deterioraci v případě uchování užitečného sluchu.
Byť výsledky této studie o zachování sluchu při mikrochirurgické léčbě VS jsou nanejvýše optimistické, je zajímavé, že jsme neprokázali významné rozdíly v míře subjektivních obtíží (HHI) v případě zachování nebo naopak ztráty sluchu. Tento závěr je dále podtržen prozatím nepublikovanými výsledky u pacientů ze stejného souboru, kteří byli následně rehabilitováni pro jednostrannou hluchotu pomocí BAHA. Kdy skóre v HHI byly nejnižší v případě rehabilitované hluchoty, a to dokonce i ve srovnání s předoperačně užitečným sluchem.
Závěr
Zachování sluchu patří mezi cíle moderní léčby VS. Bližší zjištění prediktivních faktorů určujících úspěšnost zachování sluchu jednotlivými modalitami je klíčové pro stanovení optimálního léčebného postupu i odpovídající informování pacienta. Předmětem zájmu nadcházejícího výzkumu by mělo být pochopení mechanizmů podílejících se na deterioraci sluchových funkcí, a to jednak v důsledku aktivní léčby, jednak v dlouhodobém měřítku po ní.
Práce vznikla za podpory výzkumných projektů Ministerstva zdravotnictví České republiky IGA MZ ČR NT/ 12459 - 5 a NT/ 11543-6, a dále pak projektů Karlovy univerzity PRVOUK⁄LF1⁄P27 a specifického výzkumného záměru SVV UK 266513 a UNCE 204013.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 14. 8. 2014
Přijato do tisku: 4. 5. 2015
as. MUDr. Martin Chovanec, Ph.D.
Klinika otorinolaryngologie a chirurgie hlavy a krku
1. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: martin.chovanec@lf1.cuni.cz
Zdroje
1. Zvěřina E. Neurinom akustiku – vestibulární schwannom – osobní pohled na nejmodernější postupy v jeho léčbě. Cas Lek Cesk 2010; 149(6): 269 – 276.
2. Sughrue ME, Yang I, Aranda D, Lobo K, Pitts LH, Cheung SW et al. The natural history of untreated sporadic vestibular schwannomas: a comprehensive review of hearing outcomes. J Neurosurg 2010; 112(1): 163 – 167. doi: 10.3171/ 2009.4.JNS08895.
3. Samii M, Gerganov V, Samii A. Hearing preservation after complete microsurgical removal in vestibular schwannomas. Prog Neurol Surg 2008; 21 : 136 – 141. doi: 10.1159/ 000156900.
4. Yang I, Sughrue ME, Han SJ, Aranda D, Pitts LH, Cheung SW et al. A comprehensive analysis of hearing preservation after radiosurgery for vestibular schwannoma. J Neurosurg 2010; 112(4): 851 – 859. doi: 10.3171/ 2009.8.JNS0985.
5. Rutka J. What would you do if you had a small vestibular schwannoma? An apocryphal tale. Clin Otolaryngol 2008; 33(3): 236 – 238. doi: 10.1111/ j.1749 ‑ 4486.2008.01732.x.
6. Misra BK, Purandare HR, Ved RS, Bagdia AA, Mare PB. Current treatment strategy in the management of vestibular schwannoma. Neurol India 2009; 57(3): 257 – 263. doi: 10.4103/ 0028 ‑ 3886.53263.
7. Morrison D. Management of patients with acoustic neuromas: a Markov decision analysis. Laryngoscope 2010; 120(4): 783 – 790. doi: 10.1002/ lary.20819.
8. Holý R, Skutil J, Navar M, Praženica P, Fundová P, Hahn A.Úloha neurootologa v záchytu poradiačních komplikací u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem. Cesk Slov Neurol N 2013; 76/ 109(2), 191 – 196.
9. Holý R, Praženica P, Fundová P, Kovář D, Skutil J, Hahn A. Ovlivnění funkce sluchové dráhy u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem. Cesk Slov Neurol N 2014; 77/110(2): 223 – 229.
10. Gardner G, Robertson JH. Hearing preservation in unilateral acoustic neuroma surgery. Ann Otol Rhinol Laryngol 1988; 97(1): 55 – 66.
11. American Academy of Otolaryngology ‑ Head and Neck Surgery Foundation, INC. Committee on Hearing and Equilibrium guidelines for the evaluation of hearing preservation in acoustic neuroma (vestibular schwannoma). Otolaryngol Head Neck Surg 1995; 113(3): 179 – 180.
12. Sanna M, Khrais T, Russo A, Piccirillo E, Augurio A. Hearing preservation in vestibular schwannoma: the hidden truth. Ann Otol Rhinol Laryngol 2004; 113(2): 156 – 163.
13. Wanibuchi M, Fukushima T, McElveen JT jr, Friedman AH.Hearing preservation in surgery for large vestibular schwannomas. J Neurosurg 2009; 111(4): 845 – 854. doi: 10.3171/ 2008.12.JNS08620.
14. Lenarz T, Ernst A. Intraoperative monitoring by transtympanic electrocochleography and brainstem electrical response audiometry in acoustic neuroma surgery. Eur Arch Otorhinolaryngol 1992; 249(5): 257 – 262.
15. Kluh J, Šmilauer T, Zvěřina E, Betka J. Přínos BERA k diagnostice neurinomů akustiku. Otorinolaryng a Foniat (Praha) 1999; 45(2): 26 – 30.
16. Aihara N, Murakami S, Watanabe N, Takahashi M, Inagaki A, Tanikawa M et al. Cochlear nerve action potential monitoring with the microdissector in vestibular schwannoma surgery. Skull Base 2009; 19(5): 325 – 332. doi: 10.1055/ s ‑ 0029 ‑ 1220208.
17. Kanzaki J, Tos M, Sanna M, Moffat DA, Monsell EM, Berliner KI. New and modified reporting systems from the consensus meeting on systems for reporting results in vestibular schwannoma. Otol Neurotol 2003; 24(4): 642 – 648.
18. Matthies C, Samii M. Management of vestibular schwannomas (acoustic neuromas): the value of neurophysiology for evaluation and prediction of auditory function in 420 cases. Neurosurgery 1997; 40(5): 919 – 929.
19. Chovanec M, Zvěřina E, Profant O, Skřivan J, Čakrt O,Lisý J et al. Impact of video ‑ endoscopy on the results of retrosigmoid ‑ transmeatal microsurgery of vestibular schwannoma: prospective study. Eur Arch Otorhinolaryngol 2013; 270(4): 1277 – 1284. doi: 10.1007/ s00405 ‑ 012 ‑ 2112 ‑ 6.
20. Wiegand DA, Fickel V. Acoustic neuroma ‑ the patients perspective: Subjective assessment of symptoms, diagnosis, therapy, and outcome in 541 patients. Laryngoscope 1989; 99(2): 179 – 187.
21. Gauden A, Weir P, Hawthorne G, Kaye A. Systematic review of quality of life in the management of vestibular schwannoma. J Clin Neurosci 2011; 18(12): 1573 – 1584. doi: 10.1016/ j.jocn.2011.05.009.
22. Elliott FA, McKissock W. Acoustic neuroma; early diag-nosis. Lancet 1954; 267(6850): 1189 – 1191.
23. Wade PJ, House W. Hearing preservation in patients with acoustic neuromas via the middle fossa approach. Otolaryngol Head Neck Surg 1984;w 99(2): 184 – 193.
24. Pertuiset B, Maspetiol R, Semette D, Paychere G. La conservation des fonctions auditive et faciale au cours de l‘exerese totale des neurinomas de l‘acoustique par voie sous occipitale. La Presse Medicale 1966; 74(45): 2327 – 2330.
25. Jannetta PJ, Møller AR, Møller MB. Technique of hearing preservation in small acoustic neuromas. Ann Surg 1984; 200(4): 513 – 523.
26. Zvĕřina E, Fusek I, Kunc Z, Sobota J, Stejskal L. První zkušenosti s mikrochirurgií nádorů n. VIII. Cesk Slov Neurol N 1983; 46/ 79(5): 287 – 292.
27. Mrázek J, Paleček T, Wolný E, Mrázková E. Optimální přístupová cesta k tumorům mostomozečkového koutu (univerzální cesta či eklektická filozofie při volbě přístupu?). Otorinolaryng a Foniat (Praha) 2001; 47(3): 152 – 155.
28. Skřivan J, Zvĕřina E, Betka J, Kluh J, Kraus J. Our surgical experience with large vestibular schwannomas. Otolaryngol Pol 2004; 58(1): 69 – 72.
29. Kari E, Friedman RA. Hearing preservation: microsurgery. Curr Opin Otolaryngol Head Neck Surg 2012; 20(5): 358 – 366. doi: 10.1097/ MOO.0b013e3283579673.
30. Somers T, Casselman J, de Ceulaer G, Govaerts P, Offeciers E. Prognostic value of magnetic resonance imaging findings in hearing preservation surgery for vestibular schwannoma. Otol Neurotol 2001; 22(1): 87 – 94.
31. Lassaletta L, Fontes L, Melcon E, Sarria MJ, Gavilan J. Hearing preservation with the retrosigmoid approach for vestibular schwannoma: myth or reality? Otolaryngol Head Neck Surg 2003, 129(4): 397 – 401.
32. Samii M, Gerganov VM, Samii A. Functional outcome after complete surgical removal of giant vestibular schwannomas. J Neurosurg 2010; 112(4): 860 – 867. doi: 10.3171/ 2009.7.JNS0989.
33. Rabelo de Freitas M, Russo A, Sequino G, Piccirillo E, Sanna M. Analysis of hearing preservation and facial nerve function for patients undergoing vestibular schwannoma surgery: the middle cranial fossa approach versus the retrosigmoid approach ‑ personal experience and literature review. Audiol Neurootol 2012; 17(2): 71 – 81. doi: 10.1159/ 000329362.
34. Wanibuchi M, Fukushima T, Friedman AH, Watanabe K, Akiyama Y, Mikami T et al. Hearing preservation surgery for vestibular schwannomas via the retrosigmoid transmeatal approach: surgical tips. Neurosurg Rev 2014; 37(3): 431 – 444. doi: 10.1007/ s10143 ‑ 014 ‑ 0543 ‑ 9.
35. Tatagiba M, Roser F, Schuhmann MU, Ebner FH. Vestibular schwannoma surgery via the retrosigmoid transmeatal approach. Acta Neurochir (Wien) 2014(2): 421 – 425. doi: 10.1007/ s00701 ‑ 013 ‑ 1915 ‑ 6.
36. Copeland WR, Hoover JM, Morris JM, Driscoll CL, Link MJ. Use of preoperative MRI to predict vestibular schwannoma intraoperative consistency and facial nerve outcome. J Neurol Surg B Skull Base 2013; 74(6): 347 – 350. doi: 10.1055/ s ‑ 0033 ‑ 1347369.
37. Sameš M, Vachata P. Complete hearing restoration in vestibular schwannoma with repeated sudden hearing loss. Cesk Slov Neurol N 2010; 73/ 106(3): 299 – 302.
38. Shelton C, Hitselberger WE, House WF, Brackmann DE.Hearing preservation after acoustic neuroma removal: long term results. Laryngoscope 1990; 100(2): 115 – 119.
39. Friedman RA, Kesser B, Brackmann DE, Fisher LM, Slattery WH, Hitselberger WE. Otolaryngol Head Neck Surg 2003; 129(6): 660 – 665.
40. McKenna MJ, Halpin C, Ojemann RG, Nadol JB jr, Montgomery WW, Levine RA, et al. Long‑term hearing results in patients after surgical removal of acoustic tumors with hearing preservation. Am J Otol 1992; 13(2): 134 – 136.
41. Tucci DL, Telian SA, Kileny PR, Hoff JT, Kemink JL. Stability of hearing preservation following acoustic neuroma surgery. Am J Otol 1994; 15(2): 183 – 188.
42. Chee GH, Nedzelski JM, Rowed D. Acoustic neuroma surgery: the results of long‑term hearing preservation. Otol Neurotol 2003; 24(4): 672 – 676.
43. Mazzoni A, Zanoletti E, Calabrese V. Hearing preservation surgery in acoustic neuroma: long‑term results. Acta Otorhinolaryngol Ital 2012; 32(2): 98 – 102.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Projekt ncRNAPainČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Experimentální léčba poranění míchy
- Význam magnetické rezonance v diagnostice epilepsie
- Možnosti sledování a hodnocení kvality života u dětí a dospívajících s epilepsií ve světě a v České republice
- Prionový protein, jeho úloha v buněčné proliferaci, diferenciaci a vývoji nervové soustavy
- Předpověď úspěšnosti a selhání endoskopické ventrikulocisternostomie III. komory
- Změny efektivní konektivity po facilitační fyzioterapii u roztroušené sklerózy mozkomíšní
- Projekt ncRNAPain
- Snížení rizika vzniku mozkového infarktu v průběhu kardiochirurgické operace pomocí sonolýzy – pilotní výsledky
- Zachování sluchu při mikrochirurgické léčbě vestibulárního schwannomu
- Validace české verze komplexního protokolu kvantitativního testování senzitivity
- Neurologické syndromy sdružené s protilátkami proti membránovým a synaptickým antigenům
- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Syndrom Freyové (aurikulotemporální syndrom) po parotidektomii a jeho prevence
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
- Úspěšná léčba anti‑MAG neuropatie asociované s monoklonální gamapatií nejistého významu kombinací rituximabu s dexametazonem – kazuistika
- Žilní trombóza jako komplikace ventrikuloatriálního shuntu – kazuistika
- Spinocerebelární ataxie typu 6 – kazuistika
- Diastematomyelie u dospělých – kazuistika
- Webové okénko
-
Analýza dat v neurologii
LII. Odhad poměru šancí u složitějších tabulek četností
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Význam magnetické rezonance v diagnostice epilepsie
- Experimentální léčba poranění míchy
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



