-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Experimentální léčba poranění míchy
Experimental Treatment of Spinal Cord Injuries
Spinal cord injuries still remain incurable in current clinical practice. Standard therapy focuses on early decompression and stabilization of the injured spine together with prevention of a secondary injury. On the other hand, several experimental therapies are being developed in laboratories. Some of these showed partial functional and morphological effect in laboratory animals. Over the last 20 years, some of the experimental therapies have been applied in clinical studies but did not provide unambiguous results. In the present paper, we provide an overview of current clinical and experimental therapies of spinal cord injuries.
Key words:
spinal cord injury – stem cells – biomaterials – regeneration – experimental treatment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: A. Hejčl 1–3; P. Jendelová 2,4; M. Sameš 1; E. Syková 2,4
Působiště autorů: Neurochirurgická klinika UJEP a Krajská zdravotní a. s., Masarykova nemocnice v Ústí nad Labem, o. z. 1; Ústav experimentální medicíny AV ČR, v. v. i., Praha 2; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně 3; Ústav neurověd, 2. LF UK v Praze 4
Vyšlo v časopise: Cesk Slov Neurol N 2015; 78/111(4): 377-392
Kategorie: Minimonografie
doi: https://doi.org/10.14735/amcsnn2015377Souhrn
Poranění míchy není v současném stavu poznání v klinické praxi stále léčitelné. Standardní péče se tak soustředí na včasnou dekompresi míchy, stabilizaci poraněné páteře a prevenci sekundárního míšního poranění. Na druhou stranu se v experimentální oblasti rozvíjí velké množství nových terapeutických postupů. Některé z nich prokázaly částečný funkční a morfologický efekt u laboratorních zvířat. V posledních 20 letech pak byly tyto experimentální postupy aplikovány i v klinických studiích, zatím však bez jednoznačných výsledků. V této práci poskytujeme souhrn současného stavu klinické a především experimentální terapie míšního poranění.
Klíčová slova:
míšní poranění – kmenové buňky – biomateriály – regenerace – experimentální léčbaÚvod
Poranění míchy je jedno z nejzávažnějších typů traumat. Jeho následky často vedou k celoživotnímu deficitu hybnosti, čití a vegetativního systému. Doposud pro pacienty s poraněním míchy neexistuje léčba, která by umožnila obnovu poškozených funkcí. V klinické praxi tak zůstává hlavním principem terapie časná dekomprese a stabilizace poraněné páteře, prevence sekundárního míšního poranění a s ním související komplikace s následnou intenzivní rehabilitací. Na poli experimentální léčby existuje široké spektrum metod, které jsou vyvíjeny s cílem ovlivnit jednotlivé fáze patofyziologie míšního poranění jako je neuroplasticita, regenerace míšních drah a obnova ztracených funkcí. V následující práci poskytujeme krátký souhrn nejvýznamnějších experimentálních metod v léčbě míšního poranění, včetně proběhlých klinických studií.
Historie
Trauma páteře a míchy je staré jako lidstvo samo. První známý doklad je papyrus Edwina Smithe. Jeho vznik se datuje do 17. století před n. l. Jedná se o starý egyptský text, kde neznámý písař opisoval poučení a rady lékaře z roku 3000 před n. l. V kapitole 31 je poprvé písemná zmínka o míšním poranění. V závěru pak autor o míšním poranění konstatuje, že se jedná o „nemoc, která nemůže být ošetřena“ [1]. Dle některých je autorem těchto poučení sám Imhotep [2]. Další významnou érou byla doba Hippokrata a Galéna. Hippokrates jako první popsal klinický obraz chronické paralýzy a s tím souvisejících symptomů jako jsou obstipace, močové obtíže, dekubity či venostáza dolních končetin. Sám vyvinul trakční metody k redukci deformit páteře, příkladem je trakční lavice („scamnum“) [3]. K chápání míšního poranění významným krokem přispěl Aulus Cornelius Celsus (30 před n. l.), který jako první popsal klíčovou roli míchy. Aretaeus (150 před n. l.) pak definoval míšní segmenty. Galén (150 let před n. l.) jako první experimentálně prokázal, že poranění míchy vede k ochrnutí a ztrátě citlivosti pod místem poranění [4].
V době středověku se začaly rozvíjet i chirurgické metody. Pavel z Aeginy (625 – 690) přišel s konceptem dekompresivní operace (laminektomie) u míšního poranění [5]. Přesto bylo i nadále dost autorit, které považovaly jakékoliv snahy o chirurgické řešení míšního poranění za beznadějné (LanFrank, Guy de Chauliac). Renesance chirurgických metod přišla ve stejnojmenném období (např. Ambroise Paré) [6]. Nicméně chirurgické dekompresivní operace byly většinou neúspěšné, proto převažoval spíše postoj konzervativní a autority té doby byly proti operační léčbě, kterou považovaly za „krvavou, nebezpečnou a neospravedlnitelnou“ [7].
Na přelomu 19. a 20. století započaly experimentální studie na psech, morčatech či králících. Zásadní počin v experimentálním poranění míchy byl výzkum Alfreda Reginalda Allena, jehož výsledky ovlivnily vývoj na mnoho desítek let [8]. K experimentální míšní lézi použil závaží o definovaných hmotnostech, čímž docílil reprodukovatelného modelu experimentálního poranění míchy, který se v různých modifikacích používá dodnes. Již tehdy přišel s názorem, že toxiny můžou být příčinou sekundárního míšního poranění, což byla první primitivní zmínka o konceptu sekundárního míšního poranění.
V první polovině 20. století začala vznikat centra pro léčbu pacientů s míšní lézí. Nutno zdůraznit průkopnické úsilí především dr. Donalda Munroa z Bostonu a Sira Ludwiga Guttmanna z Velké Británie. Tito „otcové“ paraplegiků založili a vedli ústavy pro pacienty s poraněním míchy, s důrazem na komplexní léčbu komplikací míšního poranění a rehabilitaci těchto pacientů. Stali se tak vzorem pro rozvoj podobných ústavů po celém světě, za čímž stojí i kladné výsledky jejich péče. U nás tento přístup podle vzoru Sira Ludwiga Guttmanna prosazoval prof. Beneš st. Díky vývoji medicíny můžeme dnes konstatovat, že zatímco 80 % pacientů za 2. světové války na poranění páteře během prvních dvou týdnů zemřelo, dnes se většina pacientů, i přes trvalý deficit, vrací zpět do společnosti.
V českých zemích a na Slovensku se poraněním míchy zabývala celá plejáda předních chirurgů (např. Maydl, Kukula či Jirásek) [1]. První souborná publikace pak byla až habilitační práce akademika Kunce z roku 1950, kterou otiskli ve Vojenských zdravotnických listech. Nejvíce se však problematice míšního poranění věnoval prof. Beneš st. V roce 1961 publikoval monografii „Poranění míchy“, která vyšla po čtyřech letech v Anglii a v roce 1968 také ve Spojených státech [9].
Demografické údaje
Průměrný věk pacientů s poraněním míchy je 40 let. Muži jsou postiženi 4× častěji než ženy. Vysoká incidence souvisí s rozvojem automobilové dopravy (převážně motocyklů) a sportovních aktivit zejména v letních měsících (skoky do vody). Incidence poranění míchy je v České republice a ve vyspělých zemích udávána okolo pěti případů na 100 000 obyvatel. Počet hospitalizovaných na spinálních jednotkách je v posledních letech mezi 240 – 300 pacienty ročně. Z toho 2/ 3 až 3/ 4 tvoří pacienti s traumatickou míšní lézí (www.spinalcord.cz). Na druhou stranu pacienti s lehčí míšní lézí nejsou na spinálních jednotkách hospitalizováni. Proto lze výše uvedené číslo pokládat za přibližně reálný počet nových jedinců s traumatickou míšní lézí v České republice. V USA je roční incidence 12 000 případů. Významný je i faktor ekonomický. Náklady na léčbu pacientů s poraněním míchy se v USA počítají na 10 miliard dolarů za rok. Dle české databáze pacientů s poraněním míchy má přibližně 45 % jedinců poranění v úrovni krční míchy, přibližně 40 % v úrovni hrudní míchy a přibližně 15 % pak v lumbální oblasti [10]. Nejčastějším typem ochrnutí je kvadruparéza (45 % případů), následována paraparézou (21 %), paraplegií (20 %) a kvadruplegií (14 %). Postižení hybnosti je doprovázeno poruchou senzitivních a autonomních funkcí [11].
Krátký souhrn patofyziologie poranění míchy
Poranění míchy lze z patofyziologického hlediska rozdělit na dvě základní fáze – primární a sekundární.
Primární fáze poranění zahrnuje vlastní moment traumatu, které postihuje páteř a míchu. Poranění míchy vzniká v návaznosti na poškození osteoligamentózního aparátu páteře buď přímo, při prudkém ohnutí, napnutí nebo rotaci míchy, nebo nepřímo, stlačením kostním úlomkem, fragmentem intervertebrálního disku, nebo cizím tělesem. Morfologická charakteristika poranění míšní tkáně a klinický nález se liší dobou trvání a silou míšní komprese, vytlačením míchy, akceleraci působícími kompresivními silami a kinetickou energií absorbovanou míchou. Poranění míchy často zahrnuje pouze jeden segment či dokonce necelý segment. Vždy je přítomen nějaký zbytek tkáně, takže se téměř nikdy nejedná o histologicky kompletní poranění (obr. 1).
Obr. 1. Schéma míšního poranění. 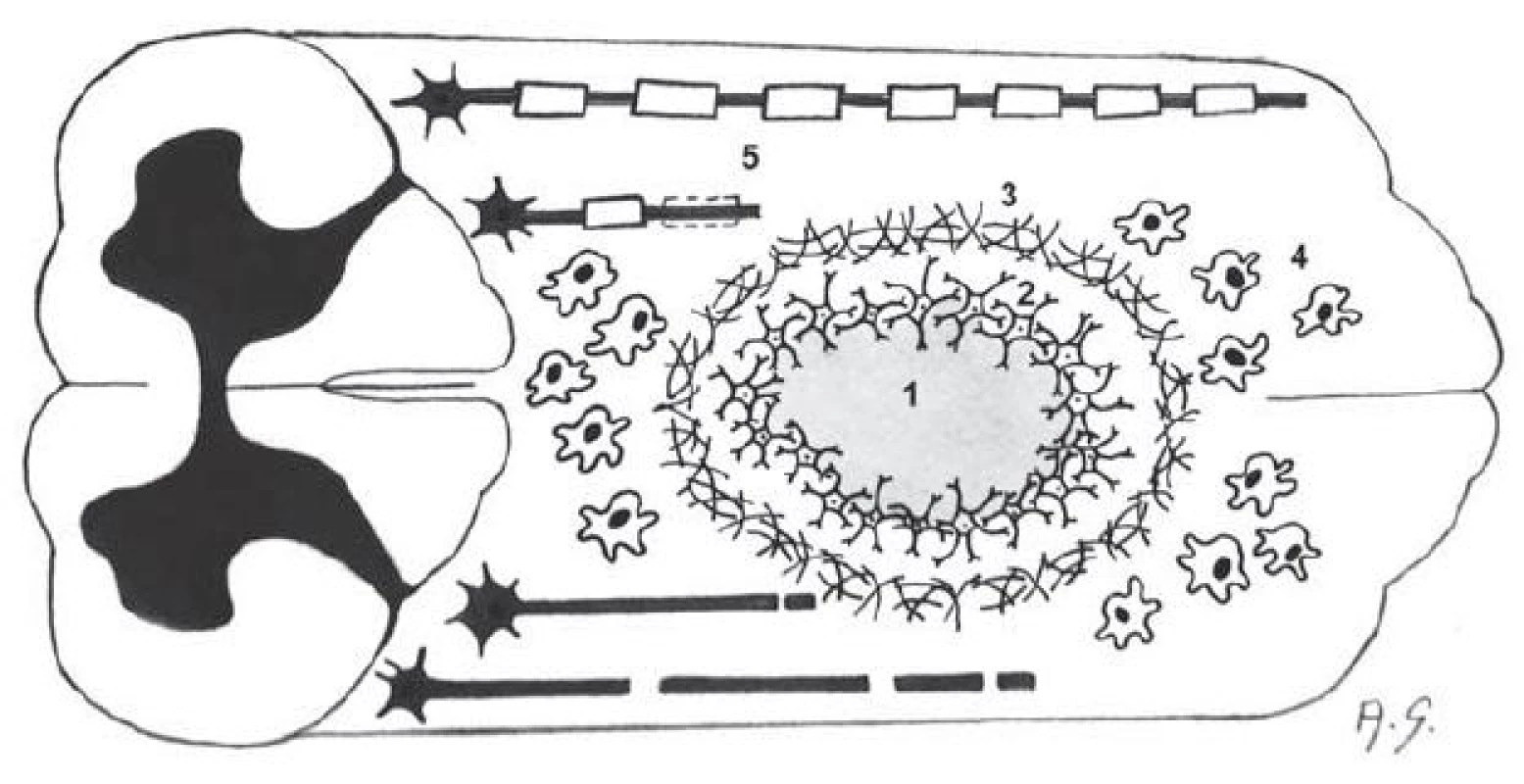
Uvnitř míšní tkáně nejdříve dominuje hemoragická léze a buněčný detritus, v chronické fázi se pak v tomto místě rozvíjí posttraumatická pseudocysta (1), která je obklopena gliální jizvou z astrocytů a jejich výběžků (2) a mezenchymální jizvou dominantně tvořenou chondroitinsulfátem (3). V okolí léze se vyskytují makrofágy (4). Zatímco většina vláken je poškozena (přerušena) a demyelinizována, na okraji bílých provazců někdy zůstávají reziduální vlákna (5) (autorka kresby: MUDr. Alena Sejkorová). Sekundární poranění míchy, které následuje po vlastním inzultu, lze dělit do několika fází: akutní fáze, subakutní fáze a chronická fáze. Akutní fáze je charakterizována převážně cévní reakcí (vazodilatace, hyperemie, petechiální krvácení), což vede k vazogennímu a cytotoxickému edému (obr. 2). Krvácení při kontuzi míšní dominuje v míšní šedi (centrální hemoragická nekróza). Mechanické poranění pak vede k rozvoji zánětlivé reakce, při které v prvních dvou dnech dominuje infiltrace tkáně neurotrofily. V následujících dvou dnech převažuje infiltrace tkáně makrofágy a lymfocyty. Neurony nekrotizují, zatímco axony odumírají Wallerovou degenerací. Tato vede k postupné dezintegraci axonů a jejich myelinových obalů.
Obr. 2. Vývoj experimentálního míšního poranění v MR obraze (T2 vážený obraz). 
Obr. 2A,B) Jeden týden po míšním poranění dominuje krvácení a edém (křížek), léze není zcela demarkována vůči míšní tkáni. Obr. 2C,D) Po třech týdnech od míšního poranění je zřejmá demarkace míšní léze (křížek) a také počínající atrofie míšní tkáně, což je dobře patrné na rozšířeném zadním SA prostoru. Obr. 2E,F) Po pěti týdnech je míšní léze již jednoznačně demarkována (křížek), objevují se pseudocysty, hlavně v axiálním řezu (F). Obr. 2G,H) Po šesti měsících od léze lze pozorovat značnou atrofi i míšní tkáně s maximem nad centrem léze. Ve střednědobé fázi mikroglie likviduje nekrotický detritus. Edém tkáně regreduje a dochází k rozvoji syringomyelie či pseudokavit v míšní tkáni. Rozvíjí se gliální jizva a dochází ke znovuobnovení hematoencefalické bariéry. V chronické fázi pak pokračuje atrofizace míchy, rozvoj syringomyelických dutin a gliální jizvy. Tato je tvořena převážně hypertrofickými astrocyty a depozity proteoglykanů chondroitin sulfátu [12].
Bunge et al rozdělili míšní trauma dle histologického nálezu do čtyř kategorií [13]:
- Makroskopický nález je normální (10 %), ale histologické vyšetření prokáže ztrátu normální struktury a demyelinizaci.
- Kontuze (49 % případů). Makroskopická struktura opět vypadá normálně, ale jsou patrny menší oblasti krvácení a nekrózy, které se vyvinou do cystických kavit.
- Lacerace (21 % případů). Je patrné poranění glia limitans s devastujícím poraněním míšního parenchymu, v epicentru je zjevná gliální jizva. Mezenchymální jizva je tvořena kolagenem a adheruje k okolním plenám. Dalším příznakem jsou kavity. Příčinou jsou často fragmenty obratlů či penetrující poranění.
- Masivní komprese (20 % případů). Míšní tkáň je macerována a rozmělněna. Častou příčinou je zlomenina obratlového těla komprimující míchu. Epicentrum míchy je opět tvořeno masivní fibrózní jizvou a kavitami následkem sekundární atrofie míšní tkáně.
Spontánní vývoj u pacientů s míšním poraněním
U pacientů s poraněním míchy můžeme pozorovat spontánní zlepšení neurologického stavu. Prognóza se však liší v závislosti na tíži iniciálního postižení. U pacientů s kompletní lézí míšní (ASIA A, American Spinal Cord Injury Association) je pravděpodobnost spontánního zlepšení dle různých studií 8 – 20 % [14]. Lepší prognóza je u pacientů s nekompletní míšní lézí, zvláště u pacientů ASIA B či C. Zde je pravděpodobnost zlepšení signifikantně větší a může být i vyšší než 50 % [15,16]. Tyto údaje mají tak zásadní význam pro plánování a hodnocení experimentálních metod léčby.
Spontánní regenerace po míšním poranění má i svůj anatomický podklad. Bylo zjištěno, že po nekompletní lézi míšní u laboratorních potkanů dochází k výrazné remodelaci, založené na axonálním sproutingu [17]. Např. u CST (kortikospinální dráha) vznikají nové spoje s krátkými a dlouhými sestupnými axony propriospinálních neuronů (PSN). V delším časovém horizontu se přitom spoje s dlouhými propriospinálními neurony (PSN), které přemostily místo poranění, udrží, zatímco spoje s krátkými PSN, které propojují jen okruhy v krátkém úseku a nepřecházejí tak přes místo léze, jsou časem ztraceny. Zajímavostí je, že axony mohou růst v CNS rychlostí přes 1 mm/ den [18].
Krátký souhrn algoritmu péče o pacienty s poraněním míchy
V akutní fázi je zásadní šetrná manipulace s pacientem. Tomu napomáhá včasné nasazení pevného krčního límce a vakuová matrace. Péče o vitální funkce pacientů v bezvědomí je zároveň i prevencí progrese sekundárního míšního poranění. Zásadní faktor v léčbě je především udržení dostatečného perfuzního tlaku, což zajistí dostatečnou oxygenaci míšní tkáně a tedy prevenci ischemie míchy. Výsledný neurologický stav lze kategorizovat dle Frankelovy škály či detailnější ASIA škály [19]. Podání metylprednizolonu dle studie NASCIS II je v současnosti spíše na ústupu, nicméně u selektovaných pacientů je nadále doporučováno [20]. Důvodem k operaci je pak nestabilní fraktura páteře či komprese míchy (obr. 3). V akutní a subakutní fázi jsou často pacienti hospitalizováni na JIP, s cílem prevence a léčby komplikací: umělá plicní ventilace u pacientů s vysokou míšní lézí, stabilizace kardiovaskulárního systému. Po přibližně 14 dnech jsou pacienti přeloženi na jednu ze čtyř spinálních jednotek (Praha, Liberec, Brno, Ostrava), kde se soustředí léčba pacienta především na intenzivní rehabilitaci zahrnující fyzioterapii i ergoterapii, nastavení režimu močení a vyprazdňování, polohování a prevenci dekubitů a dalších komplikací míšního poranění. Následně jsou pacienti překládáni na rehabilitační spinální jednotky při rehabilitačních ústavech (Kladruby, Hrabyně, Luže ‑ Košumberk).
Obr. 3. Kompresivní léze míšní – klinický případ. 
Obr. 3A) Devatenáctiletá pacientka po autonehodě s kompresivní frakturou C5 a frakturou hemilaminy C5 vpravo. Patrná je kyfotizace páteře s vrcholem v C5. Obr. 3B) Kontuze míchy patrná jako myelopatický signál od C3 po horní hranu obratle C6. Obr. 3C) Komprese míchy i zezadu zlomenou laminou obratle C5. Přední SA prostor je zcela zaniklý. Obr. 3D) Po somatektomii C5 s náhradou těla obratle autograftem a stabilizací, s fixací dlahou a bikortikálními šrouby v tělech C4 a C6. Obr. 3E) Dva roky po operaci je patrná fúze autoštěpu s obratlovými těly. Obr. 3F) Fraktura pravé hemilaminy C5 s kompresí míchy zezadu. Obr. 3G) MR míchy šest měsíců po úraze s posttraumatickou pseudocystou v úrovni C5, dominantně v zadních provazcích vpravo. Pacientka je samostatně chodící s minimálním motorickým deficitem na pravé horní končetině a menšími mikčními obtížemi. Neuroprotektivní látky
V experimentálním poranění míchy bylo vyzkoušeno velké množství látek. Seznam těch nejvýznamnějších z nich je uveden v tab. 1. Rozsáhlejší rozbor se týká jen kortikosteroidů, jejichž podání u pacientů s poraněním míchy mělo výraznější odraz v klinické praxi [20,21].
Tab. 1. Experimentální neuroprotektivní látky/ postupy u míšního poranění (SCI). 
ATB – antibiotika, ALS – amyotrofická laterální skleróza, NSA – nesteroidní antiflogistika, HMG- CoA – 3- hydroxy- 3- metylglutaryl-koenzym A, NMDA – N-metyl-D-asparagová kyselina. Kortikosteroidy
Kortikosteroidy jsou intenzivně zkoumány u míšního poranění již přes 30 let. Přestože mechanizmus jejich účinku na míšní lézi není ještě kompletně objasněn, mezi mechanizmy působení kortikosteroidů patří inhibice peroxidace lipidů, modulace imunitní odpovědi či prevence toku Ca2+ do buňky. Mezi hlavní zástupce kortikoidů patří syntetický glukokortikoid metylprednizolon. Velké množství experimentálních i klinických studií zkoumalo účinky metylprednizolonu na míšní trauma. Největší studie se zásadním vlivem na klinickou praxi byla série studií NASCIS I – III [22 – 24]. Po uveřejnění výsledků došlo k celosvětovému rozšíření aplikace vysokých dávek metylprednizolonu dle tzv. protokolu NASCIS, v případě zahájení léčby do 8 hod od traumatu: iniciální bolus 30 mg/ kg váhy během 15 min, následovaných po 45 min kontinuální dávkou 5,4 mg/ kg/ hod po dobu 24 hod. Nicméně již od počátku uveřejnění těchto studií byla slyšet značná kritika [25]. Hlavní argument oponentů je fakt, že při primární analýze studie NASCIS II nedosáhli pacienti léčení kortikosteroidy statistický významně lepších výsledků než u neléčené skupiny, zato došlo k významnému nárůstu nežádoucích účinků (sepse, pneumonie). Funkční zlepšení u podskupiny pacientů léčených do 8 hod od traumatu vzešlo až z post hoc analýzy. Dále byly publikovány výsledky pouze pravé poloviny těla, přestože byli pacienti vyšetřeni oboustranně. Při analýze všech studií zkoumajících léčbu míšního poranění metylprednizolonem plyne, že existují důkazy úrovně I – III pro to, že metylprednizolon zvyšuje riziko infekce rány, pneumonie, krvácení do GIT, prodlužuje dobu ventilace stejně jako dobu pobytu na JIP a dokonce riziko smrti [25]. To je také důvodem postupného ústupu od léčby metylprednizolonem a poslední dokument AANS/ CNS (American Association of Neurological Surgeons/ Congress of Neurological Surgeons) nedoporučuje standardní používání metylprednizolonu v léčbě poranění míchy (Spinal Cord Injury; SCI) [26]. V České republice bylo upuštěno od aplikace metylprednizolonu při podezření na poranění míchy lékaři rychlé záchranné služby na místě zásahu. V rámci nemocniční péče je pak doporučeno podávat metylprednizolon u pacientů s izolovaným, nepenetrujícím a nekompletním poraněním krční míchy do 8 hod po úrazu, ve věku 19 – 64 let a bez rizikových faktorů v anamnéze [20].
Chirurgická léčba a její časování
Operace je u pacientů s poraněním míchy indikována v případě komprese míchy či nestabilní zlomeniny. Chirurgická dekomprese komprimované míchy spolu se stabilizací je jeden z klíčových kroků prevence sekundárního poranění míchy. Zásadním faktorem operace je časování. Několik klinických studií se zabývalo vlivem akutní dekomprese míchy, avšak definice akutní dekomprese byla v každé studii jiná. Proto je nutno jednoznačně definovat a sjednotit pojem akutní operativy. V jedné studii byla akutní dekomprese definována jako 72 hod po míšním poranění a porovnána se skupinou operovanou po více než pěti dnech po míšním poranění [27]. Autoři nenašli žádný rozdíl ve výsledném ASIA skóre, délce intenzivní či rehabilitační péče mezi oběma skupinami. V letech 2002 – 2009 proběhla v šesti severoamerických centrech mezinárodní, multicentrická, prospektivní studie pod názvem Surgical Timing in Acute Spinal Cord Injury Study (STASCIS) [28]. Autoři zjistili, že na škále ASIA se zlepšilo nejméně o dva stupně téměř 20 % pacientů operovaných akutně (do 24 hod), na rozdíl od 9 % pacientů z pozdní skupiny (> 24 hod). Také procento komplikací v akutní skupině bylo nižší (24,2 %) v porovnání s pozdní skupinou 30,5 %.
Časná dekomprese hraje roli i u pacientů s cervikální spondylózou a míšním traumatem. Jedná se obvykle o starší pacienty se sekundární stenózou páteřního kanálu, kteří mohou prodělat poranění míchy i při malém traumatu. Častý klinický projev je syndrom centrální míšní šedi. Vzhledem k tomu, že většinou není přítomna žádná nestabilita, čeká se na spontánní zlepšení a stabilizaci klinického stavu, a tak jsou pacienti často operováni odloženě. V roce 2010 byl publikován názor panelu expertů [29]. Po systémovém přezkoumání literatury autoři vyvozují, že časná dekomprese (do 24 hod) by měla být provedena u pacientů s výrazným neurologickým deficitem (ASIA = C) a přetrvávající kompresí míchy. Tento postup má větší šanci na zlepšení motoriky a výsledné ASIA skóre šest měsíců od poranění v porovnání s odloženou operací [29].
Závěry z výše uvedených klinických studií ukazují, že časná dekomprese míšního traumatu vede k funkčnímu zlepšení. Tato hypotéza je také podporována experimentálními studiemi. V jedné experimentální studii vedla přetrvávající komprese k pokračujícímu poklesu amplitudy somatosenzorických evokovaných potenciálů [30]. K jejich restituci došlo po časné, nikoliv pozdní dekompresi. Rozdíl byl také patrný ve funkčních výsledcích obou skupin. Funkční výsledky v motorických testech zadních končetin ve skupině časné dekomprese ukázaly rychlé zlepšení, na rozdíl od pozdní skupiny. Další studie také ukázala lepší funkční výsledek a menší poškození míšní tkáně po časné dekompresi [31]. Přestože v předcházejících odstavcích se kladl důraz na dekompresi míchy, nezbytnou součástí operace je i stabilizace zlomeného segmentu páteře, což umožní včasnou vertikalizaci a rehabilitaci s eliminací další traumatizace míchy.
Experimentální léčba
Epidurální stimulace míchy
U savců se v lumbosakrálních segmentech míchy vyskytují nervové sítě (Central Pattern Generator; CPG). Mohou fungovat autonomně a zpracováním senzitivních informací fungují jako kontrolní centrum pro postoj a pohyb. Epidurální či farmakologickou stimulací tak můžeme generovat motorické vzorce pohybu či stoje [32,33]. V experimentech jsou tak laboratorní potkani či kočky při epidurální stimulaci schopni stát či hýbat končetinami i při chybějících propojeních z mozku. Existuje hypotéza, že podobné neurální okruhy existují i u lidí, což by při epidurální stimulaci a rehabilitaci mohlo pomoci s obnovou hybnosti u jedinců po míšním traumatu [34]. Existují rozsáhlé klinické zkušenosti s epidurální stimulací u pacientů s neuropatickou bolestí [35]. Kazuistika u pacienta s kompletní míšní lézí ukazuje, že epidurální stimulace může indukovat rytmickou aktivitu končetin vleže a dokonce pomáhat při vertikalizaci a asistované chůzi [34]. Takové výsledky podporují hypotézu lumbálního motorického centra (lumbálního generátoru pohybových vzorců) [36]. Různé formy stimulace pak mohou vést k rozličným funkčním odpovědím. Velká výhoda epidurální stimulace je její reverzibilita. Tato metoda je do budoucna velmi slibná.
Schopnost sebeobnovy CNS a kmenové buňky
Většina neurogeneze u savců probíhá před narozením jedince [37]. Po narození však nadále pokračuje v některých částech mozku a míchy, jako je subgranulární zóna gyrus dentatus hipokampu (SGZ) nebo subventrikulární zóna (SVZ) mozkových komor, odkud prekurzorové buňky migrují podél rostrálního migračního proudu (Rostral Migratory Stream; RMS) bílou hmotou do olfaktorického bulbu. Tyto kmenové buňky centrálního nervového systému (Neural Stem Cells; NSC) jsou více rezistentní k negativním impulzům, jako např. nedostatek kyslíku či neurotoxické molekuly. Za fyziologických podmínek dochází k doplnění některých buněk CNS, zvláště v hipokampu; dále buňky migrují do míst drobných pontinních lézí. NSC jsou schopny udržovat rovnováhu mezi sebeobnovou a diferenciací do specializovaných buněk CNS. Po poranění mozku dochází k zintenzivnění proliferace NSC v SVZ a neurální prekurzory migrují do místa poškození [38]. Zde se však pod vlivem prostředí diferencují převážně do gliových buněk a nenahrazují poškozené populace neuronů. Podobné kmenové buňky se nacházejí v okolí centrálního míšního kanálu, ty však mají pravděpodobně omezenou schopnost sebeobnovy a rovněž diferencují převážně do gliálních elementů [39]. Vzhledem k lokalizaci těchto buněk je jejich využití k terapeutickým účelům omezené. Biologie kmenových buněk se v poslední dekádě rozvinula a ovlivnila výrazně i výzkum v neurovědách [40,41].
Kmenové buňky jsou charakterizovány schopností dělení a diferenciace do jakékoliv buňky v organizmu. V užším smyslu tuto definici splňují embryonální kmenové buňky (Embryonic Stem Cells; ESC). Existují však i somatické kmenové buňky, které jsou součástí již určité tkáně při narození. Tyto se nazývají tkáňově specifické nebo také dospělé kmenové buňky. Nacházejí se např. v kostní dřeni, tukové tkáni, vlasových folikulech, čichovém epitelu, či mozkových komorách, ale také v pupečníku, placentě a v pupečníkové krvi. Kmenové buňky lze také rozdělit na embryonální, fetální a dospělé.
Z hlediska míšního poranění jsou studovány mezenchymální kmenové buňky (z kostní dřeně, tukové tkáně, apod.), dále Schwannovy buňky, buňky olfaktorické glie či neurální prekurzory z nesmrtelných linií fetálního mozku nebo míchy (obr. 4). Relativně novým typem buněk jsou tzv. indukované pluripotentní kmenové buňky (induced Pluripotent Stem Cells; iPSC) [42]. Jedná se o diferencované buňky z tkáně dospělého jedince (např. kůže), které jsou genetickými manipulacemi reprogramovány v pluripotentní buňky. Jejich výhodou je relativně jednoduchý odběr s možností autologní transplantace. Další výhodou je také možnost obejít eticky kontroverzní použití embryonálních buněk. V roce 2012 získali autoři této metody Shinya Yamanaka a John Gurdon Nobelovu cenu za medicínu a fyziologii.
Obr. 4. Různé typy kmenových buněk po experimentální aplikaci do poranění míchy. 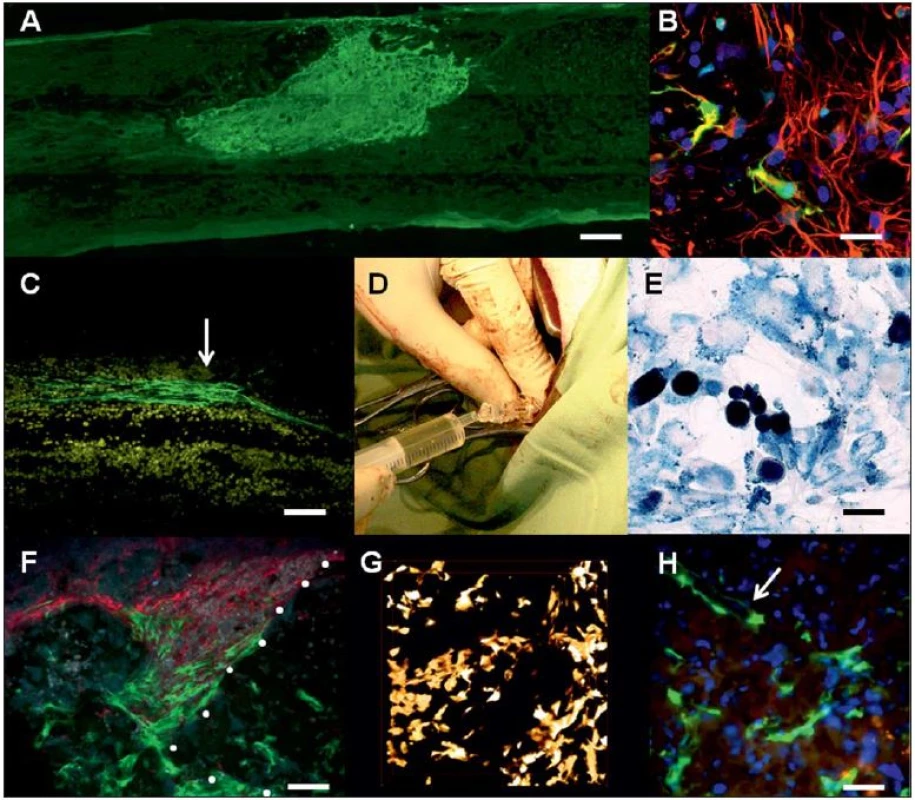
Obr. 4A) Neurální progenitory generované z indukovaných pluripotentních kmenových buněk dva měsíce po implantaci do míšní léze (měřítko = 400 μm). Obr. 4B) Spinální progenitorové buňky (Spinal Progenitor Cells; SPC; barvení zeleným fluorescenčním proteinem, Green Fluorescent Protein; GFP) osazené na HEMA hydrogelu se serotoninem jeden měsíc po implantaci do míšní hemisekce. Buňky byly pozitivní na neuronální marker nestin (červená, měřítko = 20 μm). Obr. 4C) Buňky olfaktorické glie (GFP+) po přímé injekci do míšní léze (měřítko = 100 μm). Obr. 4D) Intratékální aplikace cestou cisterna cerebellomedullaris u laboratorního prasete. Obr. 4E) MSC v míšní lézi jeden měsíc po intratékální aplikaci (barvení na železo, měřítko = 15 μm). Obr. 4F) GFP + MSC (zelené) vycestovalé z hydrogelu na zbytkové míšní tkáně, kam také vrůstají Schwannovy buňky (červené, barvení p75, měřítko = 100 μm) z oblastí míšních kořenů. Obr. 4G) 3D rekonstrukce hydrogelu (červené hranice) osázeného kmenovými buňkami – GFP + MSC před implantací do míšní léze. Obr. 4H) GFP + MSC uvnitř hydrogelu jeden měsíc po implantaci do míšní léze. Patrné je vrůstání nové cévy podél kmenových buněk (šipka, měřítko = 50 μm). Embryonální kmenové buňky a indukované pluripotentní kmenové buňky
ESC jsou buňky se schopností sebeobnovy a pluripotence [43]. Toto jsou zásadní vlastnosti buněk pro buněčnou terapii a tkáňové inženýrství. ESC jsou schopny nahradit buňky CNS jak neurony, tak i gliální elementy. Transplantované ESC mohou nahradit ztracené neurony, oligodendrocyty či astrocyty [44]. Dále mohou ESC zabránit ztrátě tkáně a minimalizují bolest po míšním poranění [45].
ESC se mohou přeměnit v jakoukoliv buňku těla. Tato jejich vlastnost ale nese riziko nekontrolované proliferace, která může vést k tvorbě teratomu po transplantaci [46]. Proto je nutná prediferenciace do určité specifické subpopulace buněk [47]. Další nevýhoda aplikace ESC je nutnost imunosuprimování pacienta.
V roce 2009 společnost Geron Corporation zahájila první klinickou studii v USA využívající lidské embryonální kmenové buňky, která byla do značné míry průlomová [48]. Ve studii klinické fáze I byly pacientům s akutním poraněním míchy (do 14 dnů po míšním poranění) aplikovány z lidských ESC generované progenitorové buňky oligodendrocytů. Avšak studie byla z finančních důvodů zastavena a firma přesunula svoji činnost do oblasti onkologické [49].
Významný krok v biologii kmenových buněk byl objev tzv. indukovaných pluripotentních kmenových buněk (iPSC) [42]. Mohou být zdrojem neurálních prekurzorových buněk (Neural Stem Cells; NSC [50]). V experimentálních studiích u laboratorních myší i potkanů po SCI došlo po implantaci NSC ke zlepšení motorických funkcí [51,52]. Implantované iPSC také diferencovaly do různých podtypů neuronů včetně motoneuronů [52]. iPSC byly také podány u kočkodanů s cervikální (C5) míšní lézí [53]. Autoři popisují zvýšený růst nervových vláken, angiogenezi a zmírnění demyelinizace u kočkodanů léčených iPSC v porovnání s kontrolní skupinou. Kočkodani po aplikaci iPSC měli také lepší funkční výsledky. Autoři nepozorovali rozvoj tumorů, nicméně hodnocení probíhalo pouze po dobu 12 týdnů po aplikaci.
Mezenchymální kmenové buňky
Kmenové buňky kostní dřeně (Bone Marrow Stromal Cells; BMSC) jsou schopny diferencovat do osteoblastů, chondrocytů, myoblastů [40]. Mezenchymální kmenové buňky (Mesenchymal Stem Cells; MSC) mohou být získány nejenom z kostní dřeně, ale i z tukové tkáně či perinatálně (pupečníková šňůra, placenta, Whartonův rosol). V posledních 15 letech byly MSC využity v mnoha laboratorních studiích experimentálního poranění [54 – 56]. Ukázalo se, že MSC částečně remyelinizují axony [57,58], podporují axonální sprouting přes lézi a redukují gliální jizvu [59,60] a dále modulují imunitní reakci podporou M2 podtypů makrofágů oproti M1 makrofágům. M2 makrofágy mají protizánětlivé účinky a zvýšenou schopnost fagocytózy, což vede k eliminaci sekundárního poškození míchy a míšní atrofie. Též snižují velikost posttraumatických kavit, snižují aktivitu astrocytů a makrofágů/ mikroglie) [61 – 63]. MSC dále syntetizují růstové cytokiny (IL‑6, IL‑7, IL‑10, VEGF, IFN ‑ γ) a snižují protizánětlivé cytokiny [64,65]. MSC byly implantovány u větších zvířat, jako jsou psi [66,67]. I přes určité zlepšení pozorované u některých psů jsou počty jedinců příliš nízké na jakékoliv statistické hodnocení.
Výhoda MSC je možnost systémové aplikace MSC bez nutnosti přímé injekce buněk do míchy, neboť jsou přitahovány do místa léze lokálními faktory uvolňovanými několik týdnů v poškozené tkáni (homing) [68]. Na rozdíl od jiných buněk mohou být tedy aplikovány intravenózně, intraarteriálně či intratékálně [69 – 71]. Další možností je stimulace kostní dřeně pomocí granulocytárního kolonie stimulujícího faktoru (G‑CSF), což mobilizuje MSC z kostní dřeně do periferie. I tento způsob aktivace MSC vede u laboratorních potkanů k prevenci atrofie bílé hmoty míšní a funkčnímu zlepšení v akutní fázi poranění míchy [63,72]. Další výhodou je možnost neinvazivního monitorování na MR pomocí např. nanočástic obsahujících železo, což lze ovšem využít i u jiných kmenových buněk [73 – 76].
Různé formy MSC byly hodnoceny v přibližně 15 klinických studiích u pacientů s míšním poraněním. Studie v první řadě směřovaly ke zjištění bezpečnosti podání kmenových buněk (fáze I – II) [55,71]. Na základě výsledků provedených studií lze konstatovat, že v krátkodobém a střednědobém horizontu (několik let) lze považovat aplikaci MSC u pacientů s traumatickým poraněním míchy za bezpečnou. Menší nežádoucí účinky po podání zahrnovaly dočasnou myalgii, horečku či zčervenání. Nicméně v jedné studii se u pacienta s postinfekční myelitidou, u kterého lékaři aplikovali opakovaně intratékálně MSC, objevila encefalomyelitida. Pokud se týká efektivity léčby MSC, lze ze studií vyvodit méně závěrů [55]. Důvodem je vysoká heterogenita většiny studií. Mnoho studií zahrnulo pacienty jak s akutní, tak i chronickou míšní lézí, buňky byly aplikovány různými způsoby a studie také často nezahrnovaly kontrolní skupiny. V jediné klinické studii provedené v České republice byly podávány nemanipulované autologní buňky kostní dřeně u pacientů po traumatickém poranění míchy v subakutní a chronické fázi, se stupněm postižení ASIA A – C [71]. Zlepšení v ASIA skóre ≥ 5 bodů bylo zaznamenáno u pěti pacientů z šesti po intraarteriální aplikaci, ale pouze u jednoho ze 14 pacientů po intravenózním podání (tab. 2). Autoři nepozorovali žádné významné komplikace po podání těchto buněk. Transplantace autologních kmenových buněk u pacientů se SCI je bezpečná, úspěšnost buněčné terapie je závislá na rozsahu míšní léze. Dle dosavadních studií se jeví, že naději na obnovení neurologické funkce mohou mít pacienti při včasném podání. Vhodným způsobem podání je aplikace buněk co nejblíže k místu poranění, např. i.a. nebo intratékálně. V současné době je připravována studie s podáním rozmnožených mezenchymálních buněk do 30 dnů po poranění s možným opakovaným podáním v odstupu šesti týdnů.
Tab. 2. Fáze I/ II klinické studie. Pacienti s cervikální lézí a intraarteriální aplikací autologních BMSC, pacient s hrudní lézí po i.v. injekci. ASIA skóre a evokované potenciály v průběhu 12 měsíců po podání kmenových buněk. 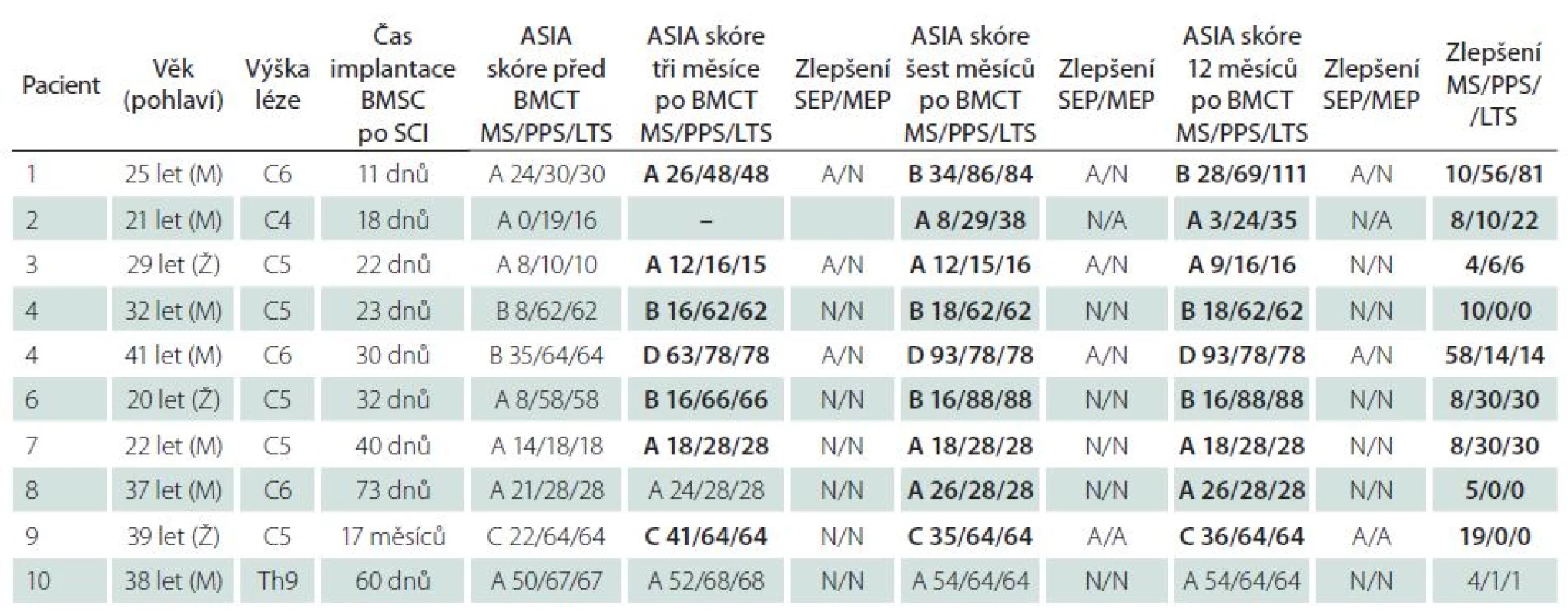
BMCT – Bone Marrow Cell Transplantation (transplantace buněk kostní dřeně), MS – Motor Score, PPS – Pin Prick Score, LTS – Light Touch Score. Schwannovy buňky
Schwannovy buňky tvoří obaly periferních nervů a hrají klíčovou roli v jejich regeneraci. Po poranění nervu tyto dediferencují, secernují prorůstové molekuly a prorůstové složky extracelulární matrix, jako je např. laminin [77], což podporuje regeneraci axonů spolu s jejich myelinizací [78]. Nabízí se tak jejich využití i pro případy míšního poranění. Jedna z klíčových studií byla publikována již v roce 1981 [79]. Autoři implantovali periferní štěpy do experimentální míšní léze a ukázali, že centrální axony prorůstaly do štěpů až v délce 3 cm.
Schwannovy buňky mohou být aplikovány buď samostatně, nebo v kombinaci s jinými metodami, jako jsou např. polymerní biomateriály [80]. Schwannovy buňky podporují vrůstání axonů do štěpu, nikoliv však přes místo léze zpět do tkáně CNS. Regenerace vláken CNS přes místo léze se však podařilo podpořit v případě, že byly Schwannovy buňky zkombinovány s dalšími metodami [81,82]. U studií, které využívaly kombinaci metod, došlo u experimentálních zvířat k částečnému funkčnímu zlepšení, avšak bez histologického průkazu funkčních spojení přes místo léze.
Doposud byly publikovány tři klinické studie, ve kterých se pacientům s poraněním míchy implantovaly Schwannovy buňky a další dvě studie jsou v současné době otevřeny (www.clinicaltrials.gov). Jedná se o studie na Miamské univerzitě, kde vědci a lékaři z týmu Miami Project to Cure Paralysis nabírají pacienty se subakutní a chronickou míšní lézí. Z výše uvedených tří studií jedna proběhla v Íránu [83]. Bylo do ní zavzato 33 pacientů s úplnou nebo částečnou lézí míšní (ASIA A, B) v úrovni krční (C) či hrudní (Th) páteře [84]. Žádné komplikace autoři nepozorovali. Také ve studii z Číny autoři nepopisují žádné komplikace po podání Schwannových buněk u pacientů po poranění míchy [85].
Olfaktorická glie
Olfaktorické neurony jsou jediné neurony, které se v průběhu celého života u dospělých savců obnovují [86]. Důležitou roli v tomto procesu obnovy hrají gliální čichové buňky. Tyto gliální buňky obklopují senzorické nervy, jejichž výběžky vedou z čichové sliznice do olfaktorického bulbu. Buňky olfaktorické glie jsou heterogenní ve své morfologii, antigenní výbavě a funkčním významu a projevuje se u nich vysoký stupeň plasticity [87,88].
Velké množství experimentálních studií u laboratorních potkanů ukázalo, že buňky olfaktorické glie mohou navádět růst poškozených axonů skrze lézi zpět do zdravé míchy, což vede k funkčnímu zlepšení operovaných laboratorních potkanů [89 – 93].
Zdrojem buněk olfaktorické glie může být buď čichová sliznice nebo čichový bulbus. V případě čichového bulbu může být tento extrahován z unilaterálního přístupu přes nosní kost či orbitu [94]. Tento přístup však s sebou nese riziko likvorey a unilaterální ztráty čichu. Proto je snaha využívat jiné, „perifernější“ zdroje, jako jsou např. čichová lamina propria či čichová sliznice. Je nutno však brát v potaz, že vzhledem k inervaci čichové sliznice trojklanným nervem může být tento zdroj čichové glie kontaminován Schwannovými buňkami z trojklanného nervu. Olfaktorická glie ze sliznice může být jednoduše získána biopsií. Dostatečné množství buněk lze získat za 4 – 6 týdnů po jejich kultivaci, což dovoluje aplikaci nejdříve v subakutní fázi míšního poranění. Pokud bychom chtěli implantovat olfaktorickou glii dříve, je možné využít následujících dvou postupů: imortalizované buňky z jiného jedince pro heterologní transplantaci nebo založit banku buněk olfaktorické glie dle jednotlivých HLA (Human Leukocyte Antigen) podtypů.
V roce 2002 byla zahájena první klinická studie v Austrálii. Do studie bylo zařazeno šest pacientů s chronickým míšním poraněním hrudní míchy (Th4–Th10) a další sloužili jako kontrola. Byly publikovány výsledky studie po jednom a třech letech [95,96]. Pacienti absolvovali biopsii čichové sliznice, ze které bylo po dobu 4 – 10 týdnů vykultivováno dostatečné množství buněk čichové glie. Následně byla u těchto pacientů provedena laminektomie, durotomie a buňky byly injikovány do míchy na více místech kraniálně a kaudálně od vlastní léze. U pacientů nebylo pozorováno žádné statisticky významné funkční zlepšení oproti kontrolám, žádné změny v MR obraze či známky růstu nádoru nebo rozvoje posttraumatické syringomyelie po léčbě. Některé publikované studie popisují zlepšení u chronických pacientů s poraněním míchy, avšak množství pacientů je tak malé, že dosud léčbu nelze statisticky hodnotit [97,98]. Teprve po provedení studie s větším množstvím pacientů, kde bude možno získat statisticky významné výsledky, lze učinit nějaké závěry.
V roce 2014 autoři z Iowy publikovali kazuistiku 26leté pacientky, ve které přináší varování a nutnost zaměřit se na dlouhodobou bezpečnost buněčné terapie [99]. Pacientka prodělala implantaci buněk čichové glie. Po osmi letech došlo k rozvoji intramedulárního ložiska, což se projevilo bolestmi v zádech. Prodělala operaci, při které jí bylo ložisko odstraněno. Histologické vyšetření ukázalo cystickou lézi, jejíž stěna byla tvořena čichovým epitelem, slizničními žlázami obsahující pohárkové buňky a nervové výběžky. Přestože se jedná o doposud první publikovaný případ, upozorňuje na nutnost dlouhodobého sledování těchto pacientů s cílem včas detekovat možný ektopický nekontrolovaný růst buněk.
Aplikace aktivovaných makrofágů
Míšní tkáň spontánně neregeneruje; poranění míšní se rozvíjí do stavu chronické léze, která se zvětšuje a kde dochází k postupné demyelinizaci reziduálních axonů, což vede k rozpadu reziduální tkáně a s tím souvisejícímu poškození nervových funkcí. Zásadní vliv na tento vývoj má imunitní systém, obzvláště makrofágy. Makrofágy lze zjednodušeně rozdělit do dvou podskupin. M1 makrofágy jsou nositelé vrozené imunity a jejich aktivita vede k odstranění cizích mikrobů a detritu z místa léze. Na druhou stranu aktivita M2 podtypu makrofágů pak vede k reparativním procesům a snížené produkci prozánětlivých a naopak sekreci protizánětlivých cytokinů. U savců monocyty derivované z krve a aktivovaná mikroglie dlouhodobě zůstávají přítomny v místě poškození [100]. Experimentální studie ukázaly, že eliminace hematogenních makrofágů vede k ochraně zbytkových axonů, snížené tvorbě kavit a podpoře axonálního sproutingu v místě léze a s tím souvisejícímu funkčnímu zlepšení u laboratorních zvířat. Na druhou stranu navýšení podtypů makrofágů, které podporují reparaci, vede k prodlouženému růstu axonů a zlepšení motorických funkcí [101].
V první dekádě 21. století proběhla studie v 11 centrech USA a Izraele [102]. Jednalo se o randomizovanou kontrolovanou multicentrickou klinickou studii ve fázi II s pacienty s kompletní transverzální lézí míšní (ASIA A) na úrovni mezi C5 a Th11. Experimentálně léčeným pacientům byla aplikována dávka autologních makrofágů v průběhu 14 dnů po míšním poranění. Ve studii bylo vyhodnoceno 43 účastníků studie (26 léčených autologními makrofágy, 17 kontrol). Zlepšení na úroveň ASIA B bylo u sedmi léčených a 10 kontrol a na ASIA C u dvou léčených a dvou kontrol. Výsledky po šesti měsících ukázaly trend k lepším výsledkům u kontrol oproti pacientům léčeným autologními makrofágy, i když rozdíl nebyl statisticky významný. Autoři studie tak nedoporučují léčbu autologními inkubovanými makrofágy u pacientů s akutním poraněním míchy. Poslední studie ukazují, že role makrofágů a celého imunitního systému je příliš komplexní a aktivace jen jednoho podtypu buněk tak nutně nemusí vést ke kýženému efektu. Spíše bude do budoucnosti vyžadována manipulace na více úrovních v závislosti na fázi a charakteru poranění a s tím souvisejícím stavem mikroprostředí v míšní lézi [103].
Inhibiční molekuly a jejich protilátky
Oligodendrocyty a myelin CNS obsahují několik skupin růst inhibujících látek a molekul. Schwab a Caroni objevili jednu z nich; jedná se o látku v myelinu produkovanou oligodendrocyty, NI - 35, spíše známou pod názvem Nogo ‑ A [104]. Nogo ‑ A je přítomna nejen v oligodendrocytech, ale také v neuronech, které se nacházejí v oblastech mozku s vysokou plasticitou, jako je hipokampus či kortex [105]. Nogo ‑ A hraje zásadní roli v inhibici regenerace axonů a kompenzatorního růstu vláken při poškození CNS. Schwab vyvinul protilátku proti Nogo ‑ A, mAb IN ‑ 1. Více experimentálních studií ukázalo, že léčba protilátkou proti Nogo ‑ A podporuje v dlouhých úsecích regeneraci axonů CNS a kompenzační růst nervových vláken, což souvisí i s významným funkčním zlepšením v experimentu na laboratorní myši či potkanu [106]. Tato protilátka se vpraví do těla experimentálního zvířete cestou hybridomových buněk, například intratékální injekcí. Podpora regenerace vláken kortikospinálního traktu po podání mAb IN ‑ 1 u parciální míšní léze byla potvrzena i u primátů, konkrétně na jedincích kočkodana [61].
V roce 2006 byla zahájena klinická studie fáze I k posouzení bezpečnosti, tolerance, farmakokinetiky a hodnocení správné dávky lidské protilátky proti Nogo ‑ A. Zahrnuti byli pacienti s kompletními i nekompletními lézemi (ASIA A – C) krční i hrudní míchy (C5 – Th12). Protilátka byla podána kontinuálně intratékálně pomocí externí pumpy v období 4. – 14. dne po míšním traumatu. Pacienti byli rozděleni do čtyř skupin dle výše dávky, kdy u skupiny s nejvyšší dávkou byla protilátka aplikována až do 28. dne po traumatu. Studie byla dokončena v roce 2010, nicméně doposud nejsou k dispozici žádné literární údaje, které by shrnuly její výsledky. Jedinou zmínkou je výskyt neutropenie po léčbě [107].
Enzymatická blokáda gliální jizvy
Gliální jizva, která se rozvíjí v subakutní a chronické fázi míšního poranění, je jedním ze základních faktorů inhibujících regeneraci CNS. Gliální jizva je tvořena hustou sítí výběžků hypertrofických astrocytů a depozity molekul extracelulární matrix, jako jsou proteoglykany chondroitin sulfátu (Chondroitin Sulphate Proteoglycans; CSPG) [108]. CSPG jsou tvořeny centrálním proteinovým řetězcem, na kterém jsou navázány sacharidové řetězce glykosaminoglykanů (GAG). Bylo prokázáno, že tyto inhibují růst axonů jak in vitro, tak také in vivo [109,110]. Bakteriální enzym chondroitináza ABC (chABC) štěpí řetězce GAG v CSPG v oblasti vzdálené až 4 mm od místa léze, čímž dochází ke snížení jejich inhibiční aktivity [111]. Enzym byl aplikován intratékálně ihned po provedení experimentálního poranění míchy a dále opakovaně každý druhý den až do 10. dne. Po podání tohoto enzymu u laboratorních potkanů došlo k upregulaci regeneračního proteinu v poraněných neuronech, což provázelo regeneraci senzitivních ascendentních i motorických (CST) drah míšních. Elektrofyziologická měření prokázala funkční zapojení zregenerovaných drah CST. Histologické změny a elektrofyziologická měření korelovala s funkčním zlepšením v podobě lepší hybnosti a propriocepce.
Podání chABC zlepší prorůstání vláken gliální jizvou. Zatímco u kortikospinálního traktu nebylo prokázáno prorůstání jizvou zpět do CNS, u vláken z pseudounipolárního ganglia aplikace chABC umožnila prorůstání axonů poškozenou zónou zadního kořene do CNS [112].
Biomateriály a tkáňové inženýrství
Chronická míšní léze tvoří bariéru pro růst nových vláken, která by propojila oblasti kraniálně a kaudálně od léze. Centru léze dominuje většinou posttraumatická pseudocysta ohraničená gliální a mezenchymální jizvou. Mícha je v lézi a jejím okolí atrofická [113]. Experimentální metody přemostění míšní léze lze rozdělit do dvou typů: jedním přístupem je přímá rekonstrukce míchy, druhým je pak našití bypassu s využitím nervového autograftu.
Přímá rekonstrukce míšní léze tedy vyžaduje kombinaci implantace „přemostění“, po kterém by rostla nová vlákna a vytvoření „permisivního“ prostředí, které bude podporovat neuroregeneraci, zahrnující růst nových myelinizovaných vláken, tvorbu funkčních synapsí, růst nových cév, gliálního podpůrného aparátu apod. (obr. 5). K tomu se využívají rozličné biomateriály, jejichž rozvoj v oblasti experimentální rekonstrukce míšního poranění významně vzrostl v posledních 20 letech. Vyvíjí se jak přírodní, tak i umělé hydrogely. Hydrogely jsou syntetické 3D porézní biomateriály s vysokým obsahem vody (až 98 %), fyzikálními a chemickými vlastnostmi, které mohou být upraveny dle požadavků pro jednotlivé biologické aplikace, včetně reparace poranění CNS [114 – 116]. Hydrogely jsou implantovány do experimentálních lézí, jako jsou hemisekce, transekce či kompresivní balónková léze s cílem vytvoření nového permisivního prostředí pro růst nové tkáně (obr. 6).
Obr. 5. Biomateriály v míšní lézi. 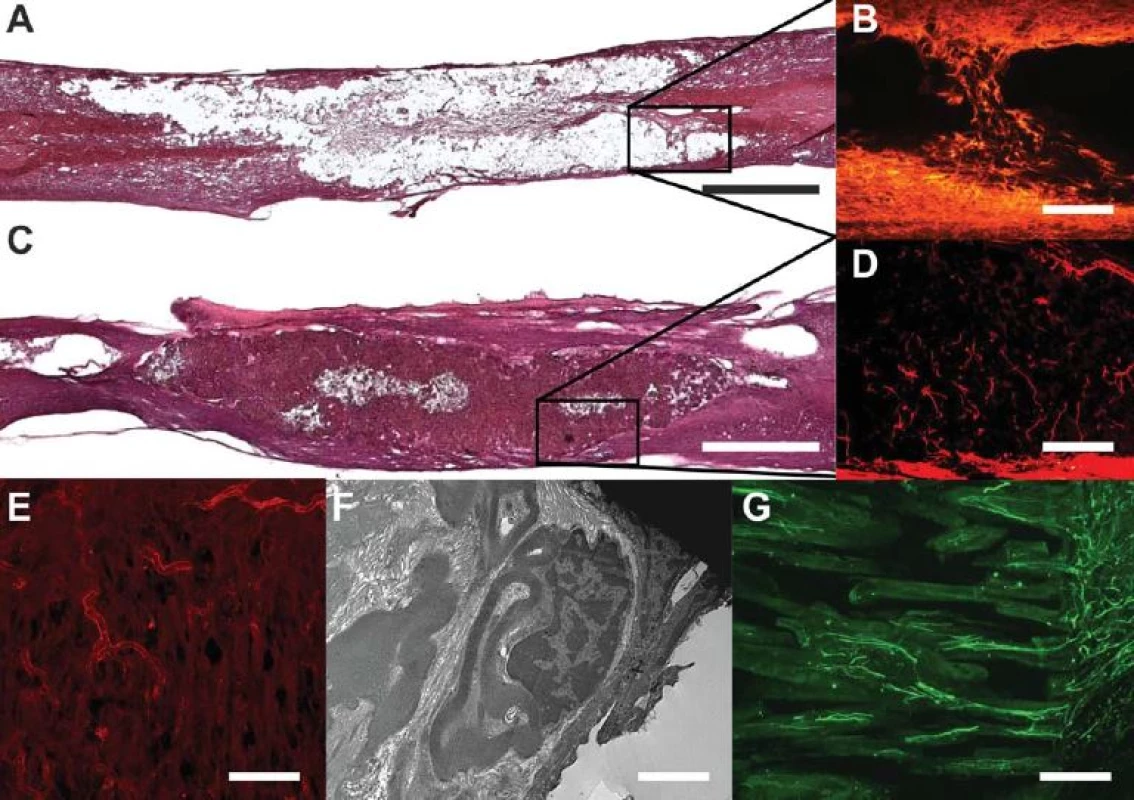
Obr. 5A) Mícha šest měsíců po míšní lézi. Dominuje objemná posttraumatická pseudocysta s reziduální tkání v centru (barvení hematoxylin-eoxin, HE, měřítko = 1 mm). Obr. 5B) Detail míšní léze, dominuje gliální jizva (barvení GFAP). Obr. 5C) Míšní léze po implantaci biomateriálu – hydrogel na bázi HPMA, póry hydrogelu jsou plně prorostlé novou tkání (barvení HE, měřítko = 1 mm). Obr. 5D) V detailu nová vlákna vrůstající do hydrogelu (barvení NF160- g594, měřítko = 100 μm). Obr. 5E) Nové cévy vrůstající do hydrogelu (barvení RECA, měřítko = 100 μm). Obr. 5F) Schwannovy buňky vytvářejí periferní typ myelinu kolem neuronů v hydrogelu implantovaném do experimentální míšní léze (měřítko = μm). Obr. 5G) Hydrogel s orientovanými póry v hemisekci míšní. Patrný je jednosměrný růst vláken od okraje míchy (tečky) směrem do pórů hydrogelu (měřítko = 100 μm). Obr. 6. Experimentální léze míšní. 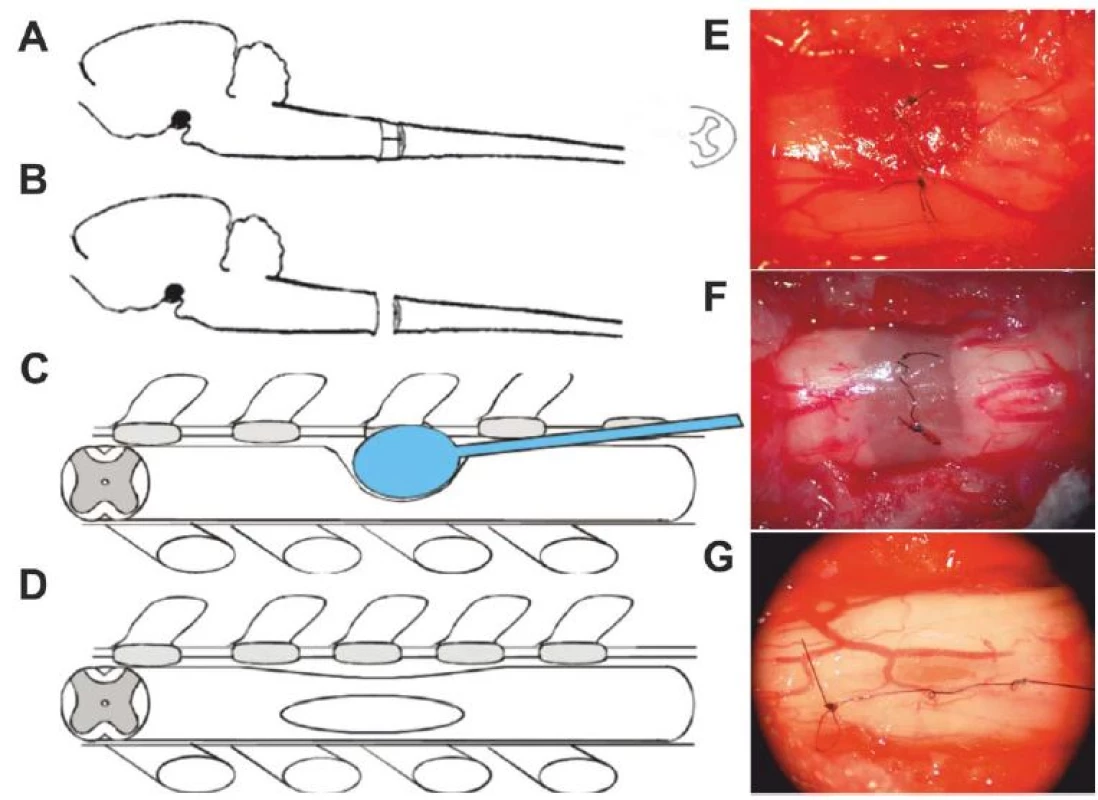
Obr. 6A) Hemisekce míchy. Obr. 6B) Transekce míchy. Obr. 6C) Balónková kompresní léze (BCL). Obr. 6D) Chronická míšní léze po BCL. Obr. 6E–G) Implantované biomateriály přemosťující jednotlivé typy míšních lézí. Výhodou syntetických biomateriálů je možnost modifikace. Jedním z faktorů, který je studován, je konzistence hydrogelů. Hydrogely mohou být injikovatelné, kdy jsou aplikovány v tekuté konzistenci a polymerizují až v lézi [117]. Tímto způsobem se minimalizuje implantační trauma. Jiným faktorem je vstřebatelnost, kdy jsou vyvíjeny hydrogely, které se s určitým časovým odstupem od implantace resorbují [118,119]. Dle naší studie se zdá, že bude nutné využít spíše dlouhodobě vstřebatelné biomateriály, které zajistí tvorbu stabilní nové tkáně přes místo léze [119]. Mezi další modifikace, které mají podpořit regeneraci tkáně, je ovlivnění náboje hydrogelu, modifikace chemického základu hydrogelu, aplikace adhezivních molekul a podobně [113,120,121]. Relativně nově se rozvíjejí biomateriály připravené decelularizací různých tkání, jako např. svalu, stěny močového měchýře, periferního nervu, mozku i míchy [122]. V poslední době byla vyvinuta i injikovatelné forma [123]. Tato decelularizovaná tkáň byla aplikována experimentálně do míšní léze jak samostatně, tak i v kombinaci s neurotrofními faktory či kmenovými buňkami [124,125], což platí i pro ostatní druhy biomateriálů [113,121,126].
Jak již bylo řečeno v úvodu, využití různých biomateriálů k přemostění a rekonstrukci míšní léze lze předpokládat hlavně v chronické fázi míšního poranění. Dosavadní studie v rámci experimentálního poranění míchy ukázaly, že implantace hydrogelů podporuje vrůstání nových myelinizovaných vláken či cév i více jak jeden měsíc po experimentální lézi u laboratorního potkana [113].
První klinická studie na využití hydrogelů u pacientů s míšním poraněním byla publikována v roce 2014 autory z Káhirské univerzity. U 14 pacientů s kompletním chronickým přerušením míchy (5 měsíců až 7 let po traumatu) bylo provedeno přemostění míšní léze pomocí štěpů z periferních nervů v kombinaci se štěpem na bázi chitosanu s lamininem. Autoři popisují zlepšení u všech 14 z nich (12 pacientů se zlepšilo na ASIA C a dva na ASIA B), nikdo z pacientů se však nezlepšil natolik, aby byl schopen chodit. Až zarážející je však vysoké procento komplikací, kdy hematomy se vyskytly u 10 pacientů a tvorba séromu v ráně u pěti pacientů. Dalším nedostatkem studie je chybějící detailnější rozbor klinického průběhu pacientů, zvláště při jejich malém počtu. Serióznost takové studie je proto diskutabilní a spíše snižuje hodnotu celého výzkumu.
Alternativa přímé rekonstrukce míšní léze je pak vytvoření spojky (bypass) spojující míchu kraniálně od místa léze s nervovými kořeny či svalem kaudálně od léze pomocí nervového autograftu [127]. Tato technika byla experimentálně aplikována jak u laboratorních potkanů, tak i kočkodanů [127 – 129]. Stejní autoři pak publikovali využití tohoto způsobu u paraplegického pacienta tři roky po traumatu míšním v úrovni Th9. Autograft ze surálního nervu byl našit na anterolaterální kvadrant míchy v úrovni Th7 – Th8 a kaudálně pak homolaterálně na ventrální kořeny L2 – L4. Po osmi měsících autoři pozorovali volní pohyb obou adduktorů dolních končetin a levého kvadricepsu. Pozorované klinické změny byly verifikovány elektrofyziologicky [130].
Kombinace experimentálních metod
Míšní léze představuje pro regeneraci kombinaci více typů bariér (pseudocysta, gliální jizva, inhibitory regenerace z myelinu atd.). Tato se dynamicky vyvíjí od vlastního momentu traumatu po dobu několika let. V experimentální léčbě se proto zkouší kombinace dvou či více metod s cílem nalézt komplexní řešení.
Testují se např. různé kombinace kmenových buněk, kmenových buněk a neurotrofních faktorů [131,132]. Další častou variantou je implantace biomateriálu spolu s kmenovými buňkami, neurotrofními faktory či enzymy [113,133,134]. Biomateriál slouží jednak jako podpůrné lešení pro růst nové tkáně a také jako nosič kmenových buněk či pool neurotrofních faktorů (obr. 4). Kmenové buňky i faktory jsou tak aplikovány do centra léze, kde vytvářejí permisivní prostředí k podpoře růstu nervových vláken. Některé studie ukázaly, že tato kombinace je efektivnější než aplikace samotných faktorů či hydrogelu [113,133]. Jiným příkladem je kombinace buněčné terapie (neurotrofní vliv) a chondroitinázy (štěpení gliální jizvy) [135]. Na základě současných znalostí o SCI lze předpokládat, že budoucí terapie míšního poranění bude vyžadovat kombinaci několika léčebných modalit.
Závěr
Dosavadní výzkum v oblasti míšního poranění za posledních 20 let přinesl významný posun v porozumění patofyziologie a částečný pokrok v jeho experimentální léčbě. V laboratořích se rozvíjí celá řada postupů pro léčbu v akutní i chronické fázi míšního poranění. V akutní fázi je spektrum terapeutických možností větší a výsledky na zvířatech slibnější. Výsledky experimentálních studií opakovaně prokázaly částečný efekt některých metod u laboratorních zvířat. Nicméně pozitivní výsledky zatím nebyly jednoznačně replikovány v klinice. Na druhou stranu většina dosud publikovaných klinických studií neprokázala zásadní komplikace nových experimentálních metod, alespoň ve střednědobém časovém horizontu. Významně se tak rozvíjí oblast kmenových buněk, tkáňového inženýrství či molekulární biologie, což snad dává důvod k opatrnému optimizmu směrem k budoucnosti.
Transfer léčby z oblasti experimentu do klinické praxe má nicméně spoustu úskalí. Laboratorní zvířata (myši, potkani apod.) mají větší schopnost regenerace a vyšší reparační potenciál v porovnání s lidmi. Experimentální studie jsou přísně kontrolované pokusy, kde lze zvolit uniformní věk laboratorních zvířat, stejnou váhu, pohlaví apod. Experimentální léze jsou stejné pro všechna zvířata, prováděná naprosto identicky a ve stejné etáži míšní. Experimentální léčba je podávána ve stejné dávce, metoda aplikace je jednotná pro všechna zvířata. Klinická praxe a klinické studie, na rozdíl od laboratorního prostředí, jsou daleko rozličnější. S tím souvisí různorodost pacientů (věk, pohlaví, váha), charakteristika míšního poranění (výška, typ, rozsah) či různá doba od poranění míchy do aplikace.
Doposud také neexistuje konsenzus, za jakých podmínek je možné přejít od experimentálního výzkumu ke klinickým studiím [136]. Je nutné reprodukovat výsledky z laboratorních potkanů a myší i na lidoopech? Dostačuje funkční zlepšení laboratorního zvířete po podání experimentální léčby k průkazu dostatečného efektu, nebo je nutné, aby tento jev doprovázely i histologické změny?
Přechod z oblasti laboratorních pokusů do klinické praxe je proto jedním ze zásadních momentů vývoje léčby míšního poranění. I přes dosavadní úspěchy převážně na poli experimentálního výzkumu jsme teprve na počátku definitivního vyřešení problematiky léčby míšního poranění. Doufejme, že všechny překážky, které nás na cestě k léčbě míšního poranění ještě čekají, v budoucnosti překonáme, abychom našim nemocným poskytli tolik očekávanou léčbu. Doposud takto učinit nemůžeme. Zatím lze pacientům nabídnout standardní léčbu s eventualitou klinických studií v rámci grantových projektů.
Podpořeno grantovou agenturou České republiky 13-00939S, 14-14961S a projektem LO1309 MŠMT ČR v rámci programu NPU I.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 20. 4. 2015
Přijato do tisku: 8. 7. 2015
MUDr. Aleš Hejčl, Ph.D.
Neurochirurgická klinika
UJEP a Krajská zdravotní a.s.
Masarykova nemocnice v Ústí nad Labem, o.z.
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: ales.hejcl@gmail.com
Recenzenti
MUDr. Radim Mazanec, Ph.D.
prof. MUDr. Vladimír Smrčka, CSc.
prof. MUDr. Martin Smrčka, Ph.D.
MUDr. Petr Vaněk
MU Dr. Aleš Hejčl, Ph.D.
Po ukončení studia na 1. LF UK v roce 2003 nastoupil na Neurochirurgickou kliniku UJEP v Ústí nad Labem. V klinické praxi se zabývá celým spektrem neurochirurgické operativy, hlouběji se věnuje mozkovým aneuryzmatům a monitoraci mozku po traumatech a SAK. V roce 2010 získal atestaci v oboru neurochirurgie. Od roku 2012 pracuje jako Senior Researcher v rámci Mezinárodního centra klinického výzkumu v Brně a ve spolupráci s Mayo Clinic a Matematickým ústavem UK se zabývá modelováním hemodynamiky v mozkových aneuryzmatech. Od roku 2002 pracuje v Ústavu experimentální medicíny AV ČR, kde se věnuje experimentálním operacím míšního poranění. V roce 2010 obhájil titul Ph.D. na téma „Experimentální přemostění míšního poranění pomocí hydrogelů“. Od roku 2012 přednáší na Neurochirurgické klinice 1. LF UK a ÚVN Praha. Je autorem více než 50 publikací a pěti kapitol v odborných publikacích. V současnosti je hlavním řešitelem dvou grantů. Od roku 2013 je školitelem v oblasti neurověd, v současnosti vede dva studenty. Je laureátem Ceny Rudolfa Petra České neurochirurgické společnosti za rok 2008 a v roce 2010 získal Cenu společnosti pro neurovědy za vynikající vědeckou práci mladých neurovědců. Je členem České neurochirurgické společnosti a České společnosti pro neurovědy ČLS JEP.
Zdroje
1. Beneš V. Poranění míchy. Praha: Avicenum 1987.
2. Hughes JT. The Edwin Smith Surgical Papyrus: an analysis of the first case reports of spinal cord injuries. Paraplegia 1988; 26(2): 71 – 82.
3. Marketos SG, Skiadas P. Hippocrates. The father of spine surgery. Spine (Phila Pa 1976) 1999; 24(13): 1381 – 1387.
4. Marketos SG, Skiadas PK. Galen: a pioneer of spine research. Spine (Phila Pa 1976) 1999; 24(22): 2358 – 2362.
5. Knoeller SM, Seifried C. Historical perspective: history of spinal surgery. Spine 2000; 25(21): 2838 – 2843.
6. Guttmann L. Spinal cord injuries: comprehensive management and research. Oxford: Blackwell Scientific 1973.
7. Walker AE. A history of neurological surgery. New York: Hafner 1967.
8. Schlesinger EB. Alfred Reginald Allen: the mythic career of a gifted neuroscientist. Surg Neurol 1991; 36(3): 229 – 233.
9. Beneš Vr. Spinal cord injury. London: Baillière, Tindall & Cassell 1968.
10. Česká společnost pro míšní léze ČLS JEP. [online]. Dostupné z URL: www.spinalcord.cz.
11. Spinal Cord Injury (SCI), facts and fiures at a glance. [online]. Available from URL: https:/ / www.nscisc.uab.edu/ PublicDocuments/ fact_figures_docs/ Facts%202014.pdf.
12. Reier PJ, Perlow MJ, Guth L. Development of embryonic spinal cord transplants in the rat. Brain Res 1983; 312(2): 201 – 219.
13. Bunge RP, Puckett WR, Becerra JL, Marcillo A, Quencer RM. Observations on the pathology of human spinal cord injury. A review and classification of 22 new cases with details from a case of chronic cord compression with extensive focal demyelination. Adv Neurol 1993; 59 : 75 – 89.
14. Yoon SH, Shim YS, Park YH, Chung JK, Nam JH, Kim MO et al. Complete spinal cord injury treatment using autologous bone marrow cell transplantation and bone marrow stimulation with granulocyte macrophage ‑ colony stimulating factor: Phase I/ II clinical trial. Stem Cells 2007; 25(8): 2066 – 2073.
15. Kiwerski J. The natural history of neurological recovery in patients with traumatic tetraplegia. Paraplegia 1989; 27(1): 41 – 45.
16. Lim PA, Tow AM. Recovery and regeneration after spinal cord injury: a review and summary of recent literature. Ann Acad Med Singapore 2007; 36(1): 49 – 57.
17. Bareyre FM, Kerschensteiner M, Raineteau O, Mettenleiter TC, Weinmann O, Schwab ME. The injured spinal cord spontaneously forms a new intraspinal circuit in adult rats. Nature Neurosci 2004; 7(3): 269 – 277.
18. Nishio T. Axonal regeneration and neural network reconstruction in mammalian CNS. J Neurol 2009; 256 (Suppl 3): 306 – 309. doi: 10.1007/ s00415 ‑ 009 ‑ 5244 ‑ x.
19. Kříž J, Háková R, Hyšperská V, Hlinková Z, Lukáš R, Anděl R. Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013. Cesk Slov Neurol N 2014; 77/ 110(1): 77 – 81.
20. Lukas R, Zykova I, Barsa P, Sram J. Current role of methylprednisolone in the treatment of acute spinal cord injury. Acta Chir Orthop Traumatol Cech 2011; 78(4): 305 – 313.
21. Bracken MB. Steroids for acute spinal cord injury. The Cochrane database of systematic reviews 2012; 1: CD001046. doi: 10.1002/ 14651858.CD001046.pub2.
22. Bracken MB, Shepard MJ, Collins WF, Holford TR, Young W, Baskin DS et al. A randomized, controlled trial of methylprednisolone or naloxone in the treatment of acute spinal ‑ cord injury. Results of the Second National Acute Spinal Cord Injury Study. New Engl J Med 1990; 322(20): 1405 – 1411.
23. Bracken MB, Shepard MJ, Hellenbrand KG, Collins WF, Leo LS, Freeman DF et al. Methylprednisolone and neurological function 1 year after spinal cord injury. Results of the National Acute Spinal Cord Injury Study. J Neurosurg 1985; 63(5): 704 – 713.
24. Bracken MB, Shepard MJ, Holford TR, Leo ‑ Summers L, Aldrich EF, Fazl M et al. Administration of methylprednisolone for 24 or 48 hours or tirilazad mesylate for 48 hours in the treatment of acute spinal cord injury. Results of the Third National Acute Spinal Cord Injury Randomized Controlled Trial. National Acute Spinal Cord Injury Study. JAMA 1997; 277(20): 1597 – 1604.
25. Hurlbert RJ, Hadley MN, Walters BC, Aarabi B, Dhall SS, Gelb DE et al. Pharmacological therapy for acute spinal cord injury. Neurosurgery 2013; 72 (Suppl 2): 93 – 105.
26. Walters BC, Hadley MN, Hurlbert RJ, Aarabi B, Dhall SS, Gelb DE et al. Guidelines for the management of acute cervical spine and spinal cord injuries: 2013 update. Neurosurgery 2013; 60 (Suppl 1): 82 – 91. doi: 10.1227/ 01.neu.0000430319.32247.7f.
27. Vaccaro AR, Daugherty RJ, Sheehan TP, Dante SJ, Cotler JM, Balderston RA et al. Neurologic outcome of early versus late surgery for cervical spinal cord injury. Spine 1997; 22(22): 2609 – 2613.
28. Fehlings MG, Vaccaro A, Wilson JR, Singh A, Cadotte WD, Harrop JS et al. Early versus delayed decompression for traumatic cervical spinal cord injury: results of the Surgical Timing in Acute Spinal Cord Injury Study (STASCIS). PloS One 2012; 7(2): e32037. doi: 10.1371/ journal.pone.0032037.
29. Lenehan B, Fisher CG, Vaccaro A, Fehlings M, Aarabi B, Dvorak MF. The urgency of surgical decompression in acute central cord injuries with spondylosis and without instability. Spine 2010; 35 (Suppl 21): S180 – S186.
30. Carlson GD, Gorden CD, Oliff HS, Pillai JJ, LaManna JC. Sustained spinal cord compression: part I: time ‑ dependent effect on long‑term pathophysiology. J Bone Joint Surg Am 2003; 85(1): 86 – 94.
31. Dimar JR 2nd, Glassman SD, Raque GH, Zhang YP, Shields CB. The influence of spinal canal narrowing and timing of decompression on neurologic recovery after spinal cord contusion in a rat model. Spine 1999; 24(16): 1623 – 1633.
32. De Leon RD, Hodgson JA, Roy RR, Edgerton VR. Full weight ‑ bearing hindlimb standing following stand training in the adult spinal cat. J Neurophysiol 1998; 80(1): 83 – 91.
33. Ichiyama RM, Courtine G, Gerasimenko YP, Yang GJ, van den Brand R, Lavrov IA et al. Step training reinforces specific spinal locomotor circuitry in adult spinal rats. J Neurosci 2008; 28(29): 7370 – 7375. doi: 10.1523/ JNEUROSCI.1881 ‑ 08.2008.
34. Harkema S, Gerasimenko Y, Hodes J, Burdick J, Angeli C, Chen Y et al. Effect of epidural stimulation of the lumbosacral spinal cord on voluntary movement, standing and assisted stepping after motor complete paraplegia: a case study. Lancet 2011; 377(9781): 1938 – 1947. doi: 10.1016/ S0140 ‑ 6736(11)60547 ‑ 3.
35. Tronnier V, Baron R, Birklein F, Eckert S, Harke H, Horstkotte D et al. Epidural spinal cord stimulation for therapy of chronic pain. Summary of the S3 guideline. Schmerz 2011; 25(5): 484 – 492. doi: 10.1007/ s00482 ‑ 011 ‑ 1094 ‑ 4.
36. Minassian K, Persy I, Rattay F, Pinter MM, Kern H, Dimitrijevic MR. Human lumbar cord circuitries can be activated by extrinsic tonic input to generate locomotor‑like activity. Hum Mov Sci 2007; 26(2): 275 – 295.
37. Nornes HO, Das GD. Temporal pattern of neurogenesis in spinal cord of rat. I. An autoradiographic study ‑ time and sites of origin and migration and settling patterns of neuroblasts. Brain Res 1974; 73(1): 121 – 138.
38. Richardson RM, Sun D, Bullock MR. Neurogenesis after traumatic brain injury. Neurosurg Clin N Am 2007; 18(1): 169 – 181.
39. Fiorelli R, Cebrian ‑ Silla A, Garcia ‑ Verdugo JM, Raineteau O. The adult spinal cord harbors a population of GFAP ‑ positive progenitors with limited self ‑ renewal potential. Glia 2013; 61(12): 2100 – 2113. doi: 10.1002/ glia.22579.
40. Prockop DJ. Marrow stromal cells as stem cells for nonhematopoietic tissues. Science 1997; 276(5309): 71 – 74.
41. Woodbury D, Schwarz EJ, Prockop DJ, Black IB. Adult rat and human bone marrow stromal cells differentiate into neurons. J Neurosci Res 2000; 61(4): 364 – 370.
42. Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 2006; 126(4): 663 – 676.
43. Thomson JA, Itskovitz ‑ Eldor J, Shapiro SS, Waknitz MA, Swiergiel JJ, Marshall VS et al. Embryonic stem cell lines derived from human blastocysts. Science 1998; 282(5391): 1145 – 1147.
44. McDonald JW, Liu XZ, Qu Y, Liu S, Mickey SK, Turetsky D et al. Transplanted embryonic stem cells survive, differentiate and promote recovery in injured rat spinal cord. Nature Med 1999; 5(12): 1410 – 1412.
45. Hendricks WA, Pak ES, Owensby JP, Menta KJ, Glazova M, Moretto J et al. Predifferentiated embryonic stem cells prevent chronic pain behaviors and restore sensory function following spinal cord injury in mice. Mol Med 2006; 12(1 – 3): 34 – 46.
46. Lees JG, Lim SA, Croll T, Williams G, Lui S, Cooper ‑ -White J et al. Transplantation of 3D scaffolds seeded with human embryonic stem cells: biological features of surrogate tissue and teratoma ‑ forming potential. Regen Med 2007; 2(3): 289 – 300.
47. Suter DM, Krause KH. Neural commitment of embryonic stem cells: molecules, pathways and potential for cell therapy. J Pathol 2008; 215(4): 355 – 368. doi: 10.1002/ path.2380.
48. Alper J. Geron gets green light for human trial of ES cell ‑ derived product. Nat Biotechnol 2009; 27(3): 213 – 214. doi: 10.1038/ nbt0309 ‑ 213a.
49. Strauss S. Geron trial resumes, but standards for stem cell trials remain elusive. Nat Biotechnol 2010; 28(10): 989 – 990. doi: 10.1038/ nbt1010 ‑ 989.
50. Miura K, Okada Y, Aoi T, Okada A, Takahashi K, Okita Ket al. Variation in the safety of induced pluripotent stem cell lines. Nat Biotechnol 2009; 27(8): 743 – 745. doi: 10.1038/ nbt.1554.
51. Nori S, Okada Y, Yasuda A, Tsuji O, Takahashi Y, Kobayashi Y et al. Grafted human‑induced pluripotent stem ‑ cell ‑ derived neurospheres promote motor functional recovery after spinal cord injury in mice. Proc Natl Acad Sci U S A 2011; 108(40): 16825 – 16830. doi: 10.1073/ pnas.1108077108.
52. Romanyuk N, Amemori T, Turnovcova K, Prochazka P, Onteniente B, Sykova E et al. Beneficial effect of human induced pluripotent stem cell ‑ derived neural precursors in spinal cord injury repair. Cell Transplant 2014; 15(8 – 9): 675 – 687.
53. Kobayashi Y, Okada Y, Itakura G, Iwai H, Nishimura S, Yasuda A et al. Pre‑evaluated safe human iPSC ‑ derived neural stem cells promote functional recovery after spinal cord injury in common marmoset without tumorigenicity. PloS One 2012; 7(12): e52787.
54. Forostyak S, Jendelova P, Sykova E. The role of mesenchymal stromal cells in spinal cord injury, regenerative medicine and possible clinical applications. Biochimie 2013; 95(12): 2257 – 2270. doi: 10.1016/ j.biochi.2013.08.004.
55. Hejčl A, Jendelová P, Sameš M, Syková E. The Use of Mesenchymal Stem Cells in the Experimental and Clinical Therapy of Spinal Cord Injury. Cesk Slov Neurol N 2014; 77/ 110(5): 560 – 567.
56. Arboleda D, Forostyak S, Jendelova P, Marekova D, Amemori T, Pivonkova H et al. Transplantation of predifferentiated adipose‑derived stromal cells for the treatment of spinal cord injury. Cell Mol Neurobiol 2011; 31(7): 1113 – 1122. doi: 10.1007/ s10571 ‑ 011 ‑ 9712 ‑ 3.
57. Sasaki M, Honmou O, Akiyama Y, Uede T, Hashi K, Kocsis JD. Transplantation of an acutely isolated bone marrow fraction repairs demyelinated adult rat spinal cord axons. Glia 2001; 35(1): 26 – 34.
58. Akiyama Y, Radtke C, Kocsis JD. Remyelination of the rat spinal cord by transplantation of identified bone marrow stromal cells. J Neurosci 2002; 22(15): 6623 – 6630.
59. Ankeny DP, McTigue DM, Jakeman LB. Bone marrow transplants provide tissue protection and directional guidance for axons after contusive spinal cord injury in rats. Exp Neurol 2004; 190(1): 17 – 31.
60. Hofstetter CP, Schwarz EJ, Hess D, Widenfalk J, El Manira A, Prockop DJ et al. Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery. Proc Natl Acad Sci U S A 2002; 99(4): 2199 – 2204.
61. Ohta M, Suzuki Y, Noda T, Ejiri Y, Dezawa M, Kataoka K et al. Bone marrow stromal cells infused into the cerebrospinal fluid promote functional recovery of the injured rat spinal cord with reduced cavity formation. Exp Neurol 2004; 187(2): 266 – 278.
62. Quertainmont R, Cantinieaux D, Botman O, Sid S, Schoenen J, Franzen R. Mesenchymal stem cell graft improves recovery after spinal cord injury in adult rats through neurotrophic and pro‑angiogenic actions. PloS One 2012; 7(6): e39500. doi: 10.1371/ journal.pone.0039500.
63. Urdzikova L, Jendelova P, Glogarova K, Burian M, Hajek M, Sykova E. Transplantation of bone marrow stem cells as well as mobilization by granulocyte ‑ colony stimulating factor promotes recovery after spinal cord injury in rats. J Neurotrauma 2006; 23(9): 1379 – 1391.
64. Urdzikova LM, Ruzicka J, LaBagnara M, Karova K, Kubinova S, Jirakova K et al. Human mesenchymal stem cells modulate inflammatory cytokines after spinal cord injury in rat. Int J Mol Sci 2014; 15(7): 11275 – 11293. doi: 10.3390/ ijms150711275.
65. Spaeth E, Klopp A, Dembinski J, Andreeff M, Marini F. Inflammation and tumor microenvironments: defining the migratory itinerary of mesenchymal stem cells. Gene Ther 2008; 15(10): 730 – 738. doi: 10.1038/ gt.2008.39.
66. Nishida H, Nakayama M, Tanaka H, Kitamura M, Hatoya S, Sugiura K et al. Evaluation of transplantation of autologous bone marrow stromal cells into the cerebrospinal fluid for treatment of chronic spinal cord injury in dogs. Am J Vet Res 2011; 72(8): 1118 – 1123. doi: 10.2460/ ajvr.72.8.1118.
67. Lim JH, Byeon YE, Ryu HH, Jeong YH, Lee YW, Kim WH et al. Transplantation of canine umbilical cord blood ‑ derived mesenchymal stem cells in experimentally induced spinal cord injured dogs. J Vet Sci 2007; 8(3): 275 – 282.
68. Sohni A, Verfaillie CM. Mesenchymal stem cells migration homing and tracking. Stem Cells Int 2013; 2013 : 130763. doi: 10.1155/ 2013/ 130763.
69. Kim JW, Ha KY, Molon JN, Kim YH. Bone marrow ‑ derived mesenchymal stem cell transplantation for chronic spinal cord injury in rats: comparative study between intralesional and intravenous transplantation. Spine 2013; 38(17): E1065 – E1074. doi: 10.1097/ BRS.0b013e31829839fa.
70. Vaquero J, Zurita M, Oya S, Santos M. Cell therapy using bone marrow stromal cells in chronic paraplegic rats: systemic or local administration? Neurosci Lett 2006; 398(1 – 2): 129 – 134.
71. Sykova E, Homola A, Mazanec R, Lachmann H, Konradova SL, Kobylka P et al. Autologous bone marrow transplantation in patients with subacute and chronic spinal cord injury. Cell Transplant 2006; 15(8 – 9): 675 – 687.
72. Kadota R, Koda M, Kawabe J, Hashimoto M, Nishio Y, Mannoji C et al. Granulocyte colony ‑ stimulating factor (G‑CSF) protects oligodendrocyte and promotes hindlimb functional recovery after spinal cord injury in rats. PloS One 2012; 7(11): e50391. doi: 10.1371/ journal.pone.0050391.
73. Sykova E, Jendelova P. Magnetic resonance tracking of implanted adult and embryonic stem cells in injured brain and spinal cord. Ann NY Acad Sci 2005; 1049 : 146 – 160.
74. Jendelova P, Herynek V, Urdzikova L, Glogarova K, Kroupova J, Andersson B et al. Magnetic resonance tracking of transplanted bone marrow and embryonic stem cells labeled by iron oxide nanoparticles in rat brain and spinal cord. J Neurosci Res 2004; 76(2): 232 – 243.
75. Sykova E, Jendelova P. Magnetic resonance tracking of transplanted stem cells in rat brain and spinal cord. Neurodegener Dis 2006; 3(1 – 2): 62 – 67.
76. Sykova E, Jendelova P. In vivo tracking of stem cells in brain and spinal cord injury. Prog Brain Res 2007; 161 : 367 – 383.
77. Arthur ‑ Farraj PJ, Latouche M, Wilton DK, Quintes S, Chabrol E, Banerjee A et al. C ‑ Jun reprograms Schwann cells of injured nerves to generate a repair cell essential for regeneration. Neuron 2012; 75(4): 633 – 647. doi: 10.1016/ j.neuron.2012.06.021.
78. Guest J, Santamaria AJ, Benavides FD. Clinical translation of autologous Schwann cell transplantation for the treatment of spinal cord injury. Curr Opin Organ Tran 2013; 18(6): 682 – 689. doi: 10.1097/ MOT.0000000000000026.
79. David S, Aguayo AJ. Axonal elongation into peripheral nervous system “bridges” after central nervous system injury in adult rats. Science 1981; 214(4523): 931 – 933.
80. Hurtado A, Moon LD, Maquet V, Blits B, Jerome R, Oudega M. Poly (D, L ‑ lactic acid) macroporous guidance scaffolds seeded with Schwann cells genetically modified to secrete a bi ‑ functional neurotrophin implanted in the completely transected adult rat thoracic spinal cord. Biomaterials 2006; 27(3): 430 – 442.
81. Sun T, Ye C, Zhang Z, Wu J, Huang H. Cotransplantation of olfactory ensheathing cells and Schwann cells combined with treadmill training promotes functional recovery in rats with contused spinal cords. Cell Transplant 2013; 22 (Suppl 1): S27 – S38. doi: 10.3727/ 096368913X672118.
82. Oudega M, Gautier SE, Chapon P, Fragoso M, Bates ML, Parel JM et al. Axonal regeneration into Schwann cell grafts within resorbable poly(alpha ‑ hydroxyacid) guidance channels in the adult rat spinal cord. Biomaterials 2001; 22(10): 1125 – 1136.
83. Saberi H, Moshayedi P, Aghayan HR, Arjmand B, Hosseini SK, Emami ‑ Razavi SH et al. Treatment of chronic thoracic spinal cord injury patients with autologous Schwann cell transplantation: an interim report on safety considerations and possible outcomes. Neurosci Lett 2008; 443(1): 46 – 50. doi: 10.1016/ j.neulet.2008.07.041.
84. Saberi H, Firouzi M, Habibi Z, Moshayedi P, Aghayan HR, Arjmand B et al. Safety of intramedullary Schwann cell transplantation for postrehabilitation spinal cord injuries: 2‑year follow‑up of 33 cases. J Neurosurg Spine 2011; 15(5): 515 – 525. doi: 10.3171/ 2011.6.SPINE10917.
85. Zhou XH, Ning GZ, Feng SQ, Kong XH, Chen JT, Zheng YF et al. Transplantation of autologous activated Schwann cells in the treatment of spinal cord injury: six cases, more than five years of follow‑up. Cell Transplant 2012; 21 (Suppl 1): S39 – S47. doi: 10.3727/ 096368912X633752.
86. Doucette JR. The glial cells in the nerve fiber layer of the rat olfactory bulb. Anat Rec 1984; 210(2): 385 – 391.
87. Pixley SK. The olfactory nerve contains two populations of glia, identified both in vivo and in vitro. Glia 1992; 5(4): 269 – 284.
88. Huang ZH, Wang Y, Cao L, Su ZD, Zhu YL, Chen YZ et al. Migratory properties of cultured olfactory ensheathing cells by single‑cell migration assay. Cell Res 2008; 18(4): 479 – 490. doi: 10.1038/ cr.2008.38.
89. Lu J, Ashwell K. Olfactory ensheathing cells: their potential use for repairing the injured spinal cord. Spine 2002; 27(8): 887 – 892.
90. Lu J, Feron F, Ho SM, Mackay ‑ Sim A, Waite PM. Transplantation of nasal olfactory tissue promotes partial recovery in paraplegic adult rats. Brain Res 2001; 889(1 – 2): 344 – 357.
91. Lu J, Feron F, Mackay ‑ Sim A, Waite PM. Olfactory ensheathing cells promote locomotor recovery after delayed transplantation into transected spinal cord. Brain 2002; 125(1): 14 – 21.
92. Ramon ‑ Cueto A. Olfactory ensheathing glia transplantation into the injured spinal cord. Prog Brain Res 2000; 128 : 265 – 272.
93. Ramon ‑ Cueto A, Cordero MI, Santos ‑ Benito FF, Avila J. Functional recovery of paraplegic rats and motor axon regeneration in their spinal cords by olfactory ensheathing glia. Neuron 2000; 25(2): 425 – 435.
94. Rubio MP, Munoz ‑ Quiles C, Ramon ‑ Cueto A. Adult olfactory bulbs from primates provide reliable ensheathing glia for cell therapy. Glia 2008; 56(5): 539 – 551. doi: 10.1002/ glia.20635.
95. Feron F, Perry C, Cochrane J, Licina P, Nowitzke A, Urquhart S et al. Autologous olfactory ensheathing cell transplantation in human spinal cord injury. Brain 2005; 128(12): 2951 – 2960.
96. Mackay ‑ Sim A, Feron F, Cochrane J, Bassingthwaighte L, Bayliss C, Davies W et al. Autologous olfactory ensheathing cell transplantation in human paraplegia: a 3‑year clinical trial. Brain 2008; 131(9): 2376 – 2386. doi: 10.1093/ brain/ awn173.
97. Chen L, Huang H, Xi H, Zhang F, Liu Y, Chen D et al. A prospective randomized double blind clinical trial using a combination of olfactory ensheathing cells and Schwann cells for the treatment of chronic complete spinal cord injuries. Cell Transplant 2014; 23 (Suppl 1): S35 – S44. doi: 10.3727/ 096368914X685014.
98. Tabakow P, Raisman G, Fortuna W, Czyz M, Huber J, Li D et al. Functional regeneration of supraspinal connections in a patient with transected spinal cord following transplantation of bulbar olfactory ensheathing cells with peripheral nerve bridging. Cell Transplant 2014; 23(12): 1631 – 1655. doi: 10.3727/ 096368914X685131.
99. Dlouhy BJ, Awe O, Rao RC, Kirby PA, Hitchon PW. Autograft ‑ derived spinal cord mass following olfactory mucosal cell transplantation in a spinal cord injury patient. J Neurosurg Spine 2014; 21(4): 618 – 622. doi: 10.3171/ 2014.5.SPINE13992.
100. Donnelly DJ, Popovich PG. Inflammation and its role in neuroprotection, axonal regeneration and functional recovery after spinal cord injury. Exp Neurol 2008; 209(2): 378 – 388.
101. Schwartz M, Yoles E. Immune‑based therapy for spinal cord repair: autologous macrophages and beyond. J Neurotrauma 2006; 23(3 – 4): 360 – 370.
102. Lammertse DP, Jones LA, Charlifue SB, Kirshblum SC, Apple DF, Ragnarsson KT et al. Autologous incubated macrophage therapy in acute, complete spinal cord injury: results of the phase 2 randomized controlled multicenter trial. Spinal Cord 2012; 50(9): 661 – 671. doi: 10.1038/ sc.2012.39.
103. Gensel JC, Zhang B. Macrophage activation and its role in repair and pathology after spinal cord injury. Brain Res 2015. doi: 10.1016/ j.brainres.2014.12.045.
104. Schwab ME, Caroni P. Oligodendrocytes and CNS myelin are nonpermissive substrates for neurite growth and fibroblast spreading in vitro. J Neurosci 1988; 8(7): 2381 – 2393.
105. Huber AB, Weinmann O, Brosamle C, Oertle T, Schwab ME. Patterns of Nogo mRNA and protein expression in the developing and adult rat and after CNS lesions. J Neurosci 2002; 22(9): 3553 – 3567.
106. Schwab ME. Nogo and axon regeneration. Curr Opin Neurobiol 2004; 14(1): 118 – 124.
107. Hawryluk GW, Rowland J, Kwon BK, Fehlings MG. Protection and repair of the injured spinal cord: a review of completed, ongoing and planned clinical trials for acute spinal cord injury. Neurosurg Focus 2008; 25(5): E14. doi: 10.3171/ FOC.2008.25.11.E14.
108. Fitch MT, Silver J. Glial cell extracellular matrix: boundaries for axon growth in development and regeneration. Cell Tissue Res 1997; 290(2): 379 – 384.
109. McKeon RJ, Schreiber RC, Rudge JS, Silver J. Reduction of neurite outgrowth in a model of glial scarring following CNS injury is correlated with the expression of inhibitory molecules on reactive astrocytes. J Neurosci 1991; 11(11): 3398 – 3411.
110. Davies SJ, Goucher DR, Doller C, Silver J. Robust regeneration of adult sensory axons in degenerating white matter of the adult rat spinal cord. J Neurosci 1999; 19(14): 5810 – 5822.
111. Bradbury EJ, Moon LD, Popat RJ, King VR, Bennett GS, Patel PN et al. Chondroitinase ABC promotes functional recovery after spinal cord injury. Nature 2002; 416(6881): 636 – 640.
112. Cafferty WB, Yang SH, Duffy PJ, Li S, Strittmatter SM. Functional axonal regeneration through astrocytic scar genetically modified to digest chondroitin sulfate proteoglycans. J Neurosci 2007; 27(9): 2176 – 2185.
113. Hejcl A, Sedy J, Kapcalova M, Toro DA, Amemori T, Lesny P et al. HPMA ‑ RGD hydrogels seeded with mesenchymal stem cells improve functional outcome in chronic spinal cord injury. Stem Cells Dev 2010; 19(10): 1535 – 1546. doi: 10.1089/ scd.2009.0378.
114. Hejcl A, Lesny P, Pradny M, Michalek J, Jendelova P, Stulik J et al. Biocompatible hydrogels in spinal cord injury repair. Physiol Res 2008; 57 (Suppl 3): S121 – S132.
115. Sykova E, Jendelova P, Urdzikova L, Lesny P, Hejcl A. Bone marrow stem cells and polymer hydrogels ‑ two strategies for spinal cord injury repair. Cell Mol Neurobiol 2006; 26(7 – 8): 1113 – 1129.
116. Kubinova S, Sykova E. Biomaterials combined with cell therapy for treatment of spinal cord injury. Regen Med 2012; 7(2): 207 – 224. doi: 10.2217/ rme.11.121.
117. King VR, Alovskaya A, Wei DY, Brown RA, Priestley JV. The use of injectable forms of fibrin and fibronectin to support axonal ingrowth after spinal cord injury. Biomaterials 2010; 31(15): 4447 – 4456. doi: 10.1016/ j.biomaterials.2010.02.018.
118. Novikova LN, Novikov LN, Kellerth JO. Biopolymers and biodegradable smart implants for tissue regeneration after spinal cord injury. Curr Opin Neurol 2003; 16(6): 711 – 715.
119. Pradny M, Michalek J, Lesny P, Hejcl A, Vacik J, Slouf M et al. Macroporous hydrogels based on 2 ‑ hydroxyethyl methacrylate. Part 5: hydrolytically degradable materials. J Mater Sci Mater Med 2006; 17(12): 1357 – 1364.
120. Kubinova S, Horak D, Hejcl A, Plichta Z, Kotek J, Proks V et al. SIKVAV ‑ modified highly superporous PHEMA scaffolds with oriented pores for spinal cord injury repair. J Tissue Eng Regen Med 2013. doi: 10.1002/ term.1694.
121. Hejcl A, Ruzicka J, Kapcalova M, Turnovcova K, Krumbholcova E, Pradny M et al. Adjusting the chemical and physical properties of hydrogels leads to improved stem cell survival and tissue ingrowth in spinal cord injury reconstruction: a comparative study of four methacrylate hydrogels. Stem Cells Dev 2013; 22(20): 2794 – 2805. doi: 10.1089/ scd.2012.0616.
122. Kubinova S, Sykova E. Nanotechnologies in regenerative medicine. Minimally invasive therapy & allied technologies: MITAT 2010; 19(3): 144 – 156. doi: 10.3109/ 13645706.2010.481398.
123. Medberry CJ, Crapo PM, Siu BF, Carruthers CA, Wolf MT, Nagarkar SP et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials 2013; 34(4): 1033 – 1040. doi: 10.1016/ j.biomaterials.2012.10.062.
124. Li C, Zhang X, Cao R, Yu B, Liang H, Zhou M et al. Allografts of the acellular sciatic nerve and brain‑derived neurotrophic factor repair spinal cord injury in adult rats. PloS One 2012; 7(8): e42813. doi: 10.1371/ journal.pone.0042813.
125. Bible E, Dell’Acqua F, Solanky B, Balducci A, Crapo PM, Badylak SF et al. Non ‑ invasive imaging of transplanted human neural stem cells and ECM scaffold remodeling in the stroke ‑ damaged rat brain by (19)F ‑ and diffusion ‑ MRI. Biomaterials 2012; 33(10): 2858 – 2871. doi: 10.1016/ j.biomaterials.2011.12.033.
126. Ruzicka J, Romanyuk N, Hejcl A, Vetrik M, Hruby M, Cocks G et al. Treating spinal cord injury in rats with a combination of human fetal neural stem cells and hydrogels modified with serotonin. Acta Neurobiol Exp 2013; 73(1): 102 – 115.
127. Liu S, Kadi K, Boisset N, Lacroix C, Said G, Tadie M. Reinnervation of denervated lumbar ventral roots and their target muscle by thoracic spinal motoneurons via an implanted nerve autograft in adult rats after spinal cord injury. J Neurosci Res 1999; 56(5): 506 – 517.
128. Liu S, Aghakhani N, Boisset N, Said G, Tadie M. Innervation of the caudal denervated ventral roots and their target muscles by the rostral spinal motoneurons after implanting a nerve autograft in spinal cord ‑ injured adult marmosets. J Neurosurg 2001; 94 (Suppl 1): 82 – 90.
129. Emery E, Rhrich ‑ Haddout F, Kassar ‑ Duchossoy L, Lyoussi B, Tadié M, Horvat JC. Motoneurons of the adult marmoset can grow axons and reform motor endplates through a peripheral nerve bridge joining the locally injured cervical spinal cord to the denervated biceps brachii muscle. J Neurosci Res 2000; 62(6): 821 – 829.
130. Tadie M, Liu S, Robert R, Guiheneuc P, Pereon Y, Perrouin‑Verbe B et al. Partial return of motor function in paralyzed legs after surgical bypass of the lesion site by nerve autografts three years after spinal cord injury. J Neurotrauma 2002; 19(8): 909 – 916.
131. Amemori T, Jendelova P, Ruzickova K, Arboleda D, Sykova E. Co ‑ transplantation of olfactory ensheathing glia and mesenchymal stromal cells does not have synergistic effects after spinal cord injury in the rat. Cytotherapy 2010; 12(2): 212 – 225. doi: 10.3109/ 14653240903440103.
132. Zhang J, Liu Z, Chen H, Duan Z, Zhang L, Chen L et al. Synergic effects of EPI ‑ NCSCs and OECs on the donor cells migration, the expression of neurotrophic factors, and locomotor recovery of contused spinal cord of rats. J Mol Neurosci 2015; 55(3): 760 – 769. doi: 10.1007/ s12031 ‑ 014 ‑ 0416 ‑ 2.
133. Chen B, He J, Yang H, Zhang Q, Zhang L, Zhang X et al. Repair of spinal cord injury by implantation of bFGF ‑ incorporated HEMA ‑ MOETACL hydrogel in rats. Sci Rep 2015; 5 : 9017. doi: 10.1038/ srep09017.
134. Han Q, Jin W, Xiao Z, Ni H, Wang J, Kong J et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials 2010; 31(35): 9212 – 9220. doi: 10.1016/ j.biomaterials.2010.08.040.
135. Fouad K, Schnell L, Bunge MB, Schwab ME, Liebscher T, Pearse DD. Combining Schwann cell bridges and olfactory ‑ ensheathing glia grafts with chondroitinase promotes locomotor recovery after complete transection of the spinal cord. J Neurosci 2005; 25(5): 1169 – 1178.
136. Kwon BK, Soril LJ, Bacon M, Beattie MS, Blesch A, Bresnahan JC et al. Demonstrating efficacy in preclinical studies of cellular therapies for spinal cord injury – how much is enough? Exp Neurol 2013; 248 : 30 – 44. doi: 10.1016/ j.expneurol.2013.05.012.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Projekt ncRNAPainČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2015 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Experimentální léčba poranění míchy
- Význam magnetické rezonance v diagnostice epilepsie
- Možnosti sledování a hodnocení kvality života u dětí a dospívajících s epilepsií ve světě a v České republice
- Prionový protein, jeho úloha v buněčné proliferaci, diferenciaci a vývoji nervové soustavy
- Předpověď úspěšnosti a selhání endoskopické ventrikulocisternostomie III. komory
- Změny efektivní konektivity po facilitační fyzioterapii u roztroušené sklerózy mozkomíšní
- Projekt ncRNAPain
- Snížení rizika vzniku mozkového infarktu v průběhu kardiochirurgické operace pomocí sonolýzy – pilotní výsledky
- Zachování sluchu při mikrochirurgické léčbě vestibulárního schwannomu
- Validace české verze komplexního protokolu kvantitativního testování senzitivity
- Neurologické syndromy sdružené s protilátkami proti membránovým a synaptickým antigenům
- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Syndrom Freyové (aurikulotemporální syndrom) po parotidektomii a jeho prevence
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
- Úspěšná léčba anti‑MAG neuropatie asociované s monoklonální gamapatií nejistého významu kombinací rituximabu s dexametazonem – kazuistika
- Žilní trombóza jako komplikace ventrikuloatriálního shuntu – kazuistika
- Spinocerebelární ataxie typu 6 – kazuistika
- Diastematomyelie u dospělých – kazuistika
- Webové okénko
-
Analýza dat v neurologii
LII. Odhad poměru šancí u složitějších tabulek četností
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Význam magnetické rezonance v diagnostice epilepsie
- Experimentální léčba poranění míchy
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




