-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
WHO Grade II ependymomy IV. komory u dospělých – zkušenosti s léčbou
WHO Grade II Ependymomas of the Fourth Ventricle in Adults – Single Institution Experience
Introduction:
Surgical resection is a generally accepted standard treatment modality in GII posterior fossa ependymomas in adults, while the role of adjuvant radiotherapy remains unclear. The purpose of this study was to evaluate local control of tumor growth and clinical outcome of patients after surgical treatment of GII fourth ventricle ependymomas.Material and methods:
We conducted a retrospective study of 15 adult patients (seven males and eight females) with histologically confirmed GII fourth ventricular ependymoma between January 2001 and December 2011.Results:
Gross total resection was achieved in 12 patients, none of them received adjuvant treatment after the initial surgery. Median follow-up after GTR was 51 months (min. – max.; 11–123 months). One patient showed radiographic signs of tumor recurrence and was re-operated 51 months after the initial surgery. Remaining patients were without any signs of tumor recurrence. After the surgery, a new neurological deficit occurred in two patients. Two of the three patients after subtotal tumor resection showed residual mass progression after 11 and 16 months postoperatively, one of them was re-operated 27 months after the initial surgery. Adjuvant radiotherapy was indicated in both re-operated patients.Conclusion:
According to our data, gross total resection is effective and safe treatment of GII fourth ventricle ependymomas. Adjuvant radiotherapy should be reserved for the cases where complete removal of tumor mass is not possible and residual tumor is growing, or after repeated resection.Key words:
ependymoma – adult – fourth ventricle – posterior fossa surgery – survival recurrence – radiotherapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: A. Štekláčová; O. Bradáč; V. Beneš
Působiště autorů: Neurochirurgická klinika 1. LF UK a ÚVN – VFN Praha
Vyšlo v časopise: Cesk Slov Neurol N 2014; 77/110(6): 753-759
Kategorie: Krátké sdělení
Práce byla podpořena grantem IGA MZ NT 12254-5 a Institucionální podporou MO 1012.
Souhrn
Úvod:
Kompletní resekce je obecně uznávaný standard léčby GII ependymomů IV. komory u dospělých, zatímco role adjuvantní radioterapie zůstává nejistá. Účelem předkládané studie je zhodnotit lokální kontrolu onemocnění a klinický stav pacientů s tímto onemocněním po chirurgické terapii.Materiál a metody:
Retrospektivně jsme zhodnotili 15 pacientů (sedm mužů a osm žen) s histologicky verifikovaným GII ependymomem IV. komory v časovém období leden 2001 – prosinec 2011.Výsledky:
Kompletní resekce tumoru byla dosažena u 12 pacientů, u žádného z nich nebyla indikována adjuvantní radioterapie. Medián dalšího sledování byl 51 měsíců (min. – max.; 11 – 123 měsíců). Ke grafické recidivě došlo u jednoho pacienta, ten byl reoperován s časovým odstupem 51 měsíců od prvního zákroku. Nový neurologický deficit po operaci byl zaznamenán ve dvou případech. U dvou ze tří pacientů po subtotální resekci došlo ke grafické progresi rezidua po 11 a 16 měsících od první operace, jeden z nich byl reoperován s odstupem 27 měsíců. Adjuvantní radioterapie byla indikována u obou pacientů po reoperaci.Závěr:
Dle našich dat je kompletní resekce efektivní a bezpečná léčba GII ependymomů IV. komory u dospělých. Následná radioterapie by měla být rezervována pro případy subtotální resekce s následnou progresí rezidua tumoru a reoperace.Klíčová slova:
ependymom – dospělý – čtvrtá komora –chirurgie zadní jámy – přežití – recidiva – radioterapieÚvod
Ependymomy tvoří 2 – 5 % všech primárních intrakraniálních nádorů v dospělé populaci [1 – 5]. Infratentoriální lokalizace je méně častá než u dětí, představuje zhruba 50 % všech případů [1,4], relativně častěji je zde histologicky verifikován nižší stupeň – grade II (GII) nádorového onemocnění [6]. Snaha o maximální bezpečnou mikrochirurgickou resekci je u dospělých pacientů obecně uznávaný standard léčby a radikalita výkonu je jeden z hlavních prognostických faktorů dalšího vývoje onemocnění [7 – 11]. Efekt adjuvantní radioterapie je prokázán u pacientů s onemocněním vyššího stupně (GIII) a v případě nízkostupňových tumorů po jejich neúplné resekci [5,7,10]. Další management pacientů s intrakraniálním ependymomem nižšího stupně (GII) po kompletní resekci zatím zůstává předmětem diskuzí [7,10,11].
Předkládaná studie představuje retrospektivní analýzu dat extrahovaných z databáze pacientů s nádorovým onemocněním centrálního nervového systému léčených na Neurochirurgické klinice 1. LF UK a ÚVN – VFN Praha. Cílem autorů bylo zhodnotit léčebnou strategii a kontrolu nádorového onemocnění u dospělých pacientů s intrakraniálním ependymomem IV. komory nízkého stupně (GII) a výsledky chirurgické léčby i následného managementu onemocnění porovnat s již publikovanými literárními soubory.
Materiál a metody
Do prezentované studie byli zahrnuti všichni pacienti z období leden 2001 až prosinec 2011, u kterých byl resekován tumor IV. komory a na základě histopatologického rozboru byla definitivně potvrzena diagnóza ependymomu nízkého stupně – GII. Soubor tvoří 15 pacientů (osm žen, sedm mužů) ve věku 31 – 70 let (průměr 52 let). O indikaci k operaci bylo rozhodnuto na základě indikačního semináře pracoviště autorů po dokončení standardního radiologického a neurologického vyšetření. Chirurgická léčba byla indikována u všech pacientů se symptomatickým onemocněním. Souhrn předoperačních klinických a radiologických dat je v tab. 1.
Tab. 1. Klinický stav pacientů a radiologická charakteristika skupiny předoperačně. 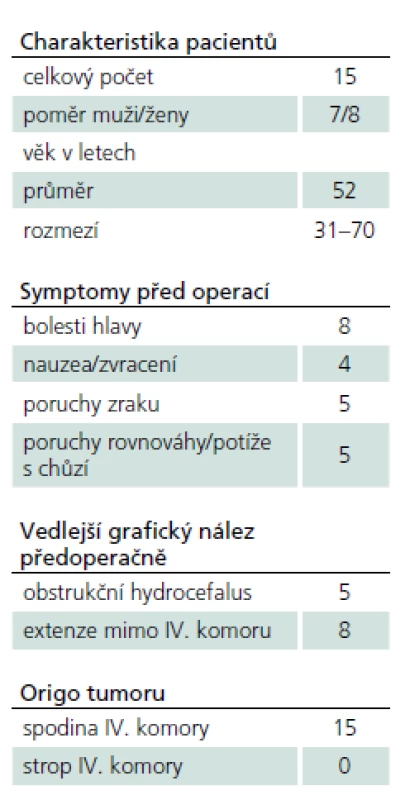
Operace probíhaly s užitím elektrofyziologického monitoringu. Standardně je v současnosti užívána poloha na břiše. Radikalita resekce byla hodnocena nezávisle ve dvou krocích – intraoperačně neurochirurgem a po výkonu neuroradiologem. Resekce byla označena jako kompletní (Gross Total Resection, GTR) v případě, že operatér si nebyl vědom úmyslného ponechání zbytku nádoru a reziduum nebylo patrné ani na pooperačním MR vyšetření. Následná terapie byla indikována multidisciplinárním seminářem za účasti neuroradiologa, neuropatologa a neuroonkologa. Grafické a ambulantní kontroly byly prováděny vždy s odstupem 3, 6 a 12 měsíců po operaci a pak pokaždé jednou ročně.
Pro srovnání s literárními údaji byla provedena literární rešerše. Do ní byly zahrnuty práce počínaje rokem 1990, indexované v databázi PubMed, publikované v anglickém jazyce. Klíčová slova použitá pro vyhledávání samostatně či v kombinaci byla: ependymoma, adult, posterior fossa, fourth ventricle, infratentorial, treatment.
Výsledky
Kompletní resekci bylo možno bezpečně dosáhnout u 12 pacientů. Důvodem inkompletní resekce byla ve všech třech případech blízká odpověď z jádra některého z hlavových nervů na spodině IV. mozkové komory.
Medián doby dalšího sledování po kompletní resekci tumoru během prvního zákroku byl 51 měsíců (min. – max.; 11 – 123 měsíců). Grafická recidiva onemocnění byla diagnostikována na základě pravidelných kontrol u jednoho pacienta po GTR s odstupem 38 měsíců od prvního zákroku, následně byla indikována reoperace. Nádor byl opět odstraněn radikálně a histologicky znovu klasifikován jako GII. Žádný z těchto pacientů nebyl indikován k adjuvantní radioterapii. Další recidivy onemocnění po kompletním odstranění ložiska nádoru nebyly k datu poslední kontroly zaznamenány.
Medián doby dalšího sledování tří pacientů po subtotální resekci tumoru byl 72 měsíců (min. – max.; 50 – 86 měsíců). Jeden z těchto pacientů byl odeslán k adjuvantnímu ozáření zbytku nádoru v těsné blízkosti jádra VII. hlavového nervu na spodině IV. komory, který následně regredoval a v dalším sledování zůstává grafický nález po dobu 31 měsíců stacionární (obr. 1). V případě druhého pacienta s reziduem tumoru v těsné blízkosti X. hlavového nervu jsme zaznamenali zcela minimální grafickou progresi, která byla na všech následných kontrolách bez vývoje, a reoperace zatím nebyla indikována. V případě třetí pacientky, u které nebylo možné dosáhnout během prvního zákroku radikální resekci tumoru, zbytek progredoval. Reoperace byla provedena s odstupem 27 měsíců, jednalo se již o GIII, výkon byl radikální a pacientka byla odeslána k adjuvantní radioterapii dávkou 59,4 Gy (obr. 2).
Obr. 1. Subtotální resekce ependymomu s adjuvantní radioterapií. 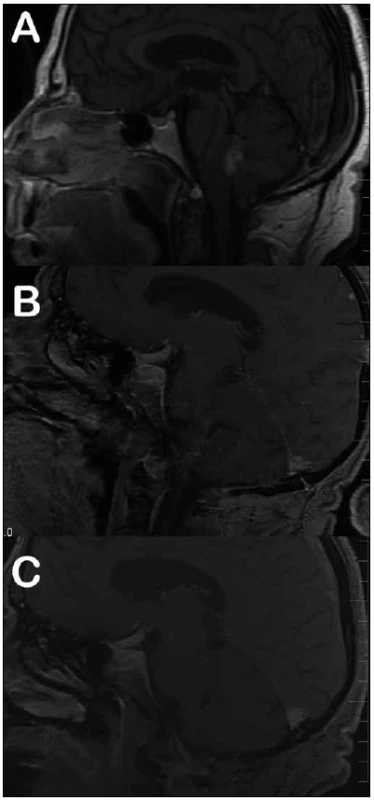
Obr. 1a) Stav před operací. Obr. 1b) Reziduum nádoru v těsné blízkosti jádra VII. hlavového nervu na spodině IV. komory. Obr. 1c) Stav po ozáření rezidua, patrná regrese sycení. Obr. 2. Subtotální resekce bez adjuvantní radioterapie. 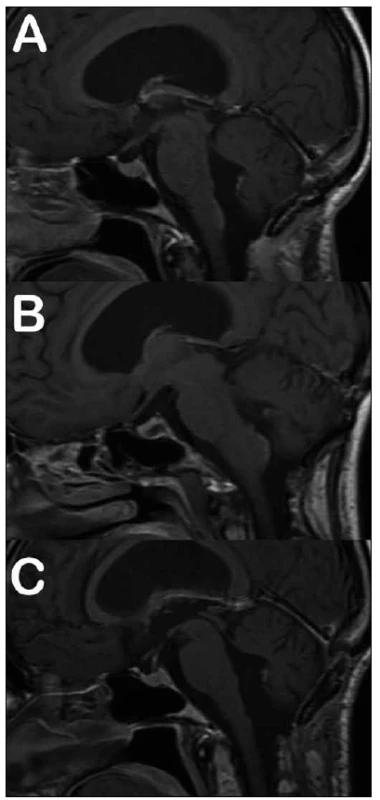
Obr. 2a) Reziduum po první operaci. Obr. 2b) Grafická progrese rezidua. Obr. 2c) Stav po reoperaci, dle histologického rozboru se již jednalo o GIII ependymom. Z celkového počtu 17 výkonů (z toho dvě reoperace) bylo významné zhoršení stavu s následným těžkým permanentním neurodeficitem zaznamenáno u jedné pacientky po prvním výkonu a u jednoho pacienta po reoperaci (chirurgická morbidita a mortalita – MM v naší sérii tedy činí 12 %). V prvním případě byl pooperační průběh komplikován zakrvácením do resekční dutiny s následnou nutností revize, v druhém případě byl výkon komplikován vzduchovou embolií (pacient byl operován v poloze vsedě) a následně masivní aspirací, jež vedla k multiorgánovému selhání, kterému pacient v konečném důsledku podlehl. Nový lehký neurologický deficit v době dimise mělo sedm pacientů po prvním zákroku a jedna pacientka po reoperaci (dočasná lehká MM 47 %), trvalé postižení bylo u jedné pacientky (lehká MM chirurgie 6 %). K pooperačním chirurgickým komplikacím došlo v pěti případech, ani v jednom neměla komplikace vliv na neurologický výsledek. Kompletní přehled léčebné strategie a komplikací je uveden v tab. 2. Z pěti pacientů s hydrocefalem předoperačně byla u jednoho pacienta dočasně zavedena zevní komorová drenáž, ve všech případech stav pooperačně spontánně regredoval a zkratová operace nebyla indikována u žádného z pacientů.
Tab. 2. Přehled zvolené léčebné strategie včetně komplikací. 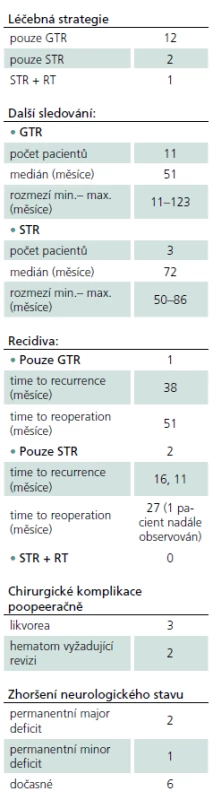
V rámci literární rešerše bylo identifikováno 20 studií, jejichž přehled je v tab. 3 a 4.
Tab. 3. Přehled studií publikovaných od roku 1990 zahrnujících výsledek léčby intrakraniálních ependymomů GII v oblasti IV. komory u dospělých. 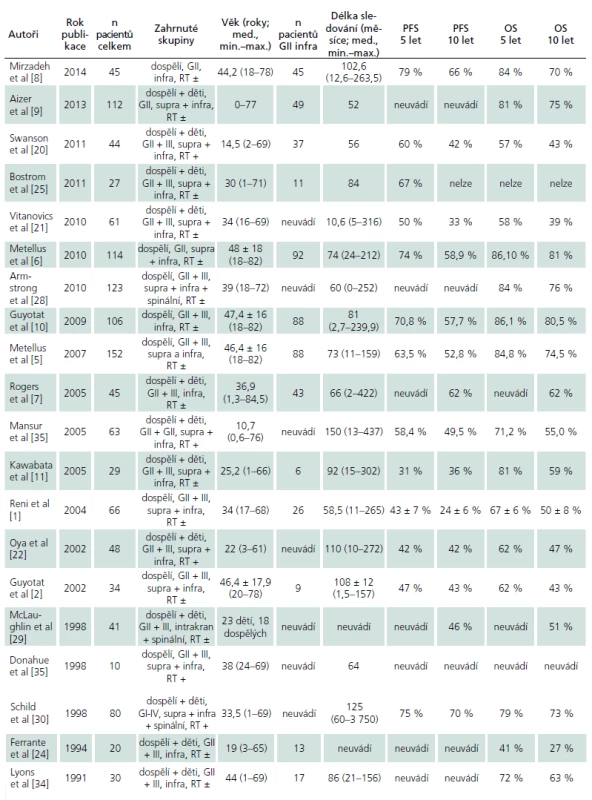
Tab. 4. Přehled publikovaných komplikací chirurgické léčby ependymomů. 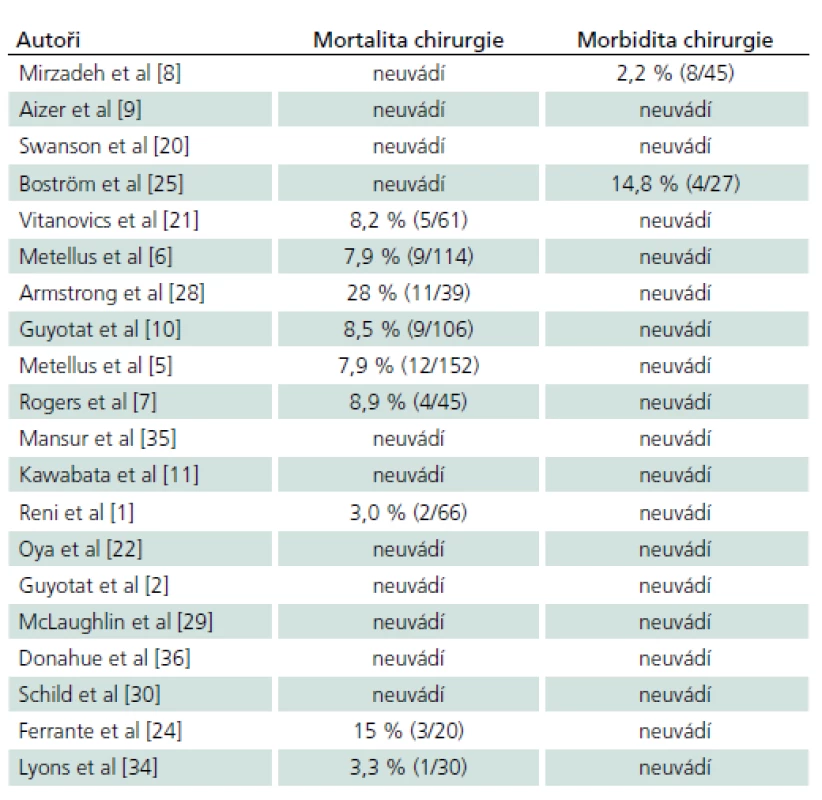
Diskuze
Infratentoriální ependymomy nízkého stupně (GII) jsou v dospělé populaci řídká diagnóza. V letech 1973 – 2003 statisticky významně stoupla incidence ependymomů v dospělé populaci z 0,13/ 100 000 oby-vatel/ rok na 0,27/ 100 000 obyvatel/ rok s průměrným ročním nárůstem 2,61 ± 0,83 % [12]. Podrobný rozbor souboru pacientů léčených s tímto onemocněním (GII, infratentoriální lokalizace, dospělý) a popis přirozeného průběhu vzhledem k frekvenci výskytu v literatuře chybí.
Již Cushing, Bailey a Fisher ve svých pracích z počátku minulého století naznačovali, že se jedná o „klasické chirurgické onemocnění relativně maligní svou lokalizací“, kde radikalita resekce a histologie jsou dva z hlavních faktorů, které rozhodují o dalším průběhu nemoci [13,14]. Významný pokrok v chirurgické léčbě přineslo zavedení mikroskopu do rutinní praxe, kdy poklesla morbidita operativy v zadní jámě lební o více než 50 % [15], a později elektrofyziologický monitoring, který umožnil ještě bezpečnější odstranění patologií v této oblasti [16 – 19].
Princip maximální možné bezpečné chirurgické resekce jako základního kamene léčby intrakraniálních ependymomů dominuje v odborné komunitě nadále. Většina současných neurochirurgů věnuje svoji pozornost faktorům ovlivňujícím další průběh onemocnění. Výsledky jejich studií se obtížně srovnávají vzhledem k nehomogenitě zahrnutých skupin, ale i přesto se jednotně shodují v tom, že bez ohledu na věk pacienta, klinický stav před operací, intrakraniální lokalizaci (supra-/ infratentoriální) a histologický grade tumoru je právě radikalita resekce základní faktor, který významně ovlivňuje lokální kontrolu nádorového onemocnění [1,6,9,11,20 – 22]. Naše pozorování do tohoto tvrzení zapadá. Z celkového počtu 15 operovaných pacientů byla radikální resekce dosažena u 12 (80 %) pacientů a subtotální resekce (STR) u tří (20 %). Recidivu jsme zaznamenali u jednoho pacienta po GTR (1/ 12 = 8 %) a u dvou pacientů po STR (2/ 3 = 67 %).
Zhodnotit celkovou bezpečnost chirurgie ependymomů není na základě dostupných literárních dat spolehlivě možné. V námi nalezených studiích devět z 20 autorů (45 %) neuvádí komplikace léčby vůbec. Morbidita a mortalita chirurgie v ostatních 11 pracích je 2,2 až 28 %, medián 8,4 %. Vždy jsou uvedeny pouze komplikace prvního zákroku. V naší sestavě jsme zaznamenali závažné zhoršení neurologického stavu ve dvou případech. U jednoho pacienta došlo ke zhoršení již po první operaci, u druhého po reoperaci. Žádný pacient nezemřel na chirurgickou komplikaci. Morbidita a mortalita naší sestavy je 1/ 15 (tj. 7 %) po prvním zákroku a celková MM chirurgie včetně reoperací je 2/ 17 (tj. 12 %). Dosažená míra komplikací tedy spadá do mezí uváděných ostatními autory.
Adjuvantní radioterapie (RT) představuje další možný krok léčby a bývá častým předmětem diskuzí. V případě ependymomů GII panuje shoda v názoru, že adjuvantní RT by měla být standard léčby u nemocných po STR [6,10,11,23].
V případě GTR se autoři stran pooperační radioterapie rozcházejí. Rogers et al ve své práci z roku 2005 tvrdí, že RT zlepšuje lokální kontrolu nemoci i po GTR (10letá kontrola progrese onemocnění v jejich sestavě byla 100 % po GTR + RT, 50 % po samotné GTR a 36 % po STR + RT) [7]. Jejich práce má z našeho pohledu dva hlavní nedostatky. Do analýzy lokální kontroly byly zahrnuty nádory typu GII i GIII a ve skupině 13 pacientů léčených GTR + RT bylo 12 dětí (věk pod 18 let). Mirzadeh et al hodnotí pouze GII ependymomy v zadní jámě u dospělých. Autoři tvrdí, že interval lokální kontroly je lepší ve skupině GTR + RT ve srovnání s pouze GTR (PFS ve skupině GTR + RT byl 9,0 ± 4,6 let a ve skupině pouze GTR 6,8 ± 3,0 let) [8]. Reni et al ve své sestavě pacientů do analýzy výsledků léčby zahrnuli dospělé nemocné s histologicky verifikovaným ependymomem GII i GIII, supra - i infratentoriální lokalizace, Ferrante et al publikovali sestavu, jež obsahovala dospělé i děti s ependymomem GII i GIII, z lokalizací se zaměřili pouze na tumory infratentoriální. Reni i Ferrante pak v rámci retrospektivní analýzy společně srovnávali ozářené a neozářené pacienty. Bohužel ani jedna z prací neuvádí kompletní charakteristiky obou skupin a omezují se pouze na tvrzení, že následná radioterapie po maximální možné bezpečné chirurgické resekci je spojena s delším celkovým přežitím pacientů [1,24].
Na druhé straně jsou práce, jejichž autoři následnou radioterapii po chirurgické léčbě GII ependymomů nepokládají za přínosnou. Metellus a Kawabata a spoluautoři se shodují v pozorování, že v jejich sestavách pacientů po kompletní resekci nádoru adjuvantní ozáření nepřispělo k prodloužení intervalu lokální kontroly nádorového onemocnění. Metellus et al popisují PFS po pěti a 10 letech u ozářených pacientů po GTR srovnatelný s PFS u pacientů po GTR neozářených. V celé sestavě potom demonstruje efekt RT po STR. Pěti - a 10letý PFS v sestavě Kawabaty byl 54 % a 48 % u ozářených pacientů, u nemocných bez další léčby to bylo 47 % a 39 % [6,11]. Žádný z této dvojice autorů ve srovnávaných skupinách zvlášť nediferencuje dětské a dospělé pacienty ani supra - a infratentoriální lokalizaci ependymomů.
Významný efekt adjuvantní radioterapie na lokální kontrolu nádorového onemocnění a délku přežití nemocných po chirurgické intervenci nepotvrdili ani jiní autoři, kteří se ve svých publikacích kromě věku, anatomické lokalizace a výsledků histopatologického rozboru rozhodli v jednotlivých skupinách nespecifikovat ani rozsah resekce [9,21,25].
Význam stereotaktické radiochirurgie je v léčbě ependymomů spíše okrajový. Stauder et al [26] obhajují užití radiochirurgie u pacientů s lokální recidivou, kteří podstoupili předchozí léčbu. V jejich skupině 25 pacientů sice prokázali dobrou lokální kontrolu onemocnění, nicméně u 27 % pacientů zaznamenali vzdálenou progresi onemocnění, navíc u 8 % pacientů vznikla symptomatická poradiační nekróza. Kano et al [27] z Pittsburské radiochirurgické skupiny na základě analýzy sestavy 39 pacientů považují radiochirurgii za další léčebnou metodu pro pacienty s reziduálním či rekurentním onemocněním, u nichž chirurgie a radioterapie selhaly.
Na našem pracovišti je u GII ependymomů IV. komory u dospělých následná radioterapie rezervována pro pacienty po STR s recidivujícím onemocněním po opakované resekci. Pokud nelze nádor opakovaně resekovat, je indikována samostatně radioterapie. Následné ozáření bylo indikováno celkem u dvou pacientů, v jednom případě u pacienta po STR (zde byla důvodem vyšší mitotická aktivita ve vzorku) a v jednom případě po reoperaci.
Důležitým faktorem pro délku celkového přežití a délku intervalu lokální kontroly onemocnění po operaci je dále histologický stupeň onemocnění. Lepší prognóza byla prokázána u pacientů s tumorem nízkého stupně (pětileté přežití nízkostupňový vs vysokostupňový tumor = 87 vs 27 %), a to jak ve skupině dětí, tak i dospělých s ependymomem bez ohledu na lokalizaci a adjuvantní terapii [5,10,11,21,22,24,28 – 30].
V dospělé populaci jsou ependymomy nejčastěji lokalizovány v míše (64 % případů všech) [12], kde se kontrola onemocnění po kompletní resekci blíží 100 %. Zde je také nejčastěji diagnostikován typ myxopapilární (GI), který je ve srovnání histologických typů nejbenignější (pětileté přežití myxopalilární ependymom vs ostatní histologické typy = 100 vs 76 %) [29,30]. V českém písemnictví se ependymomům krční a horní hrudní míchy věnovali v roce 2007 Buchvald et al [31]. Ti na sestavě osmi pacientů demonstrovali excelentní chirurgické výsledky a zároveň trvanlivost chirurgického řešení, kdy po kompletní resekci po více než dvou letech nezaznamenali jedinou recidivu onemocnění. Z intrakraniálních nádorů mají pak lepší prognózu pacienti s tumorem infratentoriální lokalizace [1,2,6,20,21,28]. Zřejmým vysvětlením je, že proporce nádorů nižšího stupně (GII) je v této lokalizace vyšší (GII supra vs GII infra = 19 vs 81 %) [5], a ve srovnání radikality resekce je právě zde častěji dosaženo kompletního odstranění tumoru (GTR supra vs GTR infra = 50 vs 62 %) [5].
Věk v době diagnózy je další důležitý prediktor výsledku léčby. Ukazuje se, že dětští pacienti mají ve srovnání s dospělými celkově horší prognózu. Průměrně pětileté přežití ve věkové skupině pod 18 let je 57 % [32], v dospělé populaci pak průměrně 85 % [5]. Nejmladší děti ve věku 0 – 4 let, které tvoří více než polovinu všech nemocných s diagnostikovaným ependymomem v dětské populaci, mají vůbec nejhorší prognózu s průměrným pětiletým přežitím 46 % [32,33]. Dále stoupající věk je pak asociován s delším celkovým přežitím a dětští pacienti ve věku 16 – 18 let (9 % všech případů onemocnění) mají pravděpodobnost pětiletého přežití 77 % [20,25,34]. Důvodem je častější výskyt vyššího stupně onemocnění u dětí (19 % všech diagnostikovaných s ependymomem ve věkové kategorii pod 18 let vs 9 % v kategorii nad 18 let) [12]. V dospělé populaci pak dopadají mladší pacienti lépe. Věková hranice zde však není jednoznačně určena. Metellus et al ve své analýze zvolili 55 let (pětileté přežití pacientů 55 let vs ≥ 55 let bylo 89 vs 76 %) a Reni et al 40 let (pětileté přežití pacientů 40 let vs ≥ 40 let bylo 74 vs 56 %) [1,5].
Závěr
Ependymomy IV. komory u dospělých jsou klasické chirurgické onemocnění. Na základě našich zkušeností a po analýze literatury jsme nenašli jasný důkaz, že po GTR je u těchto pacientů adjuvantní radioterapie racionální indikací. Adjuvantní radioterapie by měla být rezervována pro případy subtotální resekce s následnou progresí rezidua tumoru a reoperace.
MUDr. RNDr. Ondřej Bradáč
Neurochirurgická klinika
1. LF UK a ÚVN – VFN Praha
U Vojenské Nemocnice 1200
169 02 Praha 6
e-mail: ondrej.bradac@uvn.cz
Přijato k recenzi: 24. 6. 2014
Přijato do tisku: 11. 8. 2014
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Zdroje
1. Reni M, Brandes AA, Vavassori V, Cavallo G, Casagrande F, Vastola F et al. A multicenter study of the prognosis and treatment of adult brain ependymal tumors. Cancer 2004; 100(6): 1221 – 1229.
2. Guyotat J, Signorelli F, Desme S, Frappaz D, Madarassy G, Montange MF et al. Intracranial ependymomas in adult patients: analyses of prognostic factors. J Neurooncol 2002; 60(3): 255 – 268.
3. Ernestus RI, Schroder R, Stutzer H, Klug N. The clinical and prognostic relevance of grading in intracranial ependymomas. Br J Neurosurg 1997; 11(5): 421 – 428.
4. Korshunov A, Golanov A, Sycheva R, Timirgaz V. The histologic grade is a main prognostic factor for patients with intracranial ependymomas treated in the microneurosurgical era: an analysis of 258 patients. Cancer 2004; 100(6): 1230 – 1237.
5. Metellus P, Barrie M, Figarella-Branger D, Chinot O, Giorgi R, Gouvernet J et al. Multicentric French study on adult intracranial ependymomas: prognostic factors analysis and therapeutic considerations from a cohort of 152 patients. Brain 2007; 130(5): 1338 – 1349.
6. Metellus P, Guyotat J, Chinot O, Durand A, Barrie M, Giorgi R et al. Adult intracranial WHO grade IIependymomas: long-term outcome and prognostic factor analysis in a series of 114 patients. Neuro Oncol 2010; 12(9): 976 – 984. doi: 10.1093/ neuonc/ noq047.
7. Rogers L, Pueschel J, Spetzler R, Shapiro W, Coons S,Thomas T et al. Is gross-total resection sufficient treatment for posterior fossa ependymomas? J Neurosurg 2005; 102(4): 629 – 636.
8. Mirzadeh Z, Bina R, Kusne Y, Coons SW, Spetzler RF,Sanai N. Predictors of functional recovery in adults with posterior fossa ependymomas. J Neurosurg 2014; 120(5): 1063 – 1068. doi: 10.3171/ 2014.1.JNS131590.
9. Aizer AA, Ancukiewicz M, Nguyen PL, Macdonald SM,Yock TI, Tarbell NJ et al. Natural history and role of radiation in patients with supratentorial and infratentorial WHO grade II ependymomas: results from a population-based study. J Neurooncol 2013; 115(3): 411 – 419. doi: 10.1007/ s11060-013-1237-9.
10. Guyotat J, Metellus P, Giorgi R, Barrie M, Jouvet A, Fevre-Montange M et al. Infratentorial ependymomas: prognostic factors and outcome analysis in a multi-center retrospective series of 106 adult patients. Acta Neurochir (Wien) 2009; 151(8): 947 – 960. doi: 10.1007/ s00701-009-0417-z.
11. Kawabata Y, Takahashi JA, Arakawa Y, Hashimoto N. Long-term outcome in patients harboring intracranial ependymoma. J Neurosurg 2005; 103(1): 31 – 37.
12. McGuire CS, Sainani KL, Fisher PG. Incidence patterns for ependymoma: a surveillance, epidemiology, and end results study. J Neurosurg 2009; 110(4): 725 – 729. doi: 10.3171/ 2008.9.JNS08117.
13. Bailey P, Cushing H. Classification of tumours of the glioma group on a histogenetic basis with a correlated study of prognosis. Br J Surg 1926; 14(55): 554 – 555.
14. Fisher ER, Hazard JB, Gardner WJ. Intracranial ependymoma; clinicopathologic observations. Cleve Clin Q 1951; 18(4): 260 – 269.
15. Dohrmann GJ, Farwell JR, Flannery JT. Ependymomas and ependymoblastomas in children. J Neurosurg 1976; 45(3): 273 – 283.
16. Watanabe E, Schramm J, Strauss C, Fahlbusch R. Neurophysiologic monitoring in posterior fossa surgery. II. BAEP-waves I and V and preservation of hearing. Acta Neurochir (Wien) 1989; 98(3 – 4): 118 – 128.
17. Kawaguchi M, Ohnishi H, Sakamoto T, Shimizu K, Touho H, Monobe T et al. Intraoperative electrophysiologic monitoring of cranial motor nerves in skull base surgery. Surg Neurol 1995; 43(2): 177 – 181.
18. Schramm J, Watanabe E, Strauss C, Fahlbusch R. Neurophysiologic monitoring in posterior fossa surgery. I. Technical principles, applicability and limitations. Acta Neurochir (Wien) 1989; 98(1 – 2): 9 – 18.
19. Nelson KR, Phillips LH. Neurophysiologic monitoring during surgery of peripheral and cranial nerves, and in selective dorsal rhizotomy. Semin Neurol 1990; 10(2): 141 – 149.
20. Swanson EL, Amdur RJ, Morris CG, Galloway TJ, Marcus RB jr, Pincus DW et al. Intracranial ependymomas treated with radiotherapy: long-term results from a single institution. J Neurooncol 2011; 102(3): 451 – 457. doi: 10.1007/ s11060-010-0344-0.
21. Vitanovics D, Balint K, Hanzely Z, Banczerowski P, Afra D. Ependymoma in adults: surgery, reoperation and radiotherapy for survival. Pathol Oncol Res 2010; 16(1): 93 – 99. doi: 10.1007/ s12253-009-9194-5.
22. Oya N, Shibamoto Y, Nagata Y, Negoro Y, Hiraoka M. Postoperative radiotherapy for intracranial ependymoma: analysis of prognostic factors and patterns of failure. J Neurooncol 2002; 56(1): 87 – 94.
23. Reni M, Gatta G, Mazza E, Vecht C. Ependymoma. Crit Rev Oncol Hematol 2007; 63(1): 81 – 89.
24. Ferrante L, Mastronardi L, Schettini G, Lunardi P, Fortuna A. Fourth ventricle ependymomas. A study of 20 cases with survival analysis. Acta Neurochir (Wien) 1994; 131(1 – 2): 67 – 74.
25. Boström A, Boström J, Hartmann W, Pietsch T, Feuss M, von Lehe M et al. Treatment results in patients with intracranial ependymomas. Cent Eur Neurosurg 2011; 72(3): 127 – 132. doi: 10.1055/ s-0031-1273745.
26. Stauder MC, Ni Laack N, Ahmed KA, Link MJ, Schomberg PJPollock BE. Stereotactic radiosurgery for patients with recurrent intracranial ependymomas. J Neurooncol 2012; 108(3): 507 – 512. doi: 10.1007/ s11060-012-0851-2.
27. Kano H, Niranjan A, Kondziolka D, Flickinger JC, Lunsford LD. Outcome predictors for intracranial ependymoma radiosurgery. Neurosurgery 2009; 64(2): 279 – 287. doi: 10.1227/ 01.NEU.0000338257.16220.F7.
28. Armstrong TS, Vera-Bolanos E, Bekele BN, Aldape K, Gilbert MR. Adult ependymal tumors: prognosis and the M. D. Anderson Cancer Center experience. Neuro Oncol 2010; 12(8): 862 – 870. doi: 10.1093/ neuonc/ noq009.
29. McLaughlin MP, Marcus RB jr, Buatti JM, McCollough WM, Mickle JP, Kedar A et al. Ependymoma: results, prognostic factors and treatment recommendations. Int J Radiat Oncol Biol Phys 1998; 40(4): 845 – 850.
30. Schild SE, Nisi K, Scheithauer BW, Wong WW, Lyons MK, Schomberg PJ et al. The results of radiotherapy for ependymomas: the Mayo Clinic experience. Int J Radiat Oncol Biol Phys 1998; 42(5): 953 – 958.
31. Buchvald P, Suchomel P, Kaiser M. Chirurgická léčba ependymomů krční a horní hrudní míchy. Cesk Slov Neurol N 2007; 70/ 103(2): 196 – 200.
32. McGuire CS, Sainani KL, Fisher PG. Both location and age predict survival in ependymoma: a SEER study. Pediatr Blood Cancer 2009; 52(1): 65 – 69. doi: 10.1002/ pbc.21806.
33. Shu HK, Sall WF, Maity A, Tochner ZA, Janss AJ, Belasco JB et al. Childhood intracranial ependymoma: twenty-year experience from a single institution. Cancer 2007; 110(2): 432 – 441.
34. Lyons MK, Kelly PJ. Posterior fossa ependymomas: report of 30 cases and review of the literature. Neurosurgery 1991; 28(5): 659 – 664.
35. Mansur DB, Perry A, Rajaram V, Michalski JM, Park TS, Leopard JR et al. Postoperative radiation therapy for grade II and III intracranial ependymoma. Int J Radiat Oncol Biol Phys 2005; 61(2): 387–391.
36. Donahue B, Steinfeld A. Intracranial ependymoma in the adult patient: successful treatment with surgery and radiotherapy. J Neurooncol 1998; 37(2): 131–133.
36. Donahue B, Steinfeld A. Intracranial ependymoma in the adult patient: successful treatment with surgery and radiotherapy. J Neurooncol 1998; 37(2): 131–133.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2014 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Adultní forma Pompeho nemoci
- Rehabilitace kognitivních funkcí u pacientů s roztroušenou sklerózou
- Je elektrofyziologické vyšetření přínosné v diferenciální diagnostice lumbální spinální stenózy a diabetické polyneuropatie?
- Efektivita dočasné imobilizace po operaci syndromu karpálního tunelu
- Kombinace sluchových a somatosenzorických evokovaných potenciálů zvyšuje senzitivitu průkazu smrti mozku
- Test neverbální fluence – Five Point Test: normativní data pro dospělé
- Epidemiologická studie neurodegenerativního parkinsonizmu na „Horňácku“, specifickém regionu jihovýchodní Moravy, Česká republika
- Projekt ncRNAPain
- Molekulárna diagnostika NF1 na Slovensku s využitím analýzy cDNA a MLPA
- Vliv neoptimálního chirurgického ošetření páteře na průběh míšního poranění
- Využití elektromagnetické navigace při léčbě hydrocefalu a arachnoidálních cyst u dětí do jednoho roku věku
- Zkrácení door-to-needle intervalu, zkušenosti z Iktového centra Kladno
- WHO Grade II ependymomy IV. komory u dospělých – zkušenosti s léčbou
- Diazepam i. m. – nejčastěji užívaný, ale nevhodný lék ke zvládání akutní úzkosti, agitovanosti a agresivity
- Raritní použití dekompresivní hemikraniektomie u nemocného s abscesem mozku – kazuistika
- Komentář k článku autorů Mork et al Raritní použití dekompresivní hemikraniektomie u nemocného s abscesem mozku – kazuistika
- Střelné poranění hlavy replikou historické zbraně – patofyziologie a popis kazuistiky
- Odešel prof. MU Dr. Robert Kuba, Ph.D.
- O vyšetřování čití v ambulantní neurologické praxi – dopis redakci a komentář
- Komentář ke komentáři k článku Krahulík et al Výsledky operační léčby adenomů hypofýzy na Neurochirurgické klinice FN Olomouc
- Webové okénko
- MS Boston 2014: Joint ACTRIMS-ECTRIMS Meeting Jak z pacienta učinit partnera při rozhodování o léčbě
- Recenze knihy Michael T. Lawton. Seven AVMs. Tenets and Techniques for Resection.
- Analýza dat v neurologii
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Diazepam i. m. – nejčastěji užívaný, ale nevhodný lék ke zvládání akutní úzkosti, agitovanosti a agresivity
- Střelné poranění hlavy replikou historické zbraně – patofyziologie a popis kazuistiky
- Test neverbální fluence – Five Point Test: normativní data pro dospělé
- Adultní forma Pompeho nemoci
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



