-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaModulace signálních drah IL-12/IL-23 ustekinumabem tlumí poškozující zánět u pacientů s Crohnovou nemocí
Modulation of IL-12/IL-23 signaling pathways by ustekinumab alleviates inflammation in Crohn’s disease patients
Crohn’s disease (CD) is a multifactorial illness, in which pathogenesis involving damage to the inflammatory response, mediated by abnormally polarized Th1 and Th17 subsets of T cell, is a prominent feature. CD treatment options employing biological therapies, predominantly based on antitumor necrosis factor α biologics, are limited compared with other immunological diseases. With the exception of vedolizumab among numerous other biologics tested so far, clinical efficacy has recently been approved only for ustekinumab, which targets subunit p40 shared by both IL-12 and IL-23 interleukins. Interleukin-12 is indispensable for the functional polarization of T cells into the Th1 subset. Interleukin-23 is essential for the full activation and survival of the Th17 subset of T cells. Immunomodulatory intervention employing targeting of IL-12/IL-23 signaling pathways via ustekinumab alleviates inflammatory reactions in patients with CD. In addition, ustekinumab treatment is not associated with an increased risk of immunity impairment or decreased protective and barrier function of gut mucosa, which are common side effects of other biologics, especially those targeting IL-17/IL-17R signaling pathways. The clinical efficacy of another treatment targeting the unique subunit of p19 of IL-23 in CD patients is now being tested in ongoing clinical trials.
Key words:
Crohn’s disease – inflammation – Th1/Th17 subsets – signaling pathway IL-12/IL-23 – biological therapy – ustekinumab
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 4. 6. 2018
Accepted: 4. 7. 2018
Autoři: J. Krejsek
Působiště autorů: Ústav klinické imunologie a alergologie, LF UK a FN Hradec Králové
Vyšlo v časopise: Gastroent Hepatol 2018; 72(4): 334-339
Kategorie: IBD: Kazuistika
doi: https://doi.org/10.14735/amg2018334Souhrn
Crohnova nemoc (CD) je multifaktoriální onemocnění, v jehož patogenezi dominuje poškozující zánět zprostředkovaný aktivitou abnormálně polarizovaných subsetů Th1 a Th17 T lymfocytů. V porovnání s jinými imunopatologickými onemocněními jsou možnosti léčebného ovlivnění biologickou terapií u nemocných s CD omezeny. S výjimkou vedolizumabu jsou zatím téměř výlučně postaveny na neutralizaci účinků tumoru nekrotizujícího faktoru α. Z mnoha dalších testovaných biologik byla prokázána klinická účinnost pro unikátní monoklonální protilátku ustekinumab, cílící na podjednotku p40 sdílenou cytokiny IL-12/IL-23. Interleukin-12 je nezbytný pro polarizaci T lymfocytů do subsetu Th1, IL-23 je klíčovým pro úplnou aktivaci a přežívání subsetu Th17 T lymfocytů. Imunomodulační zásah do drah IL-12/IL-23 ustekinumabem významně tlumí poškozující zánět. Klinická aplikace ustekinumabu při tom není spojena s rizikem omezení obranných a bariérových funkcí, jak tomu je u jiných testovaných biologik, např. cílících na IL-17/IL-17R. V klinických studiích je ověřována i účinnost biologik neutralizujících podjednotku p19, unikátní pro IL-23, v léčebném ovlivnění nemocných s CD, u kterých byla již prokázána klinická účinnost v léčbě nemocných jinými imunopatologiemi.
Klíčová slova:
Crohnova nemoc – poškozující zánět – subsety Th1/Th17 – signální dráha IL-12/IL-23 – biologická léčba – ustekinumab
Úvod
Crohnova nemoc (CD) je závažné zánětlivé onemocnění postihující trávicí trubici s častými manifestacemi mimo gastrointestinální trakt. Je to onemocnění, jehož incidence a prevalence v rozvinutých zemích, obývaných především populací evropského původu, vzrůstá. Představuje závažný osobní i společenský problém. Poznání patofyziologie CD je věnována dlouhodobě mimořádná pozornost. Využívány jsou zvířecí modely a výsledky výzkumu u lidí. Je zřejmé, že jde o multifaktoriální onemocnění, ve kterém se protínají vlivy genetické dispozice, střevní mikrobioty, složení stravy a mnohé další. Poznání mechanizmů CD je základem pro léčebné zásahy do poškozujícího zánětu. Ty odpovídají aktivitě onemocnění a zahrnují spektrum léčiv od těch, která působí lokálně, až po mimořádně komplexní léčebné postupy, které zahrnují biologickou terapii. Cílem tohoto sdělení je informovat o mimořádné úloze signální dráhy IL-12/IL-23 v patogenezi CD. Cytokiny IL-12 a IL-23 jsou v porovnání s jinými cytokiny unikátní. Jsou to dimerické molekuly, které navíc sdílejí společnou podjednotku p40. Ta je terčem terapie biologikem ustekinumabem, která účinně tlumí poškozující zánět u nemocných s CD a představuje významné obohacení léčebných možností. Bude pojednáno i o imunobiologických vlastnostech podjednotky p19, která je specificky součástí pouze IL-23. Biologika cílící na p19 jsou nyní ověřována jako nová možnost léčby nemocných s CD v klinických studiích.
Poškozující zánět u nemocných s Crohnovou chorobou
Patofyziologické mechanizmy zahrnuté v poškozujícím zánětu u nemocných s CD jsou mimořádně komplexní [1–3]. Nejvíce informací máme k dispozici o abnormitách epitelové výstelky trávicí trubice, které jsou odpovědny za omezení bariérových funkcí sliznice. Jsou popsány nejrůznější mechanizmy, kterými imunitní systém přispívá k integritě střevního epitelu. Ty jsou u nemocných s CD v různé míře alterovány. Na rozdíl od jiných imunopatologických onemocnění je doloženo, že v patogenezi CD sehrává zásadní úlohu střevní mikrobiota a její interakce se slizničním imunitním systémem. Nově je prokazováno, že abnormity u nemocných s CD jsou nalézány i v biologicky fundamentálních buněčných procesech, jakými jsou regulace buněčné smrti, především autofagie [4,5].
Významnou úlohu v identifikaci patogenů, které proniknou do cytoplazmy epitelových buněk střevní sliznice, sehrává rodina receptorů PRR (Pattern Recognition Receptors) označovaná jako NLR (Nod Like Receptors), konkrétně NOD-2 (Nucleotide-binding Oligomerization Domain-containing protein). Identifikace vzorů PAMP (Pathogen Associated Molecular Pattern) patogenních mikroorganizmů tímto receptorem vede následně v řadě postupných kroků v buňce k sestavení tzv. inflamazómu [6]. Tento složitý molekulární komplex má za úkol aktivovat pro-kaspázu-1. Aktivovaná kaspáza-1 štěpí latentní nefunkční formy cytokinů pro IL-1β a proIL-18 za vzniku pluripotentních prozánětlivých cytokinů IL-1β a IL-18. Ty jsou zásadně důležité pro rozvoj obranného i poškozujícího zánětu [6]. Struktura receptoru NOD-2 je detailně popsána. U nemocných s CD SNP (Single Nucleotide Polymorphisms) v genu pro NOD-2 vede ke ztrátě funkce. Výsledkem je snížená schopnost eliminovat patogeny, které pronikly do nitra epitelových buněk, s důsledky popsanými výše [7].
Mimořádně přínosné pro pochopení patogeneze CD jsou recentní studie, které novými postupy analyzují střevní mikrobiotu. Jako střevní mikrobiotu označujeme všechny mikroorganizmy, které fyziologicky přinejmenším v určitých vývojových etapách osidlují trávicí trubici. Lze říci, že podstatnou částí střevní mikrobioty jsou bakterie. Nesmíme však zapomínat na fungální mikroorganizmy, např. kvasinky, viry, bakteriofágy a za určitých okolností i střevní parazity. Za fyziologických podmínek představují až 99 % bakteriálního osídlení zástupci čtyř kmenů: Firmicutes, Bacteroidetes, Proteobacteria a Actinobacteria. Mikrobiální osídlení trávicí trubice je zásadní pro vytvoření bariérových funkcí střeva a modulaci slizniční i systémové imunity. U člověka je obtížné rozhodnout, zda změněná mikrobiota, kterou zásadní studie u nemocných s CD popisují, je následkem nebo samotnou příčinou vzniku CD. Obecně je u nemocných s CD popisováno snížení druhové pestrosti bakteriálního osídlení, tzv. dysbióza charakterizovaná sníženým zastoupením bakterií kmene Firmicutes, které fyziologicky poskytují pozitivní podněty jak pro epitelové buňky (SCFA – Short Chain Fatty Acids), tak pro imunitní dozor. Zvláštní důraz je kladen na homeostatické působení bakterií Faecalibacterium prausnitzii a Akkermansia muciniphila, jejichž podíl v mikrobiotě je u nemocných s CD snížen [8].
Výsledkem je u nemocných s CD oslabení bariérových funkcí střevní sliznice, průnik bakterií do epitelových struktur a podslizniční vrstvy, který vede k bezprostřednímu kontaktu se složkami imunity a s následným rozvojem poškozujícího zánětu. Expozice abnormálním bakteriálním vzorům vede u nemocných s CD k abnormální aktivitě dendritických buněk, které cestou prezentace antigenních podnětů T lymfocytům preferenčně stimulují funkční polarizaci k Th1 a Th17 T lymfocytů se ztrátou aktivity Treg T lymfocytů. Je obtížné rozhodnout, zda abnormální osidlovací vzory nalézané u nemocných s CD jsou následkem či příčinou poškozujícího zánětu. Jednoznačně se však jedná o vzájemné interakce mezi mikrobiotou a střevní sliznicí. Ochranné bariéry na střevní sliznici jsou mnohovrstevné a jsou zapojovány podle aktuálních potřeb organizmu. Je jisté, že většina obranných aktivit je realizována na povrchu epitelových struktur. Zde se uplatňují přirozené obranné bariéry, především mukus a antibakteriální peptidy, tvořené Panethovými buňkami. Vrstva hlenu je dále stratifikována a na chemické substance tvořící hlen jsou navázány látky s přímými antimikrobiálními účinky. Jedná se o antibakteriální peptidy, zvláště defenziny, a samozřejmě také o sekreční protilátky třídy imunoglobulinu A. U nemocných s CD jsou popisovány vrozené poruchy v tvorbě β-defenzinů, kterými je vysvětlována snížená schopnost těchto nemocných zabránit prostupu mikrobů do epitelových struktur a do lamina propria, kde jsou akumulovány buněčné složky slizniční imunity. Snížená schopnost bariérové funkce střevního epitelu u nemocných s CD může souviset i s poruchami fundamentálních signálních drah epitelových kmenových buněk, konkrétně dráhy Wnt/Notch [9].
Výše popisované abnormity u nemocných s CD vedou k přinejmenším částečné ztrátě schopnosti udržet pod kontrolou střevní mikrobiotu. Výsledkem je zvýšená přítomnost invazivních a toxigenních bakteriálních druhů a kmenů. Ztráta přirozeného osídlení vede ke ztrátě podpory integrity a bariérových funkcí střevní sliznice. Epitelové buňky jsou v těchto situacích stimulovány k tvorbě prozánětlivých mediátorů a cytokinů. V daleko větší míře také umírají různými formami smrti, především nekrózou a pyroptózou. Výsledkem je masivní uvolnění prozánětlivých vzorů vnitřního poškození DAMP (Damage Associated Molecular Pattern), často charakteru alarminů a prozánětlivých cytokinů. Ty, spolu s působením vzorů PAMP invadujících mikroorganizmů, stimulují dendritické buňky k aktivitě. Dendritické buňky zpracovávají internalizované struktury PAMP/DAMP za vzniku antigenních peptidů, které navázané na molekuly HLA (Human Leucocyte Antigen) prezentují T lymfocytům. Podstatné je, že v tomto abnormálním mikroprostředí jsou dendritické buňky funkčně polarizovány tak, aby neposkytovaly homeostatické, regulační podněty aktivovaným T lymfocytům. Na místo toho jsou stimulované antigeny klonálně expandované T lymfocyty u nemocných s CD abnormálně polarizovány k převaze aktivity subsetů Th1 a Th17. Imunoregulační subsety Treg a Th2 jsou u nemocných s CD polarizovány nedostatečně. Tak jsou postupně ztráceny regulační a homeostatické mechanizmy na střevní sliznici. Postupně dochází k přesmyku od obranného zánětu k zánětu poškozujícímu (obr. 1) [10].
Obr. 1. Signální dráha IL-12/IL-23 je klíčová v obranném i poškozujícím zánětu na střevní sliznici.
Fig. 1. The IL-12/IL-23 pathway plays a key role in defensive as well as damaging inflammations of the colon mucosa.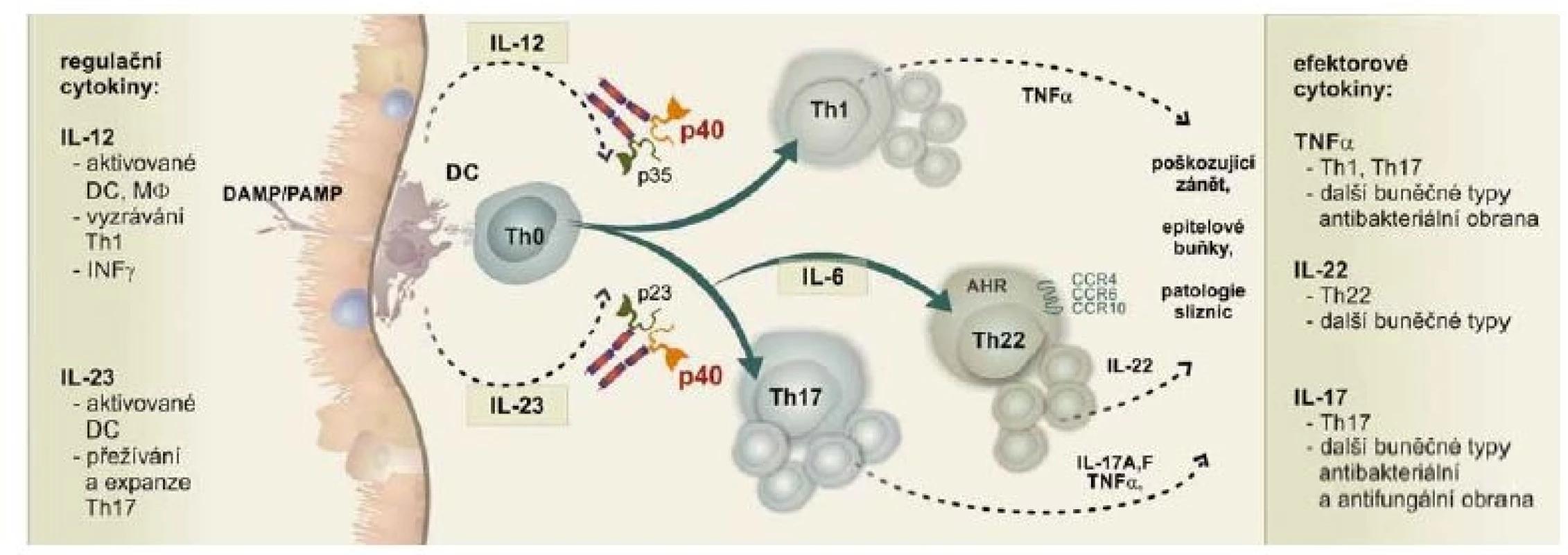
Úloha signální osy IL-12/IL-23 v obranném a poškozujícím zánětu
Podstatnou součástí obranného i poškozujícího zánětu je schopnost T lymfocytů, které po antigenní stimulaci zprostředkované prezentujícími buňkami, především dendritickými buňkami, proliferovaly, funkčně se polarizovat do různých imunoregulačních subsetů. Funkční polarizace za normálních podmínek odráží momentální potřeby organizmu a je to přísně regulovaný mnohostupňový proces.
Funkční polarizace T lymfocytů, které vznikly proliferací antigenem stimulovaného T lymfocytu subsetu Th0, určují zásadním způsobem imunobiologické charakteristiky dendritických buněk, které antigenní podněty naivním Th0 T lymfocytům předkládají v kontextu molekul HLA. Vyhodnocují kvalitativně i kvantitativně podněty DAMP a PAMP, které internalizovaly a nastavují podmínky nutné pro funkční polarizaci T lymfocytů. Jedná se zejména o spektrum cytokinů, kterým je parakrinní cestou polarizující se T lymfocyt exponován. Cytokinové mikroprostředí je doplněno o kostimulační interakce zprostředkované membránovými molekulami dendritických buněk a T lymfocytů. Výsledkem je spuštění nitrobuněčných signálních cest v T lymfocytech, které vedou k aktivaci rozdílného spektra transkripčních faktorů, jejichž prostřednictvím jsou přepisovány soubory genů nutných pro konkrétní funkční polarizaci [2].
Podle současného konceptu se na patogenezi v CD významnou měrou podílejí abnormálně aktivní subsety T lymfocytů Th1 a Th17. Jsou důkazy o snížené aktivitě regulačního subsetu Treg a subsetu Th2 T lymfocytů. Pro vyzrávání do subsetu Th1 je nezbytná dostatečná produkce interleukinu IL-12, která je lokálně zajišťována především myeloidními dendritickými buňkami a také interferony (INFγ), kde zdrojem mohou být NK (natural killer) buňky. Spolu s kostimulačními interakcemi dochází k aktivaci transkripčních faktorů STAT-1 a STAT-4. Výsledkem je plná funkční polarizace do subsetu Th1. Aktivitu subsetu Th1 fyziologicky tlumí subset Th2 T lymfocytů. K vyzrávání z Th0 do Th2 je zapotřebí IL-4, jehož zdrojem mohou být mastocyty nebo eozinofilní granulocyty. Uplatňují se transkripční faktory STAT-6 a GATA-3. T lymfocyty subsetu Th2 tvoří především IL-4 a jsou ve funkčně antagonistickém vztahu k subsetu Th1. Komplikovanější je funkční polarizace Th0 T lymfocytů do subsetu Th17. Složitější je i interpretace úlohy Th17 T lymfocytů v regulacích imunitní odpovědi. Původně byly Th17 T lymfocyty považovány pouze za součást poškozujícího zánětu. Tato představa byla vyvrácena rozsáhlými experimenty, které ukazují, že T lymfocyty subsetu Th17 jsou přirozenou součástí obranného zánětu, který je namířen především k ochraně proti invadujícím patogenům, mikroorganizmům, bakteriím a fungálním agens. K funkční polarizaci do subsetu Th17 dochází u aktivovaných T lymfocytů Th0 v přítomnosti převažujících prozánětlivých cytokinů tvořených myeloidními dendritickými buňkami. Mezi nimi zdůrazníme zásadní úlohu IL-6 a IL-1β. V jejich přítomnosti jsou aktivovány unikátní signální dráhy vedoucí k aktivaci transkripčního faktoru RORγt a STAT-3. Obranný, ale i poškozující potenciál subsetu Th17 je tak velký, že vyžaduje další regulační krok. Ten je zprostředkován IL-23, který je nezbytný k plné funkční aktivitě a k přežívání T lymfocytů, které jsou zadány ve vývoj Th17 T lymfocytů. Dalším imunoregulačním subsetem s mimořádnými funkcemi v regulacích imunitní odpovědi jsou T lymfocyty subsetu Treg. Pro jejich vyzrávání je typické využití transkripčního faktoru FoxP3. T regulační T lymfocyty tvorbou IL-10 a dalších působků představují zásadní homeostatický mechanizmus, který kontroluje především aktivity subsetu Th17 T lymfocytů.
V procesech funkční polarizace a rovněž v efektorových funkcích T lymfocytů sehrávají podstatnou úlohu IL-12 a IL-23. Zdrojem IL-12 jsou dendritické buňky, makrofágy a také neutrofilní granulocyty. Z naznačeného je zřejmé, že se jedná o součásti vrozené imunity, které se uplatňují právě tvorbou IL-12 v indukci specifické T lymfocytární imunitní odpovědi a funkční polarizaci T lymfocytů. IL-12 je tvořen čtyřmi motivy odpovídajícími α helixům. Unikátní charakteristikou je jeho struktura, která je tvořena dvěma podjednotkami IL-12A (p35) a IL-12B (p40). IL-12 je funkční po vazbě na specifický receptor, kterým je hetero dimerická struktura tvořená řetězci IL-12R-β1 a IL-12R-β2. Receptor pro IL-12 je vyjádřen ve vysoké denzitě na aktivovaných T lymfocytech, které jsou zadány ve vývoji do Th1 T lymfocytů. Po vazbě IL-12 dochází k aktivaci nitrobuněčných kináz Tyk2 a Jak2, které aktivují transkripční faktor STAT-4 nezbytný pro funkční aktivitu T lymfocytů a NK buněk. Buňky ovlivněné IL-12 tvoří ve zvýšené míře INFγ a tumor nekrotizující faktor α (TNFα – tumor necrosis factor α). Zvýšená je aktivita přirozeně zabíječských buněk a cytotoxických CD8 T lymfocytů [11].
IL-23 je stejně jako IL-12 unikátní svou heterodimerickou strukturou. Sestává se z podjednotky p40 sdílené s IL-12 a unikátní podjednotky p19. Je funkční po vazbě na heterodimerický receptor, který opět sdílí jeden z řetězců s receptorem pro IL-12. Receptor IL-23R je exprimován na řadě buněčných typů, např. T lymfocytů Th17, naivních i paměťových T lymfocytů, NK buňkách, ILC buňkách (Innate Lymphoid Cells), dendritických buňkách, makrofázích, epitelových buňkách a keratinocytech. To určuje značný dopad regulací zprostředkovaných IL-23. SNP v IL-23R (rs11209026), vedoucí ke snížení funkce, chrání před rozvojem idiopatických střevních zánětů. Konkrétně je IL-23R tvořen sdíleným řetězcem IL-12Rβ1 a unikátním řetězcem IL-23R. Jak již bylo řečeno, IL-23 je nezbytný pro plnou funkční aktivitu a přežívání T lymfocytů subsetu Th17. To je součástí obranného zánětu odpovědného za kontrolu bakteriálních a fungálních infekcí. Bohužel, v rámci poškozujícího zánětu jsou T lymfocyty podporované působením IL-23 nejvýznamnějším zdrojem cytokinů IL-17A a IL-17F. Kromě toho tvoří i další prozánětlivé cytokiny, např. IL-1β, TNFα, IL-6, IL-22. Mají vysokou schopnost vytvářet matrixové metaloproteinázy a také je v nich zvyšována aktivita inducibilní NO syntázy. Všechny tyto aktivity T lymfocytů Th17 zajištěné funkčním působením IL-23 jsou zásadní pro poškozující zánět v řadě imunopatologických onemocnění. Vedle již zmíněné CD se jedná o psoriázu, roztroušenou sklerózu mozkomíšní, revmatoidní artritidu a další [12,13].
Biologická léčba u nemocných s CD vychází z poznání poškozujícího zánětu
Dlouholeté zkušenosti z klinické praxe jasně dokládají, že péče o nemocné s CD musí být komplexní. Opírá se o aktuální znalosti patofyziologie tohoto onemocnění. Je možné říci, že možnosti ovlivnění klinického průběhu onemocnění u CD biologickou terapií jsou v porovnání s jinými imunopatologickými nemocemi, např. psoriázou, roztroušenou sklerózou nebo revmatoidní artritidou, stále omezené [14,15]. Je to důkazem mimořádné komplexnosti a komplikovanosti patofyziologie CD, kde, spolu s poškozujícím zánětem, je určující také střevní mikrobiota. Biologická terapie nemocných s CD je zprostředkována především biologiky, které neutralizují účinky TNFα. Bohužel, klinický efekt terapie anti-TNFα nastupuje pouze u části nemocných, kteří byli pro tuto terapii indikováni. Rovněž dlouhodobý efekt terapie anti-TNFα je u mnohých nemocných s CD omezený. Jednou z příčin může být tvorba neutralizujících protilátek, které omezují či úplně eliminují léčebný účinek těchto biologik. Možným důvodem intenzivní produkce protilátek neutralizujících biologika anti-TNFα je skutečnost, že jsou používány chimérické protilátky. Je výhodou, že v současné době již jsou dostupné laboratorní postupy, kterými lze stanovovat tyto neutralizující protilátky. Účinky terapie anti-TNFα lze poměrně snadno objektivizovat neinvazivním testem, kterým je stanovení koncentrace kalprotektinu ve stolici. Klinická účinnost v ovlivnění CD byla prokázána pro další biologikum, vedolizumab. Tato humanizovaná protilátka cílí na integrinový heterodimer α4β7, který funkčně odpovídá za cílenou migraci lymfoidních buněk do epitelových struktur [16].
V klinických studiích byly ověřovány i další možnosti biologické terapie CD, které se osvědčily v jiných indikacích. To, že se klinický efekt u nemocných s CD nedostavil, nebo dokonce došlo ke zhoršení aktivity onemocnění, ukazuje na výjimečnost CD. Konkrétně se jedná o biologika, která cílí na signální dráhu IL-17/IL-17R. Protilátky secukinumab a ixekizumab, které neutralizují IL-17A, způsobily zhoršení aktivity onemocnění u takto léčených nemocných s CD [17]. Podobné negativní zkušenosti byly získány také při použití protilátky, která blokuje receptor IL-17R, brodalumabu. Tyto nálezy jasně dokládají, že původní představy, že subset Th17 je zahrnut pouze v poškozujícím zánětu, byly mylné. Nyní je jasně doloženo, experimentálně i v klinice, že subset Th17 T lymfocytů je klíčový pro zajištění obranného zánětu, který má kontrolovat především bakteriální a fungální patogeny. Pro udržení bariérových funkcí střevní sliznice je kriticky důležité zachování integrity mezibuněčných spojení mezi enterocyty. Tyto tzv. pevné spoje jsou tvořeny několika molekulárními komplexy, které spolu vzájemně interagují. Mezibuněčné spojení enterocytů podléhá komplexním regulacím, které odrážejí momentální potřeby organizmu. Udržování „těsnosti“ těchto spojů je výsledkem působení vlastních enterocytů, ale také k nim významně přispívá imunitní systém. Zde je prokázáno, že klíčovou úlohu sehrává fyziologicky IL-17 [18]. Zásahy do dráhy IL-17 vedou logicky k narušení obranyschopnosti na sliznicích. Jsou narušena mezibuněčná spojení mezi enterocyty s výslednou zvýšenou prostupností. To se kriticky projeví právě u nemocných s CD, kde se prohloubí omezení kontroly střevní mikrobioty po působení těchto biologik.
Naopak rozsáhlé klinické studie prokázaly dobrý efekt léčby biologikem, které cílí na signální dráhu IL-12/IL-23. Konkrétně se jedná o ustekinumab, který specificky reaguje s podjednotkou p40, která je sdílena unikátními dimerickými cytokiny IL-12 a IL-23 [19]. Regulační efekty cytokinů IL-12 a IL-23 v obranném i poškozujícím zánětu jsou mimořádné. Velmi stručně lze konstatovat, že IL-12, tvořený především aktivovanými makrofágy polarizovanými do subsetu M1a, je nezbytný pro vyzrávání subsetu Th1 T lymfocytů, které jsou charakterizovány především tvorbou INFγ. T lymfocyty subsetu Th1 jsou již dlouhá léta identifikovány jako podstatná součást poškozujícího zánětu u nemocných s CD. Tlumení Th1 T lymfocytů působením ustekinumabu tlumí poškozující zánět u nemocných s CD. Zcela zvláštní postavení v obranném i poškozujícím zánětu sehrává IL-23. Velmi zjednodušeně lze říci, že cytokin IL-23 je zcela nezbytný pro úplnou funkční polarizaci do subsetu Th17 [20]. Zásah do funkční aktivity IL-23 vazbou ustekinumabu na podjednotku p40 vede k tlumení polarizace do subsetu Th17. Subset Th17, stejně jako subset Th1, jsou podle současného vědeckého názoru považovány za klíčové regulační a efektorové složky poškozujícího zánětu u nemocných s CD. Modulace prostřednictvím ustekinumabu vede ke klinicky významnému utlumení poškozujícího zánětu, který však není provázen závažnějším zásahem do obranných kapacit těla.
Ve zvířecích modelech napodobujících psoriázu a roztroušenou sklerózu byl prokázán pozitivní efekt blokády specifické podjednotky p19 IL-23 biologiky. Při tomto zásahu je plně zachována ochranná aktivita subsetu Th1 zprostředkovaná IL-12. V klinických pokusech u nemocných s CD jsou v současnosti testována biologika cílící na podjednotku p19. Konkrétně se jedná o brazikumab, risankizumab a mirikizumab. Dostupná data z léčebných experimentů, která u nemocných s psoriázou proti sobě porovnala biologika cílící na společnou podjednotku p40 IL-12/IL-23 a unikátní blokádu pouze podjednotky p19 IL-23, naznačují větší klinickou odezvu na léčbu anti-p19 [13].
Závěr
Ustekinumab je pravděpodobně svými biologickými vlastnostmi unikátní monoklonální protilátkou, která účinně moduluje poškozující zánět u nemocných s CD [21]. Je to v protikladu k další monoklonální protilátce, která rovněž cílí na podjednotku p40 IL-12/IL-23, briakinumabu. Klinické testování této protilátky bylo neúspěšně ukončeno ve fázi 2. V různé fázi klinického zkoušení jsou testována různá biologika, která cílí na podjednotku p19, která je unikátní součástí IL-23 [22]. Pro biologikum risankizumab byl v klinickém testování prokázán pozitivní léčebný efekt u nemocných se středně těžkou až těžkou formou CD [23]. Testovány jsou i možnosti, jak ovlivnit signální dráhy zprostředkované transformujícím růstovým faktorem β (TGF-β – Transforming Growth Factor). Imunobiologické dopady TGF-β jsou mimořádně komplexní. Odhadnout dopady zásahů do této dráhy v klinické praxi je obtížné. Budeme si muset počkat na výsledky studií. S ohledem na význam a atraktivitu problematiky léčebných zásahů u nemocných s CD lze očekávat i výsledky testování dalších léčiv, která už nemají charakter biologik [24]. Jedná se především o inhibitory nitrobuněčných kináz a také léčiva, která mají ovlivnit migraci lymfoidních buněk, např. modulací receptorů pro sfingosinfosfát a další léčebné možnosti [25,26].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 4. 6. 2018
Přijato: 4. 7. 2018
prof. RNDr. Jan Krejsek, CSc.
Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové
Zdroje
1. Buc M. Súčasné a perspektívne biologiká a malé molekuly v liečbe idiopatických zápalových chorôb čreva. Vnitř Lék 2018; 64 (3): 280–289.
2. Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon 2016. [online]. Dostupné z: http: //www.imunologie-cloveka-krejsek.cz.
3. Pagliari D, Gambassi G, Piccirillo CA et al. The intricate link among gut “Immunological Niche,” microbiota, and xenobiotics in intestinal pathology. Mediators Inflamm 2017; 8390595. doi: 10.1155/2017/8390595.
4. Petkova DS, Viret C, Faure M. IRGM in autophagy and viral infections. Front immunol 2013; 3 : 426. doi: 10.3389/fimmu.2012.00426.
5. Verstockt B, Smith KG, Lee JC. Genome-wide association studies in Crohn’s disease: Past, present and future. Clin Transl Immunology 2018; 7 (1): e1001. doi: 10.1002/cti2.1001.
6. Lei-Leston AC, Murphy AG, Maloy KJ. Epithelial cell inflammasomes in intestinal immunity and inflammation. Front Immunol 2017; 8 : 1168. doi: 10.3389/fimmu.2017.01168.
7. de Bruyn M, Vermeire S. NOD2 and bacterial recognition as therapeutic targets for Crohn’s disease. Expert Opin Ther Targets 2017; 21 (12): 1123–1139. doi: 10.1080/14728222.2017.
8. Nishida A, Inoue R, Inatomi O et al. Gut microbiota in the pathogenesis of inflammatory bowel disease. Clin J Gastroenterol 2018; 11 (1): 1–10. doi: 10.1007/s12328-017-0813-5.
9. Lane ER, Zisman TL, Suskind DL. The microbiota in inflammatory bowel disease: current and therapeutic insights. J Inflamm Res 2017; 10 : 63–73. doi: 10.2147/JIR.S116088.
10. Opazo MC, Ortega-Rocha EM, Coronado-Arrázola I et al. Intestinal microbiota influences non-intestinal related autoimmune diseases. Front Microbiol 2018; 9 (432). doi: 10. 3389/fmicb.2018.00432.
11. Taylor PR, Roy S, Leal SM et al. Activation of neutrophils by autocrine IL-17A-IL-17RC interactions during fungal infection is regulated by IL-6, IL-23, RORγt and dectin-2. Nat Immunol 2014; 15 (2): 143–151. doi: 10.1038/ni.2797.
12. Maxwell JR, Zhang Y, Brown WA et al. Differential roles for interleukin-23 and interleukin-17 in intestinal immunoregulation. Immunity 2015; 43 (4): 739–750.
13. Machado A, Torres T. Guselkumab for the treatment of psoriasis. BioDrugs 2018; 32 (2): 119–128. doi: 10.1007/s40259-018-0265-6.
14. Ramos GP, Faubion WA, Papadakis KA. Targeting specific immunologic pathways in Crohn’s disease. Gastroenterol Clin North Am 2017; 46 (3): 577–588. doi: 10.1016/j.gtc.2017. 05.009.
15. Segal AW. Making sense of the cause of Crohn’s – a new look at an old disease. Version 2. F1000Res 2016; 5 : 2510. doi: 10.12688/ f1000research.9699.2.
16. Abraham C, Dulai PS, Vermeire S et al. Lessons learned from trials targeting cytokine pathways in patients with inflammatory bowel diseases. Gastroenterology 2017; 152 (2): 374–388. doi: 10.1053/j.gastro.2016.10. 018.
17. Hueber W, Sands BE, Lewitzky S et al. Secukinumab, a human anti-IL-17A monoclonal antibody, for moderate to severe Crohn’s disease: unexpected results of a randomised, double-blind placebo-controlled trial. Gut 2012; 61 (12): 1693–1700. doi: 10.1136/gutjnl-2011-301 668.
18. Lee JS, Tato CM, Joyce-Shaikh B et al. Interleukin-23-independent IL-17 production regulates intestinal epithelial permeability. Immunity 2015; 43 (4): 727–738. doi: 10.1016/j.immuni.2015.09.003.
19. MacDonald JK, Nguyen TM, Khanna R et al. Anti-IL-12/23p40 antibodies for induction of remission in Crohn’s disease. Cochrane Database Syst Rev 2016; 11: CD007572.
20. Deepak P, Sandborn WJ. Ustekinumab and anti-interleukin-23 agents in Crohn’s disease. Gastroenterol Clin North Am 2017; 46 (3): 603–626. doi: 10.1016/j.gtc.2017.05.013.
21. Kotze PG, Ma C, Almutairdi A et al. Clinical utility of ustekinumab in Crohn’s disease. J Inflamm Res 2018; 11 : 35–47. doi: 10.2147/JIR.S157358.
22. Furfaro F, Gilardi D, Allocca M et al. IL-23 blockade for Crohn’s disease: next generation of anti-cytokine therapy. Expert Rev Clin Immunol 2017; 13 (5): 457–467. doi: 10.1080/ 1744666X.2017.1279055.
23. Feagan BG, Sandborn WJ, D’Haens G et al. Induction therapy with the selective interleukin-23 inhibitor risankizumab in patients with moderate-to-severe Crohn’s disease: a randomised, double-blind, placebo-controlled phase 2 study. Lancet 2017; 389 (10080): 1699–1709. doi: 10.1016/S0140-6736 (17) 30 570-6.
24. Catalan-Serra I, Brenna Ø. Immunotherapy in inflammatory bowel disease: novel and emerging treatments. Hum Vaccin Immunother 2018; 1–15. doi: 10.1080/21645515.2018.1461 297.
25. Aoki, M, Aoki H, Ramanathan R et al. Sphingosine-1-phosphate signaling in immune cells and inflammation: roles and therapeutic potential. Mediators Inflamm 2016; 8606878. doi: 10.1155/2016/8606878.
26. Catalan-Serra I, Brenna Ø. Immunotherapy in inflammatory bowel disease: Novel and emerging treatments. Hum Vaccin Immunother 2018. In press. doi: 10.1080/21645515.2018.1461297.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2018 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Ferinject: správně indikovat, správně podat, správně vykázat
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Alveolární echinokokóza – vzácné onemocnění vyžadující multidisciplinární přístup
- Prevalencia a asociované faktory ovariálnych cýst u pacientiek s Crohnovou chorobou
- Porovnání účinnosti kolonické kapslové endoskopie a optické koloskopie u osob s pozitivním imunochemickým testem na okultní krvácení do stolice – multicentrická, prospektivní studie
- Experimentální enteroskopie s využitím kapsle s boční optikou
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Personalizovaná terapie pacientů s gastroezofageální refluxní chorobou – metodika stanovení genového profilu CYP2C19
- Efektivita a bezpečnost budesonidu MMX (Cortiment®) v dlouhodobé udržovací léčbě ulcerózní kolitidy
- Modulace signálních drah IL-12/IL-23 ustekinumabem tlumí poškozující zánět u pacientů s Crohnovou nemocí
- Klinický případ jaterního a pleuropulmonálního abscesu amébového původu u pacienta s chronickou hepatitidou B v Cotonou
- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- 40th Czech and Slovak Endoscopic Days and 19th Endoscopic Day IKEM
- XLVI. májové hepatologické dny
-
Gastroenterologie a hepatologie nebude registrována v PubMed a co z toho plyne
Odpověď předsedovi České gastroenterologické společnosti - Zpráva o činnosti výboru ČGS ČLS JEP za období 2014–2018
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pneumatosis cystoides intestinalis (coli) - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



