-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
Hyponatremia in the context of gastrointestinal diseases
Diseases of the gastrointestinal tract (GIT) often lead to changes in the homeostasis of serum electrolyte concentrations and of acid-base and water balance. There is a large turn in water and electrolytes throughout the digestive tract. GIT is involved in electrolyte balance, water absorption, and excretion. GIT mucosa secretes a large amount of juices. Pathological conditions (increased secretion or decreased reabsorption) contribute to the deregulation of homeostasis of the internal environment. These disorders can vary in intensity from accidentally detected laboratory abnormalities to life-threatening conditions. The following review article addresses hyponatremia – the most common disorder of the internal environment – in the context of GIT diseases. The various clinical situations that may be associated with hyponatremia are discussed. In addition, hyponatremia is often accompanied by a number of other abnormalities of the internal environment, these must be respected during the treatment. It is necessary to obtain a range of data – both anamnestic and laboratory data – including changes in these data during the course of treatment. Equally important is the careful execution of a basic physical examination focusing on hydration. Understanding the pathophysiological mechanisms that lead to hyponatremia, along with detailed clinical-laboratory image analysis, is the only way to obtain an accurate differential diagnosis of hyponatremia. For physicians across all areas of expertise, it is important to perform recommended laboratory tests prior to therapy initiation, afterwards these data enable us the correct interpretation of the abnormalities.
Key words:
gastrointestinal diseases – disorders of homeostasis – hyponatremia
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 28. 6. 2018
Accepted: 3. 8. 2018
Autoři: L. Vítová
Působiště autorů: Interní klinika LF UK a FN Motol, Praha
Vyšlo v časopise: Gastroent Hepatol 2018; 72(4): 345-350
Kategorie: Vybrané kapitoly z vnitřního lékařství: přehledová práce
doi: https://doi.org/10.14735/amgh2018345Souhrn
Onemocnění gastrointestinálního traktu (GIT) vede často ke změnám vnitřního prostředí, resp. změnám objemu extracelulární tekutiny, sérových koncentrací elektrolytů a acidobazické rovnováhy. V celém rozsahu zažívacího traktu dochází k velkému obratu vody a elektrolytů. GIT se podílí na vstřebávání i exkreci vody a elektrolytů a významně zasahuje do regulace bikarbonátového pufrovacího systému. Sliznice GIT secernují řadu šťáv. Za patologické situace (zvýšená sekrece, snížená reabsorpce) tak dochází k deregulaci homeostázy vnitřního prostředí. Tyto poruchy mohou mít různou intenzitu klinicko-laboratorní symptomatologie, od náhodně zjištěné laboratorní abnormality až po život ohrožující stavy. Následující přehledový článek shrnuje problematiku hyponatremie – nejčastější poruchy vnitřního prostředí – v souvislosti s onemocněními GIT. Jsou diskutovány různorodé klinické situace, které mohou být s hyponatremií spojeny. Hyponatremie bývá navíc často provázena řadou dalších abnormalit vnitřního prostředí a v jejich kontextu je potřeba ji také vnímat. Je nutné zajistit řadu údajů – jednak anamnestických, jednak laboratorních, které jsou v průběhu léčby modifikovány. Neméně důležité je pečlivé provedení základního fyzikálního vyšetření zaměřeného na stav hydratace. Porozumění patofyziologickým mechanismům rozvoje hyponatremie spolu s podrobnou analýzou klinicko-laboratorního obrazu je jedinou cestou ke správné diferenciální diagnóze hyponatremie, která je zpětně bez těchto znalostí nemožná. Pro lékaře napříč všemi odbornostmi je důležité respektovat doporučená laboratorní vyšetření před iniciací terapie tak, aby je mohli posléze sami nebo s pomocí odborníka později interpretovat.
Klíčová slova:
choroby GIT – poruchy vnitřního prostředí – hyponatremie
Definice a patofyziologie hyponatremie
Hyponatremií označujeme stav, kdy sérová koncentrace natria klesá pod 135 mmol/l. Dochází při ní k nepoměru mezi objemem vody a množstvím natria v těle. Hyponatremie se může rozvinout v zásadě ve čtyřech situacích:
- Retence bezsolutové vody. Jde o hyponatremii euvolemickou. Diluce sama o sobě je ve vztahu k HCO3– dějem acidifikačním (diluční acidóza).
- Současná retence sodíku a vody, kdy retence vody je vyšší než retence sodíku. V tomto případě jde o diluční hypervolemickou hyponatremii, která je spojena také s diluční acidózou.
- Deplece sodíku a vody, deplece sodíku je větší než deplece vody. V tomto případě jde o depleční hyponatremii hypovolemickou, která je spojena s depleční (kontrakční) alkalózou.
- Deplece sodíku a retence bezsolutové vody. Vzniká deplečně-diluční typ hyponatremie. Poměr proti sobě jdoucích poruch má vliv na volemii i acidobazickou rovnováhu a rozhoduje, která z nich je v převaze.
Se všemi patofyziologickými formami hyponatremie se můžeme setkat u pacientů s chorobami gastrointestinálního traktu (GIT) (tab. 1). Vznik hyponatremie má pro nemocného velmi závažné důsledky, neboť řada studií prokázala horší prognózu a vyšší mortalitu pacientů s hyponatremií [1–6].
Tab. 1. Diferenciální diagnóza hyponatremie s přihlédnutím k etiologii.
Tab. 1. Differential diagnosis of hyponatremia taking into account aetiology.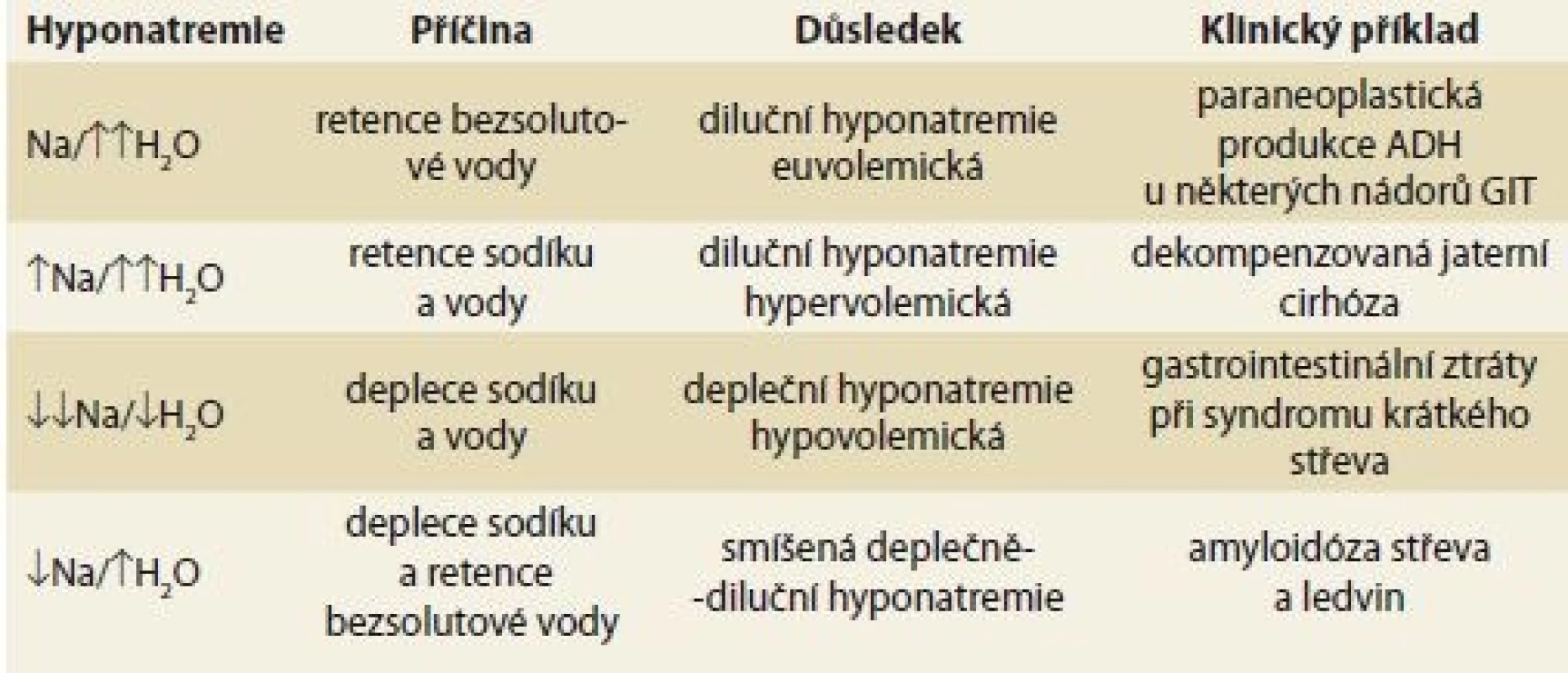
Na – sodík, H2O – voda, ADH – antidiuretický hormon, GIT – gastrointestinální trakt Natrium je hlavním iontem extracelulární tekutiny, a hlavní měrou proto zajišťuje tonicitu (efektivní osmolalitu) extracelulární tekutiny. Zatímco kryoskopicky měřená osmolalita plazmy měří všechny osmoticky aktivní látky, efektivní tonicita kalkuluje pouze s látkami, jejichž změněná koncentrace v extracelulární tekutině je schopna způsobit přesuny vody mezi extracelulárním a intracelulárním kompartmentem. Z endogenních molekul jde o sodík a glukózu. Při hyponatremii, která je spojena se sníženou efektivní tonicitou plazmy, dochází k přesunu vody z extra do intracelulárního kompartmentu. Objem intracelulární tekutiny se proto zvyšuje. Hypotonicitou extracelulární tekutiny vytvořený osmotický gradient podmiňuje přesun vody do buněk včetně neuronů a je zodpovědný za rozvoj symptomů, které jsou projevem mozkového edému. Cílem léčby je zpětný přesun vody z intra do extracelulárního prostoru. Neúměrně rychlá korekce tohoto stavu však může vést k rozvoji osmoticky podmíněné myelinolýzy s fatálními důsledky pro pacienta.
Hlavním orgánem podílejícím se na regulaci objemu tělesné vody a natremie jsou ledviny. Tato regulace je determinována glomerulární filtrací a následně tubulárním transportem vody a natria. Většina sodíkových kationtů je v izotonickém poměru s vodou resorbována v proximálním tubulu. Ke snížení tubulární resorpce sodíku v tomto segmentu vede jakákoli nefropatie spojená se sníženou glomerulární filtrací v rámci kompenzačních pochodů v reziduálních nefronech a natriuretické peptidy. Tubulární resorpci zvyšuje v tomto segmentu naopak rostoucí produkce angiotenzinu II a sympatická neurohumorální aktivace. V dalších částech nefronu modulují tubulární transport sodíku hormonální i parakrinní působky, jako je prostaglandin PGE2 a komponenty renin-angiotezin-aldosteronové osy. Tubulární transport bezsolutové vody je řízen antidiuretickým hormonem (ADH), který zajišťuje zpětnou resorpci bezsolutové vody ve sběracím kanálku a působí prostřednictvím V2 receptoru inkorporaci akvaporinu 2 do luminální membrány. Hlavním stimulem sekrece ADH je hypoosmolalita séra, druhým stimulem je snížený efektivní cirkulující objem vnímaný baroreceptory [7].
Evropská doporučení pro diagnostiku a léčbu hyponatremie
S ohledem na vysokou incidenci hyponatremie a na závažnost možných důsledků této poruchy byla v roce 2014 publikována (z iniciativy evropské nefrologické a endokrinologické společnosti a společnosti pro intenzivní medicínu) doporučení pro diagnostiku a léčbu hyponatremie [8].
V těchto doporučeních je uveden podrobný rozbor problematiky hyponatremie, vč. pravidel diferenciálně-diagnostického postupu. Zásadní vy-šetření – osmolalita moči a močová koncentrace natria – jsou nepostradatelnými laboratorními informacemi, které usměrňují diferenciální diagnózu hyponatremie i urgentní léčbu (schéma 1).
Schéma 1. Diferenciálně diagnostický postup u hyponatremie – volně převzato z evropských doporučení pro diagnostiku a léčbu hyponatremie z r. 2014 [8].
Scheme 1. Differential diagnosis procedure for hyponatremia – freely copied from the European Clinical Practice Guideline on Diagnosis and Treatment of Hyponatraemia of 2014 [8].![Schéma 1. Diferenciálně diagnostický postup u hyponatremie – volně převzato z evropských doporučení pro diagnostiku a léčbu hyponatremie z r. 2014 [8].<br>
Scheme 1. Differential diagnosis procedure for hyponatremia – freely copied from the European Clinical Practice Guideline on
Diagnosis and Treatment of Hyponatraemia of 2014 [8].](https://pl-master.mdcdn.cz/media/image/3973b6f19f608ea23ccd1077eb98faaa.jpeg?version=1535973966)
Hyponatremie jako důsledek zvracení
Žaludeční šťáva obsahuje cca 20 až 80 mmol/l Na+, 10–20 mmol/l K+, 120 až 150 mmol/l Cl–, neobsahuje bikarbonát, její pH je < 2. Proti séru se jedná o relativně „hyponatremickou“ tekutinu, nicméně ve zvratcích může být příměs žluče a pankreatické šťávy, v nichž je koncentrace natria vyšší – 150, resp. 160 mmol/l. Zvracení tedy může být příčinou hyponatremie přímými ztrátami natria. K větším ztrátám natria však dochází renální kompenzací metabolické alkalózy, která je pro zvracející jedince typická a jejíž příčinou je ztráta kyseliny solné a retence bikarbonátového aniontu. Dochází k útlumu recyklace bikarbonátového aniontu v proximálním tubulu, který spolu s natriem postupuje do distálnějších částí nefronu a zvýšená koncentrace sodíku stimuluje produkci reninu v juxtaglomerulárním aparátu, startuje renin-angiotenzin-aldosteronovou osu (protože ledvina vnímá nastalou situaci jako zvýšenou ztrátu natria). Následuje kompenzační resorpce natria a sekrece kaliového kationtu na transportéru řízeném aldosteronem ve sběrném kanálku ENaC (epithelial sodium channel). Metabolická alkalóza může být prohlubována současnou sekrecí protonového kationu ve sběracím kanálku. Při zvracení dochází k rozvoji negativní bilance vody a soli (snížený perorální příjem potravy, a tedy soli, zvýšené renální ztráty sodíku, které není ledvina schopna plně kompenzovat). Hyponatremie se vyvíjí v případě, že ztráta izotonické tekutiny vede k baroreceptorové stimulaci ADH a zvýšené resorpci bezsolutové vody v distálním nefronu (rozvíjí se depleční hypovolemická hyponatremie) [9].
Hyponatremie jako důsledek průjmů
Průjem je vedoucím symptomem onemocnění tenkého a tlustého střeva (infekční průjmy, idiopatické střevní záněty (IBD), střevní ischemie, celiakie, nádorová onemocnění střeva, malabsorpční syndrom a další), je přítomen u onemocnění biliárního traktu a pankreatu. Existuje řada dalších extraintestinálních příčin (např. autonomní neuropatie zejména u diabetes mellitus, tyreotoxikóza, zrychlená pasáž GIT po resekčních operacích, Addisonská krize). Obecně je průjem podmíněn zvýšeným podílem vody ve stolici. Na celkovém množství ztrát vody a složení stolice z pohledu elektrolytů závisí, jaká konkrétní porucha vnitřního prostředí se rozvine.
Trávicím traktem projde řádově 10 litrů vody denně (perorální příjem 2 l, sliny 1 l, žluč 1 l, žaludeční sekret 2 l, pankreatická šťáva 2 l a intestinální sekret 2 l). Z tohoto množství se 8–8,5 l absorbuje v tenkém střevě a 1,5–2 l ve střevě tlustém. Stolicí odchází 100–150 ml vody. Fyziologická koncentrace Na+ vody ve stolici je kolem 30 mmol/l, K+ kolem 75 mmol/l [10]. V případě závažného sekrečního průjmu dochází k výraznému zvýšení koncentrace Na+ ve stolici, až 140 mmol/l. Ztráty sodíku jsou provázeny ztrátami HCO3–, proto se rozvíjí hyperchloremická metabolická acidóza. Střevní ztráty sodíku v případě frekventních objemných stolic vedou k objemové depleci a kompenzačnímu rozvoji sekundárního hyperaldosteronizmu, který potencuje hypokalemii vzniklou střevními ztrátami. Při významné depleci objemu dochází ke stimulaci ADH, která je zodpovědná za rozvoj depleční hyponatremie. S obdobnou patogenezí rozvoje hyponatremie se setkáváme u pacientů se syndromem krátkého střeva. Klasickou chybou při rozvoji hyponatremie je nadměrný perorální příjem hypotonických tekutin v průběhu jídla a nedostatečné tlumení sekrece kyselé žaludeční šťávy.
Hyponatremie u jaterní cirhózy
Ascitická forma jaterní cirhózy je spojena se změnami splanchnické hemodynamiky. Dochází k vazodilataci v oblasti splanchnického řečiště – relativní hypovolemii (snížení efektivního cirkulujícího volumu), jež má za následek rozvoj sekundárního hyperaldosteronizmu, ten vede k retenci natria a současné sekreci kalia a vodíkových kationtů. Nadměrný perorální příjem hypotonické tekutiny, snížená degradace ADH v játrech a baroreceptorová stimulace ADH jsou příčinou rozvoje hypervolemické hyponatremie. Pro významnou aktivitu ADH svědčí osmolalita moči, která může dosahovat až 1 000 mOsm/kg (hyponatremie spojená se sníženou efektivní tonicitou by měla tlumit produkci ADH, a tím snížit osmolalitu moči na hodnoty pod 100 mOsm/kg). Snížená efektivní tonicita extracelulární tekutiny při hyponatremii vede k přesunům vody z extracelulárního do intracelulárního kompartmentu včetně mozkových buněk, může eskalovat projevy encefalopatie edémem mozku [11].
Hyponatremie u chorob zažívacího traktu komplikovaných AA amyloidózou
Nemocní s IBD, s dlouhodobě aktivním onemocněním, jsou ohroženi rozvojem AA amyloidózy, která obvykle postihuje ledviny a je pak provázena rozvojem nefrotického syndromu. Neuvážená terapie edematózního stavu diuretiky může vést k rozvoji hyponatremie, která má charakter hypervolemický a diluční. Postihuje-li amyloidóza také střevo nebo trvá-li aktivita základního onemocnění provázená průjmy, rozvíjí se smíšená porucha ve smyslu deplečně-diluční hyponatremie. U rizikových pacientů s IBD by proto měla být sledována také proteinurie.
Hyponatremie u tumorů GIT
Etiologie hyponatremie u pacientů s nádorovým onemocněním GIT je heterogenní a často se jednotlivé příčiny kombinují. Nepříznivá kombinace sníženého příjmu soli (nechutenství, dyspepsie vyvolaná onkologickou léčbou), perorální hydratace hypoionní tekutinou, se současnými zvýšenými gastrointestinálními ztrátami sodíku (průjmy u kolorektálních adenomů, adenokarcinomů) vede k depleční hyponatremii. Operační/resekční řešení tumorů GIT může být příčinou zvýšených ztrát tekutin a elektrolytů z důvodu snížení resorpční plochy. V neposlední řadě může být tumor GIT spojen s paraneoplastickou produkcí ADH a rozvojem syndromu nepřiměřené sekrece ADH (SIADH – syndrome of inappropriate antidiuretic hormone secretion) – euvolemická hyponatremie. K aktivaci ADH přispívají také některé látky používané při systémové chemoterapii (metotrexát, deriváty platiny, vinca alkaloidy, ifosfamid, cyklofosfamid, melfalan) [12]. Některé tumory, vč. tumorů zažívacího traktu, mohou být vzácně komplikovány rozvojem paraneoplastické membranózní nebo membranoproliferativní glomerulonefritidy. Oba typy této glomerulární léze jsou prakticky vždy spojeny s rozvojem nefrotického syndromu (s těmito typy glomerulonefritid se můžeme setkat také u pacientů s hepatitidou B nebo C).
Hyponatremie u ileózních stavů, při pankreatitidě
Při pankreatitidě nebo ileózních stavech dochází k sekvestraci tekutiny do 3. prostoru (lumen střeva, dutina břišní, retroperitoneum), což vede k významnému snížení tekutiny v prostoru intravaskulárním. Významný objemový deficit spojený s baroreceptorovou aktivací ADH a/nebo nevhodné složení infuzních roztoků podporuje rozvoj hyponatremie. Aktivátorem sekrece ADH je také bolest a nauzea.
Hyponatremie v souvislosti s vyšetřením GIT, s léčbou
Riziko rozvoje hyponatremie je známé v souvislosti s přípravou ke koloskopii. Toto riziko roste, pokud pacient chronicky užívá léky s potenciálem aktivace ADH (thiazidy, antidepresiva), inhibitory angiotensin konvertujícího enzymu nebo betablokátory, dále s věkem nad 65 let, u pacientů po gastrektomii, s polymorbiditou (renální insuficience, srdeční selhání, cirhóza jater). Rozvoj akutní hyponatremie souvisí s deplecí natria a zároveň s baroreceptorovou aktivací ADH. Vyšší riziko hyponatremie a dalších elektrolytových abnormalit je popisováno v souvislosti s použitím nízkoobjemových přípravků (citrát hořečnatý s pikosulfátem sodným, roztok sulfátů), proto by neměly být používány u rizikových pacientů a nemocných neschopných vypít dostatečné množství vody spolu s projímadlem. Zlatým standardem je použití 4 l roztoku polyethylenglykolu, který je z pohledu rozvoje elektrolytových abnormalit považován za nejbezpečnější. K rozvoji hyponatremie dochází v souvislosti s přípravou ke koloskopii cca u 8 % pacientů. Většinou se jedná o mírnou asymptomatickou hyponatremii, ale jsou popsány i případy manifestované závažnou neurologickou symptomatickou vč. kómatu [13].
Pacienti často užívají celou řadu léků, které mohou vyvolat SIADH. Ze spektra v gastroenterologii zcela běžně užívaných jsou to inhibitory protonové pumpy [12]. Terlipresin, využívaný při léčbě krvácení z jícnových varixů nebo při hepatorenálním selhání, je dalším z léků, které svou podobností s ADH mohou způsobit rozvoj hyponatremie.
Důsledky velkých objemových ztrát GIT – akutní renální selhání
V podstatě všechny stavy, při kterých dochází následkem GIT ztrát k intravaskulární hypovolemii a hypoperfuzi ledvin, mohou vést k rozvoji akutního renálního selhání (AKI – acute kidney injury). Pokud je zahájena léčba včas, AKI je čistě prerenální (pokud nebyla již v předchorobí přítomna nefropatie) a po adekvátní rehydrataci dochází k rychlé reparaci ledvinové funkce. Pokud trvá závažná hypoperfuze ledvin delší dobu, dochází k rozvoji akutní tubulární nekrózy. Reparace funkce ledvin bývá pomalejší a pravidlem bývá přechodná polyurická fáze, která sama o sobě může vést k rozvoji hyponatremie. Za této situace je potřeba pečlivě monitorovat vodní a elektrolytovou bilanci. Tubulární funkce posuzujeme na základě hodnocení frakční exkrece elektrolytů, osmoticky aktivních látek a vody.
Léčba hyponatremie
Při volbě léčebné strategie hyponatremie klademe důraz na posouzení symptomů svědčících pro edém mozku. Za významné symptomy jsou považovány – vomitus, somnolence, kóma, křeče, kardiopulmonální nestabilita; za středně významné – nauzea, zmatenost a bolesti hlavy. Důležitým aspektem je doba rozvoje poruchy. Akutní hyponatremie trvá dobu kratší než 48 hod, rozpoznání akutní poruchy proto záleží na znalosti hodnot natremie v krátkém období před rozvojem hyponatremie. Pokud tuto znalost nemáme, považujeme hyponatremii vždy za chronickou.
Pokud má pacient závažné symptomy edému mozku, je okamžitým opatřením podání 150 ml 3% NaCl v průběhu 20 min s následnou kontrolou natremie. V případě akutní hyponatremie je doporučeno pokračovat v podání 3% NaCl do vzestupu natremie o 5 mmol/l. Při zlepšení stavu následuje léčba kauzální. Nedojde-li ke zlepšení, pokračujeme v infuzi tak, aby natremie stoupala o 1 mmol/l/h do zlepšení symptomů, do kumulativního vzestupu natremie o 10 mmol/l nebo dosažení natremie 130 mmol/l. V každém případě by vzestup natremie neměl překročit 10 mmol/l prvních 24 hod a 8 mmol/l každých dalších 24 hod. Při středně závažné symptomatologii klademe větší důraz na co nejrychlejší diagnostiku příčiny hyponatremie a kauzální léčbu, nicméně v úvodu je opět prvním krokem podání 150 ml 3% NaCl, navržený vzestup natremie v tomto případě je 5 mmol/l v prvních 24 hod.
Asymptomatickou chronickou hyponatremii bychom měli léčit, pokud natremie klesne pod 130 mmol/l a taktika terapie se řídí příčinou základní poruchy. U pacientů s eu-a hypervolemickou hyponatremií je základním opatřením restrikce perorálního příjmu tekutin. Lze podat malé dávky kličkového diuretika v kombinaci s perorální substitucí NaCl, tato léčba vede ke zvýšení vylučování natriové vody. Při depleční hyponatremii (sníženém cirkulujícím volumu) je třeba pacienta substituovat izotonickými náhradními roztoky, jejichž volba se řídí parametry acidobazické rovnováhy (v praxi nejčastěji fyziologickým roztokem nebo balancovanými krystaloidy). Doporučená maximální rychlost korekce se neliší od akutní hyponatremie [8].
Poznámky užitečné pro praxi
1. Vzestup natremie musí být zejména u chronické hyponatremie pozvolný. K odhadu vzestupu natremie v závislosti na použitém 1 l infuzního roztoku lze použít Androgué a Madiasovu rovnici [14]:celková tělesná voda (CTV) = 50/60 %, tělesná hmotnost (TH) u žen/mužů, S-Na+ (natremie)
Výpočet množství podaného roztoku za 1 hod je nutno považovat za velmi orientační a v průběhu léčby je potřeba efekt léčby kontrolovat opakovaným vyšetřením natremie.
Klinický příklad
Žena, TH 60 kg, aktuální S-Na+ je 120 mmol/l, substituční roztok 0,9% NaCl = fyziologický roztok s koncentrací Na+ 154 mmol/l.
Zvýšení S-Na+ = 1,1 mmol/l po podání 1 l roztoku.
Objem podaného 3% NaCl (ml) můžeme odhadnout podle vzorce [9]: V (ml) = TH × žádané zvýšení S-Na+
Klinický příklad
Žena, TH 60 kg, aktuální S-Na+ je 120 mmol/l, substituční roztok 3% NaCl, chceme docílit zvýšení S-Na+ o 5 mmol/l za 2 hod, kolik roztoku musíme podat?
Objem podaného 3% NaCl (ml) = 60 × 5 = 300 ml.
2. Má-li pacient depleční hyponatremii, je na prvním místě korekce hypovolemie podáním izotonického infuzního roztoku. Musíme přitom počítat s rychlým odezněním baroreceptorové stimulace ADH a možností neúměrně rychlého vzestupu natremie.3. Je-li pacient současně s hyponatremií také hypokalemický, může dojít při rychlé normalizaci kalemie k rychlejší korekci natremie z důvodu zvýšení aktivity sodíkové pumpy NaK ATPázy.4. Etiologie hyponatremie je často nejednoznačná. Před zahájením terapie je nutné provést laboratorní vyšetření, která později umožní diferenciálně diagnostické zhodnocení poruchy vnitřního prostředí. Je potřeba vyšetřit zároveň hodnoty sérových a močových koncentrací Na+, K+, Cl–, urey, kreatininu a osmolality. Tyto laboratorní parametry umožňují kalkulace renálních frakčních exkrecí elektrolytů, urey a vody (frakční exkrece vyjadřuje procento stanovované látky, které je vyloučeno definitivní močí z původně profiltrovaného množství této látky) a odlišit gastrointestinální ztráty od ztrát renálních. Vyšetření močové osmolality je velice důležitým parametrem, který umožňuje posoudit aktivitu ADH. Neméně důležité je vyšetření acidobazické rovnováhy.5. Při podávání substitučních roztoků je třeba respektovat jejich vliv na acidobazickou rovnováhu. Fyziologický roztok má s ohledem na vysokou koncentraci chloridů acidifikační účinek, balancované roztoky (Plazmalyte, Isolyte) obsahující acetát, který se metabolizuje na bikarbonát, vnitřní prostředí alkalizují.6. U pacientů se stomií je potřeba při bilanci tekutin a elektrolytů zahrnout i tekutinu a elektrolyty ztrácené do stomie, zejména jsou-li tyto ztráty zvýšeny.7. V doporučeních uvedený 3% roztok NaCl není běžně dostupný, lze ho ale připravit smícháním 250 ml fyziologického roztoku se 75 ml 10% NaCl. Koncentrace natria ve výsledném roztoku je 513 mmol/l [9].8. Jeden l fyziologického roztoku obsahuje 154 mmol Na+ a 154 mmol Cl–. Jednomu gramu kapsle NaCl využívané při perorální substituci natria odpovídají 17 mmol Na+ a Cl–.9. Hyperglykemický pacient může mít hyponatremii, tato hyponatremie je však hypertonická (translokační) a není spojena s rizikem rozvoje edému mozku.Závěr
Onemocnění GIT jsou častou příčinou poruchy elektrolytové a vodní homeostázy. Při diferenciální diagnóze je třeba posuzovat parametry vnitřního prostředí komplexně (močové i sérové koncentrace elektrolytů, urey, kreatininu, osmolality a parametrů acidobazické rovnováhy). Nejčastější poruchou vnitřního prostředí obecně je hyponatremie. Ačkoli jsou publikována doporučení diferenciální diagnostiky a léčby hyponatremie, není vždy jednoduché je implementovat do praxe. Změny vnitřního prostředí jsou výsledkem složitých regulačních mechanizmů, které je třeba v diagnostickém i terapeutickém postupu respektovat. Kromě laboratorních vyšetření je samozřejmě důležité posouzení celkového stavu pacienta (měření krevního tlaku vleže a v ortostáze, měření tepové frekvence, posouzení náplně krčních žil atd.). Nesprávně zvolená léčebná strategie a nerespektující patofyziologický mechanizmus mohou mít fatální následky.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 28. 6. 2018
Přijato: 3. 8. 2018
MUDr. Lenka Vítová
Interní klinika LF UK a FN Motol
V Úvalu 84 150 00 Praha 5
Zdroje
1. Abola MV, Tanenbaum JE, Bomberger TT et al. Preoperative hyponatremia is associated with reoperation and prolonged length of hospital stay following total knee arthroplasty. J Knee Surg 2018. In press. doi: 10.1055/ s-0038-1641156.
2. Vieira J, Nunes G, Santos CA et al. Serum electrolytes and outcome in patients undergoing endoscopic gastrostomy. Arq Gastroenterol 2018; 55 (1): 41–45. doi: 10.1590/S0004-2803. 201800000-05.
3. Holland-Bill L, Christiansen CF, Farkas DK et al. Diagnosis of hyponatremia and increased risk of a subsequent cancer diagnosis: results from a nationwide population-based cohort study. Acta Oncol 2018; 57 (4): 522–527. doi: 10.1080/0284186X.2017.1378430.
4. Chung MC, Yu TM, Shu KH et al. Hyponatremia and increased risk of dementia: A population-based retrospective cohort study. PLoS One 2017; 12 (6): e0178977. doi: 10.1371/journal.pone.0178977.
5. Choi JS, Kim CS, Bae EH et al. Prognostic impact of hyponatremia occurring at various time points during hospitalization on mortality in patients with acute myocardial infarction. Medicine (Baltimore) 2017; 96 (23): e7023. doi: 10.1097/MD.0000000000007023.
6. Al Mawed S, Pankratz VS, Chong K et al. Low serum sodium levels at hospital admission: Outcomes among 2.3 million hospitalized patients. PLoS One 2018; 13 (3): e0194379. doi: 10.1371/journal.pone.0194379.
7. Čertíková-Chábová V. Exkrece sodíku, chloridů a vody, regulace objemu extracelulární tekutiny. In: Tesař V, Viklický O (eds). Klinická nefrologie. 2. vyd. Praha: Grada Publishing 2015 : 16–21.
8. Spasovski G, Vanholder R, Allolio B et al. Clin-ical practice guideline on diagnosis and treatment of hyponatraemia. Nephrol Dial Transplant 2014; 29 (Suppl 2): i1-i39. doi: 10.1093/ndt/gfu040.
9. Schück O. Poruchy metabolismu vody a elektrolytů s klinickými případy. Hyponatremie. 1. vyd. Praha: Grada Publishing 2013: 64–65.
10. Ehrmann J. Diferenciální diagnostika průjmu a možnosti léčby. Interní Med 2011; 13 (4): 167–170.
11. Gottfriedová H, Horáčková M, Čáslavská M et al. Poruchy vodního a elektrolytového metabolismu a změny acidobazické rovnováhy u pacientů s ascitickou cirhózou jater. Čas Lék čes 2017; 156 : 150–152.
12. Liamis G, Milionis H, Elisaf M. A review of drug-induced hyponatremia. Am J Kidney Dis 2008; 52 (1): 144–153. doi: 10.1053/j.ajkd.2008.03.004.
13. Costa JM, Soares JB. Symptomatic hyponatremie after bowel preparation: report of two cases and literature review. Acta Med Port 2017; 30 (11): 824–826. doi: 10.20344/amp.8794.
14. Adrogué HJ, Madias NE. Hyponatremia. N Engl J Med 2000; 342 (21): 1581–1589
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2018 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Klinická a experimentální gastroenterologie
- Kvíz z klinické praxe
- Alveolární echinokokóza – vzácné onemocnění vyžadující multidisciplinární přístup
- Prevalencia a asociované faktory ovariálnych cýst u pacientiek s Crohnovou chorobou
- Porovnání účinnosti kolonické kapslové endoskopie a optické koloskopie u osob s pozitivním imunochemickým testem na okultní krvácení do stolice – multicentrická, prospektivní studie
- Experimentální enteroskopie s využitím kapsle s boční optikou
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Personalizovaná terapie pacientů s gastroezofageální refluxní chorobou – metodika stanovení genového profilu CYP2C19
- Efektivita a bezpečnost budesonidu MMX (Cortiment®) v dlouhodobé udržovací léčbě ulcerózní kolitidy
- Modulace signálních drah IL-12/IL-23 ustekinumabem tlumí poškozující zánět u pacientů s Crohnovou nemocí
- Klinický případ jaterního a pleuropulmonálního abscesu amébového původu u pacienta s chronickou hepatitidou B v Cotonou
- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- 40th Czech and Slovak Endoscopic Days and 19th Endoscopic Day IKEM
- XLVI. májové hepatologické dny
-
Gastroenterologie a hepatologie nebude registrována v PubMed a co z toho plyne
Odpověď předsedovi České gastroenterologické společnosti - Zpráva o činnosti výboru ČGS ČLS JEP za období 2014–2018
- Výběr z mezinárodních časopisů
-
Správná odpověď na kvíz
Pneumatosis cystoides intestinalis (coli) - Kreditovaný autodidaktický test: klinická a experimentální gastroenterologie
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hyponatremie v souvislosti s chorobami gastrointestinálního traktu
- Mastocytární enterokolitida jako možná příčina chronického průjmového onemocnění
- Endosonograficky navigované drenážní výkony novými metalickými apozičními stenty s elektrokauterizační jednotkou (stent Hot AXIOS) – vlastní soubor 20 pacientů
- Metotrexát – znovu objevený lék pro Crohnovu nemoc
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





