-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochorení
The importance of fecal calprotectin in the diagnostics and treatment of inflammatory bowel diseases
Calprotectin is a cytosolic protein of neutrophil leukocytes. Its concentration correlates with migration of neutrophiles into intestinal lumen. Therefore it is a reliable marker of intestinal inflammation and it is being used in the diagnosis of inflammatory bowel disease. In recent years, new evidence is emerging of its potential use in monitoring of the disease activity, response to therapy or in predicting the disease relapse. However, the use of calprotectin in these indications is rather limited due to persistent uncertainty concerning cut-off values and intervals of its examination.
Key words:
fecal calprotectin – inflammatory bowel disease – ulcerative colitis – Crohn’s disease
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Autoři: J. Letkovský; T. Hlavatý
Působiště autorů: V. interná klinika LF UK a UN Bratislava
Vyšlo v časopise: Gastroent Hepatol 2015; 69(1): 43-49
Kategorie: IBD: přehledová práce
doi: https://doi.org/10.14735/amgh201543Souhrn
Kalprotektín je cytoplazmatický proteín neutrofilných leukocytov, ktorého koncentrácia koreluje s migráciou neutrofilov do črevného lúmen. Fekálny kalprotektín je preto spoľahlivým markerom intestinálneho zápalu a má svoje miesto v diagnostike zápalových črevných ochorení. V posledných rokoch sa hromadia poznatky o jeho potenciálnom využití pri monitorovaní aktivity zápalových črevných ochorení, pri sledovaní odpovede na liečbu, ako aj pri predikcii relapsu ochorenia. Rutinnému používaniu kalprotektínu v týchto indikáciách však nateraz bráni chýbajúci konsenzus v otázkach hodnôt cut‑off a intervalov jeho stanovovania.
Kľúčové slová:
fekálny kalprotektín – črevné zápalové ochorenia – ulcerózna kolitída – Crohnova choroba
Nešpecifické črevné zápalové ochorenia (inflammatory bowel diseases – IBD) sú chronické zápalové ochorenia gastrointestinálneho traktu s multifaktoriálnou etiopatogenézou. V celosvetovom meradle majú tieto ochorenia narastajúcu incidenciu a prevalenciu. Hlavnými nozologickými jednotkami IBD sú ulcerózna kolitída (UC) a Crohnova choroba (CD).
Kalprotektín (f - cal) je heterodimérický kalcium a zinok viažuci proteín zložený z podjednotiek S100A8 a S100A9 [1,2]. Prvýkrát bol izolovaný v roku 1980 z granulocytov, v ktorých tvorí 60 % cytoplazmatických proteínov [3]. Hladina f - cal v stolici koreluje s priemernou dennou fekálnou exkréciou granulocytov značených indiom111 [4]. Kalprotektín je preto spoľahlivým markerom intestinálneho zápalu, ktorého hladina nie je závislá od konkomitantného zápalového postihnutia organizmu [4,5].
F-cal bol donedávna považovaný za stabilný proteín umožňujúci stanovenie koncentrácie zo vzorky stolice aj po siedmich dňoch skladovania materiálu pri izbovej teplote [6]. Výsledky novších prác potvrdzujú nezmenenú hladinu f-cal po troch dňoch skladovania, avšak bol zaznamenaný signifikantný pokles jeho koncentrácie po siedmich dňoch skladovania [7].
V posledných rokoch sa venuje zvýšená pozornosť problematike intraindividuálnej variability hodnôt f-cal. Štúdia so 143 pacientmi s CD v klinickej remisii poukázala na nízku variabilitu hodnôt f - cal vo vzorkách odobraných v troch po sebe nasledujúcich dňoch, ICC 0,84 (95% CI: 0,79 – 0,89). Bola však pozorovaná zvýšená variabilita u pacientov s vyššími hodnotami f - cal [8]. Tieto výsledky sú v zhode so štúdiou s 63 pacientmi s mierne až stredne aktívnou CD. Vo vzorkách stolice odobraných v dvoch po sebe nasledujúcich dňoch bola pozorovaná zvýšená variabilita u pacientov s hodnotou f - cal nad 200 µg/ g [9].
Význam kalprotektínu v diagnostike IBD
F- cal je vhodným markerom na diskrimináciu zápalových a funkčných ochorení GIT. Podľa metaanalýzy prác zahŕňajúcich spolu 2 475 pacientov, publikovanej v roku 2009, bola priemerná špecifita f - cal pre odlíšenie zápalového a funkčného ochorenia 83 % a priemerná senzitivita 84 % [5].
V metaanalýze od von Roon et al z roku 2007 bol medián f - cal u pacientov s IBD 219,2 µg/ g a signifikantne sa líšil od mediánu kontrolnej skupiny (p < 0,001), ktorou boli pacienti s IBD a zdravé osoby. Senzitivita a špecificita f - cal pre diagnostiku IBD bola 95 %, resp. 91 % [10]. Rovnakú problematiku skúmala aj vyššie uvedená metaanalýza, podľa ktorej je senzitivita diagnostiky IBD stanovením f - cal 80 % pri 76 % špecificite [5]. Rozdiely vo výsledkoch týchto prác možno pripísať nehomogenite štúdií zahrnutých v týchto metaanalýzach [11]. Obe zo spomenutých prác uvádzajú vyššiu presnosť pre určenie diagnózy CD ako UC. V aktuálnejšej z uvedených metaanalýz bola senzitivita a špecificita pre CD 83 % a 85 %, pre UC to bolo 72 % a 74 % [5]. Dôvodom tejto diskrepancie sú pravdepodobne vyššie hladiny f-cal u pacientov s CD [12]. Vzhľadom na veľký rozptyl hodnôt f - cal u oboch nozologických jednotiek však nemožno len na základe vyšetrenia f - cal odlíšiť CD od UC [10]. V zhode s týmito nálezmi sú výsledky metaanalýzy z roku 2010, ktorá uvádza 93% senzitivitu a 96% špecificitu pre diagnózu IBD. Špecificita f-cal v skupine dospelých pacientov bola signifikantne vyššia než u detí a adolescentov, u ktorých dosiahla 76 % (p = 0,048), pri porovnateľnej senzitivite (92 %) [13]. Diskrepantný výsledok v pediatrickej populácii potvrdila metaanalýza od Henderson et al z roku 2013, ktorá uvádza 98% senzitivitu a 68% špecificitu pre diagnostiku IBD [14].
Výsledkom metaanalýzy od Van Rheenen et al bolo tiež zistenie, že skríning IBD za použitia f - cal by znamenal redukciu počtu kolonoskopií u dospelých o 67 % a o 35 % u detí a adolescentov. Na druhej strane by došlo k oneskoreniu diagnózy u 6 %, resp. 8 % pacientov [13].
F-cal sa preukázal ako presnejší marker pre stanovenie diagnózy IBD než CRP, sedimentácia erytrocytov a antiprotilátky ASCA, ANCA [5].
Nedoriešenou ostáva naďalej otázka diagnostického cut‑off. Bežne používanou hranicou pre pozitivitu f - cal je hodnota 50 µg/ g. Von Roon et al vo svojej metaanalýze navrhli pre diagnostiku IBD cut‑off na úrovni 100 µg/ g stolice [10]. Nedávno publikovaná belgická štúdia skúmala diagnostickú presnosť šiestich metód na stanovovanie kalprotektínu, pričom cut‑off jednotlivých metodík varíroval medzi 15 – 75 µg/ g. Špecificita metód sa pohybovala v rozmedzí 75 – 83 % a senzitivita medzi 68 – 95 %. Pozitívna prediktívna hodnota f-cal bola 63 – 90 % a negatívna prediktívna hodnota 86 – 89 %. Medián f - cal u pacientov s endoskopicky a histologicky verifikovanou diagnózou IBD bol v závislosti od použitej metódy 3–14krát vyšší než u osôb, u ktorých IBD nebolo diagnostikované [15]. Prehľad štúdií skúmajúcich význam fekálneho kalprotektínu v diagnostike IBD je v tab. 1 [12,16–26].
Tab. 1. Význam fekálneho kalprotektínu v diagnostike IBD. Tab. 1. The importance of fecal calprotectin in the diagnostics of IBD. 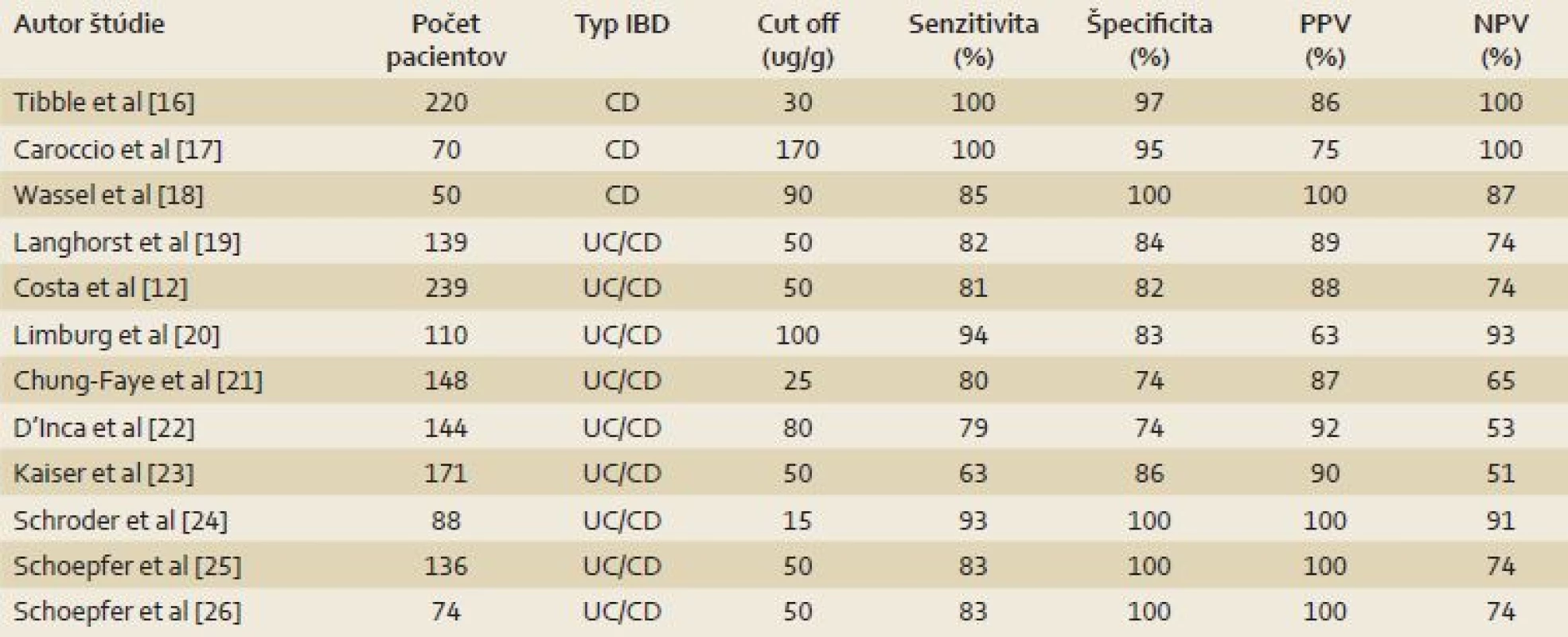
IBD – inflammatory bowel disease, NPV – negative predictive value, PPV – positive predictive value Význam kalprotektínu pre monitoring aktivity ochorenia
IBD sú chronické ochorenia, ktorých prirodzený priebeh charakterizuje striedanie období remisie a relapsov. Zlatým štandardom pre monitoring aktivity ochorenia je endoskopické vyšetrenie s histologizáciou vzoriek [27]. Bolo vyvinutých viacero endoskopických indexov aktivity IBD za účelom stratifikácie a komparácie endoskopického nálezu [11]. Štúdie skúmajúce koreláciu f - cal s endoskopickými indexmi pre CD sú v tab. 2 [22,28–35] a pre UC v tab. 3 [22,30,36–39].
Tab. 2. Korelácia fekálneho kalprotektínu s endoskopickým nálezom – CD. Tab. 2. Correlation of fecal calprotectin with endoscopic findings – CD. 
CD – Crohn‘s disease, SES-CD – simple endoscopic score for Crohn´s disease; CDEIS – Crohn´s disease Index of endoscopic severity Tab. 3. Korelácia fekálneho kalprotektínu s endoskopickým nálezom – UC. Tab. 3. Correlation of fecal calprotectin with endoscopic findings – UC. 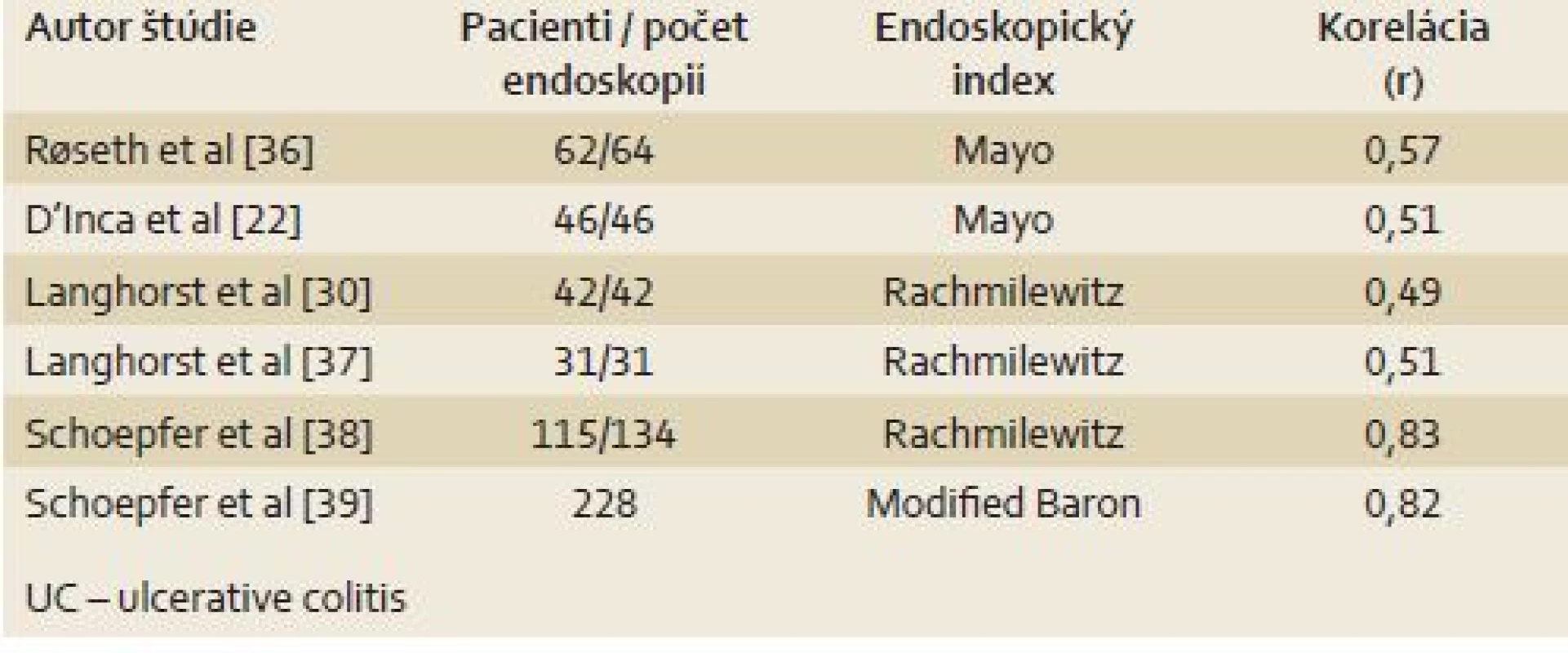
UC – ulcerative colitis Podľa výsledkov týchto štúdií f - cal dobre koreluje s endoskopickými indexmi, a teda jeho zvýšené hladiny svedčia pre endoskopicky aktívne ochorenie. Otvorenou zostáva otázka cut‑off pre aktívne ochorenie. V štúdii od Sipponen et al s cut‑off pre pozitívny f ‑ cal 200 µg/ g bola preukázaná 70% senzitivita a 92% špecificita pre detekciu endoskopicky aktívnej CD, definovanej ako CDEIS ≥ 3 [32]. V inej štúdii, s použitím indexu SES ‑ CD bola dokázaná schopnosť f ‑ cal detegovať endoskopicky aktívne ochorenie 87 % pri cut‑off 70 µg/ g [34]. V štúdiách s pacientmi s UC od Schoepfer et al bol použitý cut‑off 50 µg/ g [38,39]. Podľa výsledkov štúdie s 87 pacientmi s CD, f ‑ cal pri cut‑off 250 µg/ g informuje o prítomnosti veľkých ulcerácií so 71% senzitivitou a 100% špecificitou [40]. V nedávno publikovanej práci so 115 CD pacientmi bola potvrdená dobrá korelácia kalprotektínu s endoskopickým nálezom a hladina f ‑ cal pod cut‑off 274 µg/ g bola asociovaná s endoskopickou remisiou (AUC 0,935) [41].
V nedávnej štúdii porovnávajúcej šiestich metód na vyšetrovanie f-cal bola preukázaná vysoká špecificita (80 – 100 %) a senzitivita (80 %) kalprotektínu na detekciu stredne ťažkej až ťažkej Crohnovej choroby (podľa SES ‑ CD), s NPV v rozmedzí 71 – 100 % a PPV v rozmedzí 70 – 100 %. Použité boli cut‑off v rozmedzí 46,5 – 200 µg/ g. V prípade UC všetky testy preukázali 100% senzivitu a 57 – 86% špecificitu pre detekciu stredne ťažkého až ťažkého ochorenia. NPV a PPV boli 100 %, resp. 73 – 89 % pri použitých cut‑off v rozmedzí 31 – 200 µg/ g [15].
Bola preukázaná lepšia korelácia f ‑ cal s endoskopickým nálezom, než je tomu u klinických indexov aktivity a humorálnych markerov [11]. Stanovenie tohto parametra môže napomôcť pri odhaľovaní klinicky síce nemého, no histologicky a endoskopicky aktívneho ochorenia [42].
Význam kalprotektínu pre predikciu relapsu
Napriek klinickej remisii ochorenia u väčšiny pacientov pretrváva reziduálna zápalová aktivita, ktorá môže prispievať k riziku relapsu ochorenia [43,44]. F ‑ cal s vysokou senzitivitou a špecificitou pre intestinálny zápalový proces je potenciálne vhodným markerom pre predikciu relapsu IBD. Štúdie zaoberajúce sa touto problematikou sú uvedené v tab. 4 [42,44–52].
Tab. 4. Význam f-cal pre predikciu relapsu IBD [11]. Tab. 4. The importance of fecal calprotectin for the prediction of IBD relapse [11]. ![Význam f-cal pre predikciu relapsu IBD [11].
Tab. 4. The importance of fecal calprotectin for the prediction of IBD relapse [11].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/cfb3a694542022e00bd4999de28a63aa.jpg)
IBD – infalmmatory bowel disease, UC – ulcerózna kolitída, CD – Crohnova choroba Prvá štúdia popisujúca tento fenomén (43 CD a 37 UC pacientov) publikovaná v roku 2000 preukázala, že u pacientov v klinickej remisii ochorenia s vyššími hladinami f ‑ cal došlo vo vyššom percente k relapsu ochorenia. Elevácia f ‑ cal predpovedala relaps ochorenia s 90% senzitivitou a 83% špecificitou [45]. Podľa výsledkov inej prospektívnej štúdie (89 CD, 74 UC) pacienti, ktorí zrelabovali počas 12 mesiacov trvania štúdie, mali signifikantne vyššiu vstupnú hladinu f ‑ cal (p < 0,001). Pri použití cut‑off 150 µg/ g mali pacienti s pozitívnym f ‑ cal až štyrikrát vyššie riziko relapsu oproti pacientom s nižším f ‑ cal [46].
Iné práce poukazujú na zvýšené riziko relapsu pri pozitívnom f ‑ cal len v podskupine pacientov s UC [44], resp. u pacientov s kolonickou formou CD [47]. V štúdii s 53 pacientmi s kolonickou formou CD v klinickej remisii bol medián f ‑ cal signifikantne vyšší v skupine pacientov s relapsom ochorenia (381 vs 155 µg/ g; p < 0,001). Autori udávajú 80% senzitivitu a 91% špecificitu pre predikciu relapsu ochorenia pri cut‑off 350 µg/ g [50]. Podľa nedávnej štúdie s 97 pacientmi s CD v klinickej remisii bol medián f ‑ cal signifikantne vyšší u pacientov, u ktorých došlo k relapsu (414 vs 96 µg/ g; p=0,005). Pri cut‑off 240 µg/ g bola zistená 80% senzitivita a 74% špecificita predikcie relapsu CD, pričom negatívna prediktívna hodnota pri tomto cut‑off bola 96,8 %. Pri hodnotách f ‑ cal nad cut‑off bola zistená 12,8 ‑ násobne vyššia pravdepodobnosť relapsu počas 12 mesiacov (p = 0,002) [53]. V recentne publikovanej štúdii s 80 pacientmi s UC liečenými 5 ‑ ASA mali pacienti, u ktorých došlo počas trvania štúdie k relapsu ochorenia, signifikantne vyššie hladiny f ‑ cal (173,7 vs 135,5 µg/ g; p = 0,02). Pri cut‑off 170 µg/ g bola senzitivita a špecificita f ‑ cal pre predikciu relapsu zhodne 76 % [54].
V horeuvedených štúdiách bol f ‑ cal stanovený len na začiatku sledovania pacientov. Podľa výsledkov práce od Vos et al je výhodnejšie opakované meranie f ‑ cal počas liečby. V tejto prospektívnej štúdii zahŕňajúcej 77 dospelých pacientov v klinickej remisii na liečbe infliximabom bol f ‑ cal stanovovaný mesačne. U 15 % zo sledovaných pacientov došlo k relapsu, pričom u týchto pacientov boli zaznamenané vyššie hodnoty f ‑ cal už tri mesiace pred relapsom (477 vs 27 µg/ g). Autori ďalej uvádzajú, že hodnota f ‑ cal > 300 µg/ g v dvoch po sebe nasledujúcich meraniach predikuje relaps so 61,5% senzitivitou a 100% špecificitou [52].
Z uvedených štúdií vyplýva, že pri použití vhodného cut‑off je f ‑ cal spoľahlivým nástrojom na predikciu relapsu IBD. Úlohou budúcich štúdií bude určenie cut‑off pre jednotlivé formy IBD, resp. ich podskupiny definované Montrealskou klasifikáciou [55] a taktiež definovanie časových intervalov na stanovovanie f ‑ cal.
Význam kalprotektínu pre predikciu pooperačnej rekurencie
Napriek pokrokom vo farmakoterapii IBD, 50 – 60 % pacientov s CD podstúpi chirurgickú intervenciu v prvej dekáde od diagnózy ochorenia [56]. Navyše u signifikantnej časti pacientov dochádza po operácii k rekurencii ochorenia. Bolo preukázané, že 12 mesiacov po resekcii terminálneho ilea sú u 80 % pacientov prítomné endoskopické známky relapsu ochorenia [57]. Pacient po ileocekálnej resekcii by preto podľa súčasných odporúčaní mal podstúpiť kolonoskopické vyšetrenie 6 – 12 mesiacov po zákroku [27,58]. V posledných rokoch bolo publikovaných viacero prác skúmajúcich možnosť využitia kalprotektínu na monitoring pooperačného priebehu IBD a na predikciu pooperačného relapsu. V prospektívnej štúdii s 50 pacientmi s CD po ileocekálnej resekcii bolo zistené, že hladina f ‑ cal vyššia ako 200 µg/ g tri mesiace po operácii dokáže so 63% senzitivitou a 75% špecificitou predpovedať endoskopickú rekurenciu CD po 12 mesiacoch od operácie [59]. Podľa subanalýzy nedávnej štúdie POCER vyšetrenie f ‑ cal s cut‑off 100 µg/ g identifikuje pacientov s endoskopickými známkami pooperačnej rekurencie s 90% senzitivitou a 57 % špecificitou (PPV 52,0 %, NPV 91,0 %). Autori zároveň konštatujú, že stanovovanie f ‑ cal by mohlo nahradiť rutinné kolonoskopické vyšetrenie v pooperačnom monitoringu a zároveň pomôcť pri selekcii pacientov, u ktorých je kolonoskopické vyšetrenie potrebné [60,61].
Význam kalprotektínu pri sledovaní odpovede na terapiu
Odpoveď pacienta na liečbu možno hodnotiť na základe ústupu symptómov ochorenia, úpravy klinických skórovacích indexov, resp. poklesu laboratórnych zápalových parametrov. Tieto však majú relatívne nízku špecificitu pre intestinálny zápal [62]. V posledných rokoch sa za cieľ terapie IBD považuje zhojenie slizničných lézií, tzv. slizničné zhojenie (mucosal healing – MH) [63]. Vzťah medzi intenzitou črevného zápalu a hladinou kalprotektínu bol popísaný ešte v roku 2004 [64] a vzhľadom na dobrú koreláciu je f ‑ cal vhodným markerom na sledovanie odpovede na liečbu a dosiahnutia MH, čo potvrdzujú výsledky viacerých prác.
V prvej štúdii skúmajúcej túto problematiku bolo sledovaných 45 IBD pacientov (28 UC, 17 CD) v klinickej remisii a s normálnymi hodnotami f ‑ cal. U 84 % pacientov bol endoskopický nález negatívny, rovnako aj histologické vyšetrenie bolo bez známok infiltrácie zápalovými bunkami [65]. V štúdii s 38 IBD pacientmi (11 CD, 27 UC) liečenými konvenčnou liečbou bolo u 82 % pacientov (87 % UC pacientov, 91 % CD pacientov) po osmich týždňoch endoskopicky verifikované MH, čomu u všetkých týchto pacientov predchádzala normalizácia hladín f ‑ cal [66].Prospektívna štúdia s 15 pediatrickými IBD pacientmi liečenými glukokortikoidmi tiež preukázala pokles f ‑ cal počas liečby spolu so zlepšením klinického stavu pacientov [67].
Podobné sú aj výsledky štúdií s pacientmi liečenými biologickou liečbou. Jednou z prvých bola práca udávajúca pokles f ‑ cal u dvoch pacientov s IBD po začatí liečby infliximabom [68]. V štúdii od fínskych autorov bolo sledovaných 15 pacientov s CD liečených indukčnou anti‑TNF liečbou. U pacientov, ktorí odpovedali na liečbu, došlo k poklesu f ‑ cal, pričom medián f ‑ cal poklesol z 1 173 µg/ g na 130 µg/ g. Takmer u všetkých pacientov, u ktorých bolo endoskopicky verifikované MH (CDEIS ≤ 3), došlo k normalizácii hladín f ‑ cal, pričom medián f ‑ cal u tejto podskupiny klesol z 1 891 μg/ g na 27 μg/ g [33]. V roku 2010 bola publikovaná práca s 19 CD pacientmi, ktorí vyžadovali zintenzívnenie liečby. Pri opakovaných endoskopických vyšetreniach na začiatku štúdie a s odstupom 2 – 3 a 4 – 6 mesiacov preukázali výbornú koreláciu f ‑ cal s endoskopickými nálezmi. U pacientov so zlepšením endoskopického nálezu pozorovali pokles f ‑ cal, zatiaľčo u tých bez MH zotrvávali abnormálne hladiny f ‑ cal [69]. Výsledky týchto štúdií sú sľubné, avšak bude nutné ich overiť v štúdiách s väčším množstvom pacientov.
Záver
Kalprotektín predstavuje spoľahlivý neinvazívny marker slizničného zápalu a jeho stanovenie je dnes už rutinnou súčasťou v diagnostike IBD. Výsledky doposiaľ publikovaných prác dávajú nádej na rozšírenie jeho využitia aj pre monitoring aktivity ochorenia, sledovanie odpovede na terapiu a predikciu relapsu IBD. Úlohou budúcich štúdií bude stanovenie vhodných cut‑off hodnôt pre jednotlivé indikácie, ako aj intervalov vyšetrení, za účelom optimálneho využitia tohto markeru.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MU Dr. Juraj Letkovský
V. interná klinika LF UK a UN Bratislava
Ružinovská 6, 826 06 Bratislava
juraj.letkovsky@gmail.com
Zdroje
1. Fagerhol MK. Calprotectin, a faecal marker of organic gastrointestinal abnormality. Lancet 2000; 356(9244): 1783 – 1784.
2. Sidler MA, Leach ST, Day AS. Fecal S100A12 and fecal calprotectin as noninvasive markers for inflammatory bowel disease in children. Inflamm Bowel Dis 2008; 14(3): 359 – 366.
3. Fagerhol MK, Dale I, Anderson I. Release and quantitation of a leucocyte derived protein (L1). Scand J Haematol 1980; 24 : 393 – 398.
4. Røseth AG, Schmidt PN, Fagerhol MK. Correlation between faecal excretion of indium ‑ 111 ‑ labelled granulocytes and calprotectin, a granulocyte marker protein, in patients with inflammatory bowel disease. Scand J Gastroenterol 1999; 34(1): 50 – 54.
5. Gisbert JP, McNicholl AG. Questions and answers on the role of faecal calprotectin as a biological marker in inflammatory bowel disease. Dig Liver Dis 2009; 41(1): 56 – 66. doi: 10.1016/ j.dld.2008.05.008.
6. Røseth AG, Fagerhol MK, Aadland E et al.Assessment of the neutrophil dominating protein calprotectin in feces. A methodologic study. Scand J Gastroenterol 1992; 27(9): 793 – 798.
7. Lasson A, Stotzer PO, Öhman L et al. The intra ‑ individual variability of faecal calprotectin: a prospective study in patients with active ulcerative colitis. J Crohns Colitis 2015; 9(1): 26 – 32. doi: 10.1016/ j.crohns.2014.06.002.
8. Naismith GD, Smith LA, Barry SJ et al. A prospective single‑centre evaluation of the intra ‑ individual variability of faecal calprotectin in quiescent Crohn‘s disease. Aliment Pharmacol Ther 2013; 37(6): 613 – 621. doi: 10.1111/ apt.12221.
9. Moum B, Jahnsen J, Bernklev T. Fecal calprotectin variability in Crohn’s disease.Inflamm Bowel Dis 2010; 16(7): 1091 – 1092. doi: 10.1002/ ibd.21136.
10. Von Roon AC, Karamountzos L, Purkayastha S et al. Diagnostic precision of fecal calprotectin for inflammatory bowel disease and colorectal malignancy. Am J Gastroenterol 2007; 102(4): 803 – 813.
11. Burri E, Beglinger C. The use of fecal calprotectin as a biomarker in gastrointestinal disease. Expert Rev Gastroenterol Hepatol 2014; 8(2): 197 – 210. doi: 10.1586/ 17474124.2014.869476.
12. Costa F, Mumolo MG, Bellini M et al. Role of faecal calprotectin as non‑invasive marker of intestinal inflammation. Dig Liver Dis 2003; 35(9): 642 – 647.
13. Van Rheenen PF, van de Vijver E et al.Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta‑analysis. BMJ 2010; 341: c3369. doi: 10.1136/ bmj.c3369.
14. Henderson P, Anderson NH, Wilson DC. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease: a systematic review and meta‑analysis. Am J Gastroenterol 2014; 109(5): 637 – 645. doi: 10.1038/ ajg.2013.131.
15. Labaere D, Smismans A, Van Olmen Aet al. Comparison of six different calprotectin assays for the assessment of inflammatory bowel disease. United European Gastroenterol J 2014; 2(1): 30 – 37. doi: 10.1177/ 2050640613518201.
16. Tibble J, Teahon K, Thjodleifsson B et al.A simple method for assessing intestinal inflammation in Crohn’s disease. Gut 2000; 47(4): 506 – 513.
17. Carroccio A, Iacono G, Cottone M et al. Diagnostic accuracy of fecal calprotectin assay in distinguishing organic causes of chronic diarrhea from irritable bowel syndrome: a prospective study in adults and children. Clin Chem 2003; 49(6 Pt 1): 861 – 867.
18. Wassell J, Dolwani S, Metzner M et al. Faecal calprotectin: a new marker for Crohn’s disease? Ann Clin Biochem 2004; 41(Pt 3): 230 – 232.
19. Langhorst J, Elsenbruch S, Koelzer Jet al. Noninvasive markers in the assessment of intestinal inflammation in inflammatory bowel diseases: performance of fecal lactoferrin, calprotectin, and PMN ‑ elastase, CRP, and clinical indices. Am J Gastroenterol 2008; 103(1): 162 – 169.
20. Limburg PJ, Ahlquist DA, Sandborn WJ et al. Fecal calprotectin levels predict colorectal inflammation among patients with chronic diarrhea referred for colonoscopy. Am J Gastroenterol 2000; 95(10): 2831 – 2837.
21. Chung ‑ Faye G, Hayee B, Maestranzi S et al. Fecal M2 ‑ pyruvate kinase (M2 ‑ PK): a novel marker of intestinal inflammation. Inflamm Bowel Dis 2007; 13(11): 1374 – 1378.
22. D’Inca R, Dal Pont E, Di Leo V et al. Calprotectin and lactoferrin in the assessment of intestinal inflammation and organic disease. Int J Colorectal Dis 2007; 22(4): 429 – 437.
23. Kaiser T, Langhorst J, Wittkowski H et al. Faecal S100A12 as a non‑invasive marker distinguishing inflammatory bowel disease from irritable bowel syndrome. Gut 2007; 56(12): 1706 – 1713.
24. Schröder O, Naumann M, Shastri Y et al. Prospective evaluation of faecal neutrophil ‑ derived proteins in identifying intestinal inflammation: combination of parameters does not improve diagnostic accuracy of calprotectin. Aliment Pharmacol Ther 2007; 26(7): 1035 – 1042.
25. Schoepfer AM, Trummler M, Seeholzer Pet al. Discriminating IBD from IBS: comparison of the test performance of fecal markers, blood leukocytes, CRP, and IBD antibodies. Inflamm Bowel Dis 2008; 14(1): 32 – 39.
26. Schoepfer AM, Trummler M, Seeholzer Pet al. Accuracy of four fecal assays in the diagnosis of colitis. Dis Colon Rectum 2007; 50(10): 1697 – 1706.
27. Van Assche G, Dignass A, Panes J et al. The second European evidence‑based Consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis. J Crohns Colitis 2010; 4(1): 7 – 27. doi: 10.1016/ j.crohns.2009.12.003.
28. Sipponen T, Kärkkäinen P, Savilahti E et al. Correlation of faecal calprotectin and lactoferrin with an endoscopic score for Crohn’s disease and histological findings. Aliment Pharmacol Ther 2008; 28(10): 1221 – 1229. doi: 10.1111/ j.1365 ‑ 2036.2008.03835.x.
29. Jones J, Loftus EV Jr, Panaccione R et al. Relationships between disease activity and serum and fecal biomarkers in patients with Crohn’s disease. Clin Gastroenterol Hepatol 2008; 6(11): 1218 – 1224. doi: 10.1016/ j.cgh.2008.06.010.
30. Langhorst J, Elsenbruch S, Koelzer J et al. Noninvasive markers in the assessment of intestinal inflammation in inflammatory bowel diseases: performance of fecal lactoferrin, calprotectin, and PMN ‑ elastase, CRP, and clinical indices. Am J Gastroenterol 2008; 103(1): 162 – 169.
31. Aomatsu T, Yoden A, Matsumoto K et al. Fecal calprotectin is a useful marker for disease activity in pediatric patients with inflammatory bowel disease. Dig Dis Sci 2011; 56(8): 2372 – 2377. doi: 10.1007/ s10620 ‑ 011 ‑ 1633 ‑ y.
32. Sipponen T, Savilahti E, Kolho KL et al. Crohn’s disease activity assessed by fecal calprotectin and lactoferrin: correlation with Crohn’s disease activity index and endoscopic findings. Inflamm Bowel Dis 2008; 14(1): 40 – 46.
33. Sipponen T, Savilahti E, Kärkkäinen P et al. Fecal calprotectin, lactoferrin, and endoscopic disease activity in monitoring anti‑TNF‑alpha therapy for Crohn’s disease. Inflamm Bowel Dis 2008; 14(10): 1392 – 1398. doi: 10.1002/ ibd.20490.
34. Schoepfer AM, Beglinger C, Straumann A et al. Fecal calprotectin correlates more closely with the Simple Endoscopic Score for Crohn’s disease (SES ‑ CD) than CRP, blood leukocytes, and the CDAI. Am J Gastroenterol 2010; 105(1): 162 – 169. doi: 10.1038/ ajg.2009.545.
35. Denis MA, Reenaers C, Fontaine F et al. Assessment of endoscopic activity index and biological inflammatory markers in clinically active Crohn’s disease with normal C ‑ reactive protein serum level. Inflamm Bowel Dis 2007; 13(9): 1100 – 1105.
36. Roseth AG, Aadland E, Jahnsen J et al. Assessment of disease activity in ulcerative colitis by faecal calprotectin, a novel granulocyte marker protein. Digestion 1997; 58(2): 176 – 180.
37. Langhorst J, Elsenbruch S, Mueller T et al. Comparison of 4 neutrophil ‑ derived proteins in feces as indicators of disease activity in ulcerative colitis. Inflamm Bowel Dis 2005; 11(12): 1085 – 1091.
38. Schoepfer AM, Beglinger C, Straumann A et al. Ulcerative colitis: correlation of the Rachmilewitz endoscopic activity index with fecal calprotectin, clinical activity, C ‑ reactive protein, and blood leukocytes. Inflamm Bowel Dis 2009; 15(12): 1851 – 1858. doi: 10.1002/ ibd.20986.
39. Schoepfer AM, Beglinger C, Straumann A et al. Fecal calprotectin more accurately reflects endoscopic activity of ulcerative colitis than the Lichtiger Index, C ‑ reactive protein, platelets, hemoglobin, and blood leukocytes. Inflamm Bowel Dis 2013; 19(2): 332 – 341. doi: 10.1097/ MIB.0b013e3182810066.
40. D’Haens G, Ferrante M, Vermeire S et al. Fecal calprotectin is a surrogate marker for endoscopic lesions in inflammatory bowel disease. Inflamm Bowel Dis 2012; 18(12): 2218 – 2224. doi: 10.1002/ ibd.22917.
41. Lobatón T, López ‑ García A, Rodríguez ‑ Moranta F et al. A new rapid test for fecal calprotectin predicts endoscopic remission and postoperative recurrence in Crohn’s disease. J Crohns Colitis 2013; 7(12): e641 – e651. doi: 10.1016/ j.crohns.2013.05.005.
42. Sipponen T, Kolho KL. Faecal calprotectin in children with clinically quiescent inflammatory bowel disease. Scand J Gastroenterol 2010; 45(7 – 8): 872 – 877. doi: 10.3109/ 00365521003782389.
43. Saverymuttu SH. Clinical remission in Crohn’s disease – assessment using faecal 111In granulocyte excretion. Digestion 1986; 33(2): 74 – 79.
44. Costa F, Mumolo MG, Ceccarelli L et al. Calprotectin is a stronger predictive marker of relapse in ulcerative colitis than in Crohn‘s disease. Gut 2005; 54(3): 364 – 368.
45. Tibble JA, Sigthorsson G, Bridger S et al. Surrogate markers of intestinal inflammation are predictive of relapse in patients with inflammatory bowel disease. Gastroenterology 2000; 119(1): 15 – 22.
46. Gisbert JP, Bermejo F, Pérez ‑ Calle JL et al. Fecal calprotectin and lactoferrin for the prediction of inflammatory bowel disease relapse. Inflamm Bowel Dis 2009; 15(8): 1190 – 1198. doi: 10.1002/ ibd.20933.
47. D’Inca R, Dal Pont E, Di Leo V et al. Can calprotectin predict relapse risk in inflammatory bowel disease? Am J Gastroenterol 2008; 103(8): 2007 – 2014.
48. Diamanti A, Colistro F, Basso MS et al. Clinical role of calprotectin assay in determining histological relapses in children affected by inflammatory bowel diseases. Inflamm Bowel Dis 2008; 14(9): 1229 – 1235. doi: 10.1002/ ibd.20472.
49. Walkiewicz D, Werlin SL, Fish D et al. Fecal calprotectin is useful in predicting disease relapse in pediatric inflammatory bowel disease. Inflamm Bowel Dis 2008; 14(5): 669 – 673. doi: 10.1002/ ibd.20376.
50. Kallel L, Ayadi I, Matri S et al. Fecal calprotectin is a predictive marker of relapse in Crohn’s disease involving the colon: a prospective study. Eur J Gastroenterol Hepatol 2010; 22(3): 340 – 345. doi: 10.1097/ MEG.0b013e32832bab49.
51. García ‑ Sánchez V, Iglesias ‑ Flores E, González R et al. Does fecal calprotectin predict relapse in patients with Crohn’s disease and ulcerative colitis? J Crohns Colitis 2010; 4(2): 144 – 152. doi: 10.1016/ j.crohns.2009.09.008.
52. De Vos M, Louis EJ, Jahnsen J et al. Consecutive fecal calprotectin measurements to predict relapse in patients with ulcerative colitis receiving infliximab maintenance therapy. Inflamm Bowel Dis 2013; 19(10): 2111 – 2117. doi: 10.1097/ MIB.0b013e31829b2a37.
53. Naismith GD, Smith LA, Barry SJ et al. A prospective evaluation of the predictive value of faecal calprotectin in quiescent Crohn‘s disease. J Crohns Colitis 2014; 8(9): 1022 – 1029. doi: 10.1016/ j.crohns.2014.01.029.
54. Yamamoto T, Shiraki M, Bamba T et al. Fecal calprotectin and lactoferrin as predictors of relapse in patients with quiescent ulcerative colitis during maintenance therapy. Int J Colorect Dis 2014; 29(4): 485 – 491. doi: 10.1007/ s00384 ‑ 013 ‑ 1817 ‑ 3.
55. Satsangi J, Silverberg MS, Vermeire S et al. The Montreal classification of inflammatory bowel disease: controversies, consensus, and implications. Gut 2006; 55(6): 749 – 753.
56. Domènech E, Mañosa M, Lobatón T et al. Optimizing post‑operative Crohn’s disease treatment. Ann Gastroenterol 2014; 27(4): 313 – 319.
57. Rutgeerts P, Vermeire S, Van Assche G.Mucosal healing in inflammatory bowel disease: impossible ideal or therapeutic target? Gut 2007; 56(4): 453 – 455.
58. Van Assche G, Dignass A, Reinisch W et al. The second European evidence‑based Consensus on the diagnosis and management of Crohn’s disease: special situations. J Crohns Colitis 2010; 4(1): 63 – 101. doi: 10.1016/ j.crohns.2009.09.009.
59. Orlando A, Modesto I, Castiglione F et al. The role of calprotectin in predicting endoscopic post‑surgical recurrence in asymptomatic Crohn’s disease: a comparison with ultrasound. Eur Rev Med Pharmacol Sci 2006; 10(1): 17 – 22.
60. Wright EK, De Cruz PP, Kamm MA et al. Faecal calprotectin helps determine the need for post‑operative colonoscopy in crohn’s disease. Prospective longitudinal endoscopic validation. Results from the POCER study. J Gastroenterol Hepatol 2013; 28 (Suppl 2): 106.
61. Wright EK, De Cruz P, Gearry R et al. Fecal biomarkers in the diagnosis and monitoring of Crohn‘s disease. Inflamm Bowel Dis 2014; 20(9): 1668 – 1677. doi: 10.1097/ MIB.0000000000000087.
62. Montalto M, Gallo A, Santoro L et al. Role of fecal calprotectin in gastrointestinal disorders. Eur Rev Med Pharmacol Sci 2013; 17(12): 1569 – 1582.
63. Arnott ID, Watts D, Ghosh S. Review article: is clinical remission the optimum therapeutic goal in the treatment of Crohn’s disease? Aliment Pharmacol Ther 2002; 16(5): 857 – 867.
64. Hanai H, Takeuchi K, Iida T et al. Relationship between fecal calprotectin, intestinal inflammation, and peripheral blood neutrophils in patients with active ulcerative colitis. Dig Dis Sci 2004; 49(9): 1438 – 1443.
65. Roseth AG, Aadland E, Grzyb K. Normalization of faecal calprotectin: a predictor of mucosal healing in patients with inflammatory bowel disease. Scand J Gastroenterol 2004; 39(10): 1017 – 1020.
66. Wagner M, Peterson CG, Ridefelt P et al. Fecal markers of inflammation used as surrogate markers for treatment outcome in relapsing inflammatory bowel disease. World J Gastroenterol 2008; 14(36): 5584 – 5589.
67. Kolho KL, Raivio T, Lindahl H et al. Fecal calprotectin remains high during glucocorticoid therapy in children with inflammatory bowel disease. Scand J Gastroenterol 2006; 41(6): 720 – 725.
68. Aadland E, Fagerhol MK. Faecal calprotectin: a marker of inflammation throughout the intestinal tract. Eur J Gastroenterol Hepatol 2002; 14(8): 823 – 825.
69. Sipponen T, Björkesten CG, Färkkilä M et al. Faecal calprotectin and lactoferrin are reliable surrogate markers of endoscopic response during Crohn‘s disease treatment. Scand J Gastroenterol 2010; 45(3): 325 – 331. doi: 10.3109/ 00365520903483650.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Novinky v roce 2015Článek Biologická léčba nemá vliv na výsledky endoskopické balónkové dilatace u pacientů s Crohnovou nemocíČlánek Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcíČlánek Správná odpověď na kvízČlánek Exviera, ViekiraxČlánek Výzva ke spolupráciČlánek Autodidaktický test: IBD
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2015 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Řešení sideropenní anémie u nemocných s ulcerózní kolitidou může být někdy velkým problémem
- Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 1. část: předoperační příprava
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
- Vedolizumab v léčbě ulcerózní kolitidy
- Biologická léčba nemá vliv na výsledky endoskopické balónkové dilatace u pacientů s Crohnovou nemocí
- Topická léčba idiopatických střevních zánětů
- Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochorení
- Imunoablační léčba a autologní transplantace hematopoetických kmenových buněk u pacienta s agresivní formou Crohnovy nemoci refrakterní na medikamentózní terapii
- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí
- Novinky v roce 2015
- Syndróm bakteriálneho prerastania
- Správná odpověď na kvíz
- Exviera, Viekirax
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Preparáty firmy Nutricia v enterální výživě u dětí
- Noví členové redakční rady časopisu
- Výzva ke spolupráci
- VIII. beskydský endoskopický workshop
- Nejen anti-TNF živ je IBD pacient
- Autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Syndróm bakteriálneho prerastania
- Topická léčba idiopatických střevních zánětů
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



