-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí
Short-term results of the treatment of superficial neoplastic lesions of the stomach using endoscopic submucosal dissection
The paper presents a prospectively evaluated group of 25 patients treated by gastric endoscopic submucosal dissection (G-ESD). The aim of the study was to evaluate short-term treatment results.
Methods:
All patients treated by G-ESD during the study period 11/2011–10/2014 were included in the study. Lesions were indicated for G-ESD according to expanded criteria. En bloc resection, R0 resection, curative resection and complications were considered as indicators of short-term treatment results.Results:
A total of 20 (80%) of lesions were neoplastic according to the final histological evaluation. Among them, en bloc, R0 and curative resection could be achieved in 17 (85%), 17 (85%) and 16 (80%) respectively. Perforation was observed in two (8%) of all cases and had to be treated surgically in one (4%) case. The 30-day mortality was 0.Conclusions:
The paper presents the treatment results of a series of the first group of G-ESD patients from a Czech gastroenterology center. Our results are similar to those reported from Eastern-Asia centers. Nevertheless, the validity of the results is limited by a selection bias.Key words:
gastric cancer – endsocopic submucosal dissection – R0 resection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
24. 12. 2014Accepted:
27. 1. 2015
Autoři: O. Urban 1,2; P. Fojtík 1; Přemysl Falt 1,2
; M. Kliment 1,2; O. Mikolájek 1; M. Mazur 1; A. Foltýs 1; P. Holéczy 1,2; R. Andělová 3; M. Baník 3; I. Kasperčík 3; P. Barabáš 4; J. Richter 4
Působiště autorů: Vzdělávací a výzkumný institut AGEL, o. p. s., pobočka Ostrava-Vítkovice, Vítkovická nemocnice a. s., Centrum péče o zažívací trakt 1; LF OU v Ostravě 2; Patologie, Laboratoře AGEL a. s., Nový Jičín 3; Komplexní onkologické centrum, Nový Jičín 4
Vyšlo v časopise: Gastroent Hepatol 2015; 69(1): 65-69
Kategorie: Digestivní endoskopie: původní práce
doi: https://doi.org/10.14735/amgh201565Souhrn
Prezentujeme prospektivně sledovaný soubor 25 nemocných s žaludeční lézí léčených endoskopickou submukózní disekcí (G ‑ ESD). Cílem studie je posoudit krátkodobé výsledky léčby.
Metody:
Do studie byli zařazeni všichni nemocní, u kterých byla provedena G ‑ ESD v období 11/ 2011 – 10/ 2014. Léze byly indikovány podle rozšířených (expanded) kritérií. Za ukazatele krátkodobých výsledků léčby jsme považovali en bloc resekci, R0 resekci, kurativní resekci a výskyt komplikací.Výsledky:
Definitivní histologické vyšetření diagnostikovalo neoplazii ve 20 (80 %) případech. Z nich bylo en bloc, R0 a kurativní resekce dosaženo u 17 (85 %), 17 (85 %) a 16 (80 %). Perforace se vyskytla u dvou (8 %) nemocných, u jednoho (4 %) z nich byla řešena chirurgicky. Třicetidenní mortalita byla nulová.Závěry:
Prezentujeme první soubor G ‑ ESD v České republice. Dosáhli jsme krátkodobých výsledků léčby srovnatelných s daty z východoasijských center. Limitací výsledků je výběrový charakter souboru.Klíčová slova:
adenokarcinom žaludku – endoskopická submukózní disekce – R0 resekce
Adenokarcinom žaludku je celosvětově čtvrtým nejčastějším zhoubným nádorem. Je příčinou 10 % nádorových úmrtí. Nejvyšší incidence onemocnění je hlášena z Koreje, kde v roce 2012 dosáhla hodnoty 41,8 % [1]. V České republice byly v roce 2010 incidence a mortalita u mužů 18,5 %, resp. 14,5 % a u žen 11,8 %, resp. 9,3 % [2].
Jedinou nadějí na vyléčení je resekce nádoru, která je v Evropě a USA nejčastěji provedena chirurgicky. Ačkoli je standardní resekce žaludku nejradikálnějším způsobem lokoregionální léčby, je spojena se závažnými komplikacemi a sníženou kvalitou života [3]. V Japonsku a Koreji se proto standardem léčby povrchových stadií onemocnění staly endoskopická slizniční resekce (EMR) a endoskopická submukózní disekce (ESD), které ve srovnání s chirurgickou léčbou poskytují stejné dlouhodobé přežívání při nižším výskytu komplikací a vyšší kvalitě života [4].
ESD je technicky náročná metoda. V západních zemích s nízkou incidencí adenokarcinomu žaludku je dosud prováděna sporadicky v několika centrech. Rovněž publikace na téma žaludeční ESD (G ‑ ESD) v západních zemích jsou nečetné.
Cílem naší studie je popsat krátkodobé výsledky 25 prospektivně sledovaných G ‑ ESD provedených v moravském gastroenterologickém centru.
Soubor nemocných a metoda
Prezentujeme prospektivně sledovaný soubor nemocných léčených v Centru péče o zažívací trakt Vítkovické nemocnice v Ostravě v období 11/ 2011 – 10/ 2014. Do souboru jsme zařadili všechny nemocné, kteří v uvedeném období podstoupili G ‑ ESD.
Ke G ‑ ESD jsme indikovali dysplazii nebo karcinom v případech, které endoskopista považoval za technicky zvládnutelné.
Karcinomy jsme ke G ‑ ESD indikovali podle tzv. rozšířených kritérií (expanded criteria) podle Japonské společnosti pro karcinom žaludku (JGCA): 1. dobře diferencovaný intramukózní adenokarcinom bez ulcerace jakékoli velikosti; 2. dobře diferencovaný exulcerovaný intramukózní adenokarcinom menší 30 mm; 3. dobře diferencovaný sm1 invadující adenokarcinom menší 30 mm a 4. nízce diferencovaný intramukózní karcinom menší 20 mm [5,6].
U všech nemocných bylo provedeno endosonografické (EUS) vyšetření, nejčastěji s použitím vysokofrekvenční minisondy s pracovními frekvencemi 20 MHz nebo 30 MHz.
Za ukazatele krátkodobých výsledků léčby G ‑ ESD jsme považovali en bloc resekci, R0 resekci, kurativní resekci a výskyt komplikací. Za en bloc jsme označili resekci neoplazie včetně koagulačních značek v jednom bloku bez fragmentace – posuzoval endoskopista. Za R0 jsme považovali en bloc resekci negativní na přítomnost nádorové tkáně ve vertikální a horizontální resekční linii při histologickém vyšetření – posuzoval patolog. V případě, kdy okraj nemohl být histologicky zhodnocen, jsme resekci označili jako Rx. V případě histologicky pozitivního resekčního okraje se jednalo o resekci R1. Za kurativní jsme považovali R0 resekci bez přítomnosti histologických známek nepříznivé prognózy, tj. lymfovaskulární invaze nebo submukózní nádorové invaze > 500 µm.
U nemocných s nekurativní resekcí jsme indikovali chirurgickou léčbu, bylo‑li operační riziko přijatelné a nemocný s operací souhlasil.
Před výkonem podepsal každý nemocný informovaný souhlas, jehož součástí bylo uvedení chirurgické léčby jako alternativy ESD. V případech histologicky ověřeného karcinomu jsme léčebný postup konzultovali na mezioborovém onkologickém semináři. Studie proběhla v souladu s etickými principy Helsinské deklarace a v souladu se zásadami správné klinické praxe.
Všechny výkony provedl jeden endoskopista (prim. Ondřej Urban) s předchozí praxí asi 20 G ‑ ESD. Ve studijním období prováděl kromě G ‑ ESD rovněž ESD v jiných lokalizacích s frekvencí 25 výkonů ročně. G ‑ ESD jsme prováděli v analgosedaci nebo v celkové anestezii. Demarkační linii jsme diagnostikovali chromoendoskopií s 0,2% indigokarminem nebo virtuální chromoendoskopií s využitím narrow ‑ band imaging (NBI) módu. Obvod léze jsme označili koagulačními značkami ve vzdálenosti 2 mm od demarkační linie. K submukózní injekci jsme použili hyperosmolární roztok nebo fyziologický roztok, vždy s příměsí adrenalinu 100 000 : 1 a několika kapek metylenové modři. Cirkulární incize a submukózní disekce byly nejčastěji provedeny nástrojem IT ‑ knife 2, dále IT ‑ knife, IT ‑ knife nano, Dual ‑ knife (všechny Olympus) a Flush ‑ knife (Fujifilm). K cirkulární incizi a submukózní disekci byl použit proud Endocut (ERBE, 80/ 60 W). Krvácení ze submukózních cév bylo ošetřeno koagulací nástrojem pro disekci nebo koagulačními kleštěmi (coagrasper) s použitím koagulačního proudu.
Resekované léze byly vybaveny, rozepjaty a fixovány na korkové podložce. En bloc resekce byla potvrzena identifikací koagulačních značek. Léze byla změřena posuvným měřítkem a vyfotografována (obr. 1 – 5). Preparát byl fixován ve formalinu. Histologické vyšetření bylo provedeno týmem patologů se zkušeností s hodnocením více než 1 000 EMR a několika desítek ESD.
Obr. 1. Povrchová neoplastická léze typu 0–IIa+IIc velikosti 66 × 40 mm v antru žaludku. Fig. 1. Superficial neoplastic lesion, type 0–IIa+IIc, size 66 × 40 mm, location gastric antrum. 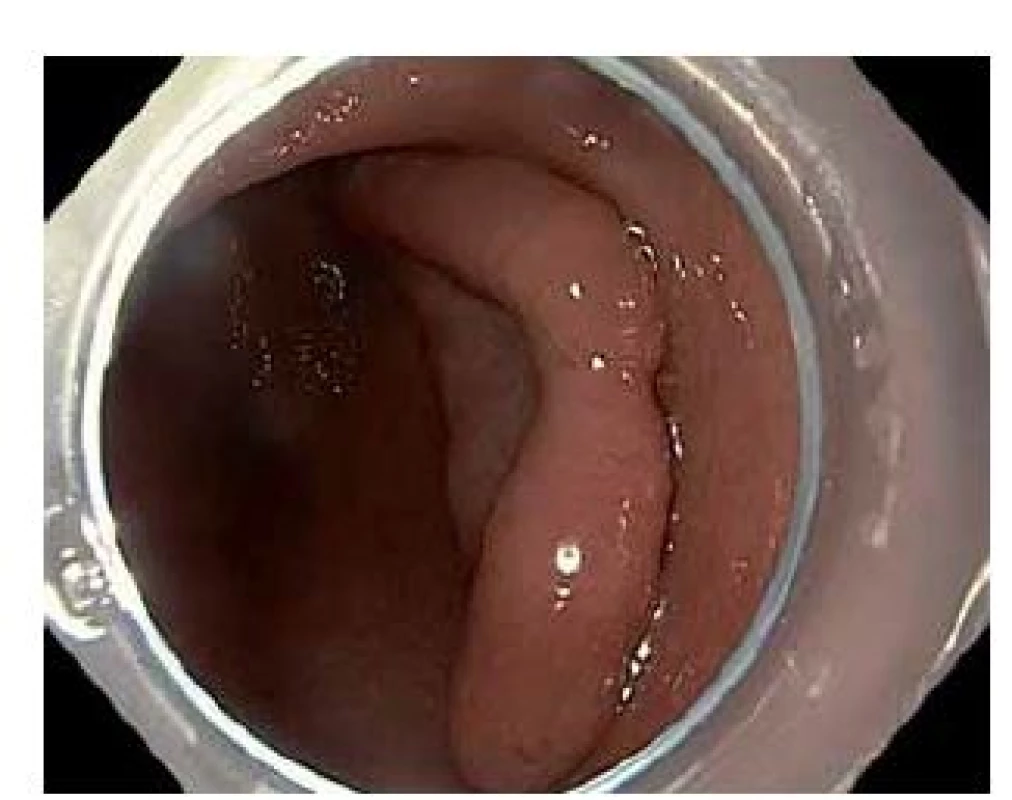
Obr. 2. Cirkulární incize nástrojem IT-knife2. Fig. 2. Circumferential incision made using IT-knife 2. 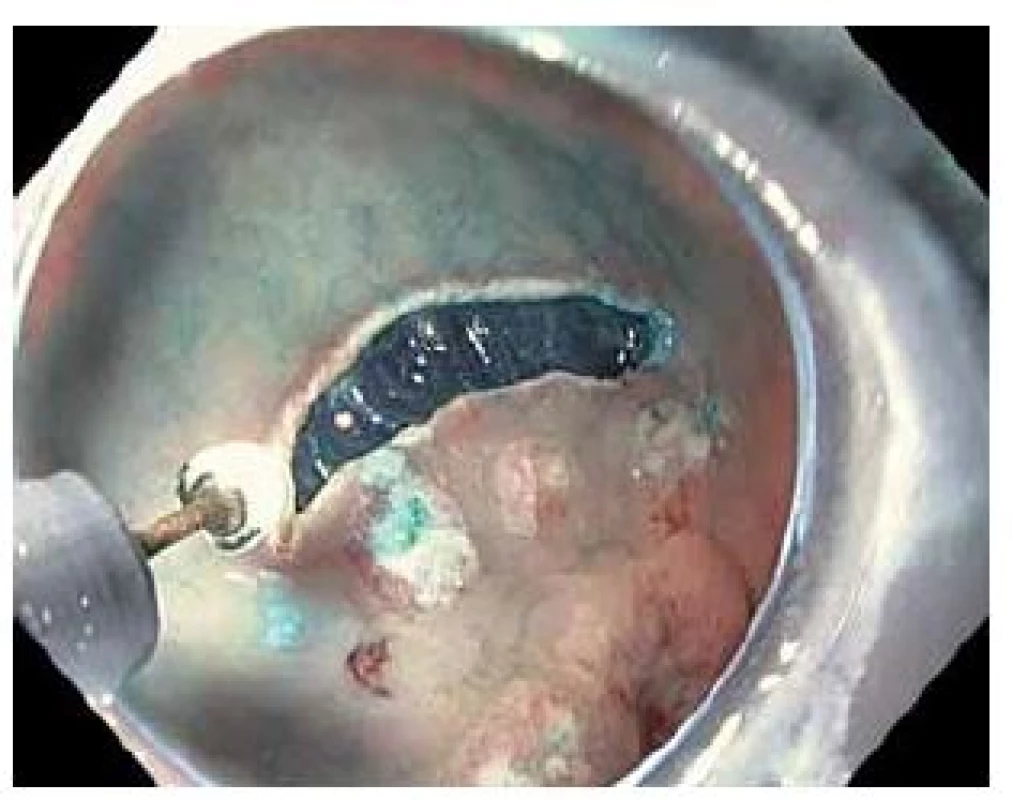
Obr. 3. Submukózní disekce. Submukóza zbarvena metylenovou modří. Fig. 3. Submucosal dissection. Submucosal layer stained by methylen blue. 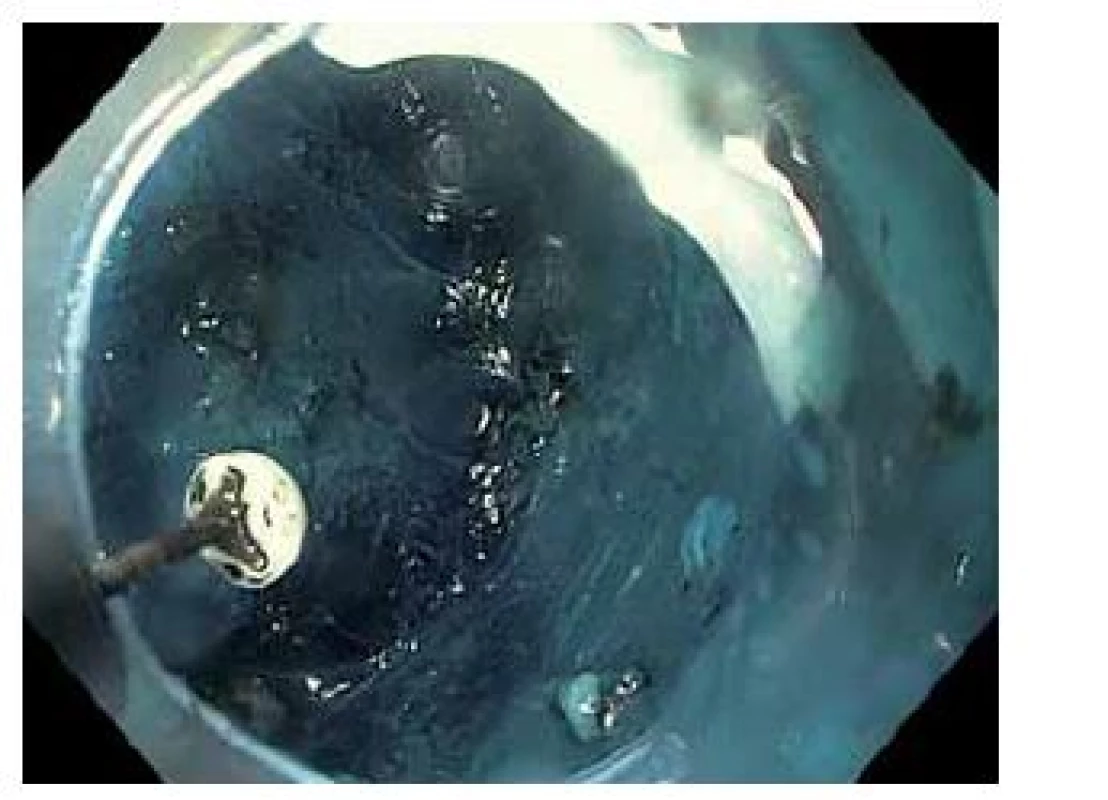
Obr. 4. Spodina po endoskopické submukózní disekci. Fig. 4 Arteficial ulcer after endoscopic submucosal dissection. 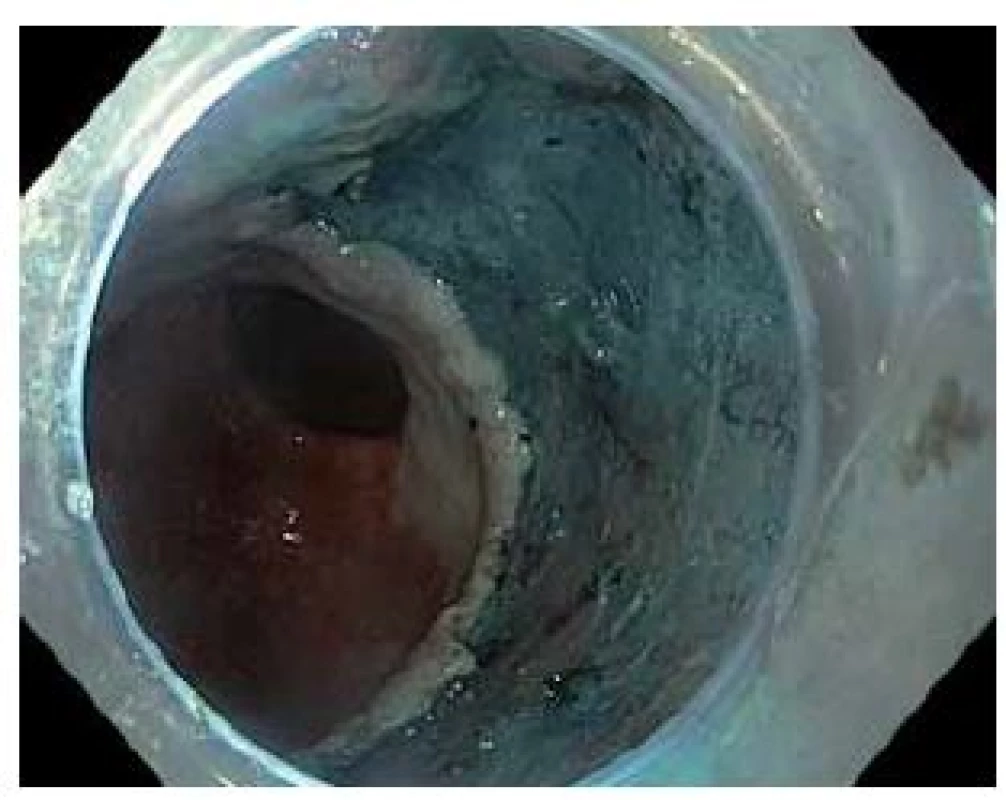
Obr. 5. Resekát rozměrů 75 × 40 mm fixován na korkové podložce (histologicky tubulovilózní adenom s ložisky intramukózního karcinomu, kurativní resekce). Fig. 5. Resected specimen, size 75 × 40 mm, stretched on a corc plate ( histology reveals tubulo-villous adenoma with multiple foci of intramucosal carcinoma, curative resection). 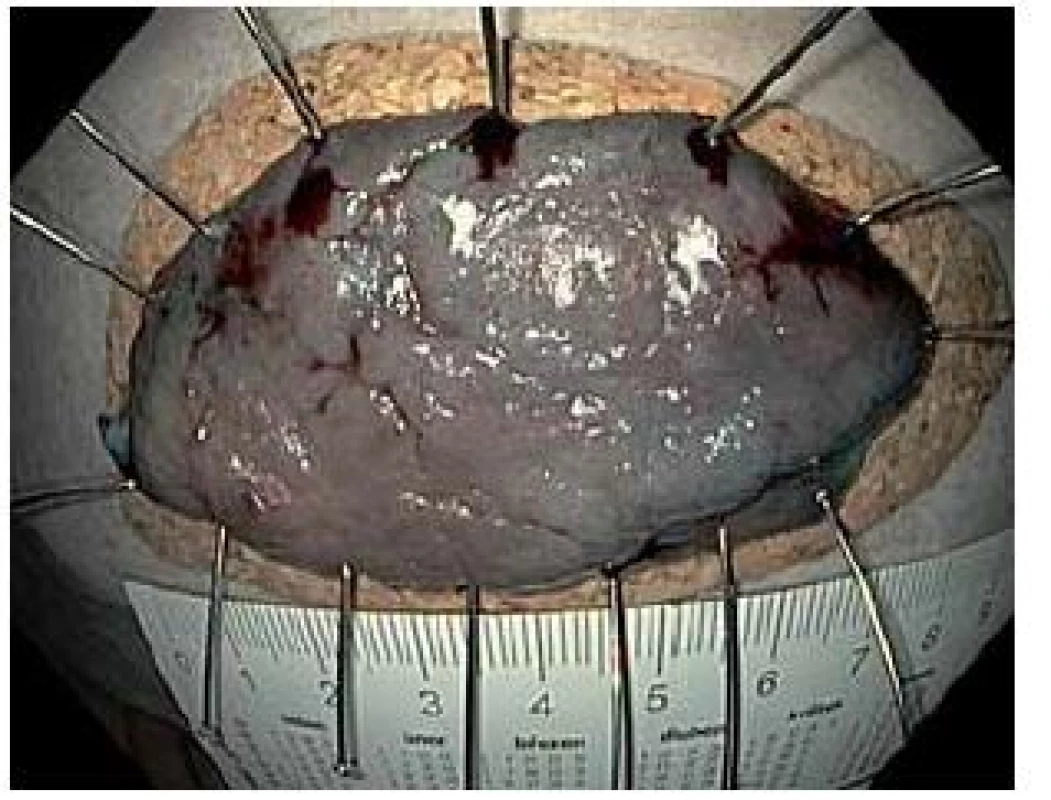
Všichni nemocní po G ‑ ESD byli hospitalizováni. V den zákroku jsme vyloučili příjem per os a aplikovali intravenózně blokátor protonové pumpy (PPI). První pooperační den jsme povolili tekutiny, druhý měkkou stravu a třetí šetřicí dietu. Délka hospitalizace nekomplikovaných případů byla 3 – 4 dny. V perorálním podávání PPI jsme pokračovali do první endoskopické kontroly. V případě pozitivity jsme indikovali léčbu infekce H. pylori.
Nemocné jsme dispenzarizovali podle modifikovaných doporučení navržených Gotodou. V případech po kurativní resekci podle guidelines kritérií kontrolujeme pouze endoskopicky za tři a dvanáct měsíců a dále každoročně. V případech kurativní resekce podle expandovaných kritérií indikujeme po roce navíc také CT vyšetření. Nemocné po nekurativní resekci, kteří nepodstoupili operaci, sledujeme individuálně [6].
Výsledky
Do studie jsme zařadili 25 nemocných (14 žen a 11 mužů) průměrného věku 71,5 (40 – 90) let, u kterých jsme provedli celkem 25 G ‑ ESD.
Celkem 15 (60 %) lézí bylo lokalizováno v antru, tři (12 %) angulárně, tři (12 %) v těle, tři (12 %) subkardiálně a jedna (4 %) v kardii.
Průměrná velikost léze byla 20 (5 – 66) mm. Průměrný operační čas od zavedení endoskopu do vybavení resekátu byl 95 (20 – 240) min.
Typ léze byl 0 – Is v sedmi (28 %) případech, 0 – IIa v deseti (40 %), 0II – b v jednom (4 %), 0 – IIa+IIc v pěti (20 %) a 0 – IIa+III v jednom (4 %). V jednom (4 %) zbývajícím případě se jednalo o subepiteliální lézi.
Postresekční histologické vyšetření zjistilo neoplastickou lézi ve 20 (80 %) případech, zbylých pět (20 %) lézí bylo neneoplastických. Ve třech (12 %) případech se jednalo o low ‑ grade dysplazii (LGD), v pěti (20 %) o high‑grade dysplazii (HGD), v pěti (20 %) o intramukózní karcinom (T1m), ve třech (12 %) o karcinom s invazí do horní třetiny submukózy (T1sm1), ve dvou (8 %) o karcinom s masivní submukózní invazí (T1 > sm1) a ve dvou (8 %) o neuroendokrinní tumor (NET, dříve karcinoid). V případech neneoplastických lézí se ve třech (12 %) případech jednalo o léze hyperplastické, v jednom (4 %) o intestinální metaplazii a v jednom (4 %) o aberantní pankreas. Výsledek předresekční klešťové biopsie se shodoval s finální histologickou diagnózou ve 14 (56 %) případech, ve čtyřech (16 %) případech došlo ke změně diagnózy, ve čtyřech (16 %) případech se jednalo o podhodnocení (understaging) a ve třech (12 %) o nadhodnocení (overstaging).
Krátkodobé výsledky léčby jsme vyhodnotili u 20 lézí s definitivní diagnózou neoplazie. En bloc resekce jsme dosáhli v 17 (85 %) případech, R0 resekce v 17 (85 %) případech a kurativní resekce v 16 (80 %).
Celkem ve čtyřech (20 %) případech nekurativní resekce se dvakrát jednalo o přítomnost neoplazie v laterálním resekčním okraji při histologickém vyšetření (R1). Jeden z těchto nemocných zemřel dva měsíce po výkonu z kardiálních příčin ve věku 90 let, druhý je sledován bez známek recidivy při kontrolní gastroskopii za tři a šest měsíců a stav hodnotíme jako úplnou remisi. U dalšího nemocného s hlenotvorným karcinomem invadujícím do sm1 byla realizována chirurgická léčba. Poslední nemocné s R1 resekcí nízce diferencovaného karcinomu s pozitivním laterálním resekčním okrajem byl následně zjištěn inoperabilní karcinom pankreatu.
Perforace se vyskytla u dvou (8 %) nemocných. V jednom případě se jednalo o intraprocedurální perforaci, která byla uzavřena klipováním, výkon byl dokončen s kurativním výsledkem a stav zvládnut konzervativně. Ve druhém případě se jednalo o opožděnou perforaci 24 hod po výkonu, bylo vyřešeno suturou z laparoskopického přístupu, což si vyžádalo prodloužení hospitalizace o deset dnů. Krvácení vyžadující emergentní endoskopické ošetření, transfuzi nebo chirurgický zákrok jsme nezaznamenali. Třicetidenní mortalita v souboru byla nulová.
Diskuze
Časný karcinom žaludku (EGC) je definován jako karcinom s invazí maximálně do submukózy (T1) bez ohledu na postižení lymfatických uzlin. Pokud infiltruje pouze sliznici (T1m) nebo přilehlou třetinu submukózy (T1sm1), má v zemích jihovýchodní Asie endoskopická léčba přednost před chirurgickou, protože je při stejných onkologických výsledcích zatížena menším rizikem komplikací a poskytuje vyšší kvalitu života.
G ‑ ESD zavedli do klinické praxe Japonci H. Ono a M. Ohkuwa v roce 2001 [7,8]. Metoda se rychle rozšířila a v roce 2012 bylo v Japonsku provedeno 39 000 G ‑ ESD, což představovalo 31 % z incidence 125 700 karcinomů žaludku. V roce 2013 toto číslo dále vzrostlo na 42 100 [9]. Ve srovnání s EMR poskytuje ESD častěji R0 resekci, čehož praktickým dopadem je nižší výskyt rekurence neoplazie. V současné době je na většině asijských pracovišť v žaludku prováděna pouze ESD.
Z Japonska se metoda rychle rozšířila nejprve na Korejský poloostrov a do Číny, později také na západní polokouli. Sdělení o první ESD v České republice jsme publikovali v roce 2006 [10]. Registr ESD v naší zemi neexistuje. Kvalifikovaným odhadem založeným na osobní komunikaci je u nás ročně provedeno asi 20 G ‑ ESD. Nedostatek informací o výsledcích léčby z domácích center může být jedním z důvodů nedostatečného povědomí o možnostech endoskopické léčby především v chirurgické a onkologické obci. Převládá nesprávný názor, že jedinou nadějí pro nemocného s karcinomem žaludku je chirurgická léčba. Důsledkem tohoto stavu je, že mnozí kandidáti endoskopické léčby jsou zbytečně vystavování rizikům chirurgické intervence, přičemž se často jedná o osoby staré a polymorbidní. V jedné ze srovnávacích studií se komplikace vyskytly v 5 % endoskopicky a 33 % chirurgicky léčených nemocných [4]. Zároveň je však nutné akceptovat, že 5 – 11 % endoskopicky léčených nemocných bude po G ‑ ESD stejně indikováno k chirurgické resekci. V těchto případech je možné chápat G ‑ ESD jako nejpřesnější stagingovou metodu. Ze studií je známo, že ESD nemá vliv na výsledek následné chirurgické resekce [11].
V této práci seznamujeme s výsledky léčby 20 nemocných. Jak en bloc, tak R0 resekce jsme dosáhli v 85 % případů. Toto číslo je srovnatelné s 92 %, resp. 82 % z metaanalýzy asijských dat a mírně horší než 92 %, resp. 91 % z recentně publikovaného portugalského souboru [12,13]. Kurativní resekce jsme dosáhli v 80 %. Toto číslo je shodné s výsledkem uvedeným v největším japonském souboru čítajícím 3 788 nemocných a 82 % v souboru portugalském, čítajícím 136 nemocných [14].
Významnými komplikacemi G ‑ ESD jsou zejména perforace a opožděné krvácení. Jsou reportovány v 1,2 – 9,7 %, resp. 1,8 – 16 % [12,13]. V recentní metaanalýze 28 japonských publikací, z nichž každá obsahovala soubor nejméně 300 ESD, bylo riziko perforace 1,2 – 5 %, opožděné perforace 0,5 % a opožděného krvácení 0 – 15,6 %. Rizikovým faktorem byla ESD v orální třetině žaludku. Perforaci bylo možné většinou uzavřít endoskopicky pomocí klipů, ale tato komplikace měla vliv na výsledek léčby, protože úspěšnost en bloc resekce klesla z 94 % na 74 % [15]. V našem souboru se vyskytla jediná intraprocedurální perforace při G ‑ ESD léze lokalizované subkardiálně u pacienta s pořadovým číslem 2, která byla vyřešena klipováním a neměla vliv na kurativní výsledek výkonu. Jediná opožděná perforace byla lokalizována v antru a vyskytla se u pacienta číslo 17. Byla vyřešena suturou z laparoskopického přístupu, G ‑ ESD byla kurativní. Významné krvácení se v našem souboru nevyskytlo, což je ovlivněno malou velikostí souboru. Z dalších komplikací jsme zaznamenali substenózu antra u jednoho nemocného.
Naše práce má celou řadu limitací. Především je náš soubor malý a zatížený chybou výběru způsobenou snahou minimalizovat výskyt komplikací. Dále musíme připustit, že karcinomy tvořily pouze 50 % našeho souboru. V dalších 20 % se však jednalo o HGD, která je v Asii často popisována jako neinvazivní intramukózní karcinom a v dalších 8 % se jednalo o NET, dříve karcinoid. Navíc, jak již bylo zmíněno výše, shoda mezi předintervenční a definitivní histologickou diagnózou byla pouze v 56 %. Podobné číslo nacházíme i v jiných pracích a to potvrzuje, že v mnoha případech rozhodne až definitivní histologické vyšetření o tom, zda se jedná o ESD kurativní nebo stagingovou. Lze také namítat, že prezentujeme pouze krátkodobá data. Nicméně je známo, že dosažení kurativní resekce je prediktivní pro dlouhodobou remisi onemocnění. Nemocné dále sledujeme. A konečně, výsledky léčby selektovaného souboru v jediném centru samozřejmě nelze zobecňovat. Zůstává však otázkou, kolik center, resp. endoskopických týmů kompetentních pro G ‑ ESD v naší zemi potřebujeme.
Závěr
Prezentujeme soubor 25 G ‑ ESD provedených v moravském gastroenterologickém centru. Podle našeho vědomí se jedná o první prezentovaný soubor v České republice. Prokazujeme, že G ‑ ESD je v našem centru zavedenou metodou. V selektovaném souboru nemocných jsme dosáhli krátkodobých výsledků srovnatelných s východoasijskými a nejlepšími evropskými centry. Metodu G ‑ ESD proto považujeme za zavedenou do klinické praxe. G ‑ ESD se také v naší zemi stala metodou první volby v léčbě povrchových neoplazií žaludku a její „nedostupnost“ by již neměla být důvodem k indikaci chirurgické terapie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24. 12. 2014
Přijato: 27. 1. 2015
MU Dr. Ondřej Urban, Ph.D.
Centrum péče o zažívací trakt
Vítkovická nemocnice a. s.
Zalužanského 1195/ 15 703 84 Ostrava
ondrej.urban@nemvitkovice.cz
Zdroje
1. Jemal A, Bray F, Center MM et al. Global cancer statistics. CA Cancer J Clin 2011; 61(2): 69 – 90. doi: 10.3322/ caac.20107.
2. Česká onkologická společnost ČLS JEP. [online]. Dostupné z: http:/ / www.linkos.cz/ .
3. Kodera Y, Sasako M, Yamamoto S et al. Identification of risk facors for the development of complications following extended and superextended lymphadenectomies for gastric cancer. Br J Surg 2005; 92(9): 1103 – 1109.
4. Chiu PW, Teoh HY, To KF et al. Endoscopic submucosal dissection (ESD) compared with gastrectomy for treatment of early gastric neoplasia: a retrospective cohort study. Surg Endosc 2012; 26(12): 3584 – 3591. doi: 10.1007/ s00464 ‑ 012 ‑ 2371 ‑ 8.
5. Gotoda T, Yanagisawa A, Sasako M et al.Incidence of lymph node metastasis from early gastric cancer: estimation with a large number of cases at two large centers. Gastric Cancer 2000; 3(4): 219 – 225.
6. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer 2011; 14(2): 113 – 123. doi: 10.1007/ s10120 ‑ 011 ‑ 0042 ‑ 4.
7. Ono H, Kondo H, Gotoda T et al. Endoscopic mucosal resection for treatment of early gastric cancer. Gut 2001; 48(2): 225 – 229.
8. Ohkuwa M, Hosokawa K, Boku N et al. New endoscopic treatment for intramucosal gastric tumors using an insulated ‑ tip diathermic knife. Endoscopy 2001; 33(3): 221 – 226.
9. Ganjoho.jp [online in Japanese]. Available from: http:/ / ganjoho.jp/ public/ statistics/ pub/ statistics01.html.
10. Urban O, Vítek P, Fojtík P et al. Endoscopic submucosal dissection. Initial experience in the Czech Republic. Folia Gastroenterol Hepatol 2006; 4(1): 4 – 10.
11. Jung H, Bae JM,Choi MG et al. Surgical outcome after incomplete endoscopic submucosal dissection of gastric cancer. Br J Surg 2011; 98(1): 73 – 78. doi: 10.1002/ bjs.7274.
12. Lian J, Chen S, Zhang Y et al. A meta‑analysis of endoscopic submucosal dissection and EMR for early gastric cancer. Gastrointest Endosc 2012; 76(4): 763 – 770. doi: 10.1016/ j.gie.2012.06.014.
13. Park YM, Cho E, Kang HY et al. The effectiveness and safety of endoscopic submucosal dissection compared with endoscopic mucosal resection for early gastric cancer: a systematic review and metaanalysis. Surg Endosc 2011; 25(8): 2666 – 2677. doi: 10.1007/ s00464 ‑ 011 ‑ 1627 ‑ z.
14. Pimentel ‑ Nunes P, Mourao F, Veloso N et al. Long‑term follow‑up after endoscopic resection of gastric superficial neoplastic lesions in Portugal. Endoscopy 2014; 46(11): 933 – 940. doi: 10.1055/ s ‑ 0034 ‑ 1377348.
15. Toyokawa T, Inaba T, Omote S et al. Risk factors for perforation and delayed bleeding associated with endoscopic submucosal dissection for early gastric neoplasms: analysis of 1123 lesions. J Gastroenterol Hepatol 2012; 27(5): 907 – 912. doi: 10.1111/ j.1440 ‑ 1746.2011.07039.x.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochoreníČlánek Novinky v roce 2015Článek Biologická léčba nemá vliv na výsledky endoskopické balónkové dilatace u pacientů s Crohnovou nemocíČlánek Správná odpověď na kvízČlánek Exviera, ViekiraxČlánek Výzva ke spolupráciČlánek Autodidaktický test: IBD
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2015 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Řešení sideropenní anémie u nemocných s ulcerózní kolitidou může být někdy velkým problémem
- Doporučené postupy chirurgické léčby pacientů s nespecifickými střevními záněty – 1. část: předoperační příprava
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
- Vedolizumab v léčbě ulcerózní kolitidy
- Biologická léčba nemá vliv na výsledky endoskopické balónkové dilatace u pacientů s Crohnovou nemocí
- Topická léčba idiopatických střevních zánětů
- Význam fekálneho kalprotektínu v diagnostike a liečbe nešpecifických črevných zápalových ochorení
- Imunoablační léčba a autologní transplantace hematopoetických kmenových buněk u pacienta s agresivní formou Crohnovy nemoci refrakterní na medikamentózní terapii
- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Krátkodobé výsledky léčby povrchových neoplastických lézí žaludku endoskopickou submukózní disekcí
- Novinky v roce 2015
- Syndróm bakteriálneho prerastania
- Správná odpověď na kvíz
- Exviera, Viekirax
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Preparáty firmy Nutricia v enterální výživě u dětí
- Noví členové redakční rady časopisu
- Výzva ke spolupráci
- VIII. beskydský endoskopický workshop
- Nejen anti-TNF živ je IBD pacient
- Autodidaktický test: IBD
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Praktický příspěvek k diagnostice a léčbě fokální nodulární hyperplazie a adenomů v játrech z pohledu hepatologa, radiologa, patologa a chirurga
- Syndróm bakteriálneho prerastania
- Topická léčba idiopatických střevních zánětů
- Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



