-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
Optimization of methotrexate treatment in rheumatoid arthritis therapy
The aim of this review is to assess the position of methotrexate (MTX) in a modern strategy for the treatment of active rheumatoid arthritis. It has been noted that MTX is not used adequately in routine clinical practice, neither in frequency, dose and possible forms of administration. As recommended by EULAR (European League Against Rheumatism), MTX should always be part of the first treatment strategy. It can also be an anchor drug when other synthetic or biological drugs are added to MTX in case of inadequate response. More recently, the combination of MTX with glucocorticoids has been shown to be beneficial in initiating treatment for early rheumatoid arthritis. The dose of 10 mg MTX per week with rapid titration to 25–30 mg per week is recommended as an initial dose. With rapid dose escalation, up to 40% of patients can achieve low disease activity status. MTX is always given in combination with folic acid. The problem of oral MTX is non-constant absorption, especially at doses higher than 15 mg per week. It is, therefore, preferable to switch to subcutaneous administration of MTX. A meta-analysis of 7 studies showed greater efficacy of subcutaneous MTX than oral. Subcutaneous administration also results in a faster onset of action. It has also been shown that switching to subcutaneous MTX can reduce the need for biological treatment by up to 20%, making it a pharmacologically advantageous procedure. Subcutaneous MTX is currently available, with autoinjectors in the form of pre-filled pens being particularly preferred.
Keywords:
Methotrexate – rheumatoid arthritis – subcutaneous methotrexate
Autoři: K. Pavelka
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 28, 2020, No. 1, p. 16-22.
Kategorie: Přehledový článek
Souhrn
Předmětem přehledné práce je posouzení pozice methotrexátu (MTX) v moderní strategii léčby aktivní revmatoidní artritidy. Je konstatováno, že MTX není používán v běžné klinické praxi adekvátně, a to ani co se týče frekvence, tak výšky dávek a možné formy podávání.
Dle doporučení EULAR (Evropské ligy proti revmatismu) má být MTX vždy součástí první léčebné strategie. Může být také kotevním lékem, kdy se k němu při nedostatečném efektu přidávají další syntetické či biologické léky. V poslední době se ukázala jako výhodná kombinace MTX s glukokortikoidy při zahajování léčby časné revmatoidní artritidy. Jako iniciální dávkování se doporučuje 10 mg MTX týdně s rychlou titrací na 25–30 mg týdně. Při rychlé eskalaci dávky je možné docílit stavu nízké aktivity až u 40 % pacientů. MTX se podává vždy v kombinaci s kyselinou listovou. Problémem perorálního MTX je nekonstantní vstřebávání, a to především vyšších dávek než 15 mg týdně. Výhodné je proto přejít na subkutánní podávání MTX. Metaanalýza sedmi studií prokázala větší účinnost subkutánního MTX oproti perorálnímu. Při subkutánním podávání je také rychlejší nástup účinku. Bylo také prokázáno, že přechod na subkutánní MTX může snižovat potřebu biologické léčby až o 20 %, takže jde i o farmakoekonomicky výhodný postup. Subkutánní MTX je v současné době dostupný, přičemž výhodné jsou především autoinjektory ve formě předplněných per.
Klíčová slova:
revmatoidní artritida – methotrexát – subkutánní methotrexát
ÚVOD
Revmatoidní artritida (RA) je chronické, zánětlivé autoimunitní onemocnění postihující až 1 % populace. Je příčinou výrazné morbidity, disability, zhoršení kvality života nemocných, ale též zvýšeného kardiovaskulárního rizika a zkrácení střední délky života až o 7–10 let (1). Léčba RA se v posledních desetiletích dramaticky změnila, což značně zlepšilo kvalitu života nemocných s RA. Nejdůležitější změny v léčebných postupech představují (obr. 1): nová kritéria pro časnou diagnostiku a následné zahájení léčby, vývoj validizovaných nástrojů pro klinické hodnocení aktivity léčby, nastavení principů léčby k cíli (T2T – treat to target) (2), optimalizace používání methotrexátu, zavedení biologických chorobu modifikujících léků RA (bDMARD) a následně cílených, syntetických DMARD (tsDMARD) a dále samozřejmě sumarizace těchto principů v doporučeních EULAR a ACR (Americká kolej revmatologů) (3, 4). V obou těchto doporučeních je jako cíl léčby uváděna remise onemocnění, alternativně u pacientů s delším trváním RA pak stav nízké aktivity. Data z kohortových studií a registrů však ukazují, že výskyt remise se v běžné klinické praxi pohybuje mezi 40–60 %, přičemž většina dat pochází z registrů biologické léčby. Nicméně dosažení trvalé remise, definované jako udržení remise (DAS 28 méně než 2,6) nejméně 12 měsíců při dvou kontrolách po 6 měsících, bylo dosaženo pouze u 16 % nemocných. Navíc rozdíl mezi nemocnými léčenými bDMARD a csDMARD nebyl příliš velký.
Obr. 1. Pokroky v léčbě RA v posledních 20 letech 
Je tedy možné říci, že výsledky léčby RA v běžné klinické praxi nejsou zcela optimální, přičemž příčin je jistě celá řada. Předmětem této práce je úvaha nad jedním výše uvedeným principem z pohledu evidence založené na důkazech, a to konkrétně používání methotrexátu.
METHOTREXÁT MÁ BÝT SOUČÁSTÍ PRVNÍ LÉČEBNÉ STRATEGIE
Doporučení EULAR č. 4 (3) říká, že MTX má být součástí první léčebné strategie u RA (obr. 2). Vysvětlení je následující: Na základě hodnocení účinnosti, bezpečnosti (zvláště při podávání kyseliny listové), možnosti individualizovat dávku a formu podávání a nízkých nákladů, zůstává methotrexát prvním (kotevním) lékem, a to jak v monoterapii, tak v kombinaci s ostatními konvenčními chorobu modifikujícími léky (csDMARD), bDMARD i tsDMARD. Některé studie ukazují i snížení výskytu komorbidit a mortality po aplikaci MTX (5).
Obr. 2. Doporučený algoritmus léčby RA podle EULAR 2016 (podle 3) 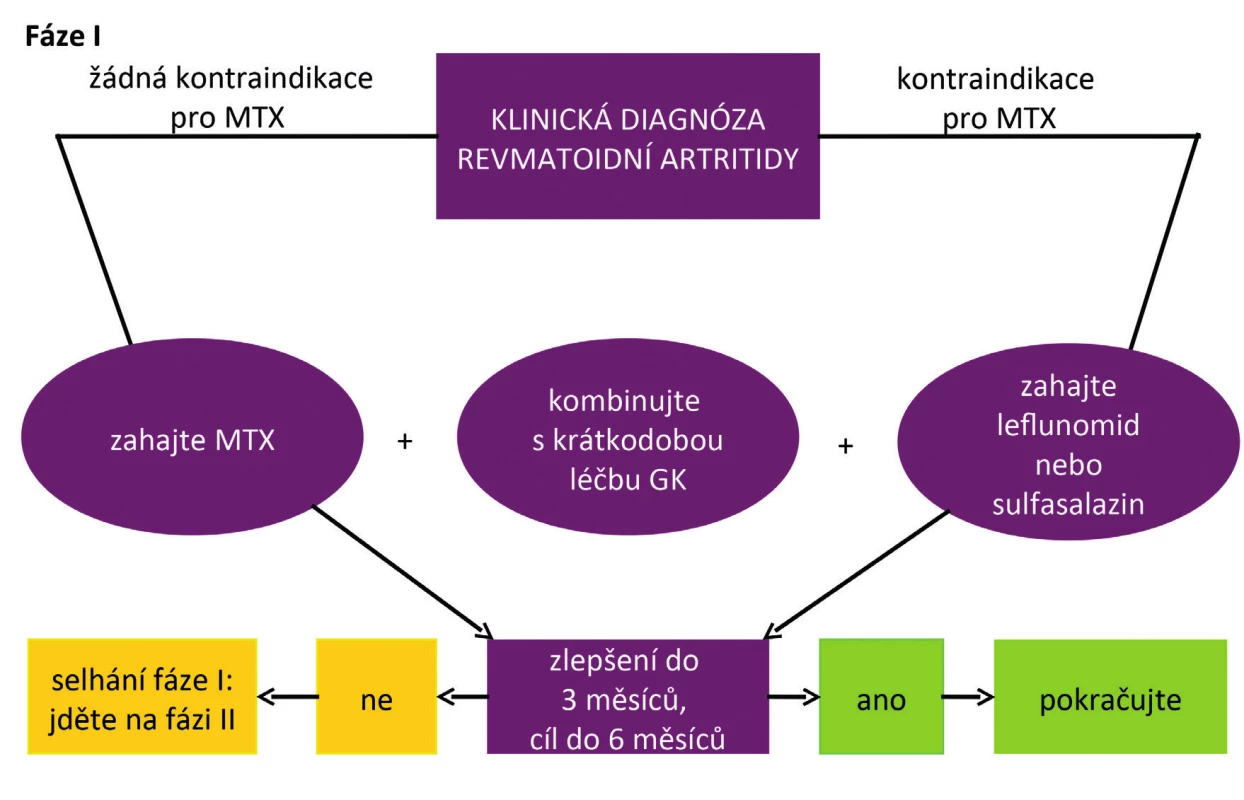
KDY NENÍ METHOTREXÁT SOUČÁSTÍ PRVNÍ LÉČEBNÉ STRATEGIE?
Pokud je MTX kontraindikován, je doporučováno použít jiná csDMARD, jako je leflunomid nebo sulfasalazin. Závažnými kontraindikacemi jsou především anamnéza závažného jaterního onemocnění, renální onemocnění, plicní fibrózy a cytopenie. Seznam možných nežádoucích účinků, z nichž většina je nezávažných, však může při přílišném zdůrazňování pacientovi zhoršovat jeho compliance k léku.
Starší studie prokazovaly stejnou účinnost MTX jako např. SAS a leflunomid (6), ale v těchto srovnávacích studiích byly často používány nízké dávky MTX. Novější srovnávací studie s vyššími dávkami MTX nebyly provedeny, přesto je však MTX považován za účinnější než leflunomid nebo sulfasalazin.
ZAHÁJIT U MTX NAIVNÍCH PACIENTŮ LÉČBU METHOTREXÁTEM V MONOTERAPII NEBO V KOMBINACI S JINÝMI csDMARD?
EULAR ve svých novějších doporučeních preferuje zahájení léčby monoterapií MTX než kombinací MTX + sulfasalazin + antimalarika, a to přestože některé studie ukázaly velmi dobrou účinnost této tzv. triple terapie, která byla srovnatelná s kombinací MTX + biologický lék (7). Některé národní revmatologické společnosti mají triple terapii stále doporučovanou jako iniciální léčbu. Nicméně některé další studie neprokázaly větší účinnost triple terapie oproti monoterapii MTX, zvláště pokud byl podáván MTX v kombinaci s glukokortikoidy. Některé studie také poukázaly na vyšší výskyt nežádoucích účinků u triple terapie. To může být také důvodem, proč ACR změnila ve svých doporučeních z roku 2015 předcházející dikci a doporučuje zahájit léčbu monoterapií MTX (4).
KOMBINOVAT PŘI ZAHÁJENÍ LÉČBY METHOTREXÁT S GLUKOKORTIKOIDY?
Doporučení používat v iniciální léčebné strategii kombinaci MTX + glukokortikoidy (GK) bylo již v doporučeních EULAR z roku 2010, nicméně je možné říci, že v inovovaných doporučeních z roku 2016 je tato dikce silnější (3). Přibyla totiž evidence o tom, že kombinace MTX + GK je stejně účinná jako kombinace csDMARD + bDMARD (8). Apli-kace glukokortikoidů by však měla být krátkodobá, konkrétně maximálně 6měsíční, a to především z důvodů vlivu kumulativní dávky GK na vznik nežádoucích účinků. Co je v inovovaných EULAR doporučeních také nové je doporučovaná dávka GK.V doporučeních z roku 2010 se hovoří o tzv. nízkých dávkách GK, jež jsou definovány jako 7,5 mg prednisonu nebo ekvivalentu denně, avšak v doporučeních z roku 2016 se na základě provedených studií uvádějí dávky vyšší, např. vhodná iniciální dávka GK je 30 mg prednisonu denně (9), 120 mg methylprednisolonu i.m. nebo 250 mg solubilního methylprednisolonu denně i.v.
JAKÉ JE VHODNÉ INICIÁLNÍ DÁVKOVÁNÍ METHOTREXÁTU?
V osmdesátých letech 20. století, když byl MTX oficiálně schválen pro léčbu RA, bylo doporučováno zahajovat léčbu dávkou 7,5 mg MTX týdně per os s pomalou titrací k vyšším dávkám. Když bylo později ověřeno, že účinnost MTX je v monoterapii výrazně závislá na dávkách, bylo doporučeno začínat s dávkou 10 mg MTX týdně s rychlou titrací na 25–30 mg MTX týdně. EULAR však ve svých doporučeních konkrétní způsob eskalace dávky neudává (3). Systematický přehled publikovaných prací ukázal zlepšenou klinickou účinnost, pokud se začínalo s dávkou 15 mg MTX týdně s titrací dávky o 5 mg měsíčně do dávky 25–30 mg týdně, která je považována za maximální možnou (10). Při této rychlé eskalaci dávky je možné docílit stavu nízké aktivity až u 40 % pacientů (11). Výsledky studií s vyššími dávkami MTX jsou však jak na skupinové, tak individuální úrovni nekonzistentní. Jeden z důvodů může být v oblasti farmakokinetiky, konkrétně biologické dostupnosti MTX při perorálním podávání vyšších dávek.
JAKÉ JE VSTŘEBÁVÁNÍ METHOTREXÁTU?
Methotrexát podávaný per os se vstřebává z gastrointestinálního traktu, ale jeho biologická dostupnost kolísá kolem 70 % s velkými rozdíly mezi jednotlivými pacienty. Jsou důkazy o tom, že rozdíly v biologické dostupnosti perorálně podávaného MTX jsou nacházeny především při dávkách vyšších než 15 mg MTX týdně. Koncentrace MTX 4 hodiny po podání byla po subkutánní aplikaci (s.c.) vyšší než po stejných dávkách MTX podávaných perorálně v 8týdenní randomizované studii (12). Při hodnocení koncentrace MTX pomocí plochy pod křivkou (AUC) dochází k proporcionálnímu zvyšování podle perorální dávky až do dávky 15 mg MTX, kdy se křivka již oplošťuje a nedochází k dalšímu zvyšování. Naproti tomu žádné oploštění AUC není patrné při podávání MTX s.c. Nicméně z toho vyplývá, že při konverzi perorálního MTX na subkutánní MTX by měly být dávky s.c. MTX redukovány. Konverzní strategii navrhl na základě provedené studie Schiff (13) (tab. 1). Při dávkách 10 a 15 mg týdně se při konverzi z perorálního na s.c. MTX používají stejné dávky, při použití 20 mg MTX per os je doporučovaná dávka s.c. MTX 15 mg a při dávce 25 mg s.c. pak 20 mg s.c. Lze uzavřít, že prediktabilita biologické dostupnosti subkutánního MTX je lepší než při perorálním podávání.
Tab. 1. Konverze orálního MTX na subkutánní – navržené ekvivalenty 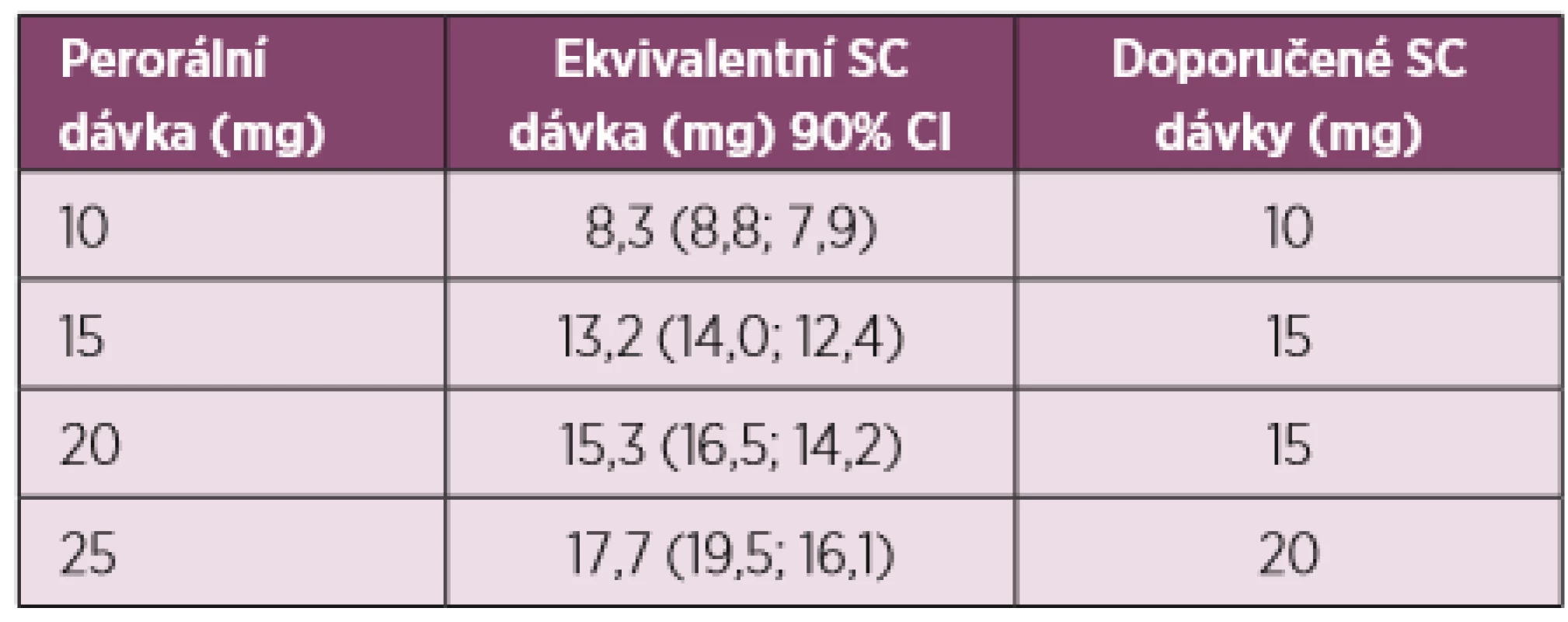
Doporučovaná subkutánní dávka byla založena na systémových hladinách MTX, ekvivalentní nebo vyšší, než jsou dosahovány při orálním MTX (13). JAKÁ JE EVIDENCE O ÚČINNOSTI SUBKUTÁNNĚ PODÁVANÉHO METHOTREXÁTU?
Výsledky několika studií ukázaly, že s.c. MTX je účinnější než stejné dávky perorálního MTX. Metaanalýza sedmi studií zahrnující 1335 pacientů prokázala větší účinnost s.c. MTX oproti per os MTX ve smyslu dosažení ACR 20 (OR 1,68) a ACR 70 (OR 1,68) (14–16).
Důležitým aspektem léčby DMARD v obecné rovině může být rychlost nástupu účinku. MTX je považován za lék s pomalým nástupem účinku, když maximálního účinku je dosahováno za 3–6 měsíců a někteří autoři uvádějí ještě delší interval. Toto může být problém, protože bDMARD a tsDMARD mají mnohem rychlejší nástup účinku. Nicméně byla také provedena studie, která se zabývala kinetikou účinku při podání s.c. MTX (17). Do studie bylo zařazeno 103 pacientů a dávka s.c. MTX byla u 98 % 25 mg týdně. Efekt v této studii byl výrazný v 6 týdnech oproti 12 týdnům (změna DAS 28 –1,9 vs. –0,2, p = 0,001). Počet pacientů, kteří docílili DAS 28 nebo CDAI remisi byl vyšší v prvních 6 týdnech (p = 0,0002). Pokud akceptujeme koncept okno příležitosti a časné, intenzivní léčby, s.c. MTX se jeví jako vhodná alternativa.
Další studie pak prokázaly, že switching z per os na s.c. MTX zlepšuje účinnost MTX u pacientů s RA s nedostatečnou účinností per os podávaného MTX ve stejné dávce (16). Většina studií, která hodnotila efekt změny perorálního MTX na subkutánní, byla retrospektivní, jak ve své přehledné práci uvádí Vena (18). Citována je také studie MENTOR provedená v Norwichi (19). Byli vyhodnoceni pacienti, kteří selhávali na perorální léčbě a byli převedeni na s.c. MTX. V průběhu 2 let selhalo na s.c. MTX pouze 13,7 % pacientů a přidání biologické léčby bylo nutné pouze v 11 %.
Zatím však nebyla prokázána větší účinnost subkutánního MTX oproti perorálnímu u juvenilní idiopatické artritidy, když retrospektivní analýza provedená Kleinem prokázala stejně časté přerušení léčby u obou forem podávání (20).
JAKÁ JE BEZPEČNOST SUBKUTÁNNÍ LÉČBY METHOTREXÁTEM?
Důležitým aspektem je, zda není vyšší biologická dostupnost s.c. MTX asociována s vyšším výskytem nežádoucích účinků než u perorální formy. V randomizované, kontrolované studii prokázal Braun větší účinnost MTX s.c. oproti per os, bez většího relevantního zvýšení nežádoucích účinků (14). Nicméně ve skupině pacientů se subkutánním MTX předčasně ukončilo léčbu pro nežádoucí účinky více pacientů než u skupiny léčené perorálně (9,3 % vs. 4,3 %), avšak počet pacientů se středně závažnými a závažnými nežádoucími účinky, častějšími než 3 %, byl naopak vyšší ve skupině léčené perorálně. Gastrointestinální nežádoucí účinky byly překvapivě stejně časté v obou skupinách. Přes vyšší biologickou dostupnost subkutánního MTX v dávkách převyšujících 15 mg neprokázal Schiff vyšší výskyt nežádoucích účinků při srovnání s perorální formou podávání (12).
Je nutné ale zdůraznit, že je vhodné u všech forem podávání a u všech dávek MTX podávat substituci kyselinou listovou, což snižuje výskyt nežádoucích účinků.
PODPORUJÍ FARMAKOEKONOMICKÁ DATA POUŽÍVÁNÍ SUBKUTÁNNÍHO METHOTREXÁTU?
Konverzi perorálně podávaného MTX na subkutánní je nutné považovat za důležitou alternativu léčby revmatoidní artritidy i v kontextu „strategie léčby k cíli“ (treat to target – T2T). Změna formy perorální na subkutánní může snížit potřebu biologické léčby až o 20 %, což má vzhledem k velikému rozdílu v ceně MTX a biologických DMARD i výrazný farmakoekonomický dopad. Koduri ve své publikaci a farmakologické analýze dat z Británie uvádí, že dokonce každý pacient na perorální léčbě MTX by měl být před případným nasazením biologik převeden na MTX subkutánní (21).
JE SUBKUTÁNNÍ MTX DOSTATEČNĚ VYUŽÍVÁN V LÉČBĚ REVMATOIDNÍ ARTRITIDY?
Methotrexát má nejdelší pětiletou retenci na léčbě ze všech DMARD a v dávce 20 mg týdně může být i zcela dostatečnou léčbou až pro třetinu pacientů s RA. Je také bránou pro biologickou léčbu a na základě evidence je doporučeno používat bDMARD i tsDMARD vždy v kombinaci s MTX (pokud je možné; asi 25–30 % pacientů žádné csDMARD netoleruje a musí být na monoterapii). Tato pozice MTX je také ukotvena v doporučeních pro léčbu RA EULAR a ACR (2, 4). Nicméně je z klinické praxe a především dat z registrů evidentní, že MTX není dostatečně používán, a to jak ve smyslu frekvence podávání, tak především jeho dávkování. Je nutné akceptovat fakt, že adherence k léčbě MTX je z více důvodů nedobrá, nicméně častým důvodem je i ne zcela optimální strategie léčby z pohledu revmatologa. V registrech není vždy možné dohledat, jakou formou byl MTX podáván, ale řada signálů svědčí pro ne zcela dostatečné využívání subkutánní formy aplikace MTX (22).
JAKÉ FORMY PARENTERÁLNÍ APLIKACE METHOTREXÁTU JSOU VÝHODNÉ?
Když byly zjištěny limity perorální léčby MTX, začaly se používat formy intramuskulární, které vyžadovaly návštěvy v zdravotnických zařízeních, kde byl MTX aplikován specializovanými sestrami. Velký pokrok přinesla později možnost subkutánní aplikace, kterou si aplikují nemocní sami doma. První formou byly předplněné stříkačky s různým obsahem MTX. Později byly vyvinuty předplněné autoinjektory. Při hodnocení obou forem s.c. MTX preferovalo 75 % pacientů použití pera před používáním předplněné stříkačky (23). Výhodou této aplikační formy je snadné použití bez nutnosti plnění před aplikací. Jehla je použita automaticky a je aplikována fixní dávka. V České republice jsou dostupné subkutánní formy pod názvem Metoject, Injectate a nově též Nordimet (24). Výhodou Metojectu a Injectate je vyšší koncentrace MTX, což znamená nižší objem aplikovaného léčiva. Ergonomicky výhodným se zdá být autoinjektor Nordimet. Jde o předplněné pero bez nutnosti mačkat knoflík s mechanismem dvojitého kliku. Byla také publikovaná studie, která prokázala, že edukace a trénink pacienta pomocí videa zlepšují compliance pacienta s touto léčbou (25).
KTEŘÍ PACIENTI JSOU VHODNÍ PRO APLIKACI SUBKUTÁNNÍHO METHOTREXÁTU?
Schválené indikace pro subkutánní léčbu MTX jsou aktivní RA, závažná psoriáza a psoriatická artritida a juvenilní idiopatická artritida.
V běžné klinické praxi nejčastěji zahajujeme MTX ve formě perorální. Indikací pro převedení na subkutánní formu je nejčastěji nedostatečná účinnost perorálního MTX. Další indikací může být gastrointestinální intolerance perorálního MTX, a to zvláště při stomatitidě. Diskutovanou indikací je pak použití s.c. MTX již jako iniciální léčbu pro pacienty s vysokou aktivitou.
Podpořeno projektem Ministerstva zdravotnictví ČR Koncepčního rozvoje výzkumné organizace 00023728 Revmatologický ústav.
Konflikt zájmů: žádný.
adresa pro korespondenci:
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: pavelka@revma.cz
Zdroje
1. Alamanos Y, Drossos AA. Epidemiology of adult rheumatoid arthritis. Autoimmune Rev 2005; 4 : 130–136.
2. Smolen J, Breedveld FC, Burmestr G, et al. Treating rheumatoid arthritis to target: 2014 update of the international task force. Ann Rheum Dis 2017; 76 : 960–977.
3. Smolen J, Landewe R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2016 update Ann Rheum Dis 2016; 75 : 3–15.
4. Singh JA, Saag KG, Bridges S. ACR Guideline for the treatment of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2016; 678 : 1–25.
5. Wasko MC, Dasgupta A, Hubert H, et al. Propensity – adjusted association of methotrexate with overall survival in rheumatoid arthritis. Arthritis Rheum 2013; 65 : 334–342.
6. Emery P, Breedveld FC, Lemmel EM, et al. A comparison of the efficacy and safety of leflunomide and methotrexate in the treatment of rheumatoid arthritis. Rheumatology (Oxford) 2000; 69 : 1004–1009.
7. Moreland LW, O Dell JR, Paulus HER, et al. A randomized comparative effectiveness study of oral triple therapy versus etanercept plus methotrexate in early aggressive rheumatoid arthritis: the treatment of Early Aggressive Rheumatoid Arthritis Trial. Arthritis Rheum 2012; 64 : 2824–2835.
8. Nam JL, Villeneuve E, Hensor EM, et al. Remission induction comparing infliximab and high-dose intravenous steroid followed by treat-to-target: a double blind, randomized, controlled trial in new onset, treatment naive, rheumatoid arthritis (IDEA study) Ann Rheum Dis 2014; 63 : 75–85.
9. Verschueren P, De Cock D, Corluy L, et al. Methotrexate in combination with other DMARD sis not superior to MTX alone for remission induction with moderate to high glucocorticoid bridging in early RA after 16 months treatment, The Care RA trial. Ann Rheum Dis 2015; 74 : 27–34.
10. Visser K, van der Heijde D. Optimal dosage and route of administration of methotrexate in rheumatoid arthritis: a systematic review of the literature. Ann Rheum Dis 2009; 68 : 1094–1099.
11. Emery P, Bingham CO, Burmester G, et al. Certolizumab pegol in combination with dose-optimised methotrexate in DMARD naive patients with early, active rheumatoid arthritis with poor prognostic factors: 1 year results from C-EARLY, a randomized, double–blind, placebo–controlled phase III study. Ann Rheum Dis 2017; 76 : 96–104.
12. Schiff MH, Jaffe JS, Freundlich B. Head to head, randomized, crossover study of oral versus subcutaneous MTX in patients with rheumatoid arthritis: drug – exposure limitations of oral MTX at doses15 mg may be overcome with subcutaneous administration. Ann Rheum Dis 2014; 73 : 1549–1551.
13. Schiff MH, Sadowski P. Oral to subcutaneous MTX dose conversion strategy in the treatment of rheumatoid arthritis. Rheumatol Int 2017; 37 : 213–218.
14. Braun J, Kastner P, Flaxcnberg P, et al. Comparison of clinical efficacy and safety of sc MTX vs oral administration of MTX in patients with active RA. Results of a six months, multicentre, randomized, double blind, controlled, phase IV trial. Arthritis Rheum 2008; 58 : 73–81.
15. Bianchi G, Caporali R, Todoenti M, et al. Methotrexate and rheumatoid arthritis: current evidence regarding subcutaneous versus oral routes of administration. Adv Ther 2016; 33 : 369–378.
16. Li D, Yang Z, Kang P. Subcutaneous administration of methotrexate at high doses makes a better performance in the treatment of rheumatoid arthritis compared with oral administration of methotrexate: a systematic review and metaanalysis. Semin Arthritis Rheum 2016; 45 : 656–662.
17. O’Connor A, Thome C, Kang, H et al. The rapid kinetics of optimal treatment with subcutaneous MTX in early inflammatory arthritis: observational study. BMC Musculoscelet Disord 2016; 17 : 364.
18. Vena GA, Cassano N, Iannone F. Update on subcutaneous methotrexate for inflammatory arthritis and psoriasis. Ther Clin Risk Management 2018; 14 : 105–116.
19. Scott DG, Claydon, P, Ellis C. Retrospective evaluation of continuation rates following a switch to subcutaneous MTX in rheumatoid arthritis patients failing to respond to or tolerate oral MTX: MENTOR study. Scand J Rheumatol 2014; 43 : 470–476.
20. Klein A, Kaul I, Foeldvari I, et al. Efficacy and safety of oral and parenteral MTX therapy in children with JIA: an observational study with patients from German MTX Registry Arthritis Care Res (Hoboken) 2012; 64 : 1349–1356.
21. Koduri GM, Mukhtyar C. Why subcutaneous methotrexate should be a prerequisite to biologic use in patients with rheumatoid arthritis. Rheumatology (Oxford) 2019; 58 : 559–560.
22. Rohr MK, Mikuls TR, Cohen SB, et al. Underuse of MTX in the treatment of rheumatoid arthritis. A national analysis of prescribing practices in the US. Arthritis Care Res 2017; 69 : 794–800.
23. McKeage K, Lyseng-Willliamson K. Methotrexate in prefilled autoinjector pen for subcutaneous use. Profile its use in EU. Drugs Ther Perspect 2018; 34 : 197–202.
24. Saraux A, Hudry Ch, Zinovieva E, et al. Use of auto-injector for methotrexate subcutaneous self-injections: high satisfaction level and good compliance in SELF-I study, a randomized, open-label, parallel group study. Rheumatol Ther 2019; 6 : 47–60.
25. Homer Dawn. Using video-based training for button-free auto-injection of subcutaneous methotrexate: A pilot study. Musculoskeletal Care 2019; 17 : 247–279.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Úvodník
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2020 Číslo 1- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Revmatoidní artritida a postižení ledvin
- Mezenchymální kmenové buňky: biologie a potenciál v léčbě systémových onemocnění pojiva
- Úvodník
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Statiny indukovaná nekrotizující autoimunitní myopatie jako neobvyklá příčina extrémních hodnot kardiálních markerů u pacienta se svalovou slabostí a otoky
- Kongres American College of Rheumatology (ACR) 2019
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Revmatoidní artritida a postižení ledvin
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



