-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mezenchymální kmenové buňky: biologie a potenciál v léčbě systémových onemocnění pojiva
Mesenchymal stem cells: biology and potential in the treatment of patients with connective tissue disease
Mesenchymal stem cells are a unique type of cells that have the ability of differentiation to another cell type and modulation of the immune system. Mesenchymal stem cells are easily obtainable from many tissues, they are able to differentiate in osteocytes, chondrocytes and adipocytes and capable to produce various immunomodulatory and immunoregulatory factors. Knowledge of the origin, life cycle and function is important for understanding of their mechanism of action in the treatment of multiple disorders, inclusive of autoimmune rheumatic diseases (i.e. systemic lupus erythematodes and rheumatoid arthritis). The aim of this review is to raise public awareness of the properties of mesenchymal stem cells and the possibilities of their potential exploitation in the treatment of connective tissue disorders.
Keywords:
immunomodulation – mesenchymal stem cells – rheumatoid arthritis – reparation – lupus erythematodes
Autoři: L. Formanová 1; V. Vodičková 1; I. Hromadníková 2; R. Klubal 1
Působiště autorů: Medicínské centrum Praha 1; Oddělení molekulární biologie a patologie buňky, 3. LF UK, Praha 2
Vyšlo v časopise: Čes. Revmatol., 28, 2020, No. 1, p. 39-51.
Kategorie: Přehledový článek
Souhrn
Mezenchymální kmenové buňky jsou unikátním typem buněk, které mají schopnost diferenciace do jiného buněčného typu a modulace imunitního systému. Lze je snadno získat z mnoha tkání, mají schopnost diferenciace v buňky kostní (osteocyty), chrupavkové (chondrocyty) a tukové (adipocyty) a produkují imunomodulační a imunoregulační faktory. Znalost jejich původu, životního cyklu a funkce je důležitá pro pochopení mechanismu účinku mezenchymálních kmenových buněk v léčbě a reparaci poškozených tkání. Vlastnosti mezenchymálních kmenových buněk umožňují jejich potenciální využití v léčbě četných onemocnění, včetně autoimunitních revmatických chorob (např. systémový lupus erythematodes nebo revmatoidní artritida). Cílem tohoto přehledového článku je seznámit odbornou veřejnost s vlastnostmi mezenchymálních kmenových buněk a možnostmi jejich potenciálního využití v léčbě systémových onemocnění pojiva.
Klíčová slova:
imunomodulace – mezenchymální kmenové buňky – revmatoidní artritida – reparace – lupus erythematodes
ÚVOD
Kmenové buňky jsou buňky nediferencované, schopné neustálé sebeobnovy a přeměny v jiný buněčný typ. Lze je rozdělit do skupin na základě jejich schopnosti diferenciace na totipotentní buňky, které mají schopnost vytvořit celého jedince: buňky pluripotentní, které mohou produkovat jakékoliv jiné buněčné typy kromě totipotentních, buňky multipotentní, kam řadíme mezenchymální kmenové buňky (MSC) schopné produkovat různé typy buněk v rámci jednoho zárodečného listu a buňky unipotentní utvářející pouze jeden typ buněk a vyznačující se schopností sebeobnovy (1).
MSC jsou schopné diferenciace v četné buněčné linie tkání mezodermu – kostní (osteocyty), chrupavkové (chondrocyty) a tukové (adipocyty) (2). Kromě přeměny v buňky mezodermu byla prokázána i jejich transdiferenciace v non-mezodermální buňky, jako jsou buňky svalové (myocyty), srdeční (kardiomyocyty), cévní, nervové (neurony), jaterní (hepatocyty) a buňky ostrůvků pankreatu (3). Široké vlastnosti MSC lze využít v mnoha směrech v rámci klinické medicíny v léčbě degenerativních (4), metabolických (5) a autoimunitních one-mocnění (6–8). Jednou z oblastí, kde lze využít léčebný potenciál kmenových buněk, je oblast revmatologických onemocnění, která je diskutována dále.
MSC a kmenové buňky se obecně dělí dvěma různými způsoby: symetrickým a asymetrickým dělením. Při symetrickém dělení vznikají buňky, které jsou totožné. Jejich fenotyp může být jak kmenový, tak i diferencovaný. Asymetrické dělení vede ke vzniku dvou buněk odlišného fenotypu (3).
MSC mohou být derivované z kostní dřeně (9), skeletální svaloviny (10), tukové tkáně (11), zubní skloviny (dentální pulpy) (12), pupečníkového stromatu či krve (13), amniové tekutiny (14), placenty (14) a zřejmě i z mnoha dalších zdrojů. V těchto tkáních mají jiné fenotypy, odlišné funkční a sekreční vlastnosti, proto bylo doporučeno specifikovat ontogenetický původ zdrojové tkáně (15).
Životní cyklus MSC
Mechanismus přeměny MSC v jiný buněčný typ je v dnešní době stále předmětem studií. Diferenciace je dvoustupňová. V prvním kroku dochází k přeměně MSC na specifický progenitor a ve druhém kroku se diferencuje konkrétní buněčný typ. Tyto procesy jsou řízeny regulátory (16). Jedním z významných regulátorů je transformační růstový faktor (TGF) a jeho podtypy – TGF-ß1, TGF-ß2 a TGF-ß3, které se účastní regulace buněčné proliferace, diferenciace a embryonálního vývoje. Dále je důležitý FGF (fibroblastový růstový faktor), PDGF (destičkový růstový faktor), EGF (epidermální růstový faktor) a IGF (inzulinu podobný růstový faktor) (17). Do procesu se zapojují také transkripční faktory, které iniciují a podporují přeměnu buněk. Významným faktorem podílejícím se na diferenciaci MSC jsou také tzv. mikroRNA, malé nekódující RNA, které se podílejí na regulaci buněčného cyklu, signalizace, stárnutí a apoptózy (18). Indukci diferenciace buněk mohou vyvolat i faktory chemické (např. dexametason) nebo faktory fyzikální (membránový potenciál) (19). Tyto faktory společně s prostředím určují, zda se MSC diferencují v adipocyt, osteocyt či jiný buněčný typ buňky.
Byly provedeny studie zaměřené na vliv stárnutí organismu na mezenchymální kmenové buňky. Ukazatelem pro hodnocení bylo nejenom snížení počtů buněk a snížení jejich proliferační a diferenciační kapacity, ale také změny na buňkách způsobené oxidačním stresem (20). U povrchových markerů, např. CD44, CD90 nebo CD105, se jejich exprese s věkem nemění, ale např. proliferace se s věkem snižuje (21). U mladších jedinců růstová křivka klesá konstantně, kdežto u buněk odebraných z dospělých jedinců není změna proliferace tak výrazná. To je samozřejmě stav při kultivaci in vitro. Při in vivo hodnocení životnosti buněk je nutné brát v úvahu více faktorů u daného jedince (22). U starších buněk také dochází ke zvýšení exprese p53 a p21, množství volných kyslíkových radikálů, oxidu dusnatého a také k apoptóze (23).
Obr. 1. Schéma diferenciace mezenchymální kmenové buňky v adipocyt, chondrocyt a osteocyt, se znázorněním jednotlivých indukujících a transkripčních faktorů. Dole pod šipkami je uveden způsob identifikace buněk
(upraveno podle/zdroj obrázku: Bobis S, Danuta J, Majka M. Mesenchymal stem cells: characteristics and clinical applications. Folia Histochem Cytobiol 2006; 44: 215–230).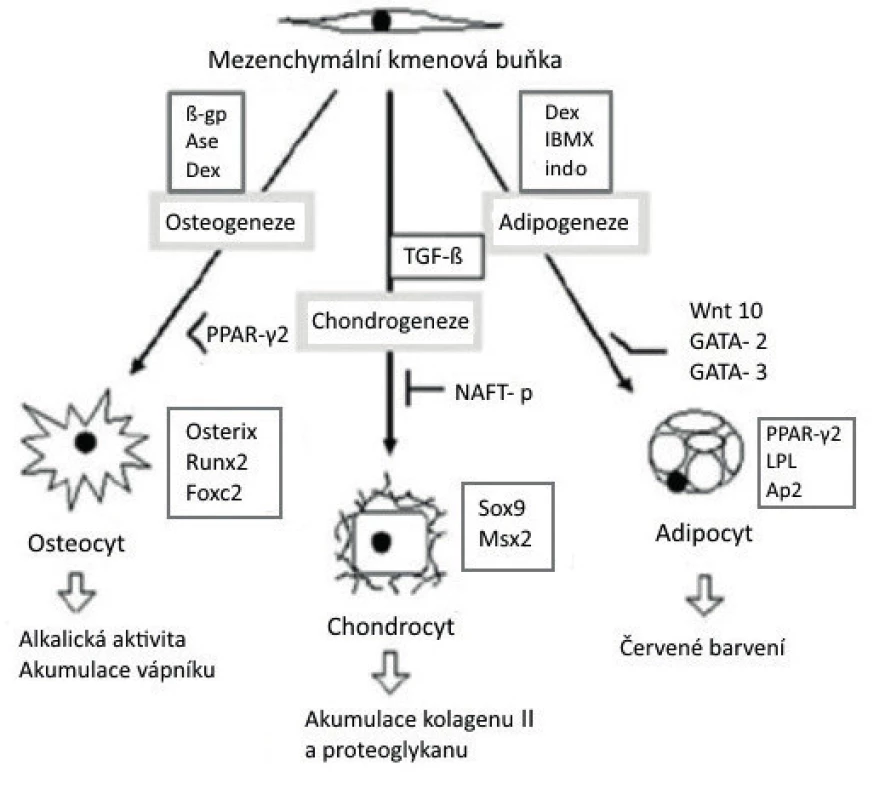
ß-gp – beta-glycerol-fosfatáza, Ase – kyselina askorbová, Dex – dexametason, IBMX – isobutylmethylxantin, indo – indomethacin, TGF-ß – transformující růstový faktor, PPAR- γ2 – peroxisom-proliferační a aktivující faktor, NAFT-p – nukleární faktor aktivace T-buněk, LPL – lipoprotein-lipáza, Ap-2 – protein vázaný na mastnou kyselinu, Wnt 10 – Wnt protein, GATA-2 a 3 – transkripční faktory GATA, Sox-9 – transkripční faktor, Runx2 – Runt-related transkripční faktor, Foxc-2 – Forkhead protein C2, Osterix – transkripční faktor Sp7 Molekulární podstata mechanismu působení MSC v organismu
Působení mezenchymálních kmenových buněk v organismu lze rozdělit na dva hlavní mechanismy.
První mechanismus působení je založený na funkční integraci diferencovaných či nediferencovaných MSC do postižené tkáně po transplantaci orgánu. Tento mechanismus byl prokázán při regeneraci jater po částečné hepatektomii či po toxickém poškození jater u myší, kdy nastala dlouhodobá funkční integrace MSC do jaterní tkáně (24, 25).
Druhým mechanismem, který hraje významnou roli v regeneraci a imunitním systému organismu, je parakrinní nebo buněčná podpora sebeobnovy postižené tkáně či orgánu (26, 27). Právě parakrinní funkce je důležitou vlastností MSC zajišťující sekreci cytokinů, chemokinů a růstových faktorů. Tyto látky následně ovlivňují mikroprostředí a buněčnou dynamiku a společně s lokálními stimuly mají zřejmě vliv na regeneraci tkání a podporu hojení (16). Mezi faktory produkované MSC patří interleukiny (IL-6, IL-8), transformační růstový faktor (TGF-β), inhibitor metalopeptidázy (TIMP-2), fibronektin, periostin, kolagen, vaskulární endoteliální růstový faktor (VEGF), stimulační faktor kolonií granulocytů a makrofágů (GM-CSF) a další (17). Tyto faktory se podílejí na další významné vlastnosti MSC, imunomodulaci, buď inhibicí složek imunitního systému, nebo přímou produkcí imunosupresivních látek. Imunosuprese je založena na potlačení funkce a sekrece T - a B-lymfocytů, dendritických buněk, makrofágů a NK-buněk, a dále na indukci T-regulačních buněk (Treg) (28).
Způsob, jakým MSC cílí na buňky v organismu, je předmětem mnoha studií, ale dostupné informace jsou stále nedostačující, zejména v oblasti vlivu MSC na buněčný cyklus a metabolismus. Tyto poznatky jsou však nutné k zjištění potencionálních nepříznivých účinků v léčbě onkologických onemocnění (29) nebo nemocí asociovaných s chronickým zánětem a metabolickými poruchami, jako je diabetes mellitus 2. typu (30, 31).
ZDROJE MEZENCHYMÁLNÍCH KMENOVÝCH BUNĚK
Kritéria pro izolaci MSC v laboratorních podmínkách byla definována v roce 2006 International Society for Cellular Therapy a stanovují tři základní požadavky. Prvním je, že MSC musí adherovat na plastik za standardních kultivačních podmínek. MSC musí také vykazovat membránovou expresi povrchových markerů CD105, CD90, a CD73 a nízkou expresi MHC molekul I. třídy. Naopak membránová exprese CD11b, CD14, CD19, CD34, CD45, CD79a a HLA-DR markerů nesmí být přítomna. V neposlední řadě musí MSC být schopné diferenciace do osteoblastů, chondrocytů a adipocytů (2).
Tyto kritéria však nejsou dostačující a je nutná jejich revize, jelikož se ukazuje, že stanovené povrchové markery pro MSC se mohou v závislosti na prostředí měnit (32–34). Uvedená kritéria vedou k získávání heterogenních, neklonogenních kultur buněk s různými diferenciačními vlastnostmi. Bylo však prokázáno jejich terapeutické využití u různých onemocnění (35).
Kostní dřeň
Kostní dřeň je významným zdrojem hematopoetických a nehematopoetických (mezenchymálních) kmenových buněk. Skládá se z prostorové sítě retikulárního vaziva, makrofágů a krevních vlásečnic. V okách sítě se nacházejí hematopoetické a mezenchymální kmenové buňky, jejichž množství se v průběhu života v kostní dřeni mění. V dospělé kostní dřeni tvoří MSC jen malou část buněk, přibližně 1 : 106 buněk u 80letého člověka. U novorozenců je poměr MSC : celkový počet buněk kostní dřeně 1 : 104 a ve druhém trimestru těhotenství je dosahováno hodnot 1 : 400 (19). Mezenchymální kmenové buňky vznikají v primitivním periostu vyvíjejících se kostí a přes formující se cévy migrují do nitra kostí, kde proliferují a stávají se prekurzory (36). Kostní dřeň možné odebrat z pánevních kostí a sterna.
Tuková tkáň
Tuková tkáň obsahuje heterogenní skupinu buněk (endoteliální progenitorové buňky, leukocyty, svalové buňky, endotelové buňky a MSC). Ty se pravděpodobně v tukové tkáni diferencují z embryonálních laterálních destičkových mezenchymálních buněk zároveň společně s preadipocytem (37). V dospělosti se nacházejí především v bílém subkutánním tuku, v menší míře ve viscerálním tuku. Tuková tkáň může být získána liposukcí.
Pupečník a pupečníková krev
Pupečník je tkáň obsahující pupečníkovou matrix chránící pupečníkové cévy. Z tkáně pupečníku a pupečníkové krve lze izolovat buňky vykazující vlastnosti mezenchymálních kmenových buněk (38). Ve srovnání s MSC z kostní dřeně mají MSC z pupečníkové krve i matrix, vyšší expresi nediferencovaných markerů lidských embryonálních kmenových buněk, jako jsou NANOG (Nanog Homeobox), DNMT3B (DNA Methyltransferase 3β) a GABRB3 (gamma aminobutyric acid type A receptor β3), a pluripotentních/kmenových buněčných markerů, a to jak v časných, tak v pozdních pasážích (39). Dále byly u MSC z pupečníkové matrix potvrzeny endodermální markery GATA-4 a HNF4 (Hepatocyte Nuclear Factor 4) a neuroektodermální markery GFAP (glial fibrillary acidic protein) a NSE (neuron-specific enolase) (40).
Vlastnosti MSC z pupečníkové krve i pupečníkové matrix jsou jinak podobné vlastnostem MSC z kostní dřeně (39). Je u nich potvrzena exprese CD44, CD73, CD90 a CD105 spolu s nepřítomností exprese endotelových/hematopoetických markerů (CD31, CD34, CD45, CD79) (40). Některé studie naznačují, že genomové mutace na chromozomální úrovni, které jsou běžně pozorovány v liniích embryonálních kmenových buněk (41), nejsou přítomné u MSC z pupečníku, které naopak vykazují vyšší chromozomální stabilitu (40). Pupečníková krev získaná z pupečníku a placenty je zdrojem nejen MSC, ale také hematopoetických kmenových buněk (HSC) (42). Mezenchymální kmenové buňky se v tkáni pupečníku vyskytují v množství od 10 000 MSC/ml (43), jsou naivní neovlivněné prostředím a stárnutím a mají mnohonásobně vyšší proliferační aktivitu (44).
Pupečníkovou krev lze po porodu uchovávat a následně využít buď autologně, tedy přímo pro dítě, při jehož porodu byla pupečníková krev odebrána, nebo může být použita pro jiného příjemce (alogenní aplikace).
Obr. 2. Schéma znázorňující vývojový a anatomický původ mezenchymálních kmenových buněk. Přerušované čáry naznačují možné spojení s pericyty
(upraveno podle/zdroj obrázku: Murray IR, West CC, Hardy RW, et al. Natural history of mesenchymal stem cells, from vessel walls to culture vessels. Cell Mol Life Sci 2014; 71(8): 1353–1374).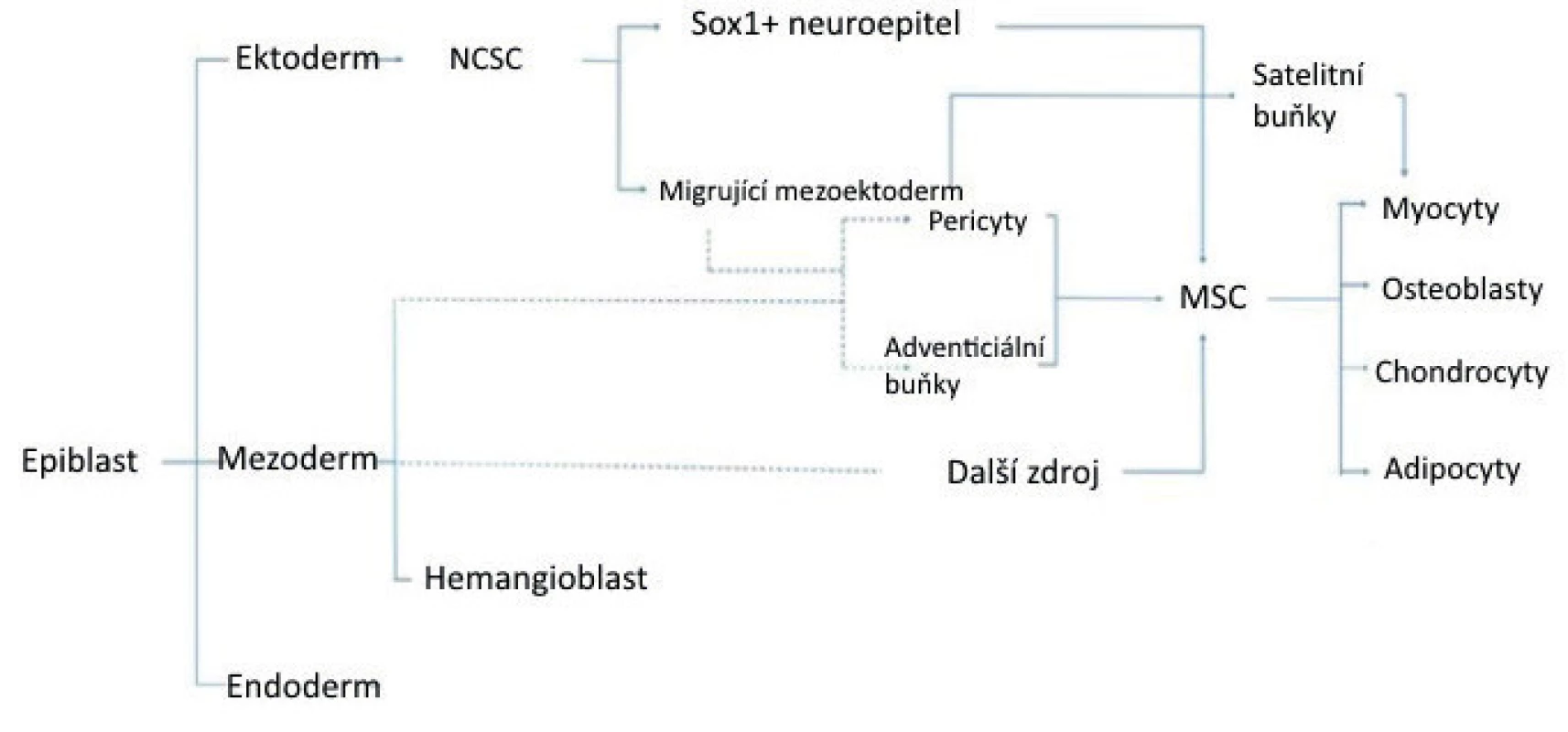
Sox1 – gen, který kóduje transkripční faktor ve vazebné doméně DNA HMG (skupina s vysokou pohyblivostí) a funguje primárně v neurogenezi, NCSC – kmenové buňky hřbetní struny Placenta
Placenta je orgán, který obsahuje MSC jak mateřského, tak fetálního původu. Buňky fetálního původu vykazují silnější imunomodulační účinky a lepší osteogenetický potenciál. Mají také vyšší hladiny HGF (jaterní růstový faktor) (45, 46). Výhodou placentárních mezenchymálních kmenových buněk je jejich snadný odběr.
Druhy mezenchymálních kmenových buněk
Kmenové buňky lze volně rozdělit do tří kategorií na základě období vývoje jedince (ontogeneze) během, kterého byly izolovány: embryonální, fetální a dospělé. Mezenchymální kmenové buňky lze získat ve fetálním období a z dospělého organismu.
Fetální mezenchymální kmenové buňky
Mohou být izolovány ze dvou odlišných zdrojů, vlastního plodu a podpůrných struktur (včetně amniotické membrány, plodové vody, Whartonova rosolu a placenty). Kmenové buňky získané z fetálních zdrojů jsou zvláště zajímavé vzhledem k jejich možnému klinickému využití. Vzhledem k možnosti využití těchto zdrojů je usnadněna izolace a eliminováno riziko pacienta. Navíc, vzhledem k poměrně velkému objemu odebraných fetálních tkání a snadnosti fyzické manipulace, je možné získat poměrně vysoký počet izolovaných kmenových buněk (47). Imunofenotyp fetálních MSC vědci potvrzují morfologií a povrchovými znaky těchto buněk. Oproti dospělým MSC mají větší proliferační kapacitu a delší telomery (48). Stejně jako dospělé buňky se mohou diferencovat do osteocytů, adipocytů a chondrocytů. Fetální MSC mají lepší proliferační aktivitu a jsou schopny až 70 dělení (dospělé buňky pouze 15 až 40 dělení) (49). Mají také lepší imunomodulační vlastnosti a méně exprimují molekuly HLA třídy I. než buňky dospělé (50). Při izolacích MSC v různých stupních gestace bylo zjištěno, že se množství MSC v krvi plodu časem zmenšuje a buňky jsou poté nalézány stále více v krvetvorných orgánech. Po 13. týdnu jsou MSC identifikovány v játrech a kostní dřeni plodu a velmi málo v krvi (51) plodu. MSC identifikované v prvním trimestru exprimují podobné markery a vykazují podobné vlastnosti jako dospělé MSC (48). Fetální kmenové buňky se po usazení v tkáních diferencují v buňky dané tkáně, nebo jsou progenitory dospělých MSC. Fetální MSC rovněž v průběhu těhotenství přestupují přes placentu a perzistují v těle matky celoživotně. Zpravidla se usídlují v kostní dřeni matky, kde proliferují, a následně opět vycestovávají do cílových tkání matky, kde se finálně diferencují a plní nejrůznější biologické funkce (50).
Obr. 3. ředpokládané mechanismy, které mohou vést ke zhoršené funkci kmenových buněk v důsledku stárnutí organismu a následný vznik onemocnění
(upraveno podle/zdroj obrázku: Ahmed ASI, HC Sheng MHC, Wasnik S, Baylink D, Lau KW. Effect of aging on stem cells. World J Exp Med 2017; 7(1)).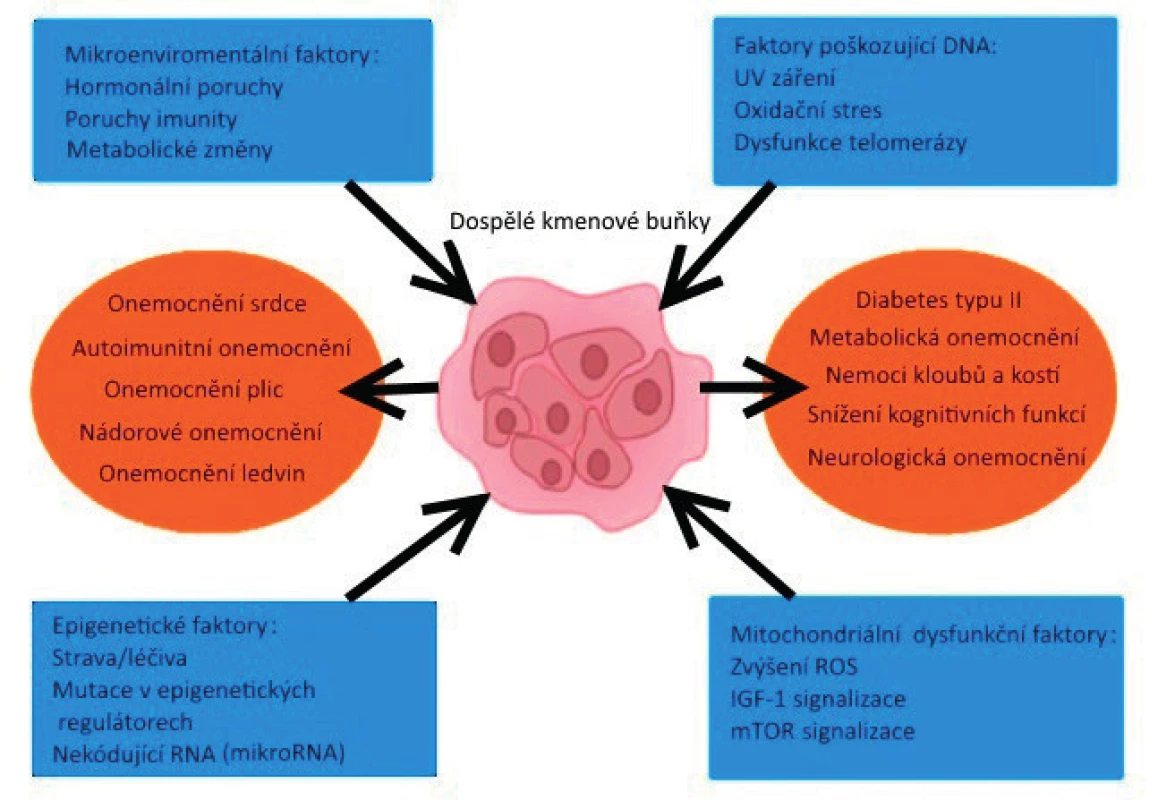
ROS – volné kyslíkové radikály, IGF-1 – inzulinu podobný růstový faktor, mTOR – mammalian target of rapamycin, serin/threoninová kináza, která se u eukaryotických organismů podílí na regulaci buněčného růstu, metabolismu a odpovědi na přítomnost živin, růstových faktorů či odpovědi na stres Dospělé (adultní) mezenchymální kmenové buňky
MSC se v plodu i v dospělosti objevují v mnoha orgánech a mají schopnost vycestovat do všech tkání. V některých studiích se objevil předpoklad původu mezenchymálních kmenových buněk mimo jiné i ve vaskulárních pericytech (52). Tato teorie není zcela potvrzená, ale přibližuje vědce k pochopení vzniku a aspektů distribuce MSC v těle. Je založená na faktu, že pericyty mají podobné vlastnosti a markery jako mezenchymální kmenové buňky.
Využití MSC v léčbě onemocnění
Možnost využití mezenchymálních kmenových buněk je podpořena jejich schopností migrace a „homingu“, tedy vycestováním a usazením do poškozené tkáně v reakci na signalizaci z poškozené tkáně, založené na interakci signalizačních molekul a receptorů na povrchu kmenové buňky. V případě poškození tkáně MSC nejdříve adherují k vaskulárnímu endotelu a následně projdou endoteliální bariérou procesem zvaným transendoteliální migrace (3, 16, 53).
Při lokální aplikaci MSC se vyskytuje minimum vedlejších nežádoucích účinků. V případě autologní aplikace se jedná o pacientovy vlastní MSC, důležité je však zvolit vhodné nosné médium. Nejvhodnější je autologní plazma. V případě alogenní aplikace se sice jedná o dárcovské buňky, avšak díky absenci exprese molekul MHC třídy II. u mezenchymálních kmenových buněk nenastává nežádoucí imunitní reakce (54). V případě intravenózního podání jsou rizika spojená především se způsobem aplikace – MSC mají tendenci se shlukovat, je tedy nutné zvolit optimální postup, aby nedošlo k ucpání cév, zejména jedná-li se o aplikaci do malých žil. Proto se, pokud je to možné, doporučuje aplikace lokální. Důležitá je charakterizace imunofenotypu MSC prostřednictvím exprimovaných povrchových markerů a morfologie. Při vývoji léčivých přípravků je také zásadní vyšetření karyotypu (karyotypizace), tumorogenicity (viz dále), toxicity (jak vysoká dávka může být pro organismus nějakým způsobem nebezpečná) a schopnost in vitro diferenciace (55).
Momentálně probíhá kolem 500 klinických studií léčby mezenchymálními kmenovými buňkami (dle serveru ClinicalTrials.gov (56)), nejvíce ve fázi II, ve které se hodnotí účinnost léčby MSC na menší skupině pacientů.
Využití MSC v revmatologii
Z výše uvedeného vyplývají možné výhody mezenchymálních kmenových buněk pro použití v humánní medicíně. Jejich schopnost diferenciace a imunomodulace se může uplatnit při léčbě kloubních degenerativních onemocnění nebo autoimunitních chorob (57, 58).
Podstata působení MSC v léčbě autoimunitních onemocnění je velmi rozsáhlá. MSC podporují polarizaci monocytů a makrofágů k protizánětlivému působení (sekrece IL-10 a inhibice sekrece IL-12, TNF-α a IL-17) a inhibici diferenciace na dendritické buňky (59). Dále podporují aktivaci T-regulačních buněk. Makrofágy stimulované MSC uvolňují TGF-β1, a mohou tak přispět k podpoře formace T-regulačních buněk (60). MSC také potlačují migraci a maturaci dendritických buněk (61). V přítomnosti MSC mají dendritické buňky menší schopnost indukce proliferace CD4+ T-lymfocytů a sekrece IL-10 (62). MSC také suprimují proliferaci T-buněk (CD4+ a CD8+) a podporují vznik regulačních T - i B-buněk (63). Působení MSC na B-buňky je zprostředkováno spíše buněčným kontaktem než parakrinní sekrecí (64, 65). MSC jsou také silným inhibitorem NK-buněk (66). Existují důkazy o efektu MSC na NK-buňky zprostředkovaným prostaglandinem E2 (PGE2), TGF-β, IL-6 a oxidem dusnatým (67, 68).
Osteoartróza (OA)
Jednou z oblastí využití léčebného postupu pomocí MSC je léčba osteoartrózy, kdy se buňky po aplikaci do místa poškození dále množí (z jedné mezenchymální kmenové buňky vznikne vždy jedna kmenová a jedna diferencovaná) a diferencují do chondrocytů. Většina MSC aplikovaných do kloubu migruje k synoviální membráně. Poté si zachovávají své vlastnosti bez diferenciace do jiné linie alespoň 28 dní (69). Mezitím vylučují trofické faktory, například PRG-4 (proteoglycan 4), BMP (kostní morfogenetický protein, bone morphogenetic protein) a TSG-6 (tumor necrosis factor-inducible gene 6), což jsou klíčové faktory pro chondroprotekci a imunosupresi (70). Chondrogeneze je zprostředkována signalizačními cestami MAP-kinázy a Wnt (Wingless/Int-1). Exprese kolagenu typu II. a proteoglykanů byla v in vitro chondrocytech diferencovaných z MSC prokázána na podobné úrovni, jako v dospělých chondrocytech (71). V rané fázi poškození chrupavky intraartikulárně aplikované MSC mohou migrovat do chondrálního defektu a regenerovat nově vznikající chrupavkovou tkáň, zatímco většina reziduálních MSC migruje do kloubní synovie a produkuje trofické faktory, které mají chondroprotektivní a imunosupresivní efekt (72).
Nedávno byly publikovány výsledky studie léčby osteoartritidy kolenního kloubu pomocí autologních mezenchymálních kmenových buněk (4). Jednalo se o dvojitě zaslepenou, randomizovanou studii s použitím placeba jako kontroly, provedenou u 24 pacientů, kteří byli po léčbě sledováni 6 měsíců. Pacienti byli posuzování klinicky dle Knee Injury and Osteoarthritis Outcome Score (KOOS) (73), Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC) (74) a zhodnocení bolesti při fyzickém cvičení. Radiologicky bylo stadium OA posouzeno pomocí magnetické rezonance dle Kellgren-Lawrence skóre (75). Dvanácti pacientům byly aplikovány MSC z tukové tkáně v dávce 1krát 108 ve 3 ml fyziologického roztoku do kolenních kloubů pod kontrolou ultrasonografické sondy. Kontrolní skupině (n = 12) byl aplikován pouze fyziologický roztok. Po 6 měsících sledování bylo shledáno zlepšení u většiny sledovaných parametrů ve skupině léčené pomocí MSC. V celkovém WOMAC skóre se jednalo o 55% zlepšení, v hodnocení bolesti o 95% zlepšení a kulhání se zlepšilo u 54 % pacientů. Ve skupině s placebem byl zaznamenán zanedbatelný rozdíl oproti stavu před léčbou. Autoři sami uznávají limitaci své studie, které tkví v malém počtu pacientů zařazených do studie a v krátké době sledování. Nicméně se jednalo o klinické hodnocení ve fázi II, v němž bylo dosaženo úspěšného výsledku.
Následovala studie s delší dobou sledování (76), které se zúčastnily tři skupiny pacientů, z nichž jedna skupina (n = 16) byla léčena pomocí autologních MSC z kostní dřeně v PBS, druhá skupina (n = 14) MSC společně s autologní destičkovou plazmou (platelet-rich plasma, PRP) a třetí skupina (n = 17) kortikosteroidy (4 mg dexamethason). Dávka MSC byla v obou případech zvolena 40krát 106. Pacienti byli posuzováni pomocí KOOS skóre 72 a rozsahu pohybu (range of motion – ROM) (77) po 1, 2, 3, 6, 9 a 12 měsících a stanovením cytokinů (IL-17A, IFN-γ, IL-10, TNF, IL-6, IL-4, a IL-2) v synoviální tekutině po 6 a 12 měsících. Výsledky ukazují na zlepšení v KOOS skóre i ROM u všech skupin již po 1 měsíci, avšak po 12 měsících vykazují zlepšení v těchto parametrech pouze skupiny léčené MSC a MSC+PRP. Vyšší procento zlepšení bylo zaznamenáno u skupiny MSC+PRP. U všech skupin došlo ke snížení IL-10 do 12 měsíců, u skupiny léčené kortikosteroidy kleslo také množství IL-17A. U ostatních cytokinů nebyl signifikantní rozdíl v porovnání s hladinami před léčbou. Limitací studie byla nepřítomnost kontrolní skupiny a nedostatečné zhodnocení účinku léčby, bylo by vhodné provést také např. magnetickou rezonanci nebo biopsii chrupavky. Studie však poukazuje na možnost využití mezenchymálních kmenových buněk v kombinaci s plazmou bohatou na destičky v terapii osteoartritidy.
Revmatoidní artritida
Velkým přínosem mohou být mezenchymální kmenové buňky v léčbě revmatoidní artritidy (RA). Některé studie se zabývají vlivem MSC na modulaci aktivity a proliferace různých subpopulací T-lymfocytů a B-lymfocytů (78, 79). Revmatoidní artritida může být podmíněna geneticky, hlavním faktorem jsou variace v hlavním histokompatibilitním komplexu (80). Ten zahrnuje mimo jiné vysoce polymorfní leukocytární antigen (HLA) I. třídy a II. třídy, přičemž molekuly HLA II. třídy prezentují antigen CD4+ T-buňkám. Bylo prokázáno, že některé alely HLA-DRB1 lokusu predisponují k výskytu revmatoidní artritidy a vysvětlují 30–40% genetické riziko tohoto onemocnění (81).
Kromě genetických předpokladů ovlivňuje vznik onemocnění prostředí a další vnější faktory (infekční agens, kouření atd.). Revmatoidní artritida je charakterizována synoviálním zánětem v kloubech, jejich otokem, produkcí autoimunitních protilátek (revmatoidní faktor a anti-citrulinové protilátky – ACPA), destrukcí chrupavky a kosti a případnými systémovými projevy (82). Uvádí se, že 43–65 % ACPA-pozitivních pacientů jsou pozitivní na alfa-enolázu, která je silně asociovaná právě s rizikovými alelami HLA-DRB1 lokusu a kouřením (83). Do patogeneze onemocnění jsou dále zapojeny B-buňky a dendritické buňky a mnoho dalších faktorů, což dokazuje, že revmatoidní artritida je velmi komplexní onemocnění, jehož patogeneze není ještě zcela prozkoumána (84).
Klasickou léčbou RA jsou zpravidla tzv. chorobu modifikující léky (DMARD). Kombinace DMARD+MSC z pupečníkové krve byla aplikována 136 pacientům s revmatoidní artritidou (85). Kontrolní skupinu tvořilo 36 pacientů léčených pouze DMARD. Výsledky ukázaly signifikantní zlepšení klinických příznaků dle American College of Rheumatology Response Criteria (86), u pacientů léčených kombinací DMARD+MSC. Dále u těchto pacientů došlo ke snížení TNF-α a IL-6 v krevním séru a zvýšil se procentuální podíl T-regulačních buněk v periferní krvi v rozmezí od 3 do 6 měsíců po aplikaci.
V další studii byly 46 pacientům s refrakterní RA aplikovány intravenózně alogenní MSC z tukové tkáně (6). V této studii byli pacienti rozděleni do tří skupin, v závislosti na dávce aplikovaných mezenchymálních kmenových buněk (1 mil./kg, 2 mil./kg, 4 mil./kg). Čtvrtá skupina sedmi pacientů dostala placebo. MSC byly podávány pouze intravenózně a cílem studie bylo především ověřit bezpečnost podávání a možné nežádoucí účinky jednotlivých dávek. Mimo to byl však také zaznamenán pozitivní účinek terapie dle skóre American College of Rheumatology Response Criteria (ACR) (86). Kritérii v tomto skóre jsou hodnocení zlepšení z pohledu pacienta a lékaře, míra bolesti, funkce kloubu a hladina proteinů akutní fáze.
Míra zlepšení je dle ACR vyjadřována procentuálně jako 20% (ACR20), 50% (ACR50) a 70% (ACR70) zlepšení (alespoň ve třech kritériích) oproti původnímu stavu. V 1. měsíci od aplikace bylo zaznamenáno zlepšení ACR20 u 15 pacientů léčených MSC a u dvou pacientů léčených placebem, zlepšení ACR50 uvádělo pět pacientů po aplikaci MSC a jeden pacient po aplikaci placeba a dva pacienti po aplikaci MSC dosáhli dokonce zlepšení ACR70 (6).
Systémový lupus erythematodes
Dalším zkoumaným onemocněním je systémový lupus erythematodes (SLE). Jedná se o chronické autoimunitní zánětlivé onemocnění se širokým spektrem klinických a sérologických projevů způsobených produkcí autoprotilátek, aktivací komplementu a ukládáním imunitních komplexů. Etiopatogeneze SLE není zcela jasná, ale předpokládá se, že je výsledkem složité interakce mezi genetickými, hormonálními a environmentálními faktory (87). Nejčastějšími autoprotilátkami podílející se na patogenezi SLE jsou protilátky cílené proti jaderné složce buněk (ANA), např. autoprotilátky proti DNA (jednořetězcové a dvouřetězcové), histonům, SSA/Ro, SSB/La, a RNP (jaderný ribonukleoprotein). Dále se uplatňují autoprotilátky proti složkám komplementového systému (anti-C1q), cytoplazmatickým molekulám, endoteliálním membránovým antigenům a interferonu α (88).
Genomové asociační studie odhalily přibližně 30 až 40 rizikových genových polymorfismů, které predisponují k SLE. Největší riziko ve všech genomových asociačních studiích se týkalo hlavního histokompabilitního komplexu, který obsahuje geny pro molekuly HLA třídy I (A, B a C) a HLA třídy II (DR, DQ a DP) (89). Největší riziko rozvoje SLE bylo dle studií asociováno s rizikovými alelami HLA třídy II, PTPN22 (protein tyrosine phosphatase, non-receptor type 22), STAT4 (signal transducer and activator of transcription 4), IRF5 (interferon regulatory factor 5), BLK (tyrosine-protein kinase Blk), ITGAM (integrin alpha M) a TNFAIP3 (tumor necrosis factor, alpha-induced protein 3) (90). Účast na vzniku onemocnění má produkce autoreaktivních dendritických buněk a stimulace proliferace autoreaktivních T - a B-buněk s produkcí prozánětlivých cytokinů, především interferonu α. Z dalších faktorů podporují vznik onemocnění faktory hormonální (např. hormony štítné žlázy) nebo environmentální (viry, UV záření, některé medikamenty) (88).
Byla provedena studie hodnotící efektivitu a bezpečnost intravenózní aplikace alogenních mezenchymálních kmenových buněk z pupečníku u 16 pacientů se závažnou a/nebo refrakterní formou SLE (8). Hodnocenými parametry bylo SLEDAI skóre (SLE Disease Activity Index, míra aktivity SLE onemocnění) (91), hladina anti-nukleárních protilátek (ANA), albuminu a C3 komplementu v séru a renální funkce. Ve všech těchto parametrech bylo pozorováno zlepšení už po 1 měsíci po aplikaci MSC. Podobná, rozsáhlejší studie s 58 pacienty s refrakterní formou SLE s cílem zhodnotit terapeutický výsledek s ohledem na počet aplikací MSC (jedna a/nebo dvě aplikace MSC) a velikost dávky byla provedena o něco později (92). Pozitivních výsledků bylo dosaženo už po jediné aplikace MSC v dávce 1 milion buněk/kg váhy. Tato dávka postačovala k navození remise u pacientů s refrakterním SLE onemocněním (92).
Psoriáza
Psoriáza je chronické zánětlivé onemocnění s různými dermatologickými projevy. Přibližně u 90 % případů je diagnostikována psoriáza vulgaris. Klasickými klinickými projevy jsou ostře ohraničené erytematózní pruritické plaky, které mohou pokrývat různě velké plochy kůže. Nejčastěji jsou postiženy povrchy končetin a pokožka hlavy (93). Charakteristickým znakem psoriázy je trvalý zánět, který vede k nekontrolované proliferaci keratinocytů a jejich dysfunkční diferenciaci. Za vývoj a udržení psoriatického zánětu jsou odpovědné poruchy vrozené a adaptivní kožní imunitní odpovědi, zprostředkované pomocnými T-buňkami (93, 94).
Patogeneze psoriázy zahrnuje interakci genetických, imunologických a environmentálních faktorů. Komplexní etiopatogeneze onemocnění vede k různým klinickým projevům s proměnlivým a nepředvídatelným průběhem. Psoriáza může být v 10–30 % případů doprovázena psoriatickou artritidou (95). Dědičnost u psoriázy se odhaduje na 60–90 % (96, 97). Geny spojené s rozvojem psoriázy představují především geny specifické pro kůži a geny vrozené a adaptivní imunity (95). Byla identifikována řada polymorfismů, z nichž významné jsou mutace v genech Th2-buněk, T-regulačních buněk a Th1/Th17-buněk, které jsou zodpovědné za produkci cytokinů účastnících se v patogenezi onemocnění (98, 99).
Běžnou léčbou jsou celková imunosupresiva, lokální steroidní a vitaminové krémy (vitamin D3) nebo terapie UV zářením. Mezenchymální kmenové buňky díky výše uvedeným účinkům na T-buňky a parakrinní sekreci mohou být také experimentálně použity v léčbě psoriázy (100).
V následující studii byl léčen 38letý pacient s lupenkou trvající 2 roky s projevy kožních příznaků především na hlavě (99). Jeho příznaky byly hodnoceny dle Psoriasis Scalp Severity Index (PSSI) (101), který hodnotí procentuální rozsah a vážnost kožních příznaků. Byly použity mezenchymální kmenové buňky z tukové tkáně zdravého dárce, ze kterých po standardní izolaci a kultivaci, bylo vytvořeno kondiciované médium (obsahující faktory z buněk, ale ne buňky samotné). Médium bylo aplikováno topicky jednou denně po dobu 1 měsíce. Stupeň onemocnění se začal snižovat již během 2 týdnů a PSSI kleslo z 28 na 0 za 1 měsíc. Kompletní regrese nastala během 6 měsíců, během nichž nebyly podávány žádné jiné léky a nebyl zaznamenán žádný vedlejší účinek léčby (99).
Vliv MSC na rozvoj nádorových onemocnění
V posledních letech vzrostl počet studií zabývajících se vlivem MSC na rozvoj nádorových onemocnění (102–106). Vědci se domnívají, že MSC podporují angiogenezi (102, 103) a tvorbu nádorově asociovaných fibroblastů podporujících růst a šíření nádoru (104–106). Tedy aplikace buněk s těmito vlastnostmi může vést k rozvoji nádorového onemocnění. Prostředí, ve kterém se tumor nachází, sestává kromě nádorových buněk dále z endoteliálních buněk, fibroblastů, MSC a dalších prozánětlivých buněčných typů (107).
Na základě chemotaktických gradientů (cytokinů či chemokinů), které jsou produkované nádorem, migrují MSC přímo do mikroprostředí nádoru. Zde interagují s nádorovými buňkami pomocí mezerových spojů (gap junctions), mezibuněčných spojení propojujících cytoplazmu sousedních buněk, nebo pomocí rozpustných molekul, jako jsou chemokiny, cytokiny, růstové faktory, metabolity, proteolytické enzymy a také miRNA (108). MSC mohou také modulovat imunitní odpověď regulací proliferace různých imunitních buněk. Tyto buňky jsou důležité pro udržování tolerance k vlastním buňkám a imunitní homeostázy. MSC tak mohou přispívat k růstu nádoru a jeho progresi (109, 110).
V současnosti nejsou známy případy vzniku nádorových onemocnění po experimentálním podání MSC během klinických studií. Naopak některé studie naznačují, že MSC mají inhibiční efekt na vznik nádoru, ale oproti velkému počtu studií, které prokazují stimulační efekt MSC na vznik nádoru, je počet těchto studií zatím nedostatečný (111–115). Pro zhodnocení rizika spojeného s léčbou pomocí MSC je tedy nutné provést další výzkum k potvrzení nebo vyvrácení této skutečnosti.
Výhody a nevýhody terapie pomocí MSC
Mezenchymální kmenové buňky si již našly své místo v léčbě mnohých onemocnění. Jejich schopnost diferenciace a imunomodulace se může uplatnit při léčbě kloubních degenerativních onemocnění nebo autoimunitních revmatických chorob (57, 58). Jejich léčebné vlastnosti se již běžně využívají ve veterinární medicíně, a to při léčbě kloubních onemocnění u psů (72, 116), nemocí pohybového aparátu u koní (117, 118) a alergií a autoimunitních onemocnění u koček (119, 120). Zdrojem kmenových buněk může být buď pacientova vlastní kostní dřeň či tuková tkáň, nebo jsou také využívány allogenní buňky od dárce. Velmi dobrým zdrojem je pupečníková krev, kterou lze uložit do banky pupečníkové krve a použít v případě potřeby. Po standardní kultivaci se kmenové buňky aplikují nejčastěji intravenózně nebo lokálně, přímo do postižené tkáně (např. do kloubu).
Dosavadní studie poukazují na skutečnost, že léčba pomocí MSC může být využita i v léčbě revmatických onemocnění u lidí. Výhodou této terapie je především její bezpečnost a efektivita. Nevýhodou jsou především legislativní omezení či absence standardizace procesů pro klinické použití v běžné praxi.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MVDr. Lucie Formanová
Medicínské centrum Praha
Mezi Vodami 205/29, 143 00 Praha 4
e-mail: lucie.formanova@mc-praha.cz
Zdroje
1. Tuch BE. Stem cells – a clinical update. Aust Fam Physician 2006; 35 : 719–721.
2. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy 2006; 8 : 315–317.
3. Chamberlain G, Fox J, Ashton B, Middleton J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells Dayt 2007; 25 : 2739–2749.
4. Lee WS, Kim HJ, Kim KI, Kim GB, Jin W. Intra-articular injection of autologous adipose tissue-derived mesenchymal stem cells for the treatment of knee osteoarthritis: a phase IIb, randomized, placebo-controlled clinical trial. Stem Cells Transl Med 2019; 8 : 504–511.
5. Cho J, D’Antuono M, Glicksman M, Wang J, Jonklaas J. A review of clinical trials: mesenchymal stem cell transplant therapy in type 1 and type 2 diabetes mellitus. Am J Stem Cells 2018; 7 : 82–93.
6. Álvaro-Gracia JM, Jover JA, García-Vicuña R, Carreño L, Alonso A, Marsal S, et al. Intravenous administration of expanded allogeneic adipose-derived mesenchymal stem cells in refractory rheumatoid arthritis (Cx611): results of a multicentre, dose escalation, randomised, single-blind, placebo-controlled phase Ib/IIa clinical trial. Ann Rheum Dis 2017; 76 : 196–202.
7. Cuascut FX, Hutton GJ. Stem Cell-Based Therapies for Multiple Sclerosis: Current Perspectives Biomedicines 2019; 7(2): 26.
8. Sun L, Wang D, Liang J, Zhang H, Feng X, Wang H, et al. Umbilical cord mesenchymal stem cell transplantation in severe and refractory systemic lupus erythematosus. Arthritis Rheum 2010; 62 : 2467–2475.
9. Kingery MT, Manjunath AK, Anil U, Strauss EJ. Bone marrow mesenchymal stem cell therapy and related bone marrow-derived orthobiologic therapeutics. Curr Rev Musculoskelet Med 2019; 12(4): 451–459.
10. Williams JT, Southerland SS, Souza J, Calcutt AF, Cartledge RG. Cells isolated from adult human skeletal muscle capable of differentiating into multiple mesodermal phenotypes. Am Surg 1999; 65 : 22–26.
11. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng 2011; 7 : 211–228.
12. Gancheva MR, Kremer KL, Gronthos S, Koblar SA. Using dental pulp stem cells for stroke therapy. Front Neurol 2019; 10 : 422.
13. Erices A, Conget P, Minguell JJ. Mesenchymal progenitor cells in human umbilical cord blood. Br J Haematol 2000; 109 : 235–242.
14. Piskorska-Jasiulewicz MM, Witkowska-Zimny M. Perinatal sources of stem cells. Postepy Hig Med Dosw (Online) 2015; 69 : 327–334.
15. Viswanathan S, Shi Y, Galipeau J, Krampera M, Leblanc K, Martin I, et al. Mesenchymal stem versus stromal cells: International Society for Cell & Gene Therapy (ISCT®) Mesenchymal Stromal Cell committee position statement on nomenclature. Cytotherapy 2019; 21 : 1019–1024.
16. Squillaro T, Peluso G, Galderisi U. Clinical trials with mesenchymal stem cells: an update. Cell Transplant 2016; 25 : 829–848.
17. Ullah I, Subbarao RB, Rho GJ. Human mesenchymal stem cells – current trends and future prospective. Biosci Rep 2015; 35: e00191.
18. Li N, Long B, Han W, Yuan S, Wang K. MicroRNAs: important regulators of stem cells. Stem Cell Res Ther 2017; 8 : 110.
19. Kern S, Eichler H, Stoeve J, Klüter H, Bieback K. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue. Stem Cells 2006; 24 : 1294–1301.
20. Yang YHK. Aging of mesenchymal stem cells: Implication in regenerative medicine. Regen Ther 2018; 9 : 120–122.
21. Stolzing A, Jones E, McGonagle D, Scutt A. Age-related changes in human bone marrow-derived mesenchymal stem cells: consequences for cell therapies. Mech Ageing Dev 2008; 129 : 163–173.
22. Ahmed ASI, Sheng MH, Wasnik S, Baylink DJ, Lau KHW. Effect of aging on stem cells. World J Exp Med 2017; 7 : 1–10.
23. Alt EU, Senst C, Murthy SN, Slakey DP, Dupin CL, Chaffin AE, Kadowitz PJ, et al. Aging alters tissue resident mesenchymal stem cell properties. Stem Cell Res 2012; 8 : 215–225.
24. Kuo TK, Hung SP, Chuang CH, Chen CT, Shih YR, Fang SC, Yang VW, et al. Stem cell therapy for liver disease: parameters governing the success of using bone marrow mesenchymal stem cells. Gastroenterology 2008; 134 : 2111–2121.
25. Aurich H, Sgodda1 M, Kaltwaßer P, Vetter M, Weise A, Liehr T, Brulport M, et al. Hepatocyte differentiation of mesenchymal stem cells from human adipose tissue in vitro promotes hepatic integration in vivo. Gut 2009; 58 : 570–581.
26. Konala VBR, Mamidi MK, Bhonde R, Das AK, Pochampally R, Pal R, et al. The current landscape of the mesenchymal stromal cell secretome: A new paradigm for cell-free regeneration. Cytotherapy 2016; 18 : 13–24.
27. Bruno S, Deregibus MC, Camussi G. The secretome of mesenchymal stromal cells: Role of extracellular vesicles in immunomodulation. Immunol Lett 2015; 168 : 154–158.
28. Kobolak J, Dinnyes A, Memic A, Khademhosseini A, Mobasheri A. Mesenchymal stem cells: Identification, phenotypic characterization, biological properties and potential for regenerative medicine through biomaterial micro-engineering of their niche. Methods 2016; 99 : 62–68.
29. Hernanda PY, Pedroza-Gonzalez A, van der Laan LJ, Bröker ME, Hoogduijn MJ, Ijzermans JN, et al. Tumor promotion through the mesenchymal stem cell compartment in human hepatocellular carcinoma. Carcinogenesis 2013; 34 : 2330–2340.
30. Dalal J, Gandy K, Domen J. Role of mesenchymal stem cell therapy in Crohn’s disease. Pediatr Res 2012; 71 : 445–451.
31. Katuchova J, et al. Mesenchymal stem cells in the treatment of type 1 diabetes mellitus. Endocr Pathol 2015; 26 : 95–103.
32. Simmons PJ, Torok-Storb B. CD34 expression by stromal precursors in normal human adult bone marrow. Blood 1991; 78 : 2848–2853.
33. Stagg J, Pommey S, Eliopoulos N, Galipeau J. Interferon-gamma-stimulated marrow stromal cells: a new type of nonhematopoietic antigen-presenting cell. Blood 2006; 107 : 2570–2577.
34. Romieu-Mourez R, François M, Boivin MN, Stagg J, Galipeau J. Regulation of MHC class II expression and antigen processing in murine and human mesenchymal stromal cells by IFN-gamma, TGF-beta, and cell density. J Immunol 2007; 179 : 1549–1558.
35. Galderisi U, Giordano A. The gap between the physiological and therapeutic roles of mesenchymal stem cells. Med Res Rev 2014; 34 : 1100–1126.
36. Krebsbach PH, Kuznetsov SA, Bianco P, Robey PG. Bone marrow stromal cells: characterization and clinical application. Crit Rev Oral Biol Med Off Publ Am Assoc Oral Biol 1999; 10 : 165–181.
37. Fraser JK, Wulur I, Alfonso Z, Hedrick MH. Fat tissue: an underappreciated source of stem cells for biotechnology. Trends Biotechnol 2006; 24 : 150–154.
38. Campagnoli C, Roberts IA, Kumar S, Bennett PR, Bellantuono I, Fisk NM. Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood, liver, and bone marrow. Blood 2001; 98 : 2396–2402.
39. Nekanti U, Rao VB, Bahirvani AG, Jan M, Totey S, Ta M. Long-term expansion and pluripotent marker array analysis of Wharton’s jelly-derived mesenchymal stem cells. Stem Cells Dev 2010; 19 : 117–130.
40. La Rocca G, Anzalone R, Corrao S, Magno F, Loria T, Lo Iacono M, et al. Isolation and characterization of Oct-4+/HLA-G+ mesenchymal stem cells from human umbilical cord matrix: differentiation potential and detection of new markers. Histochem Cell Biol 2009; 131 : 267–282.
41. Rebuzzini P, Neri T, Mazzini G, Zuccotti M, Redi CA, Garagna S. Karyotype analysis of the euploid cell population of a mouse embryonic stem cell line revealed a high incidence of chromosome abnormalities that varied during culture. Cytogenet Genome Res 2008; 121 : 18–24.
42. Nagamura-Inoue T, He H. Umbilical cord-derived mesenchymal stem cells: Their advantages and potential clinical utility. World J Stem Cells 2014; 6 : 195–202.
43. Vangsness CT, Sternberg H, Harris L. Umbilical cord tissue offers the greatest number of harvestable mesenchymal stem cells for research and clinical application: a literature review of different harvest sites. Arthroscopy 2015; 31 : 1836–1843.
44. Cardoso TC, Ferrari HF, Garcia AF, Novais JB, Silva-Frade C, Ferrarezi MC, et al. Isolation and characterization of Wharton’s jelly-derived multipotent mesenchymal stromal cells obtained from bovine umbilical cord and maintained in a defined serum-free three-dimensional system. BMC Biotechnol 2012; 12 : 18.
45. Zhu Y, et al. Placental mesenchymal stem cells of fetal and maternal origins demonstrate different therapeutic potentials. Stem Cell Res Ther 2014; 5 : 48.
46. Fukuchi Y, et al. Human placenta-derived cells have mesenchymal stem/progenitor cell potential. Stem Cells 2004; 22 : 649–658.
47. Marcus AJ, Woodbury D. Fetal stem cells from extra-embryonic tissues: do not discard. J Cell Mol Med 2008; 12 : 730–742.
48. Sagar R, Walther-Jallow L, David AL, Götherström C, Westgren M. Fetal mesenchymal stromal cells: an opportunity for prenatal cellular therapy. Curr Stem Cell Rep 2018; 4 : 61–68.
49. Götherström C, Westgren M, Shaw SW, Aström E, Biswas A, Byers PH, Mattar CN, et al. Pre - and postnatal transplantation of fetal mesenchymal stem cells in osteogenesis imperfecta: a two-center experience. Stem Cells Transl Med 2014; 3 : 255–264.
50. Hromadnikova I, Zlacka D, Hien Nguyen TT, Sedlackova L, Zejskova L, Sosna A. Fetal cells of mesenchymal origin in cultures derived from synovial tissue and skin of patients with rheumatoid arthritis. J Bone Spine Rev Rhum 2008; 75 : 563–566.
51. O’Donoghue K, Chan J. Human fetal mesenchymal stem cells. Curr Stem Cell Res Ther 2006; 1 : 371–386.
52. Murray IR, West CC, Hardy WR, James AW, Park TS, Nguyen A, Tawonsawatruk T. Natural history of mesenchymal stem cells, from vessel walls to culture vessels. Cell Mol Life Sci CMLS 2014; 71 : 1353–1374.
53. Chen Q, Shou P, Zheng C, Jiang M, Cao G, Yang Q, et al. Fate decision of mesenchymal stem cells: adipocytes or osteoblasts? Cell Death Differ 2016; 23 : 1128–1139.
54. Patel SA, Sherman L, Munoz J, Rameshwar P. Immunological properties of mesenchymal stem cells and clinical implications. Arch Immunol Ther Exp (Warsz) 2008; 56 : 1–8.
55. Ra JC, et al. Safety of intravenous infusion of human adipose tissue-derived mesenchymal stem cells in animals and humans. Stem Cells Dev 2011; 20 : 1297–1308.
56. Home – ClinicalTrials.gov. https://clinicaltrials.gov/
57. Luque-Campos N, Contreras-López RA, Jose Paredes-Martínez M, Torres MJ, Bahraoui S, Wei M, et al. Mesenchymal stem cells improve rheumatoid Arthritis progression by controlling memory T cell response. Front Immunol 2019; 10 : 798.
58. Chen W, Yu Y, Ma J, Olsen N, Lin J. Mesenchymal stem cells in primary Sjögren’s syndrome: prospective and challenges. Stem Cells Int 2018 : 4357865.
59. Deng Y, et al. Umbilical cord-derived mesenchymal stem cells instruct monocytes towards an IL10-producing phenotype by secreting IL6 and HGF. Sci Rep 2016; 6 : 37566.
60. Melief SM, et al. Multipotent stromal cells induce human regulatory T cells through a novel pathway involving skewing of monocytes toward anti-inflammatory macrophages. Stem Cells 2013; 31 : 1980–1991.
61. Zheng G, Huang R, Qiu G, Ge M, Wang J, Shu Q, et al. Mesenchymal stromal cell-derived extracellular vesicles: regenerative and immunomodulatory effects and potential applications in sepsis. Cell Tissue Res 2018; 374 : 1–15.
62. Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood 2005; 105 : 1815–1822.
63. Franquesa M, Mensah FK, Huizinga R, Strini T, Boon L, Lombardo E, et al. Human adipose tissue-derived mesenchymal stem cells abrogate plasmablast formation and induce regulatory B cells independently of T helper cells. Stem Cells 2015; 33 : 880–891.
64. Ge W, Jiang J, Arp J, Liu W, Garcia B, Wang H. Regulatory T-cell generation and kidney allograft tolerance induced by mesenchymal stem cells associated with indoleamine 2,3-dioxygenase expression. Transplantation 2010; 90 : 1312–1320.
65. Gieseke F, et al. Human multipotent mesenchymal stromal cells use galectin-1 to inhibit immune effector cells. Blood 2010; 116 : 3770–3779.
66. Weiss ARR, Dahlke MH. Immunomodulation by mesenchymal stem cells (MSCs): mechanisms of action of living, apoptotic, and dead MSCs. Front Immunol 2019; 10 : 1191.
67. Sato K, et al. Nitric oxide plays a critical role in suppression of T-cell proliferation by mesenchymal stem cells. Blood 2007; 109 : 228–234.
68. Spaggiari GM, Capobianco A, Abdelrazik H, Becchetti F, Mingari MC, Moretta L. Mesenchymal stem cells inhibit natural killer-cell proliferation, cytotoxicity, and cytokine production: role of indoleamine 2,3-dioxygenase and prostaglandin E2. Blood 2008; 111 : 1327–1333.
69. Centeno CJ, Busse D, Kisiday J, Keohan C, Freeman M, Karli D. Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells. Pain Physician 2008; 11 : 343–353.
70. van Buul GM, Siebelt M, Leijs MJ, Bos PK, Waarsing JH, Kops N, et al. Mesenchymal stem cells reduce pain but not degenerative changes in a mono-iodoacetate rat model of osteoarthritis. J Orthop Res Off Publ Orthop Res Soc 2014; 32 : 1167–1174.
71. Freitag J, Bates D, Boyd R, Shah K, Barnard A, Huguenin L, et al. Mesenchymal stem cell therapy in the treatment of osteoarthritis: reparative pathways, safety and efficacy – a review. BMC Musculoskelet Disord 2016; 17 : 230.
72. Shah K. Drury T, Roic I, Hansen P, Malin M, Boyd R, et al. Outcome of allogeneic adult stem cell therapy in dogs suffering from osteoarthritis and other joint defects. Stem Cells Int 2018; 7309201.
73. Roos EM, Roos HP, Lohmander LS, Ekdahl C, Beynnon BD. Knee Injury and Osteoarthritis Outcome Score (KOOS) – development of a self-administered outcome measure. J Orthop Sports Phys Ther 1998; 28 : 88–96.
74. Bellamy N, Buchanan WW, Goldsmith CH, Campbell J, Stitt LW. Validation study of WOMAC: a health status instrument for measuring clinically important patient relevant outcomes to antirheumatic drug therapy in patients with osteoarthritis of the hip or knee. J Rheumatol 1988; 15 : 1833–1840.
75. Kellgren JH, Lawrence JS. Radiological assessment of osteo-arthrosis. Ann Rheum Dis 1957; 16 : 494–502.
76. Bastos R, et al. Intra-articular injection of culture-expanded mesenchymal stem cells with or without addition of platelet-rich plasma is effective in decreasing pain and symptoms in knee osteoarthritis: a controlled, double-blind clinical trial. Knee Surg Sports Traumatol Arthrosc 2019 [Epub ahead of print].
77. Shah N. Increasing knee range of motion using a unique sustained method. North Am J Sports Phys Ther NAJSPT 2008; 3 : 110–113.
78. Ansboro S, Roelofs AJ, de Bari C. Mesenchymal stem cells for the management of rheumatoid arthritis: immune modulation, repair or both? Curr Opin Rheumatol 2017; 29 : 201–207.
79. Liu R, Li X, Zhang Z, Zhou M, Sun Y, Su D, et al. Allogeneic mesenchymal stem cells inhibited T follicular helper cell generation in rheumatoid arthritis. Sci Rep 2015; 5 : 12777.
80. Vos K, Visser H, Schreuder GM, de Vries RR, Zwinderman AH, Breedveld FC, et al. Human leukocyte antigen-DQ and DR polymorphisms predict rheumatoid arthritis outcome better than DR alone. Hum Immunol 2001; 62 : 1217–1225.
81. Wu J, et al. Association of HLA-DQB1 polymorphisms with rheumatoid arthritis: a meta-analysis. Postgrad Med J 2017; 93 : 618–625.
82. Alamanos Y, Drosos AA. Epidemiology of adult rheumatoid arthritis. Autoimmun Rev 2005; 4 : 130–136.
83. Kallberg H, Padyukov L, Plenge RM, Ronnelid J, Gregersen PK, van der Helm-van Mil AH, et al. Gene-gene and gene-environment interactions involving HLA-DRB1, PTPN22, and smoking in two subsets of rheumatoid arthritis. Am J Hum Genet 2007; 80 : 867–875.
84. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med 2011; 365 : 2205–2219.
85. Wang L, Wang L, Cong X, Liu G, Zhou J, Bai B, et al. Human umbilical cord mesenchymal stem cell therapy for patients with active rheumatoid arthritis: safety and efficacy. Stem Cells Dev 2013; 22 : 3192–3202.
86. Ranganath VK, Khanna D, Paulus HE. ACR remission criteria and response criteria. Clin Exp Rheumatol 2006; 24(6 Suppl 43): S14–21.
87. Ali A, et al. Systemic Lupus Erythematosus: An Overview of the Disease Pathology and Its Management. Cureus 2018; 10(9): e3288.
88. Fortuna G, Brennan MT. Systemic lupus erythematosus: epidemiology, pathophysiology, manifestations, and management. Dent Clin North Am 2013; 57 : 631–655.
89. Moser KL, Kelly JA, Lessard CJ, Harley JB. Recent insights into the genetic basis of systemic lupus erythematosus. Genes Immun 2009; 10 : 373–379.
90. Graham RR, Hom G, Ortmann W, Behrens TW. Review of recent genome-wide association scans in lupus. J Intern Med 2009; 265 : 680–688.
91. Bombardier C, Gladman DD, Urowitz MB, Caron D, Chang CH. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE. Arthritis Rheum 1992; 35 : 630–640.
92. Wang D, Akiyama K, Zhang H, Yamaza T, Li X, Feng X, Wang H, et al. Double allogenic mesenchymal stem cells transplantations could not enhance therapeutic effect compared with single transplantation in systemic lupus erythematosus. Clin Dev Immunol 2012; 2012 : 273291.
93. Rendon A, Schäkel K. Psoriasis pathogenesis and treatment. Int J Mol Sci 2019; 20 : 1475.
94. Indhumathi S, Rajappa M, Chandrashekar L, Anantha-narayanan PH, Thappa DM, Negi V. T helper-2 cytokine/regulatory T-cell gene polymorphisms and their relation with risk of psoriasis in a South Indian Tamil cohort. Hum Immunol 2017; 78 : 209–215.
95. Osmola-Mańkowska A, Teresiak-Mikołajczak E, Skrzypczak-Zielińska M, Adamski Z. Genetic polymorphism in psoriasis and its meaning for the treatment efficacy in the future. Postepy Dermatol Alergol 2018; 35 : 331–337.
96. Elder JT, Nair RP, Guo SW, Henseler T, Christophers E, Voorhees JJ. The genetics of psoriasis. Arch Dermatol 1994; 130 : 216–224.
97. Alshobaili HA, Shahzad M, Al-Marshood A, Khalil AS, Settin A, Barrimah I. Genetic background of psoriasis. Int J Health Sci 2010; 4 : 23–29.
98. Indhumathi S, Rajappa M, Chandrashekar L, Anantha-narayanan PH, Thappa DM, Negi VS. TNFAIP3 and TNIP1 polymorphisms confer psoriasis risk in South Indian Tamils. Br J Biomed Sci 2015; 72 : 168–173.
99. Seetharaman R, Mahmood A, Kshatriya P, Patel D, Srivastava A. Mesenchymal stem cell conditioned media ameliorate psoriasis vulgaris: a case study. Case Rep Dermatol Med 2019; 8309103.
100. Menter A, Gottlieb A, Feldman SR, van Voorhees AS, Leonardi CL, Gordon KB, et al. Guidelines of care for the management of psoriasis and psoriatic arthritis: Section 1. Overview of psoriasis and guidelines of care for the treatment of psoriasis with biologics. J Am Acad Dermatol 2008; 58 : 826–850.
101. Spuls PI, Lecluse LL, Poulsen ML, Bos JD, Stern RS, Nijsten T. How good are clinical severity and outcome measures for psoriasis?: quantitative evaluation in a systematic review. J Invest Dermatol 2010; 130 : 933–943.
102. Beckermann BM, Kallifatidis G, Groth A, Frommhold D, Apel A, Mattern J, et al. VEGF expression by mesenchymal stem cells contributes to angiogenesis in pancreatic carcinoma. Br J Cancer 2008; 99 : 622–631.
103. Brennen WN, Nguyen H, Dalrymple SL, Reppert-Gerber S, Kim J, Isaacs JT, et al. Assessing angiogenic responses induced by primary human prostate stromal cells in a three-dimensional fibrin matrix assay. Oncotarget 2016; 7 : 71298–71308.
104. Dvorak HF. Tumors: wounds that do not heal-a historical perspective with a focus on the fundamental roles of increased vascular permeability and clotting. Semin Thromb Hemost 2019; 45 : 576–592.
105. Ridge SM, Sullivan FJ, Glynn SA. Mesenchymal stem cells: key players in cancer progression. Mol Cancer 2017; 16 : 31.
106. Wu Y, Chen L, Scott PG, Tredget EE. Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis. Stem Cells 2007; 25 : 2648–2659.
107. Lee HY, Hong IS. Double-edged sword of mesenchymal stem cells: Cancer-promoting versus therapeutic potential. Cancer Sci 2017; 108 : 1939–1946.
108. Vallabhaneni KC, Penfornis P, Dhule S, Guillonneau F, Adams KV, Mo YY, et al. Extracellular vesicles from bone marrow mesenchymal stem/stromal cells transport tumor regulatory microRNA, proteins, and metabolites. Oncotarget 2015; 6 : 4953–4967.
109. Krueger TE, Thorek DLJ, Meeker AK, Isaacs JT, Brennen WN. Tumor-infiltrating mesenchymal stem cells: Drivers of the immunosuppressive tumor microenvironment in prostate cancer? The Prostate 2019; 79 : 320–330.
110. Zhao S, Wehner R, Bornhäuser M, Wassmuth R, Bachmann M, Schmitz M, et al. Immunomodulatory properties of mesenchymal stromal cells and their therapeutic consequences for immune-mediated disorders. Stem Cells Dev 2010; 19 : 607–614.
111. Rhee KJ, Lee JI, Eom YW. Mesenchymal stem cell-mediated effects of tumor support or suppression. Int J Mol Sci 2015; 16 : 30015–30033.
112. Ho IA, Toh HC, Ng WH, Teo YL, Guo CM, Hui KM, et al. Human bone marrow-derived mesenchymal stem cells suppress human glioma growth through inhibition of angiogenesis. Stem Cells 2013; 31 : 146–155.
113. Ohlsson LB, Varas L, Kjellman C, Edvardsen K, Lindvall M. Mesenchymal progenitor cell-mediated inhibition of tumor growth in vivo and in vitro in gelatin matrix. Exp Mol Pathol 2003; 75 : 248–255.
114. Ramasamy R, Lam EW, Soeiro I, Tisato V, Bonnet D, Dazzi F. Mesenchymal stem cells inhibit proliferation and apoptosis of tumor cells: impact on in vivo tumor growth. Leukemia 2007; 21 : 304–310.
115. Zhu Y, Sun Z, Han Q, Liao L, Wang J, Bian C, et al. Human mesenchymal stem cells inhibit cancer cell proliferation by secreting DKK-1. Leukemia 2009; 23 : 925–933.
116. Sasaki A, Mizuno M, Mochizuki M, Sekiya I. Mesenchymal stem cells for cartilage regeneration in dogs. World J Stem Cells 2019; 11 : 254–269.
117. Broeckx SY, et al. Equine allogeneic Chondrogenic induced mesenchymal stem cells are an effective treatment for degenerative joint disease in horses. Stem Cells Dev 2019; 28 : 410–422.
118. Romero A, Barrachina L, Ranera B, Remacha AR, Moreno B, de Blas I, et al. Comparison of autologous bone marrow and adipose tissue derived mesenchymal stem cells, and platelet rich plasma, for treating surgically induced lesions of the equine superficial digital flexor tendon. Vet J 2017; 224 : 76–84.
119. Taechangam N, Iyer SS, Walker NJ, Arzi B, Borjesson DL. Mechanisms utilized by feline adipose-derived mesenchymal stem cells to inhibit T lymphocyte proliferation. Stem Cell Res Ther 2019; 10 : 188.
120. Quimby JM, Borjesson DL. Mesenchymal stem cell therapy in cats: Current knowledge and future potential. J Feline Med Surg 2018; 20 : 208–216.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Úvodník
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2020 Číslo 1- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Revmatoidní artritida a postižení ledvin
- Mezenchymální kmenové buňky: biologie a potenciál v léčbě systémových onemocnění pojiva
- Úvodník
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Statiny indukovaná nekrotizující autoimunitní myopatie jako neobvyklá příčina extrémních hodnot kardiálních markerů u pacienta se svalovou slabostí a otoky
- Kongres American College of Rheumatology (ACR) 2019
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Revmatoidní artritida a postižení ledvin
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



