-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaStatiny indukovaná nekrotizující autoimunitní myopatie jako neobvyklá příčina extrémních hodnot kardiálních markerů u pacienta se svalovou slabostí a otoky
Statin--induced necrotizing autoimmune myopathy as an unusual cause of extreme elevation of cardiac markers in a patient with muscle weakness and swelling
This review article with a case report shows a patient admitted to our department for a newly developed proximal weakness of the limbs and swelling. Laboratory examination showed an enormous elevation of cardiac markers – creatine kinase (CK-MB), troponins (hs-cTnT) and myoglobin. Statin medication had been chronically used. The cardiac cause of the laboratory findings was considered very unlikely due to the examinations performed. The polymyositis was considered another potential cause, but we initially refused it on the basis of negative findings of autoantibodies. Examinations that were gradually completed resulted in a final diagnosis of Statin-Induced Necrotizing Autoimmune Myopathy (SINAM) with a positive antibody to 3-hydroxy-3-methyl - glutaryl coenzyme A reductase (anti-HMGCR). Three months after the initiation of the immunosuppressive therapy, the range of motion of the extremities was significantly improved and swelling was reduced.
Keywords:
statins – limb-girdle weakness – swelling – immune-mediated necrotizing myopathy – anti-HMGCR
Autoři: J. Švarko 1; E. Lokočová 2; E. Kourková 3; P. Zajíček 1
Působiště autorů: Interní oddělení Nemocnice Valašské Meziříčí 1; Fakultní nemocnice Olomouc, III. interní klinika – nefrologická, revmatologická a endokrinologická 2; Hematologicko-transfuzní oddělení Vsetínské nemocnice 3
Vyšlo v časopise: Čes. Revmatol., 28, 2020, No. 1, p. 52-60.
Kategorie: Kazuistika
Souhrn
V tomto souborném referátu s kazuistickým sdělením prezentujeme případ pacienta, který byl hospitalizován pro nově vzniklou proximální slabost končetin a otoky. Vstupní laboratorní výsledky vykazovaly enormní elevaci kardiálních markerů – kreatinkinázy (CK-MB), troponinu (hs-cTnT) a myoglobinu, přičemž pacient chronicky užíval statin. Kardiální příčinu těchto extrémních hodnot jsme na podkladě provedených vyšetření shledali jako vysoce nepravděpodobnou. Z dalších příčin jsme zvažovali polymyozitidu, od které bylo vzhledem k negativnímu nálezu autoprotilátek upuštěno. Postupně doplněnými vyšetřeními jsme dospěli ke konečné diagnóze statiny indukované nekrotizující autoimunitní myopatii (SINAM) s pozitivitou protilátek proti 3-hydroxy-3-methylglutaryl koenzym A reduktáze (anti-HMGCR). Po 3 měsících od počátku imunosupresivní terapie se u pacienta výrazně zlepšila hybnost končetin a zmírnily se otoky.
Klíčová slova:
pletencová slabost – statiny – otoky – imunitně zprostředkovaná nekrotizující myopatie – anti-HMGCR
ÚVOD
Autoimunitní myopatie jsou definovány jako onemocnění svalů vzniklá přímým nebo nepřímým imunitním poškozením svalových vláken. Intenzivní výzkum v této oblasti patologií přináší stále nové možnosti diagnostiky a včasného záchytu onemocnění. Imunitně zprostředkovaná nekrotizující myopatie (IMNM – immune-mediated necrotizing myopathy) je skupinou vzácných onemocnění, jejichž incidence je odhadována na 0,44–1,54/100 000/rok (1). V roce 2004 navrhla European Neuro Muscular Centre (ENMC) klasifikační kritéria, která řadí IMNM do skupiny idiopatických myozitid, společně s dermatomyozitidou (DM), polymyozitidou (PM) a myozitidou s inkluzními tělísky (IBM) (2).
Statiny indukovaná nekrotizující myopatie (SINAM – statin-induced necrotizing autoimmune myopathy) je řazena do skupiny IMNM, spolu s anti-SRP (anti-signal recognition particle) myopatií a IMNM bez přítomnosti autoprotilátek. SINAM je charakteristická přítomností protilátek proti 3-hydroxy-3-methylglutaryl koenzym A reduktáze (HMGCR). Incidence SINAM se uvádí 2–3/100 000 uživatelů statinů za rok (3).
Statinové preparáty jsou celosvětově jedny z nejužívanějších léčiv. Cílovou molekulou účinku statinů je právě HMGCR, která katalyzuje přeměnu 3-hydroxy-3-methylglutaryl koenzymu A (HMGCoA) na kyselinu mevalonovou (mevalonát). Tato je klíčovým prekurzorem biosyntézy cholesterolu v hepatocytech. Důsledkem působení statinů je pokles nejen produkce cholesterolu, ale i jeho prekurzorů. Kromě mevalonátu dochází i k poklesu dalších metabolitů, izoprenoidů dolicholu a ubiquinonu (koenzym Q10), které jsou důležité pro oxidativní metabolismus a hrají roli při apoptických procesech v buňkách. Vzhledem k tomu, že statiny mohou pronikat přes sarkolemu, nastává tento proces i ve svalech (4). Dle Bednaříka (5) je možná souvislost mezi zvýšením apoptických procesů svalových buněk u statinových myopatií. Přehled statinových myopatií uvádí tabulka 1.
Tab. 1. Klasifikace statinových myopatií (převzato a upraveno dle Bednaříka et al.) (5) 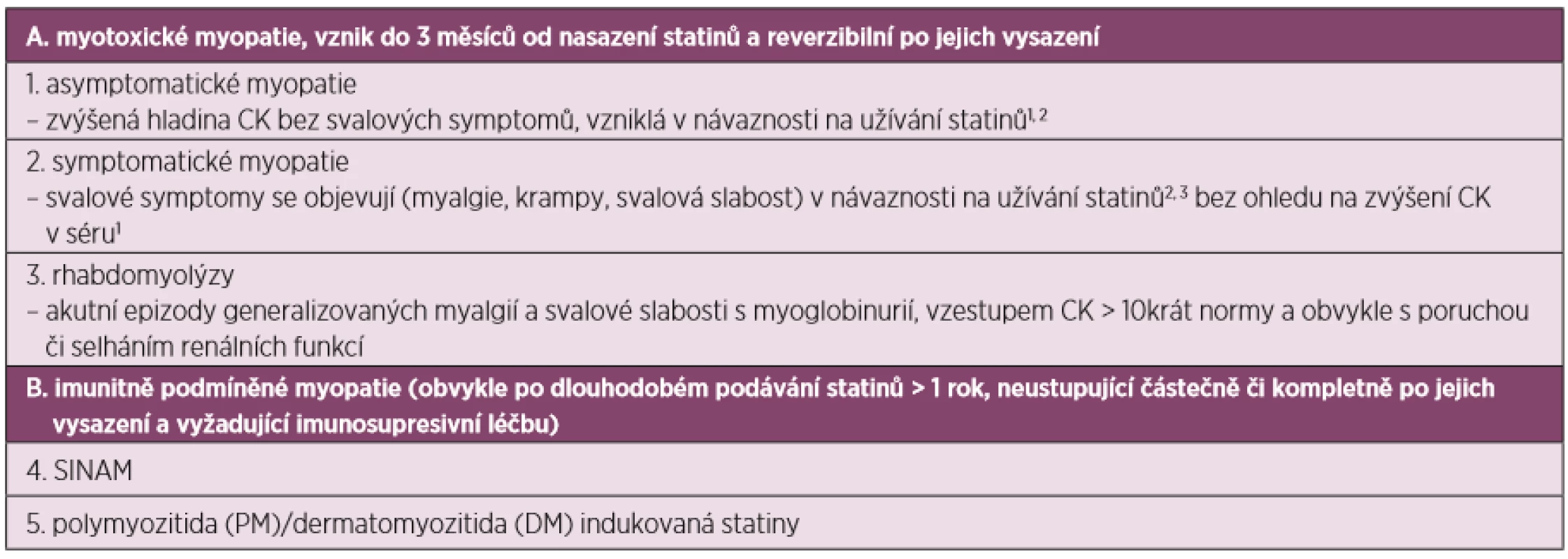
1zvýšení CK v séru vždy s porovnání s hodnotou před nasazením statinů
2nutné vyloučit jinou příčinu zvýšené hladiny CK či svalových symptomů než medikace statiny
3objevení se nových svalových symptomů nepřítomných před nasazením statinůProtilátky anti-HMGCR byly popsány roku 2010 (6). Antigen o velikosti 200/100 kDa je exprimován na membráně endoplazmatického retikula. Anti-HMGCR byly poprvé popsány u pacientů s IMNM v souvislosti s léčbou statiny. Uvádí se, že tyto protilátky jsou přítomny u 6–7 % případů s idiopatickou myozitidou (7, 8). SINAM byla popsána pouze u malého zlomku pacientů na statinové terapii (9). Na druhou stranu byla pozitivita anti-HMGCR popsána i u pacientů bez statinové terapie.
Evropská studie z roku 2014 prokázala u většiny pacientů s pozitivitou anti-HMGCR onemocnění IMNM (10). V této studii byla prevalence anti-HMGCR u jednotlivých souborech IMNM vyhodnocena jako 70 %, u pacientů starších 50 let pak 75 %. Ve 45 % pacientů s IMNM však nebylo léčeno statiny a u 5 % případů nebyla přítomna nekróza myofibril (11). Na rozdíl od neautoimunitních, tj. myotoxických svalových myopatií, reverzibilních po ukončení statinové terapie, u pacientů s pozitivitou anti-HMGCR přetrvává autoimunitní odpověď i po vysazení statinových preparátů. Titr anti-HMGCR koreluje s klinickou aktivitou nekrotizující myozitidy (12). Tyto protilátky byly také zaznamenány u dětských pacientů (13).
Nebyla prokázána zásadní souvislost anti-HMGCR IMNM s malignitami (14). Práce japonských autorů s malou skupinou pacientů však prokázala přítomnost malignity jako jeden z rizikových faktorů pro rozvoj pozitivity anti-HMGCR (15). Silná asociace s rozvojem malignit však byla prokázána u DM s pozitivitou anti-TIF1g (16).
ETIOPATOGENEZE
Patogeneze onemocnění není stále zcela objasněná. Silnou imunogenetickou predispozicí pro vznik anti-HMGCR myopatie je přítomnost specifických alel HLA II systému – HLA DRB1* 11 : 01 u dospělých, nebo HLA DRB1* 07 : 01 u dětí (13, 16).
U pacientů starších 50 let užívajících statiny byla prevalence na počátku onemocnění anti-HMGCR myopatií 89 % (6). Toto číslo se však liší v závislosti na geografickém původu studie (americká s prevalencí 38–63 %, evropská 44 %, asijská 14–38 %)(16). U asijské populace může souviset nízká prevalence onemocnění se statiny, které asijské národy přijímají v potravě (např. lovastatin v hlívě ústřičné).
Statiny mohou startovat autoimunitní proces více mechanismy. Na počátku je pravděpodobně iniciován antigen prezentujícími buňkami, které zpracovávají určité (přirozené nebo kryptické) epitopy HMGCR. Vzhledem k působení statinů dochází k nadměrné expresi HMGCR v různých typech buněk a tkání. Receptor T-lymfocytů (TcR) může být při užívání statinů aktivován změnou v aminokyselinovém řetězci HMGCR nebo odhalením kryptických epitopů. Poškození svalových vláken zprostředkované autoimunitní reakcí je namířeno proti HMGCR a ostatním antigenům, rozpoznávaným anti-HMGCR. Pokus o regeneraci myofibril má za následek zvýšenou expresi HMGCR (případně expresi proteinu, napodobujícího HMGCR), takže autoimunitní reakce perzistuje. Konečným důsledkem je atrofie a degenerace myofibril, trvající i po vysazení statinů (17).
Dalším možným spouštěčem IMNM mohou být virové infekce. Bylo zjištěno, že HMGCR (stejně jako 54-kDa podjednotka SRP) sdílí homologické oblasti s proteiny viru Varicella zoster a lidského papilomaviru typu 58. Je tedy možné, že expozice těmto virům by mohla generovat imunitní odpověď proti lidskému proteinu mechanismem molekulárních mimikrů (16). Dalším možným vysvětlením svalové toxicity u pacientů s IMNM je aktivace komplementu vzhledem k přímému působení anti-HMGCR (nebo anti-SPR) na svalové buňky. Autoprotilátky mohou přispívat k atrofii myofibril a vzniku volných radikálů a prozánětlivých cytokinů jako TNF nebo IL-6. Dále mohou narušovat fúzi myoblastů snížením produkce IL-4 a IL-13 (18).
KLINICKÉ PROJEVY A DIAGNOSTIKA
Většina pacientů se SINAM je diagnostikována v pozdějším věku. Onemocnění se rozvíjí nejdříve měsíc po započetí léčby statiny, u většiny pacientů však až po několika letech (19). Nejčastějšími klinickými projevy jsou subakutní a progresivní proximální svalová slabost a extrémně zvýšená hladina CK > 100 μkat/l. U řady pacientů je však vývoj symptomů pomalý až plíživý. Mezi další projevy se řadí celková únava, problémy se vstáváním ze židle, obtížná chůze do schodů, obtíže se zvedáním břemen a rukou nad hlavu a bolesti svalů. Dysfagie je přítomna až u 30 % pacientů. Extrémně vzácně se můžou objevit příznaky jako kožní rash či artralgie (6, 10). Přehled typických klinických a paraklinických nálezů u SINAM shrnuje tabulka 2.
Tab. 2. Přehled klinických nálezů při fyzikálním vyšetření a dalších doplňujících vyšetřeních (převzato a upraveno dle Mohassela et al.) (7) 
Diagnostika SINAM je založena na klinickém obraze, laboratorním a sérologickém vyšetření, svalové biopsii a dalších doplňujících vyšetřeních (EMG, MR).
Stanovení protilátek anti-HMGCR probíhá pomocí enzymové imunoanalýzy (ELISA). Ačkoliv se senzitivita a specificita ELISA testu pro anti-HMGCR udává nad 95 %, v nepatrném procentu případů (0,7 %) byly zaznamenány falešně pozitivní reakce (17).
Proto se doporučuje konfirmace výsledku imunoprecipitačními metodami (21, 22). Byla popsána i další metoda stanovení anti-HMGCR pomocí nepřímé imunofluorescence na krysích hepatocytech (23), tato však není běžně dostupná. Hladina anti-HMGCR koreluje s tíží proximální svalové slabosti a hladinou CK (14). Je však důležité si uvědomit, že protilátky samy o sobě diagnostické nejsou, mohou se vyskytovat i u ostatních idiopatických myozitid i u pacientů, kteří statiny nikdy neužívali.
Vedle výše uvedené kliniky a elevace CK nad desetinásobek horní hranice normy, se dále objevují vysoké, často až extrémní hodnoty myoglobinu a elevace AST a ALT při normální hladině obstrukčních enzymů.
Markery CK-MB a troponiny (cTnT) se běžně k diagnostice nekrotizující myopatie nepoužívají. MB izoenzym kreatinkinázy je zastoupen především v myokardu (40 %), vyskytuje se mimo jiné i v kosterním svalu. Jeho elevace u svalového postižení typu SINAM tedy není překvapivá (24).
Troponin cTnT je molekula specifická pouze pro myokard, za normálních okolností se v kosterním svalu nevyskytuje. Předpokládá se, že pozitivita cTnT u idiopatických zánětlivých myopatií je způsobena reexpresí této izoformy u regenerujícího kosterního svalu. Další hypotéza říká, že pouze zánětlivé změny či těžké svalové postižení jsou spouštěčem její reexprese. Zajímavostí je, že srdeční izoforma troponinu I (cTnI) pozitivní nebývá (25, 26). Některé novější práce však naznačují, že pozitivita cTnT u idiopatických zánětlivých myopatií by se dala vysvětlit zkříženou reakcí při imunoanalytické detekci jeho hladiny (27).
Nedílnou součástí diagnostiky je svalová biopsie. Typická je pauciimunní nekrotizující myopatie, vykazující degeneraci myofibril s nekrózou a s proměnlivou denzitou regenerujících vláken. U pacientů s chronickým onemocněním lze pozorovat různou velikost vláken, vnitřně umístěná jádra a zvýšenou endomyziální fibrózu (7). Příležitostně lze pozorovat perivaskulární chronický zánět. Lymfocytární infiltraci zdravých vláken lze nalézt cca u 20 % pacientů (28). MHC-1 může vykazovat zvýšené sarkolemální barvení v nekrotických vláknech. Je možné najít i depozita komplexu proteinů komplementu (MAC), C5b-9 jak v nekrotických vláknech, tak v endotelu arteriol (14, 29).
V EMG nálezu jsou typicky přítomny změny parametrů potenciálů motorické jednotky (snížení jejich amplitudy a trvání, zvýšený výskyt polyfázií), dále předčasný nábor motorických jednotek a abnormální spontánní aktivita (30).
Tabulka 3 uvádí přehled zánětlivých myopatií, klinické, laboratorní a histologické nálezy.
Tab. 3. Přehled zánětlivých myopatií, klinické, laboratorní a histologické nálezy (převzato a upraveno dle Schmidta) (31) 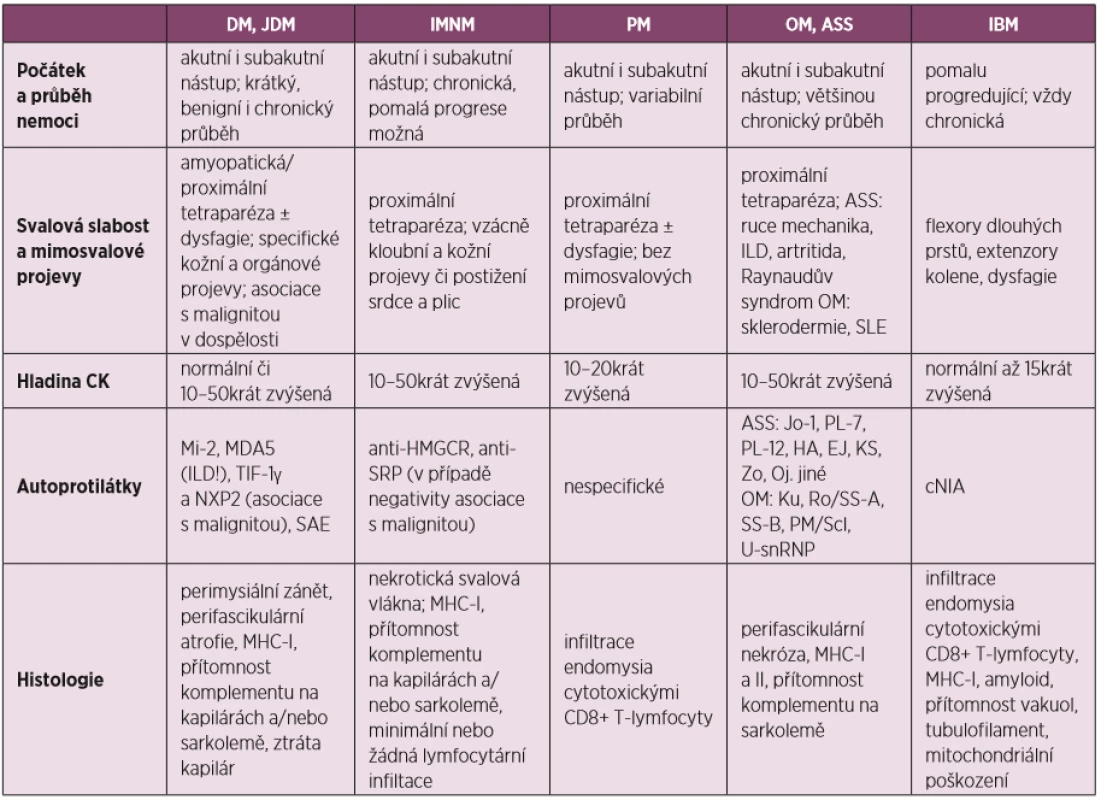
JDM – juvenilní dermatomyositida, DM – dermatomyozitida, IMNM – imunitně zprostředkovaná nekrotizující myopatie, PM – polymyozitida, OM – overlap myozitida, ASS – antisyntetázový syndrom, IBM – myozitida s inkluzními tělísky, ILD – intersticiální plicní proces, SLE – systémový lupus erythematodes Na obrázku 1 je navrhnuto schéma vhodného diagnostického algoritmu u pacienta s podezřením na SINAM.
Obr. 1. Schéma vhodného diagnostického algoritmu u pacienta s podezřením na SINAM (převzato a upraveno dle Mammena et al.) (9) 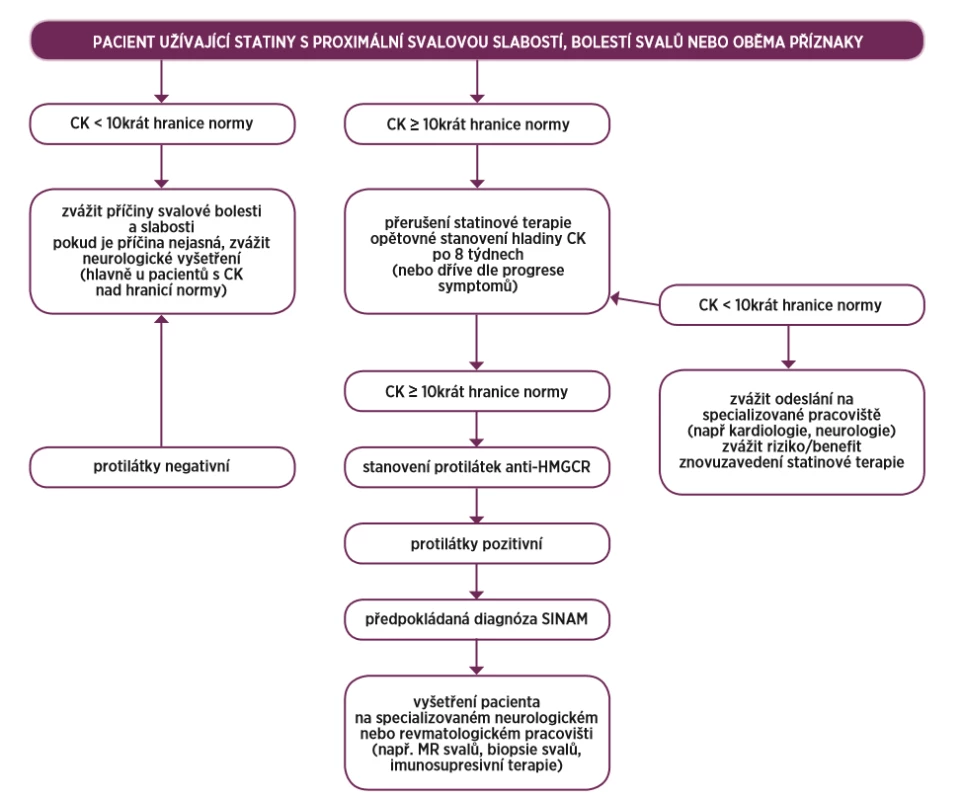
LÉČBA
Nejdůležitějším krokem v léčbě SINAM je okamžité vysazení statinových preparátů z medikace. U většiny pacientů však nadále přetrvává progredující svalová slabost, proto je nutné zahájení imunosupresivní terapie. Doporučení pro léčbu uvádí tabulka 4.
Tab. 4. Doporučení pro léčbu IMNM dle ENMC 2017 (převzato a upraveno dle Allenbacha et al.) (14) 
i.v. – intravenózní, s.c. – podkožně, IVIG – intravenózní imunoglobuliny, d – den, m – měsíc, t – týden Léčbu zahajujeme perorálním prednisolonem v dávce 1 mg/kg/den (nebo ekvivalentem). U těžké svalové slabosti glukokortikoidy kombinujeme s methotrexátem. Alternativou k methotrexátu je mykofenolát mofetil, azathioprin, cyklosporin nebo takrolimus (7, 14). U pacientů refrakterních na kombinovanou imunosupresivní léčbu nebo v případech velmi těžké svalové slabosti je vhodné kombinovat imunosupresiva (methotrexát) s podáváním intravenózních imunoglobulinů (IVIG), případně kombinovat s rituximabem. S terapií IVIG začínáme až po 6 měsících, pokud nejsou výše uvedené přístupy efektivní (14). Dávkování a efektivita této kombinované imunomodulační léčby však zatím nebyla potvrzena randomizovanou studií.
U některých pacientů netolerujících vysoké dávky glukokortikoidů nebo v případech, kdy jsou glukokortikoidy kontraindikovány, můžeme použít monoterapii IVIG (14, 32). Ve velmi těžkých případech (pacienti na JIP) je možná plazmaferéza nebo terapie cyklofosfamidem, eventuálně cyklosporinem. Po dosažení maximálního léčebného účinku a u pacientů v remisi minimalizujeme podávání glukokortikoidů nebo je zcela vysazujeme, stejně jako ostatní léčiva podávaná v kombinaci. Dlouhodobá terapie IVIG bývá účinná u refrakterních pacientů, zatím však bylo popsáno velmi málo případů. Je však možné zvážit monoterapii IVIG u pacientů, kde je kontraindikováno podání glukokortikoidů (32).
KAZUISTIKA
Popisujeme případ 75letého polymorbidního pacienta léčeného pro arteriální hypertenzi, diabetes mellitus 2. typu a hyperlipidemii, který byl odeslán na naše pracoviště obvodním lékařem v dubnu 2019 k došetření otoků dolních končetin. Pacient toho času dlouhodobě užíval telmisartan/amlodipin 80/10 mg, bisoprolol 10 mg, simvastatin 40 mg, metformin 1000 mg a s.c. insulin-glargin v dávce 12 j denně.
Otoky dolních končetin byly asymetrické, na levé noze s typickým „dolíčkováním“ (zde byla v roce 1971 navíc tříštivá zlomenina nártu). Na pravé noze byl otok menší, bez „dolíčkování“, spíše charakteru prosaku.
Ještě v březnu 2019 byl pacient plně aktivní a soběstačný, sportoval a neměl prakticky žádné potíže. Během zhruba 3 týdnů došlo k rozvoji celkové slabosti, otokům bérců a otokům obou horních končetin po předloktí. Následně se objevily bolesti bérců, stehen a paží. Pacient nebyl schopen běžné chůze bez holí.
Při podrobnějším fyzikálním vyšetření jsme zjistili, že dominujícím příznakem pacienta nejsou otoky, ale progredující svalová slabost a bolesti. Pacient nebyl schopen zvednout horní končetiny nad hlavu (nález odpovídající pletencové slabosti), měl kolébavou „kachní“ chůzi, hypotonické svalstvo a svalovou slabost dolních končetin.
Ve vstupních laboratorních hodnotách dominovalo neměřitelné CK-MB nad 300 µg/l (norma 0–6,73 μg/l), cTnT –1680 ng/l (0–14 ng/l ), myoglobin > 3000 µg/l (28–72 μg/l), NT-proBNP – 1098 ng/l (0–300 ng/l), ALT 4,38 µkat/l (0,1–0,96 µkat/l), AST 6,87 µkat/l (0,16–0,87 µkat/l). Další analyty – GGT, urea, kreatinin, bilirubin, minerály, TSH, fT4, CRP a sedimentace erytrocytů byly v normě; v krevním obraze s diferenciálem byla patrná pouze mírná leukocytóza.
Dále jsme doplnili RTG hrudníku a sonografii břicha, kde nebyla prokázána zásadní patologie, EKG bylo v normě. Vzhledem k přítomným otokům a vysokému kardiovaskulárnímu riziku (diabetes, hypertenze, hyperlipidemie) doprovázenému masivním laboratorním nálezem jsme nejdříve zvažovali kardiální příčinu potíží, proto byla nasazena diuretika. Následně provedená echokardiografie prokázala dobrou systolickou funkci obou komor, absenci významných chlopenních vad a nepřítomnost poruchy kinetiky. Nicméně byla popsána porucha relaxace levé komory s odhadem vyšších LVEDP (enddiastolický tlak levé komory), což v kombinaci s vyšší hladinou NT-proBNP svědčí pro srdeční selhání se zachovalou ejekční frakcí. K definitivnímu vyloučení koronární příčiny potíží byla v Nemocnici Třinec – Podlesí následně provedena koronarografie s nálezem nevýznamné aterosklerózy větví 1. a 2. řádu.
Při kontrolním laboratorním vyšetření nadále přetrvávaly neměřitelné hodnoty CK-MB a myoglobinu a celkové CK 45,61 µkat/l (norma 0,5 až 3,77 µkat/l). Byla prokázána hraniční hypoproteinemie 63 g/l (65–82 g/l) a hraniční hypoalbuminemie – 33,6 g/l (34–53 g/l). Krevní obraz s diferenciálem byl již v normě.
Vzhledem k minimální odezvě na diuretika, výše uvedeným enormním laboratorním hodnotám a dominující svalové slabosti jsme vyslovili podezření na polymyozitidu. Proto byl vysazen simvastatin a zahájena pulzní terapie methylprednisolonem (5 dní v dávce 250 mg/den, s pokračováním perorální léčby prednisonem 40 mg/den).
Zároveň byl odebrán imunologický myozitický profil (protilátky anti-Mi2, anti-PM Scl, anti-Ku, anti-snRNP, anti-Jo-1, anti-Pl-7, anti-Pl-12, anti-EJ, anti-OJ, anti-Ro52 a anti-SRP). Po týdnu zavedené léčby nastalo pozvolné, mírné subjektivní i objektivní zlepšení, zejména došlo ke zlepšení hybnosti horních končetin v oblasti ramen.
Výsledky vyšetření autoprotilátek však byly negativní. Vzhledem k nemožnosti provést EMG a svalovou biopsii na našem pracovišti jsme pacienta v květnu 2019 přeložili na III. interní kliniku FN Olomouc k dalšímu došetření. EMG vyšetření prokázalo pozitivní myogenní nález v m. vastus lat. vpravo a m. biceps brachii vlevo. Nadále pokračovala perorální léčba prednisonem s pozvolným efektem. Kontrolní vyšetření autoprotilátek bylo opět negativní.
Následně provedená svalová biopsie z laterální strany stehna potvrdila myozitidu s ložiskovým zánětem svalstva. Lymfocytární infiltrace MHC1 byla popsána na zhruba 10–20 % plochy, dále byly popsány fokální dystrofie, ložiskové nekrózy na asi 10 % plochy a atrofie svalových vláken. Neutrofily a vaskulitida nebyly přítomné.
Na základě těchto výsledků jsme doplnili kompletní vyšetření autoprotilátek, specifických pro myozitidy v Revmatologickém ústavu Praha. Zde byla potvrzena pozitivita anti-HMGCR protilátek s hodnotou 203,5 U/ml (norma 0–20 U/ml).
Případ pacienta uzavíráme jako imunitně zprostředkovanou nekrotizující myopatii s pozitivitou protilátek anti-HMGCR a pozitivním myogenním nálezem na EMG. Léčba prednisonem byla posílena o methotrexát 10 mg 1krát týdně.
Doplněné PET-CT prokázalo hypermetabolismus glukózy v hypodenzním ložisku pravého laloku štítnice s následným průkazem adenomu.
Pacient po 3 měsících léčby (září 2019) udával zlepšení hybnosti ramen o 50 % a zlepšení hybnosti dolních končetin o 50 %. Při lehké fyzické námaze však přetrvávala bolest v oblasti ramen a zad. Při delším stání byl nutný postoj o široké bázi, jinak docházelo k „rozklepání“ svalů. Otoky horních i dolních končetin se zmírnily zhruba o 30 %.
Odebrané kontrolní laboratorní hodnoty prokázaly již normální hodnoty CK a myoglobin 118 µg/l (28–72 μg/l).
V mezidobí prodělal pacient řadu komplikací. Nejzávažnější byly dvě epizody akutní enteroragie na podkladě divertikulózy celého colon. Adenom thyreoidey byl shledán vysoce rizikovým (histologicky high-grade dysplazie), tudíž bylo naplánováno jeho odstranění.
ZÁVĚR
Kazuistika popisuje případ pacienta původně přicházejícího s otoky končetin a extrémními hodnotami kardiálních markerů, u kterého byla později prokázána pozitivita autoprotilátek anti-HMGCR. Dominantním příznakem však byla svalová slabost se ztrátou soběstačnosti, spjatá s velmi vysokými hodnotami CK, myopatickým EMG a obrazem nekrotizující myopatie ve svalové biopsii. Je důležité si uvědomit, že nejde o nekrózu celého svalu, ale nekrózu jednotlivých myofibril.
Kardiální markery mají svůj nesporný význam k průkazu myokardiálního poškození zejména při jejich dynamice v čase, typickém klinickém nálezu a paraklinických vyšetřeních (EKG). Přesto je třeba mít na paměti, že jejich pozitivita je možná u řady patologických stavů, včetně idiopatických zánětlivých myozitid.
Nekrotizující myopatie je nejčastěji asociována s užíváním statinů, obzvláště u osob starších 50 let. Dle ENMC (14) může rozsah poškození myofibril a hladina CK korelovat s titrem anti-HMGCR. Na rozdíl od IMNM s negativními autoprotilátkami, má SINAM nízkou asociaci s malignitami, přesto není chybou doplnit u pacienta základní onkoscreening (viz vysoce rizikový adenom thyroidey u našeho pacienta). Léčba glukokortikoidy musí být často kombinována s imunosupresivy. Otoky dolních i horních končetin u našeho pacienta byly jistě multifaktoriální etiologie (diastolická dysfunkce, venózní etiologie). Podíl Ca blokátoru (amlodipin) je vzhledem k jeho dlouhodobému užívání nepravděpodobný, ale nelze jej zcela vyloučit. Stejně tak hraniční hladina albuminu je málo pravděpodobnou příčinou otoků. Otoky do typického obrazu SINAM nepatří a nejsou běžně popisovány v literatuře. Nicméně je zajímavé, že po zahájení imunosupresivní léčby došlo k částečné regresi jak svalové slabosti, tak i otoků. Pacient nadále zůstává v dispenzarizaci revmatologické ambulance.
SINAM či IMNM obecně jsou vzácná onemocnění, se kterými se internisté a revmatologové ve své klinické praxi běžně nesetkávají. Přesto je důležité na ně myslet u pacientů s progredující svalovou slabostí, užívajících statiny, ale také u nemocných, kteří přicházejí pro otoky končetin s myopatií. Je však nutné zdůraznit, že i přes tyto komplikace, jsou statiny stále bezpečné a účinné preparáty a ve světovém měřítku patří mezi nejčastěji předepisované lékové skupiny.
Poděkování
Autoři děkují za ochotnou spolupráci a cenné připomínky MUDr. Jiřímu Kourkovi z Interního oddělení Vsetínské nemocnice, a.s.
Konflikt zájmů: žádný.
adresa pro korespondenci:
MUDr. Jakub Švarko
Nemocnice Valašské Meziříčí
U Nemocnice 980, 757 01 Valašské Meziříčí
e-mail: jakub.svarko@gmail.com
Zdroje
1. Bergua C, Chiavelli H, Simon JP, et al. Immune-mediated necrotizing myopathy. Z Rheumatol 2016; 75(2): 151–156.
2. Hoogendijk, JE, Amato AA, Lecky BR, Choy EH, Lundberg IE, Rose MR, et al. 119th ENMC international workshop: Trial design in adult idiopathic inflammatory myopathies, with the exception of inclusion body myositis. Neuromuscul Disord 2004; 14(5): 337–345.
3. Mammen AL. Statin-associated autoimmune myopathy. N Engl J Med 2016; 374(7): 664–669.
4. Kalous T, et al. Imunitně zprostředkovaná nekrotizující myopatie. Neurol Praxi 2017; 18(4): 261–264.
5. Bednařík J, Vlčková E, Horák T. Statinová myopatie. Neurol Praxi 2017; 18(1): 15–19.
6. Christopher-Stine L, Casciola-Rosen LA, Hong G, et al. A novel autoantibody recognizing 200-kd and 100-kd proteins is associated with an immune-mediated necrotizing myopathy. Arthritis Rheum 2010; 62(9): 2757–2766.
7. Mohassel P, Mammen AL. Anti-HMGCR Myopathy. J Neuromuscul Dis 2018; 5(1): 11–20.
8. Padala S, Thompson PD. Statins as a possible cause of inflammatory and necrotizing myopathies. Atherosclerosis 2012; 222(1): 15–21.
9. Mammen AL, Pak K, Williams EK, et al. Rarity of anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase antibodies in statin users, including those with self-limited musculoskeletal side effects. Arthritis Care Res (Hoboken) 2012; 64(2): 269–272.
10. Allenbach Y, Drouot L, Rigolet A, Charuel JL, Jouen F, Romero NB, et al. Anti-HMGCR autoantibodies in European patients with autoimmune necrotizing myopathies: inconstant exposure to statin. Medicine (Baltimore) 2014; 93(3): 150–157.
11. Musset L, Allenbach Y, Benveniste O, Boyer O, Bossuyt X, Bentow C, et al. Anti-HMGCR antibodies as a biomarker for immune-mediated necrotizing myopathies: a history of statins and experience from a large international multi-center study. Autoimmun Rev 2016; 15 : 983–993.
12. Werner JL, Christopher-Stine L, Ghazarian SR, Pak KS, Kus JE, Daya NR, et al. Antibody levels correlate with creatine kinase levels and strength in anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase-associated autoimmune myopathy. Arthritis Rheum 2012; 64 : 4087–4093.
13. Kishi T, Rider LG, Pak K, Barillas-Arias L, Henrickson M, McCarthy PL, et al. Association of Anti-3-Hydroxy-3-Methylglutaryl-Coenzyme A reductase autoantibodies with DRB1*07 : 01 and severe myositis in Juvenile myositis patients. Arthritis Care Res 2017; 69 : 1088–1094.
14. Allenbach Y, Mammen AL, Stenzel W, Benveniste O. 224th ENMC International Workshop: Clinico-sero-pathological classification of immune-mediated necrotizing myopathies. Neuromuscul Disord 2018; 28(1): 87–99.
15. Kadoya M, Hida A, Hashimoto Maeda M, Taira K, Ikenaga C, Uchio N, et al. Cancer association as a risk factor for anti-HMGCR antibody-positive myopathy. Neurol Neuroimmunol Neuroinflamm 2016; 3(6): e290.
16. Pinal-Fernandez I, Casal-Dominguez M, Mammen AL. Immune-mediated necrotizing myopathy. Curr Rheumatol Rep 2018; 20(4): 21.
17. Mohassel P, Mammen AL. Anti-HMGCR Myopathy. J Neuromuscular Dis 2018; 5(1): 11-20.
18. Arouche-Delaperche L, Allenbach Y, Amelin D, et al. Pathogenic role of anti-signal recognition protein and anti-3-hydroxy-3-methylglutaryl-CoA reductase antibodies in necrotizing myopathies: Myofiber atrophy and impairment of muscle regeneration in necrotizing autoimmune myopathies. Ann Neurol 2017; 81(4): 538–548.
19. Klein M, Mann H, Pleštilová L, et al. Increasing incidence of immune-mediatednecrotizing myopathy: single-centre experience. Rheumatol (Oxford) 2015; 54 : 2010–2014.
20. Mammen AL, Pak K, Williams EK, et al. Rarity of anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase antibodies in statin users, including those with self-limited musculoskeletal side effects. Arthritis Care Res 2012; 64 : 269–272.
21. Droney L, Gillis D, Wong R. New immunoassays for anti-HMG-CoA reductase antibodies may lead to incorrect diagnosis in inflammatory myositis. Pathology 2017; 49 : 638–639.
22. Stuhlmüller B, Schneider U, González-González JB, Feist E. Disease specific autoantibodies in idiopathic inflammatory myopathies. Front Neurol 2019; 10 : 438.
23. Alvarado-Cardenas M, Marin-Sánchez A, Martínez MA, Martínez-Martínez L, Pinal-Fernandez I, Labrador-Horrillo M, et al. Statin-associated autoimmune myopathy: a distinct new IFL pattern can increase the rate of HMGCR antibody detection by clinical laboratories. Autoimmun Rev 2016; 15 : 1161–1166.
24. Janota T. Biochemické markery nekrózy myokardu v současné klinické praxi. Interv Akut Kardiol 2013; 12(1): 28–33.
25. Sribhen K, Phankingthongkum R, Wannasilp N. Skeletal muscle disease as noncardiac cause of cardiac troponin T elevation. J Am Coll Cardiol 2012; 59(14): 1334–1335.
26. Aggarwal R, Lebiedz-Odrobina D, Sinha A, Manadan A, et al. Serum cardiac troponin T, but not troponin I, is elevated in idiopathic inflammatory myopathies. J Rheumatol 2009; 36; 2711–2714.
27. Schmid J, Liesinger L, Birner-Gruenberger R, et al. Elevated cardiac troponin T in patients with skeletal myopathies. J Am Coll Cardiol 2018; 71(14): 1540–1549.
28. Milone M. Diagnosis and Management of Immune-Mediated Myopathies. Mayo Clinic Proceedings 2017; 92(5): 826–837.
29. Cong L, Pu CQ, Shi Q, Wang Q, Lu XH. Complement membrane attack complex is related with immune-mediated necrotizing myopathy. Int J Clin Exp Pathol 2014; 7(7): 4143–4149.
30. McGrath NM, Turner CP. Isolated gluteal and paravertebral muscle weakness due to anti-3-hydroxy-3-methylglutaryl-coenzyme a reductase antibody-associated necrotizing autoimmune myopathy. Muscle Nerve 2016; 54 : 150–152. 31. Schmidt J. Current classification and management of inflammatory myopathies. J Neuromuscul Dis 2018; 5(2): 109–129.
32. Mammen AL, Tiniakou E. Intravenous immune globulin for statin-triggered autoimmune myopathy. N Engl J Med 2015; 373 : 1680–1682.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Úvodník
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2020 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Bolest na hrudi v ordinaci revmatologa
-
Všechny články tohoto čísla
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Revmatoidní artritida a postižení ledvin
- Mezenchymální kmenové buňky: biologie a potenciál v léčbě systémových onemocnění pojiva
- Úvodník
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Statiny indukovaná nekrotizující autoimunitní myopatie jako neobvyklá příčina extrémních hodnot kardiálních markerů u pacienta se svalovou slabostí a otoky
- Kongres American College of Rheumatology (ACR) 2019
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Revmatoidní artritida a postižení ledvin
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



