-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
Autoři: L. Šedová; J. Tomasová Studýnková
Působiště autorů: Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 28, 2020, No. 1, p. 5-15.
Kategorie: Doporučené postupy
ÚVOD
Mezi zánětlivé revmatické choroby řadíme např. revmatoidní artritidu (RA), ankylozující spondylitidu (AS) a jiné spondyloartritidy včetně psoriatické (PsA), systémový lupus erythematodes (SLE) a další systémové autoimunitní nemoci.
Pacienti s těmito chorobami jsou v průběhu života, stejně tak, jako zbytek populace, indikováni k elektivním i neelektivním chirurgickým výkonům. Významné rozšíření možností farmakoterapie zánětlivých revmatických nemocí v posledních desetiletích přineslo na jednu stranu zřetelné zlepšení jejich prognózy, ale zároveň závažný dopad na imunitní systém, s následnou různou mírou rizikovosti především infekčních komplikací a ovlivnění procesu hojení po chirurgických výkonech.
Nejčastějšími plánovanými výkony u pacientů se zánětlivým revmatickým onemocněním jsou výkony ortopedické k obnovení funkce poškozených kloubů a odstranění konzervativně neovlivnitelné bolesti. Proto jsou data o perioperačních infekčních komplikacích u těchto imunosuprimovaných nemocných nejvíce dostupná pro revmato-ortopedii. Například 58 % nemocných s RA podstoupí ortopedickou operaci a u téměř 24 % se jedná o totální endoprotézu velkých kloubů (1). Proto v roce 2017 publikovala American College of Rheumatology společně s American Association of Hip and Knee Surgeons první doporučení pro perioperační úpravu léčby disease-modifying anti-rheumatic drugs (DMARDs) u pacientů se zánětlivými revmatickými nemocemi s plánovanou totální endoprotézou kyčle a kolene (2).
U zánětlivě revmatických pacientů jsou dále nutné výkony k léčbě komplikací nemoci a komorbidit, pro které již není v literatuře tolik zdrojů. Revmatochirurgické zkušenosti lze však extrapolovat i na obecnou chirurgii.
Mezi faktory, které nejvíce ovlivňují perioperační riziko infekce patří:
a) terapie – od nesteroidních antirevmatik, přes chorobu modifikující léky DMARDs konvenční i biologické, až po glukokortikoidy (GK) (3)
b) závažnost výkonu – od méně závažné operace katarakty s minimálním infekčním rizikem (4), přes ortopedické operace, po výkony břišní chirurgie s výskytem infekcí až v 10 % případů (5)
c) zánětlivá aktivita revmatického onemocnění, která sama o sobě představuje zvýšené riziko infekcí, jak bylo prokázáno např. v souboru 4000 pacientů s RA, kde HR (hazard ratio) bylo 2,0 dle výše DAS 28 (6), nebo v souboru 4321 pacientů s SLE (7) s vyšším výskytem bronchopneumonie, sepse a mortality u nemocných s vyšší aktivitou nebo závažností choroby (8)
d) komorbidity, především obezita, anemie, diabetes mellitus, předchozí infekce a hypalbuminemie, což jsou jinak obecné rizikové faktory i pro nerevmatickou populaci (obr. 1)
Obr. 1. Hlavní rizikové faktory komplikací v perioperačním období 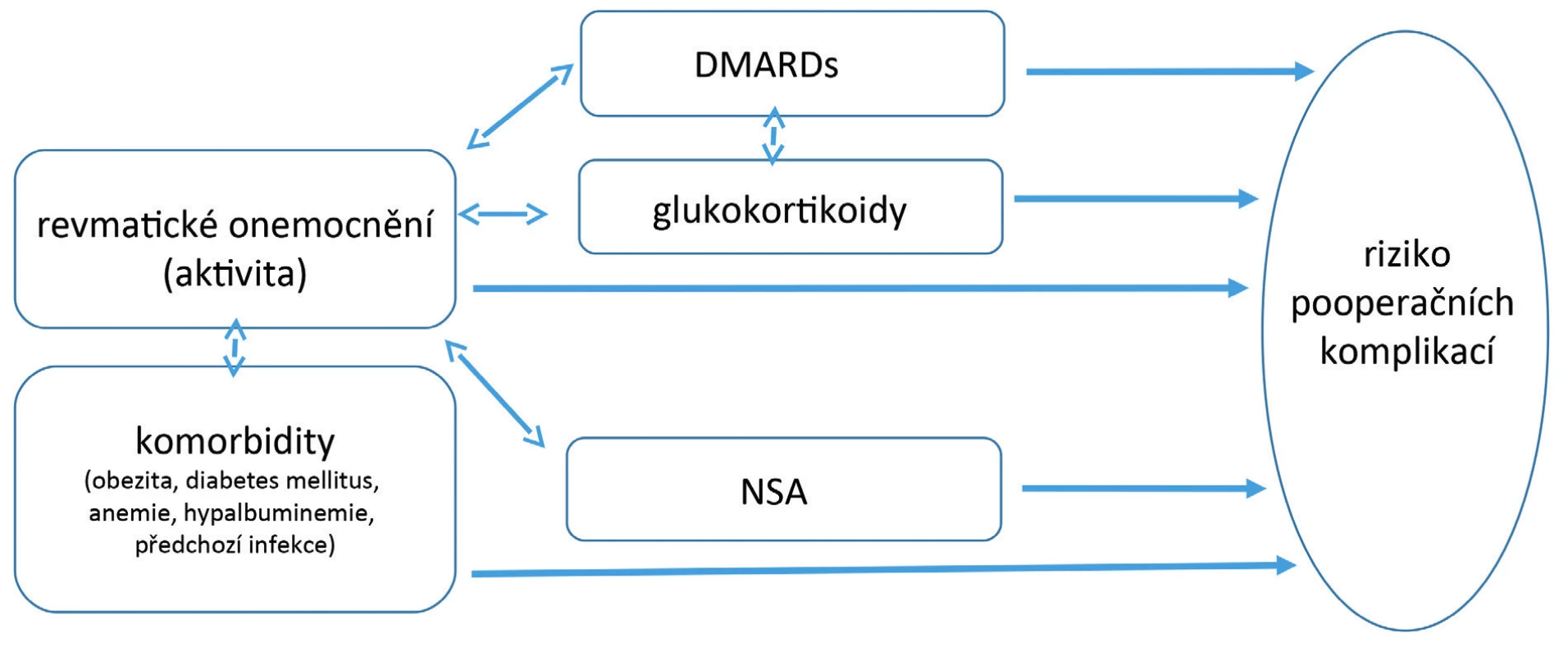
Jednotlivé revmatické choroby nejsou tak četné, např. prevalence revmatoidní artritidy (RA) a anky-lozující spondylitidy (AS) je od 0,5 do 1 % populace, psoriatické artritidy (PsA) okolo 0,16 %a systémového lupus erythematodes (SLE) cca 0,1 % populace (9).
Celkový počet revmatických nemocných je však významný a se situací, kdy řešíme perioperační úpravu léčby revmatika, se setkáváme poměrně často. Nicméně i přes tuto značnou potřebu standardizovaného postupu pro klinickou praxi nejsou jasná doporučení perioperační úpravy léčby pro revmatické choroby dostupná. Důvodem jsou omezené literární zdroje, které se týkají převážně revmatoidní artritidy.
V tomto textu jsme se pokusili shrnout v současnosti dostupná data ze světové literatury a formulovat národní doporučení aplikovatelná v našich podmínkách.
Tato doporučení vznikla na podkladě revize literatury s posledními poznatky týkajících se perioperačních opatření u pacientů se zánětlivými revmatickými chorobami. Nejedná se o závazná doporučení, tento text má za cíl usnadnit v praxi rozhodování o postupech v perioperačním období. Přístup by měl být vždy adaptován individuálně ke konkrétnímu pacientovi.
GLUKOKORTIKOIDY
Glukokortikoidy užívá velká část pacientů s revmatickými chorobami. U revmatoidní artritidy je to téměř 66 % nemocných (10, 11). Riziko infekce u pacientů léčených GK je vysoké, 100 % pacientů léčených 3 roky vyvine nějakou z infekcí (12).
Dlouhodobé podávání glukokortikoidů může zvýšit riziko komplikací v souvislosti s operací ve smyslu zhoršení hojení ran, následků zvýšené fragility kůže a cév, vyššího rizika hematomů a ulcerací, zvýšeného rizika fraktur, gastrointestinálního krvácení, vředové choroby (13, 14).
Dle současných poznatků se léčba glukokortikoidy zdá být nejvýznamnějším rizikem postoperačních komplikací (2).
Kortikoterapie je vysoce asociována s infekcemi a jejich riziko se zvyšuje s kumulativní, ale především s aktuální dávkou (12). Zároveň je známo, že dlouhodobé užívání GK vede k potlačení funkce nadledvin, které je pak spojené u kortikodependentních pacientů s očekávanou nutností podávat suprafyziologické dávky GK v průběhu operačního výkonu, kvůli předpokládanému stresu ze samotného chirurgického výkonu (15). Tento, v perioperačním období dosud všeobecně uznávaný režim (podávání suprafyzio-logických dávek GK u kortikodependentních pacientů), je v současné době velmi diskutován. Už starší randomizované a kontrolované studie, ve kterých byli pacienti léčeni stejnou dlouhodobou, nebo naopak zvýšenou dávkou GK v den operace, nebyly prokázány z hemodynamického hlediska žádné signifikantní rozdíly (16–18). Přesto, že se jednalo o malé studie z hlediska počtů pacientů, lze z jejich výsledků uzavírat, že není nutné zvyšovat dávky GK.
Perioperační úprava dávek GK by měla být následující:
- předoperační podání 100 mg hydrokortizonu i.v. (možné opakovat každých 8 hodin) nebo
- kontinuální peroperační podávání hydrokortizonu i.v. 10 mg/h
- druhý pooperační den podání 50 % dávky 1. dne
- podání GK v uvedených režimech je rovněž indikováno v případě pooperačních komplikací ohrožujících život (sepse, hypotenze, hypovolemický šok) (15)
- u pacientů užívajících 5 mg prednisonu denně a méně, nebo adekvátní dávky metylprednisolonu denně, stačí v den operace podat obvyklou dávku, eventuálně 25 mg hydrokortizonu i.v.
Jiný přístup adaptující dávky glukokortikoidů dle operační zátěže, je uveden v tabulce 1.
Tab. 1. Adaptace dávky glukokortikoidů dle operační zátěže 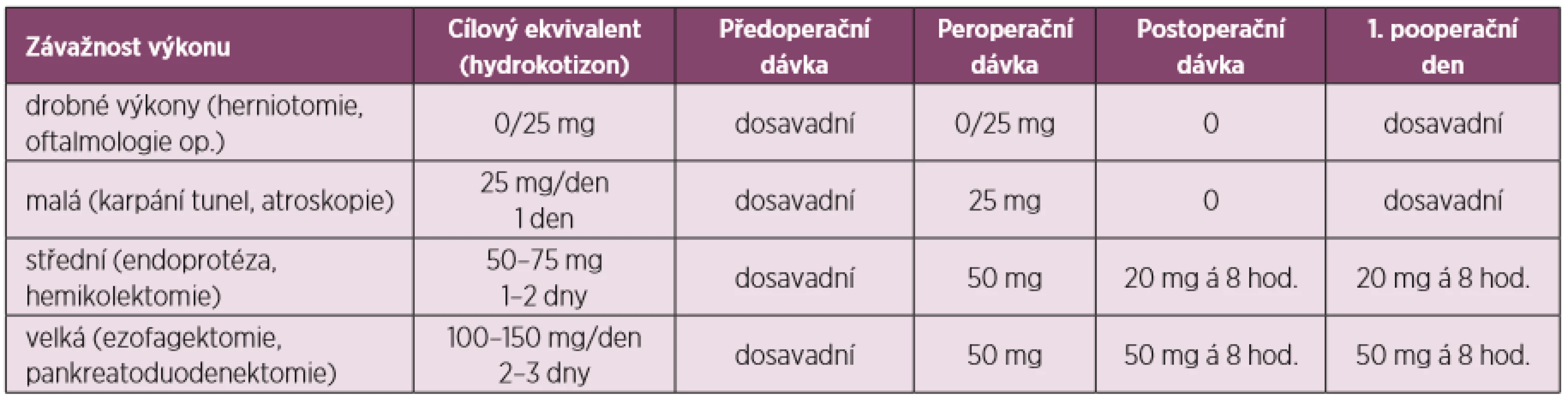
NESTEROIDNÍ ANTIREVMATIKA
Nesteroidní antirevmatika (NSA) jsou u pacientů se zánětlivým kloubním onemocněním jednou z nejvíce předepisovaných lékových skupin v celosvětovém měřítku (19, 20).
Podstatou protizánětlivého působení nesteroidních antirevmatik je inhibice syntézy prostaglandinů pomocí inhibice enzymu cyklooxygenázy (COX). Pokles prostaglandinů je spojen s velkým protizánětlivým efektem, ale na druhou stranu také s vyšším rizikem krvácení (21). NSA proto vysazujeme minimálně tři poločasy před plánovaným chirurgickým zákrokem (22).
Ibuprofen s poločasem 2,5 hodiny vysazujeme 24 hodin před zákrokem, naproxen (poločas 15 hodin) nejméně 4 dny a kyselina acetylsalicylová (ACA), která je trvalým inhibitorem destičkové COX, by se měla vysadit nejméně 7 dní před operací. Je třeba však také vzít v potaz riziko kardiovaskulárních příhod (KVP) v perioperačním období. Revmatoidní artritida představuje totiž samostatný rizikový faktor pro KVP srovnatelný s diabetes mellitus (23), který je dán chronickým zánětlivým stavem. Riziko perioperačních KVP během ortopedických výkonů u běžné populace je 0,6 %, ale u pacientů s předchozí ischemickou chorobou se toto riziko zvyšuje až na 6,5 % (20). Ačkoliv jiné práce na velkých databázích neprokázaly zvýšený výskyt KVP u pacientů s RA v postoperačním období (24), je nutné vždy zvážit i riziko KVP před peri-operačním vysazením antiagregace. Navíc ačkoliv přežití trombocytů osciluje mezi 8–10 dny a jejich obrat činí přibližně 10 % denně, z čehož vyplývá tendence vysazovat ACA 7–10 dní před operací, bylo prokázáno, že se normální funkce trombocytů dosahuje již po 20 % obměně. Stačí proto ACA vysadit 72 hodin před výkonem a opět nasadit po 8–10 dnech bez rizika většího krvácení (25).
Výsledky výzkumu o riziku krvácení u pacientů užívajících ACA jsou kontroverzní a ukazují na jedné straně větší a na druhé nesignifikantní riziko. Naopak je široce přijatý názor, že pacienti s preexistující KVP nemají vysazovat ACA nejen z důvodu profylaxe, ale i k prevenci tzv. syndromu z vysazení ACA charakterizovaného protrombotickým „rebound“ obdobím, který vede ke zvýšené produkci tromboxanu a snížení fibrinolýzy, neboli ke zvýšení tromboembolického rizika (26).
V případě COX-2 selektivních léků, které neinterferují s destičkovou cyklooxygenázou, je nutná pouze opatrnost zejména u starších nemocných s vyšším kardiovaskulárním rizikem a poruchou funkce ledvin, protože může docházet ke zhoršení hojení ran, dalšímu zhoršení renálních funkcí, navýšení kardiovaskulárního rizika a rizika cévní mozkové příhody.
Zajímavá je však práce Beckmanna et al. (27), která vyzdvihuje účinek naproxenu podávaného po dobu 3 týdnů 500 mg 2krát denně po artroskopii kyčle z indikace femoroacetabulárního impingementu v redukci heterotopických osifikací (HO). V této studii profylaktické podávání naproxenu redukovalo prevalenci heterotopických osifikací na 4 % ve srovnání s placebovou skupinou, kde prevalence byla 46 %. U pacientů s ankylozující spondylitidou (AS) byly původně obavy z heterotopických osifikací v okolí endoprotéz, což vedlo v minulosti k negativnímu postoji k radikálnímu řešení pokročilého postižení kyčlí u rizomelické formy tohoto onemocnění. Obavy z heterotopických osifikací se však ukázaly jako plané. Nelze vyloučit, že právě pravidelné užívání NSA pacienty s AS je jeden z důvodů, proč k heterotopickým osifikacím nedochází v tak velké míře, jak se předpokládalo.
KONVENČNÍ SYNTETICKÉ CHOROBU MODIFIKUJÍCÍ LÉKY (csDMARDs)
Methotrexát
Jedná se o inhibitor dihydrofolát-reduktázy s antiproliferativními a imunosupresivními účinky. Je nejčastěji používaný csDMARD a také nejlépe prozkoumaný preparát z hlediska bezpečnosti v perioperačním období (28).
Data ohledně rizika infekcí a zhoršení hojení ran spojeného s podáváním či naopak s vysazením MTX v předoperačním období byla zpočátku nejednotná. V posledních letech na podkladě systematických literárních přehledů randomizovaných a kontrolovaných studií se prosazuje názor, že nejen ponechání MTX v perioperačním období nezvyšuje riziko infekce ani zhoršení hojení (29), ale naopak, že při vysazení MTX dochází častěji ke vzplanutí zánětlivé aktivity a tím i k možným následným komplikacím při hojení (30).
Dosud největší prospektivní kohortovou studii hodnotící vhodnost vysazování či ponechávání MTX perioperačně publikovali Grenann et al. již v roce 2001. Na téměř 400 subjektech, které sledovali ještě rok po ortopedickém výkonu, prokázali, že pokud byl ponechán MTX, nedošlo k vyššímu výskytu infekcí či komplikací při hojení a ani k žádnému relapsu RA. Perioperační relapsy se však vyskytly v 10 % případů do 6 týdnů od vysazení MTX (31).
I další publikace potvrzují vyšší riziko vzplanutí RA u pacientů, kteří přeruší perioperační léčbu MTX, a nižší riziko relapsu RA při pokračování v této medikaci (32, 33).
Vzhledem k tomu, že až 80 % MTX je vylučováno ledvinami, je nutné u starších pacientů, u kterých je běžný pokles glomerulární filtrace, zvažovat i tento aspekt. Navíc glomerulární filtrace významně kolísá v postoperačním období, a to může vést k dalšímu snížení clearance MTX. Toto společně s podáváním NSA ke zvládnutí pooperační bolesti může vést ke zvýšení koncentrace MTX.
Doporučuje se proto přistupovat k problematice individuálně s ohledem na další rizika konkrétního pacienta. Ve většině případů nebude přerušení léčby indikované. K úvaze o vysazení by se mělo přistoupit při zhoršeném hojení. Vynechání dávky MTX týden před a 1–2 týdny po výkonu je vhodné u starších pacientů, v případě renální insuficience, nedostatečně kontrolovaného diabetes mellitus, při chorobách plic a jater, abúzu alkoholu a také v případě současného užívání více než 10 mg prednisonu denně (34, 35).
Leflunomid
Leflunomid je inhibitor syntézy pyrimidinu. Výsledky prací analyzujících riziko infekčních komplikací u operovaných pacientů léčených leflunomidem (LEF) jsou kontroverzní. Zatím co dle jedné je riziko popisováno u LEF ve srovnání s MTX významně vyšší (40,6 % oproti 13,6 %) ve smyslu infekcí, zhoršeného hojení operačních ran a nekrózy jizev, a podle autorů tedy chirurgický výkon žádá tzv. „wash out“ s cholestyraminem (podání 8 g cholestyraminu 3krát denně po dobu 11 dnů) (36), dle další studie nikoliv (37). Nebyl však pozorován rozdíl mezi kohortami pacientů, kteří LEF vysadili měsíc před elektivním výkonem, či nikoliv (37).
Ačkoliv dlouhý poločas leflunomidu nedovoluje jeho úplné odstranění v krátké době, celkový konsenzus (Class C evidence) doporučuje jeho vysazování 5–7 dní před operací ke snížení jeho celkové koncentrace a znovu nasazení po zhojení operační rány, v klasických případech cca po 2 týdnech od výkonu.
Ohledně „wash out“ by toto mělo být rezervováno pro stavy se závažnou infekcí, ale mělo by se zvažovat i u pacientů s vysokým rizikem, jako je anamnéza infekce endoprotézy nebo kožní infekce (38).
Sulfasalazin a hydroxychlorochin
Ačkoliv nebyly provedeny adekvátně vypovídající studie o používání těchto dvou preparátů v perioperačním období, dosavadní zkušenosti svědčí proto, že jsou relativně bezpečné. Předoperační vysazení hydroxychlorochinu by navíc nebylo vzhledem k jeho velmi dlouhému tkáňovému poločasu efektivní.
Efekt hydroxychlorochinu může být spíše protektivní u operací z důvodu snížení aktivity onemocnění, snížení kardiovaskulárního rizika a snížení počtu tromboembolických příhod (39).
Salazopyrin se zdá být naopak přínosný z hlediska prevence infekcí pro jeho antimikrobiální účinek. Je nutné však sledovat krevní obraz pro možnost vzniku leukopenie. Oba preparáty lze opět podat, jakmile nemocný je schopen p.o. příjmu (22).
Ohledně bezpečnosti dalších DMARDs, jako jsou azathioprin, cyklosporin, cyklofosfamid a mykofenolát mofetil, jsou v literatuře jen kazuistická data. Vzhledem k jejich imunosupresivnímu účinku je však vhodné je vysadit týden před plánovaným výkonem, pokud to dovolí závažnost revmatického onemocnění. V případě systémového lupus erythematodes je nutné pečlivě a individuálně posoudit aktivitu choroby a riziko vzplanutí při vysazení léčby oproti riziku infekčních komplikací při jejím ponechání (2).
BIOLOGICKÉ CHOROBU MODIFIKUJÍCÍ LÉKY (bDMARDs)
Inhibitory TNF
TNF je prozánětlivý cytokin, který se významnou mírou podílí na procesu vzniku i perpetuaci zánětu u RA, AS i psoriatické artritidy (PsA). Jeho blokáda vede k účinné kontrole aktivity nemoci a zabraňuje kloubním destrukcím. TNF hraje ovšem důležitou roli v imunitní odpovědi prostřednictvím apoptózy infikovaných buněk a destrukci nitrobuněčných organismů, z čehož vyplývá vyšší riziko závažných, především oportunních infekcí (40).
Nejčastějšími patogeny kožních infekcí a infekcí měkkých tkání jsou stafylokoky, které ve zvýšené míře kolonizuji pacienty s RA. Pokud jsou léčeny blokátorem TNF, je tento výskyt ve srovnání s pacienty léčenými jinými preparáty ještě častější, především na vrub Staphylococcus aureus (41). Kožní, kostní a kloubní infekce jsou u pacientů s RA nejčastěji vyvolány právě kmenem Staphylococcus aureus.
Analýza německých autorů z roku 2013 zaznamenala sice signifikantně vyšší výskyt infekcí ve skupině, kde nebyla léčba blokátory TNF pozastavena po dobu ortopedické intervence (35 infekcí při 681 výkonech – 5,1 %), (p < 0,05) ve srovnání se skupinou, kde léčba byla přerušena (28 případů infekcí při 870 výkonech – 3,2 %), ale při multivariační analýze vyšlo vyšší riziko pouze u operací nohy, a to pravděpodobně vzhledem k velmi nízké frekvenci infekcí ve skupině bez anti-TNF. Nejvýznamnější dalším prediktorem infekcí byl vyšší věk pacientů (42).
V roce 2016 byla provedena další metaanalýza šesti studií s celkovým počtem 2743 pacientů rozdělených do dvou skupin, kde u 1360 léčba blokátory TNF v perioperačním období pokračovala a u 1383 nemocných byla pozastavena (43). Ve skupině pa-cientů, u kterých byla léčba přerušena, bylo prokázáno snížení rizika pooperačních infekcí v porovnání se skupinou pacientů pokračujících v léčbě.
Tyto nálezy jsou konzistentní s výsledky další metaanalýzy Goodmanové et al., která srovnávala jedenáct prací sledujících operační infekce u pacientů na terapii inhibitory TNF (celkový počet pacientů 3683) oproti pacientům na terapii syntetickými DMARDs (celkový počet pacientů 4310) a prokázala na sdílených datech zvýšení rizika hlubokých i povrchových infekcí s OR (odds ratio, podíl šancí) 2,47 se statistickou významností p < 0,0001 (44). Přestože klinická hodnocení zařazená do této metaanalýzy byla menší, její výsledky potvrdila i metaanalýza Mabilleové z roku 2017 (45). V práci Cordtze z roku 2018 (46) bylo hodnoceno riziko infekčních komplikací u pacientů s diagnózou RA podstupujících totální endoprotézu kloubu. Pacienti byli rozděleni do dvou skupin s nebo bez biologické terapie (BT) a byli sledováni po dobu 90 dnů po endoprotéze kolenního nebo kyčelního kloubu. Do této studie bylo zařazeno 345 pacientů na biologické léčbě (BL) a 1601 pacientů, kteří biologickou léčbu nedostávali. Přestože výsledky nebyly statisticky významné, ve skupině pacientů s BT v porovnání s pacienty bez BT byl zaznamenán vyšší počet pooperačních infekcí (2,8 vs. 1,9 na 100 paciento-roků).
Z této studie také vyplynulo, že pacienti léčení BL měli v době operace vyšší aktivitu základního onemocnění a byli také častěji léčeni glukokortikoidy než pacienti bez biologické léčby. Počet infekcí u pacientů s vyšší aktivitou onemocnění hodnocenou pomocí skóre DAS28 před operací a pacientů, kteří měli glukokortikoidní terapii, byl vyšší. Glukokortikoidy byly také asociovány s větším rizikem úmrtí v průběhu 1 roku po operaci.
Zdá se, že je nutné před elektivním chirurgickým výkonem zvážit fakt, že vysazení blokátorů TNF může vést, i v krátké době, k reaktivaci, či zhoršení zánětlivého onemocnění, což je jedním z rizikových faktorů infekcí, zvláště pak je-li toto posléze potlačováno pomocí glukokortikoidů. V současné době však většina autorů doporučuje vysazení anti-TNF léčby předem minimálně dva poločasy konkrétního preparátu, s přihlédnutím k závažnosti výkonu, a znovu ji nasadit při dobrém hojení po 2–3 týdnech (44).
Terapie ovlivňující B-lymfocyty
Rituximab je monoklonální protilátka proti CD20 antigenu, který prezentují pre-B-lymfocyty a zralé B-lymfocyty; po diferenciaci do plasmatických buněk produkujících protilátky CD20 ztrácí. Má ve srovnání s ostatními biologiky i syntetickými DMARDs příznivější bezpečnostní profil.
V databázi Autoimmunity and Rituximab Registry 133 pacientů absolvovalo celkem 140 operací v průběhu 12 měsíců od podání infuze s rituximabem. Z nich 95 absolvovalo operaci ortopedickou a 7,4 % mělo nějakou komplikaci, především infekční. Přesto nebyla prokázána souvislost s dobou od podání medikace. Nejsou tedy u rituximabu indikovány žádné speciální úpravy léčby před chirurgickým výkonem, ale opatrnost velí podstoupit elektivní operaci na konci léčebného cyklu, tj. cca půl roku od poslední infuze (3).
K rizikům infekce bez ohledu na chirurgické intervence u pacientů léčených rituximabem patří hypogamaglobulinemie, extraartikulární postižení při RA a jiné závažné komorbidity.
Belimumab je plně humánní rekombinantní IgG1λ monoklonální protilátka, která blokuje vazbu solubilního BLyS (soluble B lymphocyte stimulator) na B-lymfocyty. Je indikován k léčbě SLE, ale zatím je určen pro pacienty bez nefrologických či neurologických manifestací tohoto onemocnění. Otázka rizika vzplanutí choroby při vysazení versus rizika infekce je zatím stále diskutována. Současná doporučení se přiklánějí spíše k vysazení tohoto preparátu před plánovaným chirurgickým výkonem z důvodu rizika infekce (47, 48).
Inhibitory IL-6
Tocilizumab je humanizovaná protilátka, která blokuje receptor prozánětlivého cytokinu IL-6, který má klíčovou roli v patogenezi RA. Podává se podkožně jednou za týden nebo i.v. jednou za měsíc.
V práci s 22 pacienty na této terapii při srovnání s nemocnými léčenými syntetickými DMARDs nebyly zaznamenány žádné infekce nebo zhoršení hojení (49). Na druhé straně v jiné studii se 161 chirurgickými výkony, došlo ke dvěma případům zhoršeného hojení a ke třem případům infekcí z nich dva byly povrchové (50).
V retrospektivní kontrolované studii, která srovnávala proces hojení a zánětlivou aktivitu u 44 pacientů s RA po endoprotézách horních či dolních končetin léčených tocilizumabem nebo syntetickými DMARDs, u kterých byla poslední i.v. dávka tocilizumabu podávána v průměru 16 dní před výkonem, nebyly nalezeny rozdíly v hladinách C-reaktivního proteinu, počtu bílých krvinek, tělesné teplotě, výskytu povrchových či hlubokých infekcí ani v trvání procesu hojení (49).
Tocilizumab má však přímý vliv na produkci CRP a jiných reaktantů akutní fáze stejně jako na vývoj febrilie. Je proto nutná velká opatrnost při posouzení eventuální možné infekční komplikace, u které mohou být vlivem tohoto preparátu mitigované hlavní varující příznaky. Toto varování by mělo být součástí každé předoperační zprávy u nemocných léčených tocilizumabem.
Přes nedostatek literárních informací se zdá bezpečné vysazování i.v. formy 4–6 týdnů a s.c. formu 2 týdny před chirurgickým zákrokem a zpětné nasazení v obou případech po 2–3 týdnech při dobrém hojení.
Sarilumab je na trhu nový blokátor aktivity IL-6. Je to lidská monoklonální protilátka proti solubilnímu i membránově vázanému receptoru IL-6. Podává se v podkožních injekcích jednou za 14 dní. Vzhledem ke kratší době používání nejsou specifické práce ohledně jeho perioperační bezpečnosti. Lze však pro společný mechanismus účinku vyvodit obdobný perioperační postup jako u tocilizumabu (51).
Inhibitor kostimulačního signálu
Abatacept je imunomodulátor působící blokádu kostimulačního signálu mezi CD80/86 a CD28, což je nezbytné pro plnou aktivaci T-lymfocytů. Má dobrý bezpečnostní profil prokázaný v průběhu kontinuální sedmileté léčby.
Analýza 263 pacientů z francouzského registru na terapii i.v. abataceptem, kteří absolvovali různé chirurgické zákroky, neprokázala souvislost mezi časem poslední dávky preparátu a rizikem komplikací. Nedostatkem této práce je sice malý počet případů (52), avšak větší soubor ze Spojených států amerických s 1537 pacientů na stejné terapii, kteří absolvovali implantaci totální endoprotézy kyčle či kolene, ukázala podobné výsledky. Výskyt pooperačních infekčních komplikací byl srovnatelný u těch, u kterých byl abatacept podán bez přestávky do termínu chirurgického zákroku, a těmi, u kterých byl vysazen 4 a více týdnů před výkonem (53).
Vzhledem k poločasu abataceptu 13–14 dní je vysazení 2 týdny před operací zřejmě dostatečné. Opět nasadit lze po dobrém zhojení (38).
Inhibitor IL-1
Anakinra je rekombinantní forma přirozeně se vyskytujícího lidského antagonisty receptoru pro interleukin 1. U nás se používá především v indikaci Stillovy choroby v dospělosti. Podává se denně v s.c. injekcích a jeho poločas je 4–6 hodin. Výskyt závažných nežádoucích účinků včetně výskytu infekci je minimální a srovnatelný s placebem. Dosud nebyl hlášen ani výskyt oportunních infekcí jako při léčbě blokátory TNF.
Podle zvířecího modelu se zdá, že by mohl negativně ovlivnit hojení (54) a vzhledem k tomu, že IL-1 hraje významnou roli také v ochraně hostitele proti infekcím, je opatrné vysadit anakinru 1–2 dny před chirurgickým výkonem střední až velké závažnosti a opět nasadit 10 dní po zhojení (2, 55).
Inhibitory IL-17
Interleukin 17 je prozánětlivě působící cytokin, který hraje důležitou úlohu při rozvoji psoriázy, psoriatické artritidy a jiných autoimunitních chorob. Cesta k dosažení inhibice IL-17 vede přes monoklonální protilátky proti jeho součástem i proti jeho receptorům, přes protilátky proti p40 podjednotce sdílené IL-12 a 23 a zabraňující jejich interakci s receptorem, následnou signalizaci, diferenciaci a produkci cytokinů, včetně IL-17. V současné době jsou registrovány secukinumab, ixekizumab a ustekinumab. Podávají se v podkožních injekcích. Ani pro tyto preparáty nejsou data týkajících se bezpečnosti perioperačního podávání, ale analýzy ze studií ERASURE a FIXTURE pro pacienty s psoriázou, které srovnávaly secukinumab s placebem a etanerceptem prokázaly, že bezpečnostní profil secukinumabu a etanerceptu je srovnatelný (56).
Další práce též u plakové psoriázy (CLEAR) srovnává secukinumab a ustekinumab a uvádí, že bezpečnostní profil srovnávaných přípravků byl obdobný (57). Stejně tak vykazuje ixekizumab podobné bezpečnostní kvality (58).
Lze proto přenést zkušenosti s ostatními biologiky, a buď vysadit, popř. naplánovat chirurgický výkon na konec terapeutického cyklu.
CÍLENÉ SYNTETICKÉ CHOROBU MODIFIKUJÍCÍ LÉKY (tcDMARDs)
Inhibitory Janusových kináz
Tofacitinib, baricitinib, upadacitinib blokují různé typy Janus kináz, které se účastní patogeneze zánětu.
Zatím nejsou k dispozici data ohledně výskytu infekcí při chirurgických výkonech u pacientů na terapii těmito preparáty. Jejich poločas je však tak krátký (3 hodiny tofacitinib, resp. 12,5 hodiny u baricitinibu, 9–14 hodin u upadacitinibu), že vysazení 2–3 dny před operací by mělo být dostatečně bezpečné (38, 59).
Apremilast není k revmatologickým indikacím v České republice dostupný. Protože se nejedná o imunosupresivum, ale o imunomodulans, neměl by v perioperačním období představovat ani riziko infekcí ani zhoršeného hojení. Je ovšem nutné získat bezpečnostní data i pro tyto situace.
Tabulky 2, 3 a 4 ukazují přehled DMARDs s jejich poločasem, dávkováním, doporučeným časem vysazení před a nasazením po operaci i s některými speciálními opatřeními u některých z nich.
Tab. 2. Úprava perioperační léčby dle preparátů csDMARDs (upraveno dle Goodmanové 2017) 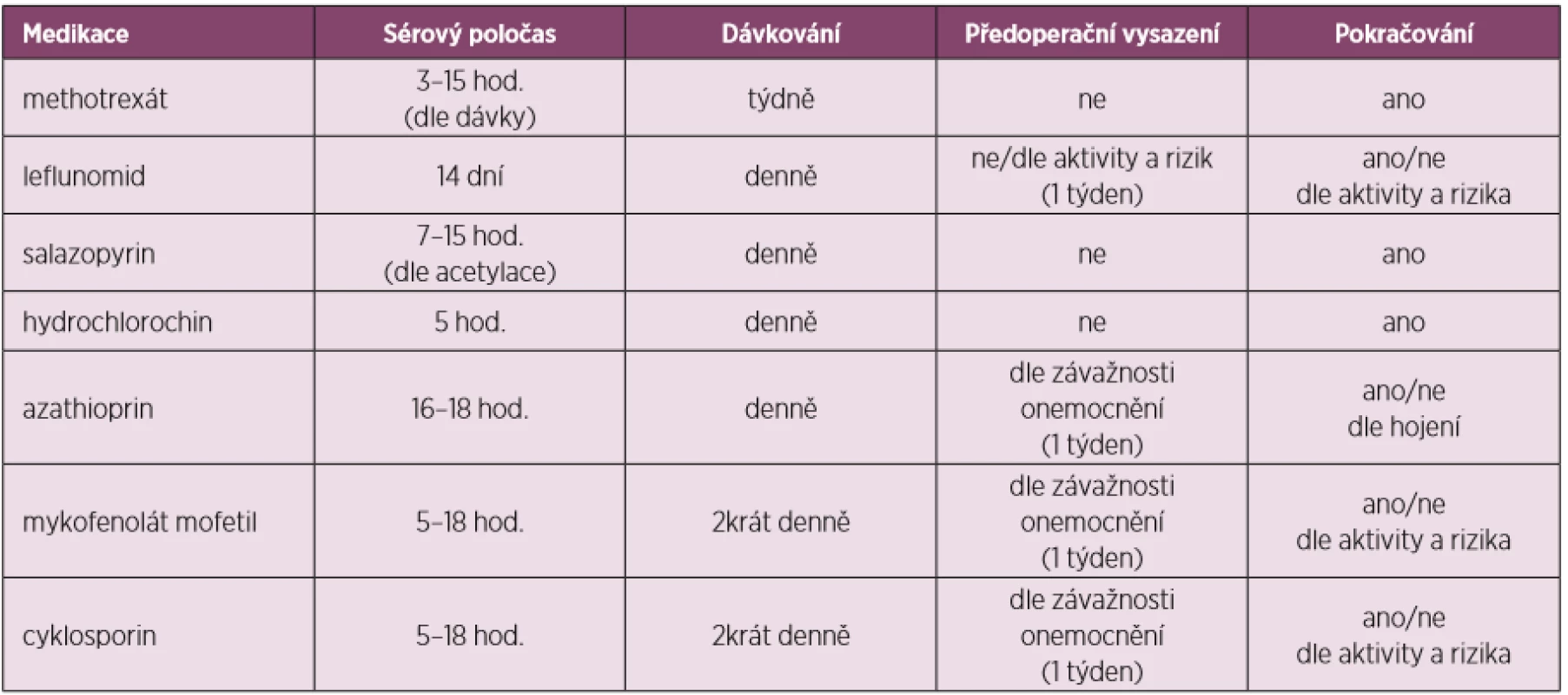
Tab. 3. Úprava perioperační léčby dle preparátů anti-TNF-α (upraveno dle Goodmanové 2017) 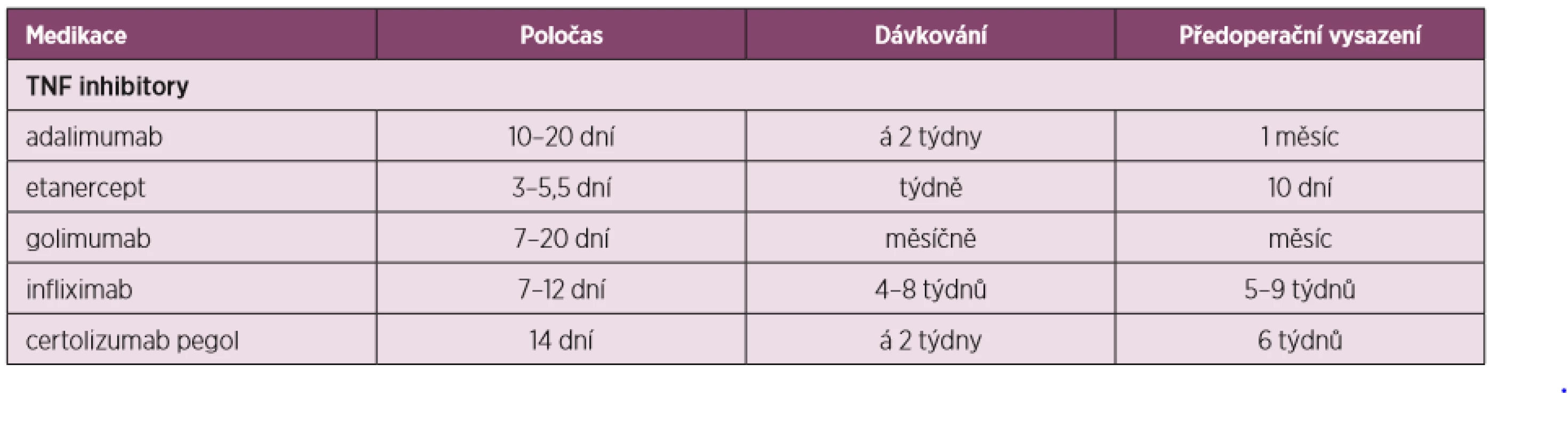
Tab. 4. Úprava perioperační léčby dle preparátů – další bDMARDs a tsDMARDs (upraveno dle Goodmanové 2017) 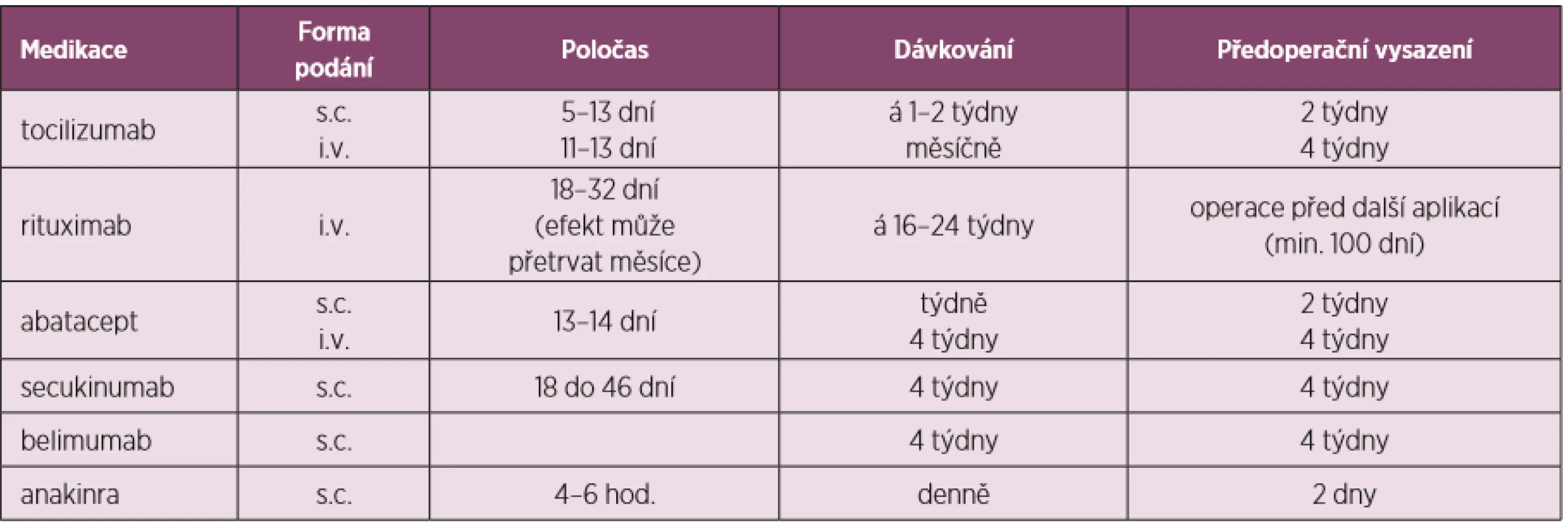
Oproti těmto doporučením francouzská revmatologická společnost publikovala svá vlastní doporučení pro léčbu revmatoidní artritidy, kde v případě blokátorů TNF se řídí kromě poločasů preparátu i závažností vlastního operačního výkonu a dělí výkony dle rizika kontaminace při operaci na malé, střední, vysoké a velmi vysoké, při čemž je operace katarakty příkladem malého rizika, sigmoiditida představuje vysoké riziko a totální endoprotéza (ev. reoperace) velmi vysoké riziko (tab. 5) (60). Postup při léčbě DMARDs znázorňuje obrázek 2.
Tab. 5. Léčba TNFi v souvislosti s rizikem infekce při operaci (upraveno dle Phama 2011) 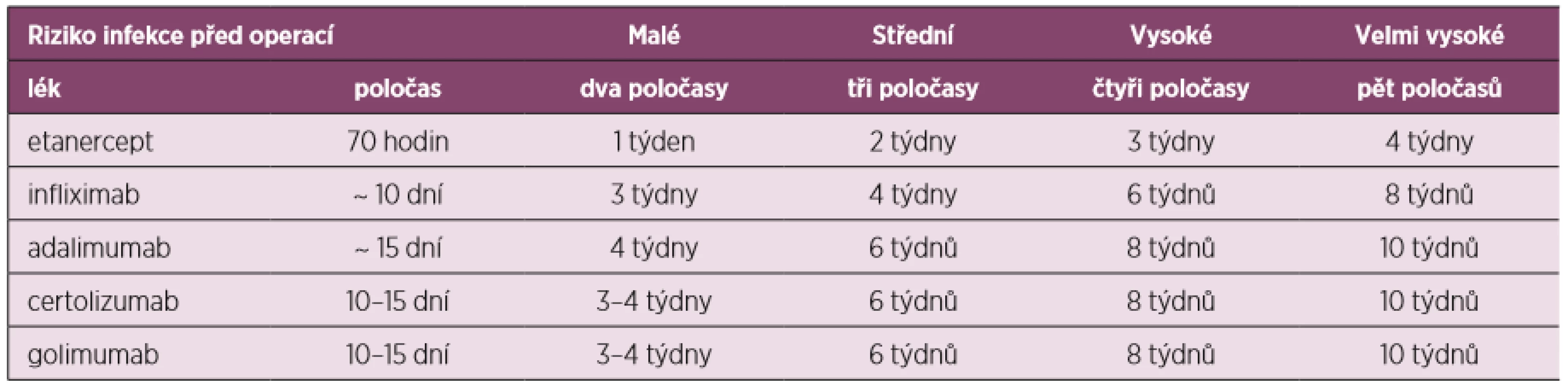
Znovu podat po zhojení bez známek jakékoliv i minimální infekce. Obr. 2. Přehled postupu DMARDs 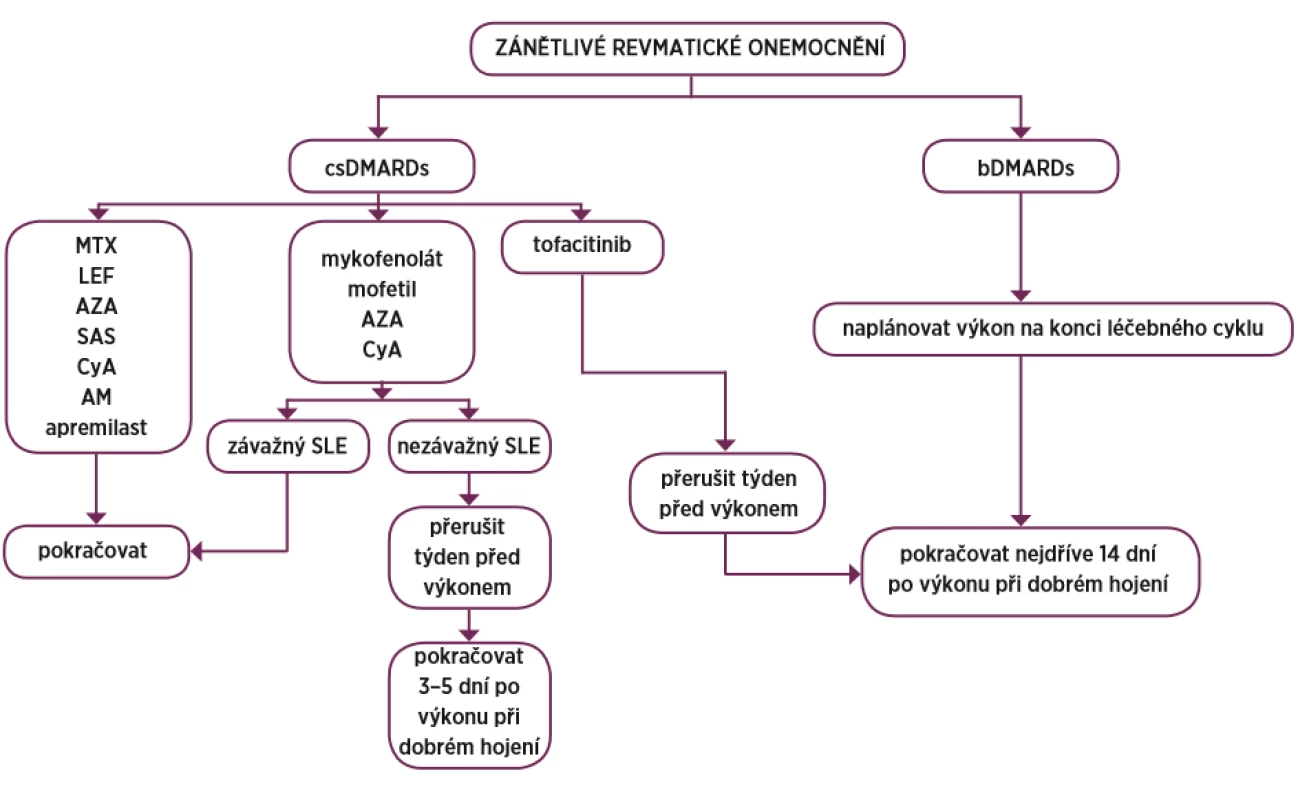
DMARDs – chorobu modifikující léky, csDMARDs – konvenční syntetické DMARDs, bDMARDs – biologické DMARDs, MTX – methotrexát, LEF – leflunomid, AZA – azathioprin, SAS – salazopyrin CyA – cyklosporin A, AM – antimalarika, SLE – systémový lupus erythematodes ZÁVĚR
Ačkoliv se možnosti terapie zánětlivých kloubních onemocnění neustále rozšiřují a lze aktivitu chorob povětšinou držet pod kontrolou, přetrvává u pa-cientů s těmito chorobami potřeba ortopedických výkonů především k ovlivnění chronické bolesti a obnovení ztrácené funkce kloubů, stejně jako i jiných chirurgických intervencí k léčbě komplikací nebo komorbidit. Proto je stále aktuální otázka managementu imunosupresivní, imunomodulační a další léčby k minimalizaci rizik a optimalizaci výsledků stále aktuální a měla by probíhat ve spolupráci revmatologa s ortopédem nebo chirurgem.
Předčasné vysazování DMARDs nebo navyšování dávek glukokortikoidů může vést ke zbytečným komplikacím, jako jsou relapsy aktivity choroby nebo infekcím. Fakt, že vyšší aktuální dávky glukokortikoidů (nad 10 mg) jsou stejně, ne-li více nebezpečné z hlediska rizika infekcí než terapie DMARDs, a že při adekvátní úpravě léčby v perioperačním období lze se těmto rizikům vyhýbat je opomíjen.
Česká revmatologická společnost (ČRS) vydává proto nyní tato obecná doporučení, která navazují na doporučení ČRS pro monitorování bezpečnosti léčby revmatoidní artritidy z roku 2009 (61) a která by se měla stát pomůckou pro revmatology i ostatní odborníky v péči o revmatiky v perioperačním období.
HLAVNÍ BODY DOPORUČENÍ
- Před úpravou léčby zánětlivých onemocnění v perioperačním období je nutné zohlednit:
- bezpečnostní profil druhu terapie a konkrétního preparátu
- rizikovost konkrétního pacienta (komorbidity a jejích léčba, předchozí infekce, BMI, zánětlivá aktivita revmatického onemocnění, závažnost výkonu)
- Před vysazením antirevmatické léčby je třeba individuálně hodnotit závažnost základního onemocnění a riziko plynoucí z možného vzplanutí choroby a komplikací vyplývajících z něho (62, 63), zejména u SLE, kde není dostatek literárních zdrojů (obr. 2).
- Nejvýznamnějším rizikovým faktorem infekčních komplikací i zhoršeného hojení je léčba glukokortikoidy.
- Při úvaze o vysazení NSA z důvodů rizika krvácení je nezbytné zvážit kardiovaskulární riziko při vynechání antiagregace.
- Inhibitory IL-6 mají přímý vliv na produkci CRP a jiných reaktantů akutní fáze stejně jako na vývoj febrilie. Je proto nutná velká opatrnost při posouzení eventuální možné infekční komplikace, u které mohou být vlivem tohoto preparátu mitigované hlavní varující příznaky. Toto varování by mělo být součástí každé předoperační zprávy u nemocných léčených inhibitory IL-6.
- V případě akutních (neelektivních) výkonů nelze upravit léčbu předoperačně, ale peroperační i postoperační postupy zůstávají shodné
Poděkování
Podporováno výzkumným projektem Ministerstva zdravotnictví ČR koncepčního rozvoje výzkumné organizace 00000023728 Revmatologický ústav.
Konflikt zájmů: žádný.
doporučené postupy
adresa pro korespondenci:
MUDr. Liliana Šedová
Revmatologický ústav
Na Slupi 4, 128 50 Praha 2
e-mail: sedova@revma.cz
Zdroje
1. Sindhu K, Cohen B, Gil JA. Perioperative Management of Rheumatoid Medications in Orthopedic Surgery Orthopedics 2017; 40 : 282–286.
2. Goodman SM, Springer B, Guyatt G, et al. 2017 American College of Rheumatology/American Association of Hip and Knee Surgeons Guideline for the Perioperative Management of Antirheumatic Medication in Patients With Rheumatic Diseases Undergoing Elective Total Hip or Total Knee Arthroplasty. Arthritis Rheumatol 2017; 69 : 1538–1551.
3. Goodman SM, Figgie M. Lower extremity arthroplasty in patients with inflammatory arthritis: Peroperative and perioperative management. J Am Acad Orthop Surg 2013; 21 : 355–363.
4. Creuzot-Garcher CP, Mariet AS, Benzenine E, et al. Is combined cataract surgery associated with acute postoperative endophthalmitis? A nationwide study from 2005 to 2014. Br J Ophthalmol 2019; 103 : 534–538.
5. van Arendonk KJ, Tymitz KM, Gearhart SL, et al. Outcomes and costs of elective surgery for diverticular disease: a comparison with other diseases requiring colectomy. JAMA Surg 2013; 148 : 316–321.
6. Cordtz RL, Zobbe K, Højgaard P, et al. Predictors of revision, prosthetic joint infection and mortality following total hip or total knee arthroplasty in patients with rheumatoid arthritis: a nationwide cohort study using Danish healthcare registers. Ann Rheum Dis 2018; 77 : 281–288.
7. Lin JA, Liao CC, Lee YJ, et al. Adverse outcomes after major surgery in patients with systemic lupus erythematosus: a nationwide population-based study. Ann Rheum Dis 2014; 73 : 1646–1651.
8. Au K, Reed G, Curtis JR, et al. High disease activity is associated with an increased risk of infection in patients with rheumatoid arthritis. Ann Rheum Dis 2011; 70 : 785–791.
9. Gabriel SE, Michaud K. Epidemiological studies in incidence, prevalence, mortality, and comorbidity of the rheumatic diseases. Arthritis Res Ther 2009; 11 : 229.
10. Shourt CA, Crowson CS, Gabriel SE, et al. Orthopedic surgery among patients with rheumatoid arthritis 1980-2007: a population-based study focused on surgery rates, sex, and mortality. J Rheumatol 2012; 39 : 481–485.
11. Caplan L, Wolfe F, Russell AS, et al. Corticosteroid use in rheumatoid arthritis: prevalence, predictors, correlates, and outcomes Rheumatol 2007; 34 : 696–705.
12. Dixon WG, Suissa S, Hudson M. The association between systemic glucocorticoid therapy and the risk of infection in patients with rheumatoid arthritis: systemic review and meta-analyses Arthritis Res Ther 2011; 13: R139.
13. Eijsbouts A, van den Hoogen F, Laan R, et al. Similar response of adrenocorticotrhophic hormone, cortisol and prolactin to surgery in rheumatoid arthritis and osteoarthritis. Br J Rheumatol 1998; 37 : 1138–1139.
14. Friedman RJ, Schiff CF, Bromberg JS. Use of supplemental steroids in patients having orthopedic operations. J Bone Joint Surg Am 1995; 77 : 1801–1806.
15. Coursin DB, Wood KE. Corticosteroid supplementation for adrenal insufficiency. JAMA 2002; 287 : 236–240.
16. Jasani MK, Freeman PA, Boyle JA, et al. Cardiovascular and plasma cortisol responses to surgery in corticosteroid-treated RA patients. Acta Rheumatol Scand 1968; 14 : 65–70.
17. Thoomason JM, Girdler NM, Kendall-Taylor P, et al. An investigation into the need for supplementary steroids in organ transplant patients undergoing gingival surgery. A double-blind, split-mouth, cross-over study. J Clin Periodontol 1999; 26 : 577–582.
18. Dixon WG, Bansback N. Understanding the side effects of glucocorticoid therapy: shining a light on a drug everyone thinks they know. Ann Rheum Dis 2012; 71 : 1761–1764.
19. Saleh KJ, Kurdi AJ, El-Othmani MM, et al. Perioperative treatment of patients with rheumatoid arthritis. J Am Acad Orthop Surg 2015; 23: e38–48.
20. Forejtová Š. Systémová nesteroidní antirevmatika. In: Farmakoterapie revmatických onemocnění. Praha: Maxdorf 2017; 33–41.
21. Basilico FC, Sweeney G, Losina E, et al. Risk factors for cardiovascular complications following total joint replacement surgery. Arthritis Rheum 2008; 58 : 1915–1920.
22. Buckwalter JA, Ballard WT, Brooks P. Principles of arthritis surgery. In: Hochberg MC, Silman AJ, Smolen JS, Weinblatt ME, Weisman MH. (eds.) Rheumatology, 3rd ed. New York: Mosby 2003; 532–542.
23. Lindhardsen J, Ahlehoff O, Gislason GH, et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study. Ann Rheum Dis 2011; 70 : 929–934.
24. Domsic RT, Lingala B, Krishnan E. Systemic lupus erythematosus, rheumatoid arthritis, and post arthroplasty mortality: a cross-sectional analysis from the nationwide inpatient sample. J Rheumatol 2010; 37 : 1467–1472.
25. Jimenez AH, Stubbs ME, Tofler GH, et al. Rapidity and duration of platelet suppression by enteric-coated aspirin in healthy young men. Am J Cardiol 1992; 69 : 258–262.
26. Gerstein NS, Schulman PM, Gerstein WH, et al. Should more patients continue aspirin therapy perioperatively?: clinical impact of aspirin withdrawal syndrome. Ann Surg 2012; 255 : 811–819.
27. Beckmann JT, Wylie JD, Potter MQ, et al. Effect of Naproxen prophylaxis in heterotopic ossification following hip arthroscopy: A double-blind-randomized-placebo controlled trial. J Bone Joint Surg Am 2015; 97 : 2032–2037.
28. Smolen JS, Breedveld FC, Burmester GR, et al. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force Ann Rheum Diseases 2016; 75 : 3–15.
29. Goodman SM, Cronstein BN, Bykerk VP. Outcomes related to methotrexate dose and route of administration in patients with rheumatoid arthritis: a systematic literature review. Clin Exp Rheumatol 2015; 33 : 272–278.
30. Loza E, Martinez-Lopez JA, Carmona L. A systematic review on the optimum management of the use of methotrexate in rheumatoid arthritis patients in the perioperative period to minimize perioperative morbidity and maintain disease control. Clin Exp Rheumatol 2009; 27 : 856–862.
31. Grennan DM, Gray J, Loudon J, et al. Methotrexate and early postoperative complications in patients with rheumatoid arthritis undergoing elective orthopaedic surgery. Ann Rheum Dis 2001; 60 : 214–217.
32. Murata K, Yasuda T, Ito H, et al. Lack of increase in postoperative complications with low-dose methotrexate therapy in patients with rheumatoid arthritis undergoing elective orthopedic surgery. Mod Rheumatol 2006; 16 : 14–19.
33. Lopez-Olivo MA, Siddhanamatha HR, Shea B, et al. Methotrexate for treating rheumatoid arthritis. Cochrane Database Syst Rev 2014; (6): CD000957.
34. Morgacheva O, Furst DE. Use of MTX in the elderly and in patients with compromised renal function. Clin Exp Rhumatol 2010; 28(5 Suppl 61): S85–94.
35. Danoff JR, Moss G, Liabaud B, et al. Total knee arthroplasty considerations in rheumatoid arthritis. Autoimmune Dis 2013; 2013 : 1853–1840.
36. Fuerst M, Möhl H, Baumgärtel K, et al. Leflunomide increases the risk of early healing complications in patients with rheumatoid arthritis undergoing elective orthopedic surgery. Rheumatol Int 2006; 26 : 1138–1142.
37. Tanaka N, Sakahashi H, Sato E, et al. Examination of the risk of continuous leflunomide treatment on the incidence of infectious complications after joint arthroplasty in patients with rheumatoid arthritis. J Clin Rheumatol 2003; 9 : 115–118.
38. Goodman SM, Figgie M. Arthroplasty in patients with established rheumatoid arthritis (RA): Mitigating risks and optimizing outcomes. Best Pract Res Clin Rheumatol 2015; 29 : 628–642.
39. Fasano S, Pierro L, Pantano I, et al. Longterm hydroxychloroquine therapy and low-dose aspirin may have an additive effectiveness in the primary prevention of cardiovascular events in patients with systemic lupus erythematosus. J Rheumatol 2017; 44 : 1032–1038.
40. Gottlieb AB. Tumor necrosis factor blockade: mechanism of action.. J Investig Dermatol Symp Proc 2007; 12 : 1–4.
41. Varley CD, Deodhar AA, Ehst BD, et. al. Persistence of Staphylococcus aureus colonization among individuals with immune-mediated inflammatory diseases treated with TNF-α inhibitor therapy. Rheumatology (Oxford) 2014; 53 : 332–337.
42. Berthold E, Geborek P, Gülfe A. Continuation of TNF blockade in patients with inflammatory rheumatic disease. An observational study on surgical site infections in 1,596 elective orthopedic and hand surgery procedures. Acta Orthop 2013; 84 : 495–501.
43. Clay M, Mazouyes A, Gilson M, et al. Risk of postoperative infections and the discontinuation of TNF inhibitors in patients with rheumatoid arthritis: A meta-analysis. Joint Bone Spine 2016; 83 : 701–705.
44. Goodman SM, Menon I, Christos PJ, et al. Management of perioperative tumour necrosis factor α inhibitors in rheumatoid arthritis patients undergoing arthroplasty: a systematic review and meta-analysis. Rheumatology (Oxford) 2016; 55 : 573–582.
45. Mabille C, Degboe Y, Constantin A, et al. Infectious risk associated to orthopaedic surgery for rheumatoid arthritis patients treated by anti-TNFalpha. Joint Bone Spine 2017; 84 : 441–445.
46. Cordtz RL, Zobbe K, Højgaard P, et al. Predictors of revision, prosthetic joint infection and mortality following total hip or total knee arthroplasty in patients with rheumatoid arthritis: a nationwide cohort study using Danish healthcare registers. Ann Rheum Dis 2018; 77 : 281–288.
47. Navarra SV, Guzmán RM, Gallacher AE, et al; BLISS-52 Study Group. Efficacy and safety of belimumab in patients with active systemic lupus erythematosus: a randomised, placebo-controlled, phase 3 trial. Lancet 2011; 377 : 721–731.
48. Ginzler EM, Wallace DJ, Merrill JT, et al; LBSL02/99 Study Group. Disease control and safety of belimumab plus standard therapy over 7 years in patients with systemic lupus erythematosus. J Rheumatol 2014; 41 : 300–309.
49. Hirao M, Hashimoto J, Tsuboi H, et al. Laboratory and febrile features after joint surgery in patients with rheumatoid arthritis treated with tocilizumab. Ann Rheum Dis 2009; 68 : 654–657.
50. Momohara S, Hashimoto J, Tsuboi H, et al. Analysis of perioperative clinical features and complications after orthopaedic surgery in rheumatoid arthritis patients treated with tocilizumab in a real-world setting: results from the multicentre Tocilizumab in Perioperative Period (TOPP) study. Mod Rheumatol 2013; 23 : 440–449.
51. Fleischmann R, Genovese M, Lin Y, et al. Long-term safety of sarilumab in rheumatoid arthritis: an integrated analysis with up to 7 years’ follow-up. Rheumatology (Oxford) 2020; 59(2): 292–302.
52. Latourte A, Gottenberg JE, Luxembourger C, et al. Safety of surgery in patients with rheumatoid arthritis treated by abatacept: data from the French Orencia in Rheumatoid Arthritis Registry. Rheumatology (Oxford) 2017; 56 : 629–637.
53. George MD, Baker JF, Winthrop K, et al. Timing of Abatacept Before Elective Arthroplasty and Risk of Postoperative Outcomes. Arthritis Care Res (Hoboken) 2019; 71 : 1224–1233.
54. Mushtaq S, Goodman SM, Scanzello CR. Perioperative management of biologic agents used in treatment of rheumatoid arthritis. Am J Ther 2011; 18 : 426–434.
55. Howe CR, Gardner GC, Kadel NJ. Perioperative medication management for the patient with rheumatoid arthritis. J Am Acad Orthop Surg 2006; 14 : 544–551.
56. Langley RG, Boni MD, Elewski E, et al. Secukinumab in plaque psoriasis – results of two phase 3 trials. N Engl J Med 2014; 371 : 326–338.
57. Blauvelt A, Reich K, Tsai TF, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate-to-severe plaque psoriasis up to 1 year: Results from the CLEAR study. J Am Acad Dermatol 2017; 76 : 60–69.
58. Mease P, Roussou E, Burmester GR, et al. Safety of Ixekizumab in Patients with Psoriatic Arthritis: Results from a Pooled Analysis of Three Clinical Trials. Arthritis Care Res (Hoboken) 2019; 71 : 367–378.
59. Bae SC, Lee YH. Comparison of the efficacy and safety of tofacitinib and baricitinib in patients with active rheumatoid arthritis: a Bayesian network meta-analysis of randomized controlled trials. Z Rheumatol 2019; 78 : 559–567.
60. Pham T, Bachelez H, Berthelot JM, et al. TNF alpha antagonist therapy and safety monitoring. Joint Bone Spine 2011; 78(Suppl 1): 15–185.
61. Šedová L, Štolfa J, Horák P, et al. Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy. Čes. Revmatol. 2009; 17 : 4–15.
62. Holroyd CR, Seth R, Bukhari M, et al. The British Society for Rheumatology biologic DMARD safety guidelines in inflammatory arthritis. Rheumatology (Oxford) 2019; 58 : 372.
63. George MD, Baker JF, Winthrop K, et al. Risk of biologics and glucocorticoids in patients with rheumatoid arthritis undergoing arthroplasty. Ann Intern Med 2019; 171 : 680.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Úvodník
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2020 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
-
Všechny články tohoto čísla
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Revmatoidní artritida a postižení ledvin
- Mezenchymální kmenové buňky: biologie a potenciál v léčbě systémových onemocnění pojiva
- Úvodník
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Statiny indukovaná nekrotizující autoimunitní myopatie jako neobvyklá příčina extrémních hodnot kardiálních markerů u pacienta se svalovou slabostí a otoky
- Kongres American College of Rheumatology (ACR) 2019
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Revmatoidní artritida a postižení ledvin
- Doporučení České revmatologické společnosti 2020 k perioperační úpravě léčby zánětlivých revmatických onemocnění
- Magnetická rezonance v diagnostice idiopatických zánětlivých myopatií
- Optimalizace léčby methotrexátem při terapii revmatoidní artritidy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



