-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv pooperačního podání oktreotidu na redukci lymforey a následně vzniku lymfocyst, lymfedému a lymfatického ascitu po lymfadenektomii u gynekologických malignit
Postoperative administration of octreotide to reduce lymphorrhea, lymphocele, lymphedema and lymphatic ascites after lymphadenectomy in gynecological malignancies
Introduction:
Octreotide is a synthetic analogue of natural somatostatin. Octreotide effect on lymphorrhea reduction in gynecological malignancies has only been assessed in case studies.Design:
Original work.Setting:
Gynecologic Oncology Center, Department of Obstetrics and Gynecology, Faculty of Medicine, Masaryk University and University Hospital Brno.Methods:
In 2014 there was a prospective, randomized, one-institution study. Patients underwent surgery including pelvic or pelvic and paraaortic lymphadenectomy for cervical, uterine and ovarian cancer. The informed consent was signed. Octreotide was evaluated in relation to diagnosis, surgery (laparoscopy versus laparotomy), pelvic and/or paraaortic lymphadenectomy, number of removed lymph nodes and their positivity, neoadjuvant chemotherapy, adjuvant chemotherapy, adjuvant radiotherapy, albumin, BMI, number of days with drains postoperatively, number of days in hospital, blood loss during surgery, time of surgery, total number of drains placed into abdominal cavity. In follow up period, within 1 year after surgery, we searched for lymphocele, lymphedema of lower extremities and lymphatic ascites in relation to lymphorrhea.Results:
44 patients (9 cervical, 19 endometrial and 16 ovarian cancer) were enrolled in two statistically comparable randomized groups. „Octreotide group“, which paradoxically showed lymphorrhea of 4082 ml on average, (without 1992 ml, p = 0.001), needed drainage for more days (p = 0.001). The diagnosis had no influence on lymphorrhea in both groups (p = 0.966). The neoadjuvant chemotherapy was administered (p = 0.026), the more lymph nodes were removed (p = 0.018), the more days the drainage was in place (p < 0.001), the bigger the lymphorrhea; no relationship between lymphorrhea and age (p = 0.631), albumin level (p = 0.584), BMI ( p= 0.966) or number of positive nodes (p = 0.259), length of surgery (p = 0.206), blood loss (p = 0.494). Nor lymphedema (p = 0.404), nor lymphocele (p = 0.086), correlated with postoperative lymphorrhea. Lymphatic ascites was associated with lymphorrhea (p = 0.048).Conclusion:
Octreotide did not reduce lymphorrhea and the incidence of lymphocele, lymphedema of lower extremities and lymphatic ascites within one year of follow-up period after surgery. According to our results, we do not recommend to administer the octreotide in oncogynecological patients after pelvic and/or paraaortic lymphadenectomy.Keywords:
lymphadenectomy, lymphatic ascites, lymphedema, lymphocele, octreotide
Autoři: Vít Weinberger 1
; Luboš Minář 1
; Michal Felsinger 1
; D. Seidlová 2; P. Ovesná 3; Markéta Bednaříková 4
; E. Jandáková 5; I. Rovný 6
Působiště autorů: Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA 1; Anesteziologicko-resuscitační klinika LF MU a FN, Brno, přednosta prof. MUDr. R. Gál, Ph. D. 2; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU, Brno, přednosta doc. RNDr. L. Dušek, Ph. D. 3; Interní hematologická a onkologická klinika LF MU a FN, Brno, přednosta prof. MUDr. J. Mayer, CSc. 4; Ústav patologie LF MU a FN, Brno, přednosta doc. MUDr. L. Křen, Ph. D. 5; Chirurgická klinika LF MU a FN, Brno, přednosta prof. MUDr. Z. Kala, CSc. 6
Vyšlo v časopise: Ceska Gynekol 2017; 82(2): 92-99
Souhrn
Úvod:
Oktreotid je syntetický analog somatostatinu. Vliv oktreotidu na redukci lymforey byl v onkogynekologii hodnocen dosud jen kazuisticky.Typ práce:
Původní práce s vlastním souborem pacientek.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF MU a Fakultní nemocnice Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA.Metodika:
Jedná se o prospektivní randomizovanou studii z roku 2014. Pacientky s karcinomem hrdla, těla dělohy a ovaria podstoupily v indikovaných případech pánevní a/nebo paraaortální lymfadenektomii. Oktreotid byl pacientkám podán po randomizaci a zařazení do skupiny s léčbou nebo bez léčby, podepsaly informovaný souhlas. Efekt oktreotidu byl hodnocen v souvislosti s diagnózou, operací (laparoskopie versus laparotomie), pánevní a/nebo paraaortální lymfadenektomií, počtem odstraněných uzlin a jejich pozitivitou, krevní ztrátou a délkou operačního výkonu, celkovým počtem drénů zavedených do dutiny břišní, neoadjuvantní a adjuvantní chemoterapií, adjuvantní radioterapií, hladinou albuminu předoperačně, BMI, počtem dní s drénem po operaci a počtem dní hospitalizace. Pooperačně byly sledovány v souvislosti s lymforeou parametry: vznik lymfocysty podle ultrazvukového vyšetření pánve a dutiny břišní, lymfedém dolních končetin a lymfatický ascites.Výsledky:
Do studie bylo zařazeno 44 pacientek (devět s karcinomem hrdla dělohy, 19 s karcinomem těla dělohy, 16 s karcinomem ovaria), které byly randomizovaně rozděleny do dvou statisticky srovnatelných skupin. Skupina s oktreotidem vykázala vyšší pooperační lymforeu (4082 ml) než skupina bez něj (1992 ml, p = 0,001), potřebovala delší dobu pooperační drenáž (p = 0,001). Diagnóza (p = 0,573) ani typ lymfadenektomie (p = 0,205) neměly vliv na lymforeu. U pacientek s neoadjuvantní chemoterapií (p = 0,026) a s vyšším počtem odebraných uzlin (p = 0,018) byla zaznamenána zvýšená lymforea. Nebyla detekována souvislost mezi velikostí lymforey a věkem pacientky (p = 0,631), hladinou albuminu předoperačně (p = 0,584), BMI (p = 0,966), počtem pozitivních uzlin (p = 0,259), délkou operace (p = 0,206) a krevní ztrátou (p = 0,494). Lymfedém dolních končetin ani výskyt lymfocyst v průběhu roku po operaci nekorelovaly s lymforeou (p = 0,404 resp. p = 0,086), lymfatický ascites koreloval s lymforeou (p = 0,048).Závěr:
Oktreotid u gynekologických malignit nemá očekávaný efekt v redukci lymforey, incidenci lymfocyst, lymfedému dolních končetin a lymfatického ascitu. Pooperační rutinní podání oktreotidu proto v onkogynekologii, u pacientek po systematické pánevní a/nebo paraaortální lymfadenektomii, nedoporučujeme.Klíčová slova:
lymfadenektomie, lymfatický ascites, lymfedém, lymfocysta, oktreotidÚVOD
V onkogynekologii je velká snaha o identifikaci faktorů, které by mohly potenciálně redukovat morbiditu pacientek po radikální chirurgické léčbě s pánevní a/nebo paraaortální lymfadenektomií. Lymforea je podkladem pro vznik lymfocysty, lymfedému dolních končetin či lymfatického ascitu v pooperačním období [1].
Lymfocysta je kolekce lymfy s tlustou fibrotickou stěnou bez epiteliální výstelky vznikající v retroperitoneu po provedené systematické pánevní a/nebo paraaortální lymfadenektomii. Patofyziologickým podkladem jejího vzniku je nekompletní lymfostáza s pooperačním únikem lymfy v tak velkém množství, že není možná její spontánní resorpce. Lymfocysty mohou být příčinou těžké morbidity, zřídka mortality [16]. Symptomatické lymfocysty způsobují bolest břicha, podbřišku, mohou vyvolávat komplikace z útlaku okolních struktur – tenkého i tlustého střeva a močového měchýře, mohou být příčinou vzniku hydronefrózy a sekundárně afunkce ledviny, mohou vyvolat otok dolní končetiny a sekundárně vznik hluboké žilní trombózy, mohou se infikovat a být příčinou septického stavu pacientky [6, 9]. Lymfocysta se může vyvinout nejčastěji během prvních tří měsíců po operaci. Incidence lymfocyst je v literatuře referována v širokém rozmezí od 1 % do 58 % [4, 14].
Prvním signálem vznikajícího lymfedému dolních končetin mohou být pouze subjektivní obtíže (bolest, pocit napětí, tlaku a otoku, únavnost), zejména po námaze. Změny objemu postižené oblasti ještě nejsou patrné (latentní lymfedém). V reverzibilním stadiu lymfedému se již objevuje mírné večerní prosáknutí postižené oblasti, které do rána samo plně ustoupí. Třetí stadium lymfedému je ireverzibilní, kdy je jasně patrný tuhý, bledý, špatně stlačitelný edém, někdy až s omezením hybnosti příslušné končetiny. Kůže už může být ztluštělá v důsledku počínající vazivové přestavby (fibrózy). Bohužel, vzácností nejsou ani pacientky ve stadiu elefantiázy s monstrózními otoky s vazivovou přestavbou kůže a podkoží a s významným omezením hybnosti končetiny [2, 17].
Lymfatický ascites resp. chyloperitoneum je stav, při kterém se v dutině břišní hromadí lymfa bez její adekvátní resorpce, způsobuje zvětšení břicha, hlavně v krajině pupku, tlačí na bránici a omezuje dýchání. Incidence lymfatického ascitu po lymfadenektomii je 1,2–8,2 % [10, 13].
Oktreotid je syntetický oktapeptidový derivát přirozeného somatostatinu s podobnými farmakologickými účinky, ale se značně prodlouženou dobou účinku. Tlumí sekreci růstového hormonu i peptidů gastro-entero-pankreatického endokrinního systému. Primární indikací k jeho užití je akromegalie, dále je indikován v prevenci komplikací chirurgických výkonů na pankreatu, užívá se k zástavě krvácení z jícnových varixů u pacientů s jaterní cirhózou. Užívá se ke zmírnění příznaků k symptomatické léčbě pacientů s gastro-entero-pankreatickými nádory. Efekt oktreotidu na lymforeu resp. incidenci lymfocyst, lymfedému a lymfatického ascitu nebyl dosud hodnocen u pacientek po provedené systematické pánevní a/nebo paraaortální lymfadenektomii pro gynekologickou malignitu. Přesný mechanismus působení oktreotidu a jeho ovlivnění redukce lymforey není dosud znám [19]. V naší studii jsme zkoumali, zda podání oktreotidu v pooperačním období má primárně pozitivní vliv na redukci lymforey, a tím sekundárně na vznik lymfocyst, lymfedému dolních končetin a lymfatického ascitu v období follow-up v průběhu jednoho roku od operace.
METODIKA A SOUBOR PACIENTEK
Jedná se o prospektivní randomizovanou studii z onkogynekologického centra FN Brno a LF MU z roku 2014. Pacientky s karcinomem hrdla, těla dělohy a ovaria podstoupily v indikovaných případech radikální chirurgický výkon včetně pánevní a/nebo paraaortální lymfadenektomie. Studie byla schválena mezioborovou onkogynekologickou a etickou komisí. Všechny pacientky podepsaly informovaný souhlas. Oktreotid byl pacientkám podán po randomizaci a zařazení do testované skupiny, nebo nepodán po zařazení do kontrolní skupiny. Zařazení pacientek do příslušné skupiny probíhalo v závislosti na diagnóze a v rámci ní byly pacientky losem přiřazeny do testovaného nebo kontrolního souboru. Oktreotid byl aplikován subkutánně od prvního do pátého pooperačního dne včetně, v dávce 0,1 mg třikrát denně, společně s nízkotučnou parenterální dietou. Drény (drén) byly (byl) zavedeny peroperačně všem pacientkám ve studii, byly napojeny na aktivní sání, jejich počet byl ponechán na rozhodnutí operatéra. Drény byly v pooperačním období extrahovány separátně, pokud sekrece z jednoho konkrétního nepřesáhla 100 ml tekutiny za den. Efekt oktreotidu na redukci lymforey byl hodnocen v souvislosti s diagnózou, operací (laparoskopie versus laparotomie), provedenou pánevní a/nebo paraaortální lymfadenektomií, počtem odstraněných uzlin a jejich pozitivitou, krevní ztrátou peroperačně, délkou operačního výkonu a celkovým počtem drénů zavedených do dutiny břišní, neoadjuvantní a adjuvantní chemoterapií, adjuvantní radioterapií, hladinou albuminu předoperačně, BMI, počtem dní s drénem po operaci a počtem dní hospitalizace. Pooperačně byly pacientky kontrolovány v zavedeném intervalu kontrol (3–4 měsíce) nebo dříve v rámci mimořádné kontroly, pokud nastaly klinické obtíže. Na kontrolách byly sledovány následující parametry: vznik lymfocysty podle ultrazvukového vyšetření pánve a dutiny břišní, lymfedém dolních končetin a lymfatický ascites (tab. 1). Ultrazvukové kontroly probíhaly standardně vyhodnocením nálezu v malé pánvi pomocí transvaginální sondy, dutina břišní nad hranicí malé pánve byla hodnocena transabdominální sondou, vše podle vyšetřovacího protokolu našeho onkogynekologického centra. Jako lymfatický ascites byl vyhodnocen ten, kde volná tekutina byla detekována nejen v malé pánvi, ale i volně v dutině břišní. Lymfedém dolních končetin byl hodnocen podle subjektivních stesků a obtíží pacientky a objektivně vizuálním a palpačním zhodnocením dolních končetin lékařem při follow-up kontrole.
Tab. 1. Srovnání charakteristik souboru pacientek, kterým byl podán oktreotid, a těch, kterým oktreotid podán nebyl 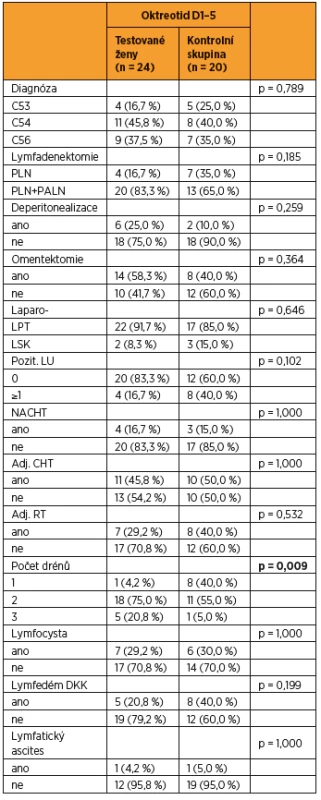
LPT – laparotomie, LSK – laparoskopie, PLN – pánevní lymfadenektomie, PALN – paraaortální lymfadenektomie, LU – lymfatická uzlina, NACHT – neoadjuvantní chemoterapie, CHT – chemoterapie, RT – radioterapie STATISTICKÁ ANALÝZA DAT
K popisu kategoriálních proměnných byly použity absolutní a relativní počty a statistické testování bylo provedeno Fisherovým exaktním testem, popřípadě maximálně věrohodným χ2 testem. Spojité proměnné byly popsány průměrem a 95% intervalem spolehlivosti (IS). Proměnné s log-normálním rozložením (včetně celkového množství odpadu do drénů), které byly úspěšně transformovány na normální rozložení, byly dále sumarizovány jako geometrický průměr s 95% IS a k testování byl použitý t-test. V případě neúspěšné transformace byl ukázán medián a rozsah a použit byl Kruskalův-Wallisův test. Vztah mezi dvěma spojitými proměnnými byl hodnocen pomocí Pearsonova či Spearmanova korelačního koeficientu. Vícerozměrný lineární regresní model s adjustací na vstupní kovariáty byl použit pro posouzení, zda je celkový odpad lymfy do drénů významně asociován s podáváním oktreotidu. Výsledky z regresní analýzy byly znázorněny jako koeficienty Exp(ß) s odpovídajícími 95% IS. Ve všech analýzách byly použity oboustranné testy s hladinou významnosti p = 0,05.
VÝSLEDKY
Do studie bylo zařazeno konsekutivně celkem 44 pacientek (9 s karcinomem hrdla dělohy, 19 s karcinomem těla dělohy a 16 s karcinomem ovaria) a byly randomizovaně rozděleny do dvou statisticky srovnatelných skupin. Při srovnání obou skupin pacientek jsme zaznamenali významný rozdíl jen v počtu drénů, kdy pacientkám s okterotidem byl zaveden větší počet drénů do dutiny břišní, a v nutnosti ponechat drény delší dobu v dutině břišní než pacientkám ve skupině bez oktreotidu. Ostatní sledované parametry byly bez rozdílu v distribuci mezi oběma skupinami (tab. 1 a tab. 2). Pro srovnání obou skupin jsme užili vícerozměrnou analýzu, aby se zahrnuly všechny potenciálně vysvětlující proměnné. Skupina s oktreotidem vykázala paradoxně celkově lymforeu 4082 ml v průměru oproti kontrolní skupině (1992 ml, p = 0,001) a bylo nutné drénovat dutinu břišní více dní (p = 0,001). Diagnóza (p = 0,573) ani typ lymfadenektomie (p = 0,205) neměly žádný vliv na celkové množství lymforey. U laparotomicky provedených operací byl statisticky nevýznamně vyšší odpad do drénů než u laparoskopicky provedených (p = 0,061). U pacientek s neoadjuvantní chemoterapií (NACHT) byl statisticky významně větší odpad do drénů (p = 0,026). Pozitivita lymfatických uzlin nekorelovala v našem souboru s celkovým odpadem do drénu. Čím větší počet drénů byl zaveden do dutiny břišní, tím větší odpad byl sledován v pooperačním období (p = 0,050). Souhrnný odpad do drénu významně koreloval s celkovým počtem odstraněných lymfatických uzlin (p = 0,018, přímá závislost) a s počtem dní s drénem (p < 0,001), respektive s délkou hospitalizace (p = 0,085). Nebyla prokázána souvislost mezi množstvím odpadu lymfy a věkem, BMI pacientky, předoperační hodnotou albuminu, délkou operace ani krevní ztrátou během operace (tab. 3 a tab. 4). Lymfedém dolních končetin ani výskyt lymfocyt v průběhu jednoročního sledování po operaci nekorelovaly s celkovým pooperačním odpadem lymfy do drénu (p = 0,404 resp. p = 0,086), naopak přítomnost lymfatického ascitu i přes svůj vzácný výskyt silně korelovala s množstvím lymfy odvedené pooperačně drény (p = 0,048) (tab. 5).
Tab. 2. Srovnání charakteristik souboru pacientek, kterým byl podán oktreotid, a těch, kterým oktreotid podán nebyl 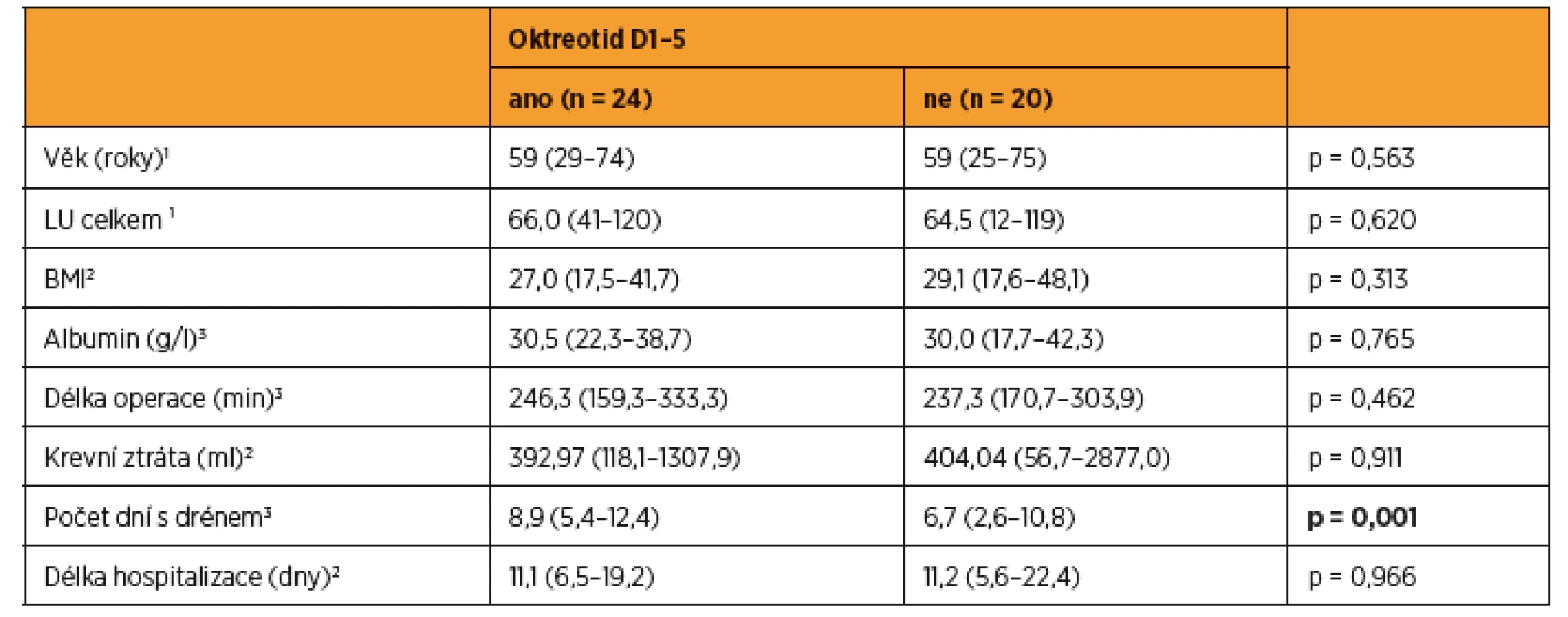
Věk, BMI, délka operace a krevní ztráta byly podobné v obou skupinách. Ve skupině s oktreotidem bylo nutné ponechat drén delší dobu než ve skupině bez oktreotidu (p = 0,001). 1 medián (rozmezí), p-value z Kruskalova-Wallisova testu 2 geometrický průměr (95% interval spolehlivosti), p-value z t-testu 3 průměr (95 % interval spolehlivosti), p-value z t-testu Tab. 3. Faktory potenciálně ovlivňující množství lymforey 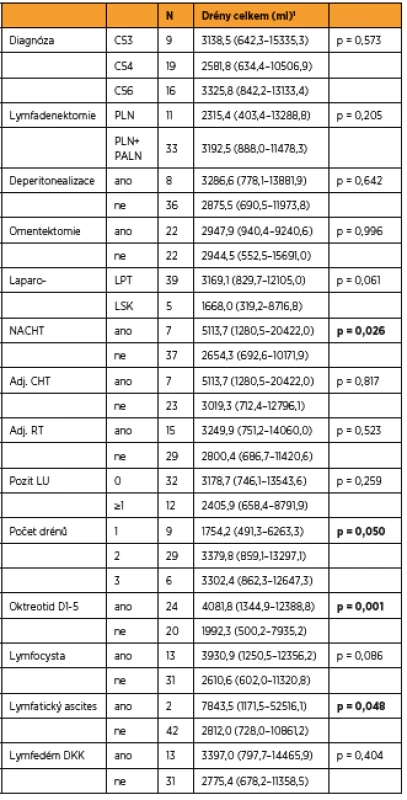
1 geometrický průměr (95 % interval spolehlivosti), p-value z t-testu C53 – karcinom hrdla dělohy, C54 – karcinom těla dělohy, C56 – karcinom ovaria, PLN – pánevní lymfadenektomie, PALN – paraaortální lymfadenektomie, LPT – laparotomie, LSK – laparoskopie, LU – lymfatická uzlina, NACHT – neoadjuvantní chemoterapie, CHT – chemoterapie, RT – radioterapie Tab. 4. Korelace (Pearsonovy/Spearmanovy) mezi spojitými parametry a celkovým množstvím tekutiny v drénech 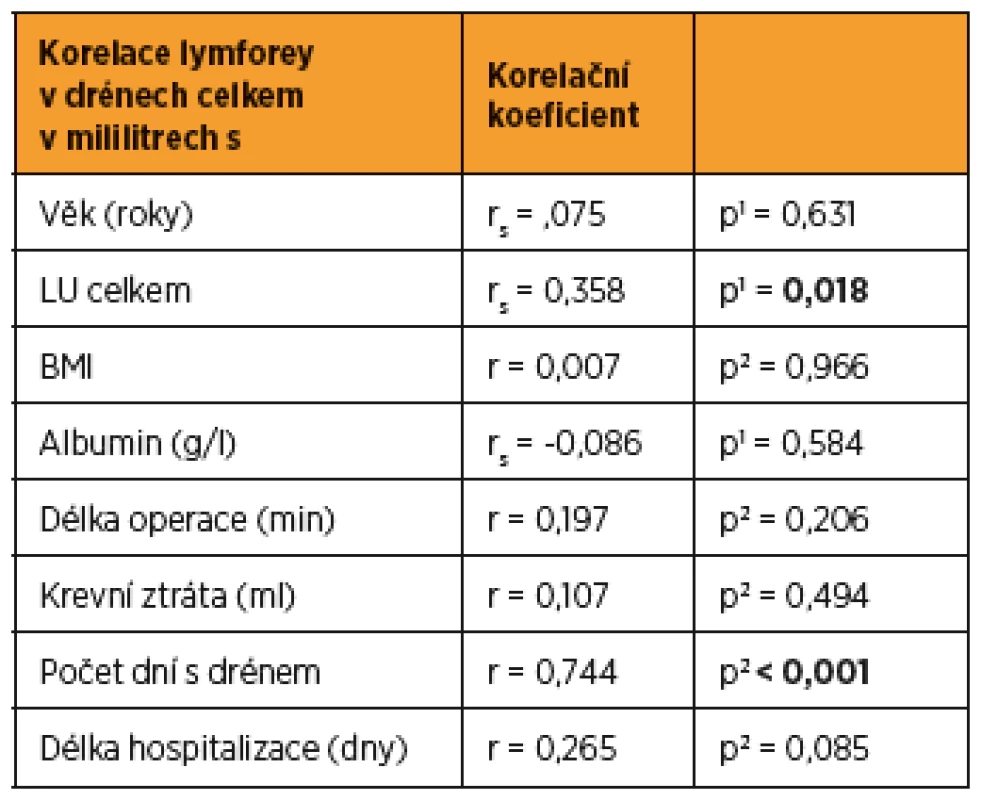
1p-value Spermanovy korelace 2p-value Pearsonovy korelace Proměnné s nenormálním rozložením dat, které byly úspěšně transformovány pomocí přirozeného logaritmu (LN), mají v tabulkách uvedeny hodnoty po zpětné transformaci (geometrický průměr s 95% intervalem spolehlivosti). Tab. 5. Vznik lymfocysty, lymfatického ascitu, lymfedému dolních končetin v závislosti na pooperační lymforey během 1. roku follow-up od operace 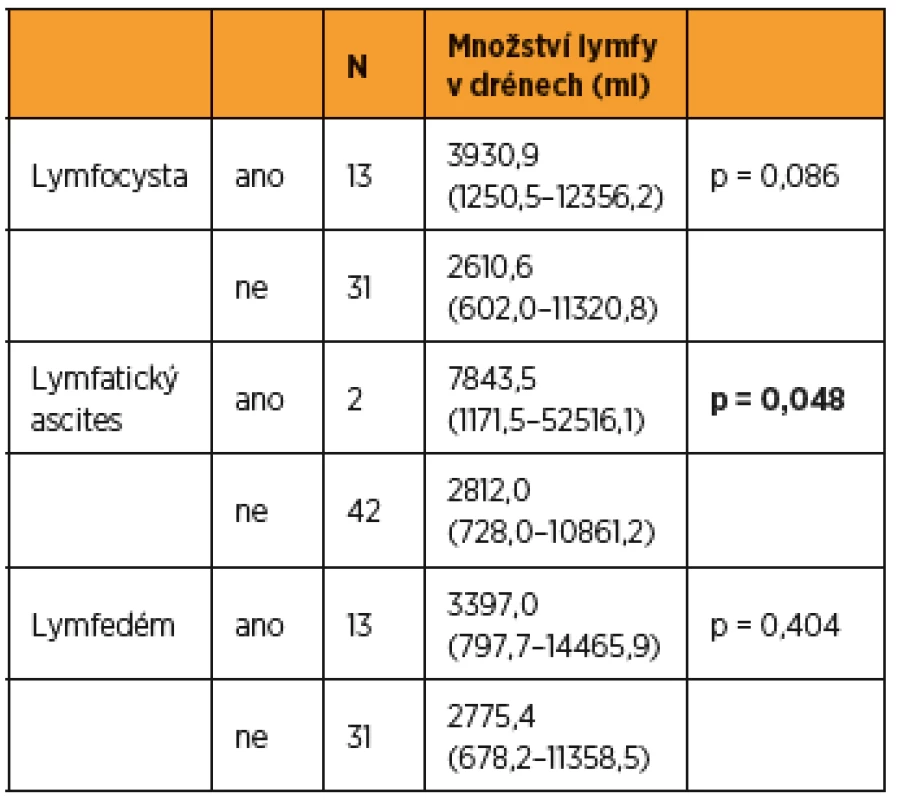
DISKUSE
Představujeme prospektivní studii na souboru 44 pacientek operovaných v průběhu roku 2014 pro gynekologickou malignitu, u kterých byla provedena systematická pánevní a/nebo paraaortální lymfadenektomie a byly randomizovaně rozděleny do skupiny s pooperačním podáním oktreotidu a bez něj. Výsledkem naší studie je, že jsme neprokázali pozitivní účinek oktreotidu na redukci lymforey. Pacientky, které dostaly oktreotid, měly statisticky významně více odpadu do drénu (v průměru 4082 ml) než pacientky, které oktreotid nedostaly (1992 ml, p = 0,001). V našem souboru neměl oktreotid pozitivní vliv v redukci odpadu lymfy po operaci u žádné z gynekologických onkologických diagnóz (karcinom hrdla, těla dělohy a ovaria).
Významný rozdíl byl zaznamenán v naší studii mezi oběma skupinami v počtu drénů, kdy pacientkám s okterotidem bylo zavedeno pooperačně větší množství drénů do dutiny břišní než pacientkám ve skupině bez oktreotidu. Tuto skutečnost si částečně vysvětlujeme tak, že ve skupině pacientek s oktreotidem byla při detailním zkoumání sledovaných parametrů zpozorována vyšší radikalita provedených operací. Rozdíly nedosáhly díky celkové malé velikosti souboru statistické významnosti, ale ve skupině s oktreotidem bylo provedeno celkem šest kompletních deperitonealizací dutiny břišní včetně strippingu bránice oproti dvěma ve skupině bez oktreotidu. Ve skupině pacientek s oktreotidem bylo provedeno 14 totálních omentektomií oproti osmi bez oktreotidu, přičemž omentum i peritoneum se zcela zásadním způsobem podílejí na zpětném vychytávání lymfy do oběhu, a tím redukci jejího množství v dutině břišní. Zavedení většího množství drénů do dutiny břišní a retroperitonea může být jednou z příčin negativního výsledku účinku oktreotidu na celkovou lymforeu pooperačně. Metaanalýza z roku 2010 zahrnovala většinu randomizovaných studií pacientek, které podstoupily pánevní lymfadenektomii pro gynekologický zhoubný nádor. Z této analýzy je známo, že zavedení drénu na konci operačního výkonu paradoxně zvyšuje riziko pooperační morbidity v souvislosti s provedenou lymfadenektomií, zvyšuje riziko vzniku symptomatické lymfocysty. Míra pooperačních komplikací s nutností pooperační hospitalizace byla vyšší u skupiny pacientek s pooperačně umístěným drénem [7, 18]. Uvedené práce na základě lymfoscintigrafického vyšetření resorpce radiofarmaka uvádějí hypotézu, že drén umístěný na konci operačního výkonu do retroperitonea působí jako cizí těleso a snižuje resorpční schopnost peritonea. Patofyziologický mechanismus tohoto jevu však nebyl dosud objasněn [3].
Statisticky významně větší lymforea byla pooperačně dokumentována u pacientek po neoadjuvantní chemoterapii (p = 0,026). Celkový souhrnný odpad do drénu významně koreloval i s celkovým počtem odstraněných lymfatických uzlin (p = 0,018, přímá závislost) a s počtem dní s drénem. Toto zjištění je zcela v souladu se studií Zikana a kol., kde autoři prezentují největší dosud popsaný soubor asymptomatických a symptomatických lymfocyst po lymfadenektomii a definují rizikové a protektivní faktory jejich vzniku [20]. V některých studiích je udávána pozitivita lymfatických uzlin jako rizikový faktor pooperační lymforey, avšak v naší studii pozitivita lymfatických uzlin nekorelovala s celkovým odpadem lymfy do drénu [8, 20]. Laparoskopie je udávána v některých studiích v literatuře jako protektivní faktor excesivní dlouho trvající lymforey [11]. V našem souboru byly u laparotomicky provedených operací odpady do drénu větší než u operací provedených laparoskopicky, ale nedosáhly statistické významnosti (p = 0,061). V následujícím roce sledování pacientek po operaci jsme neprokázali jakoukoli statisticky významnou souvislost mezi celkovým odpadem lymfy do drénu pooperačně a vznikem lymfocysty (p = 0,086) či rozvojem lymfedému dolních končetin (p = 0,404) v pooperačním období ve follow up v průběhu jednoho roku. Jen vznik lymfatického ascitu přímo koreloval s množstvím pooperační lymforey a v našem souboru byla tato spojitost statisticky významná (p = 0,048).
Vzhledem k tomu, že množství odpadu do drénů ovlivňuje více faktorů, a navíc pacientky nebyly randomizovány nezávisle vůči všem faktorům, byla na místě aplikace vícerozměrného přístupu. Do modelu byly zahrnuty všechny faktory významné v jednorozměrných analýzách. Ve vícerozměrném modelu zůstává statisticky významným faktorem podání oktreotidu – vliv na celkové množství odpadu do drénů. Model interpretujeme tak, že podání oktreotidu v naší studii zvýšilo celkové množství odpadu do drénů (p = 0,001). Podání NACHT zvýšilo množství odpadu do drénů (p = 0,015), a každá odstraněná lymfatická uzlina navíc predikovala zvýšení množství celkového odpadu drénu (p = 0,018). Počet drénů byl významný v jednorozměrné analýze, ve vícerozměrné se významnost nepotvrdila (tab. 6).
Tab. 6. Multivarientní lineárně regresní analýza faktorů ovlivňujících celkové množství lymforey v drénu (drénech) 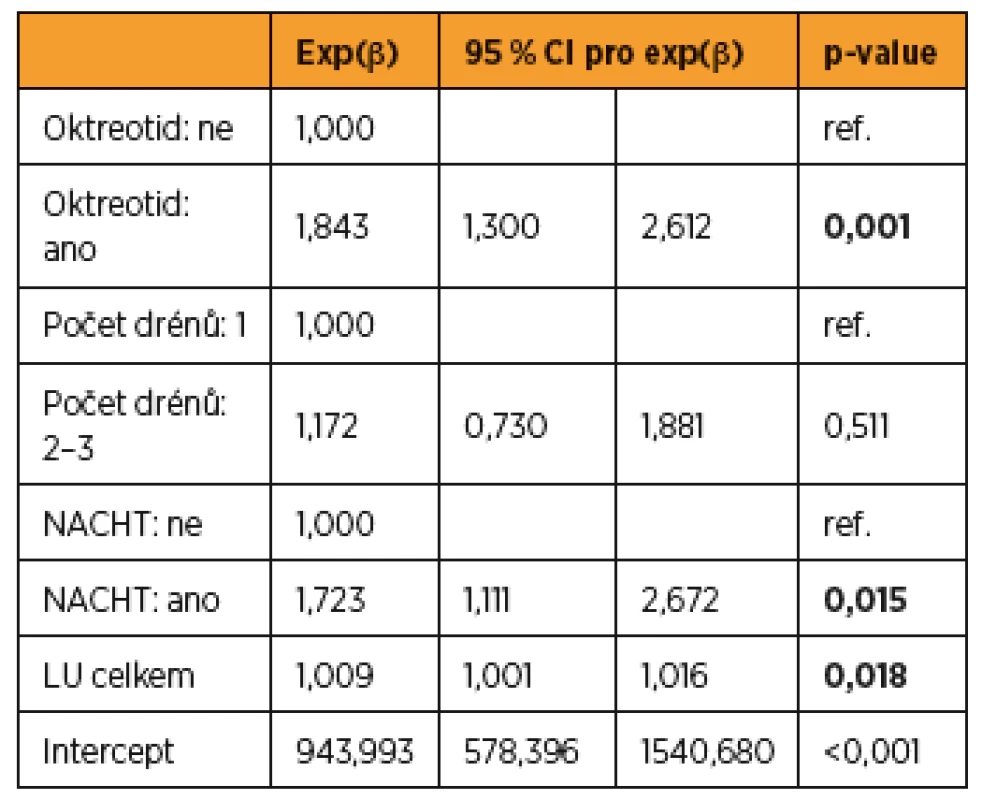
Adj. R2 – 0,409 LU – lymfatická uzlina, NACHT – neoadjuvantní chemoterapie Existuje minimum studií o účinku pooperační aplikace oktreotidu za účelem redukce lymforey po systematicky provedené lymfadenektomii. Oktreotid vykazoval slibné výsledky v redukci pooperační lymforey ve dvou dosud publikovaných prospektivních randomizovaných studiích u pacientek s karcinomem prsu po disekci axily. Oktreotid byl ve studiích podáván v dávce 0,3 mg za den po dobu pěti dní od prvního pooperačního dne a po operaci signifikantně snížil množství a délku lymforey z axily [5, 15]. Ve studii u 89 mužů po radikální prostatektomii s lymfadenektomií s více než 200 ml lymforey za den byl od třetího pooperačního dne do druhého dne po vytažení drénu aplikován oktreotid v dávce 0,1 mg třikrát denně [12]. Významně snížil délku pooperační drenáže (8,9 dní versus 12,1 dní) a délku hospitalizace (9,9 dní versus 14,9 dní).
Studie provedená u gynekologických malignit nebyla dosud publikována. Sílou naší studie je, že se jedná o první prospektivní studii na souboru pacientek s gynekologickým zhoubným nádorem (karcinom hrdla dělohy, těla dělohy a ovaria), kde u všech zařazených pacientek byla provedena pánevní a/nebo paraaortální lymfadenektomie. Byla zpracována kompletní klinická i patologická data všech pacientek od operace do jednoho roku od ní v rámci jejich follow-up. Slabinou studie je, že se jedná o studii jednoho onkogynekologického centra, která byla provedena na relativně malém počtu pacientek. Z metodiky nebylo přesně dopředu určeno, kolik drénů se bude u pacientek zavádět do dutiny břišní a retroperitonea. Všechny zavedené drény byly zapojeny na aktivní sání, což mohlo umocnit negativní vliv drénu jako cizího tělesa v těle, a zvyšovat tak produkci lymfy.
Vliv oktreotidu bude nutné vyhodnotit v rámci prospektivní randomizované multicentrické studie. Naši studii jsme po jednom roce trvání přerušili, neboť nebyl prokázán pozitivní vliv oktreotidu na snížení pooperační lymforey.
ZÁVĚR
Z výsledků naší studie vyplývá, že zásadním významným faktorem v ovlivnění pooperační lymforey zůstává podávání neoadjuvantní chemoterapie a celkový počet odstraněných lymfatických uzlin. Velmi pravděpodobně významně působí i počet zavedených drénů a doba jejich ponechání pooperačně v dutině břišní, což ale nebylo v multivariantní analýze na relativně malém souboru potvrzeno. Podání oktreotidu u gynekologických malignit od prvního do pátého pooperačního dne nemá očekávaný efekt v redukci lymforey a v pooperačním období nemá pozitivní efekt na redukci incidence lymfocyst, lymfedému dolních končetin a lymfatického ascitu. Naopak jeho podání mělo negativní dopad ve smyslu zvýšené lymforey v testované skupině pacientek. Vznik lymfocyst ani lymfedému pooperačně nebyl v naší studii ovlivněn velikostí lymforey pooperačně, vznik lymfatického ascitu ale naopak přímo souvisel s velikostí pooperační lymforey.
Práce vznikla za podpory MZ ČR - RVO (FNBr, 65269705).
MUDr. Vít Weinberger, Ph.D.
Gynekologicko-porodnická klinika LF MU a FN Brno
Obilní trh 11
602 00 Brno
e-mail: vit.weinberger@gmail.com
Zdroje
1. Achouri, A., Huchon, C., Bats, AS., et al. Complications of lymphadenectomy for gynecological cancer. Eur J Surg Oncol, 2013, 39(1), p. 81–88.
2. Akita, S., Mitsukawa, N., Kuriyama, M., et al. Suitable therapy options for sub-clinical and early-stage lymphoedema patients. J Plast Reconstr Aesthet Surg, 2014, 67(4), p. 520–525.
3. Benedetti-Panici, P., Maneschi, F., Cutillo, G., et al. A randomized study comparing retroperitoneal drainage with no drainage after lymphadenectomy in gynecologic malignancies. Gynecol Oncol, 1997, 65(3), p. 478–482.
4. Benedetti-Panici, P., Maneschi, F., Cutillo, G. Pelvic and aortic lymphadenectomy. Surg Clin North Am, 2001, 81(4), p. 841–858.
5. Carcoforo, P., Soliani, G., Maestroni, U., et al. Octreotide in the treatment of lymphorrhea after axillary node dissection: a prospective randomized controlled trial. J Am Coll Surg, 2003, 196(3), p. 365–369.
6. Ferguson, JH., Maclure, JG. Lymphocele following lymphadenectomy. Am J Obstet Gynecol, 1961, 82, p. 783–792.
7. Franchi, M., Trimbos, JB., Zanaboni, F., et al. Randomised trial of drains versus no drains following radical hysterectomy and pelvic lymph node dissection. A European Organisation for Research and Treatment of Cancer Group (EORTCC – GCG) study in 234 patients. Eur J Cancer, 2007, 43(8), p. 1265–1268.
8. Ghezzi, F., Uccella, S., Cromi, A., Bogani, G., et al. Lymphoceles, lymphorrhoea, and lymphedema after laparoscopic and open endometrial cancer staging. Ann Surg Oncol, 2012, 19(1), p. 259–267.
9. Gray, MJ., Plentl, AA., Taylor, HC. The lymphocyst: a complication of pelvic lymph node dissections. Am J Obstet Gynecol, 1958, 75(5), p. 1059–1062.
10. Han, LP., Zhang, HM., Abha, HD., et al. Management and prevention of chylous leakage after laparoscopic lymphadenectomy. Eur Rev Med Pharmacol Sci, 2014, 18(17), p. 2518–2522.
11. Ilancheran, A., Monaghan, JM. Pelvic lymphocyst – a 10 year experience, Gynecol Oncol, 1988, (29), p. 333–336.
12. Kim, WT., Ham, WS., Koo, KC., Choi, YD. Efficacy of octreotide for management of lymphorrhea after pelvic lymph node dissection in radical prostatectomy. Urology, 2010, 76(2), p. 398–401.
13. Kong, TW., Chang, SJ., Kim, J., et al. Risk factor analysis for massive lymphatic ascites after laparoscopic retroperitonal lymphadenectomy in gynecologic cancers and treatment using intranodal lymphangiography with glue embolization. J Gynecol Oncol, 2016, 27(4), p 44.
14. Logmans, A., Kruyt, RH., De Bruin, HG., et al. Lymphedema and lymphocysts following lymphadenectomy may be prevented by omentoplasty: A pilot study. Gynecol Oncol, 1999, 75(3), p. 323–327.
15. Mahmoud, SA., Abdel-Elah, K., Eldesoky, AH., El-Awady, SI. Octreotide can control lymphorrhea after axillary node dissection in mastectomy operations. Breast J, 2007, 13(1), p. 108–109.
16. Mori, N. Clinical and experimental studies on the so-called lymphocyst which develops after radical hysterectomy in cancer of the uterine cervix. J Jpn Obstet Gynecol Soc, 1955, 2(2), p. 178–203.
17. Ryan, M., Stainton, MC., Jaconelli, C., et al. The experience of lower limb lymphedema for women after treatment for gynecologic cancer. Oncol Nurs Forum, 2003, 30(3), p. 417–423.
18. Thomé, Saint. PM., Brémond, A., Rochet, Y. Absence of peritonization after pelvic cancer surgery. Results in 157 cases. J Gynecol Obstet Biol Reprod (Paris), 1991, 20(7), p. 957–960.
19. Weinberger, V., Zikán, M., Cibula, D. Lymphocele: prevalence and management in gynecological malignancies: Expert Rev Anticancer Ther, 2014, 3, p. 307–317.
20. Zikan, M., Fischerova, D., Pinkavova, I., et al. A prospective study examining the incidence of asymptomatic and symptomatic lymphoceles following lymphadenectomy in patients with gynecological cancer. Gynecol Oncol, 2015, 137(2), p. 291–298.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Ultrazvuková diagnostika syndromu fetální zánětlivé odpovědi u žen s předčasným odtokem plodové vodyČlánek Jsou nutné změny v regulaci přístupu žen bez partnera a homosexuálních osob k asistované reprodukci?Článek Abdominální těhotenství u pacientky po císařském řezu, oboustranné salpingektomii a embryotransferuČlánek Inverze dělohy
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2017 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Cévní anatomie aortopelvického retroperitonea a její abnormality v souvislosti s radikální onkogynekologickou operativou – vlastní zkušenosti
- Těhotenství a porod žen s idiopatickými střevními záněty
- INFORMACE PRO LÉKAŘE VE SPECIALIZAČNÍ PŘÍPRAVĚ
- Trojčetné těhotenství se smíšenou chorionicitou po léčbě IVF: je fetoredukce vhodná?
- Abdominální těhotenství u pacientky po císařském řezu, oboustranné salpingektomii a embryotransferu
- Karcinoid apendixu v těhotenství
- Český překlad a validace dotazníku kvality pohlavního života u žen s prolapsem pánevních orgánů či inkontinencí moči nebo stolice – PISQ-IR
- Inverze dělohy
- Ultrazvuková diagnostika syndromu fetální zánětlivé odpovědi u žen s předčasným odtokem plodové vody
- Současné využití technik v diagnostice recidivujícího vulvovaginálního dyskomfortu
- Jsou nutné změny v regulaci přístupu žen bez partnera a homosexuálních osob k asistované reprodukci?
-
Spontánní předčasný porod
Doporučený postup -
Předčasný odtok plodové vody před termínem porodu
Doporučený postup -
Intrahepatální cholestáza v těhotenství
Doporučený postup - Doc. MUDr. Věra Rokytová, CSc.
- Osobní vzpomínka na prof. MUDr. Jiřího Skřivana, DrSc., k jeho nedožitým 90. narozeninám
- Zemřel doc. MUDr. Karel Janků, CSc.
-
Profesor MUDr. Jan Hořejší, DrSc.
6. 5. 1940 – 18. 11. 2016 - Vliv pooperačního podání oktreotidu na redukci lymforey a následně vzniku lymfocyst, lymfedému a lymfatického ascitu po lymfadenektomii u gynekologických malignit
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Intrahepatální cholestáza v těhotenství
Doporučený postup -
Spontánní předčasný porod
Doporučený postup - Inverze dělohy
-
Předčasný odtok plodové vody před termínem porodu
Doporučený postup
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



