-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Štruktúrny základ transportnej funkcie vajíčkovodu
The structural basis for transport through the Fallopian tube
The Fallopian tube has until recently been a neglected structure, bypassed by in vitro fertilization and seen only as a tube that transports the oocyte or early embryo to the uterus. More recently, its role is even more undervalued after the introduction of techniques of assisted reproduction, in which the Fallopian tubes become like unnecessary. The Fallopian tube performs several important functions. It captures the oocyte after ovulation, maintains and controls the migration of spermatozoa to the site of fertilization. It provides the special microenvironment for fertilization; nourishes the early embryo while it is being carried to the uterus and amplifies signals from embryo to the mother. In our article we conducted a systematic review of relevant articles found in PubMed, Scopus and ISI Web of Knowledge, focused on the new insights into the functional morphology of Fallopian tube. We described the possible function of muscle layer motility, ciliary activity and tubal fluid movement on transport of gamets / embryo, as well as we mentioned the negative factors (such as smoking, chlamydial infection or endometriosis) affecting the transport through the Fallopian tube.
Key-words:
Fallopian tube, embryo transport, sperm migration, ciliary transport, tubal infertility.
Autoři: M. Kajanová 1,2; Ľudovít Danihel 3; Š. Polák 2,4; M. Miko 2; L. Urban 1,2; T. Bokor 3; I. Varga 2,4
Působiště autorů: Gynekologicko-pôrodnícke oddelenie, ForLife Všeobecná Nemocnica v Komárne, primár MUDr. F. Tóth, PhD. 1; Ústav histológie a embryológie, Lekárska fakulta, Univerzita Komenského, Bratislava, prednosta doc. MUDr. Š. Polák, CSc. 2; Ústav patologickej anatómie, Lekárska fakulta, Univerzita Komenského, Bratislava, prednosta prof. MUDr. Ľ. Danihel, PhD. 3; Univerzitné pracovisko reprodukčnej medicíny, 1. gynekologicko-pôrodnícka klinika, Lekárska fakulta a Univerzitná Nemocnica, Univerzita Komenského, Bratislava, prednosta prof. MUDr. L. Borovský, CSc. 4
Vyšlo v časopise: Ceska Gynekol 2012; 77(6): 566-571
Souhrn
Vajíčkovody sú často vnímané ako pasívne trubice, ktoré slúžia len na transport oocytu alebo raného embrya smerom do dutiny maternice. Ich úloha je ešte viac nedocenená zavedením techník asistovanej reprodukcie, pri ktorých sa vajíčkovody stávajú „nepotrebné“. Vajíčkovod má však obrovský význam pri zachytení oocytu po ovulácii aj pri selekcii a kontrole transportu spermií. Jedinečné mikroprostredie vajíčkovodu zabezpečuje proces oplodnenia, vyživuje embryo počas raného vývinu a tiež parakrinne prijíma signály od embrya smerom k matke. V našom literárnom prehľade prinášame aktuálny pohľad na funkčnú morfológiu vajíčkovodu. Zameriavame sa na jeho transportnú funkciu, ktorá je daná motilitou svaloviny, pohybom riasiniek epitelových buniek a prúdením tubárnej tekutiny. Opisujeme aj negatívne faktory, ktoré ovplyvňujú transport vo vajíčkovode (chlamýdiové infekcie, fajčenie, endometrióza) s cieľom využitia týchto poznatkov v gynekologickej praxi.
Kľúčové slová:
vajíčkovod, transport embrya, migrácia spermií, pohyb riasiniek, tubárna neplodnosť.ÚVOD
Prvý morfologický opis vajíčkovodu pochádza od talianskeho anatóma Gabriela Fallopia z roku 1561. Pomenoval ho ako „tuba uteri“, nakoľko mu pripomínal tubu, hudobný nástroj zhotovený z mosadzného plechu. Podľa neho sa aj v súčasnosti v anglosaskej literatúre označuje vajíčkovod ako „Fallopian tube“ [26]. Dovtedy sa vychádzalo z názoru Claudia Galéna z Pergamonu (130-200), ktorého opis prebral aj priekopník modernej anatómie Andreas Vesalius (1514–1564). Vesalius opisoval vajíčkovody ako orgány analogické semenovodom muža a predpokladal ich pevné spojenie s vaječníkmi (tzv. ženské semenníky). Funkciu vajíčkovodov objasnil holandský anatóm Reinier de Graaf (1641–1673). Aj keď v tom čase ešte nemal k dispozícii mikroskop, správne interpretoval nálezy z pitevne s klinickým obrazom a tieto poznatky spojil s výsledkami svojich experimentov na zajacoch (pozn. autorov: prvé práce Holanďana Antonia van Leeuwenhoeka o využití svetelného mikroskopu v biologických vedách vyšli v časopise Royal Society v roku 1673, teda až v roku, keď de Graaf zomrel). De Graaf predpokladal, že vajíčkovody slúžia na transport embrya do maternice, ale nesprávne sa domnieval, že k samotnému začatiu vývinu nového jedinca dochádza vo vaječníkoch. De Graaf opísal a schematicky zakreslil nepriechodnosť vajíčkovodu a tubárnu graviditu, aj keď nedokázal vysvetliť príčiny ich vzniku [5, 21].
Dlhé obdobie sa predpokladalo, že vajíčkovody sú len pasívnou trubicou slúžiacou na transport pohlavných buniek, resp. raného embrya. Experimentálne práce však potvrdzujú jeho dôležitú funkciu pri zachytení ovulujúceho oocytu a pri aktívnom transporte gamét aj oplodneného vajíčka [12], pri aktivácii spermií [40], pri oplodnení a pri vytváraní vhodného prostredia pre raný vývin embrya [32]. Vajíčkovod má preto jedinečnú transportnú aj sekrečnú funkciu, pričom obe tieto funkcie sú nevyhnutné v procese reprodukcie. V našom literárnom prehľade prinášame súhrn najnovších poznatkov o význame vajíčkovodu pri transporte gamét a embryí. Dopĺňame aj praktické využitie týchto poznatkov v gynekológii, so zameraním na asistovanú reprodukciu.
METÓDY PRÁCE
Pri vypracovaní komplexného prehľadu sme pracovali s odbornými databázami PubMed, Scopus a ISI Web of Knowledge. Po prvotnej analýze problematiky sme na základe vybraných kľúčových slov (uterine tube, embryo transport, sperm migration, ciliary transport, tubal infertility) vytvorili literárny rešerš. V rámci neho sme sa zamerali na štyri hlavné oblasti: 1. nové poznatky o mikroskopickej štruktúre vajíčkovodov, 2. mechanizmus transportu gamét a embrya vajíčkovodom, 3. faktory ovplyvňujúce transportnú funkciu vajíčkovodu, 4. klinické využitie získaných teoretických poznatkov.
STRUČNÝ PREHĽAD MIKROSKOPICKEJ STAVBY
Vajíčkovody (tubae uterinae, salpinx) sú párové svalové trubice spájajúce vaječníky s dutinou maternice, ktorých embryonálnym základom sú párové Müllerove (paramezonefrické) vývody. Tie sa objavujú počas 6. týždňa po oplodnení. Zatiaľ čo kaudálna časť Müllerových vývodov zrastá a slúži ako základ maternice a väčšej časti pošvy, kraniálne časti ostávajú oddelené. Ich konce sa otvárajú do peritoneálnej dutiny a dajú základ vajíčkovodom. V prípade embryí mužského pohlavia Müllerove vývody počas 8. až 9. týždňa vývinu účinkom anti-Müllerovho hormónu zanikajú. Vrodené anomálie vajíčkovodov sú väčšinou asociované s vrodenými chybami maternice, pošvy alebo obličiek [2]. Príkladom úplného zlyhania vývinu Müllerových vývodov, pri ktorom sa vôbec nevyvíjajú vajíčkovody, maternica ani vagína, je Mayerov-Rokitanského-Küsterov-Hauserov syndróm [25]. Na strane druhej, vo svetovej literatúre sa len zriedkavo opisujú izolované prípady unilaterálnej alebo bilaterálnej absencie vajíčkovodov, prípadne nevyvinutia proximálnej časti vajíčkovodu [13, 35, 49]. Ďalšou raritnou vrodenou anomáliou vajíčkovodov je zdvojenie ich proximálnych častí [33].
Priemerná dĺžka vajíčkovodu je 10 cm (7 až 14 cm) a jeho histologická štruktúra je naoko jednoduchá. Na priečnom reze možno od seba odlíšiť vnútornú vrstvu sliznice (tunica mucosa, endosalpinx), svalovú vrstvu (tunica muscularis, myosalpinx) a vonkajšiu serózu (tunica serosa, mesosalpinx, slov. mokvavka, čes. slupka), ktorá predstavuje duplikatúru peritonea. V rámci priebehu vajíčkovodu možno odlíšiť štyri anatomické časti. Tie sa vzájomne líšia priesvitom, hrúbkou svaloviny aj štruktúrou sliznice (obr. 1). Medzi relatívne široké časti vajíčkovodu patrí rozšírený lievik (infundibulum, čes. vejcovodová nálevka) s početnými prstovitými výbežkami označovanými ako strapce (fimbriae, čes. třásně). Medzi fimbriami sa nachádza brušné ústie vajíčkovodu (ostium abdominale). Druhou časťou je banka vajíčkovodu (ampulla, čes. baňka), ktorá je najdlhšou časťou vajíčkovodu. Jej priemerná dĺžka je 5 až 8 cm a priesvit 1 až 2 mm. Ampulla je označovaná aj ako locus fecundationis, teda miesto, kde dochádza k splynutiu ženskej a mužskej pohlavnej bunky. Sliznica v mieste infundibula a ampully vybieha do početných, vysokých a vetviacich sa krkiev (plicae mucosae, čes. vejvovodové řasy), pričom svalová vrstva je v týchto miestach relatívne tenká. Naopak, sliznica je relatívne hladká v tretej a štvrtej časti vajíčkovodu, teda v mieste úžiny (isthmus, čes. vejcovodová úžina) a v maternicovej časti (pars uterina, čes. děložní část), ktorá plynule prechádza do steny maternice. V tých častiach, ktoré sa nachádzajú bližšie k maternici, je vrstva svaloviny hrubšia. V rámci svaloviny môžeme od seba odlíšiť vnútornú cirkulárnu a vonkajšiu longitudinálnu vrstvu [3, 7].
Obr. 1a. Prierez oblasťou ampully vajíčkovodu 31-ročnej ženy (hematoxylín a eozín, zv. 40x) 
Obr. 1b. Prierez oblasťou isthmu vajíčkovodu tej istej ženy, pri tom istom farbení aj zväčšení ako na obr. 1a 
V seróze alebo v podseróznom väzive vajíčkovodov sa môžu vyskytovať cystické útvary, ktoré sú častejšie u starších žien. Vo všeobecnosti sú tieto paratubárne cysty klinicky asymptomatické a benígne, riziko ich malígnej premeny je len približne 2 až 3 % [42]. Prípady ich malígnej transformácie sú vo svetovej literatúre opisované ako zriedkavé kazuistiky, najmä ak sa vyskytujú v mladšom veku [48]. Z pohľadu pôvodu sú pravdepodobne pozostatkom Wolffových vývodov (embryonálny základ pre mužský vývodný systém) alebo sa jedná o zhluky vnorených buniek mezotelu, ktoré pokrývajú serózu, tzv. Walthardove „hniezda“ [17]. Paratubárne cysty môžu byť pôvodom aj z Müllerových vývodov, ako tzv. Morgagniho hydatidózne cysty [44]. Niektoré štúdie naznačujú, že Morgagniho cysty pripojené k fimbriám vajíčkovodu znižujú jeho schopnosť zachytiť ženskú pohlavnú bunku po ovulácii a tým znižujú pravdepodobnosť úspešného spontánneho oplodnenia [8, 39].
FUNKČNÁ MORFOLÓGIE SLIZNICE
Sliznica vajíčkovodu pozostáva z jednej vrstvy epitelových buniek, pod ktorou leží sliznicové väzivo (lamina propria) s početnými krvnými a lymfatickými cievami. Z pohľadu reprodukcie zohráva významnú úlohu interakcia pohlavných buniek / raného embrya s epitelovou výstelkou sliznice vajíčkovodu. V rámci krycieho epitelu môžeme morfologicky aj funkčne odlíšiť dve rôzne bunkové populácie. Sú to bunky s pohyblivými riasinkami a sekrečné bunky bez riasiniek, v anglosaskej literatúre označované ako peg-cells. Vzájomný pomer týchto dvoch bunkových populácií sa mení v závislosti od časti vajíčkovodu. Bunky s riasinkami sú početnejšie na fimbriách, v infundibule a ampulle (obr. 2), kým sekrečné bunky sú predominantné v mieste isthmu [3, 7].
Obr. 1. Jednovrstvový cylindrický epitel s prevahou buniek s riasinkami na povrchu fimbrií 45-ročnej ženy (hematoxylín a eozín, zv. 400x) 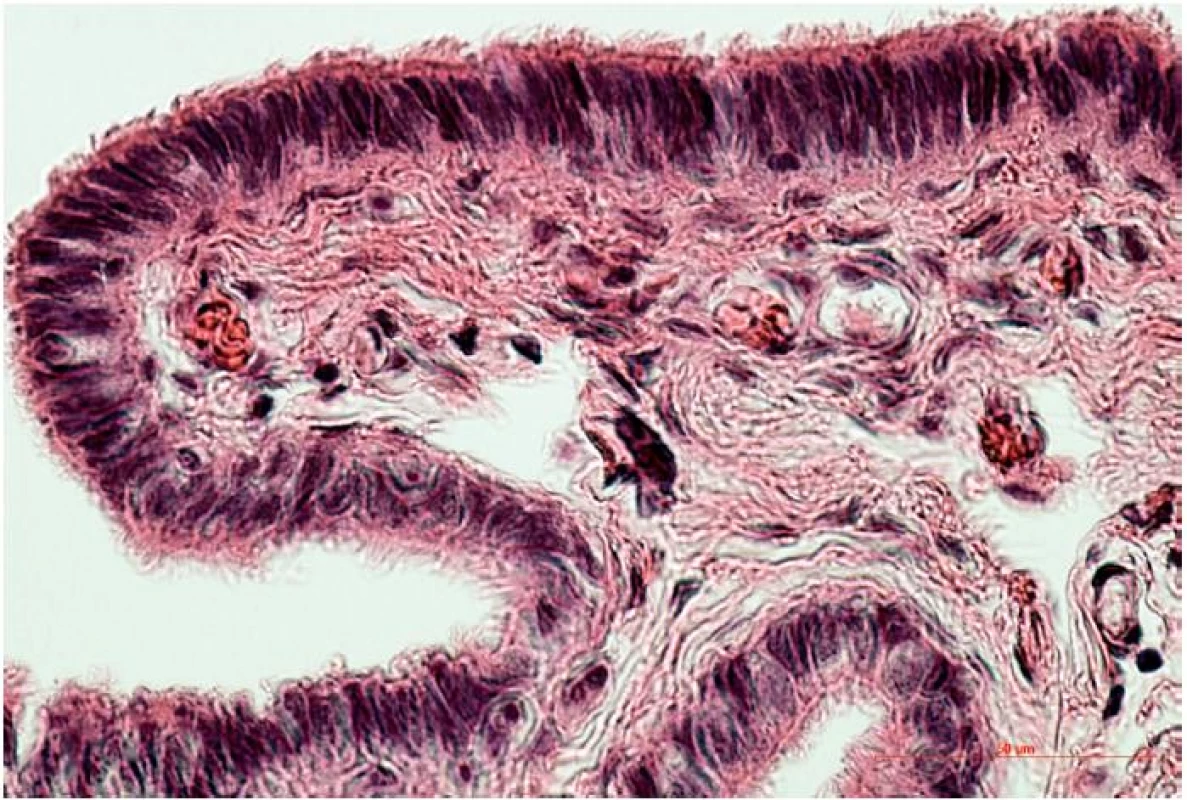
Sekrečné bunky produkujú jedinečný sekrét, ktorý je súčasťou tekutiny prúdiacej vo vnútri vajíčkovodu. Chemické zloženie tubárnej tekutiny sa odlišuje od krvnej plazmy, obsahuje vyššiu koncentráciu K+ a HCO3- a nižšiu koncentráciu Ca2+. Tubárna tekutina je bohatá na aminokyseliny (najmä arginín, alanín a glutamát), z bielkovín sú najčastejšie albumín a imunoglobulín G [26].Obsahuje makromolekulové látky selektívne prenášané z krvi, avšak sekrečné bunky produkujú aj jedinečné vajíčkovodu – špecifické bielkoviny (oviduct-specific proteins) oviductíny. Tieto bielkoviny sa viažu na obal vajíčka a embrya (zona pellucida), čo naznačuje ich funkciu v ranom vývine embrya. Zaujímavosťou je, že objem tubárnej tekutiny, ale aj hladina nutričných faktorov a oviductínov nie sú stále, sú ovplyvnené meniacou sa hladinou hormónov. Napríklad koncentrácia glukózy sa v čase ovulácie zvyšuje až 6-násobne [27]. Vo všeobecnosti možno predpokladať, že jedinečné zloženie tekutiny prúdiacej vo vnútri vajíčkovodu podporuje prežívanie spermií, pomáha v ich procese získavania oplodňovacej schopnosti (kapacitácia), a je nevyhnutná pre prežívanie oocytu a raného embrya [26, 40].
Podobne ako kôra vaječníkov, sliznica maternice alebo pošvy, aj vajíčkovody ženy v reprodukčnom veku prekonávajú pravidelné, cyklické zmeny. Morfologicky sa to prejaví zmenou výšky epitelových buniek a frekvenciou pohybu riasiniek (ciliárna aktivita). Epitelové bunky sliznice vajíčkovodov sú najnižšie počas menštruačnej fázy, následne narastajú počas proliferačnej fázy a svoju maximálnu výšku (až 30 µm) dosahujú v období okolo ovulácie. V období po ovulácii, v sekrečnej fáze, je zároveň najvyššia sekrečná aktivita sekrečných buniek a je aj najvyššia ciliárna aktivita [29, 31]. Ultraštruktúra epitelovej výstelky vajíčkovodu sa výrazne mení nie len mesačne, počas menštruačného cyklu, ale aj v rôznych vekových obdobiach ženy, počas puerpéria [9] a v menopauze [10], a dokonca aj po chirurgickej ligácii vajíčkovodov [28]. Vo všetkých prípadoch dochádza najmä k strate riasiniek epitelových buniek. O význame pohyblivosti riasiniek v procese transporte gamét a embrya sa zmienime v osobitnej stati.
Najnovšie poznatky z oblasti veterinárnej embryológie poukazujú na schopnosť raného embrya regulovať funkcie vajíčkovodu počas svojho transportu. Podľa Kölleho et al. [23] k prvej komunikácii medzi embryom a matkou dochádza už vo vajíčkovode. Embryo si formou parakrinnej komunikácie reguluje prekrvenie sliznice vajíčkovodu, aktivitu sekrečných buniek a dokáže aj znížiť frekvenciu kmitania riasiniek, čím si reguluje rýchlosť transportu. Tieto výsledky sa získali pri štúdiu hovädzieho dobytka, ich aplikácia v humánnej embryológii je zatiaľ otázna.
MECHANIZMUS TRANSPORTU VAJÍČKOVODOM
Vajíčkovod je jedinou trubicou v ľudskom tele, ktorá za fyziologických podmienok dokáže vykonávať transportnú funkciu v oboch smeroch (smerom do dutiny maternice, ako aj smerom k vaječníkom). Vajíčkovod podporuje kapacitáciu, selekciu a pohyb spermií smerom k vaječníkom [18, 46] a zároveň zabezpečuje pohyb a výživu oocytu / embrya smerom do dutiny maternice. Tieto mechanizmy transportu sú nevyhnutné pre úspešné spontánne otehotnenie. Transport vo vajíčkovode je daný tromi nezávislými dejmi, ktorými sú: motilita hladkej svaloviny, kmitanie riasiniek, prúdenie tubárnej tekutiny.
Interakcia týchto troch zložiek je dôležitá pri počiatku vzniku úspešnej tehotnosti a zároveň sa spolupodieľa na zabránení uhniezdenia embrya vo vajíčkovode a pri selekcii spermií, čím sa znižuje riziko polyspermatického oplodnenia [14]. Všetky tri deje sú kontrolované najmä meniacimi sa hladinami ovariálnych steroidných hormónov v krvi a/alebo v peritoneálnej tekutine [19]. Exaktné pochopenie regulačných mechanizmov ovplyvňujúcich transportnú funkciu vajíčkovodu má dôležitý význam vo vývine nových diagnostických metód a terapeutických stratégií pri poruchách transportnej funkcii vajíčkovodu, akými sú tubárna neplodnosť, ektopická gravidita alebo stavy po zápalových ochoreniach malej panvy.
MOTILITA SVALOVEJ VRSTVY VAJÍČKOVODU
V rámci hladkej svaloviny vajíčkovodu sa opisujú dva odlišné spôsoby kontrakcie. Dlhodobé, tonické kontrakcie sú charakteristické pre rozhranie častí ampulla a isthmus a rozhranie vajíčkovodu a maternice. Tieto tonické sťahy svaloviny dokážu dočasne zastaviť transport spermií / embrya. Druhým typom kontrakcie sú početné, pravidelné a krátke peristaltické vlny. Tieto peristaltické vlny majú rýchlosť 1 až 2 mm za sekundu a sú schopné postupovať oboma smermi. Druhý typ kontrakcie pomáha pri transporte gamét / embrya, resp. „premiešava“ tubárnu tekutinu s pohlavnými bunkami / embryom [14].
Motilitu svaloviny ovplyvňujú receptory pre ovariálne hormóny lokalizované na povrchu hladkých svalových buniek. V poslednej dobe sa však podarilo v stene vajíčkovodu identifikovať samostatnú populáciu buniek, ktorá by mohla mať funkciu udávačov kroku (tzv. pacemakerová aktivita). Lokalizované sú v sliznicovom väzive, aj medzi bunkami hladkej svaloviny. Nakoľko tieto bunky svojou funkciou pripomínajú Cajalove bunky steny čreva (tie regulujú peristaltické pohyby čreva), v odbornej literatúre sa označujú ako intersticiálne Cajalovým bunkám podobné bunky. Objavili ich len v roku 2005 rumunskí bunkoví biológovia pod vedením Popesca et al. [37]. Tieto bunky sú svojimi výbežkami v tesnom kontakte nielen medzi sebou, ale aj s bunkami hladkej svaloviny, nervovými vláknami a krvnými kapilárami [38]. Z pohľadu morfológie je zaujímavosťou, že intersticiálne Cajalovým bunkám podobné bunky majú v ľudskom tele druhé najdlhšie výbežky (po nervových bunkách). Podľa Cretoiua et al. [11] majú intersticiálne Cajalovým bunkám podobné bunky na svojom povrchu receptory pre steroidné hormóny. To by mohlo napovedať o ich senzorickej funkcii pri kontrole peristaltických pohybov svaloviny vajíčkovodu (zrýchlenie peristaltiky vplyvom estrogénov, spomalenie vplyvom progesterónu). Tieto prvotné domnienky môžu mať významné klinické využitie, napríklad pri vysvetlení príčin neplodnosti bez zjavného poškodenia vajíčkovodu. Pre úplnosť dopĺňame, že v in vitro podmienkach motilitu svaloviny vajíčkovodu ovplyvňujú aj ďalšie hormóny, resp. hormónom podobné látky, ako noradrenalín, neuropeptid Y, vazoaktívny intestinálny peptid, prostaglandíny, oxid dusnatý a ďalšie [14]. Nakoľko kumulatívny efekt týchto faktorov na funkciu vajíčkovodu in vivo nie je celkom objasnený, problematická je aj prípadná optimalizácia transportnej funkcie vajíčkovodu prostredníctvom farmakologickej intervencie.
Hladká svalovina vajíčkovodov a maternice má ešte jednu dôležitú úlohu. Systematické kontrakcie svaloviny regulované oxytocínom vytvárajú „peristaltickú pumpu“, ktorá napomáha presunu spermií z krčka maternice po „locus fecundationis“ v ampulle vajíčkovodu [51].
KMITANIE RIASINIEK VAJÍČKOVODU
Viaceré štúdie naznačujú, že práve kmitanie riasiniek je najdôležitejším podkladom transportu vo vnútri vajíčkovodu. Dôkazom sú výskumy na animálnych modeloch. Aj napriek tomu, že sa v experimentoch inhibuje aktivita svalovej vrstvy vajíčkovodu, transport embryí u laboratórnych zvierat prebieha nerušene [31]. Iným dôkazom dôležitej funkcie kmitania riasiniek sú poruchy plodnosti žien so syndrómom nepohyblivých riasiniek (tzv. Kartagenerov syndróm). Pri týchto stavoch dochádza ku geneticky podmieneným ultraštruktúrnym zmenám vnútornej štruktúry riasiniek, ktoré sa nedokážu pohybovať. Nakoľko aktivitu riasiniek pri Kartagenerovom syndróme nie je možné obnoviť, možnou liečbou neplodnosti u týchto pacientok sú metódy asistovanej reprodukcie [1, 50].
Kmitanie riasiniek je dôležitým podkladom prúdenia tubárnej tekutiny vo vnútri vajíčkovodu. Riasinky vo vajíčkovode kmitajú frekvenciou približne 5 až 20 Hz, pričom u experimentálnych zvierat sa frekvencia kmitania zvyšuje po kopulácii až o 20 % [42]. U žien bolo pozorovaná vyššia frekvencia kmitania riasiniek po ovulácii, čo napomáha zachyteniu uvoľňujúceho sa oocytu z Graafovho folikulu. Zrýchlenie kmitania je pravdepodobne spôsobené účinkom estrogénov, progesterónu a prostaglandínov uvoľnených z prasknutého Graafovho folikulu [31].
Frekvencia pohybu riasiniek je ovplyvnená hormonálne aj nervovo, pričom najviac preskúmaný je vplyv progesterónu a angiotenzínu II. (oba hormóny frekvenciu zvyšujú). Vplyv ďalších mediátorov zatiaľ nie je dokonale preskúmaný. Na strane druhej, až príliš vysoká hladina progesterónu spôsobuje dysfunkciu riasiniek vajíčkovodu. Tento poznatok môže byť príčinou zvýšeného rizika tubárnej gravidity po indukovanej ovulácii [34]. Len pre úplnosť uvádzame, že úloha autonómnej nervovej regulácie funkcií vajíčkovodu nie je doposiaľ objasnená. Po chirurgickej alebo farmakologickej denervácii sa totiž funkcia vajíčkovodu nemení [12].
VPLYV NEGATÍVNYCH FAKTOROV NA TRANPORTNÚ FUNKCIU VAJÍČKOVODU
Poruchy transportnej funkcie vajíčkovodu sa prejavujú poruchami plodnosti alebo tubárnou tehotnosťou. V tejto časti sumarizujeme najnovšie poznatky týkajúce sa vplyvu negatívnych faktorov na aktivitu riasiniek, ktorá hrá kľúčovú úlohu pri transporte gamét / embrya. Ciliárna aktivita je ovplyvnená okrem spomenutých hormónov aj inými biologicky aktívnymi látkami. Patria sem mediátory zápalu, cytokíny a produkty makrofágov, ktoré sa vyplavujú do peritoneálnej dutiny pri endometrióze. Je všeobecne známe, že endometrióza negatívne ovplyvňuje reprodukčnú schopnosť žien, avšak presný patomechanizmus nepoznáme. Lyons et al. [30] aplikovali peritoneálnu tekutinu žien s endometriózou na izolované vajíčkovody, pričom spozorovali spomalenie frekvencie kmitania riasiniek. Endometriózou zmenené mikroprostredie peritoneálnej dutiny môže prostredníctvom peritoneálnej tekutiny prúdiacej do vajíčkovodu vplývať na zachytenie ovulujúceho oocytu, na transport oocytu / embrya a môže byť aj embryotoxické.
Ďalším negatívnym faktorom je cigaretový dym. Epidemiologické štúdie uvádzajú, že ženy, ktoré denne vyfajčia 20 a viac cigariet, majú asi 4-násobne vyššie riziko tubárnej gravidity v porovnaní s nefajčiarkami [31]. Cigaretový dym, najmä nikotín, spôsobuje zníženie motility svaloviny a zníženie prekrvenia vajíčkovodu. Zložky cigaretového dymu pravdepodobne účinkujú aj na epitelové bunky, pričom nikotín znižuje frekvenciu kmitania riasiniek a formaldehyd dokonca ich pohyb úplne inhibuje [47]. Fajčenie má negatívny dopad aj na výsledok umelého oplodnenia. Podľa štúdie Chunga et al. [20], aktívne fajčenie neznižuje počet oocytov, ktoré sa laparoskopicky odoberú pri metódach asistovanej reprodukcie, avšak následne sa výrazne znižuje percento úspešne ukončených tehotností (10,5 % u fajčiarok v porovnaní s 33,3 % u nefajčiarok).
Z pohľadu reprodukčnej medicíny patria chlamýdiové infekcie medzi najdôležitejšie faktory vyvolávajúce tubárnu neplodnosť, tubárnu graviditu a reprodukčné straty. Tieto stavy sú dôkazom, že poruchy transportnej funkcie vajíčkovodov sú priamym dôsledkom zápalových procesov v malej panve. Vzťah medzi prekonanou chlamýdiovou infekciou a tubárnou neplodnosťou je tak silný, že viaceré štúdie potvrdili prediktívnu hodnotu protilátok proti chlamýdiám v krvi vo vzťahu k tubárnej neplodnosti [24, 36]. Baktérie Chlamydia trachomatis, ale aj Neisseria gonorrhaeae a Mycoplasma genitalium majú vysokú afinitu k sliznici vajíčkovodu, pričom zapríčiňujú atrofiu slizničných rias. Na úrovni epitelu dochádza k strate riasiniek, aj k degenerácii sekrečných buniek [6]. Poškodenie sliznice vedie k fibróze vajíčkovodu a k zrastaniu fimbrií, čím stúpa tlak vo vnútri vajíčkovodu. Narušenie membránových iónových kanálov epitelových buniek vedie k zvýšenej sekrécii tubárnej tekutiny a k jej zníženej reabsorpcii. Dôležitú úlohu v procese nadprodukcie tubárnej tekutiny pri postinfekčnej hydrosalpingitíde zohráva kanál chloridových iónov CFTR (cystic fibrosis transmembrane conductance regulator). Tento iónový kanál slúži pravdepodobne aj na vstup C. trachomatis do vnútra epitelových buniek [4]. Ďalším možným patomechanizmom vzniku postinfekčnej hydrosalpingitídy je zvýšenie aktivity sekrečných buniek vajíčkovodu vplyvom mediátorov zápalu [15]. Tubárna tekutina vznikajúca pri hydrosalpingitíde má priamo embryotoxický efekt, čo znižuje úspešnosť po in vitro fertilizácii. Toxický efekt na embryo má zrejme prítomnosť baktérií a ich toxínov, aj obsah cytokínov, nedostatok výživných látok a produkty oxidačného stresu v tubárnej tekutine [45].
ZÁVER
Vnútorné prostredie vajíčkovodu zohráva unikátnu úlohu v procese transportu pohlavných buniek a embrya, ako aj vo včasnom embryonálnom vývine nového jedinca. V našom prehľade poukazujeme na marginalizované, málo známe fakty o mikroskopickej štruktúre vajíčkovodu, ktoré sú podkladom jeho funkcie. Opisujeme jednotlivé mechanizmy transportu vo vnútri vajíčkovodu a spôsoby ich regulácie (endokrinne hormónmi, novšie práce poukazujú aj na parakrinnú cestu prostredníctvom samotného embrya). Transportná funkcia vajíčkovodu môže byť ovplyvnená množstvom vonkajších faktorov (cigaretový dym, chlamýdiová infekcia, endometrióza), s ktorými sa gynekológovia stretávajú vo svojej každodennej praxi. Exaktné porozumenie ich účinku na epitel vajíčkovodu môže dopomôcť k vypracovaniu nových diagnostických aj liečebných metód pri poruchách plodnosti žien.
Poznámka: pri anatomickom opise vajíčkovodu uvádzame aj oficiálnu slovenskú terminológiu [16], ako aj české ekvivalenty [22]. Snažíme sa týmto vniesť slovenské aj české anatomické názvoslovie z teoretickej úrovne do každodennej praxe.
Adresa pro korespondenci:
Doc. RNDr. Ivan Varga, PhD.
Ústav histológie a embryológie
Lekárska fakulta Univerzity Komenského
Sasinkova ulica 4
811 08 Bratislava 1
Slovensko
e-mail: ivan.varga@fmed.uniba.sk
Zdroje
1. Abu-Musa, A., Nassar, A., Usta, I. In vitro fertilization in two patients with Kartagener‘s syndrome and infertility. Gynecol Obstet Invest, 2008, 65, 1, p. 29–31.
2. Acién, P., Acién, MI. The history of female genital tract malformation classifications and proposal of an updated system. Hum Reprod Update, 2011, 17, 5, p. 693–705.
3. Adamkov, M., Varga I. Female reproductive system. In Adamkov, M. (Ed). Introduction to Functional Histology. Martin: P+M Turany, 2011, p. 333–362.
4. Ajonuma, LC., Ng, EH., Chan, HC. New insights into the mechanisms underlying hydrosalpinx fluid formation and its adverse effect on IVF outcome. Hum Reprod Update, 2002, 8, 3, p. 255–264.
5. Ankum, WM., Houtzager, HL., Bleker, OP. Reinier De Graaf (1641–1673) and the Fallopian tube. Hum Reprod Update, 1996, 2, 4, p. 365–369.
6. Baczynska, A., Funch, P., Fedder, J., et al. Morphology of human Fallopian tubes after infection with Mycoplasma genitalium and Mycoplasma hominis – in vitro organ culture study. Hum Reprod, 2007, 22, 4, p. 968–979.
7. Bhathiq, AOS., Ledger, WL. Historical backround and functioal anatomy. In Ledger, WL., Tan, SL., Bhathiq, AOS. The Fallopian tube in infertility and IVF practice. Cambridge: Cambridge University Press, 2010, p. 1–7.
8. Cebesoy, FB., Kutlar, I., Dikensoy, E., et al. Morgagni hydatids: a new factor in infertility? Arch Gynecol Obstet, 2010, 281, 6, p. 1015–1017.
9. Cigánková, V., Krajnicáková, H., Kokardová, M., Tomajková, E. Morphological changes in the ewe uterine tube (oviduct) epithelium during puerperium. Vet Med (Praha), 1996, 41, 11, p. 339–346.
10. Correr, S., Makabe, S., Heyn, R., et al. Microplicae-like structures of the fallopian tube in postmenopausal women as shown by electron microscopy. Histol Histopathol, 2006, 21, p. 219–226.
11. Cretoiu, SM., Cretoiu, D., Suciu, L., Popescu, LM. Interstitial Cajal-like cells of human Fallopian tube express estrogen and progesterone receptors. J Mol Histol, 2009, 40, 5–6, p. 387–394.
12. Croxatto, HB. Physiology of gamete and embryo transport through the fallopian tube. Reprod Biomed Online, 2002, 4, 2, p. 160–169.
13. Dahan, MH., Burney, R., Lathi, R. Congenital interruption of the ampullary portion of the Fallopian tube. Fertil Steril 2006, 85, 6, p. 1820–1821.
14. Djahanbakhch, O., Ezzati, M., Saridogan, E. Physiology and pathophysiology of tubal transport: ciliary beat and muscular contractility, relevance to tubal infertility, recent research, and future directions. In Ledger, WL., Tan, SL., Bhathiq, AOS. The Fallopian tube in infertility and IVF practice. Cambridge: Cambridge University Press, 2010, p. 19–29.
15. Downing, SJ., Chambers, EL., Maguiness, SD., et al. Effect of inflammatory mediators on the electrophysiology of the human oviduct. Biol Reprod, 1999, 61, 3, p. 657–664.
16. Holomáňová, A., Brucknerová, I. Anatomické názvy I. Latinsko-anglicko-slovenský slovník. Bratislava: Vydavateľstvo Elán, 2001, 94 s.
17. Hunt, JL., Lynn, AAA. Histologic features of surgically removed Fallopian tubes. Arch Pathol Lab Med, 2002, 126, p. 951–955.
18. Hunter, RH. Sperm release from oviduct epithelial binding is controlled hormonally by peri-ovulatory graafian follicles. Mol Reprod Dev, 2008, 75, 1, p.167–174.
19. Hunter, RH., Cicinelli, E., Einer-Jensen, N. Peritoneal fluid as an unrecognised vector between female reproductive tissues. Acta Obstet Gynecol Scand, 2007, 86, 3, p. 260–265.
20. Chung, PH., Yeko, TR., Mayer, JC., et al. Gamete intrafallopian transfer. Does smoking play a role? J Reprod Med, 1997, 42, 2, p. 65–70.
21. Jay, V. The legacy of Reinier De Graaf. Arch Pathol Lab Med, 2000, 124, 8, p. 1115–1116.
22. Kachlík, D., Čech, P., Musil, V., Báča, V. České tělovědné názvosloví. Návrh české anatomické nomenklatury podle poslední revize mezinárodně platné latinské anatomické nomenklatury. Brno: Tribun EU s.r.o., 2010, 170 s.
23. Kölle, S., Dubielzig, S., Reese, S., et al. Ciliary transport, gamete interaction, and effects of the early embryo in the oviduct: ex vivo analyses using a new digital videomicroscopic system in the cow. Biol Reprod, 2009, 81, 2, p. 267–274.
24. Lardenoije, CM., Land, JA. Chlamydia antibody testing for tubal factor subfertility. Ned Tijdschr Geneeskd, 2007, 151, 36, p. 1981–1985.
25. Laterza, RM., De Gennaro, M., Tubaro, A., Koelbl, H. Female pelvic congenital malformations. Part I: embryology, anatomy and surgical treatment. Eur J Obstet Gynecol Reprod Biol, 2011, 159, 1, p. 26–34.
26. Leese, HJ. The formation and function of oviduct fluid. J Reprod Fert, 1988, 82, p. 843–856.
27. Leese, HJ., Tay, JI., Reischl, J., Downing, SJ. Formation of Fallopian tubal fluid: role of a neglected epithelium. Reproduction, 2001, 121, 3, p. 339–346.
28. Li, J., Chen, X., Zhou, J. Ultrastructural study on the epithelium of ligated fallopian tubes in women of reproductive age. Ann Anat, 1996, 178, 4, p. 317–320.
29. Lyons, RA., Djahanbakhch, O., Mahmood, T., et al. Fallopian tube ciliary beat frequency in relation to the stage of menstrual cycle and anatomical site. Hum Reprod, 2002a, 17, 3, p. 584–588.
30. Lyons, RA., Djahanbakhch, O., Saridogan, E., et al. Peritoneal fluid, endometriosis, and ciliary beat frequency in the human Fallopian tube. Lancet, 2002b, 360, 9341, p. 1221–1222.
31. Lyons, RA., Saridogan, E., Djahanbakhch, O. The effect of ovarian follicular fluid and peritoneal fluid on Fallopian tube ciliary beat frequency. Hum Reprod, 2006, 21, 1, p. 52–56.
32. Menezo, Y., Guerin, P. The mammalian oviduct: biochemistry and physiology. Eur J Obstet Gynecol Reprod Biol, 1997, 73, p. 99–104.
33. Narayanan, R., Rajeev, MA. Duplication of the Fallopian tube.J Hum Reprod Sci, 2008, 1, 1, p. 35–36.
34. Paltieli, Y., Eibschitz, I., Ziskind, G., et al. High progesterone levels and ciliary dysfunction – a possible cause of ectopic pregnancy. J Assist Reprod Genet, 2000, 17, 2, p. 103–106.
35. Pabuccu, E., Kahraman, K., Taskın, S., Atabekoglu, C. Unilateral absence of fallopian tube and ovary in an infertile patient. Fertil Steril, 2011, 96, 1, p. e55–e57.
36. Polák, Š., Varga, I., Urban, L., Tóth, F. Chlamýdiové infekcie a reprodukčná schopnosť – I. časť. Praktická Med., 2008, 4, s. 17–20.
37. Popescu, LM., Ciontea, SM., Cretoiu, D., et al. Novel type of interstitial cell (Cajal-like) in human Fallopian tube. J Cell Mol Med, 2005, 9, 2, p. 479–523.
38. Popescu, LM., Ciontea, SM., Cretoiu, D. Interstitial Cajal-like cells in human uterus and Fallopian tube. Ann N Y Acad Sci, 2007, 1101, p. 139–165.
39. Rasheed, SM., Abdelmonem, AM. Hydatid of Morgagni: a possible underestimated cause of unexplained infertility. Eur J Obstet Gynecol Reprod Biol, 201,; 158, 1, p. 62–66.
40. Rodriguez-Martinez, H. Role of the oviduct in sperm capacitation. Theriogenology, 2007, 68S, p. 138–146.
41. Samaha, M., Woodruff, JD. Paratubal cysts: frequency, histogenesis, and associated clinical features. Obstet Gynecol, 1985, 65, 5, p. 691–694.
42. Savelli, L., Ghi, T., De Iaco, P., et al. Paraovarian/paratubal cysts: comparison of transvaginal sonographic and pathological findings to establish diagnostic criteria. Ultrasound Obstet Gynecol, 2006, 28, 3, p. 330–304.
43. Shi, D., Komatsu, K., Uemura, T., Fujimori, T. Analysis of ciliary beat frequency and ovum transport ability in the mouse oviduct. Genes Cells, 2011, 16, 3, p. 282–290.
44. Shin, YJ., Kim, JY., Lee, HJ., et al. Paratubal serous borderline tumor. J Gynecol Oncol, 2011, 22, 4, p. 295–298.
45. Strandell, A., Lindhard, A. Why does hydrosalpinx reduce fertility? The importance of hydrosalpinx fluid. Hum Reprod, 2002, 17, 5, p. 1141–1145.
46. Suarez, SS., Pacey, AA. Sperm transport in the female reproductive tract. Hum Reprod Update, 2006, 12, 1, p. 23–37.
47. Talbot, P., Riveles, K. Smoking and reproduction: the oviduct as a target of cigarette smoke. Reprod Biol Endocrinol, 2005, 3, p. 52.
48. Terek, MC., Sahin, C., Yeniel, AO., et al. Paratubal borderline tumor diagnosed in the adolescent period: a case report and review of the literature. J Pediatr Adolesc Gynecol, 2011, 24, 5, p. e115–e116.
49. Yazawa, H., Yabe, M., Endo, S., Hayashi, S. A case of congenital unilateral partial absence of fallopian tube. Fukushima J Med Sci, 2010, 56, 1, p. 44–49.
50. Záková, J., Ventruba, P., Crha, I., et al. Nové metody zvyšující úspěšnost asistované reprodukce. Čes Gynek, 2012 77, 2, s. 139–142.
51. Zervomanolakis, I., Ott, HW., Hadziomerovic, D., et al. Physiology of upward transport in the human female genital tract. Ann N Y Acad Sci, 2007, 1101, p. 1–20.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek EditorialČlánek Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v BrněČlánek Obsahový rejstříkČlánek Rejstřík autorůČlánek Věcný rejstřík
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2012 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Editorial
- Úloha leptinu v lidské reprodukci (anorexie, bulimie)
- Dehiscencia laparotómie po hysterektómii – manažment hojenia rany
- Výskyt infekcie u novorodencov SAG pozitívnych matiek v závislosti na peripartálnej antibiotickej profylaxii a spôsobe pôrodu
- Možnosti ultrazvukové predikce placenta accreta v klinické praxi
- Nové technologie a perspektivy analýzymetabolomu embrya
- 3D MR-based brachyterapie v léčbě lokálně pokročilého karcinomu děložního hrdla – časné klinické výsledky
- Moderní chirurgická a biologická léčba karcinomu prsu
- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v Brně
- Follow-up po léčbě karcinomu ovaria –opravdu bez Ca 125?
- Srovnání vybraných parametrů oxidačního stresu ve folikulární tekutině u žen s poruchou plodnosti a u zdravých fertilních dárkyň oocytů
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
- Jak dál s naším porodnictvím?
- Bezpečnost domácích porodů a medicína založená na důkazech
- Domácí porody v České republice
-
Pracovní komise pro porodnictví MZ ČR
PROHLÁŠENÍ ODBORNÝCH SPOLEČNOSTÍ
(Péče o matku a dítě) - Část zápisu z jednání výboru ČGPS ČLS JEP
-
PETICE
dle čl. 18 Listiny základních práv a svobod a zákona č. 85/1990 Sb.o právu petičním - Štruktúrny základ transportnej funkcie vajíčkovodu
- Postižení vývoje dětí s nízkou porodní hmotnostíve 24 měsících korigovaného věku, narozených v České republice v letech 2000–2009
- Porody dětí velkých hmotností ve Fakultní nemocnici v Olomouci (1993–2010)
- Endovaskulární léčba krvácení v souvislostis porodem a těhotenstvím
-
Rychle progredující tumor dělohy
kazuistika - Doporučení k předpisu kombinované hormonální antikoncepce
- Vzpomínka na prim. MUDr. J. Šráčka
- Obsahový rejstřík
- Rejstřík autorů
- Věcný rejstřík
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Domácí porody v České republice
- Doporučení k předpisu kombinované hormonální antikoncepce
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



