-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Moderní chirurgická a biologická léčba karcinomu prsu
Modern surgical and biological therapy of breast cancer
Breast cancer is the most common cancer of women in the Czech Republic. According to data from the National Cancer Registry (NOR) in 2007, the incidence is 122.7 cases of breast cancer in 100 000 women per year. Czech Republic occupies in the incidence of women brest cancer 26th place in the world and 17th place in Europe. Annualy it has been diagnosed 6500 these tumors, 1700–1900 women die for him in the Czech Republic (data from 2007). The incidence show long-term upward trend (an increase of 32% in 2007 compared to 1995), while mortality has long been stabilized. In this favorable outcome ivolved the introduction of systematic screeningu mammography in women over 45 years of age, diagnosis of early stages of disease, effective adjutant therapy and treatment of metastatic disease. In an international comparison of mortality, the Czech Republic belongs to 71th place in the world and the 27th place in Europe. Malignant neoplasm of breast cancer often affects women of working age, nearly 43% of patients are younger than 60 years. Long-term increasing incidence and stable mortality lead to a further increase in prevalence, which in 2007 reached more than 55 000 women living with breast cancer or its history. The various modalities of treatment include surgery, radiotherapy, systemic chemotherapy, hormonal therapy and targeted biological therapy.
Fastest-growing issues in breast cancer management is the sentinel nodes and non-invasive breast cancers. This entity was newly assigned and represented by a lobular carcinoma in situ (LCIS) and ductal carcinoma in situ (DCIS). DCIS as noninvasive cancer of the breast is generally 15–20% of breast cancers diagnosed and the number is growing.Key words:
breast cancer, surgery therapy, biological therapy.
Autoři: Vít Weinberger 1
; Luboš Minář 1
; Dagmar Brančíková 2
Působiště autorů: Gynekologicko-porodnická klinika FN a LF MU, Brno, přednosta prof. MUDr. P. Ventruba, DrSc., MBA 1; Interní hematoonkologická klinika FN a LF MU, Brno, přednosta prof. MUDr. J. Mayer, CSc. 2
Vyšlo v časopise: Ceska Gynekol 2012; 77(6): 513-520
Souhrn
Karcinom prsu je nejčastějším nádorem žen v České republice (ČR). Podle údajů Národního onkologického registru (NOR) z roku 2007 je incidence karcinomu prsu 122,7 případu na 100 tisíc žen za rok. ČR obsazuje v incidenci karcinomu prsu u žen 26. místo ve světě a 17. místo v Evropě. Ročně je v ČR u žen diagnostikováno 6500 těchto nádorů, 1700–1900 žen na něj zemře (data z roku 2007). Incidence vykazuje dlouhodobě rostoucí trend (nárůst o 32 % v roce 2007 oproti roku 1995), naopak mortalita je dlouhodobě stabilizovaná. Na tomto příznivém výsledku se podílí zavedení systematického mamografického screeningu u žen nad 45 let věku, diagnostika časných stadií nemoci, účinnější adjuvantní terapie a léčba metastatického onemocnění. V mezinárodním srovnání mortality je ČR na 71. místě ve světě a na 27. místě v Evropě. Zhoubný novotvar prsu často postihuje ženy v produktivním věku, téměř 43 % pacientek je mladších než 60 let. Dlouhodobě rostoucí incidence a stabilizovaná mortalita dále vedou k nárůstu prevalence, která v roce 2007 dosáhla více než 55 000 žen žijících s nádorem prsu nebo jeho anamnézou. K jednotlivým modalitám léčby patří chirurgie, radioterapie, systémová léčba chemoterapií, hormonální léčba a cílená biologická léčba.
Nejdynamičtěji se rozvíjející problematikou u zhoubného nádoru prsu je management sentinelové uzliny a neinvazivních karcinomů prsu. Tato entita byla nově vyčleněna a představuje ji lobulární karcinom in situ (LCIS) a duktální karcinom in situ (DCIS). DCIS jako neinvazivní nádorové onemocnění prsu představuje celkově 15–20 % diagnostikovaných nádorů prsu a jejich počet neustále stoupá.Klíčová slova:
karcinom prsu, chirurgická léčba, biologická léčba.ÚVOD
Karcinom prsu je nejčastějším nádorem žen v České republice (ČR). Podle údajů Národního onkologického registru (NOR) z roku 2007 je incidence karcinomu prsu 122,7 případu na 100 tisíc žen za rok. ČR obsazuje v incidenci karcinomu prsu u žen 26. místo ve světě a 17. místo v Evropě. Ročně je v ČR u žen diagnostikováno 6500 těchto nádorů, 1700–1900 žen na něj zemře (data z roku 2007). Incidence vykazuje dlouhodobě rostoucí trend (nárůst o 32 % v roce 2007 oproti roku 1995), naopak mortalita je dlouhodobě stabilizovaná (graf 1). Na tomto příznivém výsledku se podílí zavedení systematického mamografického screeningu u žen nad 45 let věku, diagnostika časných stadií nemoci, účinnější adjuvantní terapie a léčba metastatického onemocnění (graf 2). V mezinárodním srovnání mortality je ČR na 71. místě ve světě a na 27. místě v Evropě. Zhoubný novotvar prsu často postihuje ženy v produktivním věku, téměř 43 % pacientek je mladších než 60 let. Dlouhodobě rostoucí incidence a stabilizovaná mortalita dále vedou k nárůstu prevalence, která v roce 2007 dosáhla více než 55 000 žen žijících s nádorem prsu nebo jeho anamnézou. K jednotlivým modalitám léčby patří chirurgie, radioterapie, systémová léčba chemoterapií, hormonální léčba a cílená biologická léčba [1].
Graf 1. Epidemiologie zhoubného nádoru prsu u žen v ČR 
Graf 2. Záchyt klinických stadií zhoubného nádoru prsu u žen v ČR 
Nejdynamičtěji se rozvíjející problematikou u zhoubného nádoru prsu je management sentinelové uzliny a neinvazivních karcinomů prsu. Tato entita byla nově vyčleněna a představuje ji lobulární karcinom in situ (LCIS) a duktální karcinom in situ (DCIS). DCIS jako neinvazivní nádorové onemocnění prsu představuje celkově 15–20 % diagnostikovaných nádorů prsu a jejich počet neustále stoupá [2].
CHIRURGICKÁ LÉČBA
Chirurgickou léčbu karcinomu prsu lze rozdělit na chirurgii samotné mléčné žlázy, chirurgii lymfatických uzlin, chirurgii vzdálených metastáz a rekonstrukční chirurgii. Chirurgická terapie je součástí komplexní léčby karcinomu prsu. Současným standardem chirurgické léčby je prs záchovný operační výkon v kombinaci s pooperačním ozářením. Adjuvantní radioterapie je nutná jako prevence recidivy karcinomu prsu, neboť bez ní je po konzervativním a prs záchovném chirurgickém výkonu incidence lokální recidivy 27 %. Existují ale stále situace, kdy je vhodnější odstranění celého prsu. Většině pacientek bez ohledu na stadium onemocnění je nabídnuta primárně chirurgická terapie, ať již za účelem kurativním, nebo paliativním, resp. sanačním. Pouze u velmi úzké skupiny pacientek je chirurgická léčba jedinou terapií. Jde o některé neinvazivní karcinomy, karcinom stadia T1a,b N0 M0 (tumor menší než 1 cm) s příznivým histopatologickým nálezem za předpokladu ablativního, nikoli chirurgicky konzervativního výkonu.
U ostatních stadií je primární operace doplněna radioterapií a/nebo systémovou léčbou chemoterapií, hormonoterapií nebo biologickou léčbou. Část karcinomů III. stadia (lokálně pokročilých) je považována za primárně inoperabilní. Léčba u této skupiny je zahájena neoadjuvantní chemoterapií a operace je zvažována podle odpovědi na systémovou léčbu [3]. Odklon od radikálních chirurgických výkonů ve smyslu radikální mastektomie je podpořen výsledky mnoha studií, které potvrzují dosažení rovnocenných dlouhodobých léčebných výsledků po konzervativních operacích s následným ozářením prsu.
Prs zachovávající (konzervativní)chirurgické výkony
Záchovné operace mohou představovat jak odstranění tumoru s lemem okolní zdravé tkáně, tak i složitější rekonstrukční výkony, které jsou již součástí plastické chirurgie. Za bezpečný lem zdravé tkáně od karcinomu je v současnosti považován 1 mm. Pokud není splněn požadavek lemu zdravé tkáně v okrajích histopatologického preparátu, je indikována reresekce. Ta je u prs zachovávajících výkonů poměrně častá, literárně se uvádí četnost ve 20–30 %. Indikací k reresekci je rovněž duktální karcinom in situ (DCIS) v resekční linii. Naopak atypická duktální hyperplazie, atypická lobulární hyperplazie a lobulární karcinom in situ nejsou indikací k reresekci [2, 5].
Kontraindikacemi pro konzervativní – prs šetřící operace u karcinomu prsu jsou nádor větší než 4 cm, multifokální nález, difuzní mikrokalcifikace, předchozí ozáření prsu, nepoměr mezi velikostí prsu a nádoru, rozsáhlý DCIS a nemožnost zajistit adekvátní radioterapii. Podle radikality odstranění tkáně rozlišujeme několik druhů výkonů. Níže jsou uvedené subtypy parciální mastektomie [3, 4].
Lumpektomie je výkon, při kterém je vyjmut tumor s malým lemem zdravé tkáně v okolí. Kosmeticky nejpříznivější řezy jsou periareolární. Pokud je nádor v těsné blízkosti kůže, je možno ji částečně resekovat. Odstranění celého tumoru v rámci segmentu se nazývá segmentektomie nebo též tylektomie. Při výkonu se resekuje dostatečně velké množství zdravé tkáně v okolí tumoru. Kožní řezy jsou vedeny jako u lumpektomie, na rozdíl od ní jsou mírně rozšířené [5, 9].
Parciální mastektomie je výkon, při kterém se odstraní část prsu s nádorem s dostatečně velkým lemem zdravé tkáně, dále fascie z musculus pectoralis major pod tumorem a kůže nad ním. V některých případech lze výkon nazvat i kvadrantektomií. Do lůžka po resekci karcinomu, resp. do pektorálního svalu pod tumorem jsou naloženy kovové klipy, které umožní zaměřit „boost“ radiačního záření do původního místa výskytu karcinomu. Všechny výše zmíněné konzervativní výkony – prs zachovávající operace, mohou být doplněny o biopsii sentinelové uzliny (SNB) nebo o disekci axily, kdy jsou exstirpovány lymfatické uzliny z I. i II. etáže axily. Výkon je prováděn ze separátního řezu vedeného v příslušné axile [5, 6].
Radikalizující chirurgické výkony
Simplexní (totální) mastektomie je výkon, při kterém se odebírá celý prs včetně facie musculus pectoralis major. Stejně jako u modifikované radikální mastektomie lze výkon provést jako kůži šetřící (subkutánní mastektomie) nebo v kombinaci s modelací. V současné době se provádí mastektomie v následujících indikacích: nádory větší než 4 cm, nepříznivý poměr velikosti prsu vůči nádoru, multicentrické nádory, rozsáhlý DCIS, invazivní karcinom v kombinaci s DCIS v rozsáhlém okolí, Pagetův karcinom, inflamatorní karcinom, některé lokální recidivy a při nemožnosti adjuvantní radioterapie. K výkonu může být připojena i biopsie sentinelové uzliny. V případě pozitivní sentinelové uzliny je provedena disekce axily [7].
Modifikovaná radikální mastektomie podle Pickrena je výkon, při kterém se odstraní celý postižený prs včetně pektorální fascie. Z jednoho řezu je provedena rovněž disekce příslušné axily.
Subkutánní mastektomie se provádí u menších, dostatečně hluboko uložených tumorů. Při tomto výkonu je ponechán areolomamilární komplex. Radikalita výkonu je oproti výše zmíněným menší, neboť po výkonu zůstává asi 10 % reziduální tkáně prsu.
Radikální mastektomie podle Halsteda a Mayera je již historický výkon. Pro svoji radikalitu je v dnešní době obsolentní, výrazně zvyšuje pooperační morbiditu a nezlepšuje celkové přežití pacientky. Při tomto výkonu je odstraněn nejen celý prs a pektorální fascie, nýbrž i oba pektorální svaly, torakodorzální nervově cévní svazek, nervus thoracicus longus. Disekce axily se provádí ve všech třech etážích en block. Tento radikální výkon má své využití jen tehdy, pokud nádor infiltruje prsní sval, jsou postiženy Rotterovy interpektorální uzliny [8].
Rozšířená radikální mastektomie nenachází v dnešní době uplatnění. Při výkonu se odstraňovaly nitrohrudní uzliny.
Profylaktická kontralaterální mastektomie je zatím u nás indikována u pacientek s pozitivitou BRCA 1 nebo 2.Riziko kontralaterálního postižení prsu je u DCIS 6,4 % a u duktálního a lobulárního invazivního karcinomu 10 % na 10 let.
Axilární lymfadenektomie –disekce axily
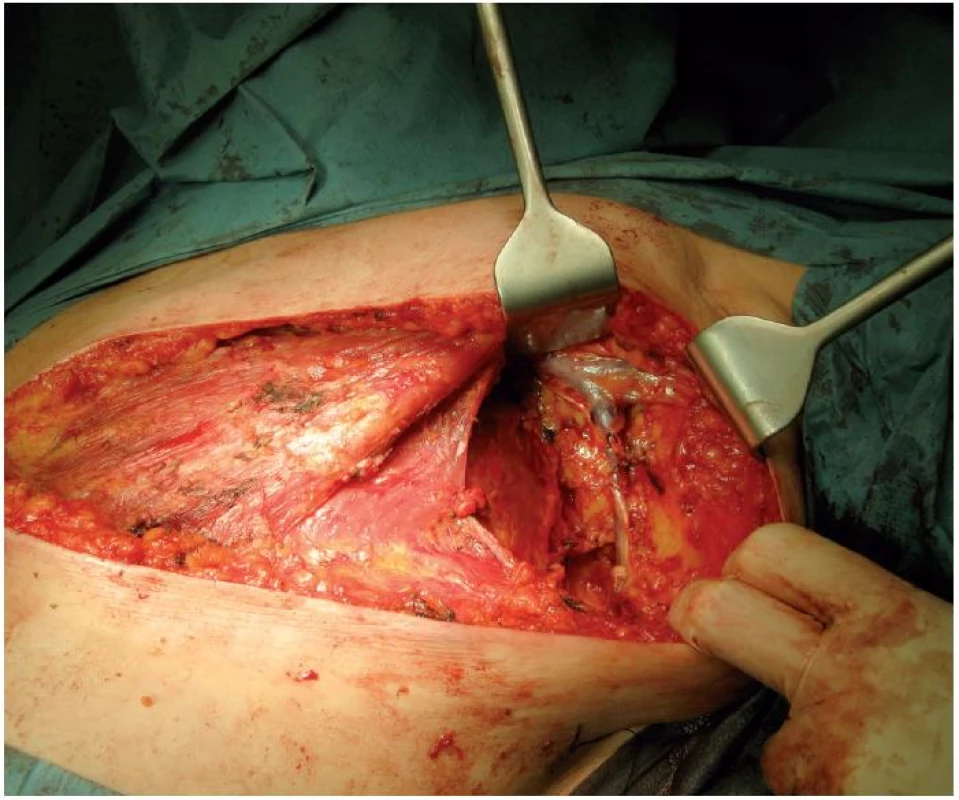
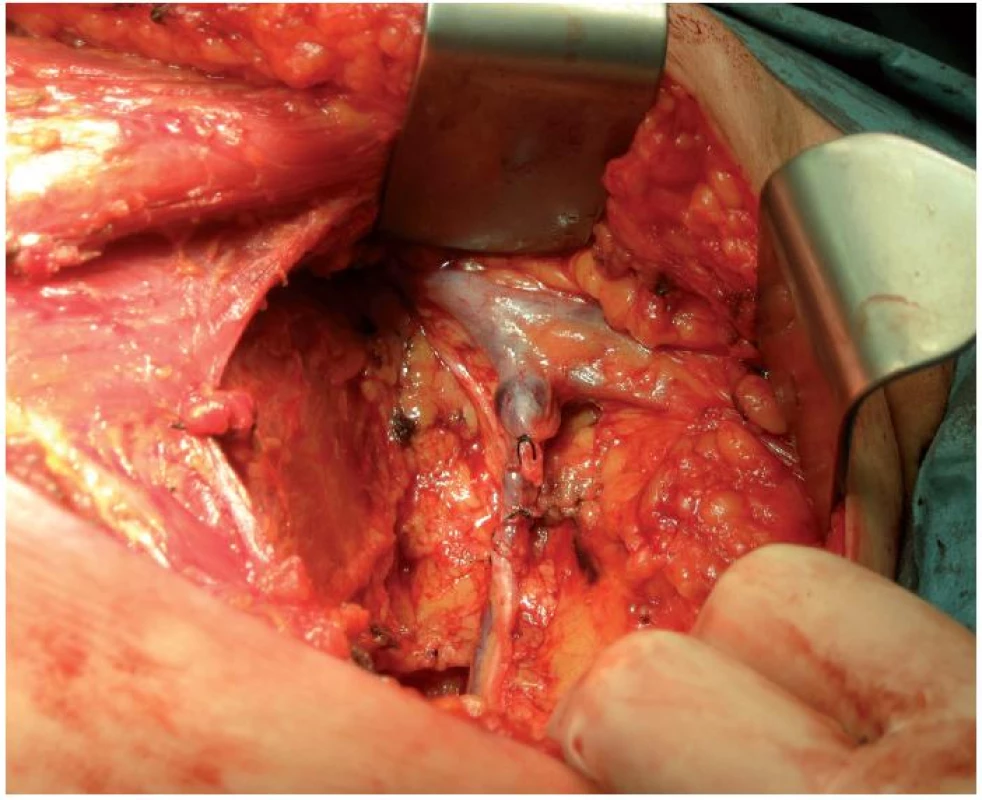
Výsledek vyšetření lymfatických uzlin má kromě terapeutického smyslu hlavně význam stagingový. Poskytuje významnou informaci o prognóze pacientky. Pro exenteraci axily je preferován oddělený kožní řez před výkony prováděnými z jednoho řezu z prsní tkáně. Zisk méně než 10 uzlin z I. a II. etáže nelze považovat za adekvátní exenteraci, lze mluvit pouze o samplingu. Při samplingu – odstranění pouze zvětšených či podezřelých uzlin, se udává falešný axilární staging v 15–45 %. Disekce III. etáže lymfatických uzlin axily se v současné době neprovádí. Je-li provedena adekvátně disekce I. a II. axilární etáže, je chyba axilárního stagingu pouze ve 2–3 %. Frekvence skip metastáz ve III. etáži je 1,6 % [5, 7] (obr. 1, 2).
Komplikace
Výkon je technicky standardizován, ale přesto může přinášet v pooperačním období krátko i dlouhodobé obtíže a komplikace. Nejsvízelnější komplikací pooperačně je vznik lymfedému horní končetiny, který se vyvíjí až v 25 % případů. Lymfedém po biopsii sentinelové uzliny se naproti tomu vyskytuje v 1–2 % případů. Další pooperační komplikace představují poruchy hybnosti v ramenním kloubu a parestezie paže. Incidence ranné infekce u axilární disekce dosahuje 6–19 %, naopak u SNB pouze asi 1 %.
Kontroverze
V současné době existuje několik kontroverzních témat v problematice disekce axilárních uzlin. Jednou kontroverzí je, zda má smysl provádět axilární disekci u primárního tumoru o velikosti do 1 cm. Druhým problémem je přítomnost mikrometastáz v lymfatických axilárních uzlinách. Za mikrometastázu se považuje nádorová tkáň v lymfatické uzlině velikosti 0,2–2 mm. Starší studie neprokázali nepříznivý vliv mikrometastáz na prognózu pacientky vůči případům bez mikrometastáz. Novější studie ovšem ukazují na snížení intervalu bez nemoci a celkově nižší dobu přežití pacientek s mikrometastázami [10].
Biopsie sentinelové uzliny
Zmínky o strážných resp. sentinelových uzlinách se dají v literatuře najít již na začátku 20. let 20. století. Hlavní podíl na prosazení konceptu sentinelové uzliny do téměř dnešní podoby měl Morton a spol., kteří vypracovali metodiku peroperačního mapování lymfatik a umožnili její užití v prakticky jakékoli lokalizaci. Sentinelová uzlina je první spádová uzlina, která drénuje nádor. Průměrný počet sentinelových uzlin prezentovaný ve velkých souborech u karcinomu prsu je od 1 do 8 uzlin u jedné pacientky. Falešně negativní uzlina je hlavním rizikem a úskalím metody. Riziko falešně negativní uzliny se snižuje s počtem vyšetřených uzlin, po 2 vyšetřených uzlinách je riziko minimální. Sentinelové uzliny jsou vyšetřovány sériovými řezy po obarvení hemaxylinem-eozinem, a pokud je nález negativní, následuje ještě imunohistochemické vyšetření, které zvýší záchyt nádorových buněk o 10 %. Podle velikosti metastáz v uzlinách rozlišujeme makrometastázy (nad 2 mm), mikrometastázy (0,2–2 mm), submikrometastázy (ITC – izolované tumorózní komponenty).
Peroperační vyšetření sentinelových uzlin může identifikovat 80 % metastáz během operace. K vyšetření je možno užít otiskovou cytologii i tzv. frozen section. Biopsie sentinelové uzliny (SNB) se stala plnohodnotnou alternativou axilární disekce. Pozitivita sentinelové uzliny znamená indikaci k disekci axily a systémové adjuvantní terapii [10, 11] (obr. 3).
Obr. 3. Sentinelová uzlina zabarvená patentovou modří 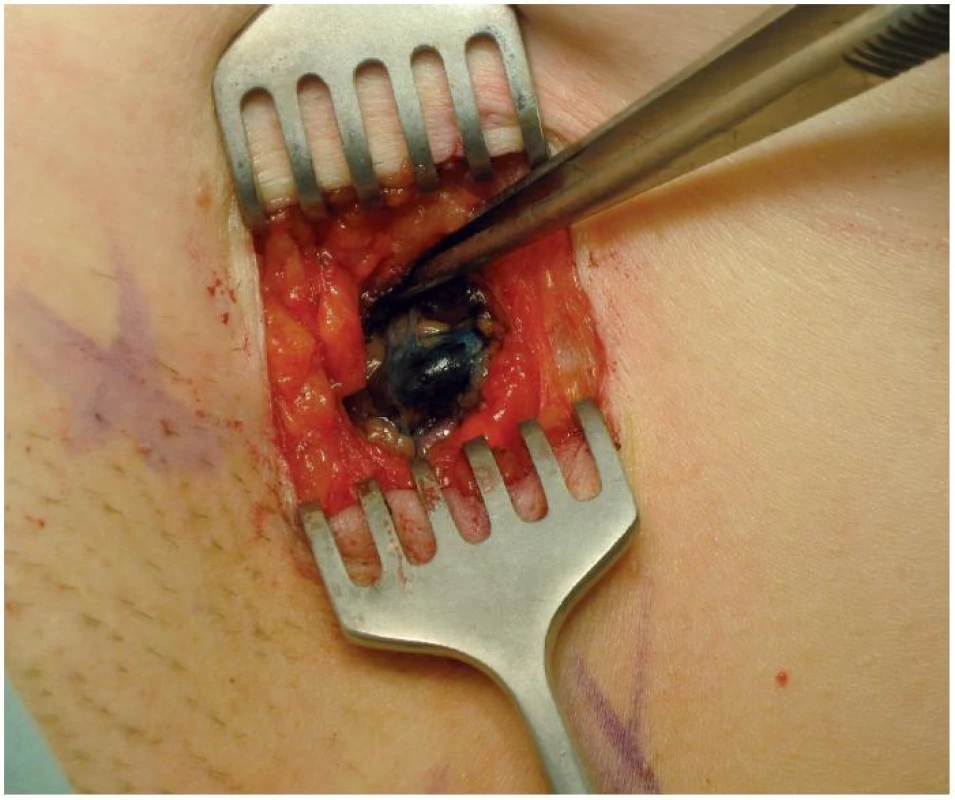
Podmínky provedení biopsie sentinelové uzliny
V současné době jsou indikací k provedení SNB verifikovaný invazivní karcinom a high grade intraduktální karcinomy prsu do velikosti 4 cm, s palpačně negativním a ultrasonograficky nesuspektním nálezem v příslušné axile a bez známek vzdálené diseminace. Podle nejnovějších studií se ukazuje, že velikost tumoru nebude limitujícím faktorem k provedení SNB. Teorie o tom, že tumory z různých částí prsu jsou drénovány do různých svodných lymfatických uzlin, se nepotvrdily a v současné době ani multicentricky se vyskytující tumor není kontraindikací provedení SNB. Ukazuje se, že ve většině případů je prakticky celý prs drénován do stejné sentinelové uzliny, bez ohledu na umístění tumoru v prsu. K identifikaci sentinelové uzliny se používá patentová modř a radiokoloid, standardem je využití obou metod zároveň. Byl prezentován velký počet studií zkoumajících optimální místo aplikace těchto látek do prsu. Studie prokázaly stejné výsledky po subdermální, intradermální a periareolární aplikaci radiokoloidu i barviva.
Kontroverze
Kontroverzní je stále užití konceptu SNB po neoadjuvantní chemoterapii, u profylaktické mastektomie a u DCIS. Užití SNB u DCIS je vedeno klinickou zkušeností, že v preparátech, ze kterých byl z biopsie získán nález DCIS, se nezřídka objeví při definitivním histologickém vyšetření preparátu i okrsky karcinomu. V současnosti podle posledních klinických studií se ukazuje, že falešná negativita SNB bez neoadjuvance a po neodjuvanci nepřesahuje 10 % [10, 11, 12]. Další kontroverzí je, jaký význam má nález mikrometastáz v SNB. Podle IBCSG Trial 23-01 ani po 4letém sledování pacientů s nálezem mikrometastáz v SNB, které byly klinicky negativní, nebyl zaznamenán statisticky významný rozdíl v procentu lokálních recidiv a uzlinových diseminací.
Rekonstrukční operace prsu
Rekonstrukce prsu po mastektomii je součástí chirurgické léčby karcinomu prsu. Rekonstrukční operace je možno rozdělit podle použitých materiálů na ty, které užívají implantáty (protézy, expandéry a permanentní expandovatelné implantáty) a na techniky používající autologní tkáně (abdominální muskulokutánní laloky – TRAM, gluteální laloky – GAP flap a laloky z oblasti musculus latissimus dorsi – LD flap). Laloky mohou být přeneseny a připojeny cévní anastomózou (volný lalok) nebo přeneseny na svalově cévním svazku [5, 7].
CÍLENÁ MOLEKULÁRNÍ TERAPIE „TARGETED THERAPY“
Vývoj biologické léčby je umožněn díky rozvoji molekulární patologie, která využívá znalosti molekulární genetiky a patologie buňky. Smyslem této terapie je cíleně vyhledat a zneškodnit nádorové buňky a ostatní zdravé buňky neovlivnit. Předpokladem zavedení cílené molekulární léčby bylo podrobné zmapování kaskády nitrobuněčného přenosu signálu, identifikace cílových struktur, identifikace všech možností terapeutické intervence. Základními nástroji cílené biologické léčby jsou monoklonální protilátky a nízkomolekulové jednozásahové nebo vícezásahové tyrozinkinázové inhibitory. Novým typem cílené léčbyje kombinace monoklonální protilátky s cytotoxickým chemoterapeutikem (antibody-drug conjugate) [13, 21, 23]. Důležitou terčovou strukturou cílené molekulární léčby je skupina receptorů pro epidermální růstové faktory (EGFR).
Monokolonální protilátky
Monoklonální protilátky jsou monospecifické, mají afinitu k jednomu stejnému antigenu. Všechny jsou stejné, neboť jsou produktem identické buňky imunitního systému (lymfocytu). Jednou z možností léčby karcinomu prsu je léčba monoklonálními protilátkami, které se vážou na antigeny specificky exprimované na povrch nádorových buněk a indukují imunologickou odpověď jen proti buňkám nádoru [13, 14]. Nádorové buňky exprimují množství různých růstových faktorů (pro monoklonální protilátky antigen). Nejlépe prostudovanou skupinou receptorů růstových faktorů jsou receptory pro epidermální růstový faktor, známe jich více než 20 druhů. Úlohou těchto receptorů je přenos informace, která přichází na povrch buňky, do intracelulárního prostředí, její přenos cytoplazmou až do jádra buňky. Tam dochází k indukci exprese určitých genů, které jsou zodpovědné za proliferaci, mitotickou aktivitu, tím tedy za přežívání a další život nádorové buňky. Intracelulární cesta není přímočará, ale může probíhat různými paralelními cestami, které se prolínají jak horizontálně, tak vertikálně. Její komplexní ovlivnění bude vyžadovat specifické kombinace různých látek ovlivňujících signální cesty na různých úrovních, aby výsledným efektem byla zástava proliferace nádorové buňky. Mezi nejčastěji zmiňované monoklonální protilátky v léčbě karcinomu prsu v současnosti patří [15, 16]:
- Bevacizumab (Avastin) – inhibitor VEGFR (vascular endothelial growth factor) receptoru, zodpovídajícího za neoangiogenezi. Existují dvě největší studie, které srovnávají prodloužení PFS (progression-free survival) u skupiny žen užívajících chemoterapii společně s Avastinem a skupinu žen užívající pouze chemoterapii samotnou u tumorů HER negativních (ICON7, GOG0218). Kombinovaná data ze studií ukázala, že Avastin neprodlužuje celkové přežití, zvyšuje toxicitu, a proto od prosince 2010 americká společnost FDA (Food and Drug Administration) stáhla lék z trhu pro užití z indikace léčby karcinomu prsu. U triple negativních vysoce vaskularizoaných tumorů ukazuje léčba metastatického onemocnění lehkou výhodu oproti samotné chemoterapii na hranici statistické významnost – studie III. fáze RIBBON 1, AVADO [30].
- Trastuzumab – firemní název Herceptin. Nachází významné uplatnění v léčbě karcinomu prsu, podrobněji viz níže.
- Pertuzumab – nový preparát, firemní název je Omnitag. Jde o protilátku proti extracelulární doméně HER2/neu, inhibitor dimerizace Her2/neu a HER3/neu receptoru, tím dochází ke zpomalení růstu tumoru. Ve studiích NeoSphere a CLEOPATRA prokázal zvýšení efektu v kombinaci s chemoterapií (docetaxelem) a herceptinem, se kterým má synergický účinek. Preparát bude brzy registrován pro léčbu metastatického karcinomu prsu. Na výsledky probíhajících studií TRYPHAENA a PHEREXA, které hodnotí adjuvantní podání preparátu u časných stadií, musíme ještě vyčkat [31].
- Neratinib – jde o perorální inhibitor HER 1 a 2. Stejně jako lipatinib je i neratinib duální inhibitor tyrozinkinázy, který blokuje efekt HER2 proteinu a ostatních bílkovin uvnitř buňky.
Herceptin – protilátka proti HER2 receptoru
Herceptin byl první schválenou monoklonální protilátkou v léčbě solidních nádorů vůbec.
HER2 receptor je rodiny EGFR. Skládá se z extracelulární vazebné domény, membránového segmentu a intracelulární domény, která je vazebným místem pro cytoplazmatický enzym – tyrozinkinázu (TK). TK je jedním z klíčovým enzymů nutných pro normální buněčný růst, diferenciaci, dělení buňky a její adhezivitu. Gen kódující HER2 receptor je v literatuře nazýván HER/2 nebo HER/neu či c-erb-2. HER2 gen je protoonkogen lokalizovaný na dlouhém raménku chromozomu 17. U nádorů prsu dochází asi ve 30 % případů k mutacím tohoto genu, což vede k amplifikaci a zvýšené expresi jeho nádorového proteinu, resp. receptoru [18]. Overexprese receptoru je asociována se zvýšenou rekurencí onemocnění, zvýšeným počtem infiltrovaných lymfatických uzlin a celkově špatnou prognózou choroby. Vzhledem k důležité prognostické roli je exprese HER2 zkoumána u každého karcinomu prsu. V klinické praxi je HER2 receptor důležitý jako cíl monoklonální protilátky trastuzumab (Herceptin) [13].Trastuzumab účinkuje efektivně pouze u nádorů prsu s FISH prokázanou overexpresí receptoru HER2, kde blokuje vstup buněk do S fáze a zastavuje buněčný cyklus v G0/G1 fázi.
U všech HER2 dependentních nádorů je používána adjuvantní léčba transtuzumabem do celkového trvání jednoho roku s event. započtením doby podávání v neoadjuvantní části systémové léčby. U metastatických tumorů se užívá trastuzumab až do prokázané progrese onemocnění [17, 18, 19, 20]. Neoadjuvantní biologická léčba trastuzumabem v kombinaci s chemoterapií u pacientek s karcinomem prsu a overexpresí HER2/neu je předmětem zájmu klinických studií [18] a prokazatelně významně zvyšuje downstaging a procento kompletních remisí při systémové neoadjuvantní léčbě.
Antibody-drug conjugate
Jsou to monoklonální protilátky, na které jsou navázány cytotoxické léky (chemoterapeutika). Využívají se v rámci ajduvantní terapie. Principem a výhodou tohoto spojení je, že cytotoxická substance je dotransportována cíleně monoklonální protilátkou na místo určení. Díky této cílené terapii se od těchto látek slibují menší nežádoucí účinky a rozšíření terapeutického okna. Příkladem těchto slibných látek jsou v léčbě karcinomu prsu glembatumumab vedotin (CDX-011) a trastuzumab-DM1 (na trastuzumab navázaná cytotoxická látka mertansin) [21, 22, 23].
Glembatumumab vedotin (CDX-011)
Je monokonální protilátka s navázanou antimitotickou látkou monomethyl auristatinem E, která se zkoumá u pokročilého nádoru prsu a melanomu. Je součástí klinických studií fáze I a II. Váže se cíleně na buňky, které na svém povrchu exprimují transmembránový glykoprotein NMB (GPNMB). Předběžné výsledky ukazují, že glembatumumab vendotin má účinek u obou zmíněných nádorů, u pacientů jejich tumor exprimuje ve zvýšené míře GPNMB, odpověď na léčbu je vyšší. V září 2010 začala IIb fáze klinické studie zkoumající účinek glembatumumab vendotinu u 120 pacientek s karcinomem prsu, které exprimují na povrchu buněk GPNMB včetně těch, jež jsou triple negativní.
Trastuzumab-DM1
Je spojením monoklonální protilátky trastuzumabu s imunokonjugátem cytostatikem maytansin – inhibitorem mikrotubulů DM1. V současné době je zkoušen v klinických studiích metastatického karcinomu prsu s HER2 pozitivními receptory po selhání Herceptinu. Data ze studií II. fáze slibují nižší toxicitu a vyšší účinnost, než standardní léčba I. linie docetaxel/Herceptin. Výsledky studie fáze III EMILIA jsou očekávány na ASCO 2012 [32].
Nízkomolekulové jednozásahové nebo vícezásahové tyrozinkinázové inhibitory
Lapatinib – Tyverb. Perorálně užívaný lék pro léčbu karcinomu prsu a dalších solidních tumorů.
Je to duální inhibitor tyrozinkinázy, který blokuje efekt HER2 proteinu a ostatních bílkovin uvnitř buňky. Zavádí se do léčby u pacientek s HER2 pozitivním karcinomem prsu, je předním lékem v terapii pacientek s triple negative karcinomem prsu a u pacientek, u nichž dojde k progresi během terapie s trastuzumabem (Herceptin) [24, 25].
PARP inhibitory. Jsou skupinou inhibitorů enzymu Poly ADP ribózapolymerázy (PARP). Jejich výzkum a vývoj je důležitý z mnoha lékařských indikací, ale mezi nejdůležitější patří užití v léčbě zhoubných nádorů. PARP1 je protein zodpovědný v buňce za opravu poškozeného řetězce DNA. PARP inhibitory tedy blokují v buňce enzymy, které jsou součástí mechanismu opravy poškozené DNA. PARP inhibitory představují součást cílené léčby, jejichž význam se studuje u triple negativního karcinomu prsu (nádorové buňky neobsahují receptory estrogenové, progesteronové, ani receptory proteinu Her2/neu [26, 27]. Příkladem ireverzibilního inhibitoru PARP 1 je Iniparib. Je to první PARP inhibitor ve III. fázi klinických studií. Slibné léčebné výsledky u triple negativních karcinomů prsu z roku 2009, kdy medián přežití byl prodloužen z 7,7 měsíce na 12,2 měsíce ovšem nebyly po rozkrytí výsledků III. fáze klinických studií potvrzeny. Další látkou ve II. fázi klinických studií je Olaparib. Na výsledky je nutno ještě počkat [28, 29].
U olaparibu je zatím průkazné, že perorální léčba preparátem je zatížena vysokou toxicitou, hlavně hematologickou (anémie, trombocytopenie, neutropenie). Lék je zkoušen i u ovariálního karcinomu u pacientem BRCA pozitivních [28, 29].
Everolimus (Afinitor) je v poslední době průlomovým lékem. Je to inhibitor mammalian target of ramapycin, ústředního proteinu kontrolujícího nádorový růst angigenezu. V kombinaci s inhibitorem aromatáz prokázal exceletní výsledky ve studiích RAD 001 a BOLERO 2 v léčbě metastatického hormonálně dependentního tumoru prsu [32].
Neratinib je ireverzibilní inhibitor receptoru pro epidermální růstový faktor (ErbB-1, ErbB-2 a ErbB-4), váže se na vnitřní doménu receptoru a inhibuje přenos signálu. V adjuvantní léčbě i v léčbě metastatické choroby prsu je zkoušen ve studiích II. fáze. Je dostupný ve formě tablet a jeho hlavní toxicitou jsou průjmy [33].
Sorafenib (Nexavar) je perorální inhibitor thyrozinkinázy s antiangiogenním efektem. V léčbě metastatického karcinomu prsu prokázal jen malé prodloužení PFS v délce šesti týdnů [34].
ZÁVĚR
Trend chirurgické léčby neinvazivního i invazivních karcinomů prsu představují prs záchovné a šetřící výkony s následnou adjuvantní terapií. Zavedení taxanů do režimů adjuvantní i neoadjuvantní léčby prodloužilo významně přežívání pacientek. Největším úspěchem adjuvantní léčby je ovšem zavedení transtuzumabu do léčebného protokolu u pacientek s overexpresí HER2. U pacientek s expresí hormonálních receptorů v tumoru jsou standardně podávány antiestrogeny a inhibitory aromatázy. Významné zlepšení přežívání ukazují kombinace chemoterapeutik s cílenou biologickou léčbou monoklonálními protilátkami.
Adresa pro korespondenci:
MUDr. Vít Weinberger
Gynekologicko-porodnická klinika
LF MU a FN
Obilní trh 11
625 00 Brno
e-mail: v.weinberger@email.cz
Zdroje
1. Webový portál – SVOD: epidemiologie zhoubných nádorů v České republice. http://www.svod.cz.
2. Pavlišta, D. Neinvazivní karcinomy prsu. Praha: Maxdorf, 2008.
3. Stankušová, H. Strategie moderní léčby karcinomu prsu. Moder Gynek Porod, 2004, 13, 3, s. 502–519.
4. Petráková, K., Růžičková, J., Fait, V. Léčební postupy u karcinomu prsu. Klin Okol, 2008, 21, 4, s. 131–140.
5. Fait, V., et al. Chirurgie karcinomu prsu v České republice. Klin Okol, 2009, 22, 6, s. 294–295.
6. Fait, V., Chrenko, V., Gatěk, J. Sentinelová biopsie u karcinomu prsu a neoadjuvantní chemoterapie. Klin Okol, 2005, 3, s. 77–79.
7. Strnad, P. Chirurgická léčba karcinomu prsu, Moder Gynek Porod, 2004, 13, 3, s. 520–527.
8. Halsted, WS. The result of radical operations for the cure of carcinoma of the breast. Ann Surg, 1907, 66.
9. Veronesi, U., et al. Breast conservation is a safe method in patients with small cancer of the breast. Long term-results of three randomized trials on 1993 patients. Eur J Cancer, 1995, 31A, p. 1574.
10. Fait, V., et al. Sentinelová biopsie a možnosti využití v současné onkochirurgii. Klin Okol, 2008, 21, 1, s. 5–19.
11. Pavlišta, D., Dudorkinova, D., Novotný, J. K problematice vyšetřeni sentinelovych lymfatickych uzlin u karcinomu prsu. Čes Gynek, 2005, 70, 3, s. 197–200.
12. Guliano, AE., et al. Sentinel lymphadenectomy in breast cancer.J Clin Oncol, 1997, 15, p. 2345.
13. Kubíčková K. Herceptin v léčbě karcinomu prsu. Moder Gynek Porod, 2004, 13, 3, p. 528–535.
14. Harris, M. Monoclonal antibodies as therapeutic agents for cancer. Lancet Oncol, 2004, 292.
15. „FDA begins process to remove breast cancer indication from Avastin label“ (Press release). FDA. 2010-12-16.
16. http://www.fda.gov/NewsEvents/Newsroom/PressAnnounce-ments/ucm237172.htm. Retrieved 2010-12-17.
17. Vogel, CL., et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. J Clin Oncol 2002, 20, p. 719.
18. Hudis, CA. Trastuzumab-mechanism of action and use in clinical practice. N Engl J Med, 2007, 357, 1, p. 39–51.
19. Romond, EH., Perez, EA., Bryant, J., et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med, 2005, 353, 16, p. 1673–1684.
20. Littlejohns, P. Trastuzumab for early breast cancer: evolution or revolution? Lancet Oncol, 2006, 7, 1, p. 22–23.
21. Kovtun, YV., Goldmacher, VS. Cell killing by antibody-drug conjugates. Cancer letters, 2007, 255, 2, p. 232–240.
22. Celldex Therapeutics Announces Initiation of Randomized Phase 2b Clinical Trial of CDX-011 In Advanced Breast Cancer. 22 Sept 2010. http://currentcancer.com/celldex-therapeutics-announces-initiation-of-randomized-phase-2b-clinical-trial-of-cdx-011-in-advanced-breast-cancer.html.
23. CuraGen Announces Expansion of CR011-vcMMAE Phase II Trial In Advanced Breast Cancer. 18 June 2009. http://www.medicalnewstoday.com/articles/154376.php.
24. Burris, HA. Dual kinase inhibition in the treatment of breast cancer: initial experience with the EGFR/ErbB-2 inhibitor lapatinib. Oncologist, 2004, 9. Suppl. 3, p. 10–15.
25. Nelson, MH., Dolder, CR. Lapatinib: a novel dual tyrosine kinase inhibitor with activity in solid tumors. Ann Pharmacother, 2006, 40, 2, p. 261–269.
26. http://www.parp-inhibitors.com/bsi201.html.
27. http://www.cancernetwork.com/display/article/10165/1514773 „Development of PARP Inhibitors: An Unfinished Story“ Jan 2010.
28. Olaparib, a PARP Inhibitor. Health and Life. http://healthlifeandstuff.com/2010/03/olaparib-a-parp-inhibitor.
29. Vasiliou, S., Castaner, R., Bolos, J. Olaparib. Drugs of the future, 2009, 34, 2, p. 101.
30. Lee, JB., Woo, OH., Park, KH., et al. Bevacizumab for salvage treatment of metastatic breast cancer: a systemic review and meta-analysis of randomized controlled trials. Invest New Drugs, 2009, 16.
31. Gelmon, KJ. Resultsof a Phase II trial oftrastuzumab (H) and pertuzumab (P) in patients (pts) with HER2-positive metastatic-breastcancer (MBC) who had progressedduringtrastuzumabtherapy. Proceedings from ASCO, 2008, Abs. TBC.
32. Baselga, JMD. Everolimus in Postmenopausal Hormone-Receptor–Positive Advanced Breast Cancer, December 7, 2011 (10.1056/NEJMoa1109653).
33. ClinicalTrials.gov NCT00398567 A Phase 1/2 Study Of HKI-272 In Combination With Herceptin In Subjects With Advanced Breast Cancer.
34. Wilhelm, SM., Axmane, L., Newell, P., et al. Preclinical overview of sorafenib, a multikinase inhibitor that targets both Raf and VEGF and PDGF receptor tyrosine kinase signaling. Molecular Cancer Therapeutics, 2008, 7, 10, p. 3129–3140.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek EditorialČlánek Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v BrněČlánek Obsahový rejstříkČlánek Rejstřík autorůČlánek Věcný rejstřík
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2012 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Editorial
- Úloha leptinu v lidské reprodukci (anorexie, bulimie)
- Dehiscencia laparotómie po hysterektómii – manažment hojenia rany
- Výskyt infekcie u novorodencov SAG pozitívnych matiek v závislosti na peripartálnej antibiotickej profylaxii a spôsobe pôrodu
- Možnosti ultrazvukové predikce placenta accreta v klinické praxi
- Nové technologie a perspektivy analýzymetabolomu embrya
- 3D MR-based brachyterapie v léčbě lokálně pokročilého karcinomu děložního hrdla – časné klinické výsledky
- Moderní chirurgická a biologická léčba karcinomu prsu
- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v Brně
- Follow-up po léčbě karcinomu ovaria –opravdu bez Ca 125?
- Srovnání vybraných parametrů oxidačního stresu ve folikulární tekutině u žen s poruchou plodnosti a u zdravých fertilních dárkyň oocytů
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
- Jak dál s naším porodnictvím?
- Bezpečnost domácích porodů a medicína založená na důkazech
- Domácí porody v České republice
-
Pracovní komise pro porodnictví MZ ČR
PROHLÁŠENÍ ODBORNÝCH SPOLEČNOSTÍ
(Péče o matku a dítě) - Část zápisu z jednání výboru ČGPS ČLS JEP
-
PETICE
dle čl. 18 Listiny základních práv a svobod a zákona č. 85/1990 Sb.o právu petičním - Štruktúrny základ transportnej funkcie vajíčkovodu
- Postižení vývoje dětí s nízkou porodní hmotnostíve 24 měsících korigovaného věku, narozených v České republice v letech 2000–2009
- Porody dětí velkých hmotností ve Fakultní nemocnici v Olomouci (1993–2010)
- Endovaskulární léčba krvácení v souvislostis porodem a těhotenstvím
-
Rychle progredující tumor dělohy
kazuistika - Doporučení k předpisu kombinované hormonální antikoncepce
- Vzpomínka na prim. MUDr. J. Šráčka
- Obsahový rejstřík
- Rejstřík autorů
- Věcný rejstřík
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Domácí porody v České republice
- Doporučení k předpisu kombinované hormonální antikoncepce
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání