-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Srovnání vybraných parametrů oxidačního stresu ve folikulární tekutině u žen s poruchou plodnosti a u zdravých fertilních dárkyň oocytů
Comparison of selective oxidative stress parameters in the follicular fluidof infertile women and healthy fertile oocyte donors
Objective:
Follicular fluid (FF) affects oocyte development and disruption of its homeostasis has a crucial effect on egg developmental potential. The aim of this study was to compare the levels of selected oxidative stress markers in the FF of women with impaired fertility and healthy fertile oocytes donors.Design:
A retrospective comparative study.Setting:
Faculty of Medicine in Pilsen, Charles University in Prague; Institute of Reproductive Medicine and Endocrinology, IVF Center Prof. Zech, Pilsen.Methods:
Levels of homocysteine (Hcy), malondialdehyde (MDA), glutathione peroxidase (GPx), total antioxidant capacity (AOK) and total protein (CB) were analyzed in the FF. We have analysed FF of 146 women – 74 infertile patients (mean age 31 years, SD = 4.65) and 72 healthy fertile oocyte donors (mean age 26 years, SD = 4.44). Only blood free samples were studied after pooling of all FF samples each patient.Results:
The study showed a statistically significantly higher Hcy levels (p < 0.0001) in the FF of healthy fertile women compared with impaired fertility group both – comparing the two groups regardless the age and in groups of the same age range (for the age group between 20 to 29 years isp = 0.0002, for the age group between 30 to 39 years is p < 0.0001). When divided into above age ranges we found statistically significantly higher levels of MDA in the control group aged 20 to 29 years compared to same age infertile patients (p = 0.0374) and statistically significantly higher AOK in infertile women between 30 to 39 years of age compared to same age control group (p = 0.0458).Conclusion:
The presence or on the contrary the absence of prooxidant parameters in the FF has an important role in the ability of conception and subsequent embryo development.Key words:
follicular fluid, homocysteine, oxidative stress, infertility, oocyte donor.
Autoři: V. Babuška 1; M. Čedíková 2,3; D. Rajdl 4; J. Racek 1,4; N. H. Zech 5; L. Trefil 1; A. Mocková 7; Z. Ulčová-Gallová 6; Z. Novotný 6; M. Králíčková 2,3,6
Působiště autorů: Ústav lékařské chemie a biochemie, LF UK, Plzeň, přednosta prof. MUDr. J. Racek, DrSc. 1; Ústav histologie a embryologie, LF UK, Plzeň, přednostka doc. MUDr. M. Králíčková, Ph. D. 2; Biomedicínské centrum, LF UK, Plzeň, vědecký ředitel doc. MUDr. M. Štengl, Ph. D. 3; Ústav klinické biochemie a hematologie, LF UK a FN, Plzeň, přednosta prof. MUDr. J. Racek, DrSc. 4; Institut reprodukční medicíny a endokrinologie, IVF Centra Prof. Zech, Plzeň, přednosta Univ. Doz. Dr. med. N. H. Zech 5; Gynekologicko-porodnická klinika, LF UK a FN, Plzeň, přednosta doc. MUDr. Z. Novotný, CSc. 6; Neonatologické oddělení, LF UK a FN, Plzeň, vedoucí doc. MUDr. J. Dort, Ph. D. 7
Vyšlo v časopise: Ceska Gynekol 2012; 77(6): 543-548
Souhrn
Cíl studie:
Vývoj oocytu je ovlivňován prostředím, zvláště folikulární tekutinou (FT). Narušení její homeostázy má zásadní vliv na vývojový potenciál vajíčka. Cílem této studie bylo srovnání hladin vybraných markerů oxidačního stresu ve FT žen s poruchou plodnosti a zdravých plodných dárkyň oocytů.Typ studie:
Retrospektivní komparativní studie.Název a sídlo pracoviště:
Lékařská fakulta v Plzni, Univerzita Karlova v Praze; Institut reprodukční medicíny a endokrinologie, IVF Centra Prof. Zech, Plzeň.Metodika:
Ve FT byly analyzovány hladiny homocysteinu (HCy), malondialdehydu (MDA), glutathionperoxidázy (GPx), celkové antioxidační kapacity (AOK) a celkové bílkoviny (CB). Celkem bylo vyšetřeno 146 žen – 74 pacientek léčených pro neplodnost (průměrný věk 31 let, SD = 4,65) a 72 zdravých plodných žen, dárkyň oocytů (průměrný věk 26 let, SD = 4,44). U každé ženy byly použity vzorky FT ze všech folikulů dohromady, tedy ve společném poolu. Ze studie byly vyloučeny vzorky, ve kterých se vyskytla příměs krve.Výsledky:
Studie prokázala statisticky signifikantně vyšší hladiny HCy (p < 0,0001) ve FT u zdravýchplodných žen oproti skupině s poruchou plodnosti, a to jak bez ohledu na věk, tak ve skupinách neplodných kontrol ve stejném věkovém rozmezí (u věkové skupiny mezi 20 až 29 lety jep = 0,0002, ve věku 30 až 39 let je p < 0,0001). Při rozdělení souborů do výše popsaných věkových pásem jsme prokázali statisticky signifikantně vyšší hladinu MDA u kontrolní skupiny ve věku 20 až 29 let oproti stejně starým ženám léčeným pro neplodnost (p = 0,0374) a statisticky signifikantně vyšší hodnotu AOK u neplodných žen mezi 30. až 39. rokem života oproti zdravým plodným dárkyním oocytů(p = 0,0458).Závěr:
Přítomnost, či naopak nepřítomnost prooxidačních parametrů ve FT má důležitou úlohuve schopnosti koncepce a následném vývoji embrya.Klíčová slova:
folikulární tekutina, homocystein, oxidační stres, neplodnost, dárkyně oocytů.ÚVOD
Folikulární tekutina (FT) zajišťuje charakteristické mikroprostředí pro vývoj oocytu. Biochemické složení FT hraje zásadní roli pro kvalitu oocytu, zvláště pro jeho schopnost fertilizace a následný vývoj embrya. FT ovlivňuje maturaci oocytu a viabilitu embrya svým hormonálním složením, interleukiny, ale i hladinou oxidačního stresu [5, 8, 12]. Bylo prokázáno [2], že pro zdárný vývoj by lidský folikul měl být v průběhu svého zrání dostatečně chráněn vůči kyslíkovým a dusíkovým radikálům, což znamená, že by volné radikály a antioxidanty měly být v rovnováze [1]. Je známo [30], že nezastupitelnou ochranitelskou roli plní např. buňky cumulus oophorus.
Oxidační stres je definován jako nárůst koncentrace reaktivních forem kyslíku a dusíku, kdy dojde k převaze těchto volných radikálů nad účinkem endogenních antioxidantů. Jejich patologický efekt vyplývá z poškozování lipidů v buněčné membráně, nukleových kyselin, proteinů a dalších buněčných materiálů [14]. In vivo se poškozujícímu efektu volných radikálů předchází nebo je efekt limitován pomocí endogenních antioxidantů, které se podle biologické funkce dělí na enzymové, jako je např. superoxiddismutáza (SOD), glutathionperoxidáza (GPx), glutathiontransferáza (GST) nebo kataláza (KAT), a nízkomolekulární, rozpustné ve vodě nebo v tucích, jako je kyselina askorbová, tokoferoly, karotenoidy, flavonoidy, glutathion, kyselina lipoová, koenzym Q, bilirubin a kyselina močová [16]. Na možnost, že by kyslíkové radikály mohly být spojovány s lidskou reprodukcí, bylo poprvé ukázáno před sedmdesáti lety [17]. Roli volných radikálů a antioxidantů ve vztahu k ženským reprodukčním funkcím je, na rozdíl od mužských, věnována malá pozornost, ačkoliv je prokázán jak fyziologický, tak patologický efekt [13].
S oxidačním stresem úzce souvisí hladina homocysteinu (HCy). Jeho vliv na homeostázu byl nejprve studován v souvislosti s kardiovaskulárním systémem, nyní je však známo jeho široké působení i mimo tento systém, např. na ženský reprodukční systém [11].
Zvýšená hladina HCy (hyperhomocysteinémie) působí škodlivě více směry. Volné radikály pocházející z oxidace HCy jsou toxické pro cévní endotel, narušuje se koagulační kaskáda a endotel, který má za normálních okolností převážně antitrombotické vlastnosti, se stává více tromboticky aktivní [27]. Dalším negativním vlivem Hcy na cévní endotel je snížení syntézy oxidu dusnatého (NO) a jeho biologická dostupnost. NO se podílí téměř na všech fázích ženské reprodukce, jako je ovulace, implantace embrya, regulace arteriálního tlaku nebo kontrakce dělohy. Důležité je, aby fyziologické koncentrace NO byly v úzkém pásmu, protože jak nadbytek, tak nedostatek vyvolávají nežádoucí účinky při reprodukci [18].
Hladina HCy koreluje s hladinou estrogenu [20], a mění se tedy nejen v závislosti na fázi menstruačního cyklu, ale i v průběhu těhotenství, kdy dochází k jejímu snížení [10, 15, 28].
Hyperhomocysteinémie je známým rizikovým faktorem těhotenských komplikací [29]. Při folikulogenezi může zvýšená hladina HCy aktivovat apoptózu vedoucí k folikulární atrézii [11]. Byla prokázána [9] negativní korelace mezi hladinou HCy ve FT a stupněm zralosti získaných oocytů a kvalitou embrya ve třetím dni in vitro kultivace. Naopak pozitivní korelace byla popsána mezi hladinou folikulárního HCy a průměrem folikulu [6]. Hyperhomocysteinémie ovlivňuje výsledek in vitro fertilizace – u žen se zvýšenou hladinou HCy byla prokázána nižší úspěšnost v dosažení těhotenství [25].
SOUBOR ŽEN A METODIKA
Studovaný soubor tvořilo 146 žen, z toho bylo 74 pacientek (průměrný věk 31 let, SD = 4,65) léčených pro neplodnost v Institutu reprodukční medicíny a endokrinologie – IVF Center Prof. Zech. Kontrolní skupinu tvořilo 72 zdravých plodných žen, dárkyň oocytů (průměrný věk byl 26 let, SD = 4,44). V našem souboru pacientek bylo 13 žen, které kouřily 2–10 cigaret za den, ostatní byly nekuřačky. Podobně v souboru plodných dárkyň bylo 26 žen, které kouřily 5–15 cigaret za den, ostatní byly nekuřačky. Po detailním seznámení s problematikou a po podpisu informovaného souhlasu byla ženám odebírána FT v době odběru oocytů v průběhu jejich léčby neplodnosti metodami asistované reprodukce. Vyšetřovány byly pooly FT, tedy směs ze všech folikulů, u nichž nedošlo ke kontaminaci krví v průběhu odběru oocytů. Ve FT byly stanoveny hladiny homocysteinu, glutathionperoxidázy, malondialdehydu, celkové antioxidační kapacity a celkové bílkoviny.
Hladina HCy byla stanovena enzymaticky kitem Liquid Stable (LS) 2-Part Homocysteine Reagent (Axis-Shield Diagnostics Ltd., UK) na přístroji Olympus AU400. Vázaný HCy nebo ve formě dimeru (oxidovaná forma) se redukuje na volný HCy prostřednictvím tris(2-karboxyethyl)fosfinu (TCEP). Takto vzniklý volný HCy poté reaguje se serinem za katalýzy cystathionin beta-syntázou (CBS) za vzniku cystathioninu. Cystathionin je postupně rozkládán na HCy cystathionin betalyázou (CBL), kdy při tomto procesu vzniká i pyruvát a amoniak. Pyruvát se poté konvertuje pomocí laktát-dehydrogenázy (LDH) na laktát s nikotinamid adenin dinukleotidem (NADH) jakožto koenzymem. Rychlost konverze NADH na NAD+ je sledována spektrofotometricky při 340 nm a je přímo úměrná koncentraci HCy.
Malondialdehyd (MDA) a jiné degradační produkty peroxidace lipidů reagují s dvěma molekulami kyseliny thiobarbiturové (TBA) v kyselém prostředí na barevný produkt, který se po extrakci n-butanolem měří při 532 nm použitím Elisa-readeru. MDA se stanovuje jako součást sloučenin reagujících s thiobarbiturovou kyselinou, tzv. TBARS (ThioBarbituric Acid Reactive Substances). Glutathionperoxidáza (GPx) katalyzuje oxidaci glutathionu kumen hydroperoxidem. V přítomnosti glutathionreduktázy a NADPH se oxidovaný glutathion ihned redukuje, přičemž NADPH se oxiduje na NADP. Pokles absorbance se stanovuje na analyzáoru OLYMPUS AU 400 optickým testem při 340nm. GPx byla stanovena kitem RANSEL (Randox Laboratories Ltd., UK). Celková antioxidační kapacita (AOK) je definována jako schopnost vzorku zhášet volné radikály. Její stanovení je založeno na vlastnostech sloučeniny ABTS (2,2‘-azino-bis(3-ethylbenzothiazoline-6-sulfonová) kyselina), která po inkubaci s peroxidázou a peroxidem vodíku tvoří radikál ABTS+. Ten je relativně stabilní a je možné ho měřit spektrofotometricky při 600 nm. Antioxidanty FT potlačují vznik tohoto radikálu. AOK je vyjadřována jako ekvivalent standardu Troloxu (6-hydroxy-2,5,7,8-tetramethylchroman-2-karboxylová kyselina), což je syntetický analog vitaminu E. Měření bylo prováděno na analyzátoru Olympus AU 400. AOK byla stanovena kitem TAS (Randox Laboratories Ltd., UK). Celková bílkovina (CB) a peptidy poskytují s biuretovým činidlem fialový komplex vhodný k fotometrickému stanovení. Absorbance byla stanovena při 546 nm na analyzátoru Olympus AU 2700 soupravou TP 300 (Lachema, CZ).
Tato studie byla schválena etickou komisí Lékařské fakulty UK v Plzni.
Statistické hodnocení
Výsledky byly statisticky hodnoceny pomocí Wilcoxonova neparametrického testu (nepárová varianta) a dále analýzou rozptylu (ANOVA, post hoc analýza pomocí Tukeyovy metody mnohonásobného porovnávání). Hodnoty p < 0,05 byly považovány za statisticky signifikantní.
VÝSLEDKY
Hladiny HCy, MDA, GPx, AOK a CB jsme porovnali ve skupinách žen léčených pro neplodnost a kontrolních plodných dárkyň oocytů. Z tabulky 1 a obrázku 1 je zřejmé, že u kontrolní skupiny žen byla naměřena signifikantně vyšší hladina homocysteinu (p < 0,0001). Tuto vyšší hodnotu jsme prokázali i při rozdělení pacientek a kontrol do jednotlivých věkových skupin – u věkové skupiny mezi 20 až 29 lety je p = 0,0002 a ve věku 30 až 39 let p < 0,0001.
Tab. 1. Hladiny HCy, MDA, GPx, AOK a CB ve folikulární tekutině neplodných žen a kontrolní skupiny zdravých dárkyň oocytů (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 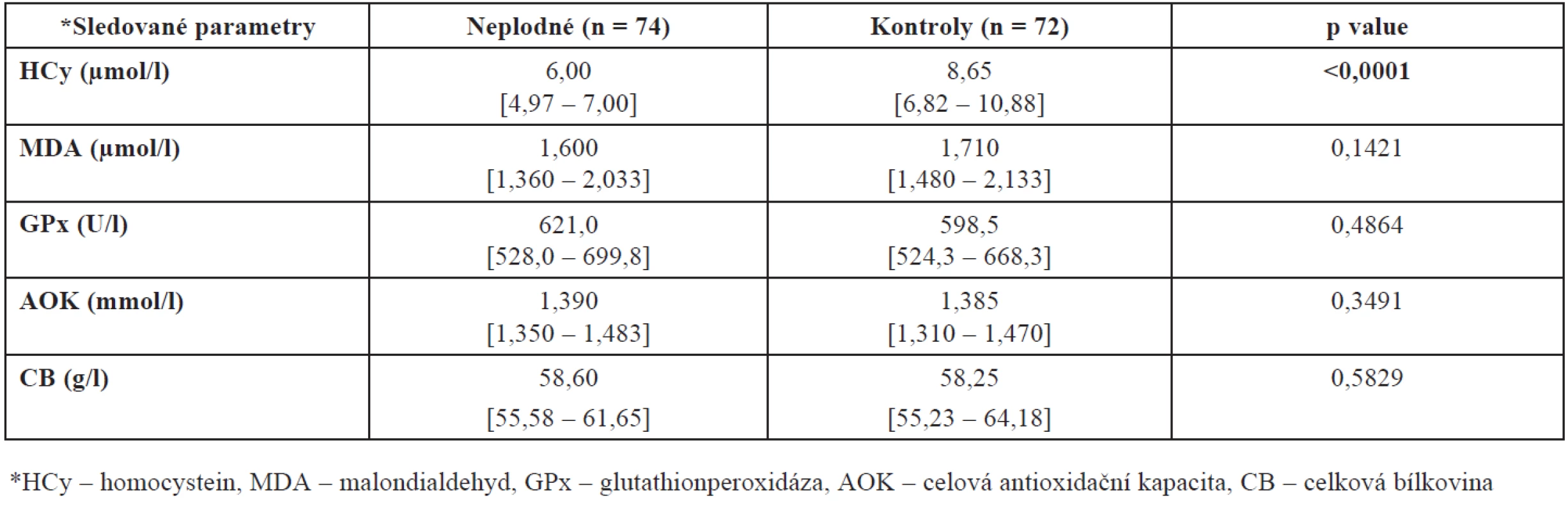
Obr. 1. Porovnání koncentrací HCy ve folikulární tekutině neplodných žen a kontrolní skupiny zdravých dárkyň oocytů 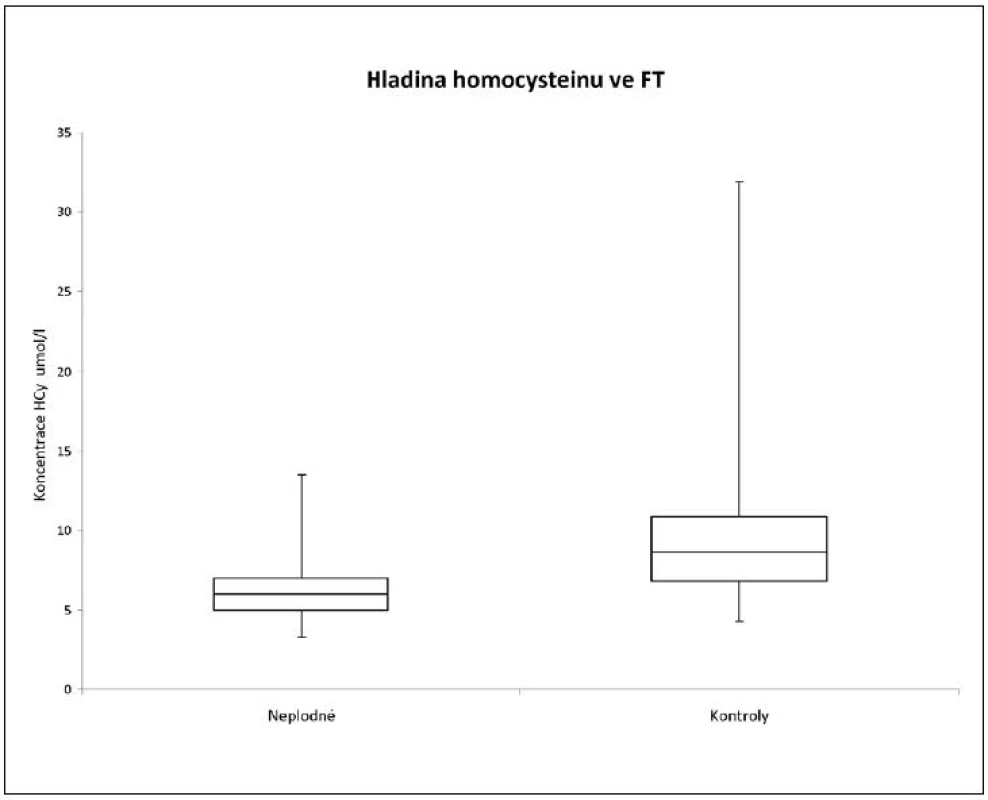
Při tomto rozdělení našeho souboru jsme prokázali rovněž vyšší hladinu MDA u kontrolní skupiny ve věku 20 až 29 let (p = 0,0374) oproti neplodným ženám stejného věku a AOK u neplodných žen mezi 30. až 39. rokem života (p = 0,0458) oproti věkově stejné skupině zdravých plodných dárkyň. Úplný přehled mediánů naměřených hodnot společně se statistickou významností a interkvartilovým rozpětím shrnuje tabulka 2.
Tab. 2. Hladiny HCy, MDA, GPx, AOK a CB ve folikulární tekutině neplodných žen a kontrolní skupiny zdravých dárkyň oocytů v závislosti na věku (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 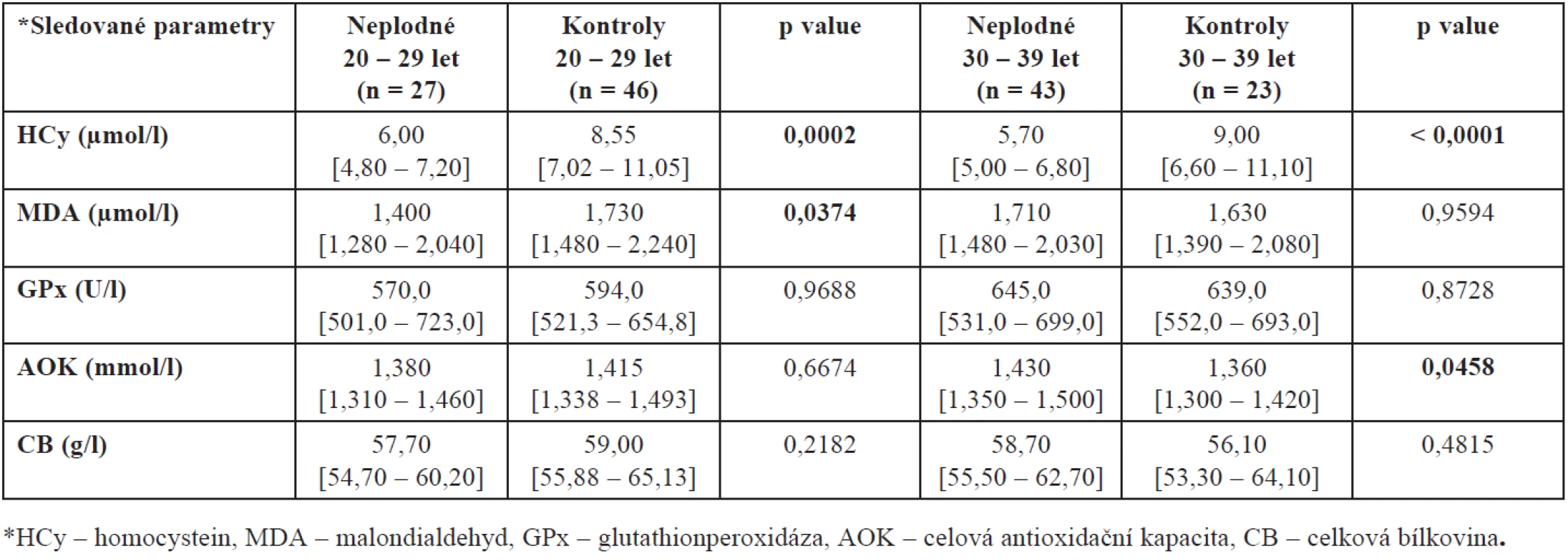
Protože plodnost žen je silně ovlivněna věkem a protože naše skupiny plodných a neplodných se liší věkovým složením, porovnali jsme ještě také hladiny mezi plodnými a neplodnými ženami stejné věkové skupiny – výsledky jsou shrnuty v tabulkách 3 a 4. Prokázali jsme zde statisticky významný rozdíl v hodnotách AOK u kontrolní skupiny zdravých dárkyň. Jak vyplývá z tabulky 4, nejvyšší hladina AOK je u žen mezi 20. až 29. rokem, u žen mladších a starších se tato hladina významně snižuje (p = 0,0450).
Tab. 3. Hladiny HCy, MDA, GPx, AOK a CB ve folikulární tekutině neplodných žen v závislosti na věku (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 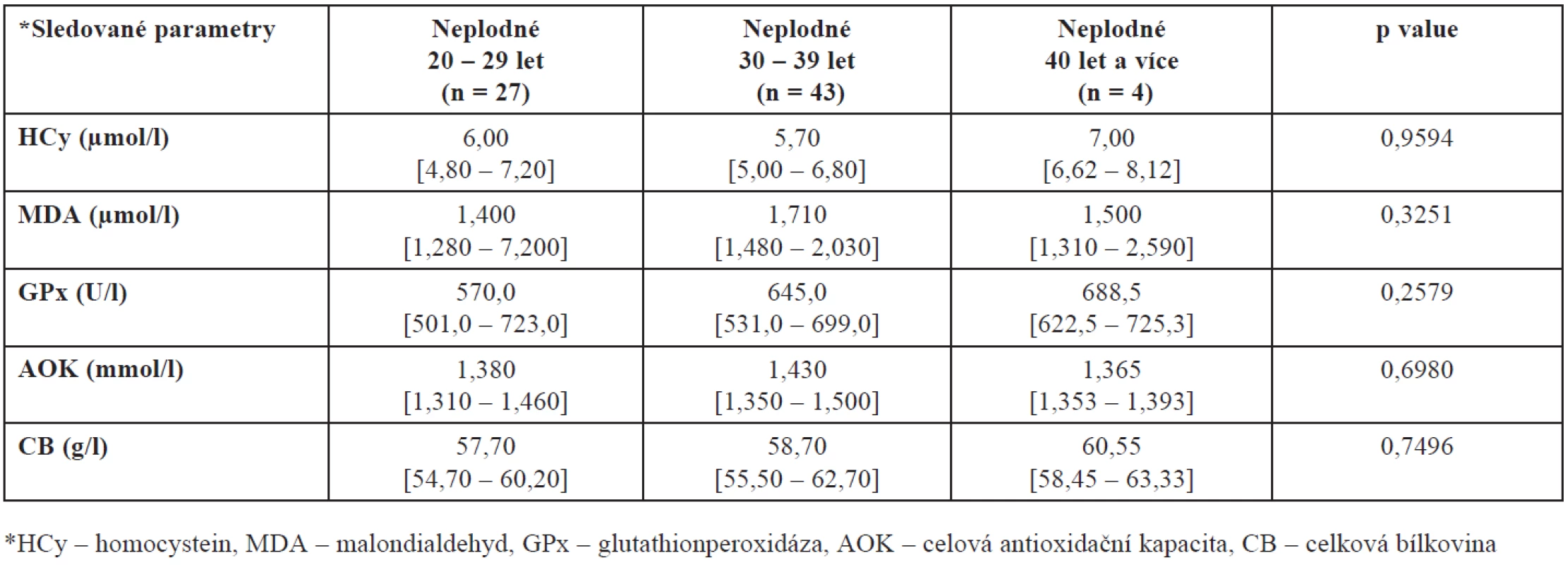
Tab. 4. Hladiny HCy, MDA, GPx, AOK a CB ve folikulární tekutině kontrolní skupiny zdravých dárkyň oocytů v závislosti na věku (hodnoty jsou uvedeny jako medián a interkvartilové rozpětí) 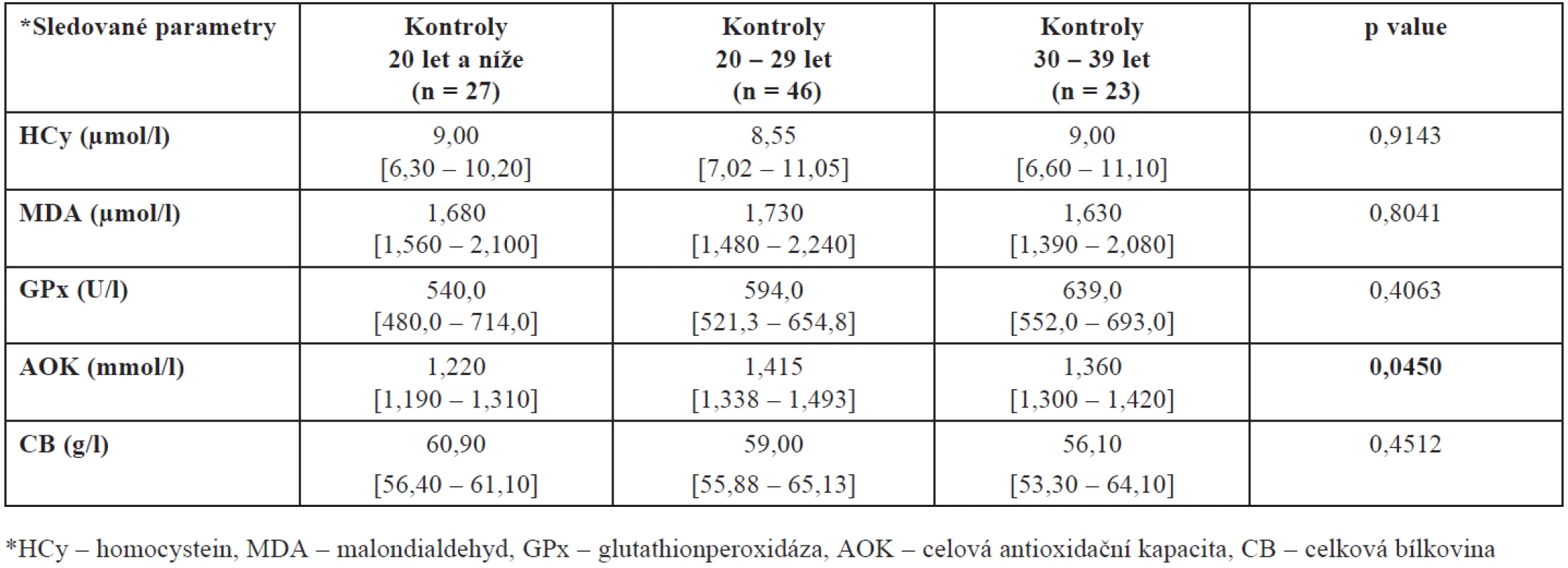
DISKUSE
U zdravých žen je lidský folikul během svého zrání dostatečně chráněn proti toxickému poškození v důsledku oxidačního stresu [2]. Stoupající aktivita kyslíkových radikálů může být jedním z důvodů neplodnosti i poklesu úspěšnosti IVF u žen se vzrůstajícím věkem, kdy dochází k progresivnímu poklesu kvality a kvantity oocytů [7, 31]. Toto vše může být ještě umocněno životosprávou ženy a jejím aktivním nikotinismem [26]. Na hladinu HCy má velký vliv plazmatická koncentrace folátu (kyselina listová – vitamin B9), který po své modifikaci na tetrahydrofolát působí jako kofaktor enzymu methylentetrahydrofolát reduktázy (MTHFR) v remetylační cestě přeměny HCy na aminokyselinu methionin. Nikotin a pravděpodobně i sekundární kouř mají vliv na hladinu folátu, jehož nízká koncentrace je spojena právě s hyperhomocysteinémií. Kuřáci mají také tendenci k menší konzumaci na folát bohatého ovoce a zeleniny. Je však třeba poznamenat, že vztah mezi kouřením a hladinou folátu není jednoznačný a některé studie prokazují jejich nezávislost [22]. Tento fakt je jistě závislý také na intenzitě kouření. V naší studii jsme prokázali, že neexistuje signifikantní spojitost mezi neplodnými ženami kuřačkami a nekuřačkami ani zdravými dárkyněmi oocytů kuřačkami a nekuřačkami v žádném sledovaném parametru.
Foláty snižují hladinu HCy jak v krvi, tak ve folikulární tekutině [11], což významně koreluje jak s kvalitou oocytu, tak s vývojovým potenciálem embrya [5, 21]. I když stále probíhá diskuse [3, 23, 24] o spojitosti mezi AOK FT a etiologií infertility, je jisté, že vliv volných radikálů je zapojen do patofyziologických mechanismů mnoha chorob souvisejících s neplodností, kde je zapotřebí léčby IVF. Pacientky s endometriózou mají ve srovnání s pacientkami s jinými diagnózami statisticky signifikantně zvýšené hladiny HCy [9].
Protože hladiny HCy jsou ovlivňovány ovariální hyperstimulací [4, 6] a protože schopnost metylace souvisí s riziky metod asistované reprodukce [19], je další výzkum v této oblasti se zapojením zkoumání zdravých plodných dárkyň přínosem.
ZÁVĚR
Naše studie potvrzuje roli HCy a dalších parametrů oxidačního stresu v ženské reprodukci. Přítomnost či naopak nepřítomnost prooxidačních vlivů ve FT má důležitou úlohu ve schopnosti koncepce a následném vývoji embrya.
Tato studie je podporována projektem OP VaVpI PO 2Biomedicínské centrum CZ.1.05/2.1.00/03.0076, grantem GA UK 696212 a projekty specifického vysokoškolského výzkumu (SVV 264 808 a 264 804).
Adresa pro korespondenci:
Ing. Václav Babuška, Ph.D.
Ústav lékařské chemie a biochemie
LF UK Plzeň
Karlovarská 48
301 66 Plzeň
e-mail: vaclav.babuska@lfp.cuni.cz
Zdroje
1. Agarwal, A., Gupta, S., Sharma, RK. Role of oxidative stress in female reproduction. Reprod Biol Endocrinol, 2005, 14, 3, p. 28.
2. Angelucci, S., Ciavardelli, D., Di Giuseppe, F., et al. Proteome analysis of human follicular fluid. Biochim Biophys Acta, 2006, 1764, 11, p. 1775–1785.
3. Appasamy, M., Jauniaux, E., Serhal, P., et al. Evaluation of the relationship between follicular fluid oxidative stress, ovarian hormones, and response to gonadotropin stimulation. Fertil Steril, 2008, 89, 4, p. 912–921.
4. Benkhalifa, M., Montjean, D., Cohen-Bacrie, P., Ménézo, Y. Imprinting: RNA expression for homocysteine recycling in the human oocyte. Fertil Steril, 2010, 15, 93, 5, p. 1585–1590.
5. Boxmeer, JC., Macklon, NS., Lindemans, J., et al. IVF outcomes are associated with biomarkers of the homocysteine pathway in monofollicular fluid. Hum Reprod, 2009, 24, 5, p. 1059–1066.
6. Boxmeer, JC., Steegers-Theunissen, RP., Lindemans, J., et al. Homocysteine metabolism in the pre-ovulatory follicle during ovarian stimulation. Hum Reprod, 2008, 23, 11, p. 2570–2576.
7. Broekmans, FJ., Kwee, J., Hendriks, DJ., et al. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum Reprod Update, 2006, 12, 6, p. 685–718.
8. Das, S., Chattopadhyay, R., Ghosh, S., et al. Reactive oxygen species level in follicular fluid – embryo quality marker in IVF? Hum Reprod, 2006, 21, p. 2403–2407.
9. Ebisch, IM., Peters, WH., Thomas, CM., et al. Homocysteine, glutathione and related thiols affect fertility parameters in the (sub)fertile couple. Hum Reprod, 2006, 21, 7, p. 1725–1733.
10. Eskes, TK. Clotting disorders and placental abruption: homocysteine – a new risk factor. Eur J Obstet Gynecol Reprod Biol, 2001, 95, 2, p. 206–212.
11. Forges, T., Monnier-Barbarino, P., Alberto, JM., et al. Impact of folate and homocysteine metabolism on human reproductive health. Hum Reprod Update, 2007, 13, 3, p. 225–238.
12. Fortune, JE. Ovarian follicular growth and development in mammals. Biol Reprod, 1994, 50, 2, p. 225–232.
13. Guérin, P., El Mouatassim, S., Ménézo, Y. Oxidative stress and protection against reactive oxygen species in the pre-implantation embryo and its surroundings. Hum Reprod Update, 2001, 7, 2, p. 175–189.
14. Halliwell, B., Gutteridge, JMC. Free radicals in biology and medicíně. 2nd ed. Oxford: Clarendon Press, 1989.
15. Holmes, VA., Wallace, JM., Alexander, HD., et al. Homocysteine is lower in the third trimester of pregnancy in women with enhanced folate status from continued folic acid supplementation. Clin Chem, 2005, 51, 3, p. 629–634.
16. Knapen, MF., Zusterzeel, PL., Peters, WH., Steegers, EA. Glutathione and glutathione-related enzymes in reproduction. A review. Eur J Obstet Gynecol Reprod Biol, 1999, 82, 2, p. 171–184.
17. MacLeod, J. The role of oxygen in the metabolism and motility of human spermatozoa. Am J Physiol, 1943, 138, p. 512–518.
18. Maul, H., Longo, M., Saade, GR., et al. Nitric oxide and its role during pregnancy: from ovulation to delivery. Curr Pharm Des, 2003, 9, p. 359–380.
19. Menezo, Y., Elder, K., Benkhalifa, M., Dale, B. DNA methylation and gene expression in IVF. Reprod Biomed Online, 2010, 20, 6, p. 709–710.
20. Mijatovic, V., van der Mooren, MJ. Homocysteine in postmenopausal women and the importance of hormone replacement therapy. Clin Chem Lab Med, 2001, 39, 8, p. 764–767.
21. Ocal, P., Ersoylu, B., Cepni, I., et al. The association between homocysteine in the follicular fluid with embryo quality and pregnancy rate in assisted reproductive techniques. J Assist Reprod Genet, 2012, 29, 4, p. 299–304.
22. Okumura, K., Tsukamoto, H. Folate in smokers. Clin Chim Acta, 2011, 412, p. 521–526.
23. Oyawoye, OA., Abdel-Gadir, A., Garner, A., et al. The interaction between follicular fluid total antioxidant capacity, infertility and early reproductive outcomes during in vitro fertilization. Redox Rep, 2009, 14, 5, p. 205–213.
24. Ozkaya, MO., Nazıroğlu, M. Multivitamin and mineral supplementation modulates oxidative stress and antioxidant vitamin levels in serum and follicular fluid of women undergoing in vitro fertilization. Fertil Steril, 2010, 94, 6, p. 2465–2466.
25. Pacchiarotti, A., Mohamed, MA., Micara G., et al. The possible role of hyperhomocysteinemia on IVF outcome. J Assist Reprod Genet, 2007, 24, 10, p. 459–462.
26. Paszkowski, T., Clarke, RN., Hornstein, MD. Smoking induces oxidative stress inside the Graafian follicle. Hum Reprod, 2002, 17, 4, p. 921–925.
27. Raijmakers, MT., Steegers, EA., Peters, WH. Glutathione S-transferases and thiol concentrations in embryonic and early fetal tissues. Hum Reprod, 2001, 16, p. 2445–2450.
28. Tallova, J., Tomandl, J., Bicikova, M., Hill, M. Changes of plasma total homocysteine levels during the menstrual cycle. Eur J Clin Invest, 1999, 29, 12, p. 1041–1044.
29. Tamura, T., Picciano, MF. Folate and human reproduction. Am J Clin Nutr, 2006, 83, 5, p. 993–1016.
30. Tatemoto, H., Sakurai, N., Muto, N. Protection of porcine oocytes against apoptotic cell death caused by oxidative stress during In vitro maturation: role of cumulus cells. Biol Reprod, 2000, 63, 3, p. 805–810.
31. Wiener-Megnazi, Z., Vardi, L., Lissak, A., et al. Oxidative stress indices in follicular fluid as measured by the thermochemiluminescence assay correlate with outcome parameters in in vitro fertilization. Fertil Steril, 2004, 82, Suppl 3, p. 1171–1176.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek EditorialČlánek Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v BrněČlánek Obsahový rejstříkČlánek Rejstřík autorůČlánek Věcný rejstřík
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2012 Číslo 6- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Editorial
- Úloha leptinu v lidské reprodukci (anorexie, bulimie)
- Dehiscencia laparotómie po hysterektómii – manažment hojenia rany
- Výskyt infekcie u novorodencov SAG pozitívnych matiek v závislosti na peripartálnej antibiotickej profylaxii a spôsobe pôrodu
- Možnosti ultrazvukové predikce placenta accreta v klinické praxi
- Nové technologie a perspektivy analýzymetabolomu embrya
- 3D MR-based brachyterapie v léčbě lokálně pokročilého karcinomu děložního hrdla – časné klinické výsledky
- Moderní chirurgická a biologická léčba karcinomu prsu
- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Subjektivní hodnocení vlastního zdraví a jeho souvislosti. Populační studie gravidních žen v Brně
- Follow-up po léčbě karcinomu ovaria –opravdu bez Ca 125?
- Srovnání vybraných parametrů oxidačního stresu ve folikulární tekutině u žen s poruchou plodnosti a u zdravých fertilních dárkyň oocytů
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
- Jak dál s naším porodnictvím?
- Bezpečnost domácích porodů a medicína založená na důkazech
- Domácí porody v České republice
-
Pracovní komise pro porodnictví MZ ČR
PROHLÁŠENÍ ODBORNÝCH SPOLEČNOSTÍ
(Péče o matku a dítě) - Část zápisu z jednání výboru ČGPS ČLS JEP
-
PETICE
dle čl. 18 Listiny základních práv a svobod a zákona č. 85/1990 Sb.o právu petičním - Štruktúrny základ transportnej funkcie vajíčkovodu
- Postižení vývoje dětí s nízkou porodní hmotnostíve 24 měsících korigovaného věku, narozených v České republice v letech 2000–2009
- Porody dětí velkých hmotností ve Fakultní nemocnici v Olomouci (1993–2010)
- Endovaskulární léčba krvácení v souvislostis porodem a těhotenstvím
-
Rychle progredující tumor dělohy
kazuistika - Doporučení k předpisu kombinované hormonální antikoncepce
- Vzpomínka na prim. MUDr. J. Šráčka
- Obsahový rejstřík
- Rejstřík autorů
- Věcný rejstřík
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Monochoriální biamniální gemini se společným žloutkovým váčkem při UZ vyšetření v I. trimestru –je zde zvýšené riziko vrozené vývojové vady?
- Domácí porody v České republice
- Doporučení k předpisu kombinované hormonální antikoncepce
- Konzervativní postup v léčbě placenta accreta – dvě kazuistiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



