-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vybrané markery v skorej predikcii preeklampsie
Selected markers in early prediction of preeclampsia
Objective:
Review of actual trends in early prediction of preeclampsia.Subject:
Literature review.Setting:
Department of Gynecology and Obstetrics, Jessenius Faculty of Medicine, Comenius University, Martin, Slovak Republic.Subject and method:
Literature review of markers used in early prediction of preeclampsia. Review of their reliability and possible advantage of combination.Conclusion:
Preeclampsia is a major cause of maternal and perinatal morbidity and mortality worldwide. Onset of clinic symptomes of preeclampsia can appear after 20 weeks of gestation. To find a single marker, or their combination, in early prediction of preeclampsia is one of the goals of modern perinatology. We look at some of the potential markers, which can fulfil these criteria.Key words:
preeclampsia, biochemical screening, doppler ultrasonography, PP 13, angiogenesis.
Autoři: M. Haško; K. Biringer; K. Biskupská Boďová; J. Danko
Působiště autorů: Gynekologicko-pôrodnícka klinika JLF UK a UNM, Martin, prednosta prof. MUDr. J. Danko, CSc.
Vyšlo v časopise: Ceska Gynekol 2011; 76(2): 135-139
Souhrn
Ciel štúdie:
Informačný prehľad o súčasných možnostiach skorej predikcie preeklampsie a ich spoľahlivosti.Typ štúdie:
Literárny prehľad.Názov a sídlo pracoviska:
Gynekologicko-pôrodnícka klinika, Jesseniova lekárska fakulta, Univerzita Komenského, Martin, Slovenská republika.Predmet a metóda štúdie:
Literárny prehľad o jednotlivých markeroch používaných v skorej predikcii preeklampsie, o ich spoľahlivosti a možnom prínose ich kombinácií.Záver:
Preeklampsia je hlavnou príčinou maternálnej a perinatálnej morbidity a mortality v celosvetovom meradle. Klinické prejavy preeklampsie sa objavujú po 20. týždni tehotenstva. Jednou z úloh modernej perinatológie je stanoviť marker, prípadne kombináciu markerov, umožňujúcu predikciu preeklampsie v dostatočnom predstihu pred objavením sa symptómov. V tomto prehľade sa venujeme niekoľkým z potenciálnych markerov, ktoré by mohli spĺňať tieto kritériá.Kľúčové slová:
preeklampsia, biochemický skríning, dopplerovská sonografia, PP13, angiogenéza.ÚVOD
Preeklampsia (PEE) je multisystémové ochorenie špecifické pre ľudskú tehotnosť. Toto ochorenie, postihujúce podľa údajov rôznych autorov 3-7 % tehotných žien v ekonomicky rozvinutých krajinách, je hlavnou príčinou maternálnej a perinatálnej morbidity a mortality [28]. Komplikuje približne 10 % prvých tehotenstiev a u žien trpiacich chronickou hypertenziou sa vyskytuje v 20-25 %. PEE je definovaná ako hypertenzia (systolický tlak krvi >140 mm Hg, diastolický >90 mm Hg) s proteinúriou (>300 mg/24 h) vzniknutá po 20. týždni tehotenstva (t.t.) [1]. Mechanizmus patogenézy PEE nie je dodnes úplne objasnený. Hlavnú úlohu zrejme zohráva nesprávna placentácia so sekundárne sťaženou výmenou krvných plynov a metabolických substrátov [4, 21]. V závislosti od gestačného týždňa v čase nástupu ochorenia sa PEE delí na skorú a neskorú formu, kde medzník predstavuje 34. t.t. PEE so skorým nástupom (<34. t.t.) je charakterizovaná uteroplacentárnou vaskulárnou insuficienciou a poškodením vilózneho systému placenty. Táto forma PEE sa vyznačuje ťažším priebehom s vyšším výskytom multisystémového postihnutia organizmu matky a nutnosťou pôrodu nezrelých plodov, ohrozených vysokou perinatálnou morbiditou a mortalitou. Pacientky so skorým nástupom ochorenia majú väčšiu pravdepodobnosť nálezu patologicky zmenených cirkulačných parametrov pri dopplerovskom sonografickom vyšetrení umbilikálnej artérie a uterinných artérií plodu [11, 13, 21].
Na včasnú diagnostiku PEE sa v posledných desaťročiach používajú viaceré klinické, laboratórne a sonografické testy s rôznou validitou. Ideálny skríningový test, ktorý by bol dostatočne presný, bezpečný a neinvazívny však zatiaľ neexistuje [31].
BIOCHEMICKÉ MARKERY V SKRÍNINGU PREEKLAMPSIE
Pri PEE je narušená invázia cytotrofoblastu do špirálovitých artérií myometria. Vplyv ich nedostatočnej prestavby na plod sa stáva zreteľným s pokračujúcim tehotenstvom, keďže prietok maternálnej krvi k placente nedokáže zabezpečiť dostatok živín pre vývin plodu. Výsledkom abnormálnej cytotrofoblastovej invázie je rozvoj placentárnej ischémie. Táto spôsobí zvýšené uvoľňovanie placentárnych faktorov do cirkulácie matky a nerovnováhu faktorov angiogenézy. Výsledkom je rozvoj endotelovej dysfunkcie charakterizujúci PEE. Veda sa intenzívne venuje hľadaniu markerov, ktoré by dokázali PEE predpovedať s veľkou presnosťou a dostatočne včas pred objavením sa klinických príznakov [4, 14].
Placentárny proteín 13
Placentárny proteín 13 (PP13) má veľkosť 32 kD a patrí medzi tzv. galektíny. Syntetizovaný je najmä na úrovni syncytiotrofoblastu a jeho 600 bp mRNA transkript je detekovateľný výhradne v placentárnom tkanive [24]. PP13 sa viaže ku proteínom extracelulárnej matrix medzi placentou a deciduou a zrejme zohráva úlohu pri implantácii placenty a remodelácii vetiev uterinných artérií. Samotný PP13 bol izolovaný zo séra matky, séra plodu a z plodovej vody [3]. Počas normálneho priebehu tehotenstva jeho koncentrácie postupne stúpajú. V sére matky, u ktorej sa následne vyvinie PEE, sú v 11.–13. t.t. výrazne znížené v porovnaní so zdravými tehotnými [3]. V treťom trimestri sú hodnoty PP13 u žien s PEE zvýšené, čo poukazuje na nekrózu syncýtiotrofoblastu [11].
Nicolaides a kol. porovnávali index pulzatility (PI) uterinných artérií (UtA) a sérové hodnoty PP 13 u 433 tehotných žien v 11.–14. t.t. V skupine žien, u ktorých sa následne rozvinula skorá forma PEE vyžadujúca pôrod pred ukončeným 34. t.t. odhalili vyššie PI UtA a nižšie hodnoty sérového PP13 v prvom trimestri ako u zdravých tehotných. Vyšetrením PI UtA u 14 % žien s najvyšším rizikom PEE vyplývajúcim z hodnôt PP13 dosiahli 90% senzitivitu pri 6% falošnej pozitivite [17]. Ďalšia štúdia takisto potvrdila záver, že hodnoty sérových hladín PP13 v prvom trimestri môžu slúžiť ako vhodný marker pre skorú formu PEE, ale sú slabým prediktorom ťažkej PEE v termíne. Pre ľahkú PEE v termíne sa ukázali neefektívne.
Prevalencia skorej formy PEE v bežnej populácii je veľmi nízka, čo vyúsťuje do nízkej prediktívnej hodnoty prvotrimestrovej koncentrácie PP13. Túto môže zvýšiť kombinácia PP13 s inými biomarkermi a prvo-, resp. druhotrimestrovým dopplerovským vyšetrením UtA [21]. V súčasnosti je už komerčne dostupný PP 13 kit pre prvotrimestrový skríning PEE.
FAKTORY ANGIOGENÉZY
S pokračujúcim výskumom PEE sa v posledných rokoch pozornosť zameriava na peptidy zohrávajúce úlohu v angiogenéze. Angiogenéza je pre normálny vývin placenty esenciálna. Vaskulárny endotelový rastový faktor (VEGF) a placentárny rastový faktor (PlGF) sú proangiogénne faktory, podieľajúce sa na normálnej proliferácii trofoblastu a na jeho nidácii. Tieto faktory za normálnych okolností pôsobia v komplexnej súhre s ich receptormi. Ide o receptor vaskulárneho endotelového faktora-1 (VEGFR-1, nazývaný aj fms-like tyrozín kináza alebo Flt-1) a receptor vaskulárneho endotelového faktora-2 (VEGFR-2) [12].Zdrojom týchto látok je samotná placenta.
Placentárne bunky vylučujú aj solubilnú izoformu Flt 1 (sFlt-1), ktorá je generovaná cez alternatívny splicing mRNA. Plní rolu anti-angiogenného faktora pri neutralizácii účinkov PlGF a VEGF [6].
V normálnom tehotenstve koncentrácia PlGF stúpa počas prvého trimestra a následne klesá s blížiacim sa termínom pôrodu. Podobná je aj dynamika zmien VEGF. Na rozdiel od proangiogénnych faktorov, koncentrácia sFlt-1 faktoru zostáva stabilná počas skorých štádií tehotenstva a postupne stúpa s blížiacim sa pôrodom. V tehotenstvách s PEE máme dôkazy o vyššej placentárnej expresii sFtl-1, o opakovaných zvýšeniach hladín sFlt-1 a redukcii bioaktívnych PlGF a VEGF.
Cooper a kol. dokázali, že množstvo placentárnej mRNA kódujúcej VEGF je u žien s PEE oproti zdravej kontrolnej skupine omnoho nižšie [8]. Podobne ako VEGF, i koncentrácia PlGF je v druhom trimestri u žien s neskorším rozvojom PEE signifikantne nižšia v porovnaní so zdravými kontrolami. Tento fakt je najvýraznejší u pacientok s ťažkou formou PEE, kde je množstvo bioaktívneho PlGF a VEGF podstatne znížené v porovnaní so zdravými ženami, resp. so ženami s miernou formou PEE [27]. Takisto je omnoho výraznejšia alterácia jednotlivých hladín a pomeru sFlt-1 a PlGF pri PEE so skorým nástupom, oproti PEE v termíne [32].
Zmenené sérové koncentrácie sFlt-1, PlGF a VEGF je možné zistiť už pred nástupom symptómov. U žien, u ktorých sa neskôr vyvinie PEE, dochádza k zvýšeniu sFlt-1 v druhom trimestri, ale nie v trimestri prvom. Koncentrácie PlGF a VEGF vykazujú odchýlky už na konci prvého trimestra. Tri longitudinálne štúdie porovnávajúce tehotenstvá normotenzných žien a žien s neskorším rozvojom PEE študovali expresiu faktorov angiogenézy [5, 15, 22]. U normotenzných tehotných zostávali koncentrácie sFlt-1 relatívne stabilné až po posledné 2 mesiace gravidity, kedy začali stúpať. Tento nárast bol omnoho výraznejší v tehotenstvách končiacich sa PEE. Zvýšenie sFlt-1 dokáže predikovať PEE zhruba 5-8 týždňov pred objavením sa symptómov. Toto platí hlavne v prípadoch skorej PEE.
Množstvo PlGF v normálnom tehotenstve postupne stúpa, vrchol dosahuje v strede tehotenstva a potom klesá. Profilová krivka koncentrácií PlGF v tehotenstve s následným rozvojom PEE má podobný tvar, ale s nižšou amplitúdou. Na konci prvého trimestra sú koncentrácie PlGF signifikantne redukované a zostávajú nižšie počas celého tehotenstva. Rozdiel medzi koncentráciami PlGF pri normotenzných tehotenstvách a tehotenstvách s PEE je najvyšší v týždňoch nástupu klinických symptómov. Množstvo PlGF i sFlt-1 v presymptomatickom období koreluje so závažnosťou, resp. časom nástupu PEE. Podobne ako koncentrácia PlGF v sére, je u pacientok s rizikom rozvoja PEE znížené i množstvo PlGF v moči [16].
Podľa niektorých štúdií sú presymptomatické odchýlky v koncentráciách sFlt-1 zrejme špecifické pre PEE, a nevyskytujú sa u žien s neskorším pôrodom novorodenca malého pre daný gestačný vek (SGA - small for gestational age), resp. pri tehotenstvách komplikovaných intrauterinnou rastovou retardáciou plodu (IUGR - intrauterine growth retardation) [22]. Iné štúdie poukázali na fakt, že abnormálna perfúzia uteru a alterácia množstva sFlt-1 a PlGF môžu byť počas 2. trimestra zistené i u vybranej skupiny pacientok s nasledovným rozvojom IUGR [26]. Najspoľahlivejším ukazovateľom predikcie PEE sa ukazuje pomer sFlt-1/PlGF [4, 10, 26].
Stepan a kol. realizovali v 19.–24. t.t. stanovenie markerov u žien s abnormálnym PI UtA. Zo 63 pacientok s abnormálnym PI UtA malo 25 neskoršie komplikácie v gravidite (u 12 PEE a u 13 IUGR), u zvyšných 38 prebehla gravidita bez komplikácií. Samotné abnormálne PI UtA malo 68% senzitivitu a 60% špecificitu. Kombináciou dopplerovského vyšetrenia UtA a stanovenia hodnôt sFlt-1 sa senzitivita a špecificita zvýšili na 78, resp. 80 %. Pri použití PI UtA a pomeru sFlt-1/PlGF senzitivita predikcie PEE stúpla na 83 % pri špecificite 95 % [26]. V minulom kalendárnom roku bol na trh uvedený rýchly, komerčne použiteľný test predikcie PEE na základe merania hladín sFlt-1 a PlGF. Najlepšie výsledky boli dosiahnuté pri identifikácii tehotenstiev komplikovaných PEE so skorým nástupom [30].
Solubilný endoglin
Endoglin (Eng) je ko-receptorom pre transformujúce rastové faktory TGF-ß1 a TGF-ß3. Eng sa nachádza na bunkových membránach cievneho endotelu a syncytiotrofoblastu a pôsobí v angiogenéze a regulácii cievneho tonusu [27]. V predikcii PEE využívame sledovanie koncentrácií solubilného endoglinu (sEng). V in vitro štúdiách sEng pôsobí ako negatívny regulátor angiogenézy. Interaguje s TGF-ß, čím narušuje formáciu kapilár z endotelových buniek. Pri nadmernej expresii u gravidných potkanov indukoval zvýšenie krvného tlaku a cievnej permeability. Kombinácia sEng a sFlt-1 spôsobovala u gravidných zvierat renálne, hepatálne a placentárne zmeny pripomínajúce HELLP syndróm. Koncentrácie sEng sú pri PEE v porovnaní s nekomplikovanými tehotenstvami zvýšené, korelujú so závažnosťou ochorenia a po pôrode znova klesajú k norme. Najvyššie koncentrácie boli sledované pri PEE s rozvojom HELLP syndrómu [29].
Zvýšené koncentrácie sEng však boli sledované i pri tehotenstvách s IUGR bez maternálnej symptomatológie. Podľa týchto štúdií sEng nie je faktorom špecifickým pre PEE a jeho zvýšenie bolo sledované i pri IUGR bez maternálnej symptomatológie. Je teda skôr všeobecným markerom placentárnej nedostatočnosti [25]. Pilotná štúdia ukázala jeho využitie pri rozlíšení PEE od iných hypertenzných ochorení v tehotenstve, ako napr. tehotenstvom indukovanej, resp. chronickej hypertenzie [23].
Koncentrácie sEng podobne ako u sFlt-1 počas normálneho tehotenstva stúpajú v posledných dvoch mesiacoch tehotenstva. Pri tehotenstvách komplikovaných PEE začínajú stúpať skôr a ich dynamika je výraznejšia. Toto sa začína diať niekoľko týždňov pred objavením sa príznakov PEE. Zmeny sú najvýraznejšie u žien so skorou formou PEE, resp. v prípadoch, keď je PEE spojená s IUGR [22].
Rana a kol. zistili v 17. t.t. zvýšenie sérového sEng a sFlt-1 u žien s PEE v porovnaní so zdravými tehotnými. V 11.-13. t.t. boli ešte koncentrácie oboch receptorov v skupine s PEE i v skupine zdravých tehotných veľmi podobné [19].
Niekoľko longitudinálnych štúdií hodnotilo možnosti integrovaného skríningu sEng, sFlt-1 a PlGF v predikcii PEE. Bolo zistené, že kombinácie rôznych faktorov majú vyššiu prediktívnu hodnotu ako samotné koncentrácie jednotlivých faktorov [19, 22].
DOPPLEROVSKÁ SONOGRAFIA V PREDIKCII PREEKLAMPSIE
Placentárnu cirkuláciu tvoria dva relatívne samostatné hemodynamické systémy – uteroplacentárne a fetoplacentárne riečisko, ktoré navzájom komunikujú cez semipermeabilnú membránu syncytiotrofoblastu chóriových klkov formou vzájomnej výmeny dýchacích plynov, výživných látok a katabolitov. Utero-placento-fetálnu cirkuláciu charakterizujú jednotlivé prietokové krivky a indexy artérií (a. uterina a jej vetvy, a.umbilicalis, a. cerebri media) a vén (v. umbilicalis, ductus venosus). V klinickej praxi vo vzťahu k PEE sa diagnostické protokoly a odporúčania zameriavajú najmä na prietokové parametre uterinných artérií a umbilikálnej artérie (UA).
UtA sú hlavné tepny funkčného zásobenia maternice a preto predominantne reprezentujú maternálnu časť utero-placento-fetálnej jednotky. Pri nedostatočnej placentácii nedochádza k fyziologickej prestavbe aa. spirales. Pri dopplersonografickom vyšetrení UtA nachádzame redukciu uteroplacentárneho prietoku a zvýšenú vaskulárnu rezistenciu. Dochádza k zmenám prietokových parametrov UtA – k zmene indexu pulzatility a perzistencii protodiastolického zárezu (tzv. notch) (obr. 1).
Obr. 1. Prietoková krivka UtA. Vzťah medzi charakterom prietokovej krivky a dopplerovskými indexami (RI - index odporu, PI - index pulzatility, S - rýchlosť na vrchole systoly, D - rýchlosť na konci diastoly). Na začiatku diastoly zreteľne viditeľný tzv. notch. <i>Zdroj: obrazový archív autorov</i> 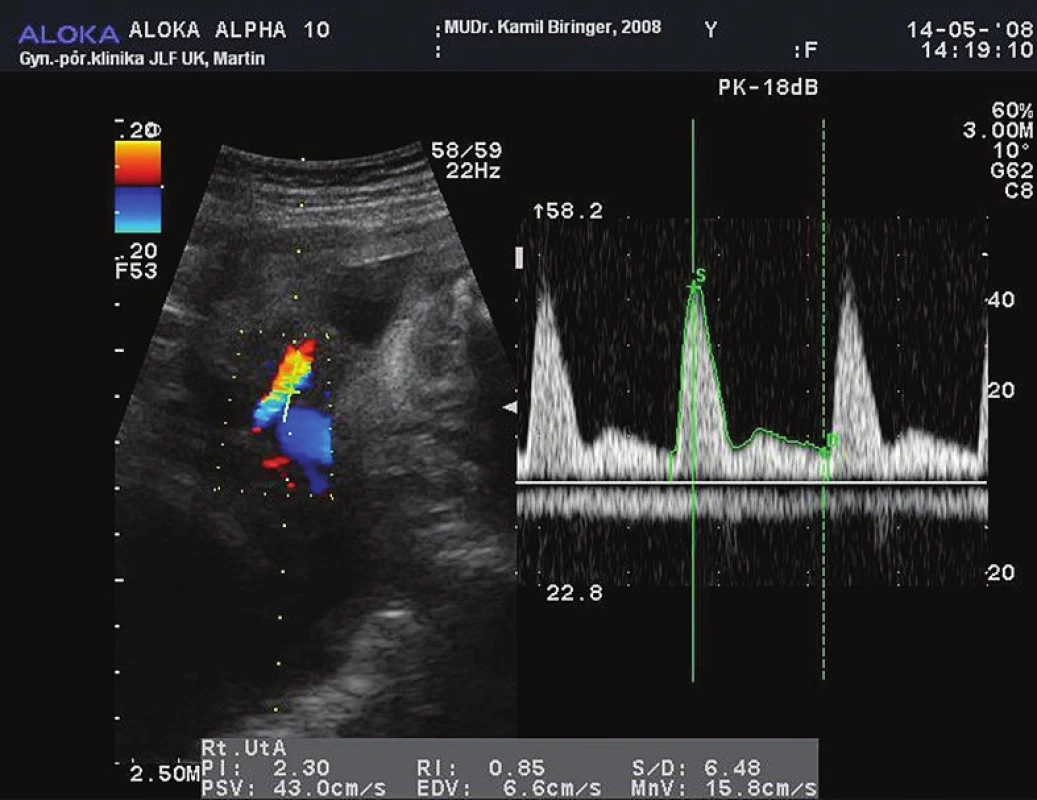
Pomocou farebného dopplerovského zobrazovania môžeme exaktne určiť kríženie UtA s vasa iliaca externa, pričom štandardný bod merania sa nachádza približne 1 cm kraniálne od tohto skríženia. Pri meraní je potrebné dosiahnuť čo najnižší insonačný uhol (<30 °). Na základe spomenutých kvalitatívnych a kvantitatívnych prietokových parametrov môžeme vytvoriť komplexný systém hodnotenia prietoku krvi v oboch UtA (na placentárnej aj kontralaterálnej strane) – uterinné arteriálne skóre (UAS). Podľa súčasných poznatkov existuje priama úmera medzi vzostupom UAS a incidenciou fetálneho distresu, IUGR a preeklampsie [2]. Patologický PI (>1,20) a/alebo perzistencia protodiastolického zárezu v UtA po 24. t.t. charakterizuje abnormálnu trofoblastovú inváziu do špirálových artérií, placentárne infarkty alebo zvýšenú mieru placentárnej apoptózy. Tieto patologické zmeny prietoku UtA sú teda prognostickým znakom možného rozvoja PEE a IUGR.
V roku 2008 Cnossen a kol. zhodnotili všetky relevantné štúdie do apríla 2006 (74 štúdií, 79 547 pacientok). Dopplersonografické vyšetrenie podľa týchto výsledkov poskytuje v druhom trimestri omnoho presnejšiu predikciu PEE ako v trimestri prvom. Najlepším prediktorom PEE je zvýšený PI UtA spolu s nálezom protodiastolického zárezu. Tieto ukazovatele sú takisto najlepšími ultrasonografickými prediktormi celkovej a ťažkej IUGR. Autori tiež priznávajú limity dopplerovského sonografického vyšetrenia v predikcii PEE a odporúčajú ho kombinovať s inými ukazovateľmi PEE [7]. V štúdiách zameraných na prietok UtA v 20. až 24. t.t. dosahovala senzitivita tohto vyšetrenia u žien so skorým rozvojom preeklampsie 50–70 % a falošná pozitivita bola cca 5 %. Phupong a kol. v 2003 uvádzajú 68-násobne zvýšené riziko vzniku PEE v prípade prítomnosti protodiastolického zárezu v 24.t.t. Negatívna prediktívna hodnota protodiastolického zárezu v tomto týždni dosahuje až 99 % [18].
Umbilikálna artéria reprezentuje fetoplacentárnu časť utero-placento-fetálnej jednotky. Za normálnych okolností jej impedancia klesá s dĺžkou gestácie, ale krvný prietok je počas celého srdcového cyklu kontinuálny a dopredný. Eleváciu prietokových indexov až reverzný end-diastolický tok nachádzame ako súčasť tzv. brain sparing fenoménu, kde kvôli nedostatočnému zásobeniu centrálneho nervového systému plodu cievna impedancia klesá v arteria cerebri media a naopak, stúpa v UA. Tieto nálezy sú znakom vyčerpania adaptačných mechanizmov plodu a prediktorom intrauterinného odumretia. Tento stav vzniká hlavne pri chronickej placentárnej insuficiencii, ktorá má obdobný patologicko-anatomický a patofyziologický podklad ako preeklampsia – poruchu na úrovni placenty [7, 9, 13].
ZÁVER
PEE predstavuje vážny zdravotný, ekonomický a spoločenský problém, ktorý dodnes nedokážeme včas odhaliť, ani v ňom adekvátne intervenovať. Jediným doteraz známym a skutočne účinným riešením zostáva pôrod plodu a placenty. Mnohokrát je následne nevyhnutná intenzívna starostlivosť o nezrelého novorodenca s otáznou prognózou. PEE sa spája s vysokou maternálnou i perinatálnou morbiditou a mortalitou. Pre všetky tieto skutočnosti je potrebné vyvinúť diagnostický postup, ktorý umožní odhalenie PEE v dostatočnom predstihu pred nástupom jej klinických prejavov. Táto diagnostika musí byť široko aplikovateľná a finančne nenáročná. Mala by identifikovať rizikové tehotenstvá a následne umožniť ich podrobný monitoring, v snahe zabezpečiť čo najlepšiu prenatálnu starostlivosť [12].
Poďakovanie
Táto práca vznikla s podporou zo zdrojov EÚ – Európského fondu regionálneho rozvoja v rámci činnosti Centra excelentnosti pre perinatologický výzkum
MUDr. Miroslav Haško
Gynekologicko-pôrodnícka klinika
JLF UK a UNM
Kollárova 2
036 59 Martin
Slovenská republika
e-mail: miro.hasko@gmail.com
Zdroje
1. American College of Obstetricians and Gynecologists. ACOG practice bulletin. Diagnosis and management of preeclampsia and eclampsia. Int J Gynaecol Obstet, 2002, 77, 33, p. 67-75.
2. Biringer, K., Haško, M., Cuľbová, M., et al. Patologická gravidita a Dopplerovská sonografia v druhej polovici tehotnosti. Gynekol Prax, 2008,6,3, s. 163-170.
3. Burger, O., Pick, E., Zwickel, J. Placental protein 13 (PP-13): Effect on cultured trophoblasts and its detection in human body fluids in normal and pathological pregnancies. Placenta, 2004, 25, p. 608-622.
4. Carty, DM., Delles, C., Dominiczak, AF. Novel biomarkers for predicting preeclampsia. Trends Cardiovasc Med, 2008, 18, 5, p.186-194.
5. Chaiworapongsa, T., Romero, R., Kim, YM., et al. Plasma soluble vascular endothelial growth factor receptor-1 concentration is elevated prior to the clinical diagnosis of pre-eclampsia. J Matern Fetal Neonatal Med, 2005, 17, p. 3-18.
6. Clark, DE., Smith, SK., He, Y., et al. A vascular endothelial growth factor antagonist is produced by the human placenta and released into the maternal circulation. Biol Reprod, 1998, 59, p. 1540-1548.
7. Cnossen, JS., Morris, RK., Riet, G., et al. Use of uterine artery Doppler ultrasonography to predict pre-eclampsia and intrauterine growth restriction: a systematic review and bivariable meta-analysis. CMAJ, 2008, 178, 6, p. 701-711.
8. Cooper, JC., Sharkey, AM., Charnock-Jones, DS. VEGF mRNA levels in placentae from pregnancies complicated by pre-eclampsia. Br J Obstet Gynaecol, 1996, 103, p. 1191-1196.
9. Costa, S., Proctor, L., Dodd, J., et al. Screening for placental insufficiency in high-risk pregnancies: is earlier better? Placenta, 29, 12, p. 1034-1040.
10. De Vivo, A., Baviera, G., Giordano, D., et al. Endoglin, PlGF and sFlt-1 as markers for predicting pre-eclampsia. Acta Obstet Gynecol Scand, 2008, 87, 8, p. 837-842.
11. Gonen, R., Shahar, R., Grimpel, YI., et al. Placental pr ein 13 as an early marker for pre-eclampsia: a prospective longitudinal study. BJOG, 2008, 115, 12, p. 1465-1472.
12. Grill, S., Rusterholz, C., Zanetti-Dällenbach, R. Potential markers of preeclampsia – a review. Reprod Biol Endocrinol, 2009, 14, 7, p. 70.
13. Gudmundsson, S., Korszun, P., Olofsson, P., et al. New score indicating placental vascular resistance. Acta Obstet Gynecol Scand, 2003, 82, 9, p. 807-812.
14. Lee, ES., Oh, MJ., Jung, JW. The levels of circulating vascular endothelial growth factor and soluble FLT-1 in pregnancies complicated by preeclampsia. J Korean Med Sci, 2007, 22, p. 94‑98.
15. Levine, RJ., Maynard, SE., Qian, C., et al. Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med, 2004, 350, p. 672-683.
16. Levine, RJ., Thadhani, R., Qian, C., et al. Urinary placental growth factor and risk of preeclampsia. JAMA, 2005, 293, p. 77‑85.
17. Nicolaides, KH., Bindra, R., Turan, OM. A novel approach to first-trimester screening for early pre-eclampsia combining serum PP-13 and Doppler ultrasound. Ultrasound Obstet Gynecol, 2006, 27, p. 13-17.
18. Phupong, V., Dejthevaporn, T., Tanawattanacharoen, S., et al. Predicting the risk of preeclampsia and small for gestational age in nts by uterine artery Doppler in low-risk women. Arch Gynecol Obstet, 2003, 268, p. 158-161.
19. Rana, S., Karumanchi, SA., Levine, RJ. Sequential changes in antiangiogenic factors in early pregnancy and risk of developing preeclampsia. Hypertension, 2007, 50, p. 137-142.
20. Robinson, CJ., Johnson, DD., Chang, EY. et al. Evaluation of placenta growth factor and soluble Fms-like tyrosine kinase 1 receptor levels in mild and severe preeclampsia. Am J Obstet Gynecol, 2006, 195, p. 255-259.
21. Romero, R., Kusanovic, JP., Than, NG., et al. First-trimester maternal serum PP13 in the risk assessment for preeclampsia. Am J Obstet Gynecol, 2008, 199, 122, p.e1-122.e11.
22. Romero, R., Nien, JK., Espinoza, J., et al. A longitudinal study of angiogenic (placental growth factor) and anti-angiogenic (soluble endoglin and soluble vascular endothelial growth factor receptor-1) factors in normal pregnancy and patients destined to develop preeclampsia and deliver a small for gestational age neonate. J Matern Fetal Neonatal Med, 2008, 21, p. 9-23.
23. Salahuddin, S., Lee, Y., Vadnais, M., et al. Diagnostic utility of soluble fms-like tyrosine kinase 1 and soluble endoglin in hypertensive diseases of pregnancy. Am J Obstet Gynecol, 2007, 197, p. 28.e1-6.
24. Sekizawa, A., Purwosunu, Y., Yoshimura, S., et al. PP13 mRNA expression in trophoblasts from preeclamptic placentas. Reprod Sci, 2009, 16, p. 408-413.
25. Stepan, H., Kramer, T., Faber, R. Maternal plasma concentrations of soluble endoglin in pregnancies with intrauterine growth restriction. J Clin Endocrinol Metab, 2007, 92, p. 2831-2834.
26. Stepan, H., Unversucht, A., Wessel, N., et al. Predictive value of maternal angiogenic factors in second trimester pregnancies with abnormal uterine perfusion. Hypertension, 2007, 49, 4, p. 818-824.
27. St-Jacques, S., Forte, M., Lye, SJ., et al. Localization of endoglin, a transforming growth factor-beta binding protein, and of CD44 and integrins in placenta during the first trimester of pregnancy. Biol Reprod, 1994, 51, p. 195, p. 255-259.
21. Romero, R., Kusanovic, JP., Than, NG., et al. First-trimester maternal serum PP13 in the risk assessment for 195, p. 255-259.
21. Romero, R., Kusanovic, JP., Than, NG., et al. First-trimester maternal serum PP13 in the risk assessment for tardácie a preeklampsie pomocou ultrazvukových markerov. Prakt Gynek, 2007, 14, 2, p. 46-54.
29. Venkatesha, S., Toporsian, M., Lam, C., et al. Soluble endoglin contributes to the pathogenesis of preeclampsia. Nat Med, 2006, 12, p. 642-649.
30. Verlohren, S., Galindo, A., Schlembach, D., et al. An automated method for the determination of the sFlt-1/PIGF ratio in the assessment of preeclampsia. Am J Obstet Gynecol, 2010, 202, 2, p. 161.e1-161.e11.
31. Višňovský, J. Vyšetrenie cirkulácie v pôrodníctve. Martin: Osveta, 2002, 200 s.
32. Wikstrom, AK., Larsson, A., Eriksson, UJ., et al. Placental growth factor and soluble FMS-like tyrosine kinase-1 in early-onset and late-onset preeclampsia. Obstet Gynecol, 2007, 109, p. 1368-1374.
Štítky
Dětská gynekologie Gynekologie a porodnictví Reprodukční medicína
Článek Možnosti a výsledky preimplantační genetické diagnostiky (PGD) u párů s chromozomální translokacíČlánek Prokázané klinické účinky rekombinantních gonadotropinů v porovnání s urinárními v indukci ovulaceČlánek EditorialČlánek Děložní myomy a jejich léčbaČlánek Screening kolorektálního karcinomu v ordinaci praktického gynekologa – který test je ten pravý?
Článek vyšel v časopiseČeská gynekologie
Nejčtenější tento týden
2011 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
-
Všechny články tohoto čísla
- Možnosti a výsledky preimplantační genetické diagnostiky (PGD) u párů s chromozomální translokací
- Luteální podpora v programu IVF/ET
- Prokázané klinické účinky rekombinantních gonadotropinů v porovnání s urinárními v indukci ovulace
- Srovnání lidského choriového gonadotropinu (Pregnyl 10 000 IU i.m.) s GnRH agonistou (triptorelin 0,2 mg s.c.) pro maturaci oocytů u stejných dárkyň vajíček – klinické a embryologické charakteristiky
- Prodloužená kultivace embryí při IVF nezvyšuje naději na otěhotnění
- Do jaké míry je rozvoj ovariálního hyperstimulačního syndromu v přímé souvislosti se syndromem polycystických ovarií u IVF pacientek podstupujících řízenou hyperstimulaci ovarií?
- Využití a význam 3D ultrasonografického vyšetření v asistované reprodukci
- Vybrané markery v skorej predikcii preeklampsie
- Význam konzultace při výběru kombinované hormonální antikoncepce – výsledky projektu CHOICE (Contraception Health Research Of Informed Choice Experience) v České a Slovenské republice
- Prevalence žen s hyperaktivním močovým měchýřem v České republice
- Děložní myomy a jejich léčba
- Screening kolorektálního karcinomu v ordinaci praktického gynekologa – který test je ten pravý?
- Spontánna ruptúra uterinných ciev počas gravidity u pacientky s predchádzajúcou endometriózou
- Zemřel prof. MUDr. Otakar Nyklíček, DrSc. FIAC (em.)
- Reprodukční imunologie ve světě
- XXXIX. globální kongres minimálně invazivní gynekologie Las Vegas, USA
- CELOSTÁTNÍ KONFERENCE Sdružení soukromých gynekologů ČR a České gynekologické a porodnické společnosti ČLS JEP
- Editorial
- Snížená plodnost a současné možnosti vyšetřování v reprodukční imunologii
- Onkofertilita – nový směr reprodukční medicíny
- Česká gynekologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Prodloužená kultivace embryí při IVF nezvyšuje naději na otěhotnění
- Děložní myomy a jejich léčba
- Luteální podpora v programu IVF/ET
- Snížená plodnost a současné možnosti vyšetřování v reprodukční imunologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




