-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pokroky ve výzkumu poškození a reparace DNA v buňkách vystavených různým druhům ionizujícího záření v éře superrozlišovací optické mikroskopie
Advances in research of DNA damage and repair in cells exposed to various types of ionizing radiation in the era of super-resolution optical microscopy
The present work introduces new findings about the influence of different radiation types on the cells, with the concern on the micro - and nanodosimetric aspects of chromatin damage. Emphasized is the relationship between the physical parameters of the incident radiation (g-rays, protons and high-LET heavy ions), character of chromatin damage, ability of cells to repair and survive DNA damage, and risk of genetic changes. While confirming a positive correlation between the LET of ionizing radiation, complexity of induced DNA double-strand breaks (DSB), and biological effectiveness (RBE) of radiation, at the same time, we show that our understanding of this relationship is only incomplete. Our discovery that various accelerated ions with similar LET can damage DNA in different ways and kill cells with unequal efficiency, could serve as an example. In addition, many aspects of DSB repair remain to be explained, for instance, how the cell activates the particular repair pathway at sites of individual DSBs, and how it depends on the radiation used and the chromatin architecture.
The discussed results may be important, above all, for newly developing hadron therapy and in the context of manned interstellar flights planning. From the methodological point of view, we point to a tremendous progress in the field of optical microscopy and its research applications. In more detail, we introduce single-molecule localization microscopy (SMLM).
Keywords:
ionizing radiation of different types – DNA radiation damaging and repair – ionizing radiation-induced foci (IRIF) – chromatin architecture – super-resolution microscopy – single-molecule localization microscopy (SMLM).
Autoři: Martin Falk 1; Michael Hausmann 2
Působiště autorů: Biofyzikální ústav AV ČR, v. v. i., Brno 1; Kirchhoffův institut pro fyziku, Univerzita Heidelberg 2
Vyšlo v časopise: Čas. Lék. čes. 2020; 159: 286-297
Kategorie: Přehledový článek
Souhrn
K novým poznatkům o vlivu různých druhů ionizujícího záření na buňky patří mikro - a nanodozimetrické aspekty poškození chromatinu. Fyzikální vlastnosti incidentního ionizujícího záření (fotonů gama, protonů a iontů s vysokým LET) souvisí s charakterem poškození chromatinu, možnostmi buňky opravit a přežít vytvořené léze DNA a rizikem genetických změn. Přestože výsledky jednoznačně potvrzují pozitivní korelaci mezi LET ionizujícího záření, komplexností indukovaných dvouřetězcových zlomů DNA (DSB) a biologickou účinností (RBE) záření, zároveň odhalují, že těmto vztahům ještě dostatečně nerozumíme. Příkladem budiž zjištění, že různé urychlené ionty s podobným LET mohou poškozovat DNA odlišným způsobem a zabíjet tak buňky s nestejnou účinností. Stále také neumíme vysvětlit mnoho aspektů reparace DSB, například co rozhoduje o aktivaci určité reparační dráhy v místě konkrétního DSB a jak je tento výběr ovlivněn použitým ionizujícím zářením a strukturou chromatinu.
Diskutované výsledky mohou být mj. důležité z hlediska nově se rozvíjející hadronové terapie nádorových onemocnění a plánování pilotovaných meziplanetárních letů. Z metodického hlediska potom tato práce ilustruje obrovský pokrok, který se udál na poli optické mikroskopie a jejích výzkumných aplikací. Detailněji je představena metoda lokalizační mikroskopie s rozlišením jednotlivých molekul (SMLM – single-molecule localization microscopy).
Klíčová slova:
ionizující záření různých typů – radiační poškození DNA a reparace – reparační ohniska indukovaná ionizujícím zářením (IRIF) – architektura chromatinu – superrozlišovací mikroskopie – lokalizační mikroskopie s rozlišením jednotlivých molekul (SMLM)
IONIZUJÍCÍ ZÁŘENÍ A JEHO STÁLE MYSTERIÓZNÍ HÁV
Působení ionizujícího záření (IZ) na lidské zdraví je dvousečné. Aplikováno v rámci radioterapie představuje jeden z doposud nejúčinnějších nástrojů pro eliminaci nádorů. Na druhé straně může vést ozáření, v závislosti na závažnosti expozice, k okamžité smrti organismu nebo rozvoji pozdních zdravotních následků, zejména nádorového bujení. IZ je schopno poškozovat biologické objekty už v relativně nízkých dávkách, přičemž ho ale nedokážeme vnímat svými smysly. Proto si stále zachovává část svého odnepaměti mystického hávu. V současné době navíc existuje významné riziko zneužití IZ a obrovské energie jaderných reakcí a zcela vyloučit nelze ani jaderné nehody, případně s nedozírnými následky. Nedávno jsme si zrovna připomněli 30. výročí největší lidmi zapříčiněné nevojenské katastrofy v dějinách – havárie jaderné elektrárny v Černobylu. Jen málo fyzikálních fenoménů proto v lidech vyvolává tak protichůdné emoce jako IZ.
Ionizující záření navíc zůstává do určité míry mysteriózní i z biologického a medicínského pohledu, jelikož stále ne zcela rozumíme jeho účinkům na živé systémy (1, 2). Přestože poškození DNA bylo odhaleno jako kritický aspekt biologických účinků IZ a vcelku detailně se podařilo popsat i kaskádu buněčných procesů následně aktivovaných v rámci buněčné odpovědi na ozáření, řada zásadních otázek radiačního poškození buněk a organismů zůstává nezodpovězena (3). Jako příklad zásadního významu budiž uvedena naše neznalost biologických účinků nízkých a velmi nízkých dávek IZ (1). Tento palčivý problém se s lidstvem táhne již od objevu radioaktivity, a ani s dnešními technologiemi nejsme schopni rozhodnout, zda IZ v nízkých dávkách působí na buňky stejným způsobem a mechanismem jako při expozici dávkám vysokým. Debatuje se, zda nízké dávky IZ vyvolávají hypersenzitivní odpověď, např. kvůli nedostatečné aktivaci reparačních systémů DNA, nebo jsou naopak za jistých okolností pro buňky prospěšné díky permanentní mírné stimulaci reparačních systémů DNA a – na vyšších úrovních organizace organismu – imunitního systému (efekt hormeze) (1). Tyto protichůdné procesy mohou přitom působit paralelně.
Vezmeme-li v úvahu, že život vznikal v době výrazně vyšších dávkových příkonů IZ, než je tomu dnes, nelze dokonce vyloučit, že buňky určitou nízkou úroveň záření ke svému životu potřebují. Prokázat nebo vyvrátit tuto hypotézu by mohly právě iniciované experimenty v nově budovaných „podzemních“ laboratořích s extrémně nízkým radiačním pozadím. K těmto a podobným studiím však potřebujeme velice citlivé metody detekce poškození DNA, které byly až donedávna nedostupné a obšírněji se jim věnujeme i v tomto článku (4). Lepšímu porozumění účinků IZ na lidské zdraví brání také neodlišitelnost radiačně indukovaných procesů od spolupůsobení dalších faktorů prostředí a spontánní karcinogeneze.
Studium biologických účinků IZ se proto stále více přesouvá na buněčnou a molekulární úroveň. Radiobiologický výzkum se tak neodmyslitelně váže k pokrokům v oblasti mikroskopie (dnes zejména superrozlišovací mikroskopie) nastíněným dále (5, 6). Zde se zabýváme zejména vztahem mezi fyzikálními parametry různých druhů ionizujícího záření, architekturou buněčného jádra (chromatinu), mechanismy vzniku a charakteristikami DSB a organizací jejich reparace v prostoru a čase. Představujeme některé své výsledky v tomto směru, jež jsou důležité medicínsky, mohou přispět ke změně určitých radiobiologických paradigmat a podařilo se jich dosáhnout primárně s využitím mikroskopie. Zároveň ilustrujeme zásadní význam unikátní vlastnosti mikroskopie spočívající ve schopnosti přímé vizualizace radiobiologických dějů, navíc na multidimenzionální (mikro-, meso-, nano-) úrovni. Princip superrezolučních mikroskopických metod překonávajících Abbeho (Rayleighův) difrakční limit je vysvětlen na příkladu superrezoluční lokalizační mikroskopie (SMLM – single-molecule localization microscopy) (7, 8), hojně využívané v našem výzkumu. Pro detailní popis experimentálních metod a procedur pojících se k prezentovaným výsledkům nicméně odkazujeme na příslušné citované práce. Druhy IZ, k nimž se výsledky vztahují, a základní charakteristiky těchto záření jsou shrnuty v tab. 1.
Tab. 1. Druhy ionizujícího záření vztahující se k diskutovaným výsledkům a jejich základní parametry 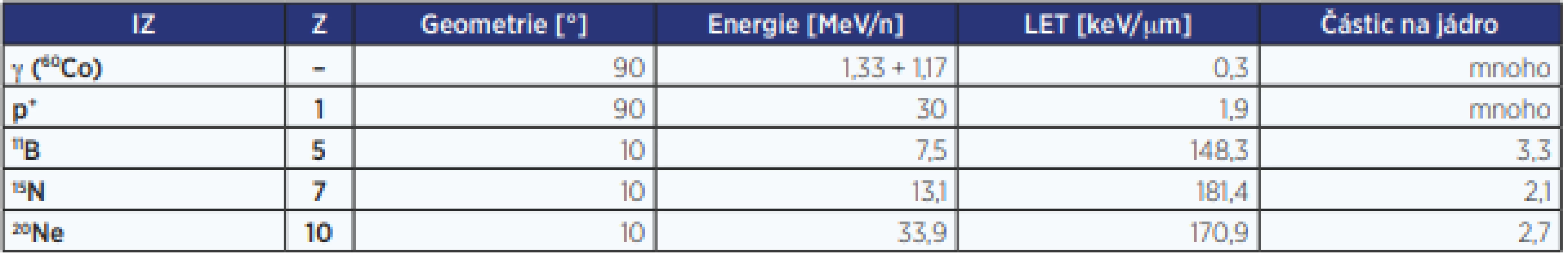
Pozn.: Sloupec „geometrie“ určuje, pod jakým úhlem byla ozářena buněčná monovrstva. Z = protonové číslo. Ačkoliv některé naše studie i výzkumy jiných laboratoří začínají poukazovat na význam cytoplazmatického radiačního poškození buněk (9–11), jaderný chromatin zůstává i nadále kritickým cílem IZ. Nejnebezpečnějším typem poškození DNA jsou jen těžko opravitelné dvouřetězcové zlomy (DSB) této molekuly, které nejúčinněji indukuje IZ (4).
OBJEV OHNISEK REPARAČNÍCH PROTEINŮ INDUKOVANÝCH ZÁŘENÍM (IRIF) A JEJICH MIKROSKOPICKÁ VIZUALIZACE – ZÁSADNÍ PŘELOM V RADIOBIOLOGII
V řádu několika minut po ozáření dochází v místech DSB v rámci jejich reparace (viz níže) k fosforylaci histonu H2AX na serinu 139 (12). Tato fosforylace zahrnuje přibližně 2 Mb chromatinu, čímž se v buněčném jádře formují mikroskopicky vizualizovatelné oblasti takto modifikovaného histonu, označované jako ohniska γH2AX. Tato ohniska následně fungují jako signál poškození DNA podílející se na iniciaci a regulaci reparace DNA. Přítomnost ohnisek γH2AX zároveň rozhoduje o řadě procesů doprovázejících reparaci DNA, například o zástavě a reaktivaci buněčného cyklu a v případě závažného poškození o spuštění apoptózy (4). Ohniska γH2AX v místech DSB v kooperaci s dalšími proteiny navozují strukturu chromatinu vhodnou pro průběh reparace a vytvářejí platformu pro sestavení složitých reparačních komplexů (13). Jednotlivé reparační proteiny tak v časově specifické sekvenci a množství postupně kolokalizují s γH2AX, čímž se formují tzv. zářením indukovaná ohniska (IRIF – ionizing radiation-induced foci).
Jelikož pro řídce ionizující záření (rtg, γ) koreluje počet reparačních ohnisek úzce s počtem DSB (4), představují IRIF kvantitativní, a v dnešní době dokonce nejcitlivější marker DSB (obr. 1). Ve většině radiačních situací tak lze prostým spočítáním IRIF v jádře odvodit (s korekcemi na čas uplynulý od ozáření) buňkami absorbovanou dávku IZ. Vede-li absorbovaná dávka 1 Gy záření γ k vytvoření přibližně 30 IRIF v buněčném jádře, pak 1 IRIF odpovídá detekovatelné dávce v řádu desítek mGy (4). Této citlivosti nedosáhneme sledováním žádného jiného biomarkeru, např. mikrojader, chromosomových translokací či jiných aberací. Vystačíme si přitom se standardní imunofluorescenční mikroskopií nebo průtokovou cytometrií. Pomocí IRIF navíc měříme přímo rozsah poškození DNA, a nikoliv až následky nepřesné reparace tohoto poškození (chromosomové aberace, mikrojádra), jež závisejí na typu buněk, jejich stavu a dalších faktorech (4). Objev detekce ohnisek γH2AX a asociovaných reparačních proteinů proto představuje v radiobiologii zásadní přelom s rozsáhlými aplikacemi výzkumnými (2, 4, 14) i biodozimetrickými (15).
Obr. 1. Detekce ohnisek IRIF (γH2AX = zelená, 53BP1 = červená) pomocí imunofluorescenční konfokální mikroskopie. 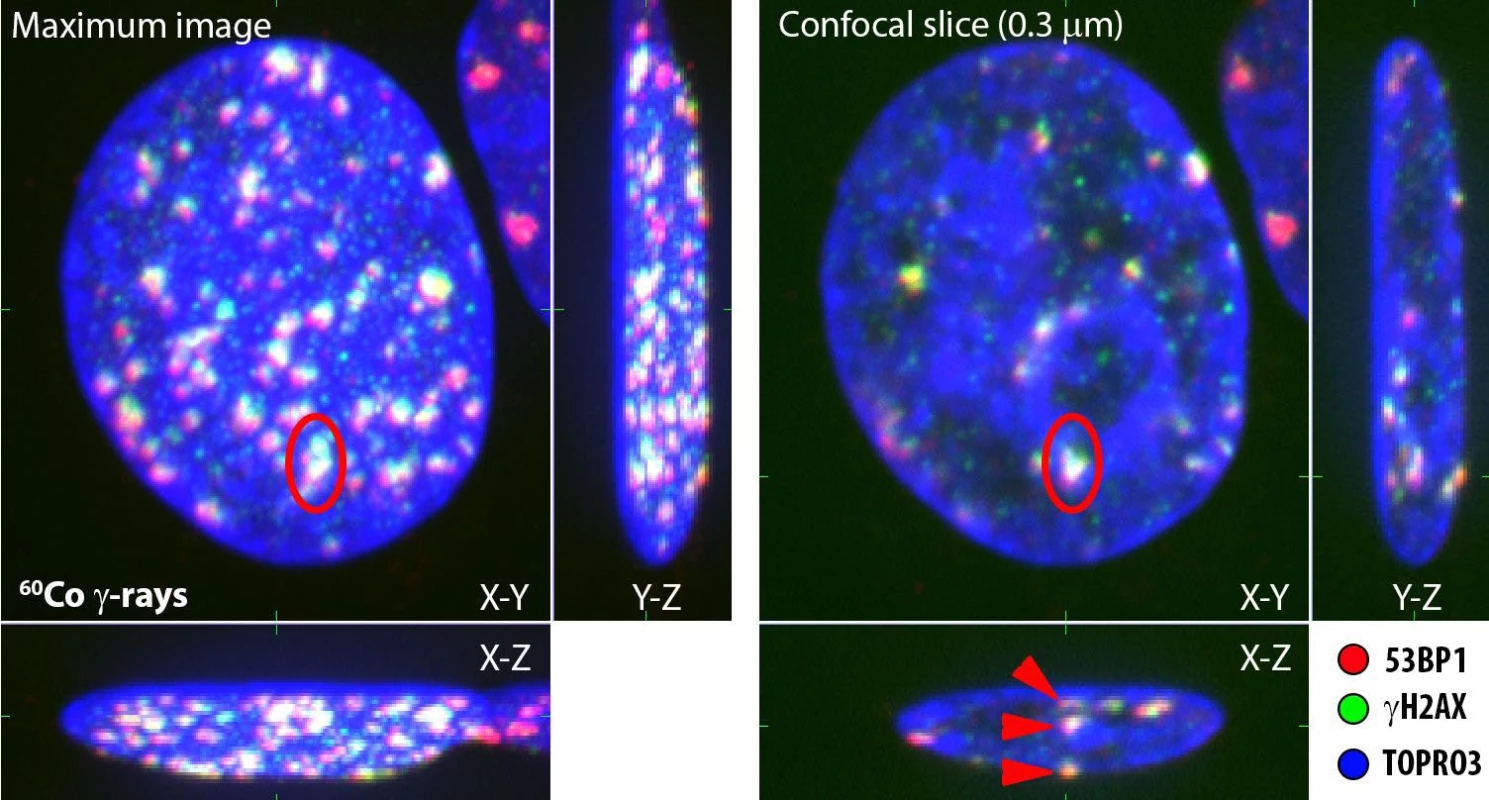
Vlevo: 2D obraz jádra (TOPRO3, modrá) lidského kožního fibroblastu, ozářeného 4 Gy záření gama, vytvořený superpozicí 30 optických řezů silných 0,25 μm (tzv. maximální obraz).
Vpravo: Konfokální řezy stejným jádrem (0,25 μm) v rovinách x–y, x–z a y–z protínajících vyznačený (červená elipsa) klastr ohnisek IRIF. Červené šipky na řezu rovinou x–z demonstrují, jak lze pomocí 3D fixace preparátů a konfokální mikroskopie odlišit v 3D prostoru jednotlivé IRIF, jež spolu v 2D prostoru splývají. Konfokální řez jádrem zároveň ukazuje pozice IRIF vůči strukturně a funkčně specifickým chromatinovým doménám – euchromatinu (tmavé nebo slabě barvené oblasti) a heterochromatinu (intenzivní modrá). Studovat lze též různý rozsah kolokalizace ohnisek γH2AX s proteinem 53BP1 a další morfologické parametry IRIF na mikroskopické úrovni.
Rozměr horizontální hrany snímků je cca 10 μm.Pro vysoké dávky v řádu Gy přetrvávají IRIF v buňkách po řadu dnů až týdnů od ozáření. Možnost jejich detekce je tak časově limitovaná, a navíc i poměrně náročná. Obdobně jako jiné biodozimetrické markery (14, 16) proto přináší kvantifikace IRIF užitek především v situacích, kdy nemáme k dispozici přesná fyzikální dozimetrická měření, nebo pokud potřebujeme přímo sledovat radiační poškození specifických tkání, či dokonce buněk exponovaného organismu. Kvantifikace IRIF zároveň představuje metodu pro odhad individuální radiosenzitivity nebo radiosenzitivity různých typů buněk (např. nádorových vs. krevních) (17), byť korelace mezi perzistujícími IRIF a radiosenzitivitou zůstává diskutována. Do těchto scénářů spadá např. triáž ozářených osob v případě rozsáhlé radiační nehody nebo identifikace pacientů hypersenzitivních k záření před započetím radioterapie. V obou případech používáme k měření lymfocyty periferní krve, které lze jednak snadno získat, a navíc se nacházejí uniformně ve fázi G0 buněčného cyklu, což stanovení dávky zpřesňuje. Lze uvažovat také o přímém preterapeutickém testování reparační kapacity nádorových buněk u jednotlivých pacientů. Musíme však vést v patrnosti, že odpověď nádoru může být ovlivněna nejen reparačními schopnostmi, ale i řadou dalších faktorů, zejména hypoxií. Své předběžné výsledky v tomto směru podrobněji diskutujeme v článku Horáková et al. v tomto vydání a v citované publikaci Falk et al. (17). Detekce IRIF nás tak přivádí o krok blíže k personalizované léčbě.
V případě hromadných událostí může být praktičtější stanovovat počty DSB prostřednictvím měření integrální intenzity signálu γH2AX pomocí průtokové cytometrie, která je ve srovnání s mikroskopií rychlejší, umožňuje analýzu obrovského množství buněk a poskytuje vyšší možnosti automatizace. Nicméně i v praktických situacích nabízí mikroskopie oproti průtokové cytometrii několik výhod, plně docenitelných zejména v případě „nestandardních“ radiačních situací (např. vystavení astronautů smíšemým radiačním polím), kdy mikrodozimetrická topologie IRIF dovoluje usuzovat (kromě dávky dané počtem IRIF) také na druh incidentního záření, tedy jeho LET a RBE (obr. 2). Kvantifikace pouze těch IRIF, kde spolu kolokalizuje γH2AX s některým z reparačních proteinů (např. 53BP1), přitom zpřesňuje určení počtu DSB a odhad dávky (1, 2, 4, 14).
Obr. 2. Mikroskopická struktura a jaderná distribuce ohnisek IRIF (γH2AX = zelená, 53BP1 = červená) generovaných indikovanými druhy ionizujícího záření vzájemně se lišícími energií a lineárním přenosem energie (LET) (viz tab. 1). 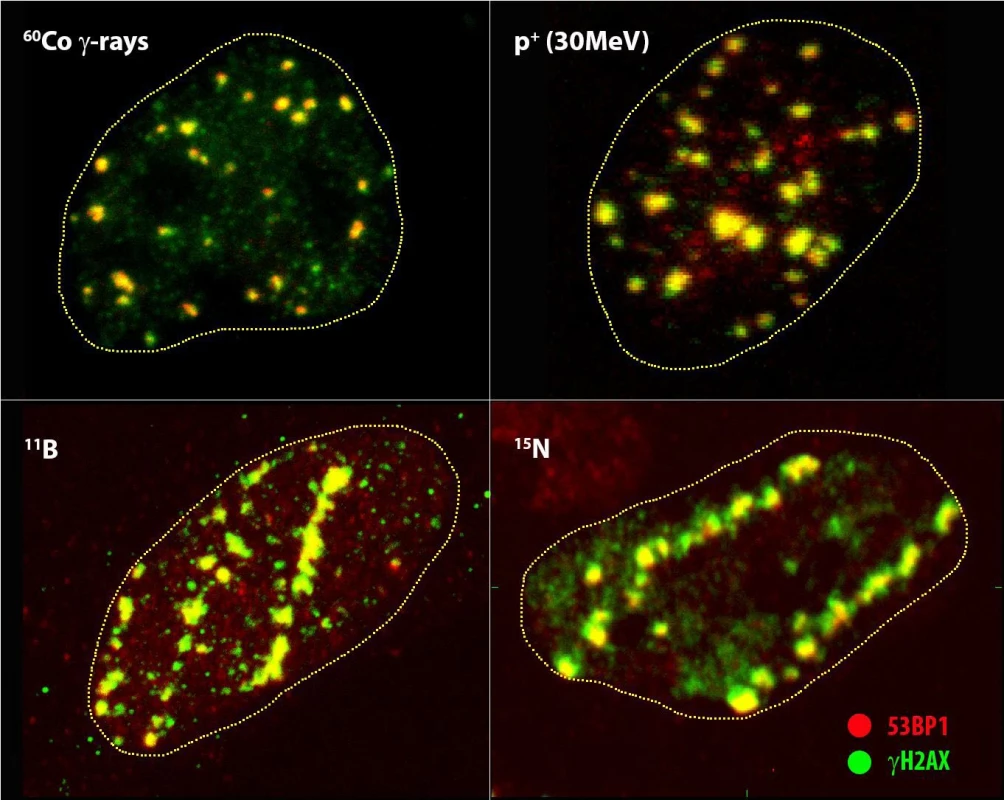
Snímky představují maximální obrazy vytvořené superpozicí 30 optických konfokálních řezů silných 0,25 μm (tzv. maximální obraz). Přerušovaná čára vyznačuje oblast buněčného jádra, jehož barvení zde bylo vynecháno za účelem lepšího zviditelnění struktury IRIF. Dolní obrázky dobře ilustrují multiplicitu IRIF a jejich klastrování v buňkách ozářených urychlenými ionty s vysokým LET. V případě protonů s energií 30 MeV vidíme spíše obraz odpovídající záření gama (vlevo nahoře) v souladu se vzájemně podobným nízkým LET než urychleným iontům ve spodním řádku. Přesto si nemůžeme nevšimnout několika mnohočetných/klastrovaných IRIF.
Rozměr horizontální hrany snímků je cca 10 μm.Rozměr horizontální hrany snímků je cca 10 μm.Zdůraznit však musíme zejména příspěvek vědecko-výzkumný. Pouze mikroskopie dovoluje přímo zkoumat vzájemné prostorově-časové vztahy mezi ohnisky γH2AX, reparačními proteiny a prostředím v okolí DSB (architekturou chromatinu, jeho epigenetickými modifikacemi atd.) (obr. 1) (2, 4). Tato skutečnost s sebou přináší bezprecedentní experimentální potenciál, a objev IRIF a jejich mikroskopické vizualizace tak představuje milník v (radio)biologickém výzkumu. Navíc lze analyzovat účinky IZ individuálně v jednotlivých, případně i živých buňkách (18, 19). Význam této přednosti spočívá nejen v možnosti kontinuálního sledování zkoumaných procesů, ale také ve skutečnosti, že jednotlivé buňky v populaci se vyskytují v různých fázích buněčného cyklu, charakteristických preferovanými reparačními mechanismy a různou radiosenzitivitou. Průměrování výsledků pro všechny buňky, jak k němu dochází například při experimentech prováděných na izolovaném buněčném materiálu, proto často vede k zamaskování některých důležitých jevů, nebo dokonce dezinterpretaci výsledků. Pro výzkumné účely má zásadní význam také skutečnost, že při použití vhodných postupů fixace můžeme studovat stejné vzorky současně pomocí různých mikroskopických metod, včetně superrozlišovací a elektronové mikroskopie, a rekonstruovat tak objekty zájmu (zde IRIF) na vzájemně korelované mikro à mezo à a nano úrovni (2, 3, 20, 21).
V následujících kapitolách se budeme podrobněji věnovat významu architektury chromatinu s ohledem na vznik DSB a IRIF v buňkách exponovaných různým typům ionizujícího záření a následně regulaci reparace DSB.
STRATEGIE REPARACE DSB, GLOBÁLNÍ A LOKÁLNÍ FAKTORY JEJÍ REGULACE
Reparační mechanismy DNA (22) bez nadsázky umožňují buněčný život v jeho známé podobě. Kromě následků ozáření vznikají DSB také účinkem dalších environmentálních faktorů (23, 24), především však následkem samotných vitálních procesů v buňce (22). DNA je tak permanentně poškozována a neobejde se bez účinných opravných systémů.
V lidských buňkách operují dvě základní dráhy reparace DSB – nehomologní spojování konců (NHEJ) a homologní rekombinace (HR) – a některé záložní (nebo též alternativní) mechanismy, které do různé míry spojují principy NHEJ a HR, a jejichž klasifikace je proto stále nejednotná. Dnes již známe poměrně detailně postupné biochemické kroky jednotlivých reparačních drah (22). Zůstává však záhadou, jaké jsou mezi NHEJ, HR a případně dalšími mechanismy oprav DSB vzájemné vztahy, zejména jak se buňka rozhoduje pro aktivaci určitého mechanismu v místě konkrétního DSB. Přitom je třeba zdůraznit, že výběr reparační dráhy v kontextu okolního prostředí představuje kritický moment opravy DSB, protože určuje rychlost – a zejména pak výsledek – celého úsilí s ohledem na přežití buňky a riziko mutageneze. Nalezení účinných technik inhibice nebo naopak podpory aktivity specifických reparačních procesů tak může představovat důležitý a značně univerzální terapeutický prostředek, aplikovatelný například v radioterapii nádorů, léčbě některých nemaligních (zejména neurodegenerativních) onemocnění a boji proti stárnutí.
Ve fázi G2 (25) mohou buňky následovat dvě reparační strategie, z nichž každá má své logické opodstatnění. V prvním případě buňka iniciuje reparaci primárně jako NHEJ, která díky své rychlosti poskytuje šanci na včasný průběh reparace, zejména u organismů s velkými genomy. Přestože NHEJ trpí určitou nepřesností (v místech zlomů dochází zejména k malým delecím či inzercím), dokáže ve velké míře zabránit vzniku chromosomových aberací, které jsou pro buňku často smrtelné. Jelikož v lidském genomu tvoří kódující sekvence pouze asi 2 %, lze riziko vzniku mutací v důležitých genech následkem NHEJ považovat za relativně malé a více než vykompenzované jejím přínosem.
S ohledem na evoluční stáří HR, dominantní úlohu tohoto mechanismu u kmenových buněk a v souladu s jeho výrazně vyšší přesností oproti NHEJ však nezní nelogicky ani opačný scénář, kdy primární HR přechází v NHEJ tehdy, nemůže-li rekombinace úspěšně pokračovat (25). Ať už však buňka zahajuje NHEJ primárně nebo až po selhání HR, NHEJ (nebo alternativní mechanismy spojování konců DNA – viz dále) opravují cca 70 % DSB vytvořených řídce ionizujícím zářením, a to jak ve fázi buněčného cyklu G1, tak i G2. Vysoce precizní, nicméně pomalou HR tudíž patrně aktivují pouze určité DSB. Kromě HR a NHEJ navíc existují i již zmíněné reparační dráhy, jež svým mechanismem leží někde mezi výše uvedenými klasickými drahami a jsou vysoce mutagenní. Považujeme je proto za alternativní nebo záložní způsoby oprav DSB (22). Tyto reparační dráhy využívají pro rekombinaci krátké homologie, takže nepotřebují ke svému průběhu sesterské chromatidy a mohou potenciálně probíhat během celého buněčného cyklu.
Extenzivní resekce DNA, a tudíž HR je v lidských buňkách ve fázi G1 obecně inhibována. Předpokládalo se proto, že HR je tímto cílena pouze na fázi buněčného cyklu S/G2, kdy jsou dostupné sesterské chromatidy pro bezchybnou (error-free) reparaci. Výsledky prezentované letos na konferenci ICRR v Manchesteru nicméně toto paradigma mění odhalujíce, že HR, byť za specifických situací, probíhá během celého buněčného cyklu. DSB v intenzivně transkribovaných genomových lokusech jsou reparovány pomocí HR s využitím nascentní RNA jakožto reparačního templátu namísto sesterské chromatidy (26). Tento objev přináší logické a velmi očekávané rozuzlení problému, jak buňka chrání důležité (geneticky aktivní) lokusy genomu před mutacemi nejen ve fázi S/G2, ale také G1. Dále se například ukázalo, že myší embryonální kmenové buňky jsou na HR dominantně závislé v průběhu celého buněčného cyklu, přičemž ve fázi G1 slouží jako templát pro rekombinaci homologické chromosomy (27).
Buněčný cyklus je tudíž důležitý, nikoli však jediný faktor ve výběru reparační dráhy. Jasně se ukazuje, že výběr nejvhodnější reparační dráhy neřídí pouze „globální“ faktory, jako již zmíněný buněčný cyklus a například též buněčný typ, stupeň diferenciace, genetické pozadí, fyziologický stav, věk a hladina kyslíku (27–30). Velice záleží též na faktorech lokálních, jež se liší pro jednotlivé DSB. Prvním známým lokálním faktorem byly chemické vlastnosti zlomených konců DNA. Později se ukázalo, že výběr reparační dráhy ovlivňuje i řada dalších vzájemně provázaných lokálních faktorů daných interakcí incidentního záření s chromatinem. Zásadní význam přitom mají nejen specifické vlastnosti záření (zejména LET) a chromatinu (architektura, epigenetický kód, transkripční aktivita, lokalizace v buněčném jádře), ale zejména jejich výsledná kombinace (31).
Abychom shrnuli výše řečené, různé studie naznačují, že prostřednictvím HR jsou reparovány především těžko opravitelné DSB nebo DSB nalézající se v genomických lokusech s vysokou potřebou zachování nepoškozené genetické informace, tedy uvnitř aktivně transkribovaných genů (32). Těžko opravitelné DSB přitom zahrnují jednak mnohočetné a/nebo komplexní léze, jednak DSB lokalizované v architektonicky nevýhodných chromatinových doménách, např. v heterochromatinu. Situace bude patrně ale komplikovanější (33). Například komplexní/mnohočetné DSB musí buňka umět opravit nejen ve fázi buněčného cyklu G2, ale též ve fázi G1. Heterochromatin zase představuje pro HR velmi nebezpečný substrát, poněvadž umožňuje nelegitimní rekombinaci mezi repetitivními sekvencemi (34), přítomnými zde ve velkém množství (viz dále). Architektura chromatinu tudíž hraje kritickou roli v mnoha aspektech tvorby i reparace DSB.
ARCHITEKTURA CHROMATINU A IRIF – KRITICKÉ FAKTORY V TVORBĚ DSB A REGULACI JEJICH REPARACE?
Relativně nedávno odhalila Penny Jeggová se svými spolupracovníky a řada dalších badatelů, že zatímco pro reparaci DSB v euchromatinu postačují tzv. korové proteiny NHEJ, tentýž proces v heterochromatinu se neobejde bez řady dalších proteinů a probíhá pomaleji (32). Reparace DSB tudíž vykazuje dvoufázovou (rychlou a pomalou) kinetikou nejen ve fázi buněčného cyklu G2, kde spolupůsobí principiálně rozdílné NHEJ a HR, ale i ve fázi G1, kde tento fenomén nelze objasnit kooperací NHEJ a HR. Vysvětlení naopak nabízí architektura poškozených chromatinových domén.
Otázkou, kterou se aktuálně zabýváme, je, zda se může architektura chromatinu podílet na tvorbě architektury IRIF a spolu s ní potom na regulaci reparačních procesů a případně i výběru určité reparační dráhy v místě konkrétního DSB (3, 20, 35, 36). Jelikož každý protein plní v rámci reparace DSB jiné úkoly a reparace probíhá v různém chromatinovém prostředí, lze očekávat, že se budou lišit také strukturní parametry jimi tvořených IRIF. Záření navíc deponuje svou energii stochasticky, což se projevuje značnou heterogenitou radiačně indukovaných DSB, přičemž na LET záření zásadním způsobem závisí i vzájemné topologické uspořádání DSB/IRIF v jádře. Můžeme proto předpokládat, že architektura a časová dynamika reparačních komplexů IRIF odráží zvolený reparační mechanismus, nebo dokonce přispívá k jeho výběru. Zda může architektura raných IRIF následně ovlivňovat další vývoj IRIF, a tudíž reparační procesy, je nyní předmětem intenzívního výzkumu (31).
V následujícím textu představíme některé indicie významně naznačující, že kromě „biochemického“ stavu buňky a fáze buněčného cyklu sehrávají důležitou roli ve výběru reparačních drah i strukturální aspekty DSB lézí a obklopujícího chromatinu. Lze se domnívat, že kompozici a strukturu formujících se IRIF stejně jako jejich dynamický vývoj v čase ovlivňují nejen biochemické interakce mezi reparačními proteiny, ale i nejrůznější další faktory, souhrnně se takto podílející na selekci a následném průběhu vybrané reparační dráhy v místě daného DSB. Jedním z těchto faktorů, jak se stále více ukazuje, je patrně lokální architektura chromatinu v místě daného DSB.
Existenci vzájemných vztahů mezi architekturou chromatinu v místě DSB, architekturou IRIF, mechanismem reparačních procesů, a dokonce i mechanismem vzniku chromosomových aberací podporuje řada prací srovnávajících tvorbu a reparaci DSB v geneticky aktivním a strukturně „otevřeném“ euchromatinu, a naopak neaktivním a kondenzovaném heterochromatinu. Kromě obecného zjištění, že transkripčně neaktivní oblasti genomu jsou méně náchylné k indukci DSB řídce ionizujícím zářením (rtg, γ) než oblasti intenzivně transkribované, zároveň však trpí mnohem většími obtížemi během reparace, se nám spolu s dalšími autory podařilo odhalit zajímavé role architektury chromatinu v (de)regulaci reparace DSB (37, 38). Příčinu pozorovaných rozdílů představuje nejen stupeň kondenzace chromatinu, ale jeho komplexní architektura v širším slova smyslu daná asociací se specifickými strukturními proteiny, např. HP1. Navázané proteiny totiž na jednu stranu chrání DNA před účinky nebezpečných volných radikálů vznikajících radiolýzou vody, na stranu druhou ovšem komplikují aktivitu reparačních enzymů (37, 38).
Aby mohly být DSB v kondenzovaném heterochromatinu opraveny, musejí se poškozené domény ještě před zahájením vlastní reparace podrobit rozsáhlé dekondenzaci a reorganizaci (34, 39). Zatímco k resekci DNA a pokrytí ssDNA konců proteiny RPA1 dochází již uvnitř kondenzované domény, k výměně RPA1 za rekombinázu RAD51, která je pro průběh HR nezbytná, může dojít až po dekondenzaci heterochromatinu. Dekondenzace heterochromatinu je patrně nezávislá na aktivitě ATM kinázy (18) a zdá se, že minimálně z velké části se jedná o proces řízený fyzikálními silami. Zdůrazněme též, že dekondenzace heterochromatinu se děje beze změny jeho originálního epigenetického kódu, a způsobuje tak dočasné rozpojení dvou až doposud úzce propojených regulačních systémů – epigenetického kódu a fyzické architektury chromatinu. Nezměněný epigenetický kód tak patrně uchovává informaci pro rekonstrukci chromatinu po reparaci (brání epimutacím) (40), zatímco architektura chromatinu definovaná fyzikálními procesy dočasně přebírá kontrolu nad HR. Pro úspěšný průběh HR musí dekondenzaci domény následovat ještě reorganizace poškozeného chromatinu na nano úrovni (34). Tento proces patrně zprostředkovává spolu s dalšími proteiny kináza ATM, která je pro reparaci v heterochromatinu nezbytná ve fázi buněčného cyklu G2 i G1 a dříve se předpokládalo, že zodpovídá právě za dekondenzaci. Situace však není doposud jasná, protože ve fázi G1 probíhá reparace heterochromatických DSB bez klasické rekombinace, přesto však závisí na ATM. Za zmínku stojí, že taktéž ribosomové geny protrudují během reparace DSB mimo jadérko a těžko opravitelné DSB jsou u některých organismů (např. kvasinek) transportovány a přichyceny k jaderné obálce (31).
Nutnost uvedených reorganizačních kroků tak poukazuje na přesnou vícestupňovou regulaci reparace DSB, zde konkrétně HR, a důležitost architektury chromatinu a fyzikálních procesů obecně v tomto procesu. Popsaný scénář také vysvětluje pomalejší průběh reparace DSB v heterochromatinu a zároveň odhaluje zajímavý způsob, jakým buňka řeší paradox s reparací heterochromatických DSB. Komplexní architektura chromatinu na jednu stranu preferuje reparaci pomocí HR. Heterochromatin však zároveň obsahuje mnoho repetic, které zvyšují riziko nelegitimní rekombinace a vzniku chromosomových translokací (31, 39) (čemuž se věnujeme v poslední kapitole tohoto článku).
Získané výsledky tak kolektivně naznačují, že lokální architektura chromatinu může ovlivňovat vytváření a architekturu IRIF, a tudíž i mechanismus, kinetiku a přesnost reparace DSB. Existence nespočetných globálních a lokálních faktorů podílejících se na rozhodování o aktivaci určité reparační dráhy v místě jednotlivých DSB vede k zamyšlení, jak buňka dokáže tyto často protichůdné podněty vyhodnotit natolik rychle a spolehlivě, aby byla schopna včas zahájit nejvhodnější reparační proces. V kontextu výše uvedeného se nabízí hypotéza, že architektura IRIF, formující se na základě komplexních okolních podmínek, může představovat integrující signál jednotlivých faktorů, který je pro buňku snadno a rychle interpretovatelný (31). Možnosti pro ověření této hypotézy se nyní otvírají s rozvojem superrozlišovacích technik optické mikroskopie.
NÁHLED DO BUDOUCNA – PŘINESE ROZVOJ SUPERROZLIŠOVACÍ MIKROSKOPIE REVOLUCI V NAŠEM POROZUMĚNÍ ARCHITEKTONICKÝM ASPEKTŮM REPARACE DSB?
Na základě výše uvedených příkladů, našich dřívějších prací (4, 14, 38, 39, 41–43) a dnes již velmi obšírné literatury můžeme konstatovat, že studium kinetiky tvorby a zániku ohnisek γH2AX a kolokalizujících reparačních proteinů pomocí konfokální mikroskopie stojí z velké části za dnešním porozuměním biochemickým procesům spojeným se vznikem radiačního poškození DNA a jeho reparací. Mikroskopie, jakožto unikátní metoda v tomto směru, nám navíc otevřela dveře také k poznání organizace reparačních procesů v časoprostoru (4).
Přestože standardní optická mikroskopie prokázala a nadále prokazuje svoji nezastupitelnost zdaleka nejen v radiobiologickém výzkumu, chceme-li proniknout do skutečné podstaty vzniku radiačního poškození a reparace DNA, musíme se s mikroskopií ponořit ještě hlouběji, až na úroveň interakcí mezi jednotlivými molekulami (3, 20, 21, 35, 36, 44, 45). Zatímco však konfokální mikroskopie umožňuje sledovat tvorbu a dynamický vývoj IRIF, a do jisté míry i jejich kompozici a strukturu okolního chromatinu, pro detailní popis těchto objektů a souvisejících procesů na molekulární úrovni je nabízené rozlišení nedostatečné (43).
Donedávna tím pádem byla jedinou alternativou elektronová mikroskopie, jež sice nabízí bezprecedentní rozlišení, avšak za cenu poměrně destruktivní fixace vzorků a nutnosti jejich rozřezání na ultratenké řezy. Vizualizace prostorových struktur v nepoškozeném stavu je tak často velmi problematická a pozorování mohou být zatížena nejrůznějšími experimentálními artefakty. Vlastnosti reparačních komplexů a poškozeného chromatinu v rozlišovací oblasti mezi pozorovací úrovní mikroskopie optické (200 nm) a elektronové (nanometry), která je pro biologické systémy kritická, proto zůstávaly dlouho ukryty v pomyslné Pandořině skříňce (2).
Za zásadní průlom nejen v radiobiologii lze proto považovat vynález průkopnických metod superrozlišovací optické mikroskopie (3, 8, 21), kterým se různým způsobem podařilo prolomit Abbeho difrakční limit a přiblížit se svou rozlišovací schopností k hranici 10 nm (obr. 3). Toto rozlišení sice stále nedosahuje hodnot elektronové mikroskopie, je však již natolik velké, že přináší možnost vizualizovat jednotlivé molekuly při zachování většiny výhod standardní optické mikroskopie. Popis jednotlivých superrezolučních mikroskopických technik jde nad rámec této práce, a čtenáře tak odkazujeme na dříve publikované články (8). Zde se omezíme jen na vysvětlení principu metody SMLM (single-molecule localization microscopy), jejíž aplikaci v kombinaci s konfokální mikroskopií pro řešení stěžejních radiobiologických otázek se budeme následně věnovat (46).
Obr. 3. Vizualizace γH2AX v jádře téhož buněčného jádra pomocí standardní imunofluorescenční mikroskopie (A) a lokalizační mikroskopie s rozlišením jednotlivých molekul (SMLM) (B). 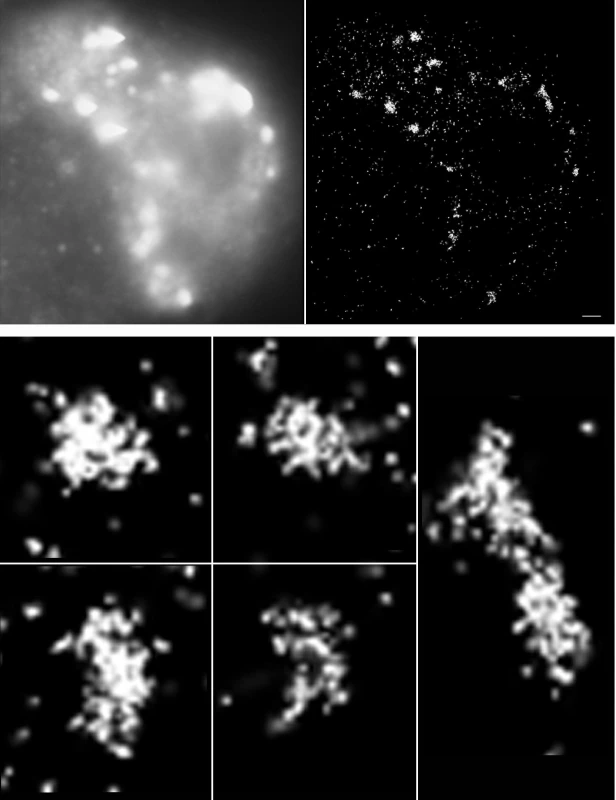
Obraz B byl vytvořen uměle na základě matice koordinát získaných ze 4000 snímků pomocí SMLM v průběhu času po vysvícení vzorku silným laserem. Obraz C představuje detailní zobrazení nanostruktury vybraných molekulárních klastrů γH2AX z panelů A a B. SMLM patří mezi metody lokalizační superrozlišovací mikroskopie a její obrovská výhoda zahrnuje, kromě dříve nepředstavitelného optického rozlišení kolem 10 nm, také stejný způsob přípravy vzorků a jejich značení jako při standardní konfokální mikroskopii (3, 8, 20, 21). Jedinou podmínkou je, aby značící fluorochromy dokázaly po iniciálním vysvícení „blikat“, jak vysvětlíme níže. Nabízí se tak unikátní příležitost studovat stejné vzorky pomocí standardní konfokální mikroskopie a SMLM. Tuto výhodu shledáváme z hlediska studované problematiky jako naprosto zásadní, protože dovoluje získat korelované výsledky pro tytéž preparáty na mikro-, mezo - a nanoúrovni (3, 45). Vzájemné porovnání těchto multidimenzionálních dat nám může poskytnout zcela nové vhledy do mechanismů radiačního poškozování DNA a její reparace. Nezanedbatelný přínos má souběžné použití konfokální mikroskopie a SMLM také z metodologického hlediska, zejména s ohledem na interpretaci získaných výsledků, komplikovanou v případě samotné SMLM zcela novým charakterem generovaných dat. Korelace výstupů SMLM a konfokální mikroskopie tak může s využitím znalostí již dříve dostupných na mikroskopické úrovni pomoci pochopit nové poznatky plynoucí ze SMLM.
Prolomení Abbeho limitu otvírající dveře k superrozlišení spočívá v případě SMLM na principiálně velmi jednoduchém triku – separaci signálů jednotlivých fluorochromů v čase (8, 47). Nejdříve je pomocí standardní mikroskopie v širokém poli (widefield) pořízen orientační obraz sledovaného objektu (obr. 3), v našem případě buněčného jádra s imunofluorescenčně značenými histony γH2AX a/nebo dalšími reparačními proteiny podílejícími se na tvorbě IRIF. Tímto získáme představu o vlastnostech (orientační počet, distribuce) IRIF v rámci celého jádra. Za dané situace svítí současně všechny molekuly fluorochromů, takže jejich signály se překrývají a vzájemně interferují, díky čemuž lze dosáhnout jen běžného rozlišení. Vysvítíme-li však následně všechny fluorochromy silným laserovým pulzem (v řádu kW.cm–2), uvedeme je do dočasně nesvítivého stavu, z něhož náhodně přecházejí do stavu dočasně svítivého — blikají. V každém okamžiku tak září pouze určitý malý počet fluorochromů, což nám poskytuje příležitost izolovat jejich signály v prostoru a čase. Za této podmínky nedochází k vzájemné interferenci mezi signály, a intenzitní profil každého z nich tak můžeme proložit Gaussovou funkcí a s velmi vysokou přesností určit pozici jeho barycentra. Pořízením časové série několika tisíc obrázků pozorovaného objektu s krátkým rozestupem (100 ms) pak získáme matici přesných souřadnic všech signálů a jejich dalších parametrů, včetně chyb měření. Tyto matice lze přímo podrobit nejrůznějším matematickým výpočtům (36) bez nutnosti často velmi obtížné analýzy obrazu, bez které se u většiny ostatních mikroskopických technik neobejdeme. Na druhou stranu můžeme jak ze surových tak i matematicky zpracovaných dat zkonstruovat umělý obraz pointilistického charakteru a jeho prostřednictvím vizuálně demonstrovat odhalené fenomény (obr. 3) (3, 21, 36, 46). Ještě podotkněme, že byť pointilistický obraz působí pro nezkušené oko jako méně přirozený a přinášející méně informací ve srovnání se „standardním“ obrazem, opak je ve skutečnosti pravdou. Pointilistický obraz se totiž mnohem více blíží realitě, jelikož neobsahuje šum vznikající interferencí signálů, na nějž si už naše mozky přivykly.
Jako příklad využití SMLM v radiobiologii uveďme právě probíhající analýzy nanostruktury ohnisek IRIF, konkrétně γH2AX a vybraných reparačních proteinů účastnících se NHEJ a/nebo HR v buňkách vystavených různým druhům IZ. Přestože se výzkum teprve rozbíhá, už dnes můžeme říci, že ohniska γH2AX v heterochromatinu vykazují jiné strukturní znaky a větší vzájemnou homogenitu než korespondující ohniska v euchromatinu (20, 46).
Zjistili jsme také, že struktura IRIF a jejich proteinová kompozice, respektive poměr reparačních proteinů detekovaných uvnitř a mimo ohniska IRIF se liší pro různé typy buněk, alespoň pro normální lidské kožní fibroblasty a radiorezistentní buňky U87 derivované z glioblastomu, jež byly doposud do naší studie zahrnuty (3). Přitom se zdá, že tyto strukturní a kompoziční odlišnosti korelují s efektivitou reparace DSB a viabilitou buněk po ozáření. V článku Bobkové et al. (3) jsme například dospěli k poznatku, že buňky U87 potřebují k vytvoření IRIF a následující reparaci menší frakci jaderného proteinu 53BP1 než normální lidské kožní fibroblasty. Z měření postiradiačních změn velikosti ohnisek IRIF a počtu molekul proteinu 53BP1 v těchto ohniscích zároveň vyplývá, že zatímco kinetika reparace DSB v buňkách U87 se obecně podobá normálním fibroblastům, prvně jmenované buňky si dokážou efektivněji poradit s nebezpečnými klastrovanými lézemi DSB. Tato naše strukturální zjištění dobře korelují s vysokou radiorezistencí nádorových buněk U87.
Co nám tedy superrozlišovací techniky odhalují o povaze a funkcích IRIF? Dnes dostupné výsledky vykreslují mikroskopicky detekovatelné IRIF jako klastry nanoskopických ohnisek γH2AX a reparačních proteinů (3, 20, 21, 36, 46, 47). Zda se jedná o funkční a organizovanou nanostrukturu v rámci jednoho IRIF, klastr více IRIF (DSB) na mikroskopické úrovni nerozlišitelných, nebo jen artefakt imunofluorescenčního značení projevující se při takto vysokém rozlišení, zůstává předmětem dalšího bádání. Vzhledem ke skutečnosti, že jednotlivé reparační proteiny vytvářejí nestejně velké a strukturované nanoklastry, různým způsobem kolokalizující s ohnisky γH2AX, jeví se zatím jako nejpravděpodobnější první možnost (3, 20, 21, 36, 46, 47). Tento závěr podporuje i skutečnost, že počty nanoklastrů γH2AX pozorované v chromatinu buněk vystavených určité dávce záření řádově převyšují hodnoty očekávané z dosavadních měření pomocí standardní konfokální mikroskopie a některých dalších metod (např. pulzní elektroforézy) (44).
Představená pozorování tak kromě zcela nových vhledů do nanostruktury IRIF a okolního chromatinu velmi dobře ilustrují nutnost vzájemné korelace často překvapivých nanoskopických dat s přeci jen snáze uchopitelnými výsledky mikroskopie. Jen tak se totiž lze přiblížit správným závěrům. Zavedení SMLM pro účely studia poškození IRIF indukovaných hustě ionizujícím zářením blíže rozvádíme v nedávno publikovaných článcích (3, 20, 21, 46).
SPECIFIKA INTERAKCE CHROMATINU S HUSTĚ IONIZUJÍCÍM ZÁŘENÍM
Do oblasti, kde se bez superrozlišovací mikroskopie téměř neobejdeme, spadá výzkum biologických účinků hustě ionizujícího záření. Specifikem DSB indukovaných hustě ionizujícím IZ je totiž jejich multiplicita a komplexnost (43). První termín odkazuje na situaci, kdy se více zlomů DNA vyskytuje v těsné vzájemné blízkosti 1–2 helikálních otáček (tj. < 3–4 nm), o komplexních DSB, respektive komplexních lézích DNA potom mluvíme, vznikají-li v místě DSB i další typy poškození (43). Následkem velice lokalizované depozice energie dochází podél dráhy letu částic hustě ionizujícího záření k tvorbě mnohočetných klastrů DSB tvořících tzv. stopy (obr. 2). Částice s různým LET tak v chromatinu logicky generují stopy odlišných mikroskopických struktur, přičemž na této struktuře závisí i schopnost buňky poškození opravit (43). Expozice záření s vysokým LET, doprovázená tvorbou stop výrazně klastrovaných DSB (obr. 2), proto koresponduje s mnohem výraznějším rizikem smrti buňky nebo alespoň chybné reparace a mutageneze než při ozáření řídce ionizujícím zářením (22). Vysoká RBE tudíž kromě výhodného profilu depozice energie (Braggovo maximum) představuje jeden z důvodů, proč jsou částice s vysokým LET tolik atraktivní z hlediska nově vyvíjených radioterapeutických přístupů (hadronová terapie), a naopak obávané v kontextu plánování pilotovaných meziplanetárních letů.
Pozitivní korelaci mezi RBE a LET (22, 43) se podařilo experimentálně prokázat až do hodnoty LET přibližně 100–200 keV/μm, v závislosti na druhu částice IZ, sledovaném biologickém efektu a typu ozářené buňky. Pro ještě vyšší LET se pak už objevuje tzv. overkill efekt (22), kdy RBE začíná s LET klesat. Přestože komplexnost klastrů v částicemi zasažených buňkách vzrůstá spolu s LET i nadále (energie záření se uvolňuje ve stále větších „kvantech“), zároveň ubývá buněk zářením zasažených, jelikož danou dávku předává stále menší počet částic. Po překročení výše uvedené hodnoty LET tak dospějeme do situace, kdy záření „vyplýtvá“ zbytečně moc energie na usmrcení každé jednotlivé buňky, a ve výsledném efektu naopak převáží rostoucí počet neozářených, a tudíž nepoškozených buněk.
Vysokou biologickou účinnost urychlených iontů tak lze evidentně připsat vzniku klastrů komplexních/mnohočetných DSB, které buňka dokáže opravit jen velmi obtížně, pokud vůbec (43, 48). Zdá se přitom, že rostoucí komplexnost/multiplicita klastrů DSB vede k preferenci reparace pomocí homologní rekombinace, což je ještě umocněno, nachází-li se DSB v heterochromatinu. Závěry však nejsou doposud jednoznačné. Studium vztahu mezi fyzikálními parametry incidentního IZ, strukturními charakteristikami DSB a jejich klastrů, distribucí DSB a jejich klastrů v rámci stop a lokální architekturou chromatinu v místě daného DSB proto představuje jeden ze základních úkolů dnešní radiobiologie.
Výzkumu na tomto poli jsme se věnovali v publikaci Ježkové et al. (43). Ačkoliv jsme potvrdili již obecně akceptovaný fakt, že multiplicita/komplexnost generovaných DSB vzrůstá spolu s LET incidentního záření a rozdíly (49) v mikrodozimetrické topologii stopy částice významně ovlivňují efektivitu reparace DSB a přežívání ozářených buněk (43, 48), dospěli jsme i k některým dalším zajímavým zjištěním. Multiplicita lézí DSB a efektivita jejich reparace se totiž lišila nejen pro záření g a urychlené ionty 11B a 20Ne, s vysokým a vzájemně si podobným LET (tab. 1), ale překvapivě i mezi uvedenými ionty. Ionty neonu přitom vytvářely v DNA DSB léze o vyšší multiplicitě než ionty boru (43). Následně provedené simulace ionizačních stop iontů 11B a 20Ne pomocí software RITRACK (NASA) přitom naznačují, že důvodem rozdílné multiplicity klastrů DSB generovaných uvedenými ionty je patrně odlišný mikrodozimetrický způsob depozice energie záření, a to i přes podobné hodnoty LET obou typů záření. Tento výsledek ukazuje na nutnost podrobněji sledovat jednotlivé fyzikální charakteristiky částic, a nejen „vše zastřešující“ LET, chceme-li odhadnout radiobiologickou účinnost hustě ionizujících záření, ať už za účelem výběru iontů potenciálně vhodných pro radioterapii nebo stanovení zdravotního rizika vyplývajícího z expozice.
IZ s vysokým LET představuje nejen unikátní radioterapeutický prostředek ale také experimentální nástroj pro studium regulace reparace DSB, protože nabízí všechny možné kombinace vlastností DSB, topologie DSB a charakteristik chromatinu. Zatímco energetické částice vytvářejí primárně velmi komplexní a mnohočetné DSB klastrované podél dráhy jejich letu, sekundárně emitované částice generují v DNA většinou jednoduché a prostorově izolované léze. Fragmentace chromatinu brání vazbě mašinérie NHEJ, takže reparace mnohočetných DSB vyžaduje HR (50). V případě komplexních DSB dochází i ke kolizi drah opravujících DSB a další typy DNA lézí. Jednoduché DSB pak v závislosti na okolním chromatinu a dalších faktorech mohou být reparovány prostřednictvím NHEJ, HR nebo i alternativních reparačních drah (31).
Zde je třeba podotknout, že hustě ionizující částicové záření, které poškozuje DNA přímo, interaguje s euchromatinem a heterochromatinem v podstatě opačným způsobem než řídce ionizující fotonové záření napadající DNA nepřímo prostřednictvím volných radikálů. Architektura heterochromatinu, jež stíní DNA před účinky radikálů (37), totiž neposkytuje ochranu před přímým poškozením prolétající částicí. A protože heterochromatin nabízí atakující částici více cílů na jednotku objemu než euchromatin, mohou v heterochromatinu naopak vznikat mnohočetnější, a tudíž hůře opravitelné DSB než v euchromatinu (2, 31). Dezintegrace heterochromatinu následkem koncentrované depozice energie navíc narušuje ochrannou funkci architektury těchto domén proti předčasné HR mezi repetitivními sekvencemi (viz výše). Reparace klastrů DSB v heterochromatinu je proto velmi riskantní, jelikož NHEJ na těchto substrátech nemůže probíhat a HR se kvůli deregulaci eventuálně mění z velmi precizního reparačního mechanismu na mechanismus s vysokým rizikem tvorby chromosomových aberací (31).
Nepřekvapí proto, že komplexní přestavby chromosomů představují charakteristický rys expozice buněk hustě ionizujícímu záření. Na základě mikroskopických a nanoskopických studií lze předpokládat, že se architektura poškozeného chromatinu a IRIF bude lišit pro různé typy IZ, a tudíž ovlivňovat i způsob reparace (43). Výzkum je však zatím jen v počátcích, a bude proto zajímavé sledovat, co odhalí o významu architektonických aspektů v regulaci reparace DSB v nadcházejících letech.
CO PROZRAZUJÍ IRIF O MECHANISMU VZNIKU CHROMOSOMOVÝCH ABERACÍ
Na závěr tohoto článku zmiňme ještě jeden velice důležitý fenomén, jenž vyplývá ze syntézy výše uvedených výsledků, a sice rozdílný mechanismus tvorby chromosomových translokací (případně i jiných aberací) v buňkách ozářených zářením s nízkým nebo naopak vysokým LET (39).
Z předchozích kapitol víme, že hustě ionizující záření generuje v DNA těžko opravitelné klastry DSB již samotným následkem prostorově koncentrované depozice energie, jež vede k lokální fragmentaci chromatinu. Takto vznikající klastry tedy nazvěme klastry primárními (2,18). Není přitom obtížné si představit, že tato ohniska vzájemně si blízkých volných konců DNA reprezentují ideální substrát pro snadnou tvorbu komplexních chromosomových translokací a dalších aberací. Řídce ionizující záření naopak deponuje svou energii v jádře mnohem homogennějším způsobem, takže nevytváří ohniska (nebo dokonce stopy) fragmentovaného chromatinu a vzniknuvší DSB jsou od sebe více vzdáleny. Nicméně i v buňkách ozářených řídce ionizujícím zářením občas pozorujeme komplexní chromosomové translokace. Jak tedy tyto translokace vznikají?
Dříve existovaly dvě protichůdné hypotézy vysvětlující tvorbu chromosomových translokací (4). První hypotéza (známá pod označením position first) považuje DSB za víceméně imobilní. Předpokládá tak, že k vzájemným výměnám chromatinu může docházet pouze mezi genetickými lokusy nacházejícími se ve vzájemné blízkosti již před ozářením. Jak se však za daných podmínek formují translokace mezi v jádře si vzdálenějšími lokusy, nebo dokonce translokace komplexní, lze vysvětlit jen stěží. Druhá hypotéza (breakage first) v podstatě kontradikuje hypotézu první, jelikož počítá s čilou migrací DSB do několika reparačních center, kde se více DSB opravuje společně. Nastává tak situace z hlediska následků podobná tvorbě primárních klastrů DSB po expozici hustě ionizujícímu záření. Tato hypotéza tak sice elegantně vysvětluje vznik translokací mezi vzájemně vzdálenými a případně i mnohočetnými lokusy, komplexní translokace by však za těchto podmínek patrně musely vznikat mnohem častěji, než ve skutečnosti pro řídce ionizující záření pozorujeme.
Říká se, že pravda leží vždy někde uprostřed a námi provedená mikroskopická pozorování ohnisek IRIF (39) toto rčení, zdá se, potvrzují i v případě mechanismu tvorby chromosomových translokací. V jádrech buněk ozářených zářením γ jsme totiž nenaměřili celkově významnější nárůst mobility ohnisek IRIF oproti nepoškozenému chromatinu, odhalili jsme však frakci IRIF, jež vykazovala výrazně vyšší pohyb (39). Zvýšenou pohyblivost vykazovaly především IRIF lokalizované v kondenzovaném chromatinu („heterochromatinu“), přičemž jejich pohyb obvykle korespondoval s relokalizací do jaderných subkompartmentů s nízkou hustotou chromatinu („euchromatinu“). Kvůli omezenému objemu těchto prostor zde mezi IRIF příležitostně docházelo k občasným kolizím a tvorbě „sekundárních“ klastrů dvou, tří nebo někdy i více ohnisek. Příčinu tohoto chování se nám následně podařilo asociovat s dekondenzací poškozených heterochromatinových domén, která podmiňuje další sestavování/aktivitu reparačních komplexů. Sekundární klastry IRIF tak na rozdíl od primárních vznikají nikoliv přímo následkem depozice energie záření, ale až následkem procesů reparace DSB (2,18).
Uvedená pozorování nás tak vedla k postulování nové hypotézy mechanismu vzniku chromosomových aberací, jež spojuje zdánlivě protichůdné aspekty obou dříve zmíněných hypotéz (4). Stručně řečeno, většina DSB je prostorově víceméně stabilních a jejich oprava probíhá samostatně v místech jejich vzniku. DSB lokalizované v heterochromatinu však následkem jeho dekondenzace v rámci reparačních procesů získávají větší pohyblivost a eventuálně vytvářejí sekundární klastry s rizikem nelegitimních chromatinových výměn. Tvorba sekundárních klastrů DSB tak vysvětluje, jak může příležitostně docházet k translokacím mezi vzdálenějšími lokusy nebo i komplexním translokacím v buňkách poškozených řídce ionizujícím zářením. Náš model také ozřejmuje, proč se komplexní translokace generované hustě a řídce ionizujícím zářením tolik liší v počtu participujících DSB a proč expozice hustě ionizujícímu záření vyvolává především intrachromosomové aberace a vice versa. Zdá se proto, že dominantní mechanismus tvorby chromosomových translokací je pro hustě a řídce ionizující záření zcela odlišný. Jen dodejme, že sekundární klastry se mohou během reparace formovat i v buňkách ozářených hustě ionizujícím zářením. Z primárních klastrů přitom vznikají vysoce komplexní klastry vyššího řádu (2).
Důležitým zjištěním plynoucím z výše uvedených pozorování (4, 39) je také skutečnost, že pravděpodobnost vzniku chromosomové translokace mezi dvěma konkrétními genetickými lokusy závisí nejen na prostorové vzdálenosti těchto lokusů v buněčném jádře (dané jadernou architekturou), ale také na lokální struktuře chromatinu v oblasti mezi těmito lokusy. Struktura chromatinu totiž ovlivňuje vzájemný pohyb jednotlivých DSB, a tudíž významným způsobem i pravděpodobnost jejich vzájemné interakce.
ZÁVĚR
Objev ohnisek IRIF představoval zásadní milník v radiobiologii a buněčné biologii. Kromě praktických aplikací v biodozimetrii poukázal jejich výzkum na zásadní důležitost architektonických faktorů při vzniku radiačního poškození, reparaci DNA a tvorbě chromosomových aberací. Vzájemné interakce mezi ionizujícím zářením a chromatinem závisejí na fyzikálních parametrech záření a architektuře chromatinu v místě DSB. Tyto interakce a další faktory mohou následně ovlivňovat architekturu formujících se reparačních komplexů (IRIF), a tudíž i výběr a průběh reparačních mechanismů. Pro potvrzení nebo vyvrácení této hypotézy jsou však nezbytné studie IRIF na nanoúrovni.
Dalším milníkem nejen v radiobiologii je proto prolomení Abbeho difrakčního limitu doprovázené rozvojem superrozlišovacích mikroskopických metod, jež posouvají strukturální analýzy IRIF a reparačních dějů až na molekulární úroveň. Bude bezesporu nesmírně vzrušující sledovat, jak nanoskopické studie rozšiřují a případně zcela mění naše porozumění NHEJ, HR, alternativním reparačním drahám a jejich vzájemné regulaci.
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Poděkování
Práce byla podpořena projekty GAČR 20-04109J, DAAD-19-03, GAČR 19-09212S, 17-08066Y a projekty Vládního zmocněnce a 3+3 pro spolupráci se SÚJV Dubna.
Seznam zkratek
DSB dvouřetězcové zlomy DNA (DNA double-strand breaks)
gH2AX histon H2AX fosforylovaný na serinu 139
HR homologní rekombinace
IRIF reparační ohniska indukovaná (v místech DSB) ionizujícím zářením (ionizing radiation-induced foci)
IZ ionizující záření
LET lineární přenos energie (linear energy transfer)
MMEJ spojování konců (DNA) zprostředkované mikrohomologiemi (microhomology-mediated end joining)
NHEJ nehomologní spojování konců (DNA) (non-homologous end joining)
RBE radiobiologická efektivita IZ
SMLM lokalizační mikroskopie na úrovni jednotlivých buněk (single-molecule localization microscopy)
SSA jednořetězcová hybridizace (single-strand annealing)
Adresa pro korespondenci:
RNDr. Martin Falk, Ph.D.
Biofyzikální ústav AV ČR, v. v. i.
Královopolská 135, 612 65 Brno
Tel.: 728 084 060
e-mail: falk@ibp.cz
Zdroje
- Falk M, Hausmann M, Lukášová E et al. Determining omics spatiotemporal dimensions using exciting new nanoscopy techniques to assess complex cell responses to DNA damage: part A – radiomics. Crit Rev Eukaryot Gene Expr 2014; 24 : 205–223.
- Falk M, Hausmann M, Lukášová E et al. Determining omics spatiotemporal dimensions using exciting new nanoscopy techniques to assess complex cell responses to DNA damage: part B – structuromics. Crit Rev Eukaryot Gene Expr 2014; 24 : 225–247.
- Bobkova E, Depeš D, Lee JH et al. Recruitment of 53BP1 proteins for DNA repair and persistence of repair clusters differ for cell types as detected by single molecule localization microscopy. Int J Mol Sci 2018; 19 : 3713.
- Falk M, Lukášová E, Kozubek S. Higher-order chromatin structure in DSB induction, repair and misrepair. Mutat Res 2010; 704 : 88–100.
- Pujals S, Albertazzi L. Super-resolution microscopy for nanomedicine research. ACS Nano 2019; 13 : 9707–9712.
- Requejo-Isidro J. Fluorescence nanoscopy. Methods and applications. J Chem Biol 2013; 6 : 97–120.
- Birk UJ. Super-resolution microscopy of chromatin. Genes (Basel) 2019; 10 : 493.
- Hausmann M, Ilić N, Pilarczyk G et al. Challenges for super-resolution localization microscopy and biomolecular fluorescent nano-probing in cancer research. Int J Mol Sci 2017; 18 : 2066.
- Konishi T, Kobayashi A, Tengku Ahmad TF, Wang J. Enhanced DNA double strand break repair triggered by microbeam irradiation induced cytoplasmic damage. J Radiat Cancer Res 2018; 9 : 183.
- Pagáčová E, Štefančíková L, Schmidt-Kaler F et al. Challenges and contradictions of metal nano-particle applications for radio-sensitivity enhancement in cancer therapy. Int J Mol Sci 2019; 20 : 558.
- Štefančíková L, Lacombe S, Salado D et al. Effect of gadolinium-based nanoparticles on nuclear DNA damage and repair in glioblastoma tumor cells. J Nanobiotech 2016; 14 : 63.
- Rogakou EP, Pilch DR, Orr AH et al. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem 1998; 273 : 5858–5868.
- Turinetto V, Giachino C. Survey and summary multiple facets of histone variant H2AX: a DNA double-strand-break marker with several biological functions. Nucleic Acids Res 2015; 43 : 2489–2498.
- Hofer M, Falk M, Komůrková D et al. Two new faces of amifostine: protector from DNA damage in normal cells and inhibitor of DNA repair in cancer cells. J Med Chem 2016; 59 : 3003–3017.
- Pejchal J, Österreicher J, Vávrová J. Biodozimetrie: dicentrická analýza a předčasná chromozomová kondenzace (PCC). Vojenské zdravotnické listy 2007; 76 : 95–104.
- Markova E, Vasilyev S, Belyaev I. 53BP1 foci as a marker of tumor cell radiosensitivity. Neoplasma 2015; 62 : 770–776.
- Falk M, Horáková Z, Svobodová M et al. γH2AX/53BP1 foci as a potential pre-treatment marker of HNSCC tumors radiosensitivity – preliminary methodological study and discussion. Eur Phys J D 2017; 71 : 241.
- Falk M, Lukášová E, Štefančíková L et al. Heterochromatinization associated with cell differentiation as a model to study DNA double strand break induction and repair in the context of higher-order chromatin structure. Appl Radiat Isot 2014; 83 Pt B: 177–185.
- Bártová E, Kozubek S, Jirsová P et al. Nuclear structure and gene activity in human differentiated cells. J Struct Biol 2002; 139 : 76–89.
- Bach M, Savini C, Krufczik M et al. Super-resolution localization microscopy of γ-H2AX and heterochromatin after folate deficiency. Int J Mol Sci 2017; 18 : 1726.
- Depeš D, Lee JH, Bobkova E et al. Single-molecule localization microscopy as a promising tool for γH2AX/53BP1 foci exploration. Eur Phys J D 2018; 72 : 158.
- Falk M, Falková I. Účinky ionizujícího záření na subcelulární a celulární úrovni, mechanizmy reparace DNA. In: Havránková R (ed.). Klinická radiobiologie. Grada, Praha, 2020 : 67–102.
- Falk M, Falková I, Kopečná O et al. Chromatin architecture changes and DNA replication fork collapse are critical features in cryopreserved cells that are differentially controlled by cryoprotectants. Sci Rep 2018; 8 : 14694.
- Rittich B, Španová A, Falk M et al. Cleavage of double stranded plasmid DNA by lanthanide complexes. J Chromatogr B Analyt Technol Biomed Life Sci 2004; 800(1–2): 169–173.
- Kousholt AN, Menzel T, Sørensen CS. Pathways for genome integrity in G2 phase of the cell cycle. Biomolecules 2012; 2 : 579–607.
- Jalan M, Olsen KS, Powell SN. Emerging roles of RAD52 in genome maintenance. Cancers 2019; 11 : 1038.
- Serrano L, Liang L, Chang Y et al. Homologous recombination conserves DNA Sequence integrity throughout the cell cycle in embryonic stem cells. Stem Cells Dev 2011; 20 : 363–374.
- Shrivastav M, De Haro LP, Nickoloff JA. Regulation of DNA double-strand break repair pathway choice. Cell Res 2008; 18 : 134–147.
- Lukášová E, Kořistek Z, Klabusay M et al. Granulocyte maturation determines ability to release chromatin NETs and loss of DNA damage response; these properties are absent in immature AML granulocytes. Biochim Biophys Acta 2013; 1833 : 767–779.
- Ma J, Setton J, Lee NY et al. The therapeutic significance of mutational signatures from DNA repair deficiency in cancer. Nat Commun 2018; 9 : 3292.
- Falk M, Hausmann M. A paradigm revolution or just better resolution – will newly emerging superresolution techniques identify chromatin architecture as a key factor in radiation-induced DNA damage and repair regulation? Cancers 2021; 13 : 18.
- Shibata A, Conrad S, Birraux J et al. Factors determining DNA double-strand break repair pathway choice in G2 phase: DSB repair pathway choice in G2 phase. EMBO J 2011; 30 : 1079–1092.
- Kakarougkas A, Jeggo PA. DNA DSB repair pathway choice: an orchestrated handover mechanism. Br J Radiol 2014; 87 : 20130685.
- Amaral N, Ryu T, Li X, Chiolo I. Nuclear dynamics of heterochromatin repair. Trends Genet 2017; 33 : 86–100.
- Hausmann M, Neitzel C, Bobkova E et al. Single molecule localization microscopy analyses of DNA-repair foci and clusters detected along particle damage tracks. Front Phys Sect Med Phys Imaging 2020; 8 : 473.
- Hofmann A, Krufczik M, Heermann DW, Hausmann M. Using persistent homology as a new approach for super-resolution localization microscopy data analysis and classification of γH2AX foci/clusters. Int J Mol Sci 2018; 19 : 2263.
- Falk M, Lukášová E, Kozubek S. Chromatin structure influences the sensitivity of DNA to gamma-radiation. Biochim Biophys Acta 2008; 1783 : 2398–2414.
- Falk M, Lukášová E, Gabrielová B et al. Local changes of higher-order chromatin structure during DSB-repair. J Phys Conf Ser 2008; 101 : 012018.
- Falk M, Lukášová E, Gabrielová B et al. Chromatin dynamics during DSB repair. Biochim Biophys Acta 2007; 1773 : 1534–1545.
- Ježková L, Falk M, Falková I et al. Function of chromatin structure and dynamics in DNA damage, repair and misrepair: γ-rays and protons in action. Appl Radiat Isot 2014; 83 Pt B: 128–136.
- Ševčík J, Falk M, Kleiblová P et al. The BRCA1 alternative splicing variant Δ14–15 with an in-frame deletion of part of the regulatory serine-containing domain (SCD) impairs the DNA repair capacity in MCF-7 cells. Cell Signal 2012; 24 : 1023–1030.
- Ševčík J, Falk M, Macurek L et al. Expression of human BRCA1Δ17–19 alternative splicing variant with a truncated BRCT domain in MCF-7 cells results in impaired assembly of DNA repair complexes and aberrant DNA damage response. Cell Signal 2013; 25 : 1186–1193.
- Ježková L, Zadneprianetc M, Kulikova E et al. Particles with similar LET values generate DNA breaks of different complexity and reparability: a high-resolution microscopy analysis of γH2AX/53BP1 foci. Nanoscale 2018; 10 : 1162–1179.
- Reindl J, Girst S, Walsh DWM et al. Chromatin organization revealed by nanostructure of irradiation induced γH2AX, 53BP1 and Rad51 foci. Sci Rep 2017; 7 : 40616.
- Friedrich T, Ilicic K, Greubel C et al. DNA damage interactions on both nanometer and micrometer scale determine overall cellular damage. Sci Rep 2018; 8 : 16063.
- Hausmann M, Wagner E, Lee JH et al. Super-resolution localization microscopy of radiation-induced histone H2AX-phosphorylation in relation to H3K9-trimethylation in HeLa cells. Nanoscale 2018; 10 : 4320–4331.
- Lemmer P, Gunkel M, Baddeley D et al. SPDM: light microscopy with single-molecule resolution at the nanoscale. Appl Phys B 2008; 93 : 1–12.
- Asaithamby A, Chen DJ. Mechanism of cluster DNA damage repair in response to high-atomic number and energy particles radiation. Mutat Res 2011; 711(1–2): 87–99.
- Baiocco G, Babini G, Barbieri S et al. What roles for track-structure and microdosimetry in the era of -omics and systems biology? Radiat Prot Dosimetry 2019; 183(1–2): 22–25.
- Wang H, Wang Y. Heavier ions with a different linear energy transfer spectrum kill more cells due to similar interference with the Ku-dependent DNA repair pathway. Radiat Res 2014; 182 : 458–461.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Editorial
- Klíčové momenty v historii československé radiobiologie
- Biologické účinky ionizujícího záření
- Moderní trendy v radioterapii
- Reparace DNA v buňkách nádorů hlavy a krku a možnosti využití monitorování tohoto procesu pro odhad radiorezistence jednotlivých nádorů a výběr optimální primární léčby
- Trendy ve farmakologické stimulaci regenerace ionizujícím zářením poškozeného savčího organismu
- Biologická dozimetrie a moderní (-omické) metody
- Pokroky ve výzkumu poškození a reparace DNA v buňkách vystavených různým druhům ionizujícího záření v éře superrozlišovací optické mikroskopie
- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Roční období, vitamin D a COVID-19
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Roční období, vitamin D a COVID-19
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Biologické účinky ionizujícího záření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



