-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Principy a výhledy vakcinace proti viru SARS-CoV-2
Principles and new perspectives in the vaccination against SARS-CoV-2 virus
It has been a year since the first person on Earth became infected with a new type of coronavirus SARS-CoV-2, causing infectious acute respiratory disease COVID-19 with relatively high morbidity and mortality. The most endangered population by coronavirus SARS-CoV-2 are healthcare professionals, the elderly and people with associated comorbidities. Due to the fast community spread, governments of different European countries introduced precaution measures including limited socializing of people, closing of most public services and introducing mandatory facial protection.
The hope for a return to the life before the pandemic is the development of an effective and safe vaccine against SARS-CoV-2 which would presumably reduce the incidence of severe forms of COVID-19 and prevent the massive spread of the disease. At the end of November, we have 13 clinical trials in phase III involving SARS-CoV-2 vaccines based on inactivated viruses, recombinant non-pathogenic viral vectors and proteins. The first mRNA-based vaccine is currently being evaluated in phase II/III clinical trial and is already being distributed and applied to high-risk population in the United Kingdom, the United States, and Israel, followed by the countries of the European Union, including the Czech Republic.
In the review article we present currently ongoing clinical studies with a special focus on the phase III clinical trials and discuss the mechanisms of action of each type of vaccine.
Keywords:
COVID-19 – SARS-CoV-2 – Vaccines – clinical trials
Autoři: Jitka Smetanová; Zuzana Střížová; Jiřina Bartůňková; Tomáš Milota
Působiště autorů: Ústav imunologie 2. LF UK a FN Motol v Praze
Vyšlo v časopise: Čas. Lék. čes. 2020; 159: 298-302
Kategorie: Přehledový článek
Souhrn
Uplynul již více než rok ode dne, co se první člověk nakazil novým typem koronaviru, SARS-CoV-2, způsobujícím infekční akutní respirační onemocnění COVID-19 s poměrně vysokou morbiditou i mortalitou. Nejohroženější skupinu obyvatel z hlediska nákazy tímto koronavirem představují zdravotníci, zvláště lidé s chronickými nemocemi, obezitou a diabetem mellitem. Kvůli komunitnímu šíření nákazy zavedli vládní představitelé většiny evropských zemí tzv. lockdown, kdy omezili pohyb osob, zavřeli většinu služeb a zavedli povinnou ochranu úst a nosu.
Naději v návrat života do období před pandemií představuje vývoj účinné a bezpečné vakcíny proti SARS-CoV-2, jež by pravděpodobně snížila výskyt těžkých forem onemocnění COVID-19 a zabránila masivnímu šíření nákazy. Ke konci listopadu bylo ve III. fázi klinického testování 13 klinických studií zahrnujících vakcíny proti SARS-CoV-2 na bázi inaktivovaných virů, rekombinantních nepatogenních virových vektorů a proteinů. První vakcína založena na bázi mRNA byla nedávno schválena, distribuována a aplikována vybraným obyvatelům Spojených států amerických, Izraele, Velké Británie a posléze i v členských státech Evropské unie včetně Česka.
V přehledovém článku prezentujeme probíhající klinické studie se zaměřením na jejich III. fázi, a to včetně mechanismu účinku jednotlivých typů vakcín.
Klíčová slova:
COVID-19 – SARS-CoV-2 – vakcíny – klinické studie
ÚVOD
Na začátku prosince roku 2019 se z čínského města Wu-chan začal šířit koronavirus SARS-CoV-2 způsobující těžký akutní respirační syndrom později pojmenovaný COVID-19 (1). S rozšířením onemocnění z Asie do Evropy, Austrálie a dalších světových kontinentů se Světová zdravotnická organizace (WHO) dne 11. března 2020 rozhodla vyhlásit stav pandemie (2).
Onemocnění COVID-19 se klinicky manifestuje velmi rozmanitě. U symptomatických pacientů je zpravidla prvním klinickým příznakem horečka a suchý dráždivý kašel doprovázený únavou. Častým projevem nemoci je také ztráta čichu, méně často i chuti (3). Vážnější případy mohou vést k rozvoji pneumonie či sekundárního hemofagocytujícího syndromu (zvaného též syndrom aktivovaných makrofágů – MAS) a mohou vyústit až v úmrtí nemocného (4). Tyto závažnější formy onemocnění COVID-19 vyžadující oxygenoterapii, mechanickou ventilaci či v krajních případech mimotělní membránovou oxygenaci jsou častěji popisovány u chronicky nemocných a starších lidí (5). Uvádí se, že zhruba 20 % pacientů zůstává asymptomatických (6).
Dle celosvětových statistik k datu 30. 12. 2020 onemocnělo COVID-19 80 453 105 lidí, z toho 1 775 776 onemocnění podlehlo (7). Počet nakažených a zemřelých osob v souvislosti s onemocněním COVID-19 se nyní nejen v evropských státech, ale také například v USA a dalších zemích zvyšuje. Tento stoupající trend by mohl být zastaven ve chvíli, kdy by došlo k proočkování větší části populace účinnou anti-SARS-CoV-2 vakcínou.
STRUKTURA A TAXONOMIE KORONAVIRU SARS-COV-2
Nositelem genetické informace koronavirů je jednovláknová molekula RNA (ssRNA). Koronavirus SARS-CoV-2 řadíme do podskupiny β společně s virem SARS-CoV, jenž v roce 2002 vyvolal epidemii syndromu náhlého respiračního selhání (SARS), a virem MERS-CoV, který o 10 let později v zemích Blízkého východu rovněž způsobil epidemii respiračního selhávání s velmi vysokou smrtností (8–10).
Společným znakem těchto virů vyvolávajících pneumonie je jejich přenos ze zvířete na člověka, jedná se tedy o zoonózy. Jako primární zvířecí hostitel pro onemocnění COVID-19 byl identifikován netopýr, neboť izolované koronaviry netopýrů se v nukleotidové sekvenci shodují s lidským SARS-CoV-2 ve více než 90 %, v případě viru betaCoV RaTG13 dokonce v 96 % (11). Více než 90% genetickou shodu vykazují i koronaviry luskounů, kteří jsou v Číně loveni pro šupiny a maso, a představují tak s největší pravděpodobností mezihostitele. Navíc jsou tito savci hojně dostupným zbožím na tržnici ve Wu-chanu, která je považována za epicentrum nákazy (12, 13).
Téměř rok se vědci zabývají strukturou nového koronaviru SARS-CoV-2, o němž je doposud známo pouze omezené spektrum informací. Lipidový obal koronaviru obsahuje několik proteinů, z nichž nejdůležitější úlohu pro vstup do hostitelské buňky hraje glykoprotein spike (S), který se váže na lidský receptor ACE2 (angiotenzin konvertujícího enzymu 2) (14). Zvýšená exprese tohoto receptoru s enzymatickou aktivitou byla prokázána především u epitelových buněk dolních cest dýchacích. Jeho přítomnost ovšem byla popsána i na řadě dalších buněk těla, například na endoteliích, buňkách jícnu, střev, ledvin či srdce, jejichž postižení může pacienta přímo ohrožovat na životě (15). Pro svůj životní cyklus SARS-CoV-2 dále využívá membránové glykoproteiny svého obalu (E) i (M) a protein nukleokapsidy (N) nacházející se v matrix samotného viru (16, 17). Struktura nového koronaviru je znázorněna na obr. 1 (18). Všechny 4 zmíněné glykoproteiny (S, E, M a N) by se v budoucnu mohly stát podstatným cílem léků zaměřených na léčbu onemocnění COVID-19 a jeho přidružených komplikací.
Obr. 1. Struktura koronaviru SARS-CoV-2 vytvořená pomocí programu Biorender 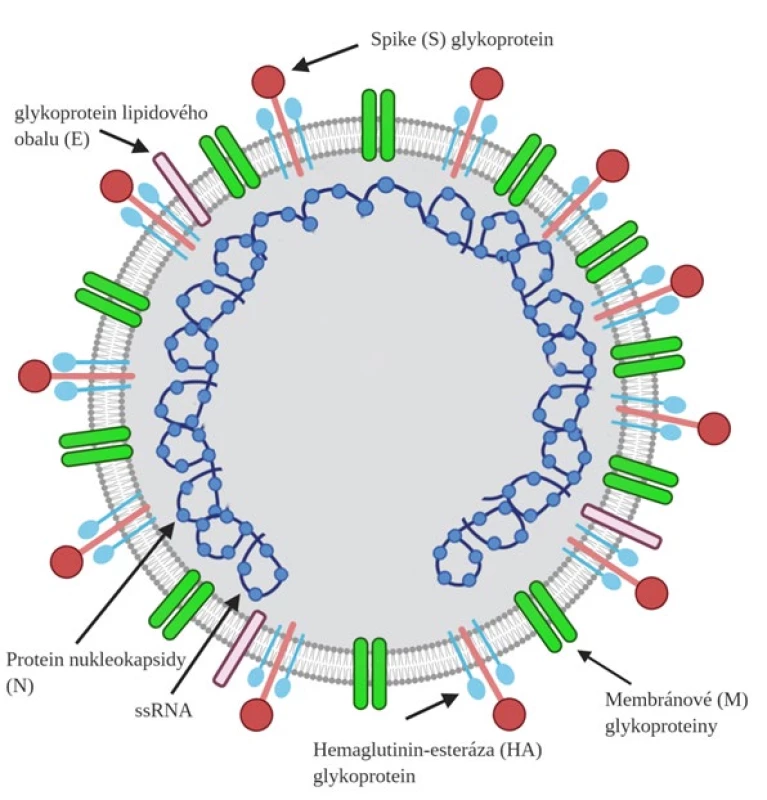
ZPŮSOB ŠÍŘENÍ SARS-COV-2
K šíření viru SARS-CoV-2 dochází ze 2 hlavních příčin. První z nich je přímá cesta, tedy přenos z člověka na člověka, a to pomocí kapének, jež člověk fyziologicky vylučuje při mluvení, kýchání a kašlání (19, 20). Před touto formou přenosu nás částečně chrání osobní ochranné pomůcky, především roušky. Druhou možnost šíření představuje nepřímý kontakt, tedy dotek virem kontaminovaného povrchu a jeho mechanický přenos na sliznice očí či úst (21). Z tohoto důvodu je doporučeno dbát zvýšené hygieny, přičemž časté mytí a dezinfekce rukou a povrchů snižuje pravděpodobnost nákazy. Doposud se vědcům nepodařilo s jistotou říci, jak dlouho virus na povrchu přežívá, a tedy jak dlouho ohrožuje jedince nákazou. Šíření infekce napomáhá i relativně dlouhá inkubační doba trvající v průměru 5–7 dní, přičemž nakažený je infekční obvykle 2 dny před propuknutím příznaků, a nevědomky tak infekci dále šíří (22).
Některé studie také naznačují, že část pacientů si nevytvoří dostatečné množství protilátek a paměťových buněk, které by je chránily před opakovanou nákazou (23). Množství vytvořených protilátek je závislé na závažnosti průběhu onemocnění. Nicméně jejich koncentrace v čase může velmi rychle klesat (24). Nadějí v boji s novým typem koronaviru tak pro lidstvo zůstává vývoj bezpečné a účinné vakcíny, která by pravděpodobně vedla ke snížení výskytu těžkých forem onemocnění COVID-19. Problémem se však jeví četný výskyt mutací, kterým SARS-CoV-2 stejně jako virus chřipky podléhá (25, 26), a všeobecně nízká dlouhodobá ochrana vakcín proti respiračním onemocněním. Je proto pravděpodobné, že vakcína proti SARS-CoV2 se stane sezónní záležitostí s nutností pravidelných přeočkování u rizikových osob, podobně jako je tomu u vakcíny proti chřipce (27).
Právě získané poznatky o interakcích viru SARS-CoV-2 s imunitním systémem jsou využity pro vývoj nové vakcíny, kde důležitou roli hraje způsob aplikace očkovací látky, její dávkování, typ použitého antigenu a přítomnost samotného adjuvans. Ke konci listopadu bylo v americké databázi klinických studií ClinicalTrials.gov pod záštitou National Institutes of Health (NIH) vedeno celkem 68 klinických hodnocení, rozdělených do pěti fází: I, I/II, II, II/III, III (28). V následujícím přehledu uvádíme příklady vyvíjených vakcín, jež jsou rozděleny z pohledu mechanismu účinku. Diskutovány jsou především vakcíny v pokročilých fázích vývoje a klinického hodnocení.
DRUHY VAKCÍN PROTI SARS-COV-2
Dle výroby a typu použitého antigenu dělíme vakcíny na 4 základní typy. První typ představují vakcíny založené na přenosu genetické informace kódující patogenní proteiny koronaviru ve formě mRNA nebo DNA. K translokaci genetické informace do buněčného jádra dochází pomocí speciálních geneticky upravených plazmidů, jež nesou kromě antigenu i silný promotor (často SV40) (29, 30). Po tomto přenosu dokáží buňky hostitele exprimovat na svém povrchu fragmenty patogenních proteinů (virové antigeny) v komplexu s molekulami MHC I. třídy. Rozpoznání komplexu virového antigenu s molekulami MHC zapříčiní cytotoxickou imunitní odpověď mediovanou CD8+ T buňkami. Naopak v aktivaci pomocných CD4+ T buněk a k produkci protilátek je nezbytné zapojení buněk prezentujících antigen (APC) (31). Výhodou v porovnání s vakcínami obsahujícími rekombinantně připravené proteiny je bezesporu skutečnost, že po přepsání genetické informace do sekvence aminokyselin dochází k posttranslačním modifikacím proteinů. Z tohoto důvodu se genové vakcíny podobají skutečnému průběhu nákazy. Negativní stránkou je hrozící nebezpečí vzniku nekontrolovatelné genové exprese, mutace a postižení somatických buněk. Na vývoji DNA vakcín pracují například v Kanadě nebo v Koreji, jejichž vakcíny AG0301-COVID19 a GX-19 jsou momentálně ve fázi I/II klinického testování (28).
Vakcíny na bázi mRNA sdílejí několik společných prvků s DNA vakcínami. Jejich bezpečnost je však v porovnání s DNA vakcínami vyšší, protože exprese kódovaných proteinů probíhá v cytoplazmě, a nehrozí tak inkorporace do genomu hostitele. Na druhou stranu molekula mRNA nevykazuje tak vysokou stabilitu jako molekula DNA, proto je mRNA chráněna transportním systémem lipidové částice, která navíc usnadní její doručení do cílové buňky (32, 33). Na vývoji této skupiny vakcín pracuje mj. biotechnologická společnost Moderna ve spolupráci s lékařským výzkumným centrem NIH sídlícím ve Spojených státech amerických, jejichž vakcína mRNA-1273 vykazující téměř 95% účinnost nedávno ukončila náběr dobrovolníků účastnících se studie III. fáze klinického testování (34) a začala již i její aplikace v praxi v USA. Vakcínu na bázi mRNA BNT162 vyvinula i německá společnost BioNTech v kooperaci s americkou společností Pfizer. Jejich vakcína se rovněž nachází ve II./III. fázi klinického testování (28) a po schválení již byla distribuována a aplikována lidem ve Velké Británii, Izraeli nebo Spojených státech amerických; od konce prosince – po schválení Evropskou lékovou agenturou (EMA) – potom rovněž v členských zemích Evropské unie včetně Česka.
Podobného mechanismu využívá i druhá skupina vakcín na bázi rekombinantních nepatogenních virových vektorů, kterými nejčastěji bývají adenovirové vektory, ale někteří výrobci vyvíjejí také vakcíny s použitím vektorů poxvirových, paramyxovirových (virus spalniček) a řady dalších (35, 36). Cílem těchto postupů je pomocí vektorů dopravit do buňky genetickou informaci koronaviru SARS-CoV-2 společně se složkami potřebnými k zahájení exprese vybraného antigenu. Tím potom dochází k produkci koronavirových proteinů a k imunitní reakci vůči nim. Virový vektor představuje pro organismus poměrně silný podnět imunitní odpovědi. Pro samotnou vakcínu je třeba brát v úvahu volbu virového vektoru, neboť již existující imunita hostitele proti viru může významně snížit účinnost vakcíny (37). Slibné výsledky klinického testování vykazuje vakcína Ad5-nCoV vyvíjená čínskou firmou CanSino Biologics nebo vakcína Sputnik V vyrobená ve výzkumném ústavu Gamaleya v Rusku. Obě dvě jsou momentálně ve III. fázi klinického testování a nesou genetickou informaci kódující glykoprotein S. Naopak švýcarská firma ImmunityBio vnáší kromě DNA kódující glykoprotein S i protein N. Od této kombinace si slibuje vyvolání silné imunitní odpovědi, ale látka hAd5 je teprve v I. fázi klinického testování. Ve III. fázi klinického testování je rovněž vakcína AZD1222 od britské firmy AstraZeneca využívající adenovirový vektor ChAdOx1, jež slibuje poměrně vysoké procento účinnosti (28).
K navození imunitní odpovědi proti koronaviru jsou vyvíjeny i vakcíny obsahující rekombinantně připravené patogenní proteiny či pouze jejich fragmenty. Testované vakcíny proti onemocnění COVID-19 nejčastěji obsahují glykoprotein S společně s adjuvans, které je nesmírně důležité k vyvolání imunitní odpovědi proti samotnému antigenu (38). K přípravě rekombinantních proteinů se hojně využívají bakteriální expresní systémy, jež ovšem nejsou vhodné pro antigeny, které podléhají posttranslační modifikaci. V těchto případech je pro rekombinantní přípravu proteinů efektivnější využít hmyzí nebo savčí buňky. Jako expresní systém proteinů slouží i transgenní rostliny, konkrétně pro glykoprotein S tabák (39). Tento druh vakcín je výrazně bezpečnější než vakcíny s atenuovanými viry. Vyvíjené proteinové vakcíny například UB-612, CoVac-1 nebo Recombinant New Coronavirus se nacházejí v I., respektive I./II. fázi klinického testování (28).
Kvůli bezpečnosti se dnes neočkuje plně virulentními kmeny mikroorganismů, ale využívají se kmeny inaktivované nebo atenuované. Inaktivované vakcíny obsahují celý usmrcený organismus bez schopnosti jeho replikace. K inaktivaci se používají především chemická činidla, a to formaldehyd nebo β-propiolakton. U většiny inaktivovaných vakcín je pro tvorbu protilátek a paměťových buněk potřeba několik dávek, jako v případě očkování proti hepatitidě typu A (40). Inaktivované viry jsou například součástí vyvíjených vakcín CoronaVac a SARS-CoV-2 inactivated vaccine, jež jsou ve III. fázi klinického testování (28). Hlavním úkolem při přípravě živých atenuovaných vakcín je vytvořit takové kmeny, které nevyvolají v organismu klinické příznaky onemocnění. Ateunované kmeny se nejčastěji připravují několikanásobným pasážováním virulentních kmenů ve speciální buněčné kultuře nebo pomocí genetického inženýrství indukcí genových mutací vedoucích k nevirulentním kmenům. Nebezpečí atenuovaných vakcín představuje riziko nežádoucích mutací, kterými se z nevirulentních kmenů mohou stát kmeny virulentní. V současné době není zaznamenána jediná živá atenuovaná vakcína proti onemocnění COVID-19, která by byla registrována ke klinickému testování.
DISKUSE
S neustále znepokojivě se zvyšujícím počtem nakažených a hospitalizovaných pacientů s onemocněním COVID-19 se celý svět uchyluje k zavádění restrikcí a nařízení, jako je nošení roušek, zvýšená hygiena rukou a omezení sociálních kontaktů na minimum. Zavedená opatření cílí na snížení reprodukčního čísla (R) a snaží se ochránit zdravotnictví před možným kolapsem. Průměrně je jedinec po prodělaném infekčním onemocnění COVID-19 imunní cca 90 dní. Případy opětovné nákazy jsou zdokumentovány jak ve světě, tak v Česku (41). Naději v ochraně obyvatelstva tak představuje očkování, které by snížilo výskyt infekčního onemocnění a pomohlo by k návratu k běžnému životu z dob před pandemií (42).
Na začátku roku 2020 započal celosvětový doposud neukončený závod o vývoj účinné a bezpečné vakcíny. Jednotlivé farmaceutické firmy se předháněly v tom, kdo první zaregistruje svoji vakcínu a začne ji distribuovat do celého světa. Laboratoře zvolily jak klasické metody k vývoji vakcíny, jako jsou inaktivované viry nebo rekombinantně připravené proteiny, tak také modernější genové metody založené na DNA, mRNA nebo na virových vektorech. Ty jsou kupodivu v klinickém vývoji nejdále, aniž kdy byly v jiných indikacích indukce protiinfekční imunity v minulosti úspěšné. Problémem ovšem může být stabilita vakcín – vakcíny na bázi mRNA obvykle vyžadují skladování při –70° C až do aplikace, což může komplikovat jejich masovou distribuci. V době přípravy článku bylo celkem 13 klinických studií zaměřených na efektivitu a bezpečnost vakcín v prevenci SARS-CoV-2 ve III. fázi klinického testování (28), která je nezbytným krokem k registraci, a tedy k masové výrobě, distribuci a podání běžné populaci.
Stejně jako v případě vakcín proti jiným respiračním onemocněním se v případě anti-SARS-CoV-2 vakcíny předpokládá její přednostní podání rizikovým osobám, jako jsou pacienti s různými komorbiditami nebo osoby ve zvýšeném riziku nákazy (zdravotníci, klienti sociálních zařízení aj.). Vzhledem k tomu, že těžké formy COVID-19 zpravidla nepostihují děti, a klinické registrační studie proto probíhají pouze v populaci dospělých dobrovolníků, nepředpokládá se v nejbližší době zavedení plošného očkování dětí (28, 43).
ZÁVĚR
Celý svět poslední dobou upíná zrak na vývoj nových vakcín, které by zpomalily šíření infekčního onemocnění COVID-19 a snížily podíl výskytu těžkých forem tohoto onemocnění. Aktuálně probíhají klinické studie zaměřené na testování bezpečnosti a účinnosti různých typů vakcín proti SARS-CoV-2. Ve III. fázi bylo ke konci listopadu celkem 13 klinických studií. Vakcína mRNA-1273 od firmy Moderna dokonce ve druhé polovině listopadu ve III. fázi ukončila náběr nových dobrovolníků. První masově dostupnou očkovací látkou se stala vakcína na bázi mRNA od společnosti Pfizer a její aplikace a distribuce již byla zahájena. Brzy se očekává ukončení III. fáze i dalších testovaných látek. V první polovině roku 2021 by měly být proočkovány rizikové skupiny i v Česku.
Čestné prohlášení
Nikdo ze spoluautorů není v souvislosti s tématem, vznikem a publikací tohoto článku ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Seznam zkratek
APC buňky prezentující antigen
EMA Evropská agentura pro léčivé přípravky
MERS Middle East respiratory syndrome
MHC hlavní histokompatibilní komplex
NIH Národní institut zdraví, USA
SARS těžký akutní respirační syndrom
SV40 opičí virus 40
Adresa pro korespondenci:
Mgr. Jitka Smetanová
Ústav imunologie 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
Tel.: 224 435 978
e-mail: jitka.smetanova@fnmotol.cz
Zdroje
- Huang C, Wang Y, Li X et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet 2020; 395 : 497–506.
- Cucinotta D, Vanelli M. WHO declares COVID-19 a pandemic. Acta Biomed 2020; 91 : 157–160.
- Kim GU, Kim MJ, Ra SH et al. Clinical characteristics of asymptomatic and symptomatic patients with mild COVID-19. Clin Microbiol Infect 2020; 26 : 948.e1–948.e3.
- Gonçalves RSG, Victor AC, Tavare ACOC, Duarte ALBP. Be-careful! Behind the storm of severe COVID-19, could be hidden macrophage activation syndrome. A case report with excellent outcome. Research Square 2020, doi: 10.21203/rs.3.rs-47499/v1.
- Li X, Xu S, Yu M et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. J Allergy Clin Immunol 2020; 146 : 110–118.
- Long QX, Tang XJ, Shi QL et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nat Med 2020; 26 : 1200–1204.
- World Health Organization. WHO Coronavirus Disease (COVID-19) Dashboard. WHO, 2020. Dostupné na: https://covid19.who.int
- Zaki AM, van Boheemen S, Bestebroer TM et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med 2012; 367 : 1814–1820.
- Weiss SR, Navas-Martin S. Coronavirus pathogenesis and the emerging pathogen severe acute respiratory syndrome coronavirus. Microbiol Mol Biol Rev 2005; 69 : 635–664.
- Chan-Yeung M, Xu RH. SARS: epidemiology. Respirology 2003; 8: S9–S14.
- Zhou H, Chen X, Hu T et al. A novel bat coronavirus closely related to SARS-CoV-2 contains natural insertions at the S1/S2 cleavage site of the spike protein. Curr Biol 2020; 30 : 2196–2203.e3.
- Lam TTY, Jia N, Zhang YW et al. Identifying SARS-CoV-2-related coronaviruses in Malayan pangolins. Nature 2020; 583 : 282–285.
- Zhang T, Wu Q, Zhang Z. Pangolin homology associated with 2019-nCoV. bioRxiv 2020, doi: 10.1101/2020.02.19.950253.
- Ou X, Liu Y, Lei X et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nat Commun 2020; 11 : 1–12.
- Zou X, Chen K, Zou J et al. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med 2020; 14 : 185–192.
- Chan JFW, Kok KH, Zhu Z et al. Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan. Emerg Microbes Infect 2020; 9 : 221–236.
- Pačes J, Střížová Z, Smrž D, Černý J. COVID-19 and the immune system. Physiol Res 2020; 69 : 379–388.
- Koirala A, Joo YJ, Khatami A et al. Vaccines for COVID-19: The current state of play. Paediatr Respir Rev 2020; 35 : 43–49.
- Parry J. China coronavirus: cases surge as official admits human to human transmission. BMJ 2020; 368: m236.
- Střížová Z, Bartůňková J, Smrž D. Can wearing face masks in public affect transmission route and viral load in covid-19? Cent Eur J Public Health 2020; 28 : 161–162.
- Ren SY, Wang WB, Hao YG et al. Stability and infectivity of coronaviruses in inanimate environments. World J Clin Cases 2020; 8 : 1391–1399.
- Savvides C, Siegel R. Asymptomatic and presymptomatic transmission of SARS-CoV-2: a systematic review. medRxiv 2020, doi: 10.1101/2020.06.11.20129072v2.
- van Doremalen N, Bushmaker T, Morris DH et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1. N Engl J Med 2020; 382 : 1564–1567.
- Wang K, Long QX, Deng HJ et al. Longitudinal dynamics of the neutralizing antibody response to severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection. Clin Infect Dis 2020, doi: 10.1093/cid/ciaa1143.
- Kaushal N, Gupta Y, Goyal M et al. Mutational frequencies of SARS-CoV-2 genome during the beginning months of the outbreak in USA. Pathogens 2020; 9 : 565.
- Lyons DM, Lauring AS. Mutation and epistasis in influenza virus evolution. Viruses 2018; 10 : 407.
- Lorenc T, Marshall D, Wright K et al. Seasonal influenza vaccination of healthcare workers: systematic review of qualitative evidence. BMC Health Serv Res 2017; 17 : 732.
- National Library of Medicine, the U.S. National Institutes of Health. ClinicalTrials.gov.
- Nishikawa H, Shiku H. DNA vaccine. Nihon Rinsho 2008; 66 : 1867–1872.
- Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines 2016; 15 : 313–329.
- Kowalczyk DW, Ertl HCJ. Immune responses to DNA vaccines. Cell Mol Life Sci 1999; 55 : 751–770.
- Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines-a new era in vaccinology. Nat Rev Drug Discov 2018; 17 : 261–279.
- Zhang C, Maruggi G, Shan H, Li J. Advances in mRNA vaccines for infectious diseases. Front Immunol 2019; 10 : 594.
- Mahase E. Covid-19: Moderna vaccine is nearly 95% effective, trial involving high risk and elderly people shows. BMJ 2020; 371: m4471.
- Ura T, Okuda K, Shimada M. Developments in viral vector-based vaccines. Vaccines (Basel) 2014; 2 : 624–641.
- Ramezanpour B, Haan I, Osterhaus A, Claassen E. Vector-based genetically modified vaccines: exploiting Jenner’s legacy. Vaccine 2016; 34 : 6436–6448.
- Thacker EE, Timares L, Matthews QL. Strategies to overcome host immunity to adenovirus vectors in vaccine development. Expert Rev Vaccines 2009; 8 : 761–777.
- Chang S, Warner J, Liang L, Fairman J. A novel vaccine adjuvant for recombinant flu antigens. Biologicals 2009; 37 : 141–147.
- Nascimento IP, Leite LCC. Recombinant vaccines and the development of new vaccine strategies. Braz J Med Biol Res 2012; 45 : 1102–1111.
- Bell BP. Hepatitis A vaccine. Semin Pediatr Infect Dis 2002; 13 : 165–173.
- Tillett RL, Sevinsky JR, Hartley PD et al. Genomic evidence for reinfection with SARS-CoV-2: a case study. Lancet Infect Dis 2021; 21 : 52–58.
- Kaur SP, Gupta V. COVID-19 vaccine: a comprehensive status report. Virus Res 2020; 288 : 198114.
- Swann OV, Holden KA, Turtle L et al. Clinical characteristics of children and young people admitted to hospital with covid-19 in United Kingdom: prospective multicentre observational cohort study. BMJ 2020; 370 : 5.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodem
- Editorial
- Klíčové momenty v historii československé radiobiologie
- Biologické účinky ionizujícího záření
- Moderní trendy v radioterapii
- Reparace DNA v buňkách nádorů hlavy a krku a možnosti využití monitorování tohoto procesu pro odhad radiorezistence jednotlivých nádorů a výběr optimální primární léčby
- Trendy ve farmakologické stimulaci regenerace ionizujícím zářením poškozeného savčího organismu
- Biologická dozimetrie a moderní (-omické) metody
- Pokroky ve výzkumu poškození a reparace DNA v buňkách vystavených různým druhům ionizujícího záření v éře superrozlišovací optické mikroskopie
- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Roční období, vitamin D a COVID-19
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Principy a výhledy vakcinace proti viru SARS-CoV-2
- Roční období, vitamin D a COVID-19
- Stáří není nemoc: Vývoj hladiny ochranných protilátek proti koronaviru SARS-CoV-2 u seniorů z Domova Břevnice
- Biologické účinky ionizujícího záření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



